ROYAUME DU MAROC
UNIVERSITE MOHAMMED V-RABAT FACULTE DE MEDECINE ET DE
PHARMACIE RABAT
ANNEE : 2020
THESE N° : 43
LIQUIDES BIOLOGIQUES DE PONCTION :
ASPECTS HEMATOLOGIQUES
Thèse
Présentée et soutenue publiquement le : / /2020
Par
Madame Majdouline BELLAKHDAR
Née le 26/11/1991 à salé
Médecin interne du CHU Ibn Sina Rabat
Pour l'Obtention du Diplôme de
Docteur en Médecine
Mots clés
: LCR, liquide d’ascite, liquide pleural, liquide synovial.
Membres du jury :
Mme S. BENKIRANE Président
Professeur d’Hématologie Biologique
Mr A. MASRAR Rapporteur
Professeur d’Hématologie Biologique
Mme M. NAZIH Juge
Professeur d’Hématologie Biologique
Mr A. JEAIDI
Juge
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 – 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION : Doyen
Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
Mr. Mohamed KARRA
UNIVERSITE MOHAMMED V
FACULTE DE MEDECINE ET DE PHARMACIE RABAT
1-
ENSEIGNANTS-CHERCHEURS MEDECINS ET
PHARMACIENS
PROFESSEURS : Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. LACHKAR Hassan Médecine Interne Pr. YAHYAOUI Mohamed Neurologie
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AZZOUZI Abderrahim Anesthésie RéanimationDoyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie ObstétriqueMédChef Maternité des Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie Dir. du Centre National PV Rabat
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir du
CEDOC+Directeur du Médicament
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie Pr. GHAFIR Driss* Médecine Interne Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie Pr. BEN RAIS Nozha Biophysique Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques
Doyen de la FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale Directeur CHIS -Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie Pr. RHRAB Brahim Gynécologie –Obstétrique Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie Directeur HôpMyIsmailMeknès
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie Pr. CHERKAOUI LallaOuafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie Pr. OUAZZANI CHAHDI Bahia Ophtalmologie Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie Dir Hôp. Mil.d’Instruction MedVRabat
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie Pr. ERREIMI Naima Pédiatrie Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie Directeur Hôp. Arrazi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale Pr. ER RIHANI Hassan Oncologie Médicale Pr. BENKIRANE Majid* Hématologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN DakhamaBadr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie DirecteurHôp. MyYoussef
Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation
Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie Pr. BENAMR Said Chirurgie Générale Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hôp. Cheikh Zaied
Pr. EL KHADER Khalid Urologie Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie Pr. BENELBARHDADI Imane Gastro-Entérologie Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie Pr. BEZZA Ahmed* Rhumatologie Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hôp. d’Enfants Rabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie Pr. HRORA Abdelmalek Chirurgie Générale Pr. KABBAJ Saad Anesthésie-Réanimation Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie Pr. HACHI Hafid Chirurgie Générale Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique Pr. TIJAMI Fouad Chirurgie Générale Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie Pr. AMAZOUZI Abdellah Ophtalmologie Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur. Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie Pr. BENYASS Aatif Cardiologie Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie Pr. AKJOUJ Said* Radiologie Pr. BELMEKKI Abdelkader* Hématologie Pr. BENCHEIKH Razika O.R. L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie Pr. KARMOUNI Tariq Urologie Pr. KILI Amina Pédiatrie Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie Pr. OUANASS Abderrazzak Psychiatrie Pr. SAFI Soumaya* Endocrinologie Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Decembre 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale Pr. ACHACHI Leila Pneumo phtisiologie Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire Pr. AMHAJJI Larbi* Traumatologie orthopédie Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSSM
Pr. BALOUCH Lhousaine* Biochimie-chimie Pr. BENZIANE Hamid* Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHARKAOUI Naoual* Pharmacie galénique Pr. EHIRCHIOU Abdelkader* Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire
Pr. ELABSI Mohamed Chirurgie générale Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale Pr. ISMAILI Nadia Dermatologie Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie Pr. MASRAR Azlarab Hématologie biologique Pr. MRANI Saad* Virologie
Pr. OUZZIF Ezzohra* Biochimie-chimie Pr. RABHI Monsef* Médecine interne Pr. RADOUANE Bouchaib* Radiologie Pr. SEFFAR Myriame Microbiologie Pr. SEKHSOKH Yessine* Microbiologie Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie Pr. ALLALI Nazik Radiologie Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités
Pr. BELYAMANI Lahcen* Anesthésie Réanimation Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie Pr. BOUI Mohammed* Dermatologie Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal* Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique Pr. MSSROURI Rahal Chirurgie Générale Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine interne Pr. BELAGUID Abdelaziz Physiologie Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique Pr. DAMI Abdellah* Biochimie chimie Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie Pr. LAMALMI Najat Anatomie pathologique Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountassir* Chirurgie générale Pr. NAZIH Mouna* Hématologie biologique Pr. ZOUAIDIA Fouad Anatomie pathologique
Decembre 2010
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique Pr. ABOUELALAA Khalil* Anesthésie Réanimation Pr. BENCHEBBA Driss* Traumatologie Orthopédique Pr. DRISSI Mohamed* Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne Pr. EL OUAZZANI Hanane* Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique Pr. JAHID Ahmed Anatomie pathologique Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
*Enseignants Militaires
Février 2013
Pr. AHID Samir Pharmacologie – Chimie Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie Pr. AMOUR Mourad Anesthésie Réanimation Pr. AWAB Almahdi Anesthésie Réanimation Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr. BENCHEKROUN Laila Biochimie-Chimie Pr. BENKIRANE Souad Hématologie biologique Pr. BENNANA Ahmed* Informatique Pharmaceutique Pr. BENSGHIR Mustapha* Anesthésie Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique et Bromatologie Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie
Pr. BOUTARBOUCH Mahjouba Anatomie Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie Pr. EL GUERROUJ Hasnae Médecine Nucléaire Pr. EL HARTI Jaouad Chimie Thérapeutique Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie Pr. LATIB Rachida Radiologie Pr. MAAMAR Mouna Fatima Zahra Médecine Interne Pr. MEDDAH Bouchra Pharmacologie Pr. MELHAOUI Adyl Neuro-chirurgie Pr. MRABTI Hind Oncologie Médicale Pr. NEJJARI Rachid Pharmacognosie Pr. OUBEJJA Houda Chirurgie Pédiatrique Pr. OUKABLI Mohamed* Anatomie Pathologique Pr. RAHALI Younes Pharmacie Galénique Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie Pr. REDA Karim* Ophtalmologie Pr. REGRAGUI Wafa Neurologie Pr. RKAIN Hanan Physiologie Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique Pr. ROUIBAA Fedoua* Gastro-Entérologie Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique Pr. BENCHAKROUN Mohammed * Traumatologie- Orthopédie Pr. BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique Pr. KOUACH Jaouad* Génycologie-Obstétrique Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie Pr. OULAHYANE Rachid* Chirurgie Pédiatrique Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Génécologie-Obstétrique
AVRIL 2014
Pr.ZALAGH Mohammed ORL
PROFESSEURS AGREGES : DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie Pr. DERRAJI Soufiane* Pharmacie Clinique Pr. DOBLALI Taoufik* Microbiologie Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE AbdedaimHatim* Anesthésie-Réanimation Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique Pr. JAHIDI Mohamed* O.R. L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI Nezha Anesthésie-Réanimation Pr. RAMI Mohamed Chirurgie Pédiatrique Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale Pr. EL ASRI Fouad* Ophtalmologie Pr. ERRAMI Noureddine* O.R. L
Pr. NITASSI Sophia O.R. L
JUIN 2017
Pr. ABI Rachid* Microbiologie Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale Pr. EL GHISSASSI Ibrahim Oncologie Médicale Pr. OURAINI Saloua* O.R. L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
* Enseignants Militaires
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie Pr. ALAOUI Katim Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr. BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI LallaChadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
Dédicaces
Je dédie cette thèse à tous les
miens…
A notre maître et président de thèse
Madame le professeur Souad BENKIRANE
Professeur d’hématologie biologique
C’est avec une profonde gratitude et une joie immense
que nous avons
reçu votre acceptation de présider le jury de notre thèse
en plaçant votre confiance en notre travail.
Avec tout le respect que nous vous devons, veuillez
trouvez ici, l’expression de notre profond respect et
A notre maître et rapporteur de thèse
Monsieur le professeur Azlarab MASRAR
Professeur d’Hématologie Biologique
Chef de service du laboratoire central d’hématologie
du CHU Ibn Sina Rabat
Ce fut un honneur et privilège de travailler avec vous, vos
compétences, qualités humaines et votre simplicité ont
toujours suscités en nous une grande admiration.
Nos sincères remerciements à vous pour votre confiance,
votre constante disponibilité, votre patience et surtout vos
conseils judicieux. C’est avec une joie et un plaisir
immense que nous exprimons notre gratitude pour tous
vos efforts déployés pour la réalisation de ce travail riche
A Notre Maitre et Juge de Thèse
Madame Mona NAZIH
Professeur d’Hématologie Biologique
Nous sommes très sensibles à l’honneur que vous nous
faites en acceptant de juger notre travail, et d’apporter
vos connaissances à la critique de ce travail.
Veuillez accepter cher maître l’expression de notre
plus haute estime et de nos sentiments
les plus respectueux.
A Notre Maitre et Juge de Thèse
Monsieur le professeur Anass JEAIDI
Professeur d’hématologie biologique
C’est pour nous un grand honneur de vous avoir dans notre
jury pour juger ce travail.
Merci de votre serviabilité dont vous nous avez témoigné en
acceptant de siéger dans notre jury de thèse, et d’apporter
vos connaissances à la critique de ce travail.
Recevez à travers ce travail notre gratitude
TABLE DES MATIERES
LISTE DES ABREVIATIONS LISTE DES TABLEAUX LISTE DES FIGURES
INTRODUCTION……….. 1 RAPPELS PHYSIOPATHOLOGIQUES……….………4 I. Le LCR ………... 5 II. LIQUIDES D’EPANCHEMENT………. 6 1. LIQUIDE D’ASCITE ... 7 2. LIQUIDE PLEURAL ... 8 3. LIQUIDE SYNOVIAL ... 9 MATERIELS ET METHODES………. 10 I. MATERIELS : ECHANTILLONS ET TECHNIQUES DE PONCTION………. 11 1. LCR ... 11 2. LIQUIDE D’ASCITE ... 12 4. LIQUIDE PLEURAL ... 13 5. LIQUIDE SYNOVIAL ... 14 II. METHODES ……… 15 1. EXAMEN MACROSCOPIQUE ... 15 2. COMPTAGE CELLULAIRE ... 15 A. Principe du comptage cellulaire ……… 15 B. le comptage manuel ………. 16 C. le comptage automatisé………. 19 RESULTATS ET ANALYSES……….. 23 I. ASPECTS MACROSCOPIQUES ………. 24 1. LCR ... 24 2. LIQUIDE D’ASCITE ... 25 3. LIQUIDE PLEURAL ... 25 4. LIQUIDE SYNOVIAL ... 25 II. ASPECTS HEMATO- CYTOLOGIQUES ………... 26 1. LCR NORMAL ... 26 2. LCR PATHOLOGIQUE ... 27 A. les cellules inflammatoires……… 27 a) Les macrophages……….. 27
b) Les plasmocytes ……… 28 c) Les polynucléaires neutrophiles………..28 d) Les polynucléaire éosinophiles ……….……….30 B. Les globules rouges……… 31 C. Les blastes……….. 32 3. LIQUIDE D’ASCITE ... 34 A. Ascite à polynucléaires neutrophiles……….. 34 B. Ascite à polynucléaires éosinophiles ……….... 35 C. Ascite à lymphocytes d’aspect banal………... 35 D. Ascite à cellules lymphoïdes atypiques ………..…………...35 4. LIQUIDE PLEURAL ... 35 A. Pleurésies à polynucléaires neutrophiles……… 35 B. Pleurésies à polynucléaires éosinophiles ……….………. 36 C. Pleurésies lymphocytaires ………..………....36 5. LIQUIDE SYNOVIAL ... 37 A. Liquides d’épanchements synoviaux mécaniques………. 37 B. Synovites inflammatoires……….. 37 a) Prédominance de polynucléaires neutrophiles……….. 38 b) Prédominance de lymphocytes ………... 38 c) Prédominance de monocytes……….… 38 d) Prédominance de polynucléaires éosinophiles………... 38 C. Liquides Synoviaux Hémorragiques………... 38 D. Liquides synoviaux avec présence de cellules atypiques ……… 39 DISCUSSION……… 40 I. Phase pré analytique ……….. 41 II. Phase analytique………... 42 III. Phase post analytique………. 46 1. LCR ... 46 2. Liquide d’ascite ... 48 3. Liquide pleural ... 48 4. Liquide synovial ... 50 CONCLUSION………... 51 RESUME ………53 BIBLIOGRAPHIE……….. 57
LISTE DES ABREVIATIONS
LCR : liquide céphalorachidien PNNs : polynucléaires neutrophiles INR : international normalised ratio G/L : milliards par litre
EDTA :acide éthylènediaminetétraacétique
Tampon PBS : tampon phosphate salin souvent abrégé PBS, de l'anglais phosphate buffered
saline
AVCI : accident vasculaire cérébral ischémique HIV : virus de l'immunodéficience humaine PL : ponction lombaire
SIDA : Le syndrome d'immunodéficience acquise CMV : cytomégalovirus
GR : globule rouge
LAL : leucémie aiguë lymphoblastique LAM : leucémie aiguë myéloblastique
FAB : la classification Franco-Américano-Britannique des leucémies aiguës IRM : imagerie par résonance magnétique
CNS : Central nervous system NCI : National cancer institute GB : globules blancs
TLP : traumatic lumbar puncture PEo : polynucléaires éosinophiles PR : polyarthrite rhumatoïde
Cellules LE : cellules du lupus érythémateux g/l : grammes par litre
SNC : système nerveux central IgG: immunoglobuline G
M. tuberculosis: mycobacterium tuberculosis PCR : Polymerase chain reaction
ACE : Antigène carcino-embryonnaire LDH : lactate déshydrogénase
LISTE DES TABLEAUX
Tableau 1: ORIENTATION DEVANT LCR HEMORRAGIQUE ... 24 Tableau 2: ORIENTATION DIAGNOSTIQUE DEVANT L’ASPECT ET LA
CELLULARITE DU LCR DANS LA PATHOLOGIE INFECTIEUSE ... 30 Tableau 3: CLASSIFICATION CNS STATUS SELON NCI WORKSHOP 1993 ... 33 Tableau 4: CLASSIFICATION CNS STATUS UTILISEE DEPUIS 2003 ... 33 Tableau 5: ORIENTATION ETIOLOGIQUE DEVANT UN EPANCHEMENT PLEURAL37 Tableau 6: CRITERES DE LIGHT 1972, UN CRITERE AU MOINS PARMI CES
LISTE DES FIGURES
Figure 1: SCHEMA DES VOIES D’ECOULEMENT DU LCR ... 6 Figure 2: PONCTION LOMBAIRE ... 12 Figure 3: REPERES DU SITE DE PONCTION D’ASCITE CHEZ UN CIRRHOTIQUE EN DECUBITUS DORSAL ... 13 Figure 4: TECHNIQUE DE PONCTION PLEURALE ... 14 Figure 5: CELLULE DE MALASSEZ EN VERRE ... 17 Figure 6: SCHEMA D’UNE LAME EN VERRE TYPE MALASSEZ AVEC SON
QUADRILLAGE ... 17 Figure 7: REPRESENTATION D’UNE LAME C-CHIP ... 19 Figure 8: EXEMPLE DE COMPTEUR PORTATIF ... 20 Figure 9: COMPTEUR AUTOMATISE CELLOMETER AUTO1000 ... 22 Figure 10: LYMPHOCYTE ET MONOCYTE D’UN LCR NORMAL APRES
COLORATION DE WRIGHT-GIEMSA ... 26 Figure 11: MACROPHAGES DANS LE LCR AU COURS D’UNE HEMORRAGIE
MENINGEE, APRES COLORATION DE WRIGHT-GIEMSA ... 27 Figure 12: PLASMOCYTES DANS LE LCR AU COURS DE LA MALADIE DE LYME.. 28 Figure 13: PNNs AVEC BACTERIES DANS LE LCR AU COURS D’UNE MENINGITE AIGUE BACTERIENNE A PNEUMOCOQUE (COLORATION WRIGHT-GIEMSA) ... 29 Figure 14: EOSINOPHILES (flèches) DANS LE LCR APRES COLORATION WRIGHT-GIEMSA ... 31 Figure 15: BLASTES DANS LE LCR AU COURS DE LAL 1 ... 34 Figure 16: ECHANTILLON CELLULAIRE AVEC DES DEBRIS SUR
HEMATIMETRE……….42 Figure 17: SUBJECTIVITE HUMAINE. ... 43 Figure 18: VUE DE COTE D’UN HEMATIMETRE VIDE (GAUCHE) ET REMPLI
INTRODUCTION
L’analyse hématologique des liquides de ponction est un processus essentiel pour le
diagnostic et le suivi de plusieurs maladies.
Pour le liquide céphalorachidien, la numération et la différenciation leucocytaire permettent de distinguer une méningite virale d’une méningite bactérienne [1], La présence d’une grande quantité d’érythrocytes indique une hémorragie méningée ou une ponction traumatique. Pour l’ensemble des autres liquides de ponction, liquides de séreuses ou articulaire, la présence d’un nombre important de PNNs suggère une infection d’origine bactérienne.
Les liquides de ponction sont analysés au laboratoire de biologie médicale pour effectuer les numérations cellulaires et un examen morphologique des cellules. Ces demandes, sporadiques dans les laboratoires de petite taille, affluent parfois en grand nombre dans le cas de laboratoires associés à des grands centres Hospitaliers. Cet afflux de prélèvements nécessite une adaptation des techniques utilisées.
Le gold standard reste le comptage manuel optique par examen microscopique [2].
Le comptage optique « manuel » à l’aide d’une cellule de comptage et l’examen cytologique au microscope requièrent du personnel compétent spécialisé (technicien de laboratoire, biologiste). Et présentent des inconvénients majeurs : Durée de l’analyse, variabilité inter-opérateur, imprécision du résultat… Il est donc légitime de vouloir mettre en place une analyse cytologique automatisée des liquides de ponction pouvant bénéficier de contrôles. Cependant on ne peut pas utiliser tels quels les modules d’analyses prévus pour le sang, non programmés pour ces tests. En effet l’analyse des liquides de ponction diffère de l’analyse cytologique du sang sur plusieurs points : par la présence de cellules particulières (cellules mésothéliales, cellules synoviales, voire cellules néoplasiques) ; par la cellularité (classiquement moins importante dans un liquide de ponction) ; et par la matrice extracellulaire. Il a donc fallu adapter les technologies existantes : modifier les volumes de liquides analysés, vérifier les méthodes de comptage cellulaire pour éliminer un effet de matrice… De nouvelles règles d’expertise ont dû être élaborées pour prendre en compte les spécificités de ces milieux, aboutissant à la construction de modules spécifiques.
Plusieurs fournisseurs d’appareils de cytologie ont développé leurs propres méthodes analytiques : Iris (iQ200 et système iriscell) ; Beckman® (LH 750/780 et DxH 800) ; Advia® (2120 et 2120i) ; SYSMEX® (séries XE, XN, module Bodyfluid™(BF)). [3]
RAPPELS
PHYSIOPATHOLOGIQUES
Le liquide de ponction est un liquide corporel non circulant, qui, sous l’effet d’une pathologie, augmente en volume et crée un épanchement. On distingue classiquement les liquides pleuraux, péritonéaux, péricardiques, articulaires. Il peut s’agir en outre de liquide présent en quantité significative dont l’analyse peut présenter un intérêt, tel que le LCR.
I. Le LCR : [4]
C’est un liquide physiologique occupant deux grands compartiments du système nerveux central :
- Les ventricules cérébraux : dans lesquels il est secrété par les plexus choroïdes (de 300 à 500 ml/jour chez l’adulte), ces derniers sont constitués par un stroma fait de cellules leptoméningées dispersées entre de très nombreux capillaires sanguins, et revêtu d'un épithélium.
- Les espaces sous arachnoïdiens cérébraux et spinaux : aux au niveau desquels il est résorbé par les villosités arachnoïdiennes.
Ces deux compartiments communiquent librement par les trous de Magendie et de LushKa. Les ventricules cérébraux sont entièrement revêtus par l'épendyme, et les espaces sous arachnoïdiens sont contenus dans les mailles des leptoméninges.
Le LCR joue plusieurs rôles :
• Mécanique : protection contre la pression vasculaire, et amortissement du déplacement du cerveau vers le crâne en cas de choc.
• Maintien de la régulation de la pression intra-crânienne. • Transport des éléments nutritifs aux neurones.
• Elimination des déchets des cellules du système nerveux central.
• Protection contre les infections via des médiateurs de l’immunité humorale et cellulaire.
Figure 1: SCHEMA DES VOIES D’ECOULEMENT DU LCR [5]
II. LIQUIDES D’EPANCHEMENT :
Quelle que soit l’origine du liquide d’épanchement, la physiopathologie est proche. A l’état normal, il existe une lubrification des séreuses par une faible quantité de liquide produite par le feuillet pariétal et réabsorbée par le feuillet viscéral. Un déséquilibre entre sécrétion et réabsorption provoque un épanchement. Ces liquides d’épanchements sont classés traditionnellement en deux catégories [6] :
Les transsudats
:
Ils correspondent à une diminution de la résorption du liquide. Les causes sont souvent mécaniques et diffèrent selon l’origine du liquide. Classiquement, on ne retrouve pas d’excès de protides et la cellularité est faible.
Les exsudats :
Ils apparaissent suite à une augmentation de la production du liquide. Ils sont le plus souvent secondaires à une prolifération tumorale ou à une inflammation ayant pour origine une
infection, des troubles vasculaires aigus, ou certaines connectivites. Le taux de protides est élevé, il peut y avoir présence de fibrinogène et on y retrouve de nombreuses cellules. De plus chaque liquide possède des caractéristiques différentes en fonction de son origine.
1. LIQUIDE D’ASCITE : [7] ; [8] ; [9]
L’ascite est un épanchement liquidien de la cavité péritonéale. On exclut généralement de cette définition les épanchements purulents (péritonites), les épanchements sanglants (hémopéritoines), et les épanchements bilieux (cholépéritoines). La caractéristique exsudative ou transsudative de l’ascite dépend de la cause de l’épanchement :
Le transsudat peut être constitué suite à :
o Une hypertension portale, retrouvée dans en cas de cirrhose, d’affection cardiaque, ou de métastases hépatiques avec compression vasculaire provoquant un blocage mécanique.
o Rarement : un syndrome néphrotique, une dénutrition ou une entéropathie exsudative, le mécanisme ainsi est la diminution de la pression oncotique du secteur vasculaire secondaire à l’hypoprotidémie.
A l’inverse, la pression portale est normale dans le cas d’un exsudat. La cause est alors extérieure :
o Carcinose péritonéale. o Tuberculose péritonéale.
o Affection pancréatique, l’ascite est secondaire dans ce cas à une fuite par rupture d'un canal pancréatique ou d'un pseudo-kyste dans la cavité péritonéale.
o Les connectivites, en particulier le lupus systémique peuvent s’associer à une ascite qui est en général riche en protides, et secondaire à une sérite par vascularite péritonéale.
o L’ascite chyleuse peut être secondaire à un traumatisme chirurgical du canal lymphatique, un obstacle lymphatique (lymphome par exemple), dysplasie congénitale des canaux lymphatiques, une infection parasitaire à filaires (après un séjour en zone d’endémie), ou rarement la tuberculeuse péritonéale.
o Le mésothéliome péritonéale.
o La maladie gélatineuse du péritoine est due à l'accumulation de mucine dans la cavité péritonéale, Le diagnostic est fait par ponction avec une aiguille de gros calibre pour ramener cette substance épaisse. Ses causes sont les cystadénomes ou cystadénocarcinomes ovariens ou appendiculaires.
2. LIQUIDE PLEURAL : [10]
La plèvre est la membrane séreuse qui recouvre les poumons, la cage thoracique, le diaphragme et le médiastin. Les deux feuillets sont contigus et l’espace virtuel formé ainsi entre les deux est la cavité pleurale. Normalement, les deux feuillets ne sont séparés que par une quantité infime de fluide quasi virtuelle (production de 5-20 ml/jour) qui facilite les mouvements de glissement des deux membranes l’une contre l’autre.
Un épanchement pleural est toujours pathologique et les mécanismes peuvent être :
• Une atteinte de l’équilibre sécrétion/résorption par
anomalie <Mécanique> :
- Déséquilibre entre les pressions hydrostatiques (insuffisance cardiaque) et oncotiques (syndrome néphrotique)
- Augmentation de la dépression pleurale (atélectasie pulmonaire)
- Passage de liquide d'ascite vers la cavité pleurale par les puits de Ranvier
• Une atteinte de la plèvre par agression
inflammatoire, infectieuse ou néoplasique
Liquide pauvre en protéines = Transsudat Liquide pauvre en Protéines = Exsudat 8
Lorsque l’épanchement pleural est unilatéral, il est le plus souvent dû à une pathologie pleurale ou pulmonaire, à la différence d’un épanchement bilatéral qui sera plutôt le témoin d’une atteinte systémique.
3. LIQUIDE SYNOVIAL : [11]
Le liquide synovial (appelé aussi liquide articulaire) remplit l’espace des cavités articulaires. Il est fabriqué par les cellules synoviales à partir d’un filtrat de plasma. Son rôle :
- Lubrifier l’articulation grâce au hyaluronate qui est responsable des propriétés visco-élastiques du liquide synovial.
- Source de nutrition (glucose, oxygène) pour le cartilage articulaire (qui n’est pas vascularisé).
- Elimination des déchets métaboliques (lactate, gaz carbonique) provenant du cartilage articulaire.
MATERIELS ET
METHODES
I. MATERIELS : ECHANTILLONS ET
TECHNIQUES DE PONCTION
1. LCR :
En l'absence de contre-indication : [12] o Hypertension intracrânienne. o Infection locale au site de ponction.
o Trouble majeur de la coagulation sanguine (Thrombocytes < 50 G/l, INR ≥1,5, Temps de saignement > 7 min, (ni l’acide acétylsalicylique, ni le clopidogrel, ni leur combinaison ne contre-indiquent une PL).
o Refus explicite ou présumé par le patient.
La ponction lombaire est réalisée en respectant une asepsie de type chirurgical [13], Elle doit se situer entre la 4ème et la 5ème vertèbre lombaire, ou entre la 3ème et la 4ème. [14]
Le LCR est prélevé dans 3 à 4 tubes stériles, numérotés de façon séquentielle selon l’ordre de prélèvement (chacun avec 1 ml = 20 gouttes), Le dernier tube prélevé est utilisé pour l’examen hématologique, parce qu’il est moins susceptible d’être contaminé par les éléments cellulaires issus du traumatisme de la ponction. [15]
Figure 2: PONCTION LOMBAIRE [16]
Le LCR doit être acheminé le plus rapidement possible en main propre au laboratoire, et son analyse doit être réalisée idéalement, dans les instants qui suivent le prélèvement. Ceci tant pour l’urgence du résultat que pour la détérioration rapide de la qualité du spécimen. Si un délai est inévitable, l’échantillon de LCR doit être conservé à 4 °C. [17]
Note : Après deux heures de conservation à la température de la pièce, les leucocytes
s’abaissent de 40 %. Après deux heures de conservation à 4 °C, les leucocytes s’abaissent de 15 %. [18]
2. LIQUIDE D’ASCITE :
Le prélèvement de liquide se fait au lit du malade après désinfection locale au niveau de la fosse iliaque gauche, au niveau du tiers externe de la ligne entre l’ombilic et l’épine iliaque antéro-supérieure. On peut l’effectuer sous contrôle échographique. Le liquide s’écoule naturellement, on le recueille traditionnellement sur 3 flacons dont 1 avec anticoagulant (EDTA ou citrate) destiné à l’examen hématologique.
Les contre-indications de cette ponction sont exceptionnelles : fibrinolyse primaire ou coagulation intravasculaire disséminée avec hémorragie évidente. Les troubles de la coagulation habituellement présents chez le patient cirrhotique ne sont pas une contre-indication. [19]
L’analyse hématologique doit être effectuée moins d’une heure après le prélèvement [17]. Le spécimen doit être réfrigéré si l’analyse est retardée. [15]
Figure 3: REPERES DU SITE DE PONCTION D’ASCITE CHEZ UN CIRRHOTIQUE EN DECUBITUS DORSAL [20]
4. LIQUIDE PLEURAL :
Obtenu par ponction pleurale qui se fait après désinfection et anesthésie locale. L’aiguille est introduite perpendiculairement à la peau dans un espace intercostal, en pleine matité, et en passant par le bord supérieur de la côte inférieure pour ne pas piquer l'artère intercostale, en arrière à 10 cm de la ligne médiane.
Les contre-indications de cette ponction sont similaires à celles décrites pour la ponction d’ascite.
Figure 4: TECHNIQUE DE PONCTION PLEURALE [21]
Pour l’examen hématologique de ce liquide, l’échantillon est prélevé dans un tube contenant, de préférence, l’anticoagulant EDTA. L’analyse doit s’effectuée moins d’une heure après le prélèvement [17]. Le spécimen doit être réfrigéré si l’analyse est retardée [15].
5. LIQUIDE SYNOVIAL :
La ponction synoviale est réalisée par un opérateur entraîné, à l'aide d'une aiguille fine avec asepsie rigoureuse. Elle se fait généralement « à l’aveugle » en utilisant des points de repères anatomiques. L’échographie est utile pour les articulations profondes comme la hanche ou les articulations dites « difficiles » comme le tarse.
Les contre-indications sont l’Infection ou dermatose au site de ponction, une Bactériémie suspectée, trouble de la coagulation (coagulopathie, traitement anticoagulant, thrombocytes < 50 G/l), matériel prothétique (ostéosynthèse, prothèse), instabilité majeure de l’articulation (arthropathie neurogène, rupture ligamentaire), ou suspicion de fracture intra articulaire. [22]
Le recueil se fait sur des tubes contenant un anticoagulant, le plus utilisé est l’EDTA, mais il peut introduire des artefacts si les cristaux sont présents et peut déformer la morphologie
cellulaire, en particulier si le transport est retardé. Pour ces raisons, certains auteurs favorisent l’utilisation de l'héparine sodique comme anticoagulant de choix.
L’analyse doit s’effectuée moins d’une heure après le prélèvement [17]. Le spécimen doit être réfrigéré si l’analyse est retardée [15].
II. METHODES :
1. EXAMEN MACROSCOPIQUE : [23]
Correspond à l’analyse à l'œil nu de l’échantillon pour déterminer sa couleur, sa limpidité, sa coagulabilité, et sa viscosité.
L’aspect macroscopique peut aider à distinguer un exsudat d’un transsudat et donc utile à l’orientation diagnostique mais, à lui seul, ce critère n’est pas suffisamment performant.
Si un exsudat (confirmé par des paramètres cellulaires et/ou biochimique) est clair, il faut penser à une infection tuberculeuse ou une infection virale.
2. COMPTAGE CELLULAIRE : [24]
A. Principe du comptage cellulaire :
Le comptage ou numération cellulaire est la détermination du nombre de cellules contenues dans un volume précis d’un milieu liquide. On exprime le résultat en concentration cellulaire, c’est à dire en unité d’événements par unité de volume (par ex. nombre de cellules / ml).
Le comptage cellulaire s’effectue toujours sur une partie de l’échantillon et jamais sur sa totalité. Pour cela un échantillon défini de la solution totale est prélevé puis le nombre d’événements présents est compté. Le nombre obtenu est extrapolé au volume total pour estimer la concentration.
La numération cellulaire peut se faire soit par un comptage manuel au microscope, soit par un comptage automatisé avec des équipements dédiés. Selon la nature de l’échantillon, le principe est identique mais avec les compteurs automatisés des optimisations sont nécessaires pour éviter de sur ou sous-exprimer la concentration cellulaire.
B. le comptage manuel :
Le comptage manuel est le comptage le plus répandu dans les laboratoires, car il est rapide et très facile à mettre en œuvre (nécessite peu de matériel). C’est l’utilisateur lui-même qui choisit de compter ou non certaines cellules.
Pour ce comptage manuel, l’expérimentateur a besoin :
o D’un hématimètre ou cellule de comptage, il s’agit d’une lame porte objet, généralement en verre épais, dans laquelle est creusée une chambre de comptage de volume connu et comportant un quadrillage.
o D’une pipette. o D’un microscope.
o D’un tampon PBS pour les dilutions.
o D’une solution à compter (liquide de ponction).
Les lames utilisées pour le comptage manuel sont des lames spécifiques, en verre ou en plastique. Généralement, les lames en verre sont les plus utilisées. Ces lames sont en forme de porte-objet de 30 x 70 mm et de 4 mm d’épaisseur comme montré ci-dessous :
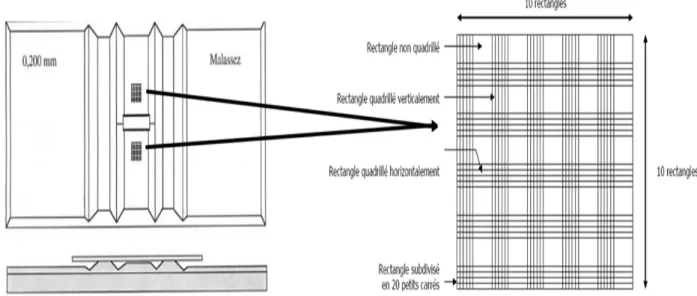
Figure 5: CELLULE DE MALASSEZ EN VERRE
La partie centrale possède un quadrillage différent selon le type de lame : Malassez, Nageotte, Neubauer, Bürker, Fuchs Rosenthal, Thoma, ou Bürker- Türk.
La lame la plus répandue en laboratoire est la lame de Malassez. Elle est gravée de 100 rectangles, eux-mêmes recoupés en 25 rectangles qui sont subdivisés en 20 petits carrés pour
faciliter le comptage. Le volume correspondant au quadrillage total est égal à 1 μl.
Figure 6: SCHEMA D’UNE LAME EN VERRE TYPE MALASSEZ AVEC SON QUADRILLAGE
Pour réaliser le comptage, un volume d’échantillon de la solution à compter (en général entre 10 et 20 µl) est déposé entre la lame et la lamelle au niveau du quadrillage (étalement de l’échantillon par capillarité entre la lame et la lamelle). En fonction de la confluence des cellules dans la suspension cellulaire, il est recommandé de faire une dilution avant le comptage. Dans ce cas, il faut tenir compte du facteur de dilution dans le calcul de la concentration totale de la suspension cellulaire.
Une fois la lame chargée, elle est observée sous le microscope. Après la mise au point, on compte le nombre d’événements sur au moins 4 ou 5 carrés du quadrillage. Après le comptage, on calcul la concentration cellulaire dans l’échantillon par la formule suivante :
Concentration (cel/ml) = Quantité de cellules / Volume (en ml)
Formule de calcul modifiée appliquée aux lames de comptage :
Concentration = (Quantité de cellules x 10 000) / (Quantité de cadres x
dilution)
Comme dans toute expérience, il est important de faire des réplicats.
Après le comptage il est essentiel de nettoyer les lames en verre pour éviter toutes contaminations croisées. Pour pallier ce risque de contamination, des lames en plastique à usage unique ont été développées : les hémocytomètres C-Chip™, Ces lames en plastique comportent 2 chambres de dépôt avec chacune 2 quadrillages permettant d’effectuer 2 comptages à partir d’une seule lame.
Figure 7: REPRESENTATION D’UNE LAME C-CHIP
Il est possible de vérifier la viabilité de la suspension cellulaire, aussi bien avec une lame en verre réutilisable ou en plastique à usage unique. Pour cela, on utilise une solution commerciale de bleu de trypan de 0,4%. Ce dernier, aussi appelé bleu diamine ou bleu de Niagara est un colorant vital dérivé de la di- toluidine (C14H16N2) qui a été synthétisé pour la première fois par le chimiste allemand Paul Ehrlich en 1904. Ce produit est utilisé en laboratoire pour colorer les cellules mortes en bleu foncé, car il pénètre dans le cytoplasme des cellules mortes dont la membrane plasmique est devenue perméable. L’ajout du bleu de trypan dans une solution marque uniquement les cellules mortes, les cellules vivantes restent intactes. Ainsi, il est possible de déterminer dans une suspension cellulaire la proportion de cellules vivantes et mortes et donc d’en déduire la viabilité cellulaire.
C. le comptage automatisé :
Basé sur l’utilisation des systèmes plus ou moins complexes et plus ou moins précis selon les modèles, qui fonctionnent tous sur un même principe : un échantillon de volume connu, une détection des cellules et un calcul de la concentration finale.
Compteur de cellules portatif :
Ce type de compteur ressemble à une pipette et il est basé sur le principe Coulter.
.
Figure 8: EXEMPLE DE COMPTEUR PORTATIF
Le principe Coulter a été développé par Wallace H. Coulter en 1940 : il permet de compter et déterminer la taille des particules en se basant sur la mesure d’impédance. Cette technologie a principalement été créée pour compter rapidement des cellules sanguines en mesurant les modifications de conductance électrique (impédance) lors du passage de ces cellules en suspension dans un fluide conducteur à travers un petit orifice.
Avec ce compteur de cellules, l’utilisateur installe à l’extrémité de la pipette une sonde, puis il va pipeter directement 50 µl de la suspension cellulaire préalablement diluée si nécessaire. La suspension entre dans la pipette pour être envoyée dans un micro-capillaire situé au niveau de la sonde qui détecte chaque cellule via le principe Coulter et détermine la concentration cellulaire.
Le résultat obtenu est alors affiché sur l’écran de la sonde avec un histogramme montrant la distribution des tailles des cellules.
Ce compteur automatisé est pratique car petit, rapide et portatif. Cependant, il reste très limité en termes d’application, et surtout, il est impossible de vérifier la fiabilité des résultats obtenus. En effet, l’utilisateur n’a aucun moyen de vérifier si les cellules comptées ne sont pas des débris ou des « clusters » de cellules comptés comme une seule cellule. Il n’a également aucun moyen de réajuster le comptage ou recompter le même échantillon à la différence de certains compteurs automatisés.
Autres compteurs automatisés :
Des compteurs automatisés disponibles sur le marché utilisent une lecture de cellules en bleu de trypan, ils possèdent une caméra CCD, un logiciel de traitement des résultats et certains sont équipés d’un portoir de tubes (comptage haut-débit).
L’échantillon est aspiré ainsi que le bleu de trypan, puis le mélange est injecté dans le système fluidique et passe à travers une cellule qui permet de capter une image de la suspension cellulaire. L’acquisition porte sur une centaine d’images qui déterminent le nombre de cellules, la concentration et la viabilité de l’échantillon. Les données obtenues sont des résultats numériques, des histogrammes de distribution des tailles de cellules et des images des cellules.
Le fait de visualiser les cellules post-comptage permet de s’assurer que le dispositif n’a pas compté de faux positifs ou des débris cellulaires. En plus des données quantitatives, l’utilisateur a accès à des données qualitatives, essentielles et complémentaires pour la suite de ses expériences.
Pour ces compteurs, le volume d’échantillon utilisé peut être important (environ 500 µl) auquel il faut ajouter le volume de tampon et le volume de nettoyage du système fluidique qui est utilisé pour écarter tout risque de contamination croisée. Ces dispositifs sont donc gourmands, d’autant plus que le volume utilisé d’une suspension cellulaire n’est pas réutilisable après le comptage.
Figure 9: COMPTEUR AUTOMATISE CELLOMETER AUTO1000
RESULTATS ET
ANALYSES
.
I. ASPECTS MACROSCOPIQUES :
1. LCR :
L'aspect normal LCR est typiquement << eau de roche >>, cet aspect diffère en fonction de la pathologie sous-jacente, il peut être :
o Trouble : cette modification est provoquée par l'hyper leucocytose, ce trouble apparaissant dès la présence de 20 globules blancs par millimètre cube [25], et tous les degrés existent depuis l'aspect opalescent jusqu'au classique aspect << eau de riz >>, évocateur d'une méningite due à des germes pyogènes [26].
o Clair : en cas de méningite : décapitée, débutante, virale, parasitaire, fongique, à leptospire ou à bactérie à tropisme intracellulaire (Mycobacterium tuberculosis, Listéria, mycoplasme, Rickettsia, chlamydia, treponema pallidum…) [27].
o Hémorragique : lié à un accident de prélèvement, une hémorragie méningée ou une infection neuro-méningée.
LCR en cas d’hémorragie méningée
LCR à ponction traumatique
liquide rouge/rosé dans 3 tubes
liquide de moins en moins
sanglant
liquide incoagulable
liquide coagulable
surnageant xanthochromique*
surnageant clair
Tableau 1: ORIENTATION DEVANT LCR HEMORRAGIQUE [28]
*Les produits de dégradation de l’Hb (oxyhémoglobine=rougeâtre-rosé métabolisée en bilirubine=jaune) donnent au plus tôt 9-15 heures après l’hémorragie une coloration jaunâtre, xanthochrome du LCR centrifugé. [28]
2. LIQUIDE D’ASCITE :
L’aspect du liquide d’ascite oriente sur l’origine transsudative ou exsudative du liquide.
o Les transsudats correspondent à des liquides clairs, opalescents ou citrins.
o Les exsudats sont troubles, rougeâtres, purulents, hémorragiques (carcinose péritonéale), lactescents (ascite chyleuse), ce dernier aspect est dû à une forte concentration en triglycérides ou cholestérol et une formule cellulaire lymphocytaire du liquide (> 70 %), ou d’aspect visqueux et épais en cas de la maladie gélatineuse du péritoine. [9] [31]
3. LIQUIDE PLEURAL :
Macroscopiquement, le liquide pleural peut déjà informer sur l’origine de l’épanchement. Un liquide trouble évoque une infection, un aspect blanc laiteux un chylothorax, un liquide uniformément sanglant un hémothorax. Un épanchement sérohématique oriente vers une cause néoplasique. En revanche, un liquide jaune citrin et clair ne préjuge pas de l’origine [32].
4. LIQUIDE SYNOVIAL :
Un liquide synovial normal est transparent, clair, très visqueux et incoagulable. Plus le liquide est inflammatoire, moins il est visqueux, la viscosité étant dépendante de la concentration et du degré de polymérisation de l'acide hyaluronique sécrété par les cellules synoviales. Les leucocytes présents dans l’articulation sécrètent des enzymes qui dépolymérisent l’acide hyaluronique [11].
L'aspect macroscopique se modifie en fonction de la pathologie : jaune paille ou jaune citrin dans le cas des arthropathies dégénératives, trouble et purulent dans les arthrites septiques. Les hémarthroses donnent des liquides synoviaux sanglants, non coagulables. On pourra chercher en outre des petites particules blanches, « en grains de riz », dans la polyarthrite rhumatoïde qui correspondent à des « agrégats » de fibrine et de débris synoviaux [33].
II. ASPECTS HEMATO- CYTOLOGIQUES :
1. LCR NORMAL : [29]
Un LCR normal a une cellularité caractérisée par : - Moins de 5 leucocytes/mm3 chez l’adulte avec :
o 80% de lymphocytes.
o 15 % de monocytes : pliés, avec un noyau en forme de haricot et une quantité modérée de cytoplasme.
o Absence de polynucléaires. o Absence de plasmocytes. - Absence d’hématies.
Figure 10: LYMPHOCYTE ET MONOCYTE D’UN LCR NORMAL APRES COLORATION DE WRIGHT-GIEMSA [30]
2. LCR PATHOLOGIQUE :
A. les cellules inflammatoires :
Les cellules inflammatoires telles que les macrophages, les plasmocytes et les polynucléaires constituent une anomalie dans le LCR. Ils peuvent accompagner des néoplasies, mais sont également observées dans des états non néoplasiques.
a) Les macrophages : [30] [34]
Ils possèdent un cytoplasme vacuolé abondant qui contient parfois des cellules, des organismes ou des pigments ingérés. Leur présence dans le LCR Peut s’associer avec :
o Méningite
o Hémorragie méningée o AVCI
o Sclérose en plaque
Figure 11: MACROPHAGES DANS LE LCR AU COURS D’UNE HEMORRAGIE MENINGEE, APRES COLORATION DE WRIGHT-GIEMSA [30]
b)
Les plasmocytes : [30]
Leur présence dans LCR peut s’associer avec :
o Méningite virale (EX : entérovirus, virus HIV) o Cysticercose
o Sclérose en plaque o Tuberculose
o Maladie de Lyme o Syphilis
Figure 12: PLASMOCYTES DANS LE LCR AU COURS DE LA MALADIE DE LYME [30]
c) Les polynucléaires neutrophiles :
Ils sont de découverte normale s'il y a contamination par le sang périphérique en cas de PL traumatique, mais de nombreux neutrophiles non accompagnés d’une augmentation proportionnelle du nombre de globules rouges accroit la possibilité de méningite aiguë bactérienne [30].
Figure 13: PNNs AVEC BACTERIES DANS LE LCR AU COURS D’UNE MENINGITE AIGUE BACTERIENNE A PNEUMOCOQUE (COLORATION
WRIGHT-GIEMSA) [30]
Chez les patients avec le SIDA, de nombreux neutrophiles suggèrent fortement une radiculopathie à cytomégalovirus (CMV). Cependant, les Inclusions cytopathiques virales, ne sont pas vues. Le diagnostic de radiculopathie à CMV dans ce cas peut être confirmé par culture virale [35].
Les PNNs dans le LCR se retrouvent également en cas de : o Méningite virale au stade précoce.
o Méningoencéphalite à toxoplasma.
o Crise convulsive épileptique récente (<12 heures) [36].
o Au cours de l'administration intrathécale de chimiothérapie ou des antituberculeux [37].
Tableau 2: ORIENTATION DIAGNOSTIQUE DEVANT L’ASPECT ET LA CELLULARITE DU LCR DANS LA PATHOLOGIE INFECTIEUSE [38]
d) les polynucléaire éosinophiles : [30]
Les éosinophiles sont absents dans le LCR ; quand présents, surtout en grand nombre, ils suggèrent une infection parasitaire, en particulier au Taenia solium (cysticercose) ou à Angiostrongylus cantonensis (méningite angiostrongylienne à éosinophiles). Ils se retrouvent également en cas de :
o Méningite à Coccidioides immitis.
o La fièvre pourprée des montagnes Rocheuses provoquée par Rickettsia rickettsii. o Shunt venticulo-péritonéal.
Paramètres LCR normal LCR purulent LCR lymphocytaire LCR panaché
Aspect clair trouble clair clair
Leucocytes <5 >10 >10 >10
Eléments PNNs lymphocytes 50% lymphocytes
50 % PNNs
Orientations normal Méningite bactérienne (à
méningocoque, pneumocoque, streptocoque B, Haemophilus, klebsielle, ou à E. Coli) Méningite virale Méningite à leptospire Méningite tuberculeuse (chlorures diminués) Méningite à Listeria, mycoplasme, chlamydia, brucella, rickettsie, ou à tréponème Méningite à Listeria Méningite bactérienne ou virale au début Abcès cérébral 30
Figure 14: EOSINOPHILES (flèches) DANS LE LCR APRES COLORATION WRIGHT-GIEMSA [30]
B. Les globules rouges :
Se retrouvent dans le LCR en cas d’une : o Hémorragie méningée.
o Ponction traumatique.
Habituellement, la numération de globules rouges est plus élevée pour le premier tube que pour le quatrième dans le cas d’une ponction traumatique, et approximativement égale dans le cas d’une hémorragie méningée, et dans ce dernier cas les globules rouges sont habituellement vieillis et d’aspect crénelé. [39]
o Inflammation hémorragique dans le cas par exemple d’encéphalite herpétique dans laquelle, le LCR est souvent faiblement hémorragique (10 à 1 000 GR) [40].
C. Les blastes :
Le LCR peut être le siège d’une atteinte tumorale au cours des hémopathies aiguës, au diagnostic initial ou lors de leur évolution.
Au diagnostic de leucémie aiguë lymphoblastique (LAL), un envahissement méningé est identifié dans 3 à 5 % des cas chez l’enfant et 5 à 10 % des cas chez l’adulte avec une plus grande fréquence au cours des LAL T et des formes hyperleucocytaires [41] [42].
Dans les leucémies aiguës myéloblastiques (LAM), l’atteinte représente 10 % des cas chez l’enfant et moins de 5 % des cas chez l’adulte, et est plus fréquemment identifiée dans les LAM4 (FAB), LAM5(FAB) et les formes hyperleucocytaires [43] [44].
La cytologie du LCR, qui permet d’identifier la présence de blastes au microscope, reste le gold standard dans la détection des envahissements neuroméningés, et ceci malgré les progrès de l’imagerie (IRM), et le développement de techniques non cytologiques telles que l’immmunophénotypage par cytométrie en flux, l’hybridation fluorescente in situ, la PCR, ou la recherche de marqueurs protéomiques [45] [46].
Avant les années 1980, le diagnostic d’infiltration blastique neuro-méningée dans les hémopathies aiguës était affirmé en morphologie après identification de blastes dans le LCR comportant en valeur absolue plus de 10 leucocytes/mm3 [47]. En 1985, lors du Rome leukemia workshop, la valeur absolue des leucocytes a été abaissée à 5/mm3 [48]. Puis au cours des années 1990, l’équipe du St Jude Children’s Hospital observa un risque élevé de rechute méningée chez des enfants dont le LCR était blastique avec une valeur absolue des leucocytes inférieure à 5/mm3 [41]. Une révision de la définition de l’atteinte méningée fut alors réalisée, tenant compte de la proportion des leucocytes et la classification du Central nervous system (CNS) status (CNS status) fut adoptée en 1993 lors du National cancer institute workshop.
Tableau 3: CLASSIFICATION CNS STATUS SELON NCI WORKSHOP 1993 [49]
Dès 1996, les ponctions lombaires traumatiques, contaminées par des éléments du sang périphérique et notamment comportant plus de 10 hématies par mm3 et des blastes étaient considérées comme « contaminées » [50, 51]. En 2003, la description dans plusieurs études cliniques de ponctions traumatiques (traumatic lumbar puncture : TLP) avec plus de 10 hématies par mm3 infiltrées ou non par des blastes (respectivement TLP + et TLP -), a permis de faire à nouveau évoluer le CNS status. [52]
Tableau 4: CLASSIFICATION CNS STATUS UTILISEE DEPUIS 2003 [49]
L’utilisation de ce CNS status a pour but de permettre une meilleure comparaison entre les études cliniques et d’harmoniser les attitudes thérapeutiques lors des atteintes méningées. Elle est basée sur le résultat de la numération des leucocytes et des hématies à l’hématimètre,
![Figure 1: SCHEMA DES VOIES D’ECOULEMENT DU LCR [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061445.698885/36.892.115.757.114.413/figure-schema-voies-ecoulement-lcr.webp)
![Figure 2: PONCTION LOMBAIRE [16]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061445.698885/42.892.208.674.114.447/figure-ponction-lombaire.webp)
![Figure 3: REPERES DU SITE DE PONCTION D’ASCITE CHEZ UN CIRRHOTIQUE EN DECUBITUS DORSAL [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061445.698885/43.892.189.681.340.588/figure-reperes-site-ponction-ascite-cirrhotique-decubitus-dorsal.webp)
![Figure 4: TECHNIQUE DE PONCTION PLEURALE [21]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061445.698885/44.892.192.683.110.395/figure-technique-de-ponction-pleurale.webp)


![Tableau 1: ORIENTATION DEVANT LCR HEMORRAGIQUE [28]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061445.698885/54.892.109.776.598.801/tableau-orientation-devant-lcr-hemorragique.webp)
![Figure 10: LYMPHOCYTE ET MONOCYTE D’UN LCR NORMAL APRES COLORATION DE WRIGHT-GIEMSA [30]](https://thumb-eu.123doks.com/thumbv2/123doknet/15061445.698885/56.892.260.611.572.825/figure-lymphocyte-monocyte-normal-apres-coloration-wright-giemsa.webp)