La lithiase rénale est une pathologie fréquente dont les causes sont multiples, allant du simple défaut d'apports hydriques aux maladies génétiques en passant par les fautes de comportement nutritionnel engendrant des anomalies d'excrétion urinaire, les uropathies malformatives et les infections [12]. En pratique clinique courante, une proportion souvent importante des patients lithiasiques a des antécédents d'infection de l'appareil urinaire. La littérature confirme cette relation avec des différences parfois importantes selon les pays et le recrutement des patients [13,14].
Dans les pays industrialisés, la part des lithiases d'infection a considérablement diminué au cours des 20 dernières années [10]. Si l'on raisonne à partir des calculs majoritaires en struvite, cette espèce cristalline étant considérée comme le marqueur privilégié des infections lithogènes induites par des germes uréasiques, la fréquence des lithiases d'infection paraît très faible aujourd'hui [15] : en France, les calculs majoritaires en struvite observés en 2002 ne représentent plus que 1,3% des cas chez l'homme et 1,4% chez la femme. Cependant, pour juger de la contribution effective d'une infection urinaire au développement du calcul, il ne faut pas se contenter de considérer la struvite comme corps majoritaire, mais il faut aussi prendre en compte sa présence, même mineure, dans le calcul, ainsi que le taux de carbonatation des phosphates calciques et la teneur d'autres constituants particulièrement liés à l'infection comme le phosphate amorphe de calcium carbonaté (PACC) ou la whitlockite [16].
Sur cette base, en France, 3,5 % des calculs développés chez l'homme contiennent de la Struvite et 5 à 6 % peuvent être considérés comme liés à un processus infectieux. Chez la femme, La proportion des calculs contenant de la struvite est passée de 25% au début des années 80 à 12% en 2002 ; la proportion des calculs en tout ou partie liés à une infection chronique des voies urinaires ne représentant plus aujourd'hui que 16% contre 28% il y a 20 ans. En Algérie, une étude récente [2], réalisée au niveau de notre laboratoire a montré que la présence de struvite n’a pas diminué au cours des dernières années puisque sur une série de 1354 calculs urinaires, 28,8% de ces derniers contenaient cette espèce cristalline. Au Maroc par contre, d’après une étude réalisée en 2000 [17], la struvite était présente dans 15,3 % des calculs. Ce taux est beaucoup plus important en Afrique noire, où la struvite est présente dans 42,9% des calculs chez les femmes [18].
Pour préciser les relations entre infection et lithiase dans l'Ouest algérien, nous avons étudié une population de patients lithiasiques recrutée dans les services d'urologie de plusieurs hôpitaux de cette région. Pour ceci, les calculs de 313 patients hospitalisés ont été analysés par spectrophotométrie infrarouge. Parallèlement, 845 urines du réveil (soit 2,7/par patient), ont été analysées pour l'étude de la cristallurie et la recherche d'une infection.
I- Définition de la lithiase urinaire
D’une manière générale, la lithiase désigne la présence, dans un organe, des calculs. La lithiase urinaire est la maladie résultante de la présence de calculs dans les reins ou les voies urinaires.
Le calcul est une concrétion constituée par un agglomérât, ordonné ou non, de particules cristallines ou amorphes, précipités dans les urines, reliées et maintenues par une trame organique de nature essentiellement protéique. La constitution de la trame ou la matrice protéique, à l’édification du calcul est considérable dans la mesure où elle assure la cohésion des cristaux, favorise la structuration du calcul et empêche son délitement [19].
I-1 Symptômes
Les symptômes qui signalent l’existence d’un calcul peuvent être un saignement dans les urines (hématurie), une infection ou une obstruction.
Les calculs rénaux de petite taille ont tendance à migrer dans l’urètre, puis vers la vessie. Leur progression s’accompagne de colique néphrétique, violente douleur qui apparaît brutalement.
Si le calcul parvient à la vessie, il peut être éliminé au cours d’une miction, parfois sans que le sujet ne le décèle, et la douleur cesse. Si le calcul est trop gros pour passer, un traitement est nécessaire en urgence [19].
I-2 Lithogenèse
A l'état normal, les nombreux éléments cristallins présents dans l'urine sont maintenus dans un état soluble par la dilution des urines et également par la présence de substances inhibitrices de la cristallisation. Pour qu'une cristallisation se forme et se développe dans l'urine, il faut que l'urine se trouve dans un état de sursaturation; cet état de sursaturation dépend de différents facteurs: concentration ionique des constituants, pH, force ionique [8].
I-2-1 Principales étapes de la lithogenèse
Quatre étapes essentielles composent la formation du calcul.
* L'apparition d'une phase insoluble.
* L'augmentation de la taille des particules formées.
* La rétention des cristaux à un niveau quelconque des voies excrétrices nucléation.
* La croissance du calcul à partir du nucleus ainsi constitué.
2
I-3 Mécanisme de cristallisation dans l’urine
La formation de cristaux est le déterminant principal des processus lithogènes urinaires. Elle est la conséquence d’un déséquilibre entre promoteurs et inhibiteurs de la cristallisation. Les premiers sont présentés par toutes les substances susceptibles, isolément ou en association, de cristalliser dans les urines : calcium, oxalate phosphate, urate, carbonate, ammonium magnésium, sodium, potassium, cystine, dihydroxyadénine, xanthine…… les seconds sont des ions de faible poids moléculaire (citrate, pyrophosphate, magnésium, zinc….) ou des macromolécules polyanioniques appartenant à plusieurs familles chimiques, principalement les glycoaminoglycanes ( sulfates de chondroitine, héparine sulfate, kératane sulfate, dermatane sulfate ) et les proteines (néphrocalcine, proteine de TAMM-HORSFALL …..).
Les promoteurs peuvent cristalliser lorsque leur produit d’activité ionique urinaire excède leur produit de solubilité, ce qui est presque toujours le cas de l’oxalate de calcium dans les urines humaines. Pour les autres promoteurs, le degré de sursaturation est fortement dépendant du pH urinaire, ce qui implique généralement, lorsque ces espèces cristallisent, des anomalies de pH qu’elles soient induites par des troubles tubulaires, des déséquilibres nutritionnels, des pathologies digestives, des prises médicamenteuses ou des contextes infectieux [20].
I-4 Types chimiques de la lithiase
Il existe plusieurs variétés chimiques de calculs urinaires, qui relèvent de mécanismes différents et, par conséquent, impliquant des traitements adaptés. La forme la plus commune dans l’Ouest Algérien [2], est la lithiase calcique, où les calculs sont faits d’oxalate de calcium (67%) et de phosphate de calcium (16,3%). La seconde en fréquence est la lithiase urique, qui compte pour 8% des cas. La lithiase de phosphate ammoniacomagnésien (PAM), ou lithiase d’infection, compte aujourd’hui pour moins de 5% des cas. Les autres variétés de lithiase, souvent héréditaires comme la cystinurie, sont beaucoup plus rares.
Ces fréquences de répartition sont de même ordre de grandeur que celles observées en France [21] où les oxalates de calcium, les phosphates de calcium et les acides uriques sont identifiés comme constituants majoritaires dans 66%, 19,4%, et 10,1% respectivement.
Ce chapitre est consacré à l’étude de la cristallisation des phosphates calcique et ammoniaco- magnésienne. Ces deux types de lithiases représentent deux familles complexes dont l’étude est rendue difficile par la diversité des espèces cristallines qui les composent et par la relative facilité avec laquelle peuvent s’opérer des conversions cristallines assurant la transformation partielle ou totale in situ d’une espèce en une autre [22].
I-4-1 Lithiase phosphocalcique
Si l’oxalate de calcium est le constituant majoritaire des calculs calciques, il est rare qu’il en soit le constituant exclusif. En fait, dans la lithiase calcique, les calculs sont le plus souvent faits d’un mélange d’oxalate de calcium et de diverses formes de phosphates de calcium, principalement d’apatites. On peut considérer comme calculs phosphatiques ceux dont le phosphate de calcium constitue au moins 50 % du contenu minéral total, c’est-à-dire dont le rapport oxalate/phosphate est inférieur à 1 [23]. Les calculs phosphocalciques, c’est-à-dire les calculs dont le contenu est fait pour plus de 50 % de phosphate de calcium et non associés à une hyperparathyroïdie primaire ou une acidose tubulaire distale, constituent une fraction non négligeable des calculs observés chez les patients atteints de lithiase calcique commune. La lithiase phosphocalcique se distingue de la lithiase oxalo-calcique par une prédominance féminine tout à fait inhabituelle en matière de lithiase calcique [22].
I-5 Cristallisation des phosphates calciques et magnésiques
Les principaux phosphates purs ou mélangés qui rentrent dans la composition des calculs urinaires sont la carbapatite (carbonate-apatite), la PACC (phosphate amorphe de calcium carbonaté), la struvite (phosphate amoniaco-magnésien hexahydraté), la whitlockite (phosphate de calcium et de magnésium), la brushite (hydrogénophosphate de calcium dihydraté), l’O.C.P (phosphate octacalcique pentahydraté), l'hydroxyapatite (hydroxyphosphate de calcium cristallisé) et la newberyite (l’hydrogénophosphate de magnésium trihydraté). Individuellement ou mélangés, ils ont été observés comme des composants majeurs ou mineurs des calculs urinaires humains [5, 24,25].
I-5-1 Cristallisation des phosphates de calcium
Les phosphates calciques représentent une famille complexe. Leur étude est difficile à cause de la diversité des espèces cristallines qui la composent. La plupart des phosphates calciques sont sensibles à l'influence de l'environnement et notamment aux ions mono ou divalents de l'urine.
Chaque phosphate de calcium à son propre produit de solubilité qui est dépendant de sa concentration molaire, du pH, et plus précisément, de la concentration en calcium ionisé, de la concentration en ion PO43-et/ou HPO42- [12]. Le domaine de précipitation usuel des phosphates calciques dans l'urine se situe au-dessus de pH = 6. Mais certains phosphates, notamment
l'hydroxyapatite et la brushite, peuvent cristallisent à un pH inférieur à 6 lorsque la calciurie et le
4
produit phosphocalcique sont élevés. L'hydroxyapatite est moins soluble que les phosphates tricalciques et octocalcique, eux même moins solubles que la brushite.
Cette dernière étant moins soluble que les phosphates amorphes de calcium. Dans l'urine, comme en solution aqueuse, lorsque la sursaturation phosphocalcique est importante (pH supérieur à 6,5 avec un produit élevé), le phosphate amorphe de calcium est la première espèce formée [12]. Il évolue spontanément dans le temps vers la formation d'apatite ou de brushite. Lorsque le pH est inférieur à 6,5 et/ou la sursaturation faible, la brushite peut cristalliser d'emblée dans les urines [26]. Pour divers auteurs, elle est capable de se transformer, elle aussi, en apatite qui est la forme thermodynamiquement la plus stable, après conversion intermédiaire en phosphate octocalcique.
Selon Pak [27], cette transformation de la brushite semblant plus stable en pH modérément acide qu'en pH alcalin. Un autre facteur pourrait intervenir dans la conversion de la brushite, à savoir la baisse de la sursaturation phosphocalcique de la solution par diminution de la calciurie et de la phosphaturie [28]. A ces phénomènes de conversion s'ajoute celui de nucléation hétérogène d'un phosphate par un autre, rendue possible grâce aux variations de pH et de sursaturation.
Les phosphates amorphes de calcium carbonatés et les apatites carbonatées sont de loin les espèces les plus fréquentes parmi les phosphates de calcium identifiés dans la cristallurie spontanées et dans les calculs [12].
I-5-1-1 Cristallisation de la carbapatite
La carbonate-apatite ou carbapatite, encore appelée dahllite par les minéralogistes est extrêmement fréquente puisqu'elle est détectée par infrarouge dans près de 80 % des calculs [29, 30, 31]. Dans les calculs, on observe essentiellement des carbapatites mixtes de type A-B à taux de carbonate, selon le pH de l'urine et sa teneur en bicarbonates, compris entre 0,5 et 25 %, et dont la prise en considération peu orienter le clinicien vers des processus lithogènes
particuliers [20].
Comme notre étude fait appel à l'identification des phosphates de calcium par infrarouge, nous donnons pour chaque phosphate qui cristallise, les références spectroscopiques.
Les données spectroscopiques IRTF de carbapatite sont données dans le spectre 1 et le tableau 1.
Spectre 1 : spectre de référence de carbapatite.
Tableau 1: Principales fréquences de vibrations de carbapatite (spectre de référence 1).
Carbonate apatite (dahllite)
Formule Ca 10-x+y M x-y (PO4) 6-x (OH) 2+2y-x (CO3)x A x-2y , nH2O Nom minéralogique Dahllite
Abréviation CA
Pics caractéristiques (cm-1)
Pic à 1037 (TF) ; double pics à 603 (m) et 566 (m) et à 1459 (f) et 1419 (f)
Pics observés (cm-1)
3435 (f) ; 1640 (f) ; (1459 (f) et 1419 (f) ; 1037 (F) ; 961(f) ; 873 (f) ; (603 (m) et 566 (m))
Investigation dans l'identification du constituant
Valence asymétrique des PO43- à 1037 forte, asymétrique à gauche, épaulée à 1100 cm-1.
Bandes symétriques faible de PO43- à 961 cm-1.
Valence carbonate 1459 et 1419 cm-1. F : Forte ; TF : Trop Forte ; m : moyenne ; f : faible
I-5-1-2 Cristallisation de la brushite
La brushite cristallise dans le système monoclinique [32]. Sur le plan physicochimique, la brushite est un phosphate acide de calcium dihydraté (CaHPO4, 2H2O). Elle a tendance à se
6
former spontanément dans des urines relativement plus acides que les autres phosphates, même si elle peut les accompagner à des pH parfois élevés [33]. De ce fait, le pH moyen de formation de la brushite dans les urines fraîches est de 6,2 [12]. La brushite est, comme la weddellite, une espèce fortement calcium-dépendante [12]. Elle est rare à l'état pur et en tant que constituant majoritaire des calculs urinaires. Elle est fréquemment associée à l'apatite ou à l'oxalate de calcium dont elle peut constituer le noyau central ou une couche interne. Pak lui attribue un rôle important dans la nucléation de nombreux calculs oxalocalciques [34].
Les données spectroscopiques IRTF de la brushite sont données dans le spectre 2 et le tableau 2.
Spectre 2: spectre de référence de la brushite.
Tableau 2: Principales fréquences de vibrations de la brushite (spectre de référence 2).
Dicalcium phosphate dihytrate (brushite)
Formule CaHPO4, 2H2O
Nom minéralogique Brushite
Abréviation Br, BRU
Suite du tableau 2: Principales fréquences de vibrations de la brushite Pics caractéristiques
(cm-1)
triple pics à 1138 (TF), 1064 (TF), 987 (F) double pics à 3544 (F), 3492 (F)
Pics observés 3544 (F) ; 3492 (F) ; 3282 (m) ; 3166 (m) ; 1649 (m) ;
(cm-1) 1212 (m) ; 1138 (F) ; 1064 (F) ; 987 (F) ; 873(m) ; 575 (m) ; 527 (F)
Investigation dans l'identification du constituant
Valence des molécules H2O à 3544-3492 cm-1
Valence asymétrique des PO43- à 1138; 1064; 987 cm-1
Bandes secondaires des PO43- à 1649 (m) et 1212 cm-1
I-5-1-3 Cristallisation du phosphate amorphe de calcium carbonaté (PACC)
Le phosphate de calcium amorphe est un constituant friable. Il n'a pas une signification particulière chez les sujets sains. En revanche, chez les lithiasiques, c'est un indicateur d'un risque de récidive. Les phosphates amorphes s'observent à des valeurs de pH voisines de la neutralité ou franchement alcalines [35]. Le PACC se distingue de la carbapatite sur les spectres IRTF par l'absence d'une bande fine à 600 cm-1 [36].
Les données spectroscopiques IRTF du PACC sont données dans le spectre 3 et le tableau 3.
Spectre 3: spectre de référence du PACC.
Tableau 3: Principales fréquences de vibrations du PACC (spectre de référence 3).
Phosphate amorphe de calcium carbonaté (PACC)
Formule Ca w (PO4) x (OH) y (CO3)z , nH2O
Nom minéralogique -
Abréviation PACC
8
Pics caractéristiques (cm-1) Pic à 1068 (TF) pour PO43- et 1414 (f) pour CO32-
Pics observés (cm-1) 3399 (m) ; 1644 (m) ; 1414 (f) et 1068 (TF);
881 (f) et 561 (m).
Investigation dans l'identification du constituant
Bande phosphate, arrondi, forte, asymétrique et centré sur 1068 cm-1
Pas de bande à 600 cm-1
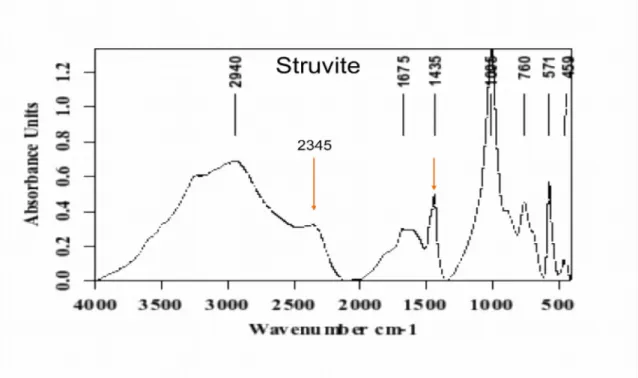
I-5-2 Cristallisation de la struvite
La struvite, ou phosphate-ammoniaco-magnésien hexahydraté (PAM), cristallise dans le système orthorhombique [37]. C'est une espèce minérale particulière puisqu'elle nécessite, contrairement aux oxalates et aux phosphates de calcium, un ensemble de conditions de cristallisation qui ne sont habituellement pas réunies dans l'urine normale, à savoir un pH urinaire et / ou un produit molaire (Mg) (NH4) (PO4) et / ou une concentration en ammoniaque élevée [12,37]. Les urines des sujets normaux sont généralement sous-saturées en struvite et que, dans la quasi-totalité des cas, la cristallisation de la struvite fait appel à des facteurs supplémentaires représentés par des microorganismes dotés d'un équipement enzymatique (désaminases ou uréases) capable de générer de l'ammoniaque à partir des acides aminés ou de l'urée de l'urine. En raison de son abondance, l'urée est la principale source d'ammoniaque. La cristallisation de la struvite est liée à l'action de l'uréase produite par des microorganismes. L'hydrolyse de l'urée urinaire sous l'action de l'uréase entraîne la libération de l'ammoniac NH3 et du gaz carbonique CO2. Il s'ensuit :
une alcalinisation des urines par les ions ammonium (pH des urines s'élevant constamment au-dessus de 7,5 et pouvant atteindre jusqu'à 10);
une précipitation de phosphate ammoniaco-magnésien, du fait de la production abondante d'ions NH4+et du pH élevé, en présence d'ions phosphate et magnésium qui sont généralement abondants dans les urines;
une augmentation de la concentration des urines en ions bicarbonates et carbonates formés à partir du CO2;
une précipitation de phosphates calciques fortement carbonatés, notamment de la carbapatite, du fait du pH alcalin et de la production d'ions carbonate, en présence d'ions phosphate et calcium.
Lorsque l'uraturie est élevée, l'augmentation de l'ammoniurie favorise la co-précipitation d'urate acide d'ammonium.
Ces mécanismes expliquent pourquoi l'association de struvite et de carbapatite est quasiment
constante dans les calculs [12]. Ils rendent également compte des relations cristallogénétiques entre la struvite et l'urate d'ammonium, ce dernier précipitant en urines alcalines d'origine infectieuse, comme en témoigne sa fréquente association au PAM dans les urines et les calculs [38,39].
Le spectre infrarouge 4 et le tableau 4 montrent les principales fréquences de vibration de la struvite.
Spectre 4: spectre de référence de la struvite.
Tableau 4: Principales fréquences de vibrations de la struvite (spectre de référence 4).
Phosphate ammoniaco-magnésien hexahydraté
Formule Mg NH4PO4, 6H2O
Nom minéralogique Struvite
Abréviation STR, PAM
Pics caractéristiques (cm-1) 1005 (TF) ; 2345 (m) (plateau) ; 1435 (m) Pics observés (cm-1)
10
2940 (m) ; 2345 (m) ; 1675 (f) ; 1435 (m) ; 1005 (TF) ; 760 (f) ; 571 (m) ; 459 (f) Investigation dans l'identification du constituant
Bande phosphate à 1005 cm-1, concave à gauche;
Déformation de l'ion ammonium à 1435 cm-1;
Plateau des molécules H2O + NH4+ à 2345 cm-1.
I-5-3Influence du pH
Le pH urinaire est un des premiers facteurs influençant la cristallisation in vivo. Certaines substances ont une solubilité qui varie peu aux pH habituellement rencontrés dans les urines (oxalates, 2,8 dihydroxyadénine ). D’autres, au contraire, sont dépendants du pH comme les phosphates, la cystine, l’acide urique. Le pH urinaire peut avoir un rôle non seulement dans la cristallogenèse, mais aussi dans le diagnostic et le traitement de la maladie lithiasique. Il modifie la cristallisation des substances dissoutes et l’efficacité des inhibiteurs ; les propriétés anticristallisantes des inhibiteurs sont influencées par le pH urinaire qui conditionne leur degré d’ionisation et par la concentration électrolytique de l’urine qui peut modifier aussi bien la conformation des macromolécules que les interactions entre inhibiteurs ou entre inhibiteurs et promoteurs. Le tableau 5 permettra de reconnaître sans difficulté l’identification des cristaux des phosphates selon leur domaine de pH de cristallisation.
Tableau 5 : Nature des cristaux des phosphates et leur domaine de pH de cristallisation [12]
Nature des cristaux Domaine de pH
Phosphate amorphe de calcium carbonaté 5,9-7,6
Carbapatite 5,9-9,0
Brushite 5,9-8,8
Phosphate octocalcique 5,5-8,8
Withlockite 5,9-9,0
Newberite 5,9-9,0
Struvite 6,7-9,0
I-6Lithiase d’infection
Lithiase et infection, ces deux pathologie peuvent évoluer indépendamment l’une de l’autre mais sont souvent induite ou entretenues l’une par l’autre. L’infection pouvant provoquer une croissance rapide de certains calculs et altérer gravement le parenchyme rénal.
En France, de 20 à 20,6 % des calculs sont associés à une infection urinaire, avec de grandes variations selon le sexe des patients [10]. En Algérie, d’après une étude réalisée au niveau de notre laboratoire, les calculs d’infection représentent 25,2 % [2].
Les lithiases rénales dites d’origine infectieuse, sont composées de calculs étant constitués majoritairement de phosphates ammoniaco magnésien (PO4 Mg NH4, 6H2O) ou de carbonate d’apatite (Ca10 PO4 CO3).
Elles ne représentent qu’un faible pourcentage de la lithiase des calculs rénaux, mais la morbidité et la mortalité qui leur sont attribuées restent élevées [10]. Elles sont dues à l’infection des urines par les bactéries qui synthétisent de l’urèase (figure 1).
L’ammonium est libéré par cette enzyme qui hydrolyse l’urée, favorisant une forte alcalinisation des urines. Le phosphate de calcium ou apatite cristallise en premier, progressivement, sur une matrice protéique, puis une phase de croissance plus rapide de dépôt du phosphate ammoniaco magnésien aboutit au calcul. A l’action de l’uréase se substitue pour certaines bactéries l’effet des désaminases qui libèrent de l’ammoniaque à partir des acides aminés urinaires.
Uréase CO32-
CO2 HCO3-
NH3 NH4+ Urée
12 H2N
CO
H2N
Carbapatite (Ca10 (PO4)6 CO3)
Ca++ PO43-
Struvite (Mg NH4 PO4)
Mg++ PO43-
PH > 8
Figure 1 : Mécanisme de l’action de l’uréase bactérienne.
L’incorporation de la bactérie dans le calcul rend ce dernier responsable de la majoration de l’infection et de sa résistance aux traitements antibiotiques conventionnels. Les calculs formés sont habituellement dénommés « coralliformes », ces derniers sont dominés par leur latence clinique et le risque important de fragments résiduels donc de récidive ou re-croissance, pouvant imposer des interventions multiples. Devant une lithiase infectieuse l’adaptation d’une antibiothérapie nécessite l’identification d’une bactérie responsable.
I-6-1Définition de l’infection urinaire
L’infection urinaire est un terme général qui comprend à la fois la colonisation microbienne asymptomatique de l’urine et l’infection symptomatique avec l’invasion microbienne et l’inflammation des structures de l’arbre urinaire.
Le processus infectieux peut atteindre le rein, le pelvis rénal, les uretères ainsi que la vessie.
De ce fait, la plupart des cliniciens posent le diagnostic d’infection urinaire lorsque le nombre de germes présents dans l’urine génère plus de 105 CFU/ml (Colony Forming Unit). Des bactériuries de 104 CFU/ml, voir de 103 CFU/ml, doivent être considérées comme significatives pour des germes particuliers, proteus ou pseudomonas [40].
Les infections urinaires peuvent concerner le contenant (l’appareil urinaire) et le contenu (l’urine) elles regroupent aussi bien :
1. Les infections urinaires hautes (parenchymateuses).
2. Les infections urinaires basses (cystites, prostatites).
I-6-2Diagnostic de la lithiase d’infection
Le diagnostic de la lithiase d’infection repose sur les deux critères suivants [41,42]:
1. La présence d’une cristallurie faite de cristaux de struvite (ammoniaco-magnésien) typiquement rhomboédriques, associés à des cristaux de carbapatite en proportion variable avec un pH unitaire supérieure à 7,0.
2. La mise en évidence d’une bactériurie à germe uréolytique habituellement, un proteus, sachant qu’une bactériurie inférieure à 105germes par millilitre est ici significative et qu’il peut exister une co- infection par un autre germe prédominant en nombre.
I-6-3 Relation entre identité des microorganismes et identité des cristaux
Dans les urines stériles, les quatre espèces cristallines les plus fréquentes sont des espèces d’origine métabolique: la wedellite et la wewellite, la carbapatite et le phosphate amorphe de calcium carbonaté. Les mêmes espèces sont retrouvées lors des infections à colibacilles. Ce germe n’a donc pas d’influence sur la nature des phases cristallines formées.
Dans certains cas, le colibacille exerce un effet spécifique sur la cristallisation par le biais de la béta-glucuronidase dont beaucoup de ses souches sont dotées.
La présence exclusive ou prépondérantes de struvite et de carbapatite dans des urines infectées par Pseudomonas Aerugenosa ou à Klebsiella Pneumoniae montre clairement, étant donné le caractère pH dépendant de ces espèces cristallines, que se sont les souches porteuses d’uréase qui, chez ces microorganismes génèrent la cristallurie [12]. Il en est de même pour les genres de Providencia et Proteus qui ont une forte aptitude à alcaliniser les urines avec corrélativement une tendance marquée à la cristallisation de la struvite, carbapatite et urate d’ammonium.
A notre connaissance, en Algérie, aucune étude n’a été faite sur la lithiase d’infection. Pour cela, nous avons essayé de préciser et d’évaluer la situation actuelle de cette pathologie et de déterminer les relations entre infection et la lithiase urinaire. Cette étude a été réalisée sur des lithiasiques recrutés dans les services d’urologie de la région Ouest algérienne.
I-7 Matériels et méthodes I-7-1 Les calculs
Les calculs de 313 patients (201 hommes et 112 femmes), extraits par voie chirurgicale ou endoscopique dans les services d'urologie des centres hospitaliers universitaires d'Oran, de Sidi-Bel- Abbes, de Tissemssilt et de Mostaganem ont été analysés par spectrophotométrie infrarouge.
I-7-2 Les urines
Au moins deux, et souvent trois urines du réveil ont été collectées pour chaque patient aux fins d'étude de la cristallurie, soit 845 prélèvements analysés (2,7 urines/malade). L'un des prélèvements a été utilisé pour un examen cytobactériologique (ECBU). En cas de résultat
14
douteux ou ininterprétable, cet examen a été répété sur le second prélèvement.
I-7-3 Examen cytobactériologique des urines
Les cristaux de struvite, qui sont responsables de la lithiase d’infection, se forment en urine alcaline, indiquant une infection des voies urinaires par des microorganismes uréasiques. Ils justifient la réalisation d’un ECBU (étude cytobactériologique des urines) pour identifier le germe responsable et déterminer sa sensibilité aux antibiotiques. Le recours au laboratoire est nécessaire pour confirmer l’infection, préciser la bactérie responsable, guider l’antibiothérapie et suivre l’effet du traitement.
L’ECBU se fait par une technique correcte et qui se base sur [43]:
L’étude cytologique qui permet d’apprécier la présence des cylindres, cristaux, leucocyterie, hématurie et aussi bien les germes.
L’étude bactériologique c’est l’affirmation de l’étude cytologique par la mise en culture (uroculture) accompagnée de la numération de ces germes cette étape est indispensable au diagnostic.
L’étude qualitative par l’identification des germes après la coloration de gram.
L’étude de la sensibilité aux antibiotiques (antibiogramme).
I-7-3-1 Cytologie des urines
Cristallurie :
La cristallurie témoigne de la sursaturation des urines en une ou plusieurs substances éliminées par le rein. Elle peut être un indicateur très utile des facteurs lithogène ou des causes de la pathologie observée.
Il est possible par exemple, de dépister certaines maladies génétiques, par l’identification des cristaux urinaires, avant même qu’une symptomatologie rénale ne soit déclarée.
Chez un malade lithiasique connu, la surveillance de la cristallurie dans certaines conditions, apparaît comme un excellent indicateur de l’efficacité du traitement médical ou au contraire comme un marqueur pronostique du risque de récidive lithiasique [44].
Choix de prélèvement :
C’est une étape essentielle de la cristallurie. L’urine ne peut être conservée trop longtemps, compte du caractère instable de l’urine, car elle conduit à cristalliser spontanément à température ambiante in vitro. En pratique on préconise d’étudier la cristallurie sur les urines du réveil du matin, car elles couvrent une période relativement longue de sursaturation liée à
la restriction hydrique et reflètent non seulement les effets du dernier repas mais aussi le métabolisme propre du sujet, plus particulièrement dans la période de jeune de la seconde partie de la nuit.
Conservation du prélèvement :
L’urine doit être transmise le plus possible au laboratoire après l’émission pour éviter les risques de cristallisation secondaires in vitro. L’idéal est de conserver à 37°C, jusqu’au moment de l’analyse, ce qui est difficilement réalisable en pratique. En pratique courante, il est conseillé de conserver l’urine au froid à 4°C pendant 24 h, ce qui a pour effet d’accroître la sursaturation urinaire et de faciliter la cristallisation.
Protocole d’étude d’une cristallurie :
L’examen doit être réalisé dés la réception du prélèvement au laboratoire. Il doit systématiquement comporter une mesure précise du pH urinaire, à 0,1 unité prés. La mesure de la densité urinaire est également une détermination utile qui renseigne sur le degré de dilution des urines et sur les apports hydriques. Un prélèvement rapidement effectué à l’aide d’une pipette de pasteur (prolongée prés du fond du tube) est placé en cellule de malassez pour l’observation microscopique.
L’étude de la cristallurie comporte une identification qualitative de toutes les espèces cristallines, une numération des cristaux par espèce identifiée. Une évaluation des tailles moyennes et maximales est demandée pour chaque espèce. Les résultats sont exprimés en nombres de cristaux par mm3. Une recherche attentive des espèces cristallines numériquement faibles doit être faite car certaines espèces sont plus importantes par leur présence que par leur nombre. Enfin il est utile d’énumérer séparément les agrégats et d’en déterminer les tailles moyennes et maximales [45-47].
I-7-3-2 Examen bactériologique
La deuxième étape de la cytologie des urines est l’examen bactériologique. Il se fait en deux étapes : un examen microscopique et une identification biochimique des germes isolés. Les urines des 313 malades ont fait l’objet d’une uroculture. Le but est d’identifier les germes responsables de l’infection.
I-7-3-2 -1 Examen microscopique et culture
La forme des colonies dépend de plusieurs facteurs intrinsèques à la bactérie (mobilité, morphologie, production de capsule, présence de fimbriae…) et extrinsèques comme la présence des colorants dans le milieu de culture. On distingue les colonies d’après leurs
16
tailles, leurs formes, l’aspect des colonies en se référant au tableau 6.
Tableau 6
:
Caractères morphologiques et culturaux des bactéries responsables de la lithiase d’infection [43].Bactéries isolées Caractères microscopiques Gram Caractères culturaux
Escherichia. Coli Bacilles isolés ou en amas Négatif Sur Drigalski, colonies jaunes, plates, à bord irrégulier.
Klebsiella Pneumoniae Bacilles isolés, en paires ou
en chaînettes Négatif
Sur Drigalski, colonies jaunes,
volumineuses épaisses muqueuses, mielleuses.
Enterobacter Sp. Bacilles courts, isolés ou en
amas Négatif Sur BGA colonies opaques, à bords
réguliers.
Proteus Mirabilis Coccobacilles en courtes
chaînes Négatif Sur BGA colonies arrondies, à bords réguliers, transparentes.
Staphylococcus Aureus Cocci en chaînettes, courtes,
groupées en grappe de raisin Positif Colonies jaunes, dorées, sur milieu Chapman.
BGA (milieu de culture) : brillant Gélose Agar
.
I-7-3-2-2 Identification biochimique
L’identification des bactéries repose en grande partie sur ses caractères biochimiques dont la mise en évidence constitue l’essentiel de la galerie d’identification, soit par la méthode classique soit par la galerie Api 20 E pour les entérobactéries. Ces caractères sont la traduction du métabolisme bactérien.
La première étape de cette étude consiste à réaliser à partir d’une colonie bien isolée, une suspension bactérienne dans 10 ml de l’eau physiologique [43]. L’identification se fait pour les bactéries Gram négatifs et positifs.
I-7-4 Les bactéries à Gram négatif I-7-4-1 Etude du métabolisme glucidique
Milieu Mévag : milieu d’étude de la voie d’attaque des glucides:
Ce milieu met en évidence le type d’attaque du glucose (oxydatif ou fermentatif) :
Après avoir régénérer deux tubes de ce milieu afin de chasser les bulles d’air, on ensemence quelques gouttes de la suspension bactériennes à l’aide d’une piqûre centrale. L’un des tubes est recouvert d’une couche de 1 cm de paraffine stérile pour créer des conditions anaérobies,
on incube à 37° C pendant 24 h. Les bactéries fermentatives produisent une acidification seulement en aérobiose, le tube qui est non découvert devient jaune [48].
Milieu TSI (Triple Sugar Ion) :Ce test en milieu permet la mise en évidence de la fermentation des sucres avec ou sans production de gaz et la formation de l’hydrogène sulfure (H2S).
On ensemence une suspension bactérienne sur la pente des stries et dans le culot par une piqûre centrale, on incube le tube à moitié fermé à 37° pendant 24h. La dégradation du glucose se fait au niveau du culot et celle du lactose et saccharose au niveau de la pente.
Le virage au jaune du milieu indique l’acidification du milieu. La présence des bulles révèle un dégagement gazeux. Le noircissement total ou partiel du culot indique un dégagement d’hydrogène sulfureux (H2S).
milieu Clarck et Lubs :Ce test permet la mise en évidence l’assimilation du glucose par la bactérie qui peut utiliser deux voies :
Lors de l’assimilation du glucose on a les deux voies suivantes :
Les Voies des acides mixtes qui conduit à la formation d’acide lactique, d’acide succinique, d’acide formique et l’éthanol; elle est mise en évidence par le test rouge de méthyle RM c’est une réaction acido basique.
La deuxième voie est la voie de l’acetoine, elle est mise en évidence par le test Vogues proskawer (Vp).
On ensemence quelques gouttes d’une suspension bactérienne sur le milieu Clarck et Lubs.
Apres incubation à 37°C pendant 24h, on partage le contenu de ce tube dans deux autres tubes, dans l’un on ajoute le rouge de méthyle, dans l’autre le Vp1 alpha naphtol, Vp2 soude.
Dans le premier tube s’il y a virage au jaune, la réaction est RM+, dans le deuxième tube s’il y’a un halo rouge, la réaction est Vp+, il faut savoir que toutes les entérobactéries sont RM+
sauf les genres klebsiella, enterobacter qui sont VP+ [48,49].
18 Voie de l’acétoine ou
Acétyle Méthyle
Carbinol (AMC) Pyruvate
Glucose
Voies des acides mixtes
Mannitol- mobilité :Cet examen permet la mise en évidence de la fermentation du mannitol avec la production d’acide, la diminution du pH et la mobilité du germe.
On ensemence une suspension bactérienne dans le milieu par piqûre centrale à l’aide d’une anse à fil droit stérile puis on incube à 37°C pendant 24h. La diffusion des bactéries à partir de la ligne d’ensemencement indique la mobilité de la bactérie.
L’acidification du milieu indiqué par le virage de l’inducteur coloré rouge de phénol au jaune est due à l’assimilation du mannitol par la bactérie [50].
Milieu citrate de simmons :Cet examen indique si la bactérie utilise le citrate comme source de carbone (1er composé formé dans le cycle de Krebs). On ensemence une suspension bactérienne par des stries sur la pente du milieu, puis on incube à 37°C pendant 24h. Le virage au bleu de l’indicateur coloré le vert de bromothymol indique la positivité de la réaction [51].
I-7-4-2 Etudes des caractères enzymatiques
La recherche des enzymes (uréase et tryptophane désaminase et bêta galactosidase) avec les testes précédent permet de classer les espèces bactériennes selon leur présence ou leur absence [48,49].
Réduction des nitrates :Ce test permet la mise en évidence de la réduction des nitrates en nitrites par la nitrate réductase (NR) selon la réaction suivante [52] :
Nitrate réductase Nitrite réductase
NO -3 (nitrate) NO -2 (nitrite) N2 ( diazote)
Le bouillon nitraté est ensemencé avec la suspension bactérienne puis incubé à 37°C pendant 24h. Si après l’ajout de 4 à 5 gouttes d’acide sulfanilique et naphtyl-amine, le milieu vire au rouge, ceci indique la présence de nitrites dans le milieu, donc la bactérie possède la nitrate réductase (NR+). Dans le cas d’une réaction négative; on ajoute une pincée de zinc, l’apparition instantanée d’une coloration rouge dans le tube est témoin de la présence de
nitrate dans le milieu, donc la bactérie ne possède pas de nitrate réductase (NR-).
Recherche de l’uréase et du tryptophane désaminase (TDA) :Ce test permet la dégradation de l’urée, du tryptophane et finalement sa transformation.
Uréase
Urée CO2 + NH3
H2O
Tryptophane indole + pyruvate + NH3
Tryptophane TDA acide indol-pyruvique
La suspension bactérienne est ensemencée sur le milieu urée indole à l’aide d’une pipette pasteur stérile, ensuite le tube est incubé à 37° C pendant 24h. L’apparition de la couleur rouge traduit l’alcalinisation du milieu donc une uréase positive. Après l’addition de quelques gouttes de réactif d’Erlich-Kovacs, l’apparition d’un anneau rouge à la partie supérieur indique la présence d’indole.
La présence du tryptophane désaminase révélée par la couleur rouge brun obtenue à la suite de l’addition de 1 à 2 gouttes de perchlorure de fer [50].
La recherche de bêta – galactosidase (test à l’ONPG ) :C’est un test de grande utilité diagnostique qui est effectué dans le cas où la bactérie serait lactose négatif
galactosidase
Ortho-Nitro-Phényl-Galatopyranoside(ONPG) galactose + ortho-nitrophénol
Dans un tube à essai contenant 0,25 ml de suspension bactérienne, on dépose un disque ONPG. On incube à 37° C pendant 24h. L’apparition de la couleur jaune indique la positivité de la réaction : la présence de bêta galactosidase [49].
I-7-4-3 Etude du métabolisme des acides aminés
20
Certaines bactéries possèdent des enzymes qui sont capables de scinder les acides aminés, en amines qui provoquent l’alcalinisation du milieu avec production de gaz carbonique.
LDC
Lysine cadaverine ODC
Ornithine putrescine ADH
Arginine agmatine
La recherche de certains enzymes tels que LDC (lysine décarboxylase), ODC (ornithine décarboxylase) et ADH (l’arginine hydrolase), permet de spécifier certains genres bactériens.
On ensemence quelques gouttes d’une suspension bactérienne à l’aide d’une pipette pasteur dans 3 tubes contenant milieu Moeller avec l’acide aminé à étudier. Dans un tube témoin ne contenant pas les acides aminés, on recouvre chaque tube avec l’huile de vaseline stérile, on incube à 37° C pendant 24h. Pour le tube témoin la couleur sera jaune à cause de la dégradation du glucose (réaction en aérobiose). Pour les trois autres tubes, si la réaction est positive la présence d’amine entraîne l’alcalinisation du milieu ceci est indiqué par le virage du jaune au violet de l’indicateur de pH (pourpre de bromocrésole), réaction en anaérobiose [48, 49].
Mettre les boites fermées dans l’étuve à 37° C pendant 24h.
I-7-5 Les bactéries à Gram positif
Les tests qui correspondent aux bactéries gram positif sont :
Teste de catalase :Ce test permet de différencier les cocci à gram positif en deux grandes familles micrococcaceae (Staphylocoque) où la catalase est présente et les streptococcaceae (streptocoque) où la catalase est absente [49,50].
Catalase
2H2O2 2H2O + O2
On prélève une colonie bactérienne et on la dépose sur une lame propre, ensuite on ajoute quelques gouttes d’eau oxygénée à 10 volumes.
Un dégagement des bulles d’air traduit la présence d’une catalase.
Culture sur milieu Chapman pour les staphylocoques :
On ensemence un ose de culture prélevée à partir d’une colonie bactérienne par des stries longitudinales sur la surface de la gélose inclinée. On incube à 37 ° C pendant 24h.
Le développement de bactéries indique que c’est un staphylocoque : le virage au jaune de l’indicateur de pH (rouge de phénol) indique la dégradation du mannitol.
Cette attaque permet de nous orienter vers staphylococcus aureus [52].
I-7-6 Antibiogramme
C’est la détermination de la sensibilité des germes aux antibiotiques. Il permet l’élaboration d’une thérapeutique anti-infectieuse pour chaque espèce bactérienne donnée.
I-7-6-1 Mode opératoire
Milieu de référence Muller Hinton coulé dans des boites de Petrie. Inonder la boite entière avec 2 à 4 ml de la suspension bactérienne à l’aide d’une pipette de pasteur, puis enlever l’excès du liquide, Sécher les boites 15mn à température ambiante, appliquer les disques à l’aide d’un distributeur ou à la pince en appuyant légèrement. Mettre à l’étuve 24h à 37°c.
I-7-6-2 Lecture des résultats
Si l’antibiotique est inhibiteur, un halo sans culture se forme autour du disque ; c’est la zone d’inhibition dont le diamètre est mesuré à l’aide d’un pied à coulis.
Les résultats comportent pour chaque antibiotique le diamètre de la zone d’inhibition et interprétation qualitative correspondante :
souche sensible
souche résistante
Souche intermédiaire I-8 Résultats
I-8-1 Les calculs
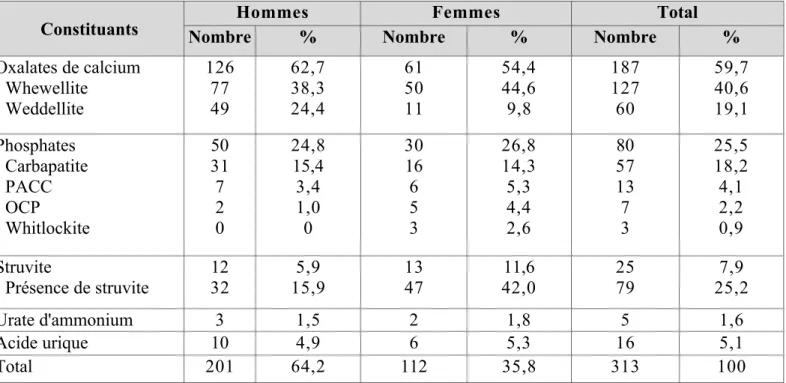
Les résultats de l'analyse infrarouge des calculs sont résumés dans le tableau 7. Il ressort que 59,7% des calculs étaient formés majoritairement d'oxalate de calcium.
D'après Leur structure et leur nature cristalline et selon les corrélations établies par ailleurs [53, 54], 40,6% de ces calculs étaient majoritaires en whewelite, avaient une structure oxalo-dépendante et pouvaient être rattachés à une hyperoxalurie de débit ou de concentration; 19,1% étaient majoritaires en weddeltite, avaient une structure calcium-dépendante et pouvaient être reliés à une hypercalciurie. Sur 313 calculs, 25,5% étaient majoritaires en phosphate de calcium et 7,9%
majoritaires en struvite (5,9% chez l'homme, 11,6% chez la femme).
22
Enfin, l'acide urique était le composant principal dans 5,1% et l'urate d'ammonium dans 1,6% des cas.
L'implication de l'infection dans le développement d'une lithiase urinaire est également plus importante chez la femme que chez l'homme.
Dans notre série, 54 calculs provenant de 20 hommes et 34 femmes correspondaient à cette situation, si bien que, sur les 313 calculs analysés, la struvite était présente dans 79 cas, soit 25,2% (15,9% chez L'homme, 42% chez la femme).
Tableau 7 : Fréquence des constituants majoritaires des calculs urinaires.
Constituants Hommes Femmes Total
Nombre % Nombre % Nombre %
Oxalates de calcium - Whewellite
- Weddellite
126 77 49
62,7 38,3 24,4
61 50 11
54,4 44,6 9,8
187 127 60
59,7 40,6 19,1 Phosphates
- Carbapatite - PACC - OCP - Whitlockite
50 31 7 2 0
24,8 15,4 3,4 1,0 0
30 16 6 5 3
26,8 14,3 5,3 4,4 2,6
80 57 13 7 3
25,5 18,2 4,1 2,2 0,9 Struvite
- Présence de struvite
12 32
5,9 15,9
13 47
11,6 42,0
25 79
7,9 25,2
Urate d'ammonium 3 1,5 2 1,8 5 1,6
Acide urique 10 4,9 6 5,3 16 5,1
Total 201 64,2 112 35,8 313 100
I-8-2 Les urines
Sur les 845 échantillons urinaires analysés, 474 (55,1%) contenaient des cristaux à l'examen direct : 165 urines, provenant de 61 patients (19,5%), dont 19 hommes et 42 femmes, contenaient des cristaux de struvite, tous associés à une infection urinaire. L'étude cytobactériologique a montré que sur les 313 malades lithiasiques, 95 (soit 30,3%) avaient une infection urinaire, jugée sur la leucocyturie, les résultats de l'examen direct et l'identi- fication des germes. Ceux-ci n'ont pu être cultivés et identifiés que chez 84 patients, les onze autres ayant été mis sous antibiothérapie avant la réalisation des prélèvements. Sept espèces bactériennes ont été identifiées : Proteus mirabilis, Proteus vulgaris, Escherichia coli, Klebsiella pneumoniae, Enterobacter sp, Pseudomonas aeruginosa, Staphylococcus
epidermidis. La nature des germes identifiés et leur fréquence selon le sexe des patients sont données dans le tableau 8.
Tableau 8 : Fréquence des agents uropathogènes en fonction du sexe des patients.
Type de germes Fréquence Fréquence Femmes (%) Hommes (%)
Proteus mirabilis 14 25,0 8 28,6
Proteus vulgaris 13 23,2 5 17,8
Escherichia coli 15 26,8 10 35,7
Klebsiella pneumoniae 8 14,3 2 7,1
Staphylococcus epidermidis 3 5,3 2 7,1
Enterobacter Sp 1 1,8 1 3,5
Pseudomonas aeruginosa 2 3,6 0 0
Total 56 100 28 100
Les résultats des études bactériologiques ont montré que les entérobactéries représentaient de loin le groupe le plus important : 94,7 %. L'espèce bactérienne la plus fréquemment retrouvée était Escherichia coli avec 29,8 %, mais le genre le plus communément identifié dans les urines des patients lithiasiques était le genre Proteus (46,4%). Aucune différence significative dans la répartition des germes n'a été observée en fonction du sexe des patients.
I-8-3 Relations entre calculs et infection urinaire
Bien que la struvite soit considérée comme un marqueur relativement spécifique, en pratique clinique quotidienne, des infections à germes uréasiques, seulement 73,9% des patients dont le calcul était majoritaire en struvite avaient un ECBU positif au moment de l'examen des urines, suggérant que l'infection avait été traitée antérieurement.
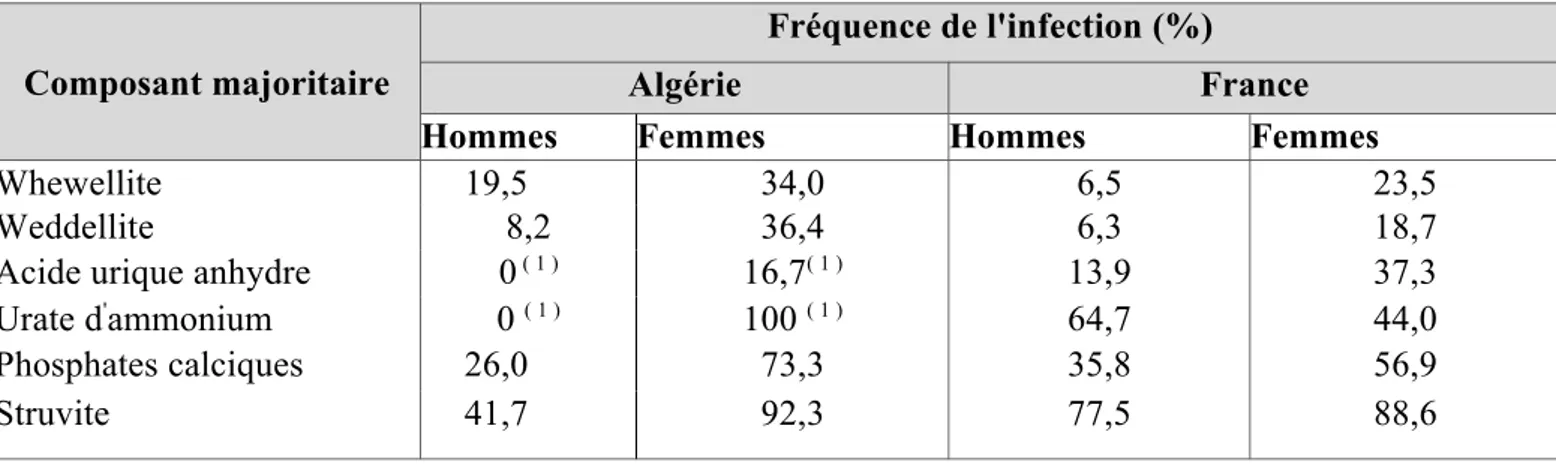
Comme le montre le tableau 9 , la fréquence de l'infection urinaire est très variable en fonction de la nature du calcul, comprise entre 6,3% pour l'acide urique et 73,9% pour la struvite. Cette variabilité est également observée en France.
La comparaison des résultats fait ressortir quelques différences, en particulier :
une proportion plus élevée, en Algérie, de calculs de whewellite et de weddellite associés
24
à une infection urinaire.
une proportion plus faible des calculs algériens d'acide urique ou d'urate d'ammonium associés à une infection, ce qui pourrait s'expliquer, partiellement du moins, par les effectifs relativement faibles de ces calculs (n=16 et n=5 respectivement).
Des différences importantes peuvent être observées selon le sexe des patients.
Tableau 9 : Fréquence de l'infection en fonction du constituant majoritaire des calculs.
Composant Fréquence de
majoritaire l'infection (%)
Algérie France
Whewellite 25,2 11,4
Weddellite 16,3 8,7
Acide urique anhydre 6,3 19,6
Urate d'ammonium 40,0 52,4
Phosphates calciques 45,0 48,9
Struvite 73,9 83,1
En effet, comme le montre clairement le tableau 10, la proportion de calculs associés à une infection urinaire est plus élevée chez la femme que chez l'homme pour toutes les espèces cristallines et cela en Algérie comme en France. La seule exception est la lithiase d'urate d'ammonium pour laquelle la proportion d'infections est plus faible chez la femme que chez l'homme en France, la raison tenant essentiellement au fait qu'une partie des calculs d'urate d'ammonium est liée à des pertes de bases et d'électrolytes par voie digestive chez des patientes abusant de laxatifs, cette étiologie étant rare en Algérie.
Tableau 10 : Fréquence de l'infection en fonction du constituant majoritaire des calculs et du sexe des patients.
Composant majoritaire
Fréquence de l'infection (%)
Algérie France
Hommes ( F e m m e s
Femmes Hommes Femmes
Whewellite 19,5 34,0 6,5 23,5
Weddellite 8,2 36,4 6,3 18,7
Acide urique anhydre 0( 1 ) 16,7( 1 ) 13,9 37,3
Urate d'ammonium 0 ( 1 ) 100 ( 1 ) 64,7 44,0
Phosphates calciques 26,0 73,3 35,8 56,9
Struvite 41,7 92,3 77,5 88,6
( 1 ) données non significatives (effectifs ≤ 10)
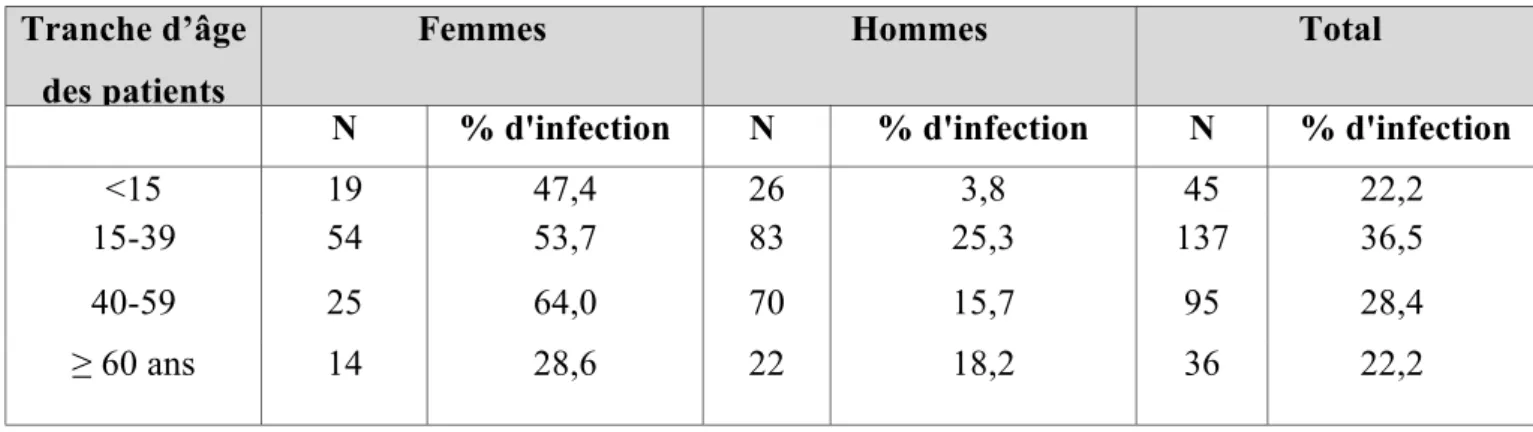
I-8-4 Relations entre l'infection, le sexe et l'âge des malades
Sur les 84 patients pour lesquels le germe urinaire a pu être identifié, 56 étaient de sexe féminin et 28 de sexe masculin, soit un rapport femmes/hommes égal à 2, corroborant le fait que la femme est plus exposée que l'homme au développement d'une lithiase d'infection [55]. Cependant, l'analyse des données en fonction de l'âge des patients (tableau 11) montre que les hommes les plus exposés à l'infection ont entre 15 et 39 ans alors que le risque infectieux est maximum pour les femmes entre 40 et 59 ans. Les sujets lithiasiques de plus de 60 ans semblent plutôt moins exposés à l'infection que les sujets plus jeunes (18,2% des hommes et 28,6% des femmes). En France, au contraire, si l'on excepte les enfants en bas âge, le risque infectieux croit avec l'âge chez L'homme comme chez la femme : environ 8%
des hommes et 33% des femmes Lithiasiques sont infectés entre 15 et 59 ans, la proportion s'élevant à 23% et 44% respectivement après 60 ans.
Tableau 11 : Fréquence de l'infection selon l'âge des patients.
Tranche d’âge des patients
Femmes Hommes Total
N % d'infection N % d'infection N % d'infection
<15 19 47,4 26 3,8 45 22,2
15-39 54 53,7 83 25,3 137 36,5
40-59 25 64,0 70 15,7 95 28,4
≥ 60 ans 14 28,6 22 18,2 36 22,2
I-8-5 Résultats de l'antibiogramme
Nous avons testé des antibiotiques reconnus comme ayant un large spectre contre les bactéries gram positif ou gram négatif. Les résultats de l'antibiogramme selon le diamètre des zones d'inhibition sont résumés dans le tableau 12 pour les trois principaux germes identifiés.
Les résultats montrent que la majorité des germes isolés est sensible à la gentamicine, l'amikacine et/ou la céfatoxime. A l'inverse, la majorité résiste à la colistine, aux aminopénicillines et aux furanes. Tous résistent à l'ofloxacine.
Tableau 12 : Pourcentage de sensibilité aux antibiotiques des différentes souches bactériennes isolées des urines des patients lithiasiques.
26
Germes
Antibiotiques
AM AMP CEF GEN AMK CTR COL OFL CEX
1
FUR E. coli
Proteus sp K. pneumon.
0%
0%
0%
0%
50%
0%
56%
90%
0%
84%
72%
100%
72%
50%
100%
52%
77%
0%
60%
0%
0%
0%
0%
0%
68%
68,2%
70%
48%
0%
0%
Antibiotiques : AM : amoxicilline ; AMP : ampicilline ; CEF : céfazoline ; GEN : gentamicine ; AMK : amikacine ; CTR : cotrimoxazole ; COL : colistine ; OFL : ofloxacine ; CEX : cefotaxime ; FUR : furane
Germes : E.coli : Escherichia coli ; Proteus sp :Proteus vulgaris et Proteus mirabilis ; K.
pneumon : Klebsiella pneumoniae
I-8-6 Corrélation entre résultats de l'ECBU, la cristallurie et le calcul
L'infection urinaire a été considérée comme présente lorsqu'un nombre élevé de leucocytes±
altérés (plus de 5 leucocytes / champ) était observé lors de l'examen des urines en microscopie optique. Les relations entre microorganismes, nature des espèces cristallines précipitées et pH urinaire sont regroupées dans le tableau 13.
Les résultats montrent que la cristallurie contient toujours de la struvite lorsque l'espèce bactérienne possède une uréase active. Dans les autres cas, on observe, lorsqu'elle est positive, une cristallurie métabolique composée de weddellite et de phosphate calciques ou d'urates amorphes complexes.
Tableau 13 : Corrélation entre cristaux, germes et pH des urines.
Germes Nombre
de malades Cristaux associés pH moyen
de précipitation
Proteus sp. 40 struvite + PACC/CA 8,5
Escherichia coli 25 weddellite + PACC/CA 7,0
Klebsiella pneumoniae 10 struvite + Weddellite 7,8
Staphylococcus epidermidis 5 struvite + PACC + weddetlite 8,3
Pseudomonas aeruginosa 2 struvite + PACC/CA 7,8
Enterobacter sp. 2 weddeltite + urates
amorphes complexes 6,0
PACC/CA - phosphate amorphe de calcium carbonaté et/ou carbapatite
Chez 27 patients (17 femmes et10 hommes) ayant une infection urinaire à l'ECBU, le calcul ne contenait pas de marqueurs de cette infection, suggérant que son origine était exclusivement métabolique et que l'infection n'avait pas de potentialités lithogènes ou qu'elle était de déclaration récente et n'avait pas contribué au processus lithiasique.
A l'inverse, parmi les patients ayant des marqueurs de l'infection dans le calcul (présence de struvite, taux de carbonatation élevé de La carbapatite, teneur élevée en PACC ou en Whitlockite...), 54 (30 femmes et 24 hommes) avaient un ECBU stérile, témoignant que le processus infectieux initiateur du calcul ou impliqué dans sa croissance avait été traité antérieurement et avait disparu.
Ces données soulignent l'importance de l'analyse du calcul pour confirmer ou infirmer le lien potentiel entre le processus lithiasique et la présence concomitante d'une infection de l'appareil urinaire.
I-9 Discussion
Dans les pays industrialisés, l'infection urinaire touche 1 à 2 % des nouveau-nés et 4 fois plus souvent le garçon que la fille [56, 57]. Passé l'âge de 3 - 4 ans, l'enfant, puis l'adulte de sexe masculin jusqu'à 60 ans est peu exposé au risque d'infection urinaire. Ce n'est qu'au- delà de 65 ans qu'on observe une augmentation significative de l'infection qui touche alors 10 % des hommes de 65 à 85 ans et jusqu'à 15% des hommes de plus de 85 ans [56-58]. A l'inverse, on note une augmentation de la fréquence des infections urinaires avec l'âge dans la population féminine : 0,5 % chez le nouveau-né, 1,5 % chez le jeune enfant, 10% chez les femmes de 30 à 65 ans, 15% chez celles de 65 à 85 ans et plus de 25 % au-delà de 85 ans [56, 59-61].
Une étude hollandaise récente suggère même qu'une femme sur deux présente au moins un épisode d'infection urinaire au cours de sa vie [61]. De telles études ne sont pas disponibles en Algérie, mais si l'on considère la proportion élevée de lithiasiques infectés, on peut en déduire que l'infection urinaire y est plus fréquente que dans les pays industrialisés et qu'elle affecte, comme dans ces pays, plus souvent les femmes que les hommes. En revanche, parmi les lithiasiques, contrairement à ce que l'on observe en France, la proportion de sujets infectés est plus élevée chez les hommes de moins de 40 ans et chez les femmes de moins de 60 ans.
De même que la prévalence de l'infection est plus élevée chez la femme que chez l'homme, de même, la littérature montre clairement que la proportion de lithiases associées à une
28
infection urinaire est beaucoup plus élevée chez la femme que chez l'homme, quelle que soit la composition des calculs [14, 62].
L'implication de l'infection dans le développement d'une lithiase urinaire est également plus importante chez la femme que chez l'homme [63]. Dans notre étude, environ la moitié des calculs chez la femme et un calcul sur cinq chez l'homme se sont formés ou ont grossi sous l'effet d'un processus infectieux. Compte tenu de la prépondérance de la lithiase masculine, nos résultats sont globalement comparables à ceux rapportés i l y a une quinzaine d'années par Holmgren et coll. [14] et par Daudon [62] qui avaient trouvé un taux d'infection de l'ordre de 30% chez les patients lithiasiques, toutes espèces cristallines confondues.
Aujourd'hui, la proportion de calculs infectés a sensiblement diminué en France et se situe autour de 16%.
Si le rôle lithogène des germes uréasiques est bien connu [64], celui du colibacille et d'autres espèces bactériennes réputées dépourvues d'uréase est moins clair. In vivo, le rôle lithogène d’E. coli, parait indirect et plutôt lié à la capacité du germe à endommager l'urothélium qu'à un rôle cristallogène propre. Cependant, certaines souches d’E.coli sont capables d'induire la cristallisation de la struvite, bien que ce germe soit reconnu dépourvu d'uréase. Ce phénomène pourrait être dû à une production d'uréase lente par certaines souches d'Escherichia Coli. En effet, i l a été montré que différentes bactéries isolées d’urines humaines, dont le colibacille, incubées dans un milieu dépourvu de source azotée à l'exception de l'urée, sont capables de synthétiser transitoirement une uréase pour satisfaire leurs besoins métaboliques [65]. Cette uréase, appelée uréase optionnelle, est codée par un plasmide dérivant du génome de Proteus mirabilis.
Le pH urinaire moyen observé chez nos patients infectés par E. coli est égal à 7, ce qui correspond à une valeur relativement élevée qui pourrait traduire la capacité du germe à augmenter le pH urinaire et à saturer l'urine en phosphates calciques et/ou magnésiens, favorisant ainsi la formation de calculs phosphatiques. Un autre effet lithogène des bactéries réputées non uréasiques est l'altération du pouvoir inhibiteur naturel des urines. En effet, de nombreuses bactéries sont capables d'utiliser le citrate urinaire comme substrat et donc d'abaisser la concentration urinaire en citrate qui est un inhibiteur de cristallisation par sa capacité à complexer le calcium et à réduire à la fois la croissance et l'agrégation cristallines.
[66]. En l'absence de citrate, la lithogenèse se trouve ainsi facilitée, surtout pour tes sels calciques.
L'examen cytobactériologique des urines a montré une excellente corrélation entre la cristallurie de struvite et les micro-organismes uréasiques tels que Proteus mirabilis,
Proteus vulgaris, Klebsiella pneumoniae ou Pseudomonas aeruginosa.
La présence exclusive ou prépondérante de struvite et de carbapatite dans les urines infectées à Pseudomonas aeruginosa ou Klebsiella pneumoniae montre clairement, étant donné le caractère pH-dépendant de ces espèces cristallines, que se sont les souches porteuses d'uréase qui génère la cristallurie. I l en est de même pour le genre Staphylococcus dont de nombreuses souches possèdent une uréase et ont, de ce fait, une forte aptitude à alcaliniser les urines et à synthétiser corrélativement la struvite.
Le traitement de la lithiase d'infection est particulièrement difficile et, pour être pleinement efficace, doit obtenir l'éradication complète et durable de l'infection urinaire à l'aide des antibiotiques et, pour éviter le réensemencement de l'arbre urinaire à partir des calculs ou fragments résiduels, assurer l'ablation complète des calculs tout en limitant les lésions du parenchyme rénal.
L'éradication de l'infection repose sur une antibiothérapie adaptée et suffisamment prolongée pour assurer la stérilisation durable de l'appareil urinaire. Le tableau 12 montre que la majorité des germes isolés dans les urines des patients lithiasiques est sensible à la gentamicine, l'amikacine et/ou la céfatoxime, mais résiste à la colistine et aux béta- lactamines. Les aminosides agissent en inhibant les stades terminaux de formation des peptidoglycanes entraînant un arrêt de la synthèse de la paroi puis une lyse bactérienne. La résistance de la plupart des espèces bactériennes aux béta-lactamines est due à leur production de bêta-tactamases.
La sensibilité aux antibiotiques des germes identifiés diffère selon les populations étudiées.
Ainsi, dans une étude récente publiée chez des enfants présentant une infection urinaire au Nigeria [67], la majorité des colibacilles- et des Proteus identifiés étaient résistants à la gentamycine, aux aminopénicillines (amoxicilline et ampicilline) et au cotrimoxazole et sensibles à la pefloxacine et à la ceftriaxone (non testées ici). Dans une autre étude, réalisée en Iran [68], sur la sensibilité aux antibiotiques des souches de colibacille isolées des urines, les auteurs ont rapporté que la majorité était résistante au cotrimoxazole et à l'ampicilline, mais sensible à la gentamycine et à la nitrofurantoïne. Si toutes ces études confirment la progression du nombre de souches bactériennes résistantes à certains antibiotiques, elles attirent en revanche l'attention sur le fait que ces résistances sont très différentes selon les populations et les milieux biologiques à partir desquels sont isolées les bactéries. Cela souligne l'importance d'une mise en culture et d'une identification des bactéries lorsqu'une infection est suspectée afin de déterminer l'antibiothérapie la mieux adaptée plutôt que de pratiquer une antibiothérapie à l'aveugle qui expose à une augmentation des résistances et à
30
une inefficacité du traitement.
I-10 Conclusion
La majorité des calculs urinaires observés en Algérie sont constitués d'oxalate de calcium.
Cependant, l'étude des marqueurs de l'infection aussi bien dans les calculs que dans les urines montre que parmi les lithiasiques, les femmes sont deux fois plus souvent infectées que les hommes et que la proportion des patients lithiasiques infectés est sensiblement plus élevée en Algérie qu'en France, quel que soit le sexe des patients. Comme le suggèrent les résultats de l'examen cytobactériologique des urines et la présence fréquente de la struvite dans les urines comme dans les calculs, les germes possesseurs d'une uréase sont impliqués dans près de la moitié des lithiases de la femme et dans un calcul sur six chez l'homme.
L'analyse des antibiogrammes par rapport aux données de la littérature attire l'attention sur les différences de sensibilités aux antibiotiques des bactéries identifiées selon les pays et les populations. Ces observations soulignent l'importance, en cas d'infection urinaire, d'une mise en culture des urines pour permettre une identification précise des espèces bactériennes et la détermination de leur sensibilité aux antibiotiques afin de leur opposer un traitement spécifique.
Lithiases et infections urinaires ont des relations multiples. L’infection peut induire la lithiase et la lithiase peut contribuer à l’insuffisance rénale chronique ou aigue.
L’incorporation de la bactérie dans le calcul en développement rend ce dernier responsable de la majoration de l’infection et de son possible résistance aux traitements antibiotiques conventionnels.
Dans une perspective de démarche préventive de lutte intégrée, nous avons jugé nécessaire de rechercher parmi quelques plantes médicinales, celles dotées d’une activité antibactérienne.
Ces plantes ont été choisies sur la base de résultats d’enquêtes étiologiques menées sur des lithiasiques au niveau de notre laboratoire : Hordeum vulgaris, Thymus vulgaris, Matricaria chamomilla, Urtica dioica, Nigella sativa et Pétroselinum sativum.
Cette étude peut favoriser la découverte de nouvelles molécules à activité antimicrobienne, économiquement accessibles et faire face à l'apparition de phénomènes de résistance des germes aux antibiotiques.
32



![Tableau 5 : Nature des cristaux des phosphates et leur domaine de pH de cristallisation [12]](https://thumb-eu.123doks.com/thumbv2/123doknet/13153599.389383/11.892.109.690.862.1149/tableau-nature-cristaux-phosphates-domaine-ph-cristallisation.webp)
![Tableau 6 : Caractères morphologiques et culturaux des bactéries responsables de la lithiase d’infection [43]](https://thumb-eu.123doks.com/thumbv2/123doknet/13153599.389383/17.892.70.851.231.553/tableau-caractères-morphologiques-culturaux-bactéries-responsables-lithiase-infection.webp)