HAL Id: hal-02833400
https://hal.inrae.fr/hal-02833400
Submitted on 7 Jun 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Mesure et modélisation des dates de débourrement des
bourgeons de six espèces ligneuses le long d’un gradient
altitudinal dans les Pyrénées
Yann Vitasse
To cite this version:
Yann Vitasse. Mesure et modélisation des dates de débourrement des bourgeons de six espèces ligneuses le long d’un gradient altitudinal dans les Pyrénées. Sciences du Vivant [q-bio]. 2005. �hal-02833400�
Université Bordeaux 1 UFR des Sciences Biologiques
MASTER II SCIENCES ET TECHNOLOGIES Mention « Systèmes Ecologiques »
Année Universitaire 2004/2005
MEMOIRE DE MASTER II
Mesures et modélisation des dates de débourrement
des bourgeons de six espèces ligneuses le long d’un
gradient altitudinal dans les Pyrénées
Présenté et soutenu le 19 juillet 2005 à Bordeaux
Yann VITASSE
Kremer Antoine Rapporteur externe
Loustau-Desprez Marie-Laure Rapporteur interne
Encadrants : Sylvain DELZON et Richard MICHALET
Laboratoire d’accueil : Ecologie des Communautés UMR INRA 1202 BIOGECO Université Bordeaux 1
Les marronniers de la terrasse
Vont bientôt fleurir, à Saint-Jean,
La villa d'où la vue embrasse
Tant de monts bleus coiffés d'argent.
La feuille, hier encor pliée
Dans son étroit corset d'hiver,
Met sur la branche déliée
Les premières touches de vert.
Mais en vain le soleil excite
La sève des rameaux trop lents ;
La fleur retardataire hésite
A faire voir ses thyrses blancs.
Pourtant le pêcher est tout rose,
Comme un désir de la pudeur,
Et le pommier, que l'aube arrose,
S'épanouit dans sa candeur.
La véronique s'aventure
Près des boutons d'or dans les prés,
Les caresses de la nature
Hâtent les germes rassurés.
Théophile Gautier, La fleur qui fait le printemps, 1852.
Remerciements
Remerciements
Avant d’entrer réellement dans ce mémoire de recherche, je tiens à souligner l’importante part de terrain qu’il a fallu entreprendre. Nous avons effectués 14 missions dans les Pyrénées ce qui signifie 13500 Km parcourus, 46 jours de terrains dont 552 h actives, 67200 m de dénivelés parcourus en voitures et un peu plus de 6500 m à pied en raquettes ou en crampons…
En premier lieu, j’aimerai remercier mon fidèle compagnon de terrain, Jean-Marc, présent à toutes les missions. Le baroudeur infatigable et sa fameuse pâte de coing redonnant le punch après 4 heures de marches… Une des personnes les mieux équipées en toutes circonstances (café avec cafetière italienne, couverture de survie, lampe frontale, crème de marron…).
Continuons ce qui concerne les missions Pyrénées ; merci à Nicole de l’Hôtel « Le Moderne » pour son accueil, sa gentillesse et ses inoubliables morilles à la crème. Merci à Dominique, ma marraine et Jean-marc pour leur hébergement leur générosité et leur accueil à Barzun (où l’on trouve les meilleurs gâteaux à la broche parmi les nombreux testés…).
Une fois revenu du terrain, il faut se sentir bien dans son équipe au laboratoire pour pouvoir travailler le plus efficacement possible. C’est pourquoi, je souhaite tout d’abord remercier l’équipe d’écologie des communautés dans son ensemble pour son ambiance, sa convivialité et comme l’indique si bien son titre « des communautés », pour ses qualités sociales.
D’une façon plus individuelle, j’aimerai à la fois remercier et féliciter le renard (ou le Pitbull selon l’humeur), Sylvain, pour son efficacité, son encadrement, ses conseils, son humour et sa confiance. Une personne très perspicace qui mérite bien son nouveau poste de Maître de Conférence et qui intègre à merveille l’esprit de l’équipe des communautés.
La colombe, Estelle, pour sa générosité infinie, sa gentillesse, son sourire en toutes circonstances et ses nombreux gâteaux (celui au chocolat et aux noix me revient en ce moment sur les papilles…). Des personnes comme toi, aussi dévouées à aider ceux qui en ont besoin, qui donnent autant d’elles-mêmes sans attendre de recevoir, deviennent extrêmement rares et sont des trésors pour la société.
Remerciements
Le baron, Constant, pour son soutien, pour nos pauses café et divertissements ainsi que l’incroyable aventure « expérimentale » de l’Astragale et la Fourmi.Blaise, le plus affectueux et farfelu de la bande, une apparence austère mais un garçon attachant. « Austère sur la forme mais absolument pas sur le fond ».
Emmanuel toujours prêt à rendre service et à remonter le moral, question de méthode… Emmanuelle, joyeuse et attentionnée, qui m’a permis de mieux appréhender les questions de plasticité phénologique suscitées par mon sujet de recherche.
D’une manière plus collective, je souhaiterai remercier la Curette, Moul, Ben et tous les stagiaires Master 1 qui ont contribués à une ambiance conviviale.
Bien sûr, je souhaite remercier chaleureusement Richard de m’avoir offert un sujet aussi passionnant et extraordinaire et de m’avoir fait confiance. Richard, une des rares personnes que je connaisse possédant une appréhension du terrain aussi fine et pertinente, capable en lisant une carte IGN de prédire la végétation potentielle… Je citerai un souvenir inoubliable parmi tant d’autres d’une mission Pyrénées : journée maussade et pluvieuse de l’automne 2004, au-dessus du lac de Fabrèges. Avec Sylvain et Jean-Marc, nous nous agrippions aux herbes pour ne pas glisser dans le ravin malgré nos bonnes chaussures de randonnées antidérapantes. Deux mètres plus loin, Richard en sandales s’extasiant devant chaque plante, le nez au sol, insouciant de la pente et de la pluie… Merci pour ta connaissance du milieu montagnard et ta vision si fine des paysages.
Je souhaiterai également remercier Antoine Kremer pour ces conseils concernant la variabilité intrapopulationnelle et Isabelle Chuine pour son aide et sa grande contribution concernant la partie modélisation.
Merci à Dame Nature pour avoir offert à nos yeux une faune extraordinaire : des chevreuils, des izards, deux genettes (une vivante et une morte…) des chauves souris, des milans royaux, des vautours, des marmottes, des écureuils, des couleuvres, des sangsues, une salamandre, des gros lézards verts (Lacerta bilineata) ; sans compter l’exubérante flore (fritillaires, ancolies, gentianes, orchidées…).
Résumé
Résumé
Le réchauffement climatique pourrait affecter la phénologie, en modifiant les dates d’initiation foliaire et donc la saison de croissance des arbres qui deviendraient alors moins bien adaptés à leur environnement local. Des populations de six espèces ligneuses (Acer
pseudoplatanus, Fraxinus excelsior, Abies alba, Ilex aquifolium, Fagus sylvatica et Quercus petraea) sont suivies au niveau de leur date de débourrement le long d’un gradient altitudinal
allant de 100 m à 1600 m dans deux vallées pyrénéennes.
Nos données ont, d’une part confirmées que les populations les plus élevées en altitude étaient les plus tardives pour l’ensemble des espèces, et d’autre part, mis en évidence de larges différences dans la réponse phénologique vis-à-vis de l’altitude et surtout de la température entre les six espèces étudiées. Ces données ont par ailleurs permis d’implémenter un modèle unique pour les six espèces « modèle Uniforc4 », qui explique plus de 90 % de la variance observée pour chacune d’entre elles. L’interprétation des paramètres du modèle a également révélé des différences de réponse des espèces vis-à-vis de la température et ont démontré que les températures de la fin de l’hiver et printanières (janvier-juin) sont cruciales et suffisent à expliquer de façon optimale l’initiation foliaire des six espèces. Néanmoins, le hêtre se distingue des autres espèces et nous supposons une forte dépendance des températures hivernales ou bien de la photopériode pour l’initiation foliaire de cette espèce.
Cette étude est à notre connaissance la première à modéliser la réponse phénologique d’espèces ligneuses sur un gradient de température aussi marqué. Les différences phénologiques de réponse des espèces à la température mises en évidence dans cette étude laissent supposer que le réchauffement climatique affectera profondément la répartition des espèces et leur interaction (compétition / facilitation). Enfin, cette étude permettra d’améliorer les modèles existant de croissance et de répartition des espèces ligneuses.
Mots clés : phénologie, débourrement des bourgeons, arbres, réchauffement climatique,
Abstract
Abstract
The climate warming could affect both the beginning and the end of growing period of trees which would become less adapted to their local environment. Leaf bud burst of six woody species (Acer pseudoplatanus, Fraxinus excelsior, Abies alba, Ilex aquifolium, Fagus
sylvatica and Quercus petraea) have been studied along an altitudinal gradient from 100 m to
1600 m in two Pyrenean valleys.
Our data evidenced that populations of the highest altitude showed the latest dates of bud burst, and highlighted also broad differences in the phenologic responses to temperature between studied species. In addition These data ensures to implement a single model for the six species " Uniforc4 model", who explains more than 90 % of the observed variance for each one of them. The parameters interpretation of the model also revealed differences in response of the species with respect to temperature and showed that temperatures of the end of the winter and spring (January-June) are crucial and are enough to explain in an optimal way foliar initiation of the six species. Nevertheless, the beech is distinguished from the other species and we suppose a strong dependence of the winter temperatures for the foliar initiation of this species.
To our knowledge, this study is the first to model the phenologic response of woody species along a so high temperature gradient. The phenologic differences highlighted in this study which reveals species differences to temperature might suppose that the climatic warming will deeply affect the distribution of the species and their interaction (competition / facilitation). This study will ensure to improve the models existing of growth and distribution of the tree species.
Key words: phenology, bud burst, climate warming, trees, species distribution, altitudinal
Sommaire
Sommaire
Introduction _______________________________________________________________ 9 1. Changement climatique et impacts potentiels sur la végétation ____________________ 9 2. Phénologie, outil d’étude ___________________________________________________ 10 3. Modélisation du débourrement des bourgeons _________________________________ 11 Matériel et méthode ________________________________________________________ 13
1. Milieux d’étude___________________________________________________________ 13 2. Espèces étudiées __________________________________________________________ 14 3. Suivi phénologique in situ __________________________________________________ 15 4. Mesures micrométéorologiques______________________________________________ 15 5. Modélisation du débourrement des bourgeons _________________________________ 16 6. Analyse des données _______________________________________________________ 17 Résultats _________________________________________________________________ 18
1. Evolution de la température le long du gradient altitudinal ______________________ 18 2. Variabilité du débourrement des bourgeons en fonction de l’altitude ______________ 19
9 Niveau intrapopulationnel ________________________________________________________ 19 9 Niveau interpopulationnel ________________________________________________________ 19
3. Variabilité du débourrement des bourgeons en fonction de la température _________ 23 4. Modélisation du débourrement des bourgeons _________________________________ 23 Discussion________________________________________________________________ 25 Conclusion _______________________________________________________________ 29 Bibliographie _____________________________________________________________ 30 Annexes__________________________________________________________________ 34
Introduction
Introduction
1. Changement climatique et impacts potentiels sur la
végétation
La végétation a évolué, durant des temps géologiques, sous les effets des fluctuations climatiques, traversant des périodes glaciaires et des périodes interglaciaires. Les arbres ont ainsi connus des périodes de température plus chaudes et plus froides qu’actuellement et ont été capables de s’adapter à un réchauffement du climat (Jacobson et Dieffenbacher-Krall 1995, Hakkinen et al. 1998).
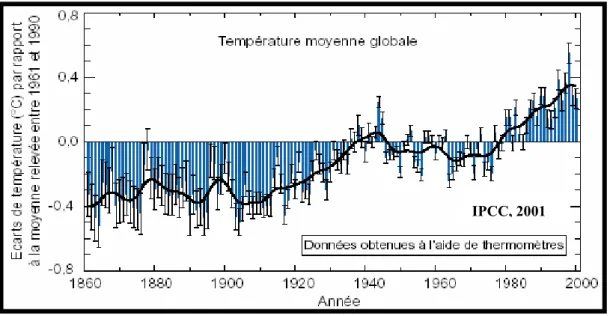
La nouveauté du changement climatique actuel et attendu est la rapidité à laquelle l’augmentation de la température est prévue. Le siècle dernier a été marqué par une élévation significative de la température moyenne globale d’environ 0.6°C (Fig. 1) (IPCC 2001). Cette hausse des températures a été particulièrement prononcée sur les quinze dernières années, tant à l’échelle mondiale qu’à l’échelle de la France (Moisselin et al. 2002). La décennie des années 90 aura été la plus chaude de tout le XXème siècle, probablement même du millénaire, et les années 1998, 2001 et 2002 ont été les plus chaudes jamais enregistrées depuis 1861, date des premiers relevés continus. Les simulations prédisent une augmentation de température comprise entre 1,4°C et 5,8°C d’ici à 2100 (IPCC 2001). Les activités anthropiques sont directement impliquées dans ce réchauffement récent, notamment le rejet important de gaz à effet de serre.
IPCC, 2001
Figure 1 : Anomalies des températures annuelles de l’air à la surface de la Terre et à la surface de la mer de 1861 à 2000, par rapport à la période 1961-1990. (barres bleues : moyenne annuelle, ligne noire : moyenne décennale).
Introduction
Les conséquences du réchauffement climatique sont déjà perceptibles notamment sur les phases de développement des plantes. La température exerce en effet un rôle primordial sur le déclenchement de la période de végétation des arbres de milieux tempérés (Hakkinen et Hari 1988, Hanninen 1990, Hunter et Lechowicz 1992, Chuine et al. 1998). De nombreuses études ont mis en évidence une tendance linéaire décroissante allant de 5 à 22 jours d’avancée des évènements phénologiques printaniers comme le débourrement des bourgeons ou encore la floraison, sur les cinquante dernières années (Menzel 1997, Ahas 1999, Menzel et Fabian 1999, Chmielewski et Rotzer 2001, Ahas et al. 2002). De même, des études montrent généralement une tendance linéaire positive, allant de 0 à 4 jours de recul des évènements automnaux comme la coloration ou la chute des feuilles (Fabian et Menzel 1999, Menzel et Fabian 1999, Menzel et al. 2001).2. Phénologie, outil d’étude
Les arbres se sont adaptés à leur climat local en faisant évoluer certaines caractéristiques phénologiques (Reich et al. 1992). Les adaptations génétiques et environnementales, déterminées par l’acclimatation des plantes sont les deux processus clés qui permettent la survie et le développement des espèces végétales dans différents milieux (Ducousso et al. 1996, Palmroth et al. 1999). Il est globalement reconnu que les arbres des zones tempérées ou boréales se sont adaptés de façon optimale à leur environnement local en minimisant la fréquence de dommages par le froid, tout en maximisant la durée de leur période de croissance (Lockhart 1983, Lechowicz et al. 1984). En effet, le débourrement des ébauches foliaires doit avoir lieu le plus tôt possible, afin d’accroître la durée de saison de croissance et, dans le même temps, les feuilles doivent être protégées des gelées tardives qui les endommageraient et réduiraient leur capacité photosynthétique. Les dates des évènements phénologiques tout au long de l’année constituent donc un trait décisif déterminant les adaptations des plantes aux changements environnementaux saisonniers (Orshan 1989). Les arbres ne pouvant réagir rapidement au réchauffement climatique (i.e. les espèces les moins plastiques à la température), deviendraient alors moins bien adaptées à leur climat local. C’est pourquoi, l’étude des stades phénologiques clés (débourrement, bourgeonnement, floraison, chute des feuilles…), mesurés depuis de nombreuses années sur diverses espèces, a connu un regain d’intérêt ces dernières années dans le cadre des recherches sur les conséquences probables du changement climatique.
Introduction
Une étude, réalisée par Kramer en 1995, qui reprend les données phénologiques des IPG (International Phenological Garden) le long d’un gradient latitudinal, montre que les réponses phénologiques sont très variables selon les espèces traduisant des différences de sensibilité aux facteurs du milieu. Ce travail basé sur l’étude de clones suggère également une grande plasticité phénologique des arbres concernant les dates de débourrement des feuilles (Kramer 1995). De même Chmielewski et al. (2004) affirme que le débourrement des bourgeons est l’évènement phénologique qui semble être le plus plastique à la température. Par ailleurs, des études utilisant l’outil de modélisation ont confirmé l’existence d’une variabilité interspécifique importante de cet évènement phénologique (Kramer 1995, Chuine et Cour 1999, Linkosalo et al. 2000).La plasticité phénologique peut donc varier entre les espèces occupant une même communauté et ces différences de plasticité peuvent profondément affecter la réponse des espèces aux changements globaux, notamment à travers les interactions biotiques (compétition et facilitation). Des réponses phénologiques différentielles des arbres peuvent modifier leur chance de survie en altérant la balance compétitive entre les diverses essences. Ces changements dans les interactions biotiques des communautés forestières pourraient alors entraîner des variations probables de la distribution actuelle des espèces, causant un défaut
d’adaptation dans un environnement changé. Plusieurs études basées sur l’outil de modélisation ont déjà effectué des prédictions sur la productivité et l’aire de répartition potentielles des essences majeures suite au changement (Loustau et al. 2004, Loustau et al. 2005). Toutefois, ces modèles n’intègrent pas de modules de réponse phénologique à la température ce qui est nécessaire pour affiner les prédictions.
3. Modélisation du débourrement des bourgeons
La modélisation est un outil indispensable pour tenter de prédire la réponse phénologique des végétaux face aux changements climatiques. La prédiction du débourrement des bourgeons des arbres, c'est-à-dire le début de la période de croissance des feuillus, ouvre en effet de nombreuses applications : comprendre les interactions insectes/initiation foliaire de l’hôte (Dixon 1977, Valentine 1983, Rinker et al. 2001), évaluer les conséquences du changement climatique sur la répartition des espèces (Cannell et Smith 1986, Hanninen et al. 1993, Chuine et Beaubien 2001, Saxe et al. 2001) ou encore modéliser les échanges de masse et d’énergie notamment le cycle global du carbone (Nizinski et Saugier 1988, Leinonen et Kramer 2002, Loustau et al. 2004, Rotzer et al. 2004). Les modèles phénologiques prédisent
Introduction
que la sortie des feuilles est régulée par la température et est induite par une période de températures froides capables de lever la dormance suivie d’une période de températures chaudes capables d’initier la croissance du bourgeon. De nombreux modèles ont été conçus et améliorés au cours de la dernière décennie pour prédire les dates de débourrement des arbres des milieux tempérés (Sarvas 1974, Cannell et Smith 1983, Kobayashi et Fuchigami 1983, Murray et al. 1989, Hanninen 1990, Hunter et Lechowicz 1992, Kramer 1994, Chuine et al. 1999, Chuine 2000). Ces modèles sont basés sur les différents états du bourgeon définis et caractérisés par son potentiel de réponse aux variations climatique (Sarvas 1974). Deux périodes se distinguent :- une période de « rest » (i.e. de dormance au sens strict) durant laquelle la croissance du bourgeon est physiologiquement bloquée à l’intérieur du bourgeon, même si les conditions climatiques sont favorables. Une période de froid prolongée est nécessaire pour lever cet état de dormance et le bourgeon devient alors quiescent,
- Une période dite de « quiescence » durant laquelle, la croissance du bourgeon est physiologiquement possible mais les conditions climatiques ne le permettent pas. L’arbre sera donc capable de reprendre sa croissance dés que les conditions climatiques redeviendront favorables.
Selon les auteurs, ces deux derniers stades peuvent s’enchaîner de manière progressive ou brutale ou alors s’entrecroiser ce qui conduit à divers types de modèles. Dans cette étude, nous utiliserons un modèle qui considère uniquement les températures de « forcing », i.e. les températures printanières capables d’initier la croissance d’un bourgeon à l’état quiescent.
L’objectif principal de notre travail est de caractériser et modéliser la réponse phénologique de six espèces ligneuses majeures en forêts de montagne, le long d’un gradient altitudinal. Le gradient altitudinal à l’instar des gradients latitudinaux employés dans de nombreuses études va nous permettre de travailler implicitement le long d’un gradient thermique marqué. Nous appréhenderons trois questions principales : (1) Comment évoluent les dates de débourrement des bourgeons de chaque espèce en fonction de l’altitude et de la température (2) Les différentes espèces choisies ont-elles une réponse phénologique similaire à la température ? (3) Un modèle unique de débourrement des bourgeons est-il capable de prédire la réponse de plusieurs espèces ligneuses ? Peut-on alors envisager des perspectives sur l’évolution de la répartition des espèces dans un contexte de changement climatique ?
Matériel et méthode
Matériel et méthode
1. Milieux d’étude
L’aire d’étude est localisée dans deux vallées du sud ouest de la France, l’une localisée dans les Pyrénées Centrales et l’autre dans les Pyrénées Atlantiques. L’étude s’est déroulée le long d’un gradient altitudinal dans le but d’obtenir des situations climatiques très contrastées pour le suivi phénologique des populations. Dans cette étude, le terme population est employé pour désigner l’échantillon d’individus d’une espèce à une altitude donnée. Les populations d’arbres étudiées ont ainsi été échantillonnées le long de gradients altitudinaux, de 100 m à 1600 m, dans la vallée d’Ossau (Pyrénées atlantiques) et la vallée de Luz Saint Sauveur (Pyrénées centrales) (Fig. 2). La proximité géographique de ces deux vallées leur fait bénéficier d’un climat montagnard océanique comparable. La pluviométrie annuelle à Tarbes calculée sur la période allant de 1946 à 2001 est de 1079 mm et la température moyenne annuelle sur cette même période est de 12.0°C (www.meteofrance.com).
Ariège Landes Pyrénées Atlantiques Hautes Pyrénées Gers Haute Garonne Lot et Garonne Gironde Ariège
ESPAGNE
ESPAGNE
Stations phénologiquessélectionnées en vallée d’Ossau
Stations phénologiques sélec-tionnées en vallée de Luz St sauveur 25 Km Ariège Landes Pyrénées Atlantiques Hautes Pyrénées Gers Haute Garonne Lot et Garonne Gironde Ariège
ESPAGNE
ESPAGNE
Stations phénologiquessélectionnées en vallée d’Ossau
Stations phénologiques sélec-tionnées en vallée de Luz St sauveur 25 Km
Matériel et méthode
Les stations ont été choisies à cinq niveaux altitudinaux de 100 m, 400 m, 800 m, 1200 m et 1600 m, plus ou moins 50 m dans les étages collinéens et montagnards (Fig. 3). Toutes les espèces ont été choisies en versant nord pour minimiser les différences d’exposition lors des résultats comparatifs, à l’exception du chêne sessile choisi toujours en versant sud, en raison de ses exigences écologiques.Etage collinéen atlantique
Forêt de chênes Etage montagnard Etage subalpin Etage alpin Nord Sud 2500 m 1800 m 2300 m 1600 m 900 m 1600 m 1200 m 800 m 400 m 100 m 1200 m Hêtraie sapinière Pin sylvestre Pins à crochet et Rhododendrons Pins à crochet et Raisins d’Ours
Etage collinéen atlantique
Forêt de chênes Etage montagnard Etage subalpin Etage alpin Nord Sud 2500 m 1800 m 2300 m 1600 m 900 m 1600 m 1600 m 1200 m 1200 m 800 m 800 m 400 m 400 m 100 m 100 m 1200 m Hêtraie sapinière Pin sylvestre Pins à crochet et Rhododendrons Pins à crochet et Raisins d’Ours
Figure 3 : Représentation schématique des 5 niveaux altitudinaux choisis et positionnés dans le triangle des étages de végétation dans une coupe transversale des Pyrénées centrales (d'après Ozenda 1994).
En raison de différences d’altitude sensibles, les milieux de montagnes possèdent pour de faibles distances horizontales, des régimes climatiques d’une diversité comparable à celle de régions situées à des latitudes très différentes. Les climats de montagne subissent l’influence de quatre facteurs principaux : l’altitude, la continentalité, la latitude et l’exposition (d’après Barry 1992).
2. Espèces étudiées
Nous avons travaillé sur des espèces très représentatives du milieu montagnard pyrénéen et qui possèdent une importante aire de répartition. De plus, parmi les espèces ayant de larges aires de répartition, nous avons alors sélectionné six espèces ayant des stratégies fonctionnelles très différentes afin de vérifier si leur réponses phénologiques sont également contrastées. Ces espèces ont alors été choisies pour leur appartenance à différentes stratégies de conservation des ressources basées sur des données de durée de vie des feuilles et de leur rapport Carbone/Azote (Cornelissen et al. 1997, Pages et al. 2003) ; deux espèces dispendieuses en nutriments, Acer pseudoplatanus L. (Acéracées) et Fraxinus excelsior L. (Oléacées), deux espèces conservatrices en nutriments, Abies alba Mill. (Pinacées) et Ilex
aquifolium L. (Aquifoliacées) et deux espèces intermédiaires, Fagus sylvatica L. et Quercus petraea Lieb. (Fagacées). Les caractéristiques morphologiques et écologiques de ces espèces
Matériel et méthode
sont présentées en annexe (Annexe D). Ces espèces ont été sélectionnées dans des populations naturellement implantées dans les Pyrénées.3. Suivi phénologique in situ
Le suivi du débourrement des bourgeons a été réalisé au cours du printemps 2005, du mois de mars au mois de juin inclus, en effectuant une visite de chaque station tous les 10 jours au minimum. Différents stades de débourrement ont été distingués (Annexe E) et à chaque stade, le pourcentage de bourgeons atteignant le stade le plus avancé est évalué sur la surface totale du houppier à l’aide de jumelles 10X42. Le bourgeon est considéré comme débourré
lorsqu’au moins une feuille est sortie et individualisée pour chaque espèce (Annexe E).
L’arbre est considéré comme débourré lorsqu’au moins 50 % des bourgeons du houppier ont acquis le critère précédent. Le suivi phénologique s’effectue sur 10 arbres sélectionnés au hasard à l’automne 2004 dans chaque population. Ces arbres ont été repérés à l’aide d’une marque de peinture et chaque station comprenant la population d’une ou plusieurs espèces a été géographiquement repérée à l’aide d’un GPS (Global Positioning System). L’altitude a été référencée par le GPS puis comparée avec un altimètre de terrain calé à partir de cartes IGN (Institut Géographique National) au 1/25000ème.
4. Mesures micrométéorologiques
Des mesures de températures ont été effectuées dans l’ensemble des stations suivies pour le débourrement des bourgeons (soit 32 stations suivies). Ces relevés météorologiques ont été réalisés à l’aide de capteurs météorologiques (HOBO RH/TEMP PRO 64K réf. : H08-032-02), toutes les 15 minutes à partir du 11 janvier jusqu’aux dates de débourrement des populations échantillonnées. L’intervalle de confiance des mesures des températures est de ± 0.28°C de 0 à 70°C. Un étalonnage en laboratoire a été effectué durant deux journées de mesures et une variation maximale de 0.2°C entre les différents capteurs a été enregistrée (données non montrées).
Les capteurs micrométéorologiques ont ensuite été implantés en milieu ouvert (non forestier) à proximité de chaque station et ont été fixés à des tuteurs en bois à une hauteur d’1.50 m au dessus du sol. Ils ont été protégés du rayonnement solaire direct et de la pluie par des abris plastiques (Annexe F).
Matériel et méthode
5. Modélisation du débourrement des bourgeons
Deux modèles ont été utilisés pour prédire le débourrement des bourgeons, regroupés sous le nom de « UniForc » (Chuine 2000). Ces modèles sont basés sur le « Spring-Warming model » (Cannell et Smith 1983) et supposent que le débourrement des bourgeons a lieu lorsque une somme critique de degré-jours (généralement appelé « forcing units ») atteint un certain seuil (Fc). Cette somme est cumulée à partir d’une date (t1) pour le premier modèle. Le
deuxième modèle utilisé est une version simplifiée du précédent, la seule différence est qu’il n’intègre pas l’estimation de la date t1, elle est implicitement fixée au premier jour de nos
relevés micrométéorologiques. Ces modèles comprennent quatre paramètres pour le premier (d, e, Fc, t1) et trois pour le second (d, e, Fc). Pour plus de commodité, nous les nommerons
« UniForc4 » et « UniForc3 ». En collaboration avec Isabelle CHUINE (Centre d’Ecologie Fonctionnelle et Evolutive), nous avons utilisé la plateforme METROPOLIS pour ajuster les paramètres du modèle « Uniforc » sur nos données.
Le seuil critique d’accumulation de la température pour lequel la population a acquis le critère de débourrement, Fc, est décrit comme la somme journalière des unités de « forcing »
accumulées à partir d’une date t1 (Equation 1).
∑
= tb t t c Rf x F 1 ) ( Eq. 1Avec : Fc, le seuil critique d’accumulation des températures à partir duquel la population
étudiée a débourré (tb) ; t1, la date de démarrage de l’accumulation des températures ; tb, la
date de débourrement des bourgeons de la population ; xt, la moyenne des températures d’un
jour Julien t.Le taux de « forcing », Rf, est choisi comme une fonction sigmoïde de la
température (Hanninen 1990, Kramer 1994, Chuine 2000) (Equation 2).
)) ( ( exp 1 1 e x d f R + + = Eq. 2
Avec : Rf, le taux de « forcing » ; d, la valeur de la pente de la sigmoïde Rf traduisant la
vitesse d’accumulation des températures ; e, la valeur du point d’inflexion de la sigmoïde Rf
estimée par le modèle ; x, la moyenne de la température journalière.
Les ajustements des paramètres sont obtenus à partir des données micrométéorologiques mesurées du 13 janvier 2005 au 15 juin 2005, c'est-à-dire après que toutes les populations aient atteint le critère de débourrement des bourgeons. Les ajustements sont réalisés en minimisant la somme des carrés des écarts total du modèle et des résidus. Les
Matériel et méthode
pourcentages de variance (R²) expliqués par les modèles sont calculés en utilisant l’équation 3 (Chuine 2000). tot res totSS
SS
SS
R
2=
(
−
)
Eq. 3Avec : SStot, la somme totale des carrés du modèle ; SSres, la somme des résidus des carrés.
6. Analyse des données
Le calcul de la variabilité des dates de débourrement en fonction de la température a été effectué en prenant la moyenne, les minima ou les maxima des températures du 13 janvier jusqu’aux dates de débourrement de la population la plus précoce pour chaque espèce (96 relevés de température par jour). La variabilité des dates de débourrement par degré Celsius a ensuite été obtenue par régression linéaire entre la température et les dates de débourrement correspondantes pour chaque espèce. Les corrélations étant nettement moins bonnes en utilisant les minima ou les maxima de température, nous parlerons dans l’ensemble du rapport uniquement des températures moyennes journalières. Les données manquantes à une station (quelques jours en raison d’un dysfonctionnement du capteur) ont été estimées par régressions linéaires en utilisant les données de la station de mesures micrométéorologiques les mieux corrélées (R² toujours supérieur à 0.9), en utilisant le logiciel SAS (version 8.2 SAS Institute, Cary, NC, USA).
Pour rendre compte de la variabilité intrapopulationnelle et interspécifique, le coefficient de variation (CV) a été calculé à l’échelle de l’espèce (Equation 4, (Sokal et Rohlf 1981), c'est-à-dire en considérant une population globale pour chaque espèce et à l’échelle de la population.
x
CV =σ Eq. 4
Avec : σ , l’écart type des dates de débourrement ; x, la moyenne des date de débourrement. La base de données de phénologie (vallée, altitude, espèces, date de débourrement) a été traitée en utilisant une analyse de variance en « split plot » afin de prendre en compte les traitements emboîtés de cette expérimentation. De plus, afin de tester les effets des espèces sur les dates de débourrement à chaque altitude, nous avons utilisé une analyse de variance (ANOVA) en compilant l’ensemble des données issues des 2 vallées (car pas d’effet vallée). L’ensemble des analyses a été effectué avec le logiciel SAS (SAS procédure GLM, Version 8.2, SAS Institute, Cary, NC, USA).
Résultats
Résultats
1. Evolution de la température le long du gradient altitudinal
Le gradient altitudinal utilisé permet d’obtenir un gradient thermique très contrasté. Les températures moyennes décroissent linéairement avec l’altitude des stations (Fig. 4). Les stations situées à 100 m d’altitude ont une moyenne de températures du mois de février comprise entre 2 à 4°C alors qu’à l’opposé, celles situées à 1600 m ont des températures évoluant entre -4 à -6°C.
Figure 4 :
Tableau I :
Valeurs moyennes de températures mesurées au cours du mois de février toutes les 15 minutes en fonction de l’altitude de chaque station (n = 2688).
-6.00 -5.00 -4.00 -3.00 -2.00 -1.00 0.00 1.00 2.00 3.00 4.00 100 400 800 1200 1600 Altitude (m) T em p ér atu re m o yen n e (° C )
L’amplitude de températures mesurée varie de 5.4 à 9.2°C pour un dénivelé maximal allant de 1182 à 1499 m selon les espèces (Tab. I). Ce gradient thermique est en effet plus ou moins important selon les espèces, en raison de leur aire de répartition. Il n’existe pas de populations naturelles d’érable sycomore et de sapin pectiné en dessous de 200 m, réduisant ainsi le gradient.
Dénivelé maximal et écart maximal de températures observés entre toutes les populations de chaque espèce pour chaque vallée prise une à une, puis regroupées.
Ac Fr Il Gradient thermique (°C) Dénivelé (m) Gradient thermique (°C) Dénivelé (m) Gradient thermique (°C) Dénivelé (m) er pseudoplatanus 5.5 1164 5.4 1052 6.2 1164 Quercus petraea 7.1 1355 7.3 1499 7.4 1499 axinus excelsior 5.3 1038 7.8 1403 7.8 1403 Abies alba 8.4 1129 4.4 764 8.4 1182 ex aquifolium 6.6 1466 9.1 1059 9.1 1483 Fagus sylvatica 8.3 1403 8.6 1473 9.2 1473
Vallée de Luz St Sauveur
Résultats
2. Variabilité du débourrement des bourgeons en fonction de
l’altitude
9
Niveau intrapopulationnel
Variabilité intrapopulationnelle le long du gradient altitudinal
Les coefficients de variation intrapopulationnelle sont compris entre 0 et 9.2 % (Fig. 5). La variabilité intrapopulationnelle est plus élevée dans les populations situées en dessous de 800 m, i.e. l’étage collinéen, pour toutes les espèces, à l’exception du hêtre. A partir de 1200 m le CV diminue pour descendre en dessous des 4 % à 1600 m quelles que soient les espèces. Les populations de houx situées à 400 et 800 m possèdent un CV relativement élevé. De même, les populations de hêtres ont un CV faible, toujours inférieur à 4 %.
Figure 5 : Evolution du coefficient de variation (CV) des dates de débourrement des populations pour chaque espèce le long du gradient altitudinal. Les CV ont été calculés dans chaque population dans les deux vallées puis regroupés par niveaux altitudinaux en calculant la moyenne des deux valeurs pour les espèces dont les populations ont été trouvées à une même altitude dans les deux vallées.
0 2 4 6 8 10 100 400 800 1200 1600 Altitude (m) C o ef fi ci en t d e var ia ti o n ( % ) Abies Acer Fagus Fraxinus Ilex Quercus
9
Niveau interpopulationnel
Variabilité interpopulationnelle moyenne de chaque espèce
Les CV interpopulationnels des six espèces sont compris entre 7 et 17 % (Fig. 6).
0 5 10 15 20
Fagus Acer Ilex Fraxinus Abies Quercus
Espèces
CV
(
%
)
Figure 6 : Valeurs des coefficients de variabilité (CV) des dates de débourrement des bourgeons calculées à l’échelle de l’espèce.
Résultats
Le chêne se distingue nettement des autres espèces avec une forte variabilité interpopulationnelle traduit par un CV > 15 % ; L’érable, le houx, le frêne et le sapin ont un CV moyen compris entre 9.5 et 11 %. A l’inverse, le CV le plus faible est obtenu pour le hêtre : 7 %.
Comparaison entre les deux vallées
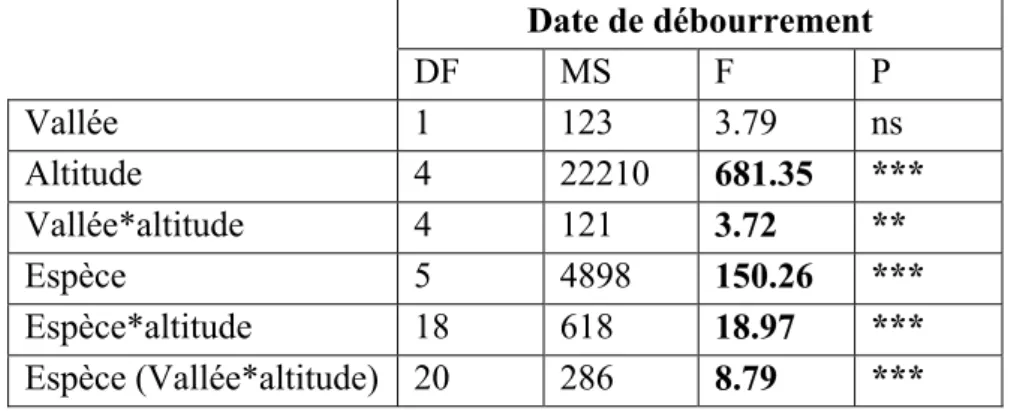
Il n’y a pas de différences significatives des dates de débourrement des espèces entre les deux vallées (Tab. II). Il existe cependant un effet très significatif de l’altitude, de l’espèce, de l’interaction espèce*altitude, vallée*altitude. L’interaction espèce*altitude montre que les espèces ne possèdent pas la même réponse phénologique le long du gradient altitudinal.
Tableau II : Analyses de variance de type emboîté (split-plot analysis) sur les dates de débourrement en fonction de la vallée, de l’altitude et de l’espèce. Avec : DF, le degré de liberté ; MS, la moyenne des carrés ; *, p < 0.05 ; ** p < 0.01 ; *** p< 0.001. Date de débourrement DF MS F P Vallée 1 123 3.79 ns Altitude 4 22210 681.35 *** Vallée*altitude 4 121 3.72 ** Espèce 5 4898 150.26 *** Espèce*altitude 18 618 18.97 *** Espèce (Vallée*altitude) 20 286 8.79 ***
Les populations situées à une même altitude mais localisées dans deux vallées différentes ont une réponse phénologique très proche (Fig. 7). Six populations voient leurs dates de débourrement significativement différentes pour une même altitude. Néanmoins, les variations phénologiques ne dépassent pas 12 jours entre deux populations d’une même altitude à l’exception des populations de houx et de sapins situées à 800 m où le décalage entre les deux populations est supérieur à 17 jours. Ce décalage important s’explique cependant par des températures anormalement froides enregistrées dans ces deux stations, probablement liées à leur exposition.
Résultats
Figure 7 : Comparaison de la date de débourrement des populations de chaque espèce par altitude et par vallée. A une même altitude, les valeurs des deux populations ayant une lettre différente sont significativement différentes.
Quercus 80 100 120 140 160 100 400 800 1200 1600 Luz Ossau Fagus 80 100 120 140 160 100 400 800 1200 1600 Luz Ossau Fraxinus 80 100 120 140 160 100 400 800 1200 1600 Abies 80 100 120 140 160 400 800 1200 1600 Ilex 80 100 120 140 160 100 400 800 1200 1600 Acer 80 100 120 140 160 400 800 1200 1600 Dat e d e d é bo urre m ent ( jours J u lien s) Altitude (m) ab b a b a b a a b b a Quercus 80 100 120 140 160 100 400 800 1200 1600 Luz Ossau Fagus 80 100 120 140 160 100 400 800 1200 1600 Luz Ossau Fraxinus 80 100 120 140 160 100 400 800 1200 1600 Abies 80 100 120 140 160 400 800 1200 1600 Ilex 80 100 120 140 160 100 400 800 1200 1600 Acer 80 100 120 140 160 400 800 1200 1600 Dat e d e d é bo urre m ent ( jours J u lien s) Altitude (m) ab b a b a b a a b b a
Stratégie de développement des espèces
Comme attendu, plus la population d’une espèce se situe à une altitude élevée, plus sa date moyenne de débourrement est tardive (Fig. 8). Néanmoins, ces deux figures montrent des différences importantes dans la stratégie de développement des espèces ligneuses étudiées. Le chêne est l’espèce la plus précoce parmi les autres. A 100 et 400 m, ses dates de débourrement sont significativement plus précoces que les autres, alors qu’à 800 m et à 1600 m, celles-ci sont non différentes de celles du hêtre et de l’érable, mais toujours plus précoces que celles du houx, du sapin et du frêne (annexe B).
80
Figure 8 : Dates moyennes de débourrement (jour de l’année) pour chaque espèce en fonction de l’altitude, pour la vallée de Luz (graphique de gauche) et la vallée d’Ossau (graphique de droite).
Vallée de Luz 100 120 140 160 180 0 400 800 1200 1600 Altitude (m) D ate de d éb o u rr em ent de s bo ur g eo n s ( j) Abies Acer Fagus Fraxinus Ilex Quercus Vallée Ossau 80 100 120 140 160 180 0 400 800 1200 1600 Altitude (m) D a te de dé bou rr e m e n t de s bo ur ge ons ( j)
Résultats
De plus, il est intéressant de constater que les populations de chênes situées à 100 m d’altitude débourrent environ un mois avant les populations de hêtres localisées à une même altitude alors que cette différence est nulle à 1600 m. La figure 8 et le tableau VI (Annexe B) montrent également que l’érable sycomore et le hêtre sont significativement plus précoces que les autres espèces seulement à partir d’une certaine altitude (800 m). A l’inverse, les deux espèces sempervirentes, le houx et le sapin sont toujours les espèces les plus tardives quelle que soit l’altitude. Le frêne occupe généralement une position intermédiaire.La corrélation linéaire entre les dates de débourrement et l’altitude varie de 0.75 à 0.93 selon les espèces (Annexe B). Le chêne sessile et l’érable sycomore sont les deux espèces dont les dates de débourrement sont les mieux corrélées à l’altitude (respectivement, R2 = 0.926 et R2 = 0.934). A l’inverse, le hêtre et le houx ont les dates les moins corrélées (R2 = 0.778 et R2 = 0.781 respectivement).
Amplitude du débourrement en fonction de l’espèce
L’amplitude de variation le long du gradient altitudinal est nettement plus forte pour le chêne (> 50 jours) que pour les autres espèces. Celle du hêtre est la plus petite (< 25 jours) (Fig. 8). Les dénivelés entre espèces n’étant pas tous comparables, il est nécessaire de normaliser l’amplitude moyenne pour un gradient d’altitude donné afin de comparer leur amplitude de réponse. Les amplitudes de réponses phénologiques ainsi standardisées révèlent de grandes différences entre les espèces (Fig. 9). Le chêne sessile reste l’espèce dont les populations possèdent la plus grande amplitude de variabilité phénologique avec l’altitude : 39 jours de décalage pour un dénivelé de 1000 m. Le sapin possède également une grande amplitude de variations phénologiques de ses populations le long du gradient altitudinal avec 33 j/1000 m. Le frêne, l’érable et le houx possèdent une amplitude moyenne : entre 20 et 30 j/1000 m et le hêtre possède la plus faible amplitude : 15 j/1000 m.
Figure 9 : Variabilité des dates de débourrement observées pour un dénivelé standardisé à 1000 m pour chaque espèce. Ces valeurs ont été obtenues à partir des équations des droites de régression entre les dates de débourrement des populations et leurs altitudes respectives.
0 10 20 30 40
Fagus Ilex Acer Fraxinus Abies Quercus
Espèces A m pl it ude m o ye n n e ( jour s Ju li en s)
Résultats
3. Variabilité du débourrement des bourgeons en fonction de
la température
Pour s’affranchir des facteurs complexes, le long du gradient altitudinal, l’amplitude de variation phénologique a été corrélée à la température mesurée dans chaque station. Les espèces diffèrent dans leur amplitude de réponse phénologique à la température (Tab. III). Le décalage phénologique en nombre de jours par degré supplémentaire est le plus important pour le chêne sessile : -7,19 jours et le plus faible pour le hêtre : -2.33 jours (Tab. III). Le frêne, l’érable et le sapin possèdent des valeurs comparables, entre -5.05 et 5.32 j/°C. Le houx possède une amplitude plus faible : -3.80 j/°C.
Tableau III : Avancée de la date de débourrement des bourgeons par degré supplémentaire. Ces valeurs correspondent aux pentes des droites de régression calculées entre les températures moyennes enregistrées du 13/01/05 jusqu’au dates de débourrement de la population la plus précoce et les dates de débourrement des populations respectives. * si p < 0.05, ** si p < 0.01 et *** si p< 0.001. j/°C R² p Quercus petraea -7.19 0.93 *** Fraxinus excelsior -5.32 0.95 *** Acer pseudoplatanus -5.21 0.88 *** Abies alba -5.05 0.89 ** Ilex aquifolium -3.80 0.87 *** Fagus sylvatica -2.33 0.75 **
Les dates de débourrement de toutes les espèces sont également linéairement corrélées aux moyennes de températures qui précèdent le débourrement. Les corrélations ont toutes un R² > 0.87 à l’exception du hêtre (R² = 0.75) et sont toutes significatives (Tab. III).
4. Modélisation du débourrement des bourgeons
Les deux modèles utilisés permettent d’expliquer de façon significative les dates de débourrement observées de toutes les espèces (p<0.01) (Tab. IV). Le modèle à quatre paramètres (« Uniforc4 ») explique toujours plus de variance que celui à 3 paramètres (« Uniforc 3 ») et ce quelle que soit l’espèce considérée (Annexe C). Les deux modèles étant mathématiquement très proches, nous discuterons ici uniquement du modèle « Uniforc4 ». Tableau IV : Valeurs des paramètres du modèle « Uniforc4 » estimé à l’aide du « logiciel » METROPOLIS pour chaque espèce avec le pourcentage de variance expliquée et le degré de significativité. **, p < 0.01 ; ***, p < 0.001.
d e Fcrit t1 R 2 F p SSres Quercus petraea -0.30 -16.77 7.74 73.46 0.93*** 35.96 0.00001 343.05 Fraxinus excelsior -1.14 -14.10 8.25 79.99 0.97*** 35.77 0.00072 56.19 Ilex aquifolium -40.00 -10.63 18.01 94.10 0.97*** 35.54 0.00073 46.34 Abies alba -34.97 -14.81 5.91 94.08 0.99** 88.41 0.00192 12.19 Fagus sylvatica -40.00 5.57 88.35 34.17 0.92** 16.49 0.00217 62.09 Acer pseudoplatanus -0.29 -11.66 17.03 77.11 0.98** 44.20 0.00145 21.69
Résultats
Ilex 120 130 140 150 160 120 130 140 150 160 Abies 120 130 140 150 160 120 130 140 150 160 Acer 110 120 130 140 150 160 110 120 130 140 150 160 Fagus 120 130 140 150 160 120 130 140 150 160 Fraxinus 110 120 130 140 150 160 110 120 130 140 150 160 Valeurs observées Quercus 90 100 110 120 130 140 150 160 90 100 110 120 130 140 150 160 V al eur s p réd ite s Ilex 120 130 140 150 160 120 130 140 150 160 Abies 120 130 140 150 160 120 130 140 150 160 Acer 110 120 130 140 150 160 110 120 130 140 150 160 Fagus 120 130 140 150 160 120 130 140 150 160 Fraxinus 110 120 130 140 150 160 110 120 130 140 150 160 Valeurs observées Quercus 90 100 110 120 130 140 150 160 90 100 110 120 130 140 150 160 V al eur s p réd ite sLe modèle explique 92% à 99% de la variabilité des dates de débourrement selon l’espèce et il est significatif pour toutes les espèces (p < 0.01) (Tab. IV) et prédit avec robustesse les dates de débourrement de chaque espèce (Fig. 10).
Figure 10 : Valeurs prédites par le modèle Uniforc4 en fonction des valeurs observées des dates de débourrement pour les six espèces.
La date t1 à partir de laquelle les températures sont prises en compte pour prédire au mieux
les dates de débourrement est très variable selon les espèces. Cette date traduit la capacité du bourgeon à redémarrer sa croissance suite aux températures favorables ce qui signifie, au sens physiologique, la date marquant le début de la quiescence. Le hêtre se distingue nettement avec une date t1 très précoce de 34.2 j ; à l’inverse la phénologie du houx et du sapin est prédite avec
la meilleure résolution pour une date t1 plus tardive (94.1 j) ; tandis que les valeurs de t1 pour le
frêne élevé, l’érable sycomore et le chêne sessile occupent une place intermédiaire (respectivement 80 j, 77.1 j et 73.5 j). Le modèle montre également des différences importantes au niveau du seuil d’accumulation requis, Fc, pour permettre le débourrement des bourgeons
selon les espèces. Le chêne, le frêne et le sapin ont des Fc très faibles (< 8.3°C), celui du hêtre est relativement élevé (88.3°C), tandis que celui obtenu pour l’érable et le houx se place dans une position intermédiaire (respectivement 18°C et 17°C). Les paramètres estimés c et d sont également très variables selon les espèces. Le paramètre d qui représente la vitesse d’accumulation de la température varie entre -0.29 et -40 en fonction des essences et le paramètre e qui représente le point d’inflexion de la sigmoïde Rf, varie entre -16.77 et 5.57.
Notons que ce dernier paramètre est anormalement positif chez le hêtre, signifiant que cette espèce aurait une température de mi-réponse négative.
Discussion
Discussion
Le gradient altitudinal utilisé, nous a permis de suivre la phénologie du débourrement de six espèces d’arbres sur un gradient de température extrêmement important comparé aux travaux de la littérature sur ce sujet. Toutefois, dans nos 32 stations étudiées, l’altitude et la température ne sont pas toujours linéairement corrélées : certaines stations étant légèrement plus froides que la normale pour une altitude donnée. Il n’est donc pas surprenant que les dates de débourrement des bourgeons soient moins bien corrélées à l’altitude qu’à la température. Nos données ont, d’une part confirmées que les populations les plus élevées
en altitude étaient les plus tardives pour l’ensemble des espèces, et d’autre part, mis en évidence de larges différences dans la réponse phénologique vis à vis de la température (et de l’altitude) entre les six espèces étudiées. Ces données ont par ailleurs permis d’implémenter un modèle unique pour les six espèces « modèle Uniforc4 », qui explique plus de 92 % de la variance observée pour chacune d’entre elles. L’interprétation des
paramètres du modèle a également révélé des différences de réponse des espèces vis-à-vis de la température et ont démontré que les températures de la fin de l’hiver et printanières (janvier-juin) sont cruciales et suffisent à expliquer de façon optimale l’initiation foliaire des 6 espèces.
Nous observons, à l’échelle de l’espèce, de fortes différences d’amplitude de réponse à la température. Le chêne sessile possédant la plus forte variabilité interpopulationnelle et le hêtre la plus faible. Ces résultats vont à l’encontre d’une étude réalisée par Linkosalo (1999) qui affirme que le début de la période de croissance des arbres répond de manière homogène à la température quelles que soient les espèces. Kramer (1995) a mis en évidence une amplitude de variation sur des individus clonés comparable à nos résultats concernant le hêtre avec une valeur de -2.4 j/°C mais très différentes pour le genre Quercus avec une amplitude de -1.9 j/°C chez le chêne pédonculé (Quercus robur). Des simulations basées sur des modèles phénologiques prévoient un avancement des dates de débourrement allant jusqu’à 6 jours, en fonction de l’espèce, pour une augmentation de la température hivernale de 1°C (Menzel et Fabian 1999). Cette étude concorde parfaitement avec nos résultats. Cependant les études précédentes sont basées sur des gradients latitudinaux et rarement sur des gradients
Discussion
altitudinaux et peu d’études phénologiques ont été réalisées sur les espèces utilisées dans cette étude, hormis pour le hêtre.Le chêne possède la plus grande variabilité de réponse phénologique au niveau interpopulationnel le long du gradient avec plus d’un mois d’écard entre les stations les plus hautes et les plus basses et avec un CV moyen de 16.6 %. Ce fort coefficient de variabilité pourrait s’expliquer soit par des populations très différenciées sur le plan génétique soit par une forte plasticité phénologique de cette espèce. En général les arbres forestiers manifestent une variabilité clinale de la date de débourrement, comme l’ont montré de nombreux tests de provenances. Une différence significative est généralement mis en évidence entre populations originaires d’environnements contrastés du point de vu géographique et climatique (Jermstad et al. 2001, Howe et al. 2003). Chez le chêne sessile, les populations provenant de latitudes plus septentrionales sont toujours plus tardives que celles provenant de latitudes plus méridionales et les populations situées sur des plateaux sont plus précoces que celles situées en plaine (Ducousso et al. 1996). Toutefois ce dernier résultat est basé sur un faible gradient altitudinal de 0 à 400 m, altitude où par ailleurs, des inversions thermiques sont fréquentes. Néanmoins, les forts flux de gènes observées chez les essences forestières, les fortes variances de conditions thermiques à un site donné et la forte plasticité phénologique des arbres à la température (Kramer 1995) laissent supposer que l’hypothèse d’une variation phénologique liée à la génétique entre les populations est insuffisante pour expliquer les patterns phénologiques observés chez beaucoup d’espèces ligneuses (Chuine 2000).
Les valeurs relativement fortes des CV calculés au niveau intrapopulationnel traduisent une variabilité importante du caractère mesuré à l’intérieur des populations sélectionnées. Ces valeurs de CV intrapopulationnel semblent diminuer à mesure que l’altitude augmente. Nous pouvons avancer l’hypothèse que les populations de plaines reçoivent davantage de flux de pollens et de graines que les populations élevées en altitude, ces dernières nettement plus isolées seraient donc plus structurées au niveau génétique. Le houx est une des espèces qui possède la plus grande variabilité du caractère de débourrement des bourgeons au niveau intrapopulationnel le long du gradient altitudinal (jusqu’à 9.2 % à 800 m en vallée de Luz). Cette variabilité peut s’expliquer par l’échantillonnage même de cette espèce. En effet, nous avons sélectionné autant que possible des individus de même taille et situés dans les mêmes conditions lumineuses ; néanmoins pour cette espèce, il a été difficile de trouver des individus de taille similaire dans toutes les stations. Certaines stations possèdent donc des individus de taille variée, plus ou moins exposés à la lumière, ce qui peut influencer directement la
Discussion
phénologie (Seiwa 1999). De plus, il est assez difficile de s’attacher à la variabilité intrapopulationnelle compte tenu du protocole de l’étude. Nous pouvons en effet, déceler des variabilités intrapopulationnelles uniquement supérieures à 10 jours entre deux individus et la taille de la population échantillonnée (10 individus) est probablement trop faible. Ces résultats nous donne néanmoins des tendances qui seront intéressantes à approfondir.Nous n’avons pas observés de relations fortes entre les stratégies d’utilisation de la ressource des espèces et leur phénologie mais nos résultats suggèrent cependant que la stratégie de développement phénologique des espèces pourrait être lié à leurs durées de vie foliaire puisque les espèces sempervirentes comme le houx ou le sapin débourrent plus tardivement que les feuillus chaque altitude.
Les différents stades phénologiques sont facilement observés in situ mais la date où le bourgeon sort de la dormance et la période durant laquelle les températures froides (« chilling ») et les températures chaudes (« forcing ») ont un effet actif sur la croissance du bourgeon ne peuvent être estimés que par modélisation. Les modèles permettent donc d’analyser finement et quantitativement les conditions thermiques qui affectent la phénologie depuis l’entrée en dormance jusqu’au débourrement des bourgeons dans les populations naturelles. Les capteurs micrométéorologiques ayant été posés au début du mois de janvier, nous n’avons pas pu tester les modèles prenant en compte les températures hivernales qui permettent la levée de dormance. Cependant des études de modélisation phénologique ont montré que les modèles qui fonctionnent uniquement avec les températures agissant une fois la dormance levée, c'est-à-dire les températures de la fin de l’hiver et du début du printemps, donnaient les plus forts pourcentages de variance expliquée sur les dates de débourrement des bourgeons (Hunter et Lechowicz 1992, Chuine et al. 1998, 1999). Aussi, le modèle utilisé dans cette présente étude permet d’expliquer une forte variabilité de la variance observée (R²>0.92) avec une forte significativité (p<0.001) ce qui laisse supposer également que les températures automnales et hivernales ont une faible influence sur la date de débourrement des ces espèces. Nous pouvons avancer l’hypothèse que les espèces sélectionnées le long du gradient altitudinal subissent des hivers rigoureux par conséquent, le facteur froid n’est pas limitant pour la levée de dormance contrairement aux températures chaudes de la fin de l’hiver.
Cependant, le modèle utilisé dans cette étude explique de façon optimale les dates de débourrement du hêtre mais avec une relation anormalement négative entre le débourrement
Discussion
des bourgeons et la température. Par ailleurs, le hêtre est une des essences forestières dont la phénologie a été la plus étudiée en Europe, néanmoins les facteurs responsables de l’ouverture de ses bourgeons restent encore controversés. De nombreuses études ont en effet cherché à comprendre l’influence des températures froides et de la photopériode sur le débourrement des bourgeons de cette espèce et leurs conclusions sont contradictoires. Les premières portant sur la phénologie du hêtre concluent que la foliation de cette essence dépend étroitement de la photopériode (Wareing 1953, Lavarenne-Allary 1965). Alors que d’autres, plus récentes montrent par expérimentation en conditions contrôlées que la croissance des bourgeons chez le hêtre est principalement déterminée par les températures hivernales (Falusi et Calamassi 1990). Ils observent également que la photopériode semble interagir avec la température mais considèrent ce paramètre comme négligeable dans le contrôle de la dormance chez cette espèce. Des études utilisant la modélisation confirment également que les températures froides hivernales et la somme des températures printanières suffisent à modéliser avec précision les dates de débourrement de cette essence (Hunter et Lechowicz 1992, Chuine etal. 1999). Kramer (1994) observe même une perte de pouvoir prédictif des modèles de
débourrement, appliqué au hêtre, lorsque la photosensibilité est incluse comme paramètre. Toutefois, une étude récente va à l’encontre de ces précédents résultats, elle confirme à nouveau l’importance de la durée de photopériode pour le débourrement du hêtre et dans une moindre mesure les températures hivernales (Schaber et Badeck 2003). D’une manière générale, les études expérimentales en conditions contrôlées montrent un rôle important de la photopériode sur la croissance des bourgeons alors que les études réalisées in situ accordent un rôle plus important aux températures hivernales et un rôle négligeable de la photopériode. Nos résultats semblent aller dans la même direction que ces dernières études et supposent l’importance des températures froides hivernales dans le déclenchement futur des dates de débourrement de cette espèce traduit par la valeur négative du paramètre de mi réponse à la température estimée par le modèle « UniForc4 ».
Conclusion
Conclusion
Cette étude est la première, à notre connaissance, à caractériser la phénologie d’espèces ligneuses sur un gradient altitudinal aussi marqué. Elle révèle de grandes différences de réponses phénologiques à la température selon les espèces et laisse présager d’un impact important du changement climatique sur la répartition des essences forestières espèces et leur interaction (compétition/facilitation). Notre étude apporte des connaissances nécessaires à la compréhension des changements potentiels d’aire de répartition des espèces sous l’influence du changement climatique. Ce travail pourra contribuer au perfectionnement des modèles de croissance et de répartition future des espèces en y ajoutant un module phénologique.
Toutefois, cette étude ne nous a pas permis de quantifier la plasticité phénologique de nos populations et de nos espèces. Or, les variables climatiques comme la température peuvent constituer une force de sélection importante sur la phénologie tandis que la plasticité phénologique des espèces en réponse au climat peut réduire cette action sélective. La variabilité du caractère phénologique observé à l’échelle de l’espèce peut ainsi dépendre de deux facteurs : de la variabilité intrapopulationnelle et de la variabilité interpopulationnelle liée à la fois à l’effet de l’environnement mais aussi à la structure génétique de la population.
Afin de caractériser la plasticité de la phénologie de ces six espèces, il sera indispensable, en plus du suivi in situ de la phénologie le long du gradient altitudinal de réaliser une expérimentation dans un « même environnement » (« common garden ») pour s’affranchir de celui-ci. Cette expérimentation consistera à récolter un lot de graines de chaque individu dans chaque population et à les semer en pépinière. La plasticité de la phénologie pourra ainsi être quantifiée en comparant l’amplitude de réponse des populations
in situ et des populations soumises à un environnement commun (pépinière).
De plus, il serait également intéressant de quantifier la durée respective de la saison de croissance de chaque espèce en effectuant des suivis de la coloration des feuilles à l’automne prochain. Des mesures microclimatiques devront également être effectuées avant le début de l’hiver pour appréhender le phénomène de levée de dormance (température hivernale) afin d’améliorer les modèles testés.
Bibliographie
Bibliographie
Ahas, R. 1999. Long-term phyto-, ornitho- and ichthyophenological time-series analyses in Estonia. International Journal of Biometeorology 42:119-123.
Ahas, R., A. Aasa, A. Menzel, V. G. Fedotova, and H. Scheifinger. 2002. Changes in European spring phenology. International Journal of Climatology 22:1727-1738. Barry, R. G. 1992. Mountain Weather and Climate., 2nd edition edition. Routledge Publishing
Company, London392.
Cannell, M. G. R., and R. I. Smith. 1983. Thermal time, chill days and prediction of budburst in Picea sitchensis. Journal of Applied Ecology 20:951-963.
Cannell, M. G. R., and R. I. Smith. 1986. Climatic warming, spring budburst and frost damage on trees. Journal of Applied Ecology 23:177-191.
Chmielewski, F. M., and T. Rotzer. 2001. Response of tree phenology to climate change across Europe. Agricultural and Forest Meteorology 108:101-112.
Chuine, I. 2000. A unified model for budburst of trees. Journal of Theoretical Biology
207:337-347.
Chuine, I., and E. G. Beaubien. 2001. Phenology is a major determinant of tree species range. Ecology Letters 4:500-510.
Chuine, I., and P. Cour. 1999. Climatic determinants of budburst seasonality in four temperate-zone tree species. New Phytologist 143:339-349.
Chuine, I., P. Cour, and D. D. Rousseau. 1998. Fitting models predicting dates of flowering of temperate-zone trees using simulated annealing. Plant, Cell and Environment 21:455-466.
Chuine, I., P. Cour, and D. D. Rousseau. 1999. Selecting models to predict the timing of flowering of temperate trees: implications for tree phenology modelling. Plant, Cell and Environment 22: 1-13.
Cornelissen, J. H. C., M. J. A. Werger, P. Castro-Diez, J. W. A. v. Rheenen, and A. P. Rowland. 1997. Foliar nutrients in relation to growth, allocation and leaf traits in seedlings of a wide range of woody plant species and types. Oecologia 111:460-469. Dixon, A. F. G. 1977. Aphid ecology: life-cycles, polymorphism, and population regulation.
Annual Review of Ecology and Systematics 8:329-353.
Ducousso, A., J. P. Guyon, and A. Kremer. 1996. Latitudinal and altitudinal variation of bud burst in western populations of sessile oak (Quercus petraea (Matt.) Liebl.). Annales des Sciences Forestieres 53:775-782.
Fabian, P., and A. Menzel. 1999. Changes in phenology of trees in Europe. EFI Proceedings:43-51.
Falusi, M., and R. Calamassi. 1990. Bud dormancy in beech (Fagus sylvatica L.). Effect of chilling and photoperiod on dormancy release of beech seedlings. Tree Physiology