Royaume du Maroc Université Mohammed V
Faculté de Médecine et de Pharmacie de RABAT
MEMOIRE
MEMOIRE EN VUE DE L4OBTENTION DU DIPLOME NATIONAL DE SPECIALITE MEDICALE EN CARDIOLOGIE
Présenté par :
Dr.
BERROUINE SOUKAINASous la direction :
PR I. FELLATAnnée 2020
Prise en charge interventionnelle
de la fibrillation atriale
I. Introduction ... 5
II. ELEMENTS GENERAUX DE PHYSIOPATHOLOGIE ... 7
1. L’hypothèse focale ... 7
2. L’hypothèse réentrante ... 8
2.1. La « multiple wavelets theory » et le « leading circle » ... 8
2.2. Les rotors ... 8
3. La FA en pratique clinique ... 9
3.1. L’importance des veines pulmonaires ... 9
3.2. Les électrogrammes complexes fractionnés atriaux ... 11
4. Remodelage atrial secondaire à la FA ... 12
4.1. Remodelage électrophysiologique ... 13
4.2. Remodelage structurel ... 14
4.3. Remodelage du système nerveux autonome ... 14
5. Formes génétiques de FA ... 15
6. De la FA paroxystique à la FA persistante ... 15
III. EPIDEMIOLOGIE –DEFINTION ... 21
1. Épidémiologie et facteurs de risque ... 21
2. Définitions ... 21
3. Classification ... 22
4. Prise en charge médicale ... 22
IV. Ablation de la FA ... 23
1. HISTORIQUE DE L’ABLATION DE FA ... 23
1.1. Les premières techniques chirurgicales ... 23
1.2. L’ablation par voie endocavitaire ... 27
2. LES DONNEES ACTUELLES SUR L’ABLATION DE FA ... 36
2.1. La radiofréquence ... 36
2.1.1. Le déroulement de la procédure ... 37
2.1.2. Les définitions consensuelles du succès de l'ablation ... 41
2.2. LA CRYOTHERAPIE ... 41
2.2.1. Mécanismes de la cryothérapie : ... 41
2.2.2. Avantages de la cryothérapie ... 44
2.2.3. Evolution et matériel ... 44
2.3. Indications et résultats ... 51
2.3.1. FA paroxystique : ... 51
2.3.2. FA persistante [106] ... 52
2.3.3. FA + Insuffisant cardiaque ... 53
2.3.4. Ablation du nœud atrio-ventriculaire + pacemaker/défibrillateur ... 54
2.4. Complications ... 56
V. PREVENTION INTERVENTIONNELLE DU RISQUE CARDIO-EMBOLIQUE DE LA FA ... 57 1. Techniques ... 57 2. Indications ... 58 3. Résultats ... 59 Conclusion ... 60 Résumés ... 61 Références ... 63
I. Introduction
La fibrillation atriale (FA) est l’arythmie soutenue la plus fréquente. Elle est responsable d’une augmentation de la morbidité et de la mortalité. En plus des symptômes éventuels, palpitations, dyspnée ou lipothymies, la FA augmente de façon significative le risque d’insuffisance cardiaque, de troubles cognitifs et d’accident embolique [1] . La FA affecte environ 1 à 2% de la population. La prévalence augmente avec l’âge, allant de 0.5% avant 40-50 ans jusqu’à 10% chez les patients octogénaires. [2] Une augmentation significative du nombre de sujets atteints est attendue dans les années à venir compte tenu du vieillissement de la population. [3] L’analyse la cohorte de Framingham, après ajustement pour les principales comorbidités associées, a mis en évidence une majoration du risque de mortalité de 50% chez l’homme et de 90% chez la femme. [4] Différentes cardiopathies ou comorbidités cardio-vasculaires augmentent le risque de FA, telles que l’hypertension artérielle, la coronaropathie, la dysfonction ventriculaire gauche (quelle qu’en soit l’étiologie), les valvulopathies, les cardiopathies congénitales, ou la chirurgie cardiaque. La dilatation atriale, l’étirement (« stretch ») et/ou l’ischémie ont été décrits comme de potentiels mécanismes impliqués. La FA peut également survenir en l’absence de toute cardiopathie sous-jacente et est alors appelée « Lone AF » ou FA sur cœur sain. Par ailleurs, de nombreux facteurs extra-cardiaques prédisposent à la FA tels que la consommation d’alcool, l’hyperthyroïdie, le syndrome d’apnées-hypopnées du sommeil ou l’obésité.
L’histoire naturelle de la FA débute habituellement par des épisodes paroxystiques, définis par des épisodes de courte durée cédant spontanément dans les 7 jours (habituellement dans les premières 48 heures). Certains patients vont présenter des épisodes de FA paroxystique indéfiniment, mais une grande partie d’entre eux va évoluer vers la forme persistante, définie comme des épisodes de FA durant plus de 7 jours et nécessitant une intervention médicale (cardioversion électrique ou médicamenteuse) pour restaurer le rythme sinusal. Si la stratégie de contrôle du rythme échoue ou n’est pas ou plus souhaitée par le patient et/ou le médecin, la FA est définie comme permanente. L’inexorable progression de la FA paroxystique vers la FA persistante puis permanente reflète le remodelage électrophysiologique et structurel progressif survenant au niveau du tissu atrial, rendant les sources de l’arythmie plus stables, facilitant ainsi son caractère soutenu.
Malgré plus de 100 ans de recherche clinique et fondamentale, les mécanismes impliqués dans l’initiation et le maintien de la FA et ceux impliqués dans la transition de la forme paroxystique à la forme persistante sont mal connus. Par ailleurs, les thérapies aujourd’hui
utilisées ne sont pas optimales. De nombreux traitements anti-arythmique ont été testés et ont montré un succès limité dans les cas de FA persistante. A l’opposé, la démonstration par Haissaguerre et al. [5] en 1998 de la responsabilité des foyers veineux pulmonaires dans le déclenchement de la FA a significativement amélioré la prise en charge de la maladie, et aujourd’hui l’isolation veineuse pulmonaire est curative dans près de 70 à
80% des cas de FA paroxystique. [6] Cependant, le succès de l’ablation de la FA persistante et ce d’autant qu’elle est de longue-durée reste limité. Incontestablement, seule une meilleure compréhension des mécanismes impliqués dans le maintien de cette arythmie nous permettrait de concevoir des traitements curatifs et/ou préventifs plus efficaces et spécifiques.
En 2030, l’Union Européenne comptera 14 à 17 millions de patients en fibrillation atriale (FA), avec120 000 à 215 000 nouveaux cas chaque année. L’augmentation de la prévalence de cette arythmie a conduit au développement de nouvelles stratégies thérapeutiques interventionnelles, permettant de prendre en charge les différents aspects de cette maladie. Ainsi, l’ablation endocavitaire ou épicardiquede la FA, par radiofréquence ou cryoablation, permet d’obtenir des résultats supérieurs à un traitement anti-arythmique dans le contrôle des symptômes et l’apparition d’insuffisance cardiaque en cas de FA paroxystique ou persistante. Chez les patients avec une maladie avancée, l’ablation de la jonction atrio-ventriculaire associée à l’implantation d’un stimulateur cardiaque bi-ventriculaire vient de démontrer sa nette supériorité, remettant au gout du jour cette technique. Enfin, en cas de risque hémorragique majeur et de contre-indication aux anticoagulants, l’occlusion de l’auricule gauche par voie percutanée aprouvé son intérêt dans la prévention des accidents emboliques liés à la FA. Le futur verra certainement l’apparition de nouvelles technologies, mais aussi de stratégies personnalisées basées sur une sélection optimale des bons candidats à ces interventions, notamment grâce à l’apport de l’imagerie en amont du geste.
II. ELEMENTS GENERAUX DE
PHYSIOPATHOLOGIE
En 1924, Walter Garrey publiait une revue de la littérature de 36 pages sur la FA dans
Physiological Reviews, [7] contenant plus de 150 références. En 2011, le même journal publiait
à nouveau une revue sur le même thème, signée par Ulrich Schotten, de 61 pages et contenant 656 références. [8] En près d’un siècle de recherche clinique et fondamentale, nos connaissances sur les mécanismes gouvernant la FA ont considérablement avancé. Les travaux cliniques ainsi que les modèles animaux de FA créés au cours des 20 dernières années, [9] parmi lesquels les modèles de stimulation atriale à haute fréquence, [10] ont permis de mieux appréhender la physiopathologie de cette arythmie. D’une façon générale, l’initiation et l’entretien d’une arythmie dépendent de la conjonction de trois facteurs : une gâchette (« triggers »), un substrat propice, et l’action du système nerveux autonome, ensemble connu sous le nom de « Triangle de Coumel ». Comme nous le verrons, les triggers déclenchant la FA proviennent préférentiellement des veines pulmonaires (VP), structures qui sont également impliquées dans le maintien de l’arythmie. Plusieurs théories ont successivement été émises pour expliquer l’initiation et l’entretien de la FA, telles que les ectopies atriales focales, les « leading circles », les rotors ou la théorie des vaguelettes multiples (« multiple wavelets theory »).
Nous allons exposer brièvement ces différentes hypothèses avant d’expliquer le rôle majeur des VP dans la FA.
1. L’hypothèse focale
Les ectopies atriales focales peuvent résulter d’une hyperautomaticité (dépolarisation diastolique spontanée) ou d’activités déclenchées (post-dépolarisations).
Les post-dépolarisations tardives (« Delayed after-depolarizations » = DAD) sont une importante source d’ectopies. Elles sont la conséquence d’une anomalie de l’homéostasie calcique, principalement secondaire à une fuite de calcium (Ca2+) à travers les récepteurs à la ryanodine de type 2 (RyR2). [11]
Les post-dépolarisations précoces (« Early after-depolarizations » = EAD) surviennent quand le potentiel d’action (PA) est excessivement prolongé, permettant aux canaux calciques de sortir de leur état d’inactivation et d’initier un nouveau PA. [12]
Des EAD particulières, dénommées « EAD tardives en phase 3 » (« late phase 3EADs »), survenant lorsque deux situations concomitantes sont présentes, à savoir un raccourcissement du PA et une augmentation de la concentration en calcium intra-cellulaire, ont été décrites comme étant responsables de récurrences précoces de FA après retour à un rythme sinusal. [13]
2. L’hypothèse réentrante
2.1. La « multiple wavelets theory » et le « leading circle »
Très tôt, des constatations expérimentales ont mis en évidence que des phénomènes réentrants étaient impliqués dans l’initiation et le maintien de la FA. [14]
Des modélisations informatiques[15] et des études expérimentales chez l’animal[16] confirmant cette hypothèse ont par la suite été publiées, appuyées également par le succès de la procédure chirurgicale d’ablation de la FA (Cox-Maze) dans laquelle la compartimentalisation des oreillettes empêche les vaguelettes de s’auto-entretenir. [17]
En 1973, Allessie et al. firent une découverte essentielle en démontrant qu’une réentrée pouvait s’auto-entretenir en l’absence d’obstacle anatomique. [18]
La principale caractéristique de ce principe dénomé « leading circle » est la présence d’un gap excitable minime, rendant l’arrêt de la réentrée par stimulation prématurée improbable. Par ailleurs, de minimes changements dans les propriétés électrophysiologiques du tissu auront des conséquences importantes dans la dynamique de la réentrée, favorisant alors son arrêt spontané. Le nombre de « leading circles » pouvant coexister dans un même tissu dépend de la taille de celui-ci et de la longueur d’onde des circuits. Ainsi, la dilatation atriale et le raccourcissement de la longueur d’onde augmentent le nombre de « leading circles » pouvant exister au sein de l’oreillette.
Cette théorie a prévalu pendant une vingtaine d’années jusqu’à ce qu’on démontre qu’elle ne pouvait pleinement expliquer le maintien de la FA. [19]
2.2.
Les rotors
A l’époque où le concept de « leading circle » émergeait, une nouvelle forme de réentrée était théorisée, à savoir les rotors. [20] Un rotor est défini comme une réentrée fonctionnelle organisée autour d’un core central (Figure 1). L’onde bidimensionnelle résultant de cette réentrée est appelée une « onde spirale » (« spiral wave »). Son équivalent tridimensionnel est une « scroll wave » (ou « onde rouleau »).
Figure 1: Rotor visualisé lors d’une expérience d’optical mapping, avec cartographie de phase.
Image 1 : Visualisation de la paroi latérale de l’oreillette gauche (OG) qui est cartographiée pendant l’expérience; une sonde de stimulation visible à gauche de l’image permet de stimuler à haute fréquence et déclencher la FA. Images 2 à 6 : Visualisation d’un rotor stable tournant dans le sens horaire.
3. La FA en pratique clinique
3.1. L’importance des veines pulmonaires
L’initiation d’un épisode de FA nécessite une gâchette (« trigger ») qui engendre l’arythmie et un substrat prédisposé pour maintenir l’arythmie. Chez l’homme, des nombreux travaux ont démontré l’importance des VP dans l’initiation de la FA.
Le rôle essentiel des VP a été originellement décrit par Haissaguerre et al. en 1998. [5] Dans cette étude, les auteurs ont démontré que les VP étaient une source majeure d’ectopies initiant des épisodes de FA paroxystique, et pouvant être la cible des thérapies ablatives. Cette découverte a mis en évidence l’importance des VP dans le déclenchement de la FA et particulièrement celle des manchons de tissu musculaire pénétrant les VP (Figure 2).
Dans une étude autopsique, Hassink et al. ont retrouvé ces extensions myocardiques chez 100% des patients aux antécédents de FA, mais également chez 85% des patients n’en ayant jamais présenté. [21] Les patients avec un antécédent de FA présentaient cependant plus d’hétérogénéité dans l’architecture des manchons myocytaires, plus de myocytes hypertrophiques et plus de fibrose. Ces extensions myocardiques s’organisent en un réseau complexe à la surface externe des VP, séparées de la couche de cellules musculaires lisses veineuses par un tissus fibro-adipeux. Les caractéristiques anatomiques des manchons (étendue en longueur et en circonférence) sont différentes à l’échelon inter-individuel mais également entre chacune des VP d’un même patient.
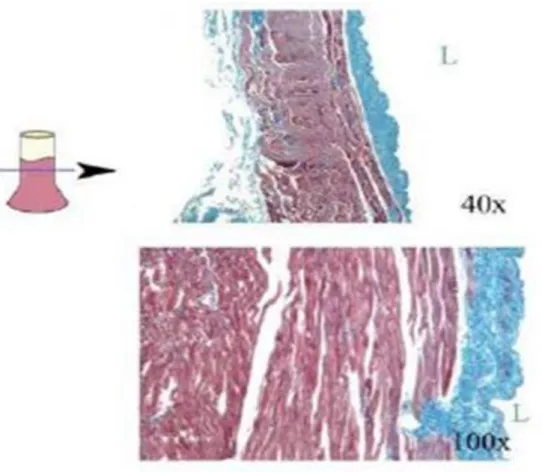
Figure 2: Manchons myocytaires veineux pulmonaires. Section d’une VP de chien (coloration au trichrome de Masson). Une organisation hétérogène des fibres musculaires est visible. La face endoluminale de la VP est marquée par un « L ».
Modifié d’après Verheule et al et Schotten et al [8]
Les myocytes des VP ont des propriétés électrophysiologiques distinctes : leur potentiel transmembranaire de repos est moins négatif que celui du tissu atrial environnant (#- 70mV), la densité des courants ICaL et IK1 réduite, alors que celle d’IKr et d’IKs est Augmentée [22].
D’autre part, la densité en connexine-40 est diminuée. [23] Une hétérogénéité dans le potentiel trans-membranaire de repos, la durée du PA (qui est plus courte que celle du tissu atrial) et la période réfractaire effective cellulaire entre la partie proximale et distale des manchons mycoytaires a également été décrite, expliquant le rôle essentiel de cette région dans l’initiation et le maintien de la FA. [24]
Le mécanisme exact du caractère pro-arythmique des VP est inconnu. Les différents mécanismes décrits précédemment (hyperautomaticité, micro-réentrées et activités déclenchées) sont probablement en cause. Les caractéristiques propres des myocytes veineux pulmonaires en association avec l’architecture chaotique des manchons myocytaires expliquent très certainement le fait qu’elles soient le siège d’ectopies initiant la FA ; l’anisotropie et l’hétérogénéité de conduction locales permettant quant-à-elles de perpétuer l’arythmie par un mécanisme de « sink-source mismatch ». [25] Le stretch atrial a été démontré comme étant responsable d’une organisation des ondes de dépolarisation provenant de la jonction entre la partie supérieure des VP et de l’OG, mécanisme physiopathologique expliquant probablement pourquoi les patients ayant une dilatation atriale et une augmentation de la pression atriale ont un risque plus élevé de développer des arythmies.54 Hormis les VP, d’autres structures ont été décrites comme étant responsables de l’initiation et du maintien de la FA. [26]
La veine cave supérieure (VCS) est probablement la plus fréquente, responsable chez 37% des patients présentant des triggers extra-veineux pulmonaires. Les autres sources d’ectopies sont le ligament de Marshall (reliquat de la VCS gauche), le sinus coronaire, la crista terminalis, et la veine cave inférieure. L’ensemble de ces foyers peut être traité par les méthodes d’ablation.
3.2. Les électrogrammes complexes fractionnés atriaux
Les électrogrammes complexes atriaux fractionnés (complex fractionnated atrial electrograms = CFAE) sont des électrogrammes endocavitaires enregistrés dans l’oreillette au cours d’un épisode de FA présentant un fractionnement important , des cycles courts(<120ms) et/ou un bas-voltage (0.06 à 0.25 mV) et des potentiels multiples. [27]
Nademanee et al. ont été les premiers à cibler ces potentiels via l’ablation par radiofréquence (RF) chez les patients présentant une FA réfractaire au traitement anti-arythmique, démontrant alors un taux d’arrêt per-procédure de la FA élevé et un faible taux de récidive au cours du suivi[28].
Une récente méta-analyse des principales études ayant évalué l’efficacité de l’ablation des CFAE en complément d’une isolation veineuse pulmonaire standard a démontré une
augmentation du taux de persistance du rythme sinusal chez les patients présentant une FA non-paroxystique, après une seule procédure sans adjonction d’anti-arythmiques. [29] A l’opposé, les patients présentant une FA paroxystique ne semblent pas tirer bénéfice de cette stratégie.
Bien que ces résultats soient prometteurs, une approche plus mécanistique est nécessaire afin d’appréhender au mieux ces potentiels, mais à ce jour, malgré de nombreux travaux, leur réelle implication dans le maintien de la FA est inconnue.
La localisation des plexi-ganglionnaires dans l’OG concorde avec celle où sont enregistrés des CFAE, [30] et il a été proposé que ces derniers pouvaient en fait refléter l’activation du système nerveux autonome. Cependant, tout comme l’ablation des CFAE, l’ablation des plexi- ganglionnaire est controversée et n’a pas démontré de réel bénéfice sur le maintien du rythme sinusal à long terme. [31]
La limite majeure concernant la cartographie et l’ablation des CFAE est liée à leur définition même. En effet, la définition de la Heart Rhythm Society, de l’European Heart Rhythm Association et de l’European Cardiac Arrhythmias Society (HRS/EHRA/ECAS) inclus différents paramètres objectifs difficiles à utiliser au quotidien dans un laboratoire d’électrophysiologie, et la plupart des médecins utilisent une appréciation visuelle totalement subjective afin de définir ce qui est ou non un potentiel fragmenté. Il a ainsi été récemment démontré que le pourcentage de sites considérés comme des CFAE variait selon les critères choisis pour les définir. L’utilisation d’algorithmes de détection automatique intégrés dans les systèmes de cartographie tridimensionnelle a permis de faciliter l’identification de ces potentiels, [32] mais de nouveaux travaux de recherche seront nécessaires afin de savoir si ces sites sont ou non des régions actives dans le maintien de la FA et donc de potentielles cibles de l’ablation.
4. Remodelage atrial secondaire à la FA
Des épisodes courts de FA peuvent survenir sur des oreillettes saines. Cependant, une modification significative des propriétés électrophysiologiques et structurelles des oreillettes est nécessaire afin de soutenir des épisodes sur une durée prolongée. Ce mécanisme, appelé «remodelage atrial » est une conséquence directe de l’arythmie et favorise son entretien.
Depuis le milieu des années 1990, de nombreuses équipes ont étudié les différents éléments impliqués dans le remodelage atrial en utilisant des modèles animaux. [10]
4.1. Remodelage électrophysiologique
L’activation rapide des myocytes atriaux en FA va provoquer une augmentation de la concentration intra-cellulaire en Ca2+. Afin de limiter la surcharge calcique, les cardiomyocytes atriaux vont déclencher des mécanismes protecteurs d’action rapide et retardée. Ces altérations du métabolisme calcique intra-cellulaire sont également responsables de la dysfonction contractile observée après récupération du rythme sinusal.
La conséquence immédiate de la diminution de ICaL est la réduction de la durée du PA et de la période réfractaire effective de l’oreillette, diminuant alors la longueur d’onde et facilitant la présence de multiples circuits de réentrée. L’augmentation du courant potassique à rectification entrante (IK1) due en partie à une augmentation de sa sous-unité Kir2.1 est également impliquée dans le raccourcissement de la durée du PA. [33] Cette augmentation est probablement la conséquence d’une réduction des micro-ARN inhibiteurs miR-1 et miR-26. [34] L’augmentation de la densité d’IK1 va accélérer la fréquence de rotation des rotors et accroitre leur stabilité, ainsi que favoriser l’hyperexcitabilité cellulaire par l’hyperpolarisation membranaire et la majoration de la disponibilité du courant sodique. Un gradient d’IK1 gauche-droit a récemment été décrit et explique sans doute en partie la présence de DFmax plus élevées dans l’OG. [35] La densité du courant potassique à rectification entrante constitutivement actif et dépendant de l’acétylcholine (IKAch) est également augmentée et contribue au raccourcissement du PA. [36] Les mécanismes impliqués dans les modifications de densité d’
IKAch sont une augmentation de l’activité de la protéine kinase activatrice PKC_ et une
dimuntion de l’activité inhibitrice de la PKC.[37] De façon similaire à IK1, un gradient gauche droite d’IKAch et des niveaux élevés d’ARNm de Kir3.4 ont été mis en évidence chez les moutons comme chez l’homme. Ceci explique également l’effet plus prononcé de l’acétylcholine sur l’OG comparé à l’OD. [38] En résumé, au-delà du rôle des obstacles anatomiques (tels que le faisceau de Bachmann) dans la fragmentation des ondes de fibrillation et dans la diminution de la fréquence d’activation de l’OG vers l’OD, des propriétés éléctrophysiologiques distinctes concernant les canaux potassiques expliquent le gradient de DF observé chez l’animal comme chez l’homme. [38]
Différents modèles animaux ont mis en évidence une diminution du courant sodique entrant INa, [39] mais les résultats publiés chez l’homme sont discordants, retrouvant tantôt une diminution ou aucune modification81 de la densité de ce courant. Comme décrit précédemment, l’augmentation du courant IK1 va entrainer une cinétique de récupération de l’inactivation plus rapide ainsi qu’une augmentation de la disponibilité des canaux sodiques.
Les autres modifications ioniques induites par la FA incluent : une diminution du courant potassique sortant transitoire et à rectification retardée (Ito et IKur) [40] et une augmentation du courant INCX (échangeur sodium potassium).84 Les données concernant IKr et IKs sont rares et controversées, mettant en évidence soit une diminution, soit aucun changement, selon le modèle animal étudié (stimulation atriale rapide ou FA associée à de l’insuffisance cardiaque). [41]
4.2. Remodelage structurel
La seconde forme de remodelage survenant après le passage en FA est d’ordre structurel, s’exprimant principalement par l’apparition de fibrose et d’un remodelage génique/protéique des cardiomyocytes.
La fibrose atriale est une des principales conséquences structurelles de la FA. Les fibroblastes cardiaques, en se transformant en myofibroblastes sont à l’origine du remodelage du tissu conjonctif, [42] puisque produisant les protéines de la matrice extra-cellulaire ainsi que des cytokines affectant les propriétés des cardiomyocytes. [43] Les myofibroblastes peuvent se connecter aux cardiomyocytes et affecter leurs propriétés électrophysiologiques. [44] les modifications de couplage cardiomyocytes-myofibroblastes, associées à la présence d’obstacles anatomiques représentés par la fibrose entrainent une anisotropie de conduction, favorisant le maintien des réentrées et la perpétuation de la FA. Ce remodelage est une cible pour de potentielles interventions thérapeutiques.
4.3. Remodelage du système nerveux autonome
Des terminaisons nerveuses adrénergiques et cholinergiques sont présentes à forte densité autour des VP et de l’OG, principalement dans les 5mm autour de la jonction VPOG[45].
Le système nerveux autonome cardiaque intrinsèque est un important acteur dans la FA[46]. Les systèmes sympathiques et parasympathiques favorisent l’initiation et le maintien de l’arythmie, respectivement par la genèse de DAD .
Un remodelage concernant ces 2 systèmes survient au cours de la FA, matérialisé par l’augmentation du nombre de terminaisons nerveuses sur la paroi postérieure de l’OG et au pourtour des VP. [47], [48].
Les interventions modulant l’activité du système nerveux autonome, qu’elles soient pharmacologiques ou non, pourraient constituer d’importantes stratégies thérapeutiques pour prévenir l’initiation de l’arythmie ou en empêcher le maintien.
Chez un groupe de patients présentant des épisodes de FA déclenchés par un mécanisme vagal, l’ablation des plexi ganglionnaires atriaux droits seule (sans isolation des VP) a permis d’obtenir un taux de maintien du rythme sinusal de 70% à 18 mois. De nouvelles études seront nécessaires afin de connaître l’exacte localisation des plexi ganglionnaire atriaux impliqués dans la FA et de déterminer le type de patients/d’arythmie qui pourrait tirer bénéfice d’une ablation ciblée.
5. Formes génétiques de FA
Des causes génétiques et développementales [49] ont récemment été décrites comme étant à l’origine de certains types de FA. Une prédisposition génétique a été mise en évidence dans l’étude de Framingham mettant en évidence une augmentation de 85% du risque d’apparition de FA chez les patients dont au moins un des parents était atteint. [50]
De nombreuses mutations monogéniques ainsi que des polymorphismes favorisent la survenue de la FA. Cependant, dans la grande majorité des cas de FA familiale, aucune mutation causale n’est mise en évidence, ce qui sous-entend que d’autres gènes sont impliqués.
6. De la FA paroxystique à la FA persistante
L’histoire de la FA évolue le plus souvent sur de nombreuses années, débutant volontiers par de brefs épisodes paroxystiques devenant plus fréquents et plus longs au fil du temps jusqu’à ce que des formes soutenues apparaissent. Le registre Allemand AFNET (Registry of the German competence NETwork on Atrial Fibrillation) a inclus 9852 patients entre 2004 et 2006 en les différenciant selon le type de FA présentée (1er épisode, FA paroxystique, persistante ou permanente)[51].
La présence de comorbidités, définies par l’âge supérieur à 75 ans, l’hypertension artérielle, le diabète, la présence d’une cardiomyopathie, l’insuffisance cardiaque et les valvulopathies (ou antécédents de remplacements valvulaires) étaient notées. La Figure 3 montre que la proportion de patients en FA permanente augmente linéairement en fonction de la présence de comorbidités, alors que parallèlement la proportion de patients en FA paroxystique décroit. De façon surprenante, la proportion de patients en FA persistante reste stable, aux alentours de 15 à 20%, donnée suggérant que cette forme ne représente probablement qu’un « état de transition » entre la FA paroxystique et la FA permanente.
Figure 3: Evolution de la proportion du type de FA en fonction du nombre de comorbidités concomitantes, parmi lesquelles l’âge _ 75 ans, l’hypertension artérielle, le
diabète, la présence d’une cardiomyopathie, l’insuffisance cardiaque et les valvulopathies ou antécédents de remplacements valvulaires. D’après Nabauer et al,
Europace, 2009.
L’Euro Heart Survey sur la FA a inclus 5333 patients entre 2003 et 2004, pour
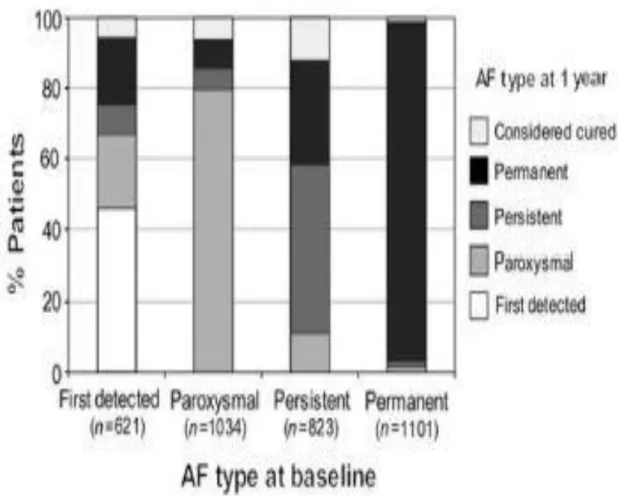
Les quels un suivi à 1 an était prévu afin de déterminer leur statut clinique et d’analyser le taux de récidive et de progression de la FA. [52] Dans cette intéressante sous-étude, les auteurs ont montré que 46% des patients ayant présenté un premier épisode de FA n’ont jamais eu de récidive au cours de l’année de suivi (Figure 4). Après 1 an de suivi, environ 20% présentaient une réelle histoire de FA paroxystique, 10% une FA persistante et 20% étaient en
FA permanente.
Les patients présentant quant-à-eux à l’inclusion une FA paroxystique n’ont pour la majorité (80%) pas progressé vers des formes plus soutenues ; 30% des patients en FA persistante ont progressé vers la forme permanente alors que, logiquement, ceux en FA permanente sont globalement (96%) restés dans cette forme de la maladie. Ainsi, parmi les patients présentant un premier accès de FA sans cause aiguë réversible, près de la moitié ne récidiverons jamais alors que l’autre moitié s’inscrira dans une réelle histoire de FA.
Figure 4: Evolution du type de FA après 1 an de suivi, selon le type de FA à l’inclusion, chez les patients inclus dans l’Euro Heart Survey on Atrial Fibrillation. D’après
Nieuwlaat et al, Eur Heart J, 2008.
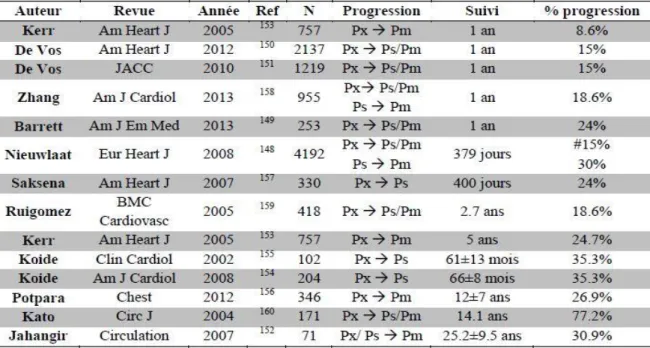
De nombreuses autres études, résumées dans le Tableau 1, ont analysé le risque de progression de la FA au fil du temps [52]: celui-ci apparait extrêmement variable, dépendant principalement de la méthode diagnostique utilisée lors du suivi (ECG de repos, Holter ECG, enregistreur d’évènements, …), allant de 8.6 à 24% à 1 an [52], [53] et atteignant près de 30% dans les études avec un suivi prolongé. Saskena et al, en utilisant une méthode plus sensible (interrogation des mémoires de stimulateurs cardiaques chez des patients implantés pour une indication anti-bradycardique standard) ont retrouvé un pourcentage de progression de la FA paroxystique vers la FA persistante élevé de 24%, survenant à un intervalle moyen de 147±149 jours.157 De façon intéressante, les auteurs retrouvaient une augmentation significative de la charge et de la durée des épisodes chez les patients progressant vers des formes plus soutenues de l’arythmie par rapport à ceux demeurant en FA paroxystique (pente d’augmentation 14s/jour
vs. 0s/jour, p<0.001). La raison pour laquelle certains patients voient leur charge en arythmie
augmenter au fil du temps et d’autres non est pour le moment inconnue.
De nombreux facteurs prédictifs de progression vers des formes soutenues de FA ont été mis en évidence, qu’ils soient :
- Cliniques : âge, [52] hypertension artérielle, [51]: antécédent d’accident vasculaire ischémique transitoire ou constitué, bronchopneumopathie chronique obstructive (BPCO), stratégie de contrôle de la fréquence chez les patients en FA paroxystique, cardiomyopathie/insuffisance cardiaque, consommation d’alcool modérée [53],
- Structurels : dilatation atriale, [54] valvulopathies mitrales ou aortiques [59], - Electrocardiographiques : durée et dispersion de l’onde P.
Un score permettant d’identifier les patients à haut risque de transition de la forme paroxystique aux formes persistante/permanente a récemment été décrit. Ce score, dénommé « HATCH score », n’inclut que des paramètres cliniques qui se voient pondérés d’1 ou 2 points (score total allant de 0 à 7 pts) : l’hypertension artérielle (1 pt), l’âge > 75 ans (1 pt), un antécédent d’accident vasculaire ischémique transitoire ou constitué (2 pts), la BPCO (1pt) et la présence d’une insuffisance cardiaque (2 pts). Dans cette étude, le pourcentage de progression moyen de 15% à 1 an variait notablement en fonction du score, puisqu’avoisinant respectivement 6%, 10%, 24% et 37% pour les patients à risques très faible (score à 0), faible (score à 1), modéré (score de 2 à 4) et élevé (score de 5 à 7). Ce score, très récemment introduit, n’a pas encore pu être évalué dans des études de suivi à long-terme, mais uniquement dans 2 études rétrospectives qui ne lui ont retrouvé cependant qu’une valeur prédictive limitée sur le risque de transition. [56].
Certains patients présentant une réelle histoire de FA paroxystique sur cœur sain (« lone atrial fibrillation ») sans aucun des facteurs cliniques composant le HATCH score et sans aucun des facteurs échocardiographiques ou électrocardiographiques cités précédemment ont tout de même un risque de voir leur arythmie évoluer spontanément ou malgré la mise en place d’un traitement anti-arythmique, ce qui sous-entend que le remodelage
Électrophysiologique et structurel à l’origine de la transition est un processus complexe faisant intervenir d’autres paramètres. Il est tout de même important de noter que la FA peut avoir une histoire naturelle différente, avec des formes paroxystiques fréquentes n’évoluant jamais vers des formes plus soutenues ou des formes d’emblée permanentes.
Sur le plan physiopathologique, l’évolution de la forme paroxystique vers la forme persistante puis permanente de la FA reflète la progression du remodelage électrophysiologique et structural atrial consécutif à l’arythmie et parfois aggravé par des
Facteurs associés (cardiopathie sous-jacente, comorbidités, …). En 1995, Carlos Morill et Maurits Wijffels ont développé des modèles animaux de FA, respectivement chez le chien et la chèvre, qui ont permis d’innombrables avancées dans la compréhension de la physiopathologie de cette arythmie. Dans l’étude de Wijffels et al, [11]. Les auteurs ont implanté des chèvres avec des stimulateurs cardiaques leur permettant de stimuler l’oreillette à haute fréquence (50 Hz) et d’induire des épisodes de FA. Ces épisodes, initialement de courte durée (6±3 secondes) devenaient progressivement de plus en plus longs jusqu’à dépasser une semaine (7.1±4.8 jours). Le cycle moyen de la FA quant-à-lui décroissait au cours des 24 premières heures de l’arythmie de 145±18 à 108±8 ms parallèlement au raccourcissement de la période réfractaire atriale effective et à une perte de son adaptation à l’augmentation de fréquence. L’ensemble de ces modifications électrophysiolgiques était complètement réversibles après 1 semaine passée en rythme sinusal. Du titre de cette étude est né le concept de « atrial fibrillation begets atrial fibrillation » (la FA engendre la FA), illustrant l’inexorable progression de l’arythmie vers des formes soutenues.
Sur le plan thérapeutique, la progression de la FA de la forme paroxystique à la forme persistante puis persistante de longue durée a des conséquences importantes. En effet, au stade le plus précoce, lorsque la FA est paroxystique, celle-ci dépend principalement des « triggers » représentés par les extrasystoles atriales provenant des VP, alors qu’à mesure que la charge en arythmie augmente, le remodelage structurel atrial prend de l’importance. Ceci correspond à la transformation d’une maladie dépendant du « trigger » à une maladie dépendant du substrat. Cela complexifie la stratégie thérapeutique médicamenteuse, mais également les procédures d’ablation endocavitaires. En cas de FA paroxystique, l’isolation veineuse pulmonaire seule permet de prévenir les récidives chez près de 80% des patients. [6]
Au contraire, en cas de FA persistante, la procédure est plus complexe, et doit associer à l’isolation veineuse pulmonaire des lignes complémentaires (toit, isthme mitral, …), l’isolation de foyers extra-veineux (VCS, sinus coronaire, auricule gauche) ou l’ablation d’autres cibles potentielles. Ces procédures, complexes et fastidieuses, ont une efficacité limitée comme en témoigne le faible pourcentage de patients en rythme sinusal après un suivi à moyen-terme. [57] Pour le moment, nous ne disposons que de peu de données sur les facteurs permettant de ralentir la progression de la FA. Alors que l’étude AFFIRM a démontré que la stratégie de contrôle pharmacologique du rythme ne diminuait pas la mortalité des patients en FA, [58] quelques études ont établi qu’elle réduisait le risque de transition vers des formes plus soutenues de l’arythmie à 1 an de suivi par rapport à une stratégie de contrôle de la fréquence (5.8% vs. 27.6%, p<0.001 dans l’étude de Zhang et al et 11 vs. 26% dans l’étude de De Vos et al150).
Deux études récentes ont également confirmé de façon rétrospective qu’une stratégie de contrôle du rythme par ablation diminuait le risque de progression de la FA paroxystique vers des formes soutenues [59].
L’étude prospective multicentrique et contrôlée ATTEST (Atrial Fibrillation Progression Trial, numéro Clinicaltrials.gov NCT01570361) débutée en février 2012 a pour but de valider cette stratégie, à savoir si l’ablation par RF de la FA paroxystique retarde la progression vers des formes soutenues, par rapport à une stratégie purement médicale de contrôle du rythme ou de la fréquence. Un total de 330 patients seront inclus et les résultats attendus en fin d’année 2016. Pouvoir éviter la transition de la FA vers des formes plus soutenues ou à défaut, prédire dans quel délai les patients en FA paroxystique vont évoluer vers des formes/persistantes ou permanentes permettrait d’améliorer la prise en charge de ces patients, diminuant ainsi la morbidité (qualité de vie, symptômes, complications) et la mortalité associée à l’arythmie.
Tableau 1 : prévalence de la progression de la FA vers des formes soutenues.
III. EPIDEMIOLOGIE –DEFINTION
1. Épidémiologie et facteurs de risque
La fibrillation atriale (FA) est l’arythmie la plus fréquente, avec une prévalence estimée en 2010 à 33,5 millions de personnes (3 % de la population mondiale) [60–63]. On estime aujourd’hui qu’en Europe et aux états Unis, un adulte d’âge moyen sur quatre développera une FA au cours de sa vie. En 2030, l’UE comptera 14 à 17 millions de patients en FA, avec 120 000 à 215 000 nouveaux cas chaque année [64]. Bien entendu, le vieillissement de la population est considéré comme l’une des explications majeures à ce phénomène pandémique. Les autres facteurs de risque de FA les plus fréquents sont une hypertension artérielle, une coronaropathie, une insuffisance cardiaque, une valvulopathie sous-jacente, un diabète, une obésité, un syndrome d’apnée du sommeil, ou une insuffisance rénale chronique. Il existe également quelques formes familiales sporadiques. Les complications liées à cette arythmie sont nombreuses et fréquentes, au premier rang desquelles les évènements thrombo-emboliques, qui ont un impact majeur sur la morbidité. Ainsi, on estime que la FA est responsable d’un quart des accidents vasculaires cérébraux ischémiques (AVC), et qu’elle multiplie par cinq le risque d’AVC [61]. Il existe parallèlement un sur risque d’insuffisance cardiaque à long terme (FEVG préservée ou altérée) responsable d’une surmortalité [64]. Enfin, on observe fréquemment chez les patients souffrant de FA une altération de la qualité de vie, ainsi qu’un taux d’hospitalisations plus élevé que chez les patients en rythme sinusal (10 à 40 % des patients en FA sont hospitalisés au moins une fois dans l’année). Il a été décrit également une association entre FA et déclin cognitif ainsi que de risque de démence vasculaire (même chez les patients traités par anticoagulants) [64].
2. Définitions
La FA est définie dans les recommandations de la société européenne de cardiologie (ESC) comme une arythmie cardiaque présentant les caractéristiques suivantes [64] :
•l’électrocardiogramme de surface (ECG) montre une irrégularité « absolue » des intervalles RR (les intervalles RR ne doivent pas se répéter selon un cycle identifiable) •absence d’onde P individualisable sur l’ECG de surface.
•la durée du cycle atrial (intervalle entre deux activations atriales), s’il est visible, est variable et inférieur à 200 ms.
3. Classification
Historiquement, on parlait de FA aigue et chronique pour décrire la temporalité de la FA. En 2012, une nouvelle classification a été introduite par la société européenne de cardiologie (ESC), révisée en 2016 [64,64] :
-Premier diagnostic de FA : premier épisode connu, indépendamment de sa durée, de sa
sévérité ou du caractère symptomatique.
-Paroxystique : FA se terminant spontanément ou consécutivement à une intervention
médicale, et durant moins de 7 jours (la plupart du temps moins de 48 heures). Des épisodes récurrents sont possibles avec une périodicité très variable d’un patient à l’autre
-Persistante : FA persistant après 7 jours, pour laquelle une stratégie de maintien du
rythme sinusal est envisagée. Les épisodes se terminant par cardioversion chimique ou électrique sont inclus dans la définition, si le retour en rythme sinusal est obtenu plus de7 jours après le début de la FA.
-Persistante de longue durée : FA persistante de plus d’un an, pour laquelle une stratégie de maintien du rythme sinusal est envisagée.
-FA permanente : FA acceptée par le patient et son médecin. Par définition, seule une
stratégie de contrôle de la fréquence cardiaque est comprise dans cette définition. En cas de tentative de restauration du rythme sinusal, le patient rebascule dans la catégorie des FA persistantes (de longue durée le plus souvent).
4. Prise en charge médicale
Celle-ci a pour but de prévenir les complications de la FA. Ainsi, le risque ischémique cardio-embolique, actuellement estimé avec le score CHA2DS2-Vasc (pouvant être pondéré avec le risque hémorragique du patient), est le plus souvent prévenu par un traitement anticoagulant. L’avènement des anticoagulants oraux direct, désormais positionnés en première intention dans les recommandations européennes comme franc¸ aises, a simplifié la gestion de ce risque, avec une sécurité d’usage souvent supérieure à celle des AVK. Le risque d’insuffisance cardiaque et de gêne fonctionnelle est lui plus difficile à prévenir, car moins prévisible. De manière non intuitive, il n’est pas prouvé qu’une stratégie de contrôle du rythme (retour en rythme sinusal) soit supérieure à une stratégie de contrôle de la fréquence cardiaque (patient en FA avec des médicaments ralentisseurs) [65]. En effet, le bénéfice hémodynamique du retour en rythme sinusal (quand il est possible, les anti-arythmiques et le choc électrique externe ou interne ayant un taux de succès de l’ordre de 20 à 50 % à moyen terme) est
contrebalancé par les effets secondaires de ces thérapies. Ils exposent en effet à des complications pour un tiers des patients, parfois sévères propres aux molécules comme le sotalol (1 % de torsade de pointe) ou l’amiodarone (dysthyroïdie, pneumopathie interstitielle voire fibrose pulmonaire, photosensibilisation, dépôts cornéens, etc.).Une méta-analyse de 2015 portant sur 59 études (21 305 patients) retrouvait une augmentation de la mortalité associée à la prescrip-tion des anti-arythmiques de classe IA (disopyramide, quinidine,sotalol), et une augmentation des risques d’arythmie ventriculaire pour tous les anti-arythmiques (sauf les bétabloquants et l’amiodarone) [66]. Il apparait donc évident que le maintien du rythme sinusal est préférable en particulier à l’aide d’une stratégie non médicamenteuse. Dans ce contexte, des stratégies interventionnelles ont été développées, afin d’améliorer les taux de succès de contrôle du rythme tout en limitant les risques induits par les traitements médicamenteux anti arythmiques et anticoagulants.
IV. Ablation de la FA
1. HISTORIQUE DE L’ABLATION DE FA
1.1. Les premières techniques chirurgicales
Les premières publications faisant état d’une intervention sur le substrat responsable de la FA sont l’œuvre de chirurgiens cardiaques. Le but était de créer une cicatrice (fibrose) par le biais d’une section suivie de suture « cut and sew » afin d’obtenir un bloc électrique.
- Les incisions au bistouri La première méthode d’isolation de l’oreillette gauche était basée sur le concept de la masse critique. En 1980, Williams et Al publiaient une étude menée sur 10 chiens, où ils excluaient la majorité des foyers arythmogènes. La systole atriale droite était préservée, ainsi que la conduction de l’influx sinusal aux ventricules. Malheureusement, ce n’était pas le cas de la systole de l’OG. Cette méthode fut appliquée chez l’homme par Graffigna, chez des patients en FA permanente subissant une chirurgie valvulaire. Il rapporta un taux de succès 52 immédiat de 81% avec un maintien après quelques mois. Malheureusement, compte tenu de la perte de la systole de l’OG, le risque thromboembolique persistait.
Cox et al. entreprirent en 1993 de réduire et de compartimenter les deux oreillettes lors d’une procédure appelée intervention de « MAZE » [67] (labyrinthe). Elle visait à interrompre les circuits de réentrées en créant autour d’une voie principale de multiples lésions linéaires qui délimitaient des impasses électriques, fragmentant le tissu auriculaire en plusieurs petites
surfaces. Il devenait alors théoriquement impossible pour l’influx de revenir à son point de départ. Cette opération dont il existe trois versions offre un taux de succès proche de 80 % sans AA et proche de 100% avec (recul de plus de trois mois). La dernière version (figure 5) est devenue la méthode chirurgicale de référence [68] en ajout aux chirurgies coronariennes[69] et valvulaires[70] effectuées chez des patients en FA avec également de très bons résultats (respectivement 98 et 96% de succès avec plus de 5 ans de suivi). Mais cette méthode reste complexe et lourde à entreprendre puisqu’elle nécessite de recourir à une sternotomie. Plus récemment, une variante simplifiée et surtout moins invasive110 a été proposée pour les FA paroxystiques : « mini-MAZE » (figure 6). Des aménagements ont été proposés comme la réduction atriale basée sur le fait que la dilatation de l’OG était un facteur de récidive post procédurale.
Figure 6: Schématisation de la procédure de MINI-MAZE
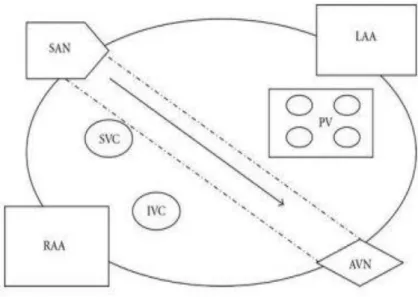
En 1985 Guiraudon et son équipe, autres précurseurs, élaborent une alternative chirurgicale appelée opération du « Corridor » [71] et qui se limite à la compartimentation de l’oreillette droite (OD) (figure 7). Il ne s’agit plus de réduire la masse critique des oreillettes mais plutôt de « guider » l’activité électrique du nœud sinusal vers le ventricule. Cette technique moins lourde excluait la quasi-totalité des oreillettes, impliquant la perte hémodynamique de la systole atriale. Le taux de restauration de rythme sinusal était initialement de près de 85 % des cas et se maintenait à 69 % à 5 ans sans AA [72]. Malheureusement, l’OG continuait toujours à fibriller, ce qui continuait à exposer le patient aux risques thromboemboliques.
Figure 7: Schématisation de la méthode du corridor par Guiraudon
-Cryolésions et radiofréquence : première utilisation de la cryochirurgie date de 1994
où une équipe de chirurgiens a proposé une triple compartimentation de l’oreillette gauche grâce à cette méthode chez 22 patients opérés de la valve mitrale. Cette procédure a permis un maintien du rythme sinusal à 6 mois dans 64% des cas. Mais la découverte du rôle prépondérant des veines pulmonaires dans l’arythmogénèse de la FA a obligé les chirurgiens cardio-thoraciques à revoir leurs méthodes, en se focalisant sur la déconnexion des VP. Plusieurs équipes [73] ont réussi à obtenir de bons résultats par cryoablation ou radiofréquence, que ce soit par voie endocardique ou épicardique. Dans un objectif d’alléger la procédure, Kottkamp [74] et son équipe ont utilisé la radiofréquence pour isoler les VP entre elles et par rapport à l’anneau mitral en utilisant une mini thoracotomie droite couplée à la vidéo chirurgie avec succès. De même le système Epicor Ultramaze qui délivre une énergie ultrasonique focalisée de haute densité permet une déconnexion des VP par voie épicardique. Les résultats obtenus toujours en complément d’un autre geste chirurgical sont satisfaisants [75] . Néanmoins, toutes ces méthodes restaient très invasives et lourdes puisqu’elles nécessitaient une circulation extra corporelle. De plus, la cardioplégie ne permettait pas de contrôler électrophysiologiquement en direct l’efficacité des lésions créées.
La première série de patients traités par voie endocavitaire exclusivement à cœur battant a été publiée par l’équipe de Maessen en 2001 [76]. Les lésions endocardiques ont été créées en utilisant des micro-ondes. Au total, 24 patients furent traités, 21 étaient en FA chronique et
seulement 3 en FA paroxystique. Au bout de neuf mois, 20 patients étaient en rythme sinusal. L’équipe Lyonnaise du Pr Robin a également obtenu de bons résultats à 6 mois en utilisant le système Epicor à cœur battant, avant le branchement de la CEC [77]. Le taux de succès obtenu était de 80%. Ces résultats ont mis en évidence une nouvelle alternative pour un traitement curatif de la FA chez des patients ne relevant pas d’une chirurgie cardiaque. Depuis, cette voie s’est développée avec différentes sources d’énergie comme la radiofréquence ou la cryoablation.
1.2. L’ablation par voie endocavitaire
- L’avènement de la radiofréquence : la première source d’énergie utilisée par les
rythmologues interventionnels était la fulguration endocavitaire. Elle consiste à délivrer à l'aide d'une sonde endocavitaire un choc électrique, au contact de la zone myocardique que l'on veut détruire. La sonde est reliée à un défibrillateur externe. Du fait de son caractère très douloureux, la fulguration se fait sous anesthésie générale brève. Ses premières utilisations datent du début des années 1980 pour l’ablation du NAV et de la fin des années 80 pour les ablations de flutter commun [78]. Du fait de ses limites (douleur, imprécision), la fulguration endocavitaire fut rapidement supplantée par la radiofréquence (RF). Cette technique consiste en la cautérisation des tissus à traiter grâce à la chaleur produite par l’effet résistif d’un courant électrique passant entre l’électrode distale du cathéter d’ablation et une plaque dorsale. Elle présente l’avantage que les lésions créées sont plus précises et n’entraînent plus de risques de perforation pariétale comme avec la fulguration. Elles sont surtout moins douloureuses, ne rendant donc pas nécessaire l’anesthésie. Le deuxième intérêt de ces nouvelles techniques cœur battant était de pouvoir suivre l’efficacité électrophysiologique des lésions créées. Les premières procédures d’ablation par radiofréquence, réalisées avec des cathéters de 4mm non irrigués, cherchaient à reproduire le Maze chirurgical par la création de lésions linéaires dans l’endocarde atrial [79]. Les modestes taux de succès (40% à 50%) associés à un risque relativement élevé de complications ont toutefois freiné l’enthousiasme pour cette technique. Cependant, la découverte que des potentiels issus des VP provoquaient la FA et la démonstration que l’élimination de ces foyers pouvait terminer l’arythmie provoqua un regain d’intérêt majeur pour ce type de procédure.
- Les lésions linéaires : A l’instar des principales techniques chirurgicales, le principe
des lésions linéaires auriculaires endocardiques repose sur la diminution de la masse critique nécessaire pour l’arythmogénèse (prévention des réentrées).
Les lignes dans l’OD :
Les premières lésions linéaires endocavitaires furent réalisées dans l’OD du fait d’une plus grande facilité et sécurité. Ainsi, en 1994, le cas d’un patient atteint de FA paroxystique incessante résistante aux AA fut publié. Trois lésions linéaires dans l’OD furent réalisées, ce qui permit de ne pas avoir de récidive de FA pendant les 3 mois de suivi.
Malheureusement, les résultats des ces ablations de l’OD furent décevants. Les séries les plus optimistes rapportaient 56% de succès sans AA à 11 mois et 37% à 36 mois sous AA.
Une série de Jaïs rapporte 37% de succès sous AA à 26 mois. C’est pourquoi l’équipe de Michel Haïssaguerre a réalisé, sur une série de 45 patients faisant de la FA paroxystique récidivante malgré le traitement AA, une extension des lésions linéaires de l’OD à l’OG en cas d’échec per procédural [80]. Pour les lignes de l’OD, le succès était de 13% à 11 mois sans AA et s’élevait à 33% avec. Une des explications des nombreux échecs pouvait être la rareté des blocs complets sur les lignes d’ablation. Pour les patients chez qui des lignes dans l’OG avaient été réalisées, les auteurs ont constaté une plus grande stabilité du rythme sinusal avec moins de récidives de FA. Ces données aboutirent à l’extension des lésions linéaires dans l’OG.
Les lignes dans l’OG :
Jais et al. Associèrent en 1999 chez 44 patients (40 FA paroxystiques et 4 FA permanentes) deux lignes d’ablation à droite et trois ou quatre lignes à gauche [81]. Dans l’OD une ligne septale et une ligne cavo-tricuspide étaient réalisées. A gauche, ils réalisèrent deux lignes joignant chaque veine supérieure à l’anneau mitral postérieur, une joignant les deux veines supérieures et enfin une quatrième joignant la VP supérieure droite au foramen ovale.
Le passage dans l’OG fut réalisé par ponction trans septale. Après 11 mois de suivi, 57% des patients s’étaient maintenus en rythme sinusal. Ces premiers résultats encourageants furent obtenus au prix d’une iatrogénie non négligeable (5 hémopéricardes, une thrombose de veines pulmonaires). Mais le suivi des patients de cette étude a permis de constater de nombreuses rechutes sous la forme de flutters atypiques nécessitant une deuxième procédure d’ablation.
Pour expliquer l’apparition retardée de ces flutters non inductibles en fin de procédure on avança l’hypothèse d’un remodelage des lésions aboutissant à une brèche ou « gap » dans la ligne. La zone frontière entre la ligne d’ablation et les structures anatomiques isolantes comme l’anneau mitral constituait également une zone de vulnérabilité. Ces flutters gauche nécessitaient à l’époque une longue et fastidieuse cartographie pour leurs ablations[82].
L’analyse de résultats de ces premières ablations linéaires gauches montra que le risque de flutter gauche était proportionnel au nombre et à la longueur des lignes. Plusieurs schémas d’ablation furent proposés pour essayer de limiter ce risque. En 1999, Pappone proposa de réaliser trois lignes dans l’OD (inter cave, ICT et septale) mais une seule ligne dans l’OG, cette dernière encerclant les 4 veines pulmonaires. Sur une série de 27 patients atteint de FA paroxystique il réussit à obtenir une absence de récidive chez 16 patients ainsi que 3 patients quasi asymptomatiques sans traitement AA130. La ligne d’ablation gauche était faite par repérage anatomique au moyen du système de navigation 3D CARTO®. D’autres auteurs proposèrent d’autres schémas de lignes intra-auriculaires sur des petites séries de patients, avec des taux de succès variant entre 30 et 60% sans AA et entre 60 et 85% avec. Malgré ces résultats encourageants, l’ablation par lésions linéaires présentait beaucoup de contraintes qui limitaient sa réalisation à grande échelle. Les procédures étaient longues, allant jusqu'à une douzaine d’heures, ce qui impliquait une exposition prolongée aux rayonnements ionisants. Mais surtout, les complications iatrogènes étaient importantes : d’une part, celles liées au matériel comme les cathéters non irrigués qui favorisaient les accidents thrombo-emboliques et les tamponnades et, d’autre part, celles liées à la procédure elle-même comme les BAV et les dysfonctions sinusales. C’est dans ce contexte que la découverte du rôle majeur dans l’arythmogenèse des foyers situés dans les veines pulmonaires fit évoluer les stratégies d’ablation, pour focaliser les zones initiatrices.
- L’ablation focale : La cartographie du démarrage spontané de la FA chez l’homme est
longtemps restée difficile du fait du caractère imprévisible et soutenu de l’arythmie. Chez des sujets souffrant de FA paroxystique quotidienne, les procédures d’ablations linéaires gauches avaient permis de raccourcir la durée et la fréquence des épisodes. Mais c’est également ces procédures qui ont permis de participer à la mise en évidence de foyers d’extra systoles atriales (ESA). Au cours d’études électrophysiologiques, des salves d’ESA avec phénomène P sur T précédaient le démarrage de la FA (figure 8). Leur ablation par ablation focalisée de radiofréquence fut décrite dès 1994 par Haïssaguerre et al et permit la guérison des patients. D’autres patients victimes de FA « focale » purent être guéris par l’ablation de ce foyer qui était souvent localisé dans une veine pulmonaire.
Figure 8: Extrasystoles auriculaires précoces (P sur T) bigéminées (*) déformant l’onde T du complexe QRS qui précède et initiant un accès de fibrillation auriculaire .
En 1998, l’équipe de Michel Haïssaguerre mettait en évidence le rôle majeur des veines pulmonaires puisque c’est à cet endroit qu’étaient localisés 94% des foyers identifiés.
L’ablation de ces foyers fut une évolution dans l’histoire du traitement curatif de la FA. Les foyers étaient ablatés par des tirs localisés. D’autres équipes expérimentèrent la technique, mais l’approche punctiforme d’un foyer situé à l’intérieur d’une veine posa rapidement deux problèmes menant à son abandon progressif.
Tout d’abord, la cartographie était longue et fastidieuse, dépendant de l’activité du foyer lors de la procédure et plusieurs foyers pouvaient coexister au sein de la même veine.
Ensuite, la technique qui consistait à appliquer le courant de radiofréquence au contact du site d’activation électrique ectopique détecté risquait d’« éteindre » un foyer voisin et donc d’exposer le patient à une récidive localisée dans la même veine. Par ailleurs, en cas de foyer localisé loin à l’intérieur de la veine (jusqu'à 3 cm), les lésions de RF risquaient de se compliquer de sténose du fait du plus petit calibre de la veine à cet endroit (figure 9)
Figure 9: Schématisation des deux stratégies. Risque de sténose moindre en ablatant à l’ostium.
Ces constatations ont conduit à une nouvelle stratégie d’isolation ou de déconnexion des veines pulmonaires du reste de l’oreillette à proximité de l’ostium permettant de traiter en même temps tous les foyers d’une même veine.
- L’isolation des veines pulmonaires : Le croisement de l’étude histologique et
électrophysiologique des veines pulmonaire a permis de mettre en évidence des ponts de conduction électrique entre les veines et le tissu atrial. Ces connexions atrio-veineuses ne sont pas présentes sur toute la circonférence de l’ostium, ce qui rend possible une déconnexion électrique complète de la veine en seulement quelques applications de courant de radiofréquence (un seul dans 20% des veines et 2 dans 47%) [83]. (Andronache et al, abstract sur 100 patients présenté à Cardiostim 2012)
L’enregistrement des foyers ectopiques des veines pulmonaires au cours d’une étude électrophysiologique a été facilité grâce à un cathéter circulaire de dix pôles développé par M. Haïssaguerre avec l’aide du laboratoire Biosense (Lasso®, biosense Webster, Diamond Bar, CA, USA). Ce cathéter orientable de 15 à 20 mm de diamètre est disposé dans le premier centimètre de la VP (figure 15) et permet l’enregistrement de deux types de potentiels : le premier correspondant à l’enregistrement d’une activité électrique éloignée d’origine auriculaire (A) appelée « farfield » ; le deuxième potentiel très fin ou « spike potential » reflétant la dépolarisation locale des fibres musculaires de la veine pulmonaire (potentiel veineux pulmonaire ou PVP). Lors du rythme sinusal normal, le Lasso positionné dans la VP affiche la
séquence suivante : potentiel auriculaire-potentiel veineux (A-PVP).
Figure 10: Positionnement radiologique du Lasso et du cathéter d’ablation dans la veine pulmonaire
L’activation de la VP se fait en cascade depuis le site le plus proche du point de pénétration de la bandelette musculaire vers le site le plus distal. Lors d’ectopies spontanées de la veine, l’enregistrement du Lasso révèle une inversion de séquence : potentiels veineux pulmonaires suivis du potentiel auriculaire (PVP-A). Le potentiel veineux le plus précocement enregistré (correspondant au A-PVP le plus court) indique la situation précise du pont musculaire et détermine le site idéal d’ablation qui conduira à l’interruption de la connexion électrique entre l’OG et la VP.
Avec cette technique d’ablation, Haïssaguerre et al ont traité 90 patients [84]. Le cathéter lasso était positionné après angiographie sélective des VP. Puis, après identification du dipôle en regard du potentiel veineux le plus précoce, l’ablation était réalisée en délivrant le courant de RF en regard du dipôle identifié (figure 16). Le succès consistait en une disparition des
PVP ou en leur dissociation de l’activité électrique de l’OG. Sur les 80 patients qui n’avaient plus d’ESA en fin de procédure, 40 ont eu des récidives. Il est important de noter que dans cette série de patients, les quatre VP n’avaient pas été systématiquement déconnectées. Les récidives pouvaient donc être imputées à une reconnexion d’une veine ablatée ou à
l’émergence d’un nouveau foyer dans une veine non isolée. Après reprise éventuelle et avec 8 mois de recul, le succès était de 71% sans AA et de 84% avec. Les auteurs obtinrent 90% de succès pour les patients dont les potentiels de VP étaient tous déconnectés contre 55% chez les autres.
Ce taux de succès fut obtenu au prix d’un hémopéricarde, deux accidents ischémiques transitoires péri-procéduraux et six sténoses supérieures à 50% de veines pulmonaires. Ce dernier risque a été considérablement réduit au cours de l’étude, puisqu’aucun cas n’a été retrouvé après limitation de la puissance de tir à 30 Watt, ce qui a concerné les 55 derniers patients.
Figure 11: Stimulation cardiaque par le sinus coronaire. Déconnexion d’une veine pulmonaire pendant un tir de RF avec disparition des PVP après le 3ème battement
- Isolation anatomique des veines pulmonaires :Le traitement de la FA par ablation des
veines pulmonaires a été rapidement unanimement reconnu et accepté. Nombreux sont les centres qui aujourd’hui ont suivi l’expérience bordelaise. Il est toutefois important de souligner qu’à côté de la déconnexion « électrophysiologique » des VP (utilisation du Lasso), une voie alternative dite « électroanatomique » a été ouverte en Italie par Pappone et al. [85-86]. Cette
technique fait appel à un système de reconstruction en 3-D de l’OG (utilisation du system CARTO, Biosense-Webster). Elle correspond à des lésions circonférentielles « point par point » autour de l’ostium des VP à une distance de 5 à 10 mm (figure 17) grâce à un code couleur (1 tissu traité par RF = 1 point de couleur). L’ablation ne se focalise plus sur une déconnexion segmentaire des VP mais est une ablation circonférentielle de la veine ciblée. Les auteurs ne recherchaient donc pas un bloc électrique bidirectionnel complet mais un succès « anatomique». Le taux de réussite à 9 mois était de 62% sans AA et de 85% avec, sans différence entre les FA paroxystiques (n=14) et permanentes (n=12).
En dépit de la durée nécessaire à la réalisation des cartographies de l’OG, cette approche comportait plusieurs intérêts :
Diminution du temps de fluoroscopie ;
Association de l’élimination des foyers et d’une modification du substrat ; Elimination d’éventuels foyers proximaux proches des ostia ;
Disparition théorique du risque de sténose des VP ; Dénervation locale (SNA).
Ce dernier point a fait l’objet d’une publication en 2004 [87], dans laquelle la même équipe proposait d’associer une dénervation complète de la région des ostia de façon systématique, obtenant un moindre taux de récidives à 1 an. L’explication avancée était la diminution du tonus vagal.
Même si les résultats semblent concordants, l’absence d’études randomisées rend la comparaison directe de ces deux techniques (isolation électrophysiologique et isolation anatomique) difficile. Certains auteurs proposent une approche mixte, sans pour autant démontrer d’efficacité supérieure [87 , 89].
Figure 12: Reconstruction 3D de l’OG avant et après ablation circonférentielles extra ostiale, interostiales et mitro-pulmonaire (système CARTO)
2. LES DONNEES ACTUELLES SUR L’ABLATION DE FA
2.1. La radiofréquence
Dans les années suivant la description princeps des deux méthodes évoquées précédemment, plusieurs équipes ont publié leurs résultats associant le plus souvent l’isolation des VP à des lésions linéaires complémentaires.La comparaison randomisée entre les deux techniques d’isolation électrophysiologique et celle d’isolation anatomique a fait l’objet de plusieurs essais dont les résultats étaient discordants . Depuis ces études, la plupart des centres ont adopté la méthode circonférentielles qui permet quasiment de supprimer le risque de sténose de VP. En revanche, la vérification électrique des lésions effectuées et les lignes complémentaires diffèrent entre les équipes. La figure 13 illustre les principales lésions utilisées.
Figure 13: Représentation schématique des types de lésions effectuées lors d’une ablation de FA
(A) Lésions d’ablations circonférentielles autour des VP gauches et droites (B) Sites les plus fréquents d’ablations linéaires
(C) Similaire à (B) mais avec des lésions additionnelles entre les VP supérieures et inférieures, produisant une lésion en « 8 »
(D) Certains des sites d’ablations lorsque des électrogrammes complexes fractionnés sont visés