ﺎﻨﺘﻤﻠﻋ ﺎﻣ ﻻﺇ ﺎﻨﻟ ﻢﻠﻋ ﻻ ﻚﻧﺎﺤﺒﺳ
ﻚﻧﺇ
ﻢﻴﻜﳊﺍ ﻢﻴﻠﻌﻟﺍ ﺖﻧﺃ
ﺔﻳﻵﺍ :ﺓﺮﻘﺒﻟﺍ ﺓﺭﻮﺳ
31
UNIVERSITE MOHAMMED V DE RABAT FACULTE DE MEDECINE ET DE PHARMACIE - RABAT DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 – 2013 : Professeur Najia HAJJAJ - HASSOUNI
ADMINISTRATION :
Doyen : Professeur Mohamed ADNAOUI
Vice Doyen chargé des Affaires Académiques et estudiantines
Professeur Mohammed AHALLAT
Vice Doyen chargé de la Recherche et de la Coopération
Professeur Taoufiq DAKKA
Vice Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général : Mr. Mohamed KARRA
1- ENSEIGNANTS-CHERCHEURS MEDECINS ET
PHARMACIENS
PROFESSEURS :
Décembre 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation Pr. SETTAF Abdellatif pathologie Chirurgicale
Novembre et Décembre 1985
Pr. BENSAID Younes Pathologie Chirurgicale
Janvier, Février et Décembre 1987
Pr. CHAHED OUAZZANI Houria Gastro-Entérologie Pr. LACHKAR Hassan Médecine Interne Pr. YAHYAOUI Mohamed Neurologie
Décembre 1988
Pr. BENHAMAMOUCH Mohamed Najib Chirurgie Pédiatrique
Décembre 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. CHAD Bouziane Pathologie Chirurgicale Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
Janvier et Novembre 1990
Pr. CHKOFF Rachid Pathologie Chirurgicale Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique Pr. MANSOURI Fatima Anatomie-Pathologique Pr. TAZI Saoud Anas Anesthésie Réanimation
Février Avril Juillet et Décembre 1991
Pr. AL HAMANY Zaîtounia Anatomie-Pathologique
Pr. AZZOUZI Abderrahim Anesthésie Réanimation –Doyen de la FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZZAD Rachid Gynécologie Obstétrique Pr. CHABRAOUI Layachi Biochimie et Chimie
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie – Dir. du Centre National PV
Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir du CEDOC
Décembre 1992
Pr. AHALLAT Mohamed Chirurgie Générale V.D Aff. Acad. et Estud Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. BOUJIDA Mohamed Najib Radiologie
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie Pr. CHRAIBI Chafiq Gynécologie Obstétrique Pr. DEHAYNI Mohamed* Gynécologie Obstétrique Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
Mars 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid Endocrinologie et Maladies Métaboliques Doyen de la FMPA
Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale- Directeur CHIS
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HADRI Larbi* Médecine Interne
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale Pr. JELTHI Ahmed Anatomie Pathologique Pr. MAHFOUD Mustapha Traumatologie – Orthopédie Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
Mars 1994
Pr. ABBAR Mohamed* Urologie
Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BELAIDI Halima Neurologie
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie
Pr. CHAMI Ilham Radiologie
Pr. CHERKAOUI Lalla Ouafae Ophtalmologie Pr. JALIL Abdelouahed Chirurgie Générale Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
Mars 1995
Pr. ABOUQUAL Redouane Réanimation Médicale Pr. AMRAOUI Mohamed Chirurgie Générale Pr. BAIDADA Abdelaziz Gynécologie Obstétrique Pr. BARGACH Samir Gynécologie Obstétrique Pr. CHAARI Jilali* Médecine Interne
Pr. DIMOU M’barek* Anesthésie Réanimation Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie - Directeur HMI Med V
Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
Décembre 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUADGHIRI Mohamed Traumatologie-Orthopédie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie
Novembre 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. HAIMEUR Charki* Anesthésie Réanimation Pr. KADDOURI Noureddine Chirurgie Pédiatrique Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TAOUFIQ Jallal Psychiatrie
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
Novembre 1998
Pr. AFIFI RAJAA Gastro-Entérologie
Pr. BENOMAR ALI Neurologie – Doyen de la FMP Abulcassis
Pr. BOUGTAB Abdesslam Chirurgie Générale Pr. ER RIHANI Hassan Oncologie Médicale Pr. BENKIRANE Majid* Hématologie
Pr. KHATOURI ALI* Cardiologie
Janvier 2000
Pr. ABID Ahmed* Pneumophtisiologie
Pr. AIT OUMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. ISMAILI Hassane* Traumatologie Orthopédie- Dir. Hop. Av. Marr.
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Inspecteur du SSM
Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne
Novembre 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie Directeur Hop. Chekikh Zaied
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques Pr. MAHASSINI Najat Anatomie Pathologique
Pr. MDAGHRI ALAOUI Asmae Pédiatrie Pr. ROUIMI Abdelhadi* Neurologie
Décembre 2000
Pr. ZOHAIR ABDELAH* ORL
Décembre 2001
Pr. BALKHI Hicham* Anesthésie-Réanimation Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie Directeur. Hop.d’Enfants
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABBAJ Saad Anesthésie-Réanimation
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale Pr. MIKDAME Mohammed* Hématologie Clinique Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
Décembre 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL FELLOUS Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. LAGHMARI Mina Ophtalmologie
Pr. MABROUK Hfid* Traumatologie Orthopédie Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumophtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
Pr. ZENTAR Aziz* Chirurgie Générale
Janvier 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie Pr. BOUGHALEM Mohamed* Anesthésie Réanimation
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre* Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique Pr. TIJAMI Fouad Chirurgie Générale Pr. ZARZUR Jamila Cardiologie
Janvier 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. BERNOUSSI Abdelghani Ophtalmologie Pr. DOUDOUH Abderrahim* Biophysique Pr. EL HAMZAOUI Sakina* Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité)
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire Pr. LYAGOUBI Mohammed Parasitologie
Pr. NIAMANE Radouane* Rhumatologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique Pr. ZERAIDI Najia Gynécologie Obstétrique
Décembre 2005
Pr. CHANI Mohamed Anesthésie Réanimation
Avril 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation Pr. HARMOUCHE Hicham Médecine Interne Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie Pr. SAFI Soumaya* Endocrinologie Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
Octobre 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi* Chirurgie cardio vasculaire Pr. AMHAJJI Larbi* Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed* Anesthésie réanimation Directeur ERSM
Pr. BALOUCH Lhousaine* Biochimie-chimie Pr. BENZIANE Hamid* Pharmacie clinique Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHARKAOUI Naoual* Pharmacie galénique Pr. EHIRCHIOU Abdelkader* Chirurgie générale Pr. ELABSI Mohamed Chirurgie générale Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid* Radiothérapie
Pr. ICHOU Mohamed* Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar* Anesthésie réanimation Pr. LOUZI Lhoussain* Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed* Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRABET Mustapha* Médecine préventive santé publique et hygiène
Pr. MRANI Saad* Virologie
Pr. OUZZIF Ez zohra* Biochimie-chimie Pr. RABHI Monsef* Médecine interne Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine* Microbiologie
Pr. SIFAT Hassan* Radiothérapie
Pr. TABERKANET Mustafa* Chirurgie vasculaire périphérique Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale
Pr. TANANE Mansour* Traumatologie orthopédie Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
Décembre 2007
Pr. DOUHAL ABDERRAHMAN Ophtalmologie
Décembre 2008
Pr ZOUBIR Mohamed* Anesthésie Réanimation Pr TAHIRI My El Hassan* Chirurgie Générale
Mars 2009
Pr. ABOUZAHIR Ali* Médecine interne
Pr. AGDR Aomar* Pédiatre
Pr. AIT ALI Abdelmounaim* Chirurgie Générale Pr. AIT BENHADDOU El hachmia Neurologie
Pr. AKHADDAR Ali* Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. AMINE Bouchra Rhumatologie
Pr. ARKHA Yassir Neuro-chirurgie
Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae* Biochimie-chimie
Pr. BOUI Mohammed* Dermatologie
Pr. BOUNAIM Ahmed* Chirurgie Générale
Pr. BOUSSOUGA Mostapha* Traumatologie orthopédique Pr. CHAKOUR Mohammed * Hématologie biologique
Pr. CHTATA Hassan Toufik* Chirurgie vasculaire périphérique Pr. DOGHMI Kamal* Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie Pr. ENNIBI Khalid* Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. L’KASSIMI Hachemi* Microbiologie Directeur Hôpital My Ismail
Pr. LAMSAOURI Jamal* Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-phtisiologie
PROFESSEURS AGREGES :
Octobre 2010
Pr. ALILOU Mustapha Anesthésie réanimation Pr. AMEZIANE Taoufiq* Médecine interne Pr. BELAGUID Abdelaziz Physiologie
Pr. BOUAITY Brahim* ORL
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine aéronautique Pr. DAMI Abdellah* Biochimie chimie Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL MAZOUZ Samir Chirurgie plastique et réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro entérologie Pr. LAMALMI Najat Anatomie pathologique Pr. MOSADIK Ahlam Anesthésie Réanimation Pr. MOUJAHID Mountassir* Chirurgie générale
Pr. NAZIH Mouna* Hématologie
Pr. ZOUAIDIA Fouad Anatomie pathologique
Mai 2012
Pr. AMRANI Abdelouahed Chirurgie Pédiatrique Pr. ABOUELALAA Khalil* Anesthésie Réanimation Pr. BELAIZI Mohamed* Psychiatrie
Pr. BENCHEBBA Driss* Traumatologie Orthopédique Pr. DRISSI Mohamed* Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek* Médecine Interne Pr. EL OUAZZANI Hanane* Pneumophtisiologie Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie pathologique
Pr. MEHSSANI Jamal* Psychiatrie
Pr. RAISSOUNI Maha* Cardiologie
Février 2013
Pr. AHID Samir Pharmacologie – Chimie
Pr. AIT EL CADI Mina Toxicologie
Pr. AMRANI HANCHI Laila Gastro-Entérologie Pr. AMOUR Mourad Anesthésie Réanimation Pr. AWAB Almahdi Anesthésie Réanimation Pr. BELAYACHI Jihane Réanimation Médicale Pr. BELKHADIR Zakaria Houssain Anesthésie Réanimation Pr. BENCHEKROUN Laila Biochimie-Chimie
Pr. BENKIRANE Souad Hématologie
Pr. BENNANA Ahmed* Informatique Pharmaceutique 0.
Pr. BENSGHIR Mustapha* Anesthésie Réanimation Pr. BENYAHIA Mohammed* Néphrologie
Pr. BOUATIA Mustapha Chimie Analytique
Pr. BOUABID Ahmed Salim* Traumatologie Orthopédie Pr. BOUTARBOUCH Mahjouba Anatomie
Pr. CHAIB Ali* Cardiologie
Pr. DENDANE Tarek Réanimation Médicale
Pr. DINI Nouzha* Pédiatrie
Pr. ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr. ECH-CHERIF EL KETTANI Najwa Radiologie
Pr. ELFATEMI Nizare Neuro-Chirurgie
Pr. EL GUERROUJ Hasnae Médecine Nucléaire Pr. EL HARTI Jaouad Chimie Thérapeutique
Pr. EL JOUDI Rachid* Toxicologie
Pr. EL KABABRI Maria Pédiatrie
Pr. EL KHANNOUSSI Basma Anatomie Pathologie
Pr. EL KHLOUFI Samir Anatomie
Pr. EL KORAICHI Alae Anesthésie Réanimation Pr. EN-NOUALI Hassane* Radiologie
Pr. ERRGUIG Laila Physiologie
Pr. FIKRI Meryim Radiologie
Pr. GHFIR Imade Médecine Nucléaire
Pr. IMANE Zineb Pédiatrie
Pr. IRAQI Hind Endocrinologie et maladies métaboliques
Pr. KABBAJ Hakima Microbiologie
Pr. KADIRI Mohamed* Psychiatrie
Pr. LATIB Rachida Radiologie
Pr. MAAMAR Mouna Fatima Zahra Médecine Interne
Pr. MEDDAH Bouchra Pharmacologie
Pr. MELHAOUI Adyl Neuro-chirurgie
Pr. MRABTI Hind Oncologie Médicale Pr. NEJJARI Rachid Pharmacognosie Pr. OUBEJJA Houda Chirurgie Pédiatrique Pr. OUKABLI Mohamed* Anatomie Pathologique Pr. RAHALI Younes Pharmacie Galénique
Pr. RATBI Ilham Génétique
Pr. RAHMANI Mounia Neurologie
Pr. REDA Karim* Ophtalmologie
Pr. REGRAGUI Wafa Neurologie
Pr. RKAIN Hanan Physiologie
Pr. ROSTOM Samira Rhumatologie
Pr. ROUAS Lamiaa Anatomie Pathologique Pr. ROUIBAA Fedoua* Gastro-Entérologie Pr. SALIHOUN Mouna Gastro-Entérologie
Pr. SAYAH Rochde Chirurgie Cardio-Vasculaire Pr. SEDDIK Hassan* Gastro-Entérologie
Pr. ZERHOUNI Hicham Chirurgie Pédiatrique
Pr. ZINE Ali* Traumatologie Orthopédie
Avril 2013
Pr. EL KHATIB Mohamed Karim* Stomatologie et Chirurgie Maxillo-faciale
Pr. GHOUNDALE Omar* Urologie
Pr. ZYANI Mohammad* Médecine Interne
MARS 2014
ACHIR ABDELLAH Chirurgie Thoracique
BENCHAKROUN MOHAMMED Traumatologie- Orthopédie BOUCHIKH MOHAMMED Chirurgie Thoracique
EL KABBAJ DRISS Néphrologie
EL MACHTANI IDRISSI SAMIRA Biochimie-Chimie
HARDIZI HOUYAM Histologie- Embryologie-Cytogénétique
HASSANI AMALE Pédiatrie
HERRAK LAILA Pneumologie
JANANE ABDELLA TIF Urologie
JEAIDI ANASS Hématologie Biologique
KOUACH JAOUAD Génécologie-Obstétrique LEMNOUER ABDELHAY Microbiologie
MAKRAM SANAA Pharmacologie
OULAHYANE RACHID Chirurgie Pédiatrique RHISSASSI MOHAMED JMFAR CCV
SABRY MOHAMED Cardiologie
SEKKACH YOUSSEF Médecine Interne
TAZL MOUKBA. :LA.KLA. Génécologie-Obstétrique
*
Enseignants MilitairesDECEMBRE 2014
ABILKACEM RACHID' Pédiatrie
AIT BOUGHIMA FADILA Médecine Légale
BEKKALI HICHAM Anesthésie-Réanimation
BENAZZOU SALMA Chirurgie Maxillo-Faciale
BOUABDELLAH MOUNYA Biochimie-Chimie
BOUCHRIK MOURAD Parasitologie
DERRAJI SOUFIANE Pharmacie Clinique
DOBLALI TAOUFIK Microbiologie
EL AYOUBI EL IDRISSI ALI Anatomie
EL GHADBANE ABDEDAIM HATIM Anesthésie-Réanimation EL MARJANY MOHAMMED Radiothérapie
FE]JAL NAWFAL Chirurgie Réparatrice et Plastique
JAHIDI MOHAMED O.R.L
LAKHAL ZOUHAIR Cardiologie
OUDGHIRI NEZHA Anesthésie-Réanimation
Rami Mohamed Chirurgie Pédiatrique
SABIR MARIA Psychiatrie
SBAI IDRISSI KARIM Médecine préventive, santé publique et Hyg.
AOUT 2015
Meziane meryem Dermatologie
Tahri latifa Rhumatologie
JANVIER 2016
BENKABBOU AMINE Chirurgie Générale
EL ASRI FOUAD Ophtalmologie
ERRAMI NOUREDDINE O.R.L
NITASSI SOPHIA O.R.L
2- ENSEIGNANTS – CHERCHEURS SCIENTIFIQUES
PROFESSEURS / PRs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie – chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. BOURJOUANE Mohamed Microbiologie
Pr. CHAHED OUAZZANI Lalla Chadia Biochimie – chimie
Pr. DAKKA Taoufiq Physiologie
Pr. DRAOUI Mustapha Chimie Analytique Pr. EL GUESSABI Lahcen Pharmacognosie Pr. ETTAIB Abdelkader Zootechnie Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. HAMZAOUI Laila Biophysique
Pr. HMAMOUCHI Mohamed Chimie Organique Pr. IBRAHIMI Azeddine Biologie moléculaire Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Pr. ZELLOU Amina Chimie Organique
Mise à jour le 14/12/2016 par le Service des Ressources Humaines
A mes très chers parents KOUROUB Hannouma
et HANNAN Abdelhakim
Vous le premier amour que j’ai connu, c’est pour cette raison
que je débute en vous remerciant, vous m'avez offert plus
que tout ce que je pouvais désirer et mériter, et vous jouez
un rôle primaire et dominant dans ma vie.
Toi ma mère symbole d’amour et de tendresse, tu as toujours
été là pour m’écouter, merci de m’avoir mis au monde, de m’avoir
enseigné tout ce qui est important pour y vivre et
pour ton soutien constant
Toi mon père symbole de la force et source d'inspiration,
tu m’as appris à avoir confiance en moi et c’est grâce
à ton éducation que je suis aujourd’hui une personne autonome,
indépendante et heureuse de vivre.
Par le biais de cette thèse, mon amour pour vous pourra
garder une trace écrite, mais dans mon cœur il est présent
A ma petite sœur adorée Hannan Rim
Merci pour les moments extraordinaires de joie qu’on a partagés et
pour les moments de déprime et de tristesse où j’avais besoin de parler
à une sœur, je te souhaite une vie pleine de bonheur et réussite et
saches que je t'aime de tout mon cœur.
A mes oncles, tantes, cousins et à tous les membres
de la famille
Je vous remercie chaleureusement pour votre présence
et votre soutien et je vous souhaite santé, bonheur et prospérité.
A mes très chères amis
Nafissa Arragragui, Fadma Gouaz, Sanae Guarti, Siham El Founini,
Soraya Bouhairi, Zineb Hammouch, Kawtar Zinedine, Najoua
Sefiani, Meriem EL Hajjaji, Hanae Berreho, Gharbi Malak Asmaa
Benmouloud, Asmae Benkerroum, El Oudani Mehdi, El Idrissi
Bouhiaoui Mehdi, Jamaaoui Imad, Sarsi Mehdi, El Harrass
Abdassamad, Chokri Anas, El Harghi Ismail, Almoustapha Brahima
Qui m'ont accompagné, aidé, soutenu et encouragé tout au long de la
réalisation de cette thèse. Pour ces moments d’amitié de bonheur
Un énorme MERCI pour cet homme tout simplement génial Chiba
Mouncef avec qui j’ai partagé beaucoup d’émotions de bonheur,
sympathie, admiration et tendresse.
Je suis vraiment touchée et reconnaissante
pour ton soutien constant et ton réconfort que tu m’as témoigné
durant les moments difficiles je ne pourrai jamais
A notre maitre et Président
de thèse Monsieur le professeur ABDELLAH DAMI
Professeur de biochimie
Permettez-moi de vous remercier Monsieur le président,
pour ce grand honneur que vous me faites, en acceptant
de présider ce jury.
C'est avec un réel plaisir que j'ai assisté à vos cours car
J’étais toujours curieuse de découvrir et comprendre
le principe des méthodes analytiques
Je vous prie, cher Maître, d'accepter dans ce travail
A notre maitre et encadrant de thèse
Monsieur le professeur AZLARAB MASRAR
chef de service hématologie biologique CHU
Je tiens à vous exprimer ma profonde gratitude ainsi
que mes sincères remerciements pour m’avoir accueilli dans votre
service et d'avoir accepté de m'encadrer pour ce travail de thèse.
Je dois vous avouer que vous êtes parmi les professeurs qui ont
marqué mon esprit, vous m’avez donné le goût de l’apprentissage,
vous m’avez aidé à me surpasser et à prendre confiance en moi,
je tiens à vous dire que vous êtes un excellent professeur je vous
remercie pour votre savoir et vos connaissances que vous
avez partagé avec nous durant vos cours.
Vos conseils avisés, vos encouragements incessants ainsi que vos
qualités humaines m’ont été d’une très grande utilité pour mener
à terme ce travail. Je vous suis sincèrement reconnaissante
pour toutes ces choses.
Veuillez trouver ici le témoignage de toute mon estime
et de mon profond respect.
A notre maitre et juge de thèse
Madame le professeur NAZIH MOUNA
professeur d’hématologie biologique
Je vous remercie d’avoir accepté de faire partie des membres du jury.
Votre rigueur scientifique, votre amour pour le travail font de vous
une professeur de qualité et c’est grâce à vos compétences
pédagogiques que j’ai suivi vos cours avec beaucoup
d’attention et plaisir.
Je suis particulièrement honorée de votre présence
et je vous exprime ici ma plus haute considération.
A notre maitre et juge de thèse
Madame le professeur SOUAD BENKIRANE
professeur d'hématologie biologique
C’est pour moi un immense plaisir que vous ayez
accepté de participer au jury.
Je n’oublierai jamais l’atmosphère chaleureuse
et assidue de vos séances
Je tiens absolument à vous présenter mes meilleurs vœux
de santé et que votre futur bébé arrivera à vous faire sourire
ou pleurer de joie, vous émerveiller et vous attendrir tout à la fois.
Que ce travail soit pour moi l’occasion de vous exprimer mon
admiration ainsi que ma gratitude.
LISTE DES ABREVIATIONS
A : AdénineADN : Acide désoxyribonucléique
C : Cytosine
CAS : Chemical Abstracts Service
EDTA : Acide éthylène-diamine-tétra-acétique
Ex : Exemple
G : Guanine
GBEA : Guide de Bonne Exécution des Analyses
GR : Globule rouge
HT : Hématocrite
IgM : Imunoglobuline
ISCMPA : Irmandade de Santa Casa de Misericórdia de Porto Alegre
ISO : International Standard Organisation
MCDH : Micro Chromatic Detection Haematology
MGG : May-Grünwald-Giemsa
Min : Minute
n : Nombre
p : La valeur-p
PBS : Tampon phosphate salin
R/B : Rouge/ Bleu
r2 : Coefficient de corrélation
RBC : Red blood cell
REG : Réticulum endoplasmique granuleux
RFID : Identification par Radio Fréquence
RVB : Système rouge vert bleu
Sec : Seconde
SPSS : Paquet statistique pour les sciences sociales STAT : Urgent
T : Thymine
TLA : Total Laboratory Automation
V/B : Vert / Bleu
VHL : Organisation hollandaise pour la recherche dans l'hématologie biologique σ : Ecart type
LISTE DES FIGURES
Figure 1. Présentation de l’automate de coloration de lames RAL STAINER . ...7 Figure 2. Description du kit RAL Stainer MCDh ...8 Figure 3. Le Kit MCDh du RAL Stainer...9 Figure 4. Etapes de mise en place du kit de coloration. ... 12 Figure 5. Etapes d’installation des lames dans leur porteur. ... 13 Figure 6. Etapes de chargement de lames dans l‘automate... 13 Figure 7. Unité de Préparation de lame hématologique automatisée SP-1000i de
Sysmex. ... 14
Figure 8. Graphe représentant la variation de la netteté des frottis sanguins selon les
deux méthodes de coloration : automatique et semi automatique. ... 23
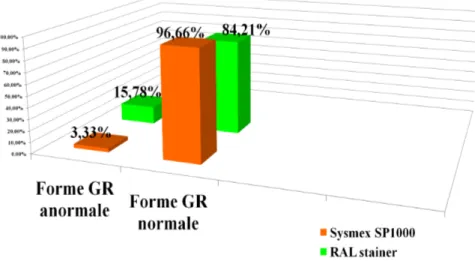
Figure 9. Graphe représentant la forme des globules rouge selon les deux méthodes
de coloration : automatique et semi automatique. ... 23
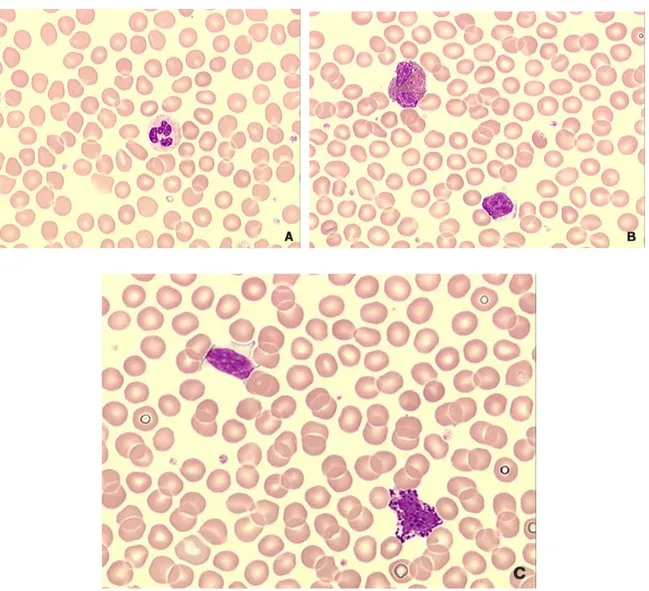
Figure 10. Technique d’étalement d’un frottis sanguin. ... 26 Figure 11. Adaptation de la technique d’étalement à la viscosité du sang. ... 27 Figure 12. A,B,C exemples de coloration de May-Grünwald-Giemsa correcte avec des
hématies beige rosé, non réfringentes, les autres éléments colorés selon leurs constituants cellulaires et une zone intercellulaire transparente et claire. ... 32
Figure 13. Coloration considérée comme correcte : les hématies sont rose orangé ou
«chamois» et le cytoplasme des polynucléaires est rosé (flèche noire). Les corps lympho-glandulaires sont bien visibles. MGG × 400. ... 33
Figure 14. Coloration considérée comme optimale : les hématies (cercle rouge) sont
rose orangé ou « chamois », le cytoplasme des polynucléaires est quasi transparent et les granulations bien visibles (flèche noire), les granulations des mastocytes sont violet sombre (carré jaune) et les corps lympho-glandulaires sont bien visibles (flèche bleue). MGG × 400... 33
Figure 15. Coloration considérée comme inadéquate : les hématies sont verdâtres, ce
qui démontre l’usage d’une solution de dilution/rinçage alcaline. MGG × 400……..34
Figure 16 . A, B colorations réalisées avec un tampon au pH trop alcalin. Le frottis est
alors sur coloré: les hématies ont un aspect bleu-vert, les cytoplasmes deviennent Grisâtres... 34
Figure 17. A, B Hématies réfringentes sur un frottis mal fixé par le May-Grünwald
soit que la qualité du colorant ne soit pas correcte (le méthanol entrant dans sa composition ne doit pas contenir plus de 3% d’eau) soit qu’il n’a pas été renouvelé assez fréquemment. ... 35
Figure 18. Exemple de coloration mal rincée (A,B) ou de coloration réalisée à partir
d’un prélèvement fait sur héparine et non sur EDTA (C,D). Le fond de la lame entre les éléments cellulaires n’est pas net. On peut aussi observer ce phénomène en présence d’une importante hypergammaglobulinémie, en particulier de type IgM. ... 35
Figure 19. Exemple d’un frottis sanguin correct : homogène, de bonnes longueur et
largeur, sans franges. ... 38
Figure 20. Exemples de mauvais frottis. ... 39 Figure 21. Zone de décompte inadaptée : trop épaisse, hématies tassées. ... 40 Figure 22. Zone de décompte inadaptée : trop fine, hématies écrasées. ... 40 Figure 23. Zone optimale de décompte : hématies en couche monocellulaire, au centre
clair visible. ... 41
Figure 24. Zone optimale de décompte et réalisation d’un trajet en créneaux pour la
Figure 25. Quelques exemples de coloration. ... 46 Figure 26. Couleur moyenne des hématies (n > 30) des échantillons (n = 40). ... 47 Figure 27. Analyse des rapports de couleurs des hématies (n > 30) des échantillons (n
= 40). ... 48
Figure28. Analyse des hématies de 32 frottis d'archives de Necker . ... 49 Figure 29. Diminution du temps de réponse corrélé à la diminution du nombre
d’étapes manuelles d’après les travaux de R. Dadoun. * : Statistiquement significatif (p<0,01) ... 53
Figure 30. a) Frottis sanguin périphérique manuel de mauvaise qualité b) Frottis
automatisé de bonne qualité ... 55
Figure 31. Régression linéaire et de dispersion des parcelles pour les neutrophiles
des bandes neutrophiles, les neutrophiles segmentés, les éosinophiles, les monocytes, les lymphocytes, les lymphocytes atypiques, les granulocytes immatures et érythroblastes. ... 67
LISTE DES TABLEAUX
Tableau I. Affinités tinctoriales des différents constituants cellulaires après coloration
panoptique. ... 18
Tableau II. Protocole de coloration May Grunwald Giemsa avec tampon RAL
pH 7.0 ... 19
Tableau III. Produits nécessaires à la coloration ... 36 Tableau IV. Résultats de la coloration ... 37 Tableau V. Procédure et protocole de coloration. ... 45
Tableau VI. Protocole de la coloration May-Grünwald- Giemsa manuelle et avec la
méthode SP 1000 i ... 58
Tableau VII. Tampons utilisés pour la coloration ... 59 Tableau VIII. Paramètres des frottis sanguins effectuées par l'équipement Sysmex
SP-1000i calculée à partir de l'hématocrite du patient ... 62
Tableau IX. Evaluation de la qualité des lames produites par le Sysmex SP-1000i
utilisant le control de qualité par CellaVision DM96 pour chaque niveau d'hématocrites. ... 64
Tableau X. Nombre de lames et de leucocytes mal classés par le CellaVision DM96
utilisant des lames préparées par le Sysmex SP-1000i. ... 66
Tableau XI. Valeurs de corrélation correspondantes ... 66 Tableau XII. Résultats de coloration avec le kit RAL Stainer MCDh ... 71
SOMMAIRE
I. INTRODUCTION ...2 II. MATERIELS ET METHODES ...6
II.1 L’automate de coloration des lames RAL Stainer ...6 II.1.1 Principe ...7 II.1.2 Description du kit ...8 II.1.3 Caractéristiques techniques ...9 II.1.4 Mode opératoire ... 10 II.1.4.1 Préparation des frottis sanguins ... 10 II.1.4.2 Mise en place du kit de coloration ... 11 II.2 Unité de Préparation de Lame Hématologique Automatisée SP-1000i de
Sysmex ... 14 II.2.1 Technologie ... 15 II.2.1.1 Préparation de la lame ... 15 II.2.1.2 Coloration ... 15 II.2.1.3 Mécanisme d’action de la coloration MGG ... 16 II.3 Les critères de jugement des colorations ... 20
III. RESULTATS ... 23 IV. DISCUSSION ... 25 V. CONCLUSION... 78 RESUMES ... 79 REFERENCES ... 83
1
2
I. INTRODUCTION :
Malgré l’amélioration des analyseurs automatisés d’hématologie destinés à la réalisation des hémogrammes, l’examen du frottis sanguin au microscope est indispensable quand les données fournies par les appareils sont qualitativement ou quantitativement anormales. Sa réalisation apporte alors des informations permettant dans un nombre de cas la validation technique du résultat. Dans certaines situations, les cellules pathologiques et anormales dont les aspects morphologiques sont proches de ceux des cellules normales ne déclenchent pas d’alarmes et ne sont donc pas détectées. Leur recherche systématique au microscope est alors nécessaire [1]. Les différentes étapes de préparation d’un frottis doivent respecter des critères précis afin de limiter les risques d’erreur liés à un artefact technique lors de l’analyse au microscope : préparation de l’échantillon à analyser et du matériel utilisé pour l’étalement, réalisation du geste, séchage à l’air libre et coloration. L’examen du frottis devra comprendre obligatoirement une analyse morphologique des éléments figurés du sang, à laquelle sera ajoutée la réalisation d’une formule leucocytaire microscopique si les données quantitatives de l’automate ne sont pas satisfaisantes. Il reste néanmoins des limites liées à la nature même de cet examen, qu’il est nécessaire de connaître afin d’éviter tout biais dans l’interprétation des résultats et les frottis d’intérêt devront ensuite être conservés. Les circonstances les plus courantes nécessitant la réalisation d’un frottis sanguin sont les suivantes [2]:
présence d’anomalies quantitatives de l’hémogramme : thrombopénie, leucopénie ou hyperleucocytose (selon les données de la formule leucocytaire automatisée), anémie (pour la recherche
3
d’anomalies morphologiques des hématies), macrocytose ou microcytose isolées ;
présence d’anomalies quantitatives de la formule leucocytaire : neutropénie ou agranulocytose, hyperlymphocytose, monocytose; présence d’alarmes « constructeur », liées à une difficulté à identifier
ou séparer les populations leucocytaires : suspicion de présence de blastes, de cellules lymphoïdes anormales, de schizocytes par exemple.
Ces anomalies peuvent être liées entre elles, l’examen du frottis peut permettre un diagnostic ou au moins l’orientation vers un diagnostic. Les conditions de travail au microscope se sont considérablement modifiées, avec notamment la standardisation de la confection des frottis et des colorations qui facilitent la lecture au microscope et rendent plus aisée l’interprétation en cas d’anomalies. La coloration combinée de May-Grünwald-Giemsa (MGG), dite «coloration panoptique de Pappenheim », et celle de Wright ont succédé à l’ancienne coloration aux triacides d’Ehrlich modifiée par Romanovski. Les colorants de ce groupe contiennent du bleu de méthylène (colorant basique) et de l’éosine (colorant acide) en différentes proportions et ils diffèrent aussi par la méthode utilisée pour activer le bleu de méthylène. Avec le nombre croissant de demandes d’analyses biomédicales les techniques manuelles classiques se trouvent dépassées pour répondre à ce grand besoin, l’introduction des instruments automatiques soulage efficacement cette situation en procurant des résultats d’analyse rapides et fiables. Pour une lecture optimale du frottis sanguin, des colorations automatisées ont été aussi développées ainsi que
4
plusieurs types de techniques de confection automatisée d’étalements sanguins avec un ajustement en fonction de l’hématocrite ont été successivement mis en place [1].
L’objectif de notre travail est d’évaluer deux colorations panoptiques : MCDH (RAL Stainer), une coloration formulée sans méthanol, prête à l'emploi et ne nécessite aucune dilution assurant ainsi reproductibilité et standardisation, et May-Grunwald-Giemsa (MGG) à pH7 (Sysmex SP1000) : possédant une unité de préparation et de coloration de lames complètement automatisée et intégrée qui permet la préparation cohérente et fiable de frottis sanguins de haute qualité.
5
Matériels
et méthodes
6
II. MATERIELS ET METHODES :
L’étude est menée au niveau du laboratoire central d’hématologie à l’hôpital Ibn Sina (Rabat). La population cible est constituée des patients ayant présenté un hémogramme nécessitant la réalisation d’un frottis sanguin. L’effectif de notre échantillon est de 60 frottis sanguins. Les critères d’étude sélectionnés pour examiner l’apparence des frottis sont la coloration des hématies, leur forme, la netteté de l'image et sa brillance [3].
II.1 L’automate de coloration des lames RAL Stainer :
Le RAL Stainer est un automate de coloration simple d’utilisation il propose comme coloration hématologique le Kit RAL Stainer MCDh .Les réactifs sont conditionnés dans des bacs scellés, munis d’une puce RFID pour éviter toute utilisation du réactif au-delà de la date limite d’utilisation et tout excès, problème récurrent avec les procédés « ouverts ». Les protocoles de coloration ont été optimisés pour les frottis sanguins périphériques préparés avec l’Hemoslider. L’analyseur permet un chargement et un déchargement en continu, en laissant la possibilité d’insérer une lame urgente à tout moment. L’ensemble ne nécessite aucune maintenance et, du point de vue de la sécurité et des questions environnementales, les colorants sont dépourvus de méthanol [4].
7
Figure 1. Présentation de l‘automate de coloration de lames RAL STAINER [5]. II.1.1 Principe :
La coloration panoptique MCDh permet de réaliser la formule sanguine et médullaire, elle s’effectue par l’utilisation successive de quatre réactifs : le MCDh 1, le MCDh 2, le MCDh 3 et le MCDh 4. Le MCDh 1, formulé avec de l’alcool éthylique, est un mélange de colorants neutres ; il permet la fixation du frottis et prépare la coloration, notamment, des éléments hydrosolubles tels que les granulations basophiles. Ces colorants sont inactifs en milieu alcoolique et n’agissent de façon sélective qu’au moment de leur libération dans la solution MCDh 2. Cette libération provoque la précipitation des colorants neutres permettant la coloration des hématies, du cytoplasme des granulocytes neutrophiles ainsi que les granulations éosinophiles. Le MCDh 3 est une solution aqueuse de couleur bleue, qui permet la coloration du cytoplasme des
8
monocytes et des lymphocytes. Le MCDh 3 permet également le phénomène de métachromasie en colorant les granulations azurophiles en rouge. Enfin, le MCDh 4 vient éliminer l’excès de colorant et participe à la différenciation des éléments cellulaires grâce à l’action d’agents de rinçage spécialement sélectionnés. Ce dernier réactif est fourni sous la forme d’un concentré qu’il faut diluer à 6 litres avec de l’eau, de préférence déminéralisée. C’est l’action successive des 4 réactifs qui permet l’apparition de la couleur violette au niveau de la chromatine, des plaquettes et des granulations neutrophiles [6].
II.1.2 Description du kit : [6]
9
Figure 3. Le Kit MCDh du RAL Stainer [6]. II.1.3 Caractéristiques techniques : [7]
Kit de réactifs MCDh pour RAL Stainer - Prêt à l'emploi
- Capacité de coloration maximale 500 lames - Durée de conservation 18 mois avant ouverture - 20 jours après ouverture
- Température de stockage entre 15 °C et 30 °C Débit Selon le protocole de coloration utilisé.
- Protocole de coloration standard 11 min - Cycle de séchage : 2 minutes
- Coloration, 4 bains de coloration et 1 bain de rinçage - Capacité de chargement jusqu'à 10 lames par support
10
- 2 stations de chargement
Dimensions automate de coloration RAL - Hauteur 62,4 cm
- Diamètre 42,5 cm - Poids 28 kg
- Coloration supportée, kit de réactifs MCDh (sans méthanol) - Entretien, aucune préparation de réactif
- Pas de maintenances
- Température ambiante 15 °C à 30 °C
- Consommation électrique 150 VA ou moins - 50 – 60 Hz
- 110 – 23 V
II.1.4 Mode opératoire :
II.1.4.1 Préparation des frottis sanguins :
Le principe de confection d'un frottis consiste à étaler une goutte de sang uniformément sur une lame de verre, de manière à obtenir une seule couche de cellules, qui après coloration et fixation, pourra permettre d'effectuer l'étude morphologique des éléments figurés du sang, et de déterminer s'il y a anomalies de présence, d'aspect ou de nombre de cellules[8].
11
II.1.4.2 Mise en place du kit de coloration : [5,6]
Si à l’allumage, l’appareil ne détecte pas de kit de coloration, il demande d’insérer un kit de coloration.
Dans la page Réglages on a appuyé sur
On a placé les 4 flacons numérotés de 1 à 4 dans leur emplacement respectif puis on a ôté les bouchons.
On a Préparé le liquide de rinçage : dans le bidon de rinçage, on a dilué le contenu des flacons 5 (MCDh 4, concentré) jusqu’à 6 litres avec de l’eau, de préférence déminéralisée.
On a Connecté le bidon de rinçage au RAL Stainer.
Temps de réalisation : les temps de coloration de référence sont préprogrammés.
RAL Stainer est un appareil automatique de bain de coloration. Un bras qui suit une trajectoire circulaire et verticale successivement :
accroche le porteur de lames déposé par l‘utilisateur ;
Apporte le porteur de lames dans chaque réservoir de coloration et ensuite dans le réservoir de rinçage en fonction de l'enregistrement protocole ;
fait retourner le porteur de lames à sa position initiale. Les lames sont ensuite séchées.
12
Figure 4. Etapes de mise en place du kit de coloration [6].
Le bras de l’automate va ouvrir les couvercles des stations de coloration, les
portes de chargement des réactifs sont correctement alignées.
Rompre la bague d’inviolabilité puis positionner les flacons encore fermés du kit
de coloration en faisant correspondre les numéros visibles sur les étiquettes des
flacons et sur les emplacements dans l’appareil. Enlever les bouchons avec
précaution
Fermer délicatement les tiroirs de chargement des réactifs jusqu’à entendre un « clic » de verrouillage. L’automate referme
les couvercles des stations de coloration et identifie le kit de
13
Figure 5. Etapes d‘installation des lames dans leur porteur [5].
Figure 6. Etapes de chargement de lames dans l‘automate [5].
Tourner le support de lames et libérer la mâchoire en plaçant le bouton sur le O(Open)
Placer jusqu'à dix lames (identification
maintenu).
Bloquer la mâchoire par le déplacement de la manette sur la position C "Closed"
14
II.2 Unité de Préparation de Lame Hématologique Automatisée SP-1000i de Sysmex :
Le SP-1000i est la troisième génération de produits de préparation et de coloration de lame intégrés éprouvés, développés, fabriqués et soutenus par Sysmex. Dans le cadre de l’exploitation de routine, le SP-1000i offre une préparation automatisée rapide des frottis de sang périphérique pour aider les laboratoires à satisfaire et standardiser le délai d'exécution de réexamen de frottis. Il possède une unité de préparation et de coloration de lames complètement automatisée et intégrée qui permet la préparation cohérente et fiable de frottis sanguins de haute qualité. Il améliore et standardise le temps nécessaire pour préparer le frottis et applique les critères définis par le laboratoire pour préparer les frottis : Une préparation de lame réflexive [9].
Figure 7. Unité de Préparation de Lame Hématologique
15 II.2.1 Technologie : [9]
II.2.1.1 Préparation de la lame :
Utilisent une lame d'étalement robuste et auto-nettoyante pour préparer des frottis monocouches
Impriment directement sur la lame porte-objets des informations selon les options définies par le laboratoire qui peuvent comporter :
- Une ou plusieurs étiquettes de code à barres uni- ou bidimensionnelles
- Le nom du patient
- Le numéro de code à barres
- Le résultat spécifique à l'instrument
Sèchent automatiquement les frottis avant coloration. Abritent les lames dans des cassettes individuelles.
Deux tours d'entreposage latéraux intégrés offrent la capacité d'abriter des lames de couleurs différentes afin de différencier visuellement les frottis STAT des autres frottis.
II.2.1.2 Coloration :
Les colorants de type coloration de Romanovsky comportent un mélange : D’un colorant basique ou cationique comme l’azur qui colore en bleu ou bleu violet les groupements acides des acides nucléiques, des protéines du noyau et du cytoplasme, des granulations basophiles et à un moindre degré des granulations neutrophiles. Et d’un colorant acide ou anionique comme l’éosine qui colore en rouge-orangé les groupements basiques de l’hémoglobine et des granulations éosinophiles. Le colorant de May- Grunwald est une solution
16
neutre d’éosine et de bleu de méthylène dans de l’alcool méthylique ce qui permet la fixation des éléments. Lorsqu’on utilise ce colorant isolément, les noyaux sont colorés en bleu pale, les cytoplasmes en bleu très clair ou sont incolores, les granulations secondaires des granulocytes en rouge clair pour la lignée neutrophile, en bleu foncé pour la lignée basophile et en rouge-orangé pour la lignée éosinophile. Les hématies sont colorées en beige rosé. Le colorant de Giemsa est une combinaison d’éosine et de dérivés du bleu de méthylène dont l’azure. Il colore les noyaux en violet, les cytoplasmes en bleu plus ou moins intense ou en rose selon les cellules et les granulations primaires des granulocytes en rouge-pourpre intense (granulations dites alors azurophiles). Ces deux colorants, qui donnent des résultats complémentaires, ont été associes par Pappenheimer dans une coloration panoptique. Les solutions colorantes doivent être renouvelées quotidiennement, voire plus souvent si un grand nombre de lames sont colorées. En effet, la précipitation de l’éosine par l’azur B au cours du temps décroit le pourvoir colorant, la coloration violette des noyaux devient alors bleue [10].
II.2.1.3 Mécanisme d’action de la coloration MGG[11]
Le mélange de May-Grünwald, comme les autres mélanges de Romanowsky est donc un colorant neutre, un sel résultant de la combinaison d’une base et d’un acide : le premiercomposé est une base cationique bleue : le bleu de méthylène ou l’azur B de méthylène qui sont des thiazines (composés organiques ayant un cycle contenant quatre atomes de carbone, un atome d’azote et un atome de soufre). Tous deux ont une charge électrique nominale de+1. Le deuxième composé est un acide anionique rouge : l’éosine, qui est un xanthène (composé organique tricyclique constitué d’un cycle de pyrane entouré de deux
17
cycles benzéniques). La charge électrique nominale de l’éosine B et de l’éosine Y est de -2. Au contact des cellules et en présence d’eau, le mélange de May-Grünwald va se dissocier grâce à la dilution du bleu de méthylène et/ou de l’azur B en des sous-produits basiques bleus de type azur A, azur C, violet de méthylène et thionine .Le colorant de May-Grünwald va se fixer essentiellement sur les noyaux et les acides nucléiques cytoplasmiques, donc sur l’ergastoplasme (REG) et sur les ribosomes libres des cellules à forte activité de biosynthèse protéique. En effet les dimères d’azur B, unis par des forces de van der Walls et chargés positivement sont attirés par les charges électronégatives des groupements phosphate de l’ADN et par des interactions hydrophobes avec les bases puriques (A, G) et pyrimidiques (C, T). L’éosine, quant à elle, se fixe préférentiellement sur les protéines ayant des charges positives (groupements aminés et chaînes latérales de la lysine et de l’arginine), c’est-à-dire sur les membranes et sur les cytoplasmes ainsi que sur l’hémoglobine. Les caractéristiques tinctoriales des différents composants cellulaires sont résumées dans le tableau suivant :
18
Tableau I. Affinités tinctoriales des différents constituants
cellulaires après coloration panoptique [10].
Noyau Violet
Nucléole Bleu
Corps de Jolly Violet
Cytoplasme Bleu +/- intense
Granulations primaires, corps d’Auer Pourpre / Violet-pourpre
Granulations neutrophiles Violet clair / Rose
Granulations éosinophiles Orange
Granulations basophiles Violet foncé / Noir
Corps Döhle Bleu pale
19
Tableau II. Protocole de coloration May Grunwald Giemsa avec tampon RAL pH 7.0 [12]. Etapes de
coloration Réactif Temps Remarque Colorant 1 :
Préfixation
Solution May Grunwald pour systèmes SP automatiques Colorant 1 : Fixation séchage 15 secondes Colorant 1 : Non diluée
Solution May Grunwald pour systèmes SP automatiques
5 secondes
Colorant 1 : Diluée (1 :10)
Solution May Grunwald pour systèmes SP automatiques / solution tampon pH =7.0 pour
systèmes SP automatiques 2 minutes 30 secondes Colorant 2 : Diluée (1 :25)
Solution Giemsa pour systèmes SP automatiques / solution tampon pH =7.0 pour systèmes
SP automatiques
3 minutes
Rinçage Sysmex SP-rinçage 7 minutes
Séchage de lame Réutilisation du
colorant 1
Solution May Grunwald pour systèmes SP automatiques
10 minutes
Sur dispositif de chauffage
Tampon Solution tampon pH = 7.0 pour
systèmes SP automatiques 5 temps
Rinçage Sysmex SP –rinçage
Dans le protocole standard ci-dessus le tampon RAL pH 7,0 est utilisé. L’avantage de l’utilisation du tampon RAL est de réaliser une meilleure expression de la granulation dans le cytoplasme des neutrophiles segmentés. Les globules rouges sont intensément colorés avec une expression claire de la forme biconcave des cellules [12].
20
II.3 Les critères de jugement des colorations : [3] Les critères de sélection que nous avons choisis sont:
● Coloration : 3 colorations ont été définies:
Brillance comporte 3 niveaux :
Le gris Le gris rosé Le rouge
21
● Netteté de l’image: la clarté de l’espace interstitiel entre les hématies
22
23
III. RESULTATS :
La variation de la netteté et la forme des globules rouges selon les deux méthodes de coloration MCDH (RAL Stainer) et May-Grunwald-Giemsa (MGG) à pH7 (Sysmex SP1000) sont représenté dans les graphes suivants :
Figure 8. Graphe représentant la variation de la netteté des frottis sanguins selon les deux
méthodes de coloration : automatique et semi-automatique.
Figure 9. Graphe représentant la forme des globules rouge selon les deux méthodes
24
25
IV. DISCUSSION :
La réalisation ou la confection d'un frottis sanguin de bonne qualité ou d'un bon frottis sanguin doit suivre une procédure précise avec un minimum d'entrainement et une maitrise parfaite de la manipulation des produits sanguins. La réalisation d'un bon frottis nécessite également la maitrise des manipulations à effectuer en adéquation avec le matériel choisi [8]. La préparation du frottis se fait à partir de sang total, prélevé récemment (moins de 6 heures idéalement) soit par ponction veineuse sur tube éthylène diamine tétra-acétique (EDTA), soit directement par prélèvement capillaire si la ponction veineuse n’est pas réalisable. La qualité du matériel utilisé est un élément essentiel : lames de verre dégraissées à bord rodés et pans coupés, tubes capillaires en verre. L’opérateur prendra soin d’utiliser des gants jetables, compte tenu du risque de contact avec le sang. La technique manuelle d’étalement suit les étapes décrites ci-dessous, et doit être réalisée par un opérateur habilité: [2]
préparer la ou les lames, posées horizontalement sur un plan dur non incliné ;
homogénéiser le sang dans le tube par retournements successifs (insister en cas de leucopénie) ;
déposer une goutte de sang à l’extrémité de la lame ;
maintenir la lame posée avec la main non directrice, et présenter avec la main directrice une seconde lame inclinée de 30◦ à 45◦ devant la goutte; mettre en contact la seconde lame avec la goutte en la tirant en arrière, puis laisser diffuser le sang le long de l’arête (bien faire attention à récupérer la totalité de la goutte) ;
26
étaler le sang vers l’autre extrémité de la lame posée en glissant la seconde lame d’un mouvement régulier, sans appuyer exagérément, de manière que la totalité du sang soit étalée sur la lame ;
identifier le frottis selon la procédure en vigueur dans le laboratoire, puis le laisser sécher à l’air libre sans forcer le séchage (pas d’agitation ou d’utilisation de séchoir, qui peuvent abîmer les cellules et compromettre leur identification ultérieure).
Lors de l’étalement, il convient d’adapter son geste à la viscosité du sang : [2] sang de viscosité basse (anémie) : le mouvement doit être plus rapide
que la normale et/ou la lame tenue plus verticalement (angle supérieur à 45◦) ;
sang de viscosité haute (polyglobulie, hyperleucocytose supérieure à 100 g/l, hypergammaglobulinémie) : le mouvement doit être plus lent et/ou la lame tenue moins verticalement (angle inférieur à 45◦).
Les analyseurs modernes peuvent être équipés d’un étaleur, qui permet la préparation automatisée des frottis de sang. L’étalement est réalisé selon le même principe que la méthode manuelle avec une adaptation des paramètres d’étalement de l’automate au taux d’hématocrite afin d’obtenir une qualité de frottis reproductible quelle que soit la viscosité du sang [2].
27
Figure 11. Adaptation de la technique d’étalement à la viscosité du sang [2].
Le frottis sanguin n’a qu’une conservation limitée et doit être coloré rapidement, sans fixation préalable. Il peut être coloré par différentes techniques : la plus couramment utilisée est celle de May-Grünwald-Giemsa, pour réalisation de la formule leucocytaire et étude morphologique des cellules, mais peuvent également être utilisées des techniques cytochimiques (mise en évidence de la myéloperoxydase dans des blastes sanguins par exemple) ou immunocytochimiques [2].
La coloration manuelle des frottis sanguins par May-Grünwald-Giemsa est réalisée selon les étapes suivantes : (MGG)
28
Les frottis ou appositions doivent être séchés très rapidement (agitation à l’air, lames préchauffées à 40◦C sur platine, lampe à infrarouges, sèche-cheveux sur position « froid », hotte ventilée ...). Pour autant la dessiccation des frottis n’est pas une véritable fixation et il faut faire agir un fixateur comme le méthanol. Comme le rappelle Bessis « Lorsque les frottis sont destinés à être colorés par le MGG on utilise la fixation par le méthanol absolu » mais « en pratique la solution-mère de May-Grünwald est dissoute dans le méthanol qui sert de fixateur ». C’est pourquoi dans toute coloration de MGG le premier temps (May-Grünwald pur) est une étape de fixation et les cellules qu’on examine à l’issue de ce temps ne présentent aucune coloration. Dans la plupart des équipes, on utilise soit la méthode de Bessis (3 minutes de solution alcoolique de May-Grünwald pure versée sur les frottis/appositions afin qu’ils soient entièrement couverts), soit le méthanol absolu (un minimum de 2 minutes, le temps optimal étant de 10 à 15 minutes pour Lopez Cardozo, 10 minutes étant la durée généralement choisie par les équipes qui travaillent en récipients, que ce soit en méthode manuelle ou automatisée) .
Les deux temps de la coloration : [11]
Après le temps de fixation (3 à 5 minutes de May-Grünwald pur versé sur les frottis/appositions afin qu’ils soient entièrement couverts, ou 10 minutes de méthanol absolu en bac à coloration), on ajoute autant d’eau tamponnée qu’on aura utilisé de May-Grünwald : 2 à 3 minutes (Wright) ,3 minutes (Bessis) ou 5 minutes (Koss). Ce n’est que lorsque le May-Grünwald est dilué pour moitié avec de l’eau tamponnée qu’on obtient une coloration. Wright(1902) précise que l’application du mélange de Romanowsky (l’actuel May-Grünwald) donne aux hématies une teinte bleue, et que la coloration différentielle ne se développe
29
qu’avec le rinçage à l’eau en fin de coloration (de préférence distillée), les hématies devenant «verdâtres, puis jaunâtres et finalement orangées ou rosées », la décoloration prenant 1 à 3 minutes et l’eau de rinçage résultant de la décoloration étant bleue.
Après le temps de coloration au May-Grünwald dilué on doit éliminer le colorant et, sans laver, passer les lames dans la solution de Giemsa. On doit préparer la solution de Giemsa extemporanément : Bessis préconise de préparer « 30 mL d’eau distillée dans une éprouvette avec 15 gouttes de Giemsa près de la surface : le colorant reste à la partie supérieure de l’eau sans se mélanger. Puis on verse le contenu de l’éprouvette sur les lames, frottis à la face inférieure pour éviter que des précipités ne tombent sur la surface colorée ». La durée de la coloration est de 10 à 30 minutes (Bessis) ou de 15 minutes (Koss) .Les frottis sont ensuite lavés sous un fort courant d’eau du robinet (running water : 1 à 3 minutes pour Wright, 1 à 2 minutes pour Koss), ce qui permet de développer tous les aspects de la polychromie, puis séchés.
Ces précisions appellent deux commentaires : dans la dilution de la solution-mère de Giemsa, Bessis ne conseille pas d’utiliser de l’eau tamponnée mais seulement de l’eau distillée, ce que reprennent Ganter et Jolles ainsi que Koss y compris dans l’édition de 2006, page 1616 , et colorer à l’envers, c’est le principe de fonctionnement de l’automate fermé Bayer Hématek®2000. Bessis(1972) ainsi que Lopez Cardozo (1973) recommandent de ne pas monter les lames avec des lamelles (pratique répandue dans les laboratoires de biologie polyvalente et en hématologie)
![Figure 1. Présentation de l‘automate de coloration de lames RAL STAINER [5].](https://thumb-eu.123doks.com/thumbv2/123doknet/15041503.691793/40.892.128.773.131.534/figure-présentation-de-automate-coloration-lames-ral-stainer.webp)
![Figure 3. Le Kit MCDh du RAL Stainer [6].](https://thumb-eu.123doks.com/thumbv2/123doknet/15041503.691793/42.892.110.759.131.510/figure-kit-mcdh-ral-stainer.webp)
![Figure 4. Etapes de mise en place du kit de coloration [6].](https://thumb-eu.123doks.com/thumbv2/123doknet/15041503.691793/45.892.107.824.168.405/figure-etapes-mise-place-kit-coloration.webp)
![Figure 7. Unité de Préparation de Lame Hématologique Automatisée SP-1000i de Sysmex [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/15041503.691793/47.892.266.627.598.902/figure-unité-préparation-lame-hématologique-automatisée-sp-sysmex.webp)
![Tableau II. Protocole de coloration May Grunwald Giemsa avec tampon RAL pH 7.0 [12].](https://thumb-eu.123doks.com/thumbv2/123doknet/15041503.691793/52.892.98.786.159.798/tableau-protocole-coloration-may-grunwald-giemsa-avec-tampon.webp)
![Figure 11. Adaptation de la technique d’étalement à la viscosité du sang [2].](https://thumb-eu.123doks.com/thumbv2/123doknet/15041503.691793/60.892.107.778.130.487/figure-adaptation-technique-étalement-viscosité-sang.webp)