HAL Id: tel-00719093
https://tel.archives-ouvertes.fr/tel-00719093
Submitted on 19 Jul 2012
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
l’habitat post-installation chez les poissons
récifaux-lagonaires de Nouvelle-Calédonie
Camille Mellin
To cite this version:
Camille Mellin. Sélection de l’habitat à l’installation et utilisation de l’habitat post-installation chez les poissons récifaux-lagonaires de Nouvelle-Calédonie. Ecologie, Environnement. Université Pierre et Marie Curie - Paris VI, 2007. Français. �tel-00719093�
UNIVERSITE PIERRE &MARIE CURIE ECOLE PRATIQUE DES HAUTES ETUDES
THESE DE DOCTORAT
Spécialité Océanologie Biologique et Environnement Marin
Présentée par Camille Mellin
Pour obtenir le grade de
Docteur de l’Université Paris VI et de l’Ecole Pratique des Hautes Etudes
Sélection de l’habitat à l’installation et utilisation de l’habitat post-installation
chez les poissons récifaux-lagonaires de Nouvelle-Calédonie
Thèse dirigée par René Galzin et Dominique Ponton
Soutenue le 11 décembre 2007, devant le jury composé de :
M. R. GALZIN Professeur, EPHE Perpignan Directeur de thèse
M. M. MEEKAN Ph.D., AIMS Townsville Rapporteur
M. P. NIVAL Professeur, Université Paris VI Examinateur
M. D. PONTON Directeur de Recherche, IRD Nouméa Directeur de thèse M. E. THIEBAUT Maître de Conférences, Université Paris VI Examinateur M. L. WANTIEZ Maître de Conférences, Université de Nouvelle-Calédonie Rapporteur
Remerciements RemerciementsRemerciements Remerciements
Ces trois années de thèse ont été pour moi une expérience plus qu’enrichissante, sur le plan professionnel mais aussi sur le plan humain. C’est avec une grande sincérité que je tiens à remercier tous ceux que j’ai croisés sur ma route entre la France et le Pacifique ; ceux qui m’ont conseillée, écoutée, guidée ou encore épaulée dans les moments difficiles.
Je tiens tout d’abord à adresser mes remerciements les plus sincères à mes directeurs de thèse. Dominique, il m’est difficile de trouver les mots pour te remercier... Tu as été un encadrant exceptionnel et sans toi cette thèse n’aurait pas été ce qu’elle est. Merci du fond du cœur pour ta patience, ton écoute, ta disponibilité ; merci pour avoir tempéré le caractère fonceur et entêté auquel tu as eu affaire... J’ai réalisé ma thèse dans des conditions exceptionnelles grâce à toi. Merci aussi pour toutes ces discussions passionnantes où nous refaisions le monde des jeunes poissons et dont je garde un souvenir impérissable. Dominique, merci pour tout... René, j’ai finalement passé peu de temps auprès de toi, mais ces moments m’ont beaucoup apporté. Merci de m’avoir fait confiance, de m’avoir permis de réaliser ce projet.
Un grand merci à Mark Meekan et Laurent Wantiez, mes deux rapporteurs, pour leurs conseils avisés et pour avoir amélioré la qualité de ce travail. Merci aux membres du jury d’avoir porté attention à ce travail et de m’avoir accordé leur disponibilité. Merci aux membres de mon comité de thèse pour leur écoute et leurs suggestions qui m’ont permis de construire ce projet.
Je tiens à remercier les laboratoires et les équipes de recherche qui m’ont accueillie au cours de ma thèse. Merci à Fabrice Colin pour m’avoir accueillie au sein du centre IRD de Nouméa pendant presque trois ans. Merci à l’ensemble du personnel administratif et aux services techniques de l’IRD Nouméa, qui m’ont offert un soutien exceptionnel pour réaliser ma thèse. Je tiens aussi à remercier du fond du cœur certains chercheurs du centre qui, bien que n’étant pas officiellement impliqués dans ma thèse, m’ont écoutée et conseillée : merci tout particulièrement à Claude Payri, Olivier Pringault, Pascal Douillet et Sylvain Ouillon.
Merci à l’ensemble des chercheurs et étudiants de l’EPHE Perpignan pour leur soutien pendant la dernière ligne droite et pour leurs conseils sur la soutenance. Merci tout particulièrement à Serge Planes, Mehdi Adjeroud et Cécile Fauvelot.
Je remercie du fond du cœur toute l’unité de recherche Coréus dont j’ai extrêmement apprécié le dynamisme, l’écoute et aussi l’ambiance. Merci à Jocelyne Ferraris pour m’avoir permis de réaliser ma thèse dans cette équipe et pour m’avoir représentée auprès des différents services de direction et d’administration de l’IRD. J’ai rencontré des personnes exceptionnelles au sein de l’UR Coréus, et je voudrais notamment remercier du fond du cœur Pascale Chabanet, Serge Andréfouët et Michel Kulbicki. Pascale, ma petite Plume, ces trois ans passés à tes côtés m’ont permis de découvrir une femme formidable, qui continue à croire en ses rêves et à s’émerveiller devant la beauté des récifs. Tes films et récits de voyage dans l’Océan Indien m’ont toujours fait rêver et j’espère t’y rejoindre un jour. Plume, merci pour tout... Serge, je n’ai jamais réussi à comprendre comment tu faisais pour gérer autant de projets, de contrats, de conventions tout en restant zen. Merci de m’avoir fait découvrir le « transfert d’échelles » et de m’avoir inspiré tant d’idées pour des recherches futures. J’espère du fond du cœur que nous aurons l’occasion de continuer à travailler ensemble. Michel, tu m’as transmis ta passion des poissons récifaux et j’ai été honorée que tu me confies ta gigantissime base de données
qui m’a permis d’explorer la complexité des « kulbicubes ». Nos discussions sur la dispersion larvaire, la biogéographie et le degré d’isolement m’ont passionnée. Merci également à David Lecchini, Marc Léopold, Pascal Dumas, Philippe Borsa et Dominique Pelletier pour leurs conseils avisés et leur soutien au cours de ma thèse. Merci aussi à Laurent Vigliola, j’ai beaucoup apprécié notre collaboration et j’espère que nous continuerons à travailler sur ces histoires de mortalité sélective.
Ce travail n’aurait pas vu le jour sans l’aide précieuse des personnes qui m’ont aidée sur le terrain et au laboratoire. Mon plus profond remerciement revient à celui qui ne voulait pas voir apparaître son nom sur cette page. Je respecte ta volonté ; tout le monde te reconnaîtra quand même. Mon mentor tahitien, qui m’a appris les noms latins de plusieurs centaines d’espèces de poissons, qui m’a accompagnée dans les vagues et contre les courants, parfois sous des rafales à 35 nœuds... Tu gardais toujours le sourire même quand je n’étais foutue de ramener que du « cochon » pour ton pique-nique ou quand je râlais contre Sam. Ce n’est pas parce que je te remercie que tu n’entendras plus parler de moi, ne t’inquiète pas... Merci à Joseph Baly, « Jojo », pour sa force tranquille, son extrême patience et sa précision au laboratoire. Merci aux pilotes du Coris et de l’Aldric, Miguel Clarque, Samuel Tereua et Napoléon Colombani, qui ont assuré la navigation dans toutes les conditions et dans la bonne humeur. Merci aux plongeurs, Jean-Louis Menou, Eric Folcher, Cathy Geoffray et Franck Bouilleret, ainsi qu’à Jean-Michel Boré pour leur précieuse aide sous-marine. Merci aux stagiaires que j’ai co-encadrés, Sigrid Lehuta, Arnaud Grüss et Emeline Rolland, qui ne doivent pas garder que des bons souvenirs du tri des échantillons avec le mal de mer, ou de mes gros yeux quand toutes les seringues de clou de girofle s’éparpillent à la surface...
Merci à tous les thésards, stagiaires et « CDDistes » de l’IRD Nouméa qui m’ont si bien entourée pendant ma thèse ; merci particulièrement à Laure, Lydiane, Patricia, Nico, Greg, Xav, Aymeric, Pascal, Isa, Ben, Daouda, Céline, Andrès et Romain. Merci aux « voisins » de la CPS pour leur amitié, leur bonne humeur et les apéros du vendredi soir : merci à Phil, Nad, Scott, Antoine & Aude. Merci aux copains de Perpignan, notamment Jérémy, Pablo et mes deux collocs, Ambroise et Elodie, pour leur réconfort et leurs bons petits plats (surtout la tarte tatin ;-).
Je ne serai évidemment jamais arrivée là sans l’aide et le soutien de ma famille. Merci à mes parents de m’avoir épaulée pendant ces longues années d’étude et d’avoir supporté ma longue absence au bout du monde. Je vous suis infiniment reconnaissante pour ce soutien précieux et j’espère vous rendre un jour le bonheur que vous m’avez apporté… Un grand merci également à mes amis de « Chti’Land », de Paris ou de Londres qui restent toujours dans mon cœur, même à 20 000 km.
Enfin, merci à Alex, qui a m’a supportée pendant ces derniers mois de thèse, et qui s’est démené depuis l’atoll d’Ouvéa pour arriver à Paris la veille de la soutenance. Tu n’imagines pas à quel point tes « ondes positives » m’ont réconfortée et encouragée à ce stade de la thèse… Je te dois beaucoup.
Ce travail a bénéficié de financements de l’IRD, du Programme d’Evaluation des Ressources Marines de la Zone Economique Exclusive de Nouvelle-Calédonie (ZoNéCo), du Ministère de l’Outre-Mer, du Programme National d’Environnement Côtier (PNEC) et de l’initiative régionale française pour la protection et la gestion des récifs coralliens (CRISP), ainsi que d’une allocation de recherche nationale attribuée par le Ministère de l'Enseignement supérieur et de la Recherche.
« Vagabonder à la surface des océans est souvent source de sérénité, et, parfois, permet de tutoyer ses rêves. S’y immerger, c’est s’ouvrir à son observation et à sa compréhension »
Sommaire
Introduction générale... - 3 -
1. Cycle de vie des poissons récifauxlagonaires ... 3
2. L’habitat essentiel : un concept dynamique... 4
3. Echelles spatiotemporelles de description de l’habitat essentiel... 7
4. Structure spatiotemporelle des assemblages de juvéniles à l’installation ... 7
5. Structure spatiotemporelle des assemblages de juvéniles postinstallation ... 11
6. Contexte local ... 17
7. Questions et objectifs de la thèse... 20
-Chapitre 1 : Estimation des caractéristiques du microhabitat corallien disponible pour les juvéniles par une méthode photographique... - 29 -
Soumis à Journal of Experimental Marine Biology and Ecology Chapitre 2 : Schémas spatiaux d’abondance, de croissance larvaire et juvénile chez une espèce de poisson récifal à l’échelle de colonies coralliennes ... - 47 -
A soumettre à Aquatic Biology Chapitre 3 : Schémas spatiaux de croissance larvaire et juvénile chez trois espèces de poissons récifaux à l’échelle de deux îlots ... - 67 -
A soumettre à Oecologia Chapitre 4 : Schémas spatiaux d’installation des juvéniles sur des récifs artificiels en fonction de la durée d’immersion et à l’échelle de deux îlots ... - 87 -
Soumis à Journal of Experimental Marine Biology and Ecology Chapitre 5 : Schémas saisonniers et ontogéniques de l’utilisation de l’habitat à l’échelle du lagon sud-ouest... - 111 -
Accepté à Estuarine, Coastal and Shelf Science Chapitre 6 : Prédictions spatialisées du nombre d’espèces et d’individus juvéniles à l’échelle de deux îlots ... - 135 -
Accepté à Coral Reefs Discussion générale... - 161 -
Estimation des caractéristiques du microhabitat corallien... 161
Sélection d’un habitat à l’installation ... 163
Habitat et processus postinstallation ... 167
-Conclusions et perspectives ... - 177 -
Références citées ... - 184 -
Introduction générale
Les récifs coralliens, dont la diversité spécifique est souvent comparée à celle des forêts tropicales humides (Connell, 1978), ont été largement impactés par les perturbations climatiques (Hughes et al., 2003), la pollution (Hughes, 1994 ; McClanahan et al., 2002), les techniques de pêche destructives et la surexploitation des ressources (Pauly et al., 2002) durant les dernières décennies. Les phénomènes de blanchissement corallien, de dégradation des habitats et d’effondrement des populations de poissons herbivores se multiplient de manière inquiétante, induisant parfois un changement radical dans la structure de l’écosystème récifal (Hughes, 1994 ; McClanahan et al., 2002). Ces perturbations désormais chroniques diminuent la résistance et la résilience des écosystèmes récifaux et, par conséquent, menacent la pérennité des ressources économiques qui y sont associées (Nyström et al., 2000). A l’échelle mondiale, 30% des écosystèmes récifaux sont d’ores et déjà considérés gravement perturbés tandis que 60% auront probablement disparu à l’horizon 2030 (Hughes et al., 2003). Face à cette « crise écologique » (sensu Bellwood et al., 2004) il apparaît nécessaire d’approfondir nos connaissances sur les processus qui conditionnent le renouvellement des populations de poissons, et donc la pérennité des ressources qui y sont associées. Le recrutement peut être défini par l’intégration de nouveaux individus parmi les individus sexuellement matures (Sale, 1991) ; il marque l’issue des premiers stades de vie des poissons dont les abondances présentent une importante variabilité spatio-temporelle et qui, de fait, ont longtemps été considérés comme une « boîte noire » par les écologistes. Ce n’est que depuis 1980 que le développement des techniques d’échantillonnage permet d’étudier ces premiers stades de vie (Leis & McCormick, 2002 ; Cowen, 2002).
1. Cycle de vie des poissons récifaux-lagonaires
La majorité des poissons récifaux-lagonaires possèdent un cycle de vie complexe (Figure 1) avec une phase pélagique potentiellement dispersive pour les larves, suivie d’une phase benthique pour les juvéniles et les adultes (Victor, 1991 ; Jones et al., 1999 ; Mora & Sale, 2002 ; Lecchini & Galzin, 2003). La phase pélagique peut varier, selon l’espèce, entre 10 et 100 jours et, pour une même espèce, selon les conditions rencontrées dans l’environnement pélagique (Leis, 1991). A l’issue de la phase pélagique, les larves deviennent compétentes, c.-à.-d. elles atteignent un stade de développement qui leur permet de quitter le milieu pélagique et de s’installer dans un habitat benthique (Leis & McCormick, 2002). Les larves sont alors
exposées à un environnement complexe où le choix d’un habitat s’impose parmi de nombreux substrats potentiels et malgré divers prédateurs et compétiteurs (Carr & Hixon, 1995 ; Webster, 2002 ; Srinivasan, 2003 ; Adams et al., 2004). L’installation est donc la transition du stade larvaire pélagique au stade juvénile benthique (Andrews & Anderson, 2004).
Les premiers stades de vie des poissons récifaux-lagonaires, caractérisés par d’importants taux de mortalité, représentent un goulot d’étranglement des abondances. De plus, chaque transition entre deux stades de développement implique un changement comportemental, morphologique ou écologique ; ces transitions constituent des étapes critiques qui déterminent les abondances aux stades de développement ultérieurs (Leis & McCormick, 2002). Pendant la phase larvaire, plus de 99% des individus n’atteindront pas le stade d’installation (Leis, 1991). A partir de l’installation, même si la mortalité varie en fonction de l’espèce, et dans le temps pour une même espèce, le taux de mortalité peut atteindre 60% le jour de l’installation et de 9% à 20% par jour après l’installation (Doherty et al., 2004). D’après la théorie de « croissance-mortalité », la probabilité qu’un individu survive est d’autant plus élevée que sa croissance est rapide (Anderson, 1988 ; Cowen & Sponaugle, 1997). Cette théorie suggère que les individus de taille élevée à un âge donné ont plus de chance d’échapper aux prédateurs et s’alimentent plus facilement, ce qui se traduit en général par une croissance plus élevée, des stades larvaire et juvénile plus courts et/ou une vulnérabilité aux prédateurs réduite (Cowan et al., 1997 ; Hawn et al., 2005). La croissance, et par conséquent la survie des jeunes poissons après l’installation, peuvent être favorisées par la disponibilité des ressources alimentaires (Verweij et al., 2006) ainsi que par la qualité de l’habitat en terme de refuge (Forrester, 1990 ; Shima & Osenberg, 2003 ; Lecchini et al., 2007b). L’habitat sélectionné à l’installation est donc primordial pour les jeunes poissons car il peut conditionner leur croissance et leur survie, et donc le succès de leur recrutement dans les populations adultes.
2. L’habitat essentiel : un concept dynamique
L’ontogénie est le processus qui correspond à la différenciation des stades de développement au cours de la vie de l’organisme (Lévêque, 2001). Le cycle biologique ne peut s’accomplir que si l’individu trouve les conditions nécessaires à son développement à chacun des stades ontogéniques. Or les stades ontogéniques successifs sont en général caractérisés par des exigences écologiques, physiologiques et biologiques différentes, ce qui peut impliquer la fréquentation d’habitats différents (Kramer et al., 1997 ; Dahlgren & Eggleston, 2000).
Pour les premiers stades de vie, l’habitat essentiel a été défini comme étant « un milieu où les abondances, les taux de croissance et de survie des jeunes poissons, et le nombre d’individus qui recrutent par unité de temps sont relativement élevés » (Hook et al., 2003). D’autres auteurs définissent l’habitat essentiel comme celui qui contribue le plus au renouvellement des populations adultes (Beck et al., 2001 ; Dahlgren et al., 2006). Cette deuxième définition implique qu’au moins un des facteurs incluant abondances, taux de croissance, taux de survie et recrutement par unité de temps soit plus élevé dans l’habitat essentiel que dans les autres habitats des juvéniles (Figure 2). Cependant, la contribution effective d’un habitat de juvéniles au renouvellement des populations adultes s’avère souvent difficile à mesurer (Gillanders et al., 2003). Dans le cadre de cette thèse, l’habitat essentiel des juvéniles a été considéré sous l’angle des abondances et des taux de croissance des juvéniles, comme cela a déjà été fait dans certaines études en milieu tempéré (p. ex. Gilliers et al., 2006).
Chez les juvéniles de poissons récifaux-lagonaires, les habitats essentiels diffèrent suivant les espèces et, pour une même espèce, diffèrent souvent des habitats des adultes (Shapiro, 1991). Chez plusieurs espèces dont les adultes mènent une vie récifale relativement sédentaire, les juvéniles se retrouvent en grande densité dans les habitats non récifaux tels que les herbiers et les mangroves. Ces habitats, considérés comme zones nourriceries, peuvent ensuite être le point de départ de déplacements post-installation vers le(s) lieu(x) de vie des adultes (Cocheret de la Morinière et al., 2002). A Lizard Island (Grande Barrière), chez trois espèces étudiées par McCormick et Makey (1997) le passage de la larve compétente au juvénile varie, selon l’espèce, du développement continu à une succession de sauts ontogéniques accompagnés de changements d’habitat. Les changements d’habitat au cours de l’ontogénie diffèrent selon l’espèce (Caselle & Warner, 1996) et conditionnent en grande partie la distribution spatiale des individus (Lecchini & Galzin, 2005).
L’habitat essentiel des juvéniles est donc une notion dynamique : c’est la référence spatiale et temporelle désignant la position qu’occupe à un instant donné une densité importante de juvéniles qui optimisent le compromis entre différentes contraintes biologiques et écologiques. La quantité, la taille et la connectivité de ces habitats essentiels sont des conditions nécessaires à la pérennité des ressources car elles conditionnent fortement le renouvellement des populations adultes (Schmitten, 1999 ; Andrews & Anderson, 2004 ; Dahlgren et al., 2006).
Figure 2 : Représentation schématique des facteurs caractérisant l’habitat essentiel de juvéniles, ici Naso
unicornis. La largeur des flèches indique la contribution de chaque facteur au recrutement. Les juvéniles présents
dans un habitat essentiel (en gris) présentent en moyenne des densités, des taux de survie et de croissance et/ou des mouvements vers les habitats adultes qui sont plus importants que pour les juvéniles des autres habitats : (a) les quatre facteurs sont supérieurs dans l’habitat essentiel ou (b) seul un des facteurs, ici le mouvement vers les habitats adultes, est supérieur dans l’habitat essentiel [Modifié d’après Beck et al. (2001)].
Figure 3 : Echelles spatio-temporelles associées à la dynamique des populations et à leur description dans les écosystèmes coralliens [Adaptation du diagramme de Dickey (1990 ; 1991)].
3. Echelles spatio-temporelles de description de l’habitat essentiel
Les schémas de distribution des poissons récifo-lagonaires doivent être considérés selon différentes échelles spatiales et temporelles (Williams, 1991). Dans les écosystèmes coralliens, on distingue souvent trois échelles spatio-temporelles d’observation (Figure 3). A macro-échelle (10-100 km), des facteurs environnementaux tels que la latitude ou le degré d’isolement d’un récif permettent d’expliquer le nombre d’espèces observées en une région donnée (Caley & Schluter, 1997 ; Karlson & Cornell, 1998 ; Bellwood & Hughes, 2001 ; Munday, 2002), susceptible de varier à une échelle temporelle supérieure à la décade. Une même région englobe les variations locales de l’habitat à méso-échelle (0.1-10 km). A cette échelle agissent principalement les facteurs physiques et hydrodynamiques contrôlant par exemple la dispersion larvaire (Roughgarden et al., 1988 ; Danilowicz & Sale, 1999 ; Cowen et al., 2000 ; Botsford et al., 2001 ; Mora & Sale, 2002) ou la disponibilité en ressources alimentaires (Pinazo et al., 2004) qui peuvent varier d’un jour à l’autre comme d’une année à l’autre. Le microhabitat peut être caractérisé à micro-échelle (1-100 m) par la disponibilité en ressources alimentaires, les caractéristiques des refuges contre les prédateurs et les interactions avec les résidents (Beukers & Jones, 1997 ; Webster, 2002 ; Adams et al., 2004 ; Almany, 2004a) susceptibles de varier au cours d’une même journée.
Le caractère fragmenté des habitats de l’écosystème corallien, qui induit des variations qualitatives et quantitatives dans la structure des communautés de poissons (Chittaro, 2004), s’applique ainsi à chacune de ces échelles pour caractériser l’habitat essentiel.
4. Structure spatio-temporelle des assemblages de juvéniles à
l’installation
Recrutement ou habitat limitant ?
Les variations observées au niveau des assemblages de juvéniles après l’installation ont longtemps été considérées comme le seul résultat des variations du flux larvaire : c’est l’hypothèse qui stipule que le recrutement est limitant (Doherty, 1991). Cependant, un nombre croissant d’études montrent que pour certaines espèces, la disponibilité des refuges potentiels contre les prédateurs est la principale source de variation spatiale des abondances à
l’installation, d’où l’hypothèse qui stipule que c’est l’habitat qui serait limitant (Holbrook et al., 2000 ; Schmitt & Holbrook, 2000 ; Holbrook & Schmitt, 2002 ; Sale et al., 2005). La structure spatio-temporelle des assemblages de juvéniles à l’installation résulterait donc d’une combinaison entre la distribution spatio-temporelle des larves dans la colonne d’eau et la disponibilité en refuges contre les prédateurs au moment de l’installation. C’est cette hypothèse de départ qui sera retenue dans le cadre de cette thèse, par opposition à l’hypothèse stipulant que le recrutement est le seul facteur limitant.
Les facteurs environnementaux influençant la distribution des larves dans la colonne d’eau juste avant leur installation, et donc leur présence éventuelle à proximité des habitats benthiques, sont en dehors du champ d’étude de cette thèse. Brièvement, des différences dans la composition des assemblages larvaires peuvent être observées à différentes échelles spatiales (Cowen, 2002). Ces différences résultent à la fois de la distribution fragmentée des stades larvaires et de l’influence des facteurs environnementaux depuis l’échelle régionale jusqu’à l’échelle locale (Leis, 1991). Au sein des assemblages, les larves peuvent présenter des capacités natatoires variables suivant l’espèce, le stade de développement ou la condition physiologique (Leis & Carson-Ewart, 2002 ; Leis & McCormick, 2002). Des processus à la fois physiques et biologiques déterminent donc la présence des larves à proximité des habitats d’installation potentiels.
Facteurs extrinsèques de la sélection d’un habitat à l’installation
Une fois au voisinage des habitats benthiques dans lesquels elles peuvent d’installer, les larves sélectionnent un refuge contre les prédateurs en fonction de facteurs à la fois extrinsèques et intrinsèques, qui diffèrent suivant les espèces. Les facteurs extrinsèques influençant la sélection d’un habitat à l’installation peuvent être distingués selon différentes échelles spatiales. A l’échelle 10-100 m, les larves de la plupart des espèces s’installent préférentiellement dans un type d’habitat comme les mangroves (Cocheret de la Morinière et al., 2002), les herbiers (Dahlgren & Eggleston, 2000 ; Cocheret de la Morinière et al., 2002) ou les récifs frangeants (Victor, 1991 ; Lecchini & Galzin, 2005). Ces habitats seraient préférés pour la qualité des refuges contre les prédateurs, la disponibilité de ressources alimentaires ou la présence de conspécifiques. A l’installation, les larves peuvent atteindre un habitat particulier car elles possèdent des capacités natatoires qui leur permettent de remonter les courants (Jones & McCormick 2002 ; Leis & McCormick 2002 ; Irisson et al. 2004). A
l’échelle 1-10 m, les facteurs extrinsèques qui influencent la sélection d’un microhabitat à l’installation incluent notamment la couverture benthique du substrat ou la présence de poissons résidents (conspécifiques et/ou hétérospécifiques). Des études récentes ont montré que ces facteurs peuvent être détectés par les jeunes poissons grâce à des signaux visuels (Booth, 1992 ; Lecchini et al., 2005a ; Lecchini et al., 2005b), chimiques (Sweatman, 1988 ; Lecchini et al., 2005a ; Lecchini et al., 2005b) ou auditifs (Wright et al., 2005 ; Lecchini et al., 2005b). La complexité du substrat (Tolimieri, 1995 ; Scharf et al., 2006) et la profondeur (Srinivasan, 2003) sont également des critères de sélection du microhabitat à l’installation par les jeunes poissons.
Relativement peu d’études se sont intéressées aux schémas de distribution des juvéniles au moment de leur installation. La principale raison est la difficulté d’observer directement et d’identifier in situ des individus très petits, mobiles, souvent cryptiques et s’installant à un rythme irrégulier sur des substrats souvent complexes (Kaufman et al., 1992). Ces schémas de distribution sont donc plus souvent inférés à partir de suivis réalisés plusieurs jours après l’installation (Öhman et al., 1998) et, de fait, intègrent déjà certains effets des processus post-installation. Dans ce contexte, les substrats artificiels présentent un avantage considérable dans la mesure où ils peuvent être facilement relevés suivant des fréquences variables (Valles et al., 2006). De plus, les substrats artificiels peuvent être utilisés de manière synoptique dans différents habitats pour étudier les schémas spatiaux d’installation des jeunes poissons. En raison de ces nombreux avantages pour étudier différents aspects de l’installation, l’utilisation de substrats artificiels s’est récemment développée. Des unités standardisées pélagiques ont notamment été utilisées pour étudier les schémas de distribution verticale de larves juste avant l’installation sur la Grande Barrière (Leis et al., 2002) et en Californie ("SMURFs" ; Ammann, 2004). Dans les habitats benthiques, des unités d’herbiers artificiels ont été utilisées en Australie (Irving et al., 2007) et au Japon (Nakamura et al., 2003) tandis que des unités de débris coralliens ont été utilisés aux Barbades (Valles et al., 2006) pour étudier des schémas spatio-temporels d’installation des poissons et des invertébrés.
Facteurs intrinsèques de la sélection d’un habitat à l’installation
Parmi les facteurs intrinsèques influençant la sélection d’un habitat, une bonne condition physiologique au moment de l’installation pourrait permettre aux jeunes poissons d’atteindre plus facilement les habitats les plus propices à l’installation (Shapiro, 1987). Plusieurs indices
de condition peuvent être utilisés pour décrire l’état physiologique des individus comme par exemple leur teneur en lipides, leur développement musculaire ou leur croissance (McCormick & Molony, 1993 ; McCormick, 1998). Parmi ceux-ci, la croissance offre plusieurs intérêts. Les courbes de croissance, rétrocalculées grâce à l’analyse des otolithes, permettent d’obtenir une information rétrospective de la condition physiologique du poisson depuis l’éclosion jusqu’à la capture (Jones & McCormick, 2002). C’est également un paramètre synthétique qui permet de s’affranchir de l’étude des interactions entre environnement, abondance et qualité des proies (Bergenius et al., 2002). La croissance peut être influencée par des facteurs génétiques (Planes & Romans, 2004) ou maternels (Gagliano & McCormick, 2007a) mais elle est également fortement influencée par des facteurs environnementaux (McCormick, 1998). La croissance des jeunes poissons est ainsi fréquemment utilisée dans le cadre de l’évaluation de la qualité des nourriceries (Gilliers 2004).
Des facteurs environnementaux qui dépendent de la densité de juvéniles (ex : disponibilité en ressources alimentaires) ou qui n’en dépendent pas (ex : température, courants) peuvent conjointement influencer la croissance larvaire. Chez une majorité d’espèces, des différences de croissance larvaire entraînent souvent des différences d’âge à l’installation (Shima & Findlay, 2002 ; Denit & Sponaugle, 2004 ; Sponaugle & Grorud-Colvert, 2006), occasionnellement des différences de taille à l’installation (McCormick & Hoey, 2004) et rarement des différences simultanées des deux (McCormick, 1994). La flexibilité de l’âge à l’installation, donc de la durée de vie pélagique, semble être corrélée aux traits de vie de chaque espèce tels que des œufs benthiques ou pélagiques. En effet, à l’éclosion les larves provenant d’œufs benthiques sont généralement plus grandes et plus développées que les larves provenant d’œufs pélagiques, ces dernières présentant souvent des durées de vie pélagiques plus longues et plus variables (Sponaugle & Cowen, 1994). Certaines espèces ont une durée de vie pélagique flexible qui peut leur permettre de décaler le moment de leur installation (Thorrold & Hare, 2002). La capacité de retarder l’installation permettrait ainsi d’atteindre une taille suffisante, de trouver un habitat favorable et/ou d’échapper plus facilement aux prédateurs lors de l’installation (Denit & Sponaugle, 2004). Cependant, on ne sait toujours pas si des espèces aux traits de vie différents mais exposées à des conditions environnementales similaires présentent les mêmes différences de croissance larvaire, durée de vie pélagique et/ou taille à l’installation.
5. Structure spatio-temporelle des assemblages de juvéniles
post-installation
Différents mécanismes post-installation contribuent à modifier la structure des assemblages de juvéniles établie lors de l’installation. Le premier mécanisme responsable d’une réduction drastique des abondances après l’installation est la prédation, largement documentée pour différentes espèces et à différentes échelles spatio-temporelles (Hixon, 1991 ; Hixon & Beets, 1993 ; Carr & Hixon, 1995 ; Webster, 2002 ; Jones & McCormick, 2002 ; Doherty et al., 2004). La compétition inter- ou intra-spécifique pour l’espace ou le refuge est également un mécanisme majeur dans la modification de la structure des assemblages de juvéniles après l’installation (Munday, 2001 ; Holbrook & Schmitt, 2002 ; Webster, 2004).
Mortalité densité-dépendante et influence du microhabitat
Les mécanismes de compétition et de prédation sont complexes puisqu’ils sont à la fois densité-dépendants et hétérogènes dans l’espace. Au moins pour les espèces dont les juvéniles utilisent les microhabitats coralliens, la compétition densité-dépendante pour une quantité limitée de refuges potentiels implique qu’une fraction de la population soit dans les zones périphériques et plus risquées du refuge, cette fraction augmentant avec la densité de juvéniles (Shima, 2002 ; Holbrook & Schmitt, 2002). La mortalité densité-dépendante qui en résulte se traduit par des variations d’abondances bornées par la capacité d’accueil du refuge (Lecchini et al., 2006), qui est déterminée par la quantité mais aussi la qualité de ce refuge contre les prédateurs. La mortalité densité-dépendante peut être détectée soit par l’analyse de séries temporelles de l’abondance des juvéniles, soit par des expériences de manipulation des abondances sur le terrain ou en laboratoire (Schmitt & Holbrook, 2007). Les mécanismes densité-dépendants ont été largement documentés pour de nombreuses espèces et à plusieurs échelles spatio-temporelles (voir synthèse de Hixon & Webster, 2002).
Enfin, l’hétérogénéité spatiale des mécanismes de prédation et de compétition peut être le résultat des variations spatiales de la qualité du refuge (Forrester & Steele, 2004 ; Almany, 2004a ; Holmes & McCormick, 2006), de la densité de prédateurs et de compétiteurs potentiels (Hixon & Beets, 1993 ; Carr & Hixon, 1995 ; Steele & Forrester, 2002) et des densités de juvéniles (Adams et al., 2004 ; Chittaro et al., 2005 ; Almany et al., 2007). Les caractéristiques du microhabitat définissant la qualité du refuge jouent certainement un rôle
majeur sur la mortalité par prédation et l’intensité de la compétition pour l’espace. Cependant, dans la plupart des études le microhabitat est décrit visuellement et de manière qualitative, ce qui limite fortement notre capacité à mettre en évidence son effet sur l’intensité de la compétition et de la prédation après l’installation. Pour cette même raison, bien que l’intensité de la mortalité densité-dépendante soit également hétérogène dans l’espace (Shima & Osenberg, 2003 ; Steele & Forrester, 2005), aucune étude n’a jusqu’à présent évalué l’effet des caractéristiques du microhabitat sur cette intensité.
Une description précise du microhabitat des juvéniles est désormais possible grâce au développement récent de techniques basées sur l’analyse d’images pour mesurer la taille, la forme ou la biomasse d’organismes benthiques tels que les coraux scléractiniaires (p. ex. Todd et al., 2001b ; Eleftheriou & McIntyre, 2005 ; Dawson, 2006). Les mesures réalisées à partir d’images numériques présentent de nombreux avantages, notamment leur caractère non-destructif (Harvey & Shortis, 1996). De plus, le temps passé sur le terrain est réduit car les mesures sont effectuées en laboratoire. L’archivage possible des images permet enfin de comparer les états successifs d’un microhabitat donné (Todd et al., 2001a). Ces techniques peuvent être basées sur la stéréo-photographie (Abdo et al., 2006), les reconstructions 3D basées sur la photogrammétrie (Cocito et al., 2003) ou réalisées à partir de coupes 2D d’un objet, obtenues par rayons X par exemple (c.-à.-d. tomographie ; Kruszynski et al., 2006). Ces techniques peuvent s’avérer inadéquates dans le cadre de l’étude du microhabitat corallien des juvéniles à cause de leur coût, des compétences techniques et du temps requis pour les mettre en œuvre. En outre, aucune étude n’a évalué la précision ni l’exactitude de ces techniques pour estimer le volume interstitiel (ou volume inter-branche) des colonies coralliennes.
Mortalité sélective et performances de croissance post-installation
Une petite taille implique en général une vulnérabilité accrue face aux prédateurs (hypothèse de "bigger-is-better" ; Anderson, 1988). Le risque de prédation est également plus élevé chez les individus à faible croissance, dont les stades larvaire et juvénile sont allongés (hypothèse de "stage-duration" ; Houde, 1987) et dont la condition physiologique est en général plus faible (hypothèse de "growth-mortality" ; Anderson, 1988). La mortalité des juvéniles au moment de l’installation peut donc dépendre de leur taille (Cowan et al., 1997 ; Vigliola & Meekan, 2002) et/ou de leur croissance (Shima & Findlay, 2002 ; Hoey & McCormick, 2004). La mortalité croissance-sélective peut rapidement augmenter le taux de croissance moyen apparent d’une cohorte en éliminant d’abord les individus présentant les croissances
les plus faibles (Shima & Findlay, 2002). Parmi les survivants, les individus qui ont bénéficié d’une meilleure croissance pélagique ont souvent tendance à avoir une meilleure croissance benthique (Cowan et al., 1997 ; McCormick & Hoey, 2004). Cependant, comme pendant la phase pélagique, la croissance benthique peut dépendre de facteurs environnementaux à la fois densité-dépendants et densité-indépendants.
Schémas d’utilisation de l’habitat au cours de l’ontogénie
Du fait de contraintes écologiques variables au cours de l’ontogénie, une même espèce peut présenter des abondances, croissance et survie maximales dans des habitats différents au cours de son développement (Kramer et al., 1997 ; Dahlgren & Eggleston, 2000). Ces changements d’habitat peuvent résulter de déplacements post-installation (Booth, 1992 ; Frederick, 1997b) et/ou d’une mortalité variable au cours du développement dans un même habitat (McCormick & Makey, 1997 ; Dahlgren & Eggleston, 2000). Les techniques de marquage-recapture, seul moyen de distinguer le déplacement de la mortalité, sont souvent difficiles à mettre en œuvre (Gillanders et al., 2003). Par conséquent, les changements d’habitat sont plus souvent directement inférés à partir de la comparaison des schémas de distribution aux différents stades de vie (p. ex. Shapiro, 1991 ; Gillanders et al., 2003 ; Adams & Ebersole, 2004 ; Lecchini & Galzin, 2005). Ces études récentes ont mis en évidence quatre schémas majeurs d’utilisation de l’habitat entre le stade juvénile et le stade adulte : 1) une augmentation du nombre d’habitats utilisés, 2) une réduction du nombre d’habitats utilisés, 3) un changement radical des habitats utilisés et 4) aucun changement des habitats utilisés.
Cependant, l’existence éventuelle de schémas similaires au cours de la croissance juvénile reste à déterminer. De plus, la diversité des schémas d’utilisation de l’habitat a toujours été étudiée à fine échelle spatiale, et d’éventuels changements d’habitat le long du gradient côte-large par exemple n’ont pour l’instant jamais été mis en évidence. Enfin, étant donné les variations saisonnières qui caractérisent à la fois les assemblages de juvéniles à des latitudes similaires (Robertson & Kaufmann, 1998) et les assemblages de larves en Nouvelle-Calédonie (Carassou & Ponton, 2007), il semble nécessaire d’évaluer les variations saisonnières des schémas d’utilisation de l’habitat chez les juvéniles.
Vers une prédiction spatiale des assemblages de juvéniles
Le développement de modèles prédictifs du nombre d’espèces et d’individus juvéniles dans un habitat donné représente un défi pour l’écologie et la conservation des récifs coralliens.
Les habitats qui abritent les richesses spécifiques maximales participeraient à la résistance et à la résilience de l’écosystème, et seraient donc à protéger en priorité (Myers et al., 2000 ; Roberts et al., 2002). Or le principal facteur limitant la taille des populations de poissons récifaux-lagonaires, après l’installation, est la mortalité juvénile (voir synthèse de Doherty, 2002). Identifier les facteurs environnementaux associés à des richesses spécifiques et des abondances en juvéniles élevées est donc crucial car ils influencent les mêmes variables au stade adulte. Protéger les habitats qui abritent un nombre important d’espèces et d’individus juvéniles pourrait alors significativement améliorer le succès du recrutement (Scharf et al., 2006 ; Gilliers et al., 2006) et, par conséquent, augmenter le nombre d’espèces et d’individus dans l’ensemble de la communauté.
Les modèles prédictifs du nombre d’espèces ou d’individus au sein des assemblages de poissons existent pour l’instant uniquement pour les adultes (p. ex. Ault & Johnson, 1998b ; Mellin et al., 2006 ; Kuffner et al., 2007 ; Pittman et al., 2007). La possibilité de prédire les mêmes variables au sein des assemblages de juvéniles reste donc indéterminée et doit être évaluée à différentes échelles spatio-temporelles. La principale différence avec les modèles développés pour les poissons adultes est la nécessité de considérer la variabilité temporelle des assemblages de juvéniles liée aux variations de température (Sponaugle et al., 2006) ou aux variations de force et de direction du vent (Findlay & Allen, 2002 ; Sponaugle et al., 2005).
Les modèles prédictifs du nombre d’espèces et d’individus dans une zone donnée sont, par définition, spatialement explicites et basés sur des mesures continues des facteurs environnementaux au sein de cette zone. Ce type de modèles s’est récemment développé en milieu terrestre (voir revues de Guisan & Zimmermann, 2000 ; Guisan & Thuiller, 2005) mais reste extrêmement rare en milieu marin. Or la télédétection fournit désormais des méthodes rapides et efficaces pour cartographier l’environnement marin côtier et peu profond, et donc représenter des données bathymétriques (Maritorena, 1996), géomorphologiques (Andréfouët & Guzman, 2004) ou d’habitat (Andréfouët et al., 2003a) sur une grille continue. Il semble donc logique d’utiliser l’information fournie par la télédétection pour reproduire la démarche couramment suivie lors du développement de modèles spatialement explicites en milieu terrestre (Guisan & Zimmermann, 2000 ; Guisan & Thuiller, 2005). Cette démarche comprend 1) la définition d’une relation prédictive entre les espèces et leur environnement à partir de données ponctuelles et grâce à la méthode de modélisation statistique linéaire ou
non-linéaire la plus appropriée et 2) la cartographie des prédictions du modèle au sein d’un domaine spatial où les facteurs environnementaux prédictifs sont mesurées de manière continue.
Figure 4 : Position de la Nouvelle-Calédonie dans l’Indo-Pacifique.
Figure 5 : Image Landsat 7 du lagon sud-ouest de Nouvelle-Calédonie. L’îlot Canard est le plus proche de la côte et séparé de l’îlot Maître par un chenal. Dans le lagon sud-ouest, trois autres îlots (Signal, Larégnère, Goéland) et trois récifs (Larégnère, Sèche Croissant, Crouy) sont situés entre l’îlot Maître et le récif barrière.
6. Contexte local
La Nouvelle-Calédonie et le lagon sud-ouest
La Nouvelle-Calédonie se situe dans le Pacifique Sud, entre les latitudes 19°S et 23°S et les longitudes 163°E et 168°E (Figure 4). L’archipel est constitué de la Grande-Terre (île principale), de trois groupes d’îles (Loyauté, Ile des Pins et Bélep) et de quelques îles inhabitées. La Grande-Terre est bordée par un récif barrière de 1600 km de long, représentant une superficie de 8000 km² (Andréfouët & Torres-Pulliza, 2004). La distance entre la Grande-Terre est le récif barrière varie entre 1 et 65 km. Ce récif barrière délimite un lagon de 23400 km² dont la profondeur atteint 40 m en certains endroits (Testau & Conand, 1983).
Les principaux facteurs contrôlant la circulation des eaux lagonaires sont le vent et la marée (Douillet et al., 2001). Dans cette région du Pacifique Sud, le régime de vent est dominé par les alizés d’est, sud-est (110°). Les alizés sont présents tout au long de l’année et se renforcent entre les mois d’octobre et de mars. Un second régime de vent vient de l’ouest (270°) et caractérise plutôt la saison hivernale, les dépressions tropicales et les cyclones.
Le littoral du lagon sud-ouest est découpé par de larges baies et de nombreuses presqu’îles (Figure 5). Plusieurs unités récifales se succèdent le long du gradient côte-large : le récif frangeant, les récifs intermédiaires (formations coralliennes intra-lagonaires, comprenant les platiers d’îlots) et le récif barrière. Les îlots du lagon sud qui présentent des mosaïques bien délimitées de biotopes lagonaires variés (herbiers, algueraies, coraux), offrent la possibilité d’étudier l’influence des caractéristiques de l’habitat à différentes échelles spatiales, depuis celle du lagon (distance à la côte ou à la barrière par exemple) jusqu’à celle des biotopes (diversité structurale) et des microhabitats (composition par ex.) sur la structure des communautés de juvéniles. Par ailleurs, si la plupart des îlots ont un statut de réserve et sont encore relativement peu dégradés, l’intérêt qu’ils suscitent auprès des plaisanciers permet de craindre à l’avenir une modification de la qualité des habitats ou du comportement des poissons. Ces îlots semblent donc particulièrement adaptés à l’acquisition de connaissances fondamentales sur les premiers stades de vie des poissons et à l’application des résultats en termes de gestion intégrée des zones côtières.
Les poissons de Nouvelle-Calédonie et les premiers stades de vie
Depuis 1985, de nombreuses informations ont été acquises sur les poissons de Nouvelle-Calédonie en terme d’inventaire taxonomique (Fricke & Kulbicki, 2006), de traits de vie (Kulbicki, 1988) et d’écologie des adultes (Thollot, 1992a ; Wantiez, 1993 ; Kulbicki, 1997 ; Kulbicki, 2007). Ces informations ont par ailleurs permis de comparer les peuplements de poissons de Nouvelle-Calédonie avec ceux d’autres sites de l’Indo-Pacifique (Kulbicki, 1992 ; Kulbicki et al., 2005).
En revanche, les études portant sur les premiers stades de vie débutent à peine et les connaissances sur leur écologie demeurent très parcellaires. Ces travaux sont en grande partie freinés par le manque d’outils permettant l’identification des stades jeunes des poissons récifaux-lagonaires (Tableau 1). Des outils d’identification des jeunes poissons s’avèrent pourtant indispensable pour venir en appui de l’approche écologique considérant leur relation avec le milieu. Une étape préliminaire et nécessaire à cette approche est donc l’élaboration d’un guide d’identification, qui a démarré en 2005 et qui se poursuit parallèlement aux études sur l’écologie des jeunes poissons (Ponton et al., 2006).
Tableau 1. Nombre d’espèces par famille recensées en Nouvelle-Calédonie et pour lesquelles il existait en 2005 des informations permettant d’identifier leurs juvéniles. Seules 15 familles des 175 connues en NC sont présentées ici. Avec [1] : Kuiter (2002) ; [2] : Randall (2005) ; [3] : Allen et al. (2003) ; [4] : Wilson (1998) ; [5] : Belwood & Choat (1989)
Espèces Espèces avec
Famille Nom commun recensées description Référence
en NC des juvéniles Holocentridae Poissons-soldats 29 0 Scorpaenidae Rascasses 49 0 Serranidae Loches 84 10 [2], [3] Carangidae Carangues 41 0 Lutjanidae Vivaneaux 41 4 [3] Haemulidae Gaterins 14 7 [3]
Lethrinidae Becs de cane 20 12 [2], [3], [4] Mullidae Rougets barbets 18 0
Chaetodontidae Poissons-papillons 35 14 [2[, [3] Pomacanthidae Poissons-anges 16 3 [3] Pomacentridae Poissons-demoiselles 99 0 Labridae Labres 106 58 [1] Scaridae Poissons-perroquets 27 23 [2], [3], [5] Acanthuridae Poissons-chirurgiens 39 14 [2[, [3] Siganidae Poissons-lapins, picots 13 3 [2]
Certains facteurs environnementaux responsables des variations spatio-temporelles des assemblages larvaires ont pu être identifiés dans le lagon sud-ouest de Nouvelle-Calédonie (Carassou, 2004 ; Carassou & Ponton, 2007). En revanche, seules quelques études parcellaires ont été menées sur les juvéniles du lagon de Nouvelle-Calédonie. Dans les herbiers et algueraies proches de Nouméa, Kulbicki (2007) a observé des cohortes de jeunes Siganus
fuscescens et des bancs de jeunes Lethrinidae qui semblaient migrer vers d’autres habitats au
cours de leur croissance. D’après Thollot (1992a ; 1992b), et contrairement à ce qui était observé aux Caraïbes, le rôle de nourricerie des mangroves ne s’appliquerait qu’à quelques espèces de Lutjanidae. Aucune autre étude n’a jusqu’à présent considéré l’écologie des stades juvéniles de poissons récifaux-lagonaires en Nouvelle-Calédonie.
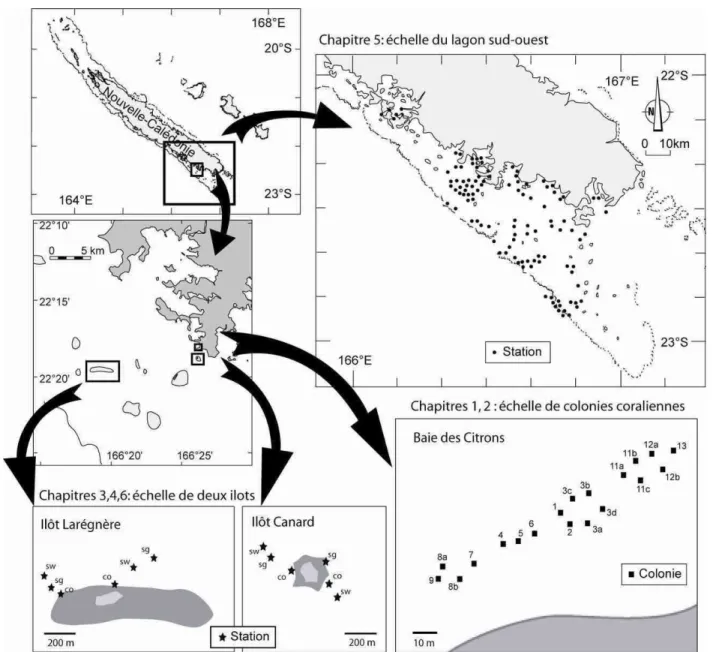
Cadre de la thèse et collaborations
Cette thèse a été effectuée au sein de l’UR 128 (biocomplexité des écosystèmes coralliens de l’Indo-Pacifique) à l’IRD Nouméa, sous la direction de Dominique Ponton (IRD) et de René Galzin (UMR 5244 CNRS-EPHE-UPVD, Université de Perpignan). Plusieurs collaborations ont été développées dans le cadre de cette thèse, à la fois au sein et à l’extérieur de l’équipe. Au sein de l’équipe, une collaboration avec Michel Kulbicki a permis d’explorer des données de comptages visuels de juvéniles réalisés sur une période de 15 ans et dans l’ensemble du lagon sud-ouest (Chapitre 5 ; Figure 6 ; Tableau 2). Une collaboration avec Serge Andréfouët a permis de cartographier les habitats lagonaires autour des îlots Canard et Larégnère et d’élaborer des cartes prédictives de richesse spécifique et d’abondance en juvéniles autour de l’îlot Larégnère (Chapitre 6). Une collaboration avec Philippe Borsa a permis de confirmer l’identification jusqu’à l’espèce des spécimens de Siganus fuscescens et Lethrinus genivitattus capturés, grâce aux outils de biologie moléculaire. Le travail de terrain (comptages visuels, captures) ainsi que l’identification des juvéniles ont été réalisés avec l’aide de Gérard Mou-Tham. Enfin, la préparation des otolithes a été réalisée grâce à la contribution de Joseph Baly. Une collaboration extérieure avec Laurent Vigliola (IRD Brest, UR RAP) a permis d’approfondir l’analyse des données de croissance de Siganus fuscescens et Lethrinus
genivitattus ainsi que de Chromis viridis (Chapitre 3). Trois stagiaires ont été co-encadrés
avec Dominique Ponton sur différents aspects de cette thèse : Sigrid Lehuta, étudiante INA P-G en césure (six mois), Arnaud P-Grüss, étudiant ENSAR en césure (six mois) et Emeline Rolland, étudiante en licence à l’Université de Nouvelle-Calédonie (un mois).
7. Questions et objectifs de la thèse
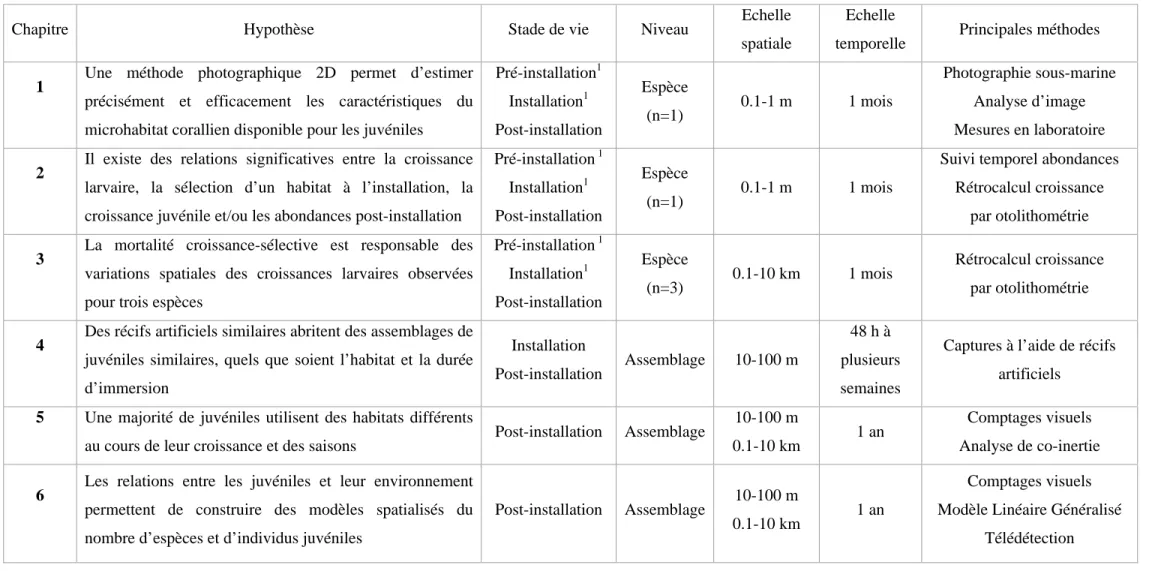
Différentes questions parmi celles présentées plus haut ont été retenues dans le cadre de la thèse. Ces questions concernent des échelles spatio-temporelles, stades (intallation vs. post-installation) et niveaux d’observation (espèce vs. assemblage) différents (Tableau 2). L’objectif était d’offrir une vision « multi-facette » d’un certain nombre de processus qui structurent les assemblages de juvéniles au cours de la croissance, plutôt qu’une vision exhaustive des processus intervenant à un stade de vie donné, à une échelle donnée et à un niveau d’observation donné.
La première question était d’ordre méthodologique et visait à répondre au besoin de décrire le microhabitat corallien intervenant dans les questions abordées dans le chapitre 2.
Question abordée dans le chapitre 1 : Peut-on décrire précisément, exactement et efficacement les caractéristiques du microhabitat corallien disponible pour les juvéniles grâce à une méthode photographique 2D ?
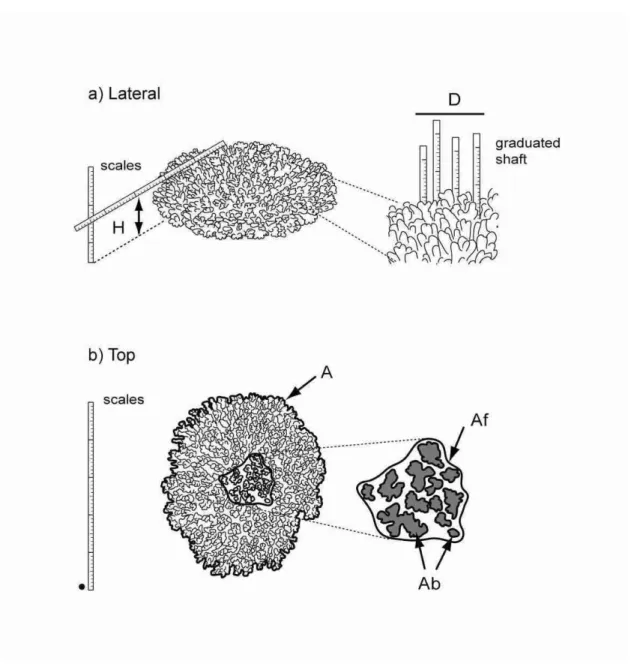
Des études récentes (p. ex. Todd et al., 2001b ; Cocito et al., 2003 ; Abdo et al., 2006) ont montré qu’il était possible d’évaluer certaines caractéristiques morphométriques des organismes benthiques à partir de l’analyse d’images sous-marines. Cependant, aucune étude n’a testé si l’analyse d’images permettait de déterminer le volume interstitiel des colonies coralliennes. Or cette variable pourrait être significativement corrélée à la distribution spatiale et/ou à la croissance des juvéniles de certaines espèces (Schmitt & Holbrook, 2007 ; Lecchini et al., 2007b).
Le chapitre 1 de la thèse présente le développement et le test d’une méthode photographique 2D permettant d’estimer le volume total, le volume interstitiel des colonies coralliennes et le ratio entre ces deux variables, définissant un indice de refuge pour les poissons.
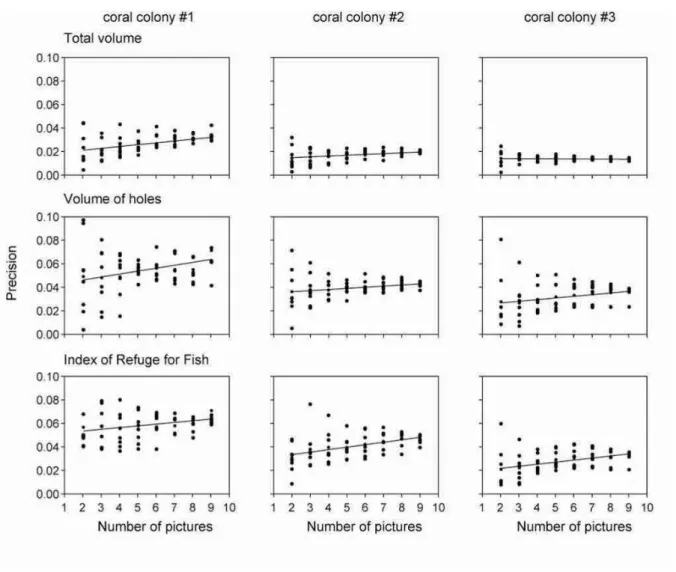
Ces trois variables ont été estimées à partir d’images sous-marines de colonies coralliennes tabulaires d’Acropora couplées à des mesures in situ. La méthode a été évaluée en fonction de trois critères incluant l’exactitude, la précision et l’efficacité.
Les objectifs spécifiques de ce chapitre étaient de : 1) déterminer par des essais en laboratoire le nombre d’images nécessaires pour obtenir efficacement des mesures précises et exactes des certaines caractéristiques des colonies coralliennes et 2) tester cette méthode in situ dans le cadre d’études entre des juvéniles et leur microhabitat.
La méthode développée et testée dans ce chapitre a permis de décrire le microhabitat corallien des juvéniles de Pomacentrus moluccensis (Pomacentridae) afin d’explorer les schémas spatiaux d’abondance, de croissance larvaire et juvénile de cette espèce à l’échelle de colonies coralliennes.
Questions abordée dans le chapitre 2 : 1) existe-t-il une relation entre la croissance larvaire et la sélection du microhabitat à l’installation ? 2) existe-t-il une relation entre les caractéristiques du microhabitat, la croissance des juvéniles et/ou leurs abondances ?
La relation entre la croissance larvaire et le microhabitat sélectionné à l’installation a déjà été suggérée par Shapiro (1987) mais n’avait jamais été testée. Par ailleurs, la relation entre les caractéristiques du microhabitat et la croissance juvénile a rarement été étudiée (voir pour exception Jones, 1988). Enfin, bien que l’intensité de la mortalité juvénile densité-dépendante varie dans l’espace (Shima & Osenberg, 2003), aucune étude n’a évalué le rôle que jouent les caractéristiques du microhabitat. Ces questions ont été considérées à une échelle spatiale plus large, en fonction du type de récif (récif frangeant ou intermédiaire) ; ou de la couverture benthique, p. ex. corail vivant, décris coralliens, sable (Holbrook et al., 2000). Cependant, au moins pour de nombreuses espèces sédentaires, les caractéristiques du microhabitat telles que la rugosité et le nombre d’anfractuosités des colonies coralliennes orientent probablement les schémas spatiaux d’abondance et/ou de croissance à l’installation (Webster, 2004 ; Lecchini et al., 2007b).
Le chapitre 2 avait pour objectif de déterminer le degré de covariation entre les caractéristiques du microhabitat, les abondances des juvéniles, leurs performances de croissance pré- et post-installation et l’intensité de la mortalité densité-dépendante.
En baie des Citrons (Nouméa), 15 colonies coralliennes ont été décrites grâce à la méthode développée et testée dans le chapitre 1. Un suivi visuel des abondances de Pomacentrus
moluccensis (Pomacentridae) sur ces colonies coralliennes a été réalisé tous les deux jours
pendant 28 jours. A la fin de cette période, tous les juvéniles présents ont été capturés. L’étude de leurs otolithes a permis de déterminer leur âge et leur croissance depuis l’éclosion jusqu’à la capture.
Les schémas spatiaux de croissance larvaire et juvénile ont également été étudiés à l’échelle de deux îlots et au niveau de trois espèces.
Questions abordées dans le chapitre 3 : 1) quelle est la relation entre croissance larvaire et croissance juvénile pour trois espèces dans un habitat côtier et un habitat intermédiaire ? 2) la mortalité juvénile croissance-sélective a-t-elle une influence sur les variations observées ?
Des études récentes ont montré que des différences de croissance larvaire ou juvénile pouvaient être observées entre des sites séparés d’une distance <10 km (p. ex. McCormick, 1994 ; Denit & Sponaugle, 2004). Ces différences peuvent entraîner des différences de durée de vie pélagique et/ou de croissance juvénile. Cependant, ces études n’ont souvent considéré qu’une seule espèce. Des études supplémentaires sont donc nécessaires pour déterminer si des larves d’espèces différentes exposées à des conditions environnementales similaires montrent des différences similaires de croissance larvaire, de taille et d’âge à l’installation, et/ou de croissance juvénile.
Par ailleurs, un problème majeur qui se pose lorsque l’on compare des trajectoires de croissance de juvéniles rétrocalculées est que l’information est basée sur les survivants. Or certaines études récentes ont montré que la mortalité juvénile pouvait dépendre de la croissance des individus en éliminant préférentiellement ceux à faible croissance (Shima & Findlay, 2002). Malgré une prise de conscience de l’effet potentiel de la mortalité sélective sur les trajectoires de croissance rétrocalculées, cet effet reste rarement testé lors de la comparaison de la croissance juvénile entre différents sites ou différentes périodes.
Dans ce contexte, les objectifs spécifiques du chapitre 3 étaient de 1) évaluer et comparer la croissance larvaire et juvénile de trois espèces dans un habitat côtier (îlot Canard) et un habitat intermédiaire (îlot Larégnère) et 2) proposer une procédure d’analyse permettant de tester l’effet de la mortalité sélective sur les différences observées pour les trajectoires de croissance.
Des juvéniles de Chromis viridis (Pomacentridae), Lethrinus genivittatus (Lethrinidae) et
Siganus fuscescens (Siganidae) ont été capturés autour des îlots Canard et Larégnère entre
Décembre 2005 et Mars 2006. L’analyse de leurs otolithes a permis de rétrocalculer les trajectoires de croissance et de déterminer l’âge à la capture, ainsi que la taille et l’âge à l’installation. Des Modèles Linéaires Généralisés à mesures répétées ont ensuite été utilisés pour identifier les facteurs responsables des différences observées au niveau des trajectoires de croissance.
Les schémas d’installation des juvéniles sur des récifs artificiels disposés dans des algueraies, herbiers et récifs coralliens ont ensuite été étudiés selon deux durées d’immersion des récifs.
Question abordée dans le chapitre 4 : Comment varie la structure des assemblages de juvéniles collectés à l’aide de récifs artificiels placés dans différents habitats, après une courte ou une longue durée d’immersion?
Plusieurs études ont utilisé des unités standardisées de susbtrats naturels ou artificiels pour comprendre la structure spatio-temporelle des assemblages de juvéniles (p. ex. Sweatman & St John, 1990 ; Schmitt & Holbrook, 1996 ; Valles et al., 2006 ; Irving et al., 2007). Ces études ont montré que la composition des assemblages de juvéniles pouvait être influencée par plusieurs facteurs dont la complexité structurale de l’unité de susbtrat, les organismes qui étaient déjà présents sur cette unité, ou son environnement en termes de densités de prédateurs par exemple. Ces études ont également montré que la composition des assemblages de juvéniles pouvait varier en fonction de la fréquence d’échantillonnage. Cependant, aucune étude n’a comparé la structure des assemblages de juvéniles collectés à partir de substrats artificiels disposés dans des habitats différents.
Les objectifs du chapitre 4 étaient les suivants : 1) comparer la composition d’assemblages capturés après une courte ou longue durée d’immersion des récifs artificiels dans chaque habitat, 2) identifier d’éventuels changements d’association espèce-habitat selon la durée d’immersion des récifs et 3) évaluer le pourcentage de variations du nombre d’espèces et d’individus qui peut être expliqué par les caractéristiques de l’habitat pour chaque durée d’immersion.
Des récifs artificiels ont été disposés dans les algueraies, les herbiers et les récifs coralliens autour des îlots Canard et Larégnère. Ces récifs artificiels ont été relevés durant quatre périodes d’échantillonnage, après une courte (48 h) ou une longue (> 2 semaines) durée d’immersion pour chaque période.
A deux échelles spatiales (10-100 m et 0.1-10 km) et au fil des saisons, l’analyse de données de comptages de juvéniles dans différents habitats du lagon sud-ouest de Nouvelle-Calédonie a permis d’explorer les schémas saisonniers et ontogéniques de l’utilisation de l’habitat par les juvéniles.
Question abordée dans le chapitre 5 : Quelle est la diversité de schémas d’utilisation de l’habitat au sein des assemblages de juvéniles, au cours de leur croissance et au fil des saisons ?
Plusieurs études ont inféré les schémas d’utilisation de l’habitat entre le stade juvénile et le stade adulte des poissons récifaux à partir de la comparaison des distributions spatiales des individus de classes de tailles successives (Gillanders et al., 2003 ; Adams & Ebersole, 2004 ; Lecchini & Galzin, 2005). Ces études ont mis en évidence quatre schémas majeurs d’utilisation de l’habitat entre le stade juvénile et le stade adulte : 1) une augmentation du nombre d’habitats utilisés, 2) une diminution du nombre d’habitats utilisés, 3) un changement radical des habitats utilisés et 4) aucun changement des habitats utilisés. Cependant, ces schémas ont toujours été évalués à fine échelle spatiale et l’existence potentielle de changements d’utilisation de l’habitat à plus large échelle, p. ex. le long du gradient côte-large, n’a jamais été étudiée. Par ailleurs, d’éventuels changements d’utilisation de l’habitat au cours de la croissance juvénile n’ont encore jamais été considérés.
Compte-tenu de ces éléments, les objectifs du chapitre 5 étaient de 1) caractériser les assemblages de juvéniles associés à chaque habitat (à deux échelles spatiales) et leurs variations saisonnières, 2) mettre en évidence les changements d’habitat entre classes de taille successives et/ou d’une saison à l’autre pour les espèces dominantes et 3) évaluer l’importance relative de chaque schéma d’utilisation de l’habitat au sein des assemblages.
Les assemblages de juvéniles associés à différents habitats (échelles 10-100 m et 0.1-10 km) ont pu être caractérisés, à chaque saison, à partir de données de comptages réalisés dans le lagon sud-ouest entre 1986 et 2001. A l’échelle 10-100 m, les habitats considérés étaient les fonds meubles avec des macroalgues et des phanérogames et les fonds durs avec du corail vivant. A l’échelle 0.1-10 km, les habitats considérés les habitats côtiers, intermédiaires ou proches du récif barrière (0.1-10 km). Les schémas de distribution des juvéniles ont été comparés dans chaque habitat et à chaque saison grâce à des analyses de co-inertie.
Aux mêmes échelles spatio-temporelles, un modèle a été développé et évalué afin de prédire de manière spatialisée le nombre d’espèces et d’individus juvéniles en fonction des caractéristiques de l’environnement.
Question abordée dans le chapitre 6 : Peut-on établir des cartes prédictives du nombre d’espèces et d’individus juvéniles ?
Les modèles spatialement explicites de distribution d’espèces permettent de prédire le nombre d’espèces ou d’individus à des périodes ou dans des habitats où il serait coûteux d’acquérir ces données sur le terrain. Ce type de modèle permet également d’identifier les échelles spatiales et les variables environnementales qui influencent la distribution des espèces et des individus. Les modèles spatialement explicites de richesse spécifique et d’abondances d’espèces se sont récemment développés en milieu terrestre (Guisan & Zimmermann, 2000 ; Guisan & Thuiller, 2005) mais restent extrêmement rares pour les poissons récifaux (voir pour exceptions Kuffner et al., 2007 ; Pittman et al., 2007). Ces modèles n’ont encore jamais été développés pour les juvéniles malgré les nombreux avantages qu’ils représenteraient.
Dans le contexte d’une première étude pour les juvéniles de poissons récifaux, les objectifs du chapitre 6 étaient de 1) évaluer le pourcentage de variations du nombre d’espèces et d’individus juvéniles qui peut être prédit par une combinaison de variables environnementales enregistrés à différentes échelles spatio-temporelles et 2) cartographier les prédictions du modèle à partir d’une carte des habitats récifaux, établie grâce aux outils de télédétection.
Des comptages visuels des juvéniles ont été réalisés entre mars 2005 et mars 2006 autour des îlots Larégnère et Canard. L’habitat a été décrit à deux échelles spatiales. Des variables environnementales d’ordre temporel, telles que la température moyenne mensuelle de l’eau, la vitesse et la direction moyennes mensuelles du vent ont également été enregistrées. Des Modèles Linéaires Généralisés ont été utilisés pour prédire le nombre d’espèces et le nombre d’individus juvéniles en fonction d’une combinaison de variables environnementales à différentes échelles spatio-temporelles. Les prédictions des modèles ont ensuite été spatialisées à partir d’une carte des habitats récifaux.
![Figure 3 : Echelles spatio-temporelles associées à la dynamique des populations et à leur description dans les écosystèmes coralliens [Adaptation du diagramme de Dickey (1990 ; 1991)]](https://thumb-eu.123doks.com/thumbv2/123doknet/14703684.565601/13.892.154.750.688.1079/echelles-temporelles-associées-populations-description-écosystèmes-coralliens-adaptation.webp)