FACULTE DES SCIENCES DE LA NATURE ET DE LA VIE ET DES SCIENCES DE LA TERRE DEPARTEMENT DE BIOLOGIE
Réf : ……./UAMOB/F.SNV.ST/DEP.BIO/2017
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine: SNV Filière: Sciences Agronomiques
Spécialité: Ago-Alimentaire et Contrôle de Qualité
Présenté par:
Hamer Laine Soumia
&
Zoubiri AsmaThème
Caractérisation d’un fromage frais “Agougli” fabriqué à
partir du lait de chèvre coagulé avec l’enzyme du Ficus
carica L.
Soutenu le:
28/06 / 2018Devant le jury composé de:
Nom et Prénom
Grade
Mme. Mazri Chafiaa MCB Univ. de Bouira Promotrice
Mr.Bouchibane Mbarek MAB Univ. de Constantine Président
Mme. Ammouche Zahia MAB Univ. de Bouira Examinatrice
Liste de tableaux Liste de figures Liste des abréviations.
Introduction ... 01 Partie 1: Etudebibliographique. ... I. Figuier ... 03 1. Généralités ... 03 2. Usagethérapeutique ... 03 2.1. Activitéhépatoprotectrice ... 04 2.2. Activitéhypoglycémique ... 04 2.3. Activité anticancérigène ... 04
2.4. Effet sur la mémoire ... 04
2.5. Effet anti-verrue ... 04 3. Valeurnutritionnelle ... 04 4. Usagetraditionnel du figuier ... 05 5. Latex ... 05 5.1. Ficine ... 05 5.2. Utilisation de la ficine ... 05
II. le lait de chèvre ... 06
1. Généralités ... 06 2. Définition du lait ... 07 3. Composition ... 07 3.1. Eau ... 07 3.2. Lipides ... 07 3.3. Protéines ... 08 3.4. Glucides ... 09 3.5. Vitamines ... 09 3.6. Minéraux ... 09 4. Effetthérapeutique ... 09 4.1. Traitement de maladiescardiovasculaires ... 09
4.2. Traitement de maladies gastro-intestinales ... 10
4.3. Traitement du cancer ... 10
4.4. Effetantimicrobien ... 10
III. Fromagefrais: ... 11
1. Historique ... 11
3. Définition du fromagefrais ... 11
4. Etapes de fabricationdu fromagefraisselon la méthodetraditionnelle. ... 12
4.1. Collecte du lait……….. ….. ... 12 4.2 Pasteurisation ... 12 4.3. Coagulation ... 12 4.4. Egouttage ... 14 4.5. Salage ... 14 Matérielet méthodes : I..Méthodes ... 15 I.1. Matièrespremières ... 15 I.1.1...Lait ... 15 I.1.2Ficine ... 15
I.2. Caractérisation du laitreconstitué ... 15
I.2.1. Détermination de l’aciditétitrable ... 15
I.2.2. Détermination du pH ... 16
I.2.3. Extraitsec total ... 16
I.3.Caractéristiques de l’extraitenzymatique ... 17
I.3.1 Activité coagulante ... 17
I.3.2. Force coagulante ... 17
I.4.Détermination de conditionsoptimales de l’activitéd’extrait de ficine ... 18
I.4.1 Températureoptimale ... 18
I.4.2. pH optimal ... 19
I.4.3. Concentration en CaCl2 ... 19
I. 5.Essai de fabricationd’unfromagefraisselon la méthodetraditionnelle ... 20
I.5.1.Analysesphysicochimiques du laitutilisépour la fabrication du fromage ... 20
I.5.2. Analysesphysicochimiques du fromage fabriqué ... 21
I.5.3. Analysessensorielles ... 22
Résultats et discussions: ... 23
II.1.Caractéristiquesphysicochimiques du laitreconstitué ... 23
II.2. Caractéristiquesphysicochimiques de l’extraitenzymatique ... 23
II.3. Conditionsoptimales de coagulation ... 24
II.3.1. Effet de température ... 24
II.3.2. Effet du pH ... 25
II.3.3. Effet de CaCl2 ... 26
II.4. Essai de fabricationd’unfromagefrais en utilisant la ficine ... 26
II.4.1. Caractéristiquesphysicochimiques du laitutilisé ... 26
II.4.3. Caractéristiquesorganoleptiques ... 28 Conclusion et perspectives. ... 30 RéférencesbibliographiquesErreur ! Signet non défini.
1
L’agriculture de montagne en Algérie est très diverse par la richesse de ses produits. La culture du figuier comme espèce rustique et l’élevage de la chèvre en font partie de
ce patrimoine national qui a connu comme d’autres pays méditerranéens ces dernières décennies, un déclin du nombre d’exploitants et un risque d’abandon des surfaces agricoles. Conscients de ce déclin et du rôle de l’agriculture dans le maintien du paysage et la reconnaissance de l'existence des différents produits et services conjoints qu’elle rend à la population, plusieurs travaux de recherche sont menés par : (Vinson, 1999 et 2005 ; Solomon et al., 2006 ; Oliveira et al., 2009 et 2012, Siar, 2014 et Siaret al., 2017) afin de sauvegarder et d’améliorer le patrimoine figuiécole national en valorisant le savoir-faire relatif à cette espèce afin de répondre au besoin de l’industrie agro-alimentaire et spécialement la fromagère qui a connu ces dernières années une extension sur tout le territoire national.
La production mondiale du lait de chèvre a occupé la troisième place après celui de vache et de bufflonne avec un rendement de 15 128 186 tonnes du lait en 2009 (Park et Haenlein, 2013). Le lait de chèvre, dont la production commence à se développer en Algérie ces dernières années, présente un bon nombre d’avantages lui permettant même de substituer le lait de vache dans l’agriculture familiale. Elle contribue au revenu des éleveurs, leur maintien en territoires pauvres et peu accessibles et permet une présence humaine dans des régions exposées au dépeuplement humain. Ainsi, certaines races de chèvres telles que la race suisse sont de véritables animaux laitiers vue leur rendement égal à celui de vache citant : une chèvre de 65 Kg donne en moyenne 1000 Kg du lait équivalent à celui d’une vache à 680 Kg qui donne environ 6100 Kg du lait, car le métabolisme est proportionnellement lié à ¾ du pouvoir de masse corporelle (Park et Haenlein, 2013).
En revanche, le fromage est un aliment très apprécié dans le monde vu son goût délicieux et sa richesse en nutriments, il est obtenu par transformation du lait en utilisant des cultures microbiennes ou des enzymes coagulantes et parfois les deux en même temps.
Les enzymes sont actuellement largement utilisées comme auxiliaires technologiques. 60% de ces enzymes sont des protéases (Haard,1992). Ces protéases ont plusieurs origines microbiennes, animales ou encore végétales telles que la ficine obtenue à partir de latex du figuier.
2
Le latex du figuier qui contient la ficine est employé depuis les périodes antiques pour la fabrication des fromages ou comme un antihelminthique (Feijoo-Siota et al., 2014). La ficine est aussi utilisée pour l’attendrissement de la viande (Grzonka et al., 2007).
Traditionnellement, dans les montagnes d’Algérie, le latex de figuier (ficine brute) est utilisé comme agent coagulant pour la préparation d’un fromage connu sous le nom « AGOUGLI ».
La Ficine, est le nom donné pour l’enzyme protéolytique (endopeptidase) isolée à partir de latex des arbres du genre Ficus. Elle appartient à la famille des protéases à cystéine (Azarkan et al., 2011).
Durant ces dernières décennies, il a été observé une pénurie mondiale en présure pour des raisons zootechniques et économiques parce qu’elle a connu une demande accrue à cause d’une augmentation régulière de la production mondiale du fromage. Raison pour laquelle des recherches ont été activement poussées dans le but de trouver de nouvelles sources potentielles d’enzymes qui pourront être substituées à la présure animale (Banga-mboko et al., 2002).
Dans ce travail on s’intéresse à l’extraction de molécules de figuier à intérêt industriel, c’est le cas de sa sève qui apporte un contenu enzymatique valorisable, notamment « la ficine », une protéase qui joue un rôle dans la coagulation du lait.
L’objectif principal de cette étude est la valorisation du savoir-faire ancestrale comme pratiques traditionnelles des pasteurs Kabyles qui fabriquaient leur fromage frais sur place durant le pâturage en utilisant le lait de chèvre, par la caractérisation de l’extrait brut de latex “la ficine”, ainsi que l’étude de la possibilité de son emploi comme succédané de présure dans l’industrie fromagère pour fabriquer le fromage frais “Agougli”. Pour atteindre cet objectif on a procédé à la :
• Récupération de la matière première: Le latex. • Extraction de l’extrait enzymatique: La ficine. • Caractérisation de la ficine.
• Utilisation de cet extrait dans la fabrication d’un fromage frais. • Caractérisation organoleptique du fromage obtenu: Profil sensoriel.
I. Figuier
1.
Généralités sur le figuier:
Le figuier ou F. carica Selon son historique il vient d’Asie (Khadivi et al., 2018). F. caricafamille des Moraceaes qui regroupe environ 40 genres.
Figure n°1
Il existe des figues comestibles et d’autres non, el femelles et de figuiers males (Caprifigues
La récolte des fruits mangeables se fait une ou deux d’arbuste unifère ou bifère (Mazri, 2001).
hauteur peut atteindre 5 à 9 mètre suivante: Règne:Végétal Embranchement: Phanérogame Classe Dicotylédones Ordre: Urticales Famille: Moraceae Genre: Ficus
Espèce: Ficus carica L.
3
sur le figuier:
carica L. est l’un des premiers arbres domestiqués dans le monde. d’Asie occidentale puis il a expansé vers le bassin méditerranéen carica est une espèce parmi les 1400 espèces
famille des Moraceaes qui regroupe environ 40 genres.
Figure n°1 : Ficus carica L.(Baby et Raj, 2011).
Il existe des figues comestibles et d’autres non, elles sont recueillies Caprifigues) respectivement (Lazreg-Aref et al.,
La récolte des fruits mangeables se fait une ou deux fois par année, elle
d’arbuste unifère ou bifère (Mazri, 2001). Le figuier est un arbuste à feuilles caduques son 5 à 9 mètres(Al-Snafi, 2017) dont la classification botanique est la
Phanérogames
L.
est l’un des premiers arbres domestiqués dans le monde. occidentale puis il a expansé vers le bassin méditerranéen
espèces appartenant à la
2011).
recueillies à partir des figuiers et al.,2018).
fois par année, elle dépend du type e à feuilles caduques son dont la classification botanique est la
4 2. Usage thérapeutique:
Depuis la nuit des temps, l’homme a utilisé les différentes parties du figuier comme médicament sans comprendre son mécanisme d’action. Aujourd’hui, les composés bioactifs présents dans le figuier lui offrent un effet thérapeutique remarquable et bien défini. Le figuier peut être un facteur de lutte contre plusieurs maladies graves. Parmi ses effets citant:
2.1. Activité hépato protectrice:
L’induction d’une inversion des changements biochimiques, histologiques et fonctionnels, était significativement observée en traitant des rats avec l’extrait d’éther du pétrole (Joseph et Raj, 2011).
2.2. Activité hypoglycémique:
L’administration orale ou intra péritonéale de l’extrait des feuilles du figuier a provoqué une hypoglycémie remarquable sur des rats diabétiques (Joseph et Raj, 2011).
2.3. Activité anti-cancérigène:
Une étude in vitro de différentes doses du latex du figuier sur des cellules cancéreuses humaines a montré qu’une dose de 10mg/ml du latex provoque un effet anti cancérigène significatif après 72 heures du traitement concernant le cancer d’œsophage (Al-Snafi, 2017).
2.4. Effet sur la mémoire:
L’extrait d’héxane des feuilles du figuier à une dose de 200mg/kg d’extrait a permis aux souris albinos ayant un déficit en mémoire de récupérer et de retenir des connaissances spatiales (Al-Snafi, 2017).
2.5. Effet anti-verrue:
Une étude comparative réalisée sur 25 personnes ayant des verrues en y appliquant un traitement au latex du figuier et un autre à la cryothérapie a montré que le latex a un effet non négligeable sur la résolution complète des verrues (Al-Snafi, 2017).
5 3. Valeur nutritionnelle:
Les figues constituaient une nourriture pour l’homme depuis longtemps, elles ont toujours été un aliment avant d’être un fruit. Les figues séchées ont des meilleurs apports nutritionnels par rapport aux autres fruits séchés, voire elles sont très riches en fibres, en polyphénols et en minéraux tels que: le calcium, le potassium et le sodium.
Le tableau ci-dessous représente les nutriments en (g) contenus dans 100g de figues sèches.
Tableau 1: Nutriments en (g) contenus dans 100g de figues séchées Nutriments : Quantité par 100g Calories totaux MGT sodium potassium calcium fer glucides sucres fibres : solubles insolubles protéines vitamine C 283 Kal 0.52 ×103 12.26 60.9 13.30 3.07×103 66.16 ×103 49.0×103 12.21×103 3.47 ×103 8.47×103 3.14 ×103 0.68×103 (Barolo et al., 2014) 4. Usage traditionnel du figuier:
L’usage traditionnel est le résultat d’une longue expérience et produit d’une efficacité remarquable et sure mais dont le mécanisme voire le principe actif ne sont pas encore définis. Traditionnellement la plupart des parties du figuier était utilisée pour traiter certaines maladies, citant:
Les racines étaient utilisées comme tonique, pour la leucodermie et la teigne.
L’utilisation de fruits comestibles était pour traiter plusieurs problème de santé tels que: La bronchite, la gastrite, la constipation, la paralysie, la toux irritative, la douleur dans la poitrine, pharyngite et faiblesse (Al-Snafi, 2017).
5. Latex:
Le latex est le liquide blanc laiteux qui s’écoule après une coupure de la tige, les feuilles et les fruits non murs.
6
Le latex du figuier et d’une grande importance, il sert à protéger cet arbre contre les phytopatogènes et les insectes herbivores, (Rawlings et Salvesen, 2013), et les conditions hostiles comme l’eau et le stress environnemental (Zare et al ., 2013).
5.1. Ficine (ficaine):
Il est sur que le latex des espèces du genre « Ficus » possède une activité protéolytique.(Devaraj et al., 2008).
Le nom ficine était inventé par Robbins c’est la poudre blanche purifiée ayant une activité vermifuge obtenu à partir du genre « Ficus ».
Walti a aussi donné le nom ficine à une préparation cristalline d’une espèce non nommée appartenant au genre Ficus.
En 1992, l’Union International de Biochimie et Biologie Moléculaire recommandé le nom ficaine pour le composant protéolytique majeur du latex; Le terme ficine est donc considéré générique.
Ficaine est sans doute la principale composante du latex du figuier; C’est un seul polypeptide considéré comme membre de la sous-famille C1A, peptidase C01.006 pour ces deux raisons:
La séquence d’acide aminé autour de résidus cystéine et histidine du site actif est similaire avec ceux présents autour des résidus équivalents dans la papaïne. Il est inhibé par la cystatine des œufs de poulet.
Le pH optimal du ficaine est proche de 7 et le large profil du pH est régi principalement par un groupe de valeurs de pKa de 4,46 et 8,37. L’activation de ficaine nécessite des agents réducteurs.
5.2. Utilisation de la ficine (ficaine):
• L’intérêt historique de ficine est du à sa capacité à digérer les nématodes gastro-intestinales.
• Elle est utilisée pour démasquer les antigènes en sérologie.
• Protection du figuier contre les ravageurs (Rawlings et Salvesen, 2013).
• Elle peut être utilisée comme substituant dans les industries agroalimentaires pour l’attendrissement de viande en tant qu’enzyme exogène (Zare et al ., 2013).
7
II. Lait de chèvre
1. Généralités:
La production mondiale du lait de chèvre et de brebis est approximative à 3.5 % (Park et Haenlein, 2013). Ces deux animaux sont appelés le petit stock vu leur petite taille et grande valeur. Pour des raisons ethniques et d’appréciation les gens font élever ces ruminants.
Généralement, le lait de chèvre est transformé en fromage et en yaourt (Park et Haenlein, 2013).
Figure 02: Chèvres (Fischer, 2011).
2. Définition du lait:
Le lait est le produit intégral de la traite totale et ininterrompue d’une femelle laitière bien portante, bien nourrie, non surmenée.
Il doit être recueilli proprement et ne pas contenir de colostrum.
3. Composition du lait de chèvre:
La composition du lait de chèvre est similaire à celles des laits des autres ruminants mais elle se diffère par les proportions. Les composants majeurs du lait de chèvre sont:
3.1. Eau:
C’est le composant major dont il représente 87.3% de la composition globale (Tunick, 2014).
3.2. Lipides:
Les lipides sont de grande importance, ils permettent d’obtenir des produits laitiers de bonne qualité.
8
Ce lait inclut une gamme diversifiée de lipides y compris des lipides simples: diacylglycérol, monoacylglycérol et des esters du glycérol; Et d’autres complexes tels que: phospholipides, stérols, hydrocarbures.
Outre sa richesse en acides gras à chaines courtes ou moyennes lui donne une propriété antimicrobienne.
Ces lipides se manifestent comme des globules gras de petites tailles en les comparant avec celles du lait de vache, cette caractéristique explique l’homogénéité naturelle du lait de chèvre.
Les aliments lactés obtenus à partir du ce lait sont facilement digérer grâce à l’abondance et la petite taille de ces globules grasses.
3.3. Protéines:
Selon leur répartition dans les phases, on distingue: les caséines (phase colloïdale) et les protéines du lactosérum.
3.3.1. Les caséines:
Elles représentent environ 80% des protéines totales sous forme de micelles constituées de quatre unités « submicelles » qui sont: la caséine αs1 (0-28%), la caséine αs2 (1-25%), la caséine β (0-64%) et la caséine κ (15-20%) (Tilahun et al ., 2014).
La structure de micelle est maintenue par le phosphate de calcium colloïdal (CCP). (Un colloïde: est une particule entre un dixième et millième micromètre en taille, et suspendu dans un liquide). Le phosphate du calcium c’est la liaison entre le phosphore et le calcium dont celui du lait est probablement le Ca3 (PO4)2(Tunick, 2014).
Le phosphate est un atome de phosphore entouré de quatre atomes d’oxygène dont il est présent dans plusieurs acides aminés de la caséine.
Le lait de chèvre inclut la plus grande proportion en β-carotène et la plus petite en caséine αs1 responsable de la digestion lente.
Les micelles de caséines sont très riches en calcium et en phosphore mais d’une faible stabilité thermique.
L’acide aminé libre le plus connu et le plus abondant dans ce lait est la taurine qui intervient dans la croissance, le développement cérébral, la formation des sels de la bile et le
9
règlement des flux de calcium en offrant la stabilité aux membranes en tant qu’une régulation osmotique et /ou une élimination des toxines.
3.3.2. Les protéines du lactosérum:
Elles sont représentées majoritairement par la β-lactoglobulines et α-lactalbumines. Ces deux protéines jouent un rôle primordial dans le traitement de certaines maladies, citant:
La β-lactoglobulines est un transporteur du rétinol, d’acides gras et de triglycérides, il est efficace pour le traitement de maladies du stress chronique.
La α-lactalbumines était étudier pour ses fonctions apoptotiques de tuer les cellules cancéreuses voire une activité anti-oxydante.
3.4. Glucides:
Le lactose est le sucre caractéristique et le plus abondant du lait, il est produit à partir du glucose et du galactose dans les glandes mammaires. Il améliore l’absorption de calcium, phosphore et magnésium.
Pour la fabrication de l’acide, les bactéries lactiques utilisent le lactose comme substrat donc il est essentiel pour la fabrication du fromage. (Tilahun et al ., 2014).
Les oligosaccharides sont représentés principalement par les glycopeptides, les glycoprotéines et une petite quantité de nucléotides.
Des études espagnoles ont démontré l’effet anti-inflammatoire de ces oligosaccharides sur des rats ayant des colites ( Tilahunet al ., 2014).
3.5. Vitamines:
Le lait de chèvre est très riche en vitamine A obtenue par transformation complète de β-carotène. Par contre, sa teneur en vitamine D est faible ainsi en vitamine B6.
Il est aussi riche en vitamine C ce qui favorise l’immunité.
3.6. Minéraux:
Le lait de chèvre représente une source importante de minéraux comme le cuivre, le zinc, le chlore, le sélénium et surtout en calcium, phosphore et potassium.
10
4. Effet thérapeutique du lait de chèvre:
4.1.Traitement des maladies cardiovasculaires:Les maladies cardiovasculaires deviennent le premier facteur de la mort dans les villes industrialisées.
La principale cause de ces maladies est le développement des plaques athérosclérotiques dans les vaisseaux sanguins, c’est une action lente qui peut débuter dés l’enfance dont l’initiation n’est pas encore connue mais il existe certaines probabilités qu’elle soit le résultat de l’accumulation de lipoprotéines athérogéniques sur la paroi interne des artères. Les lipoprotéines athérogéniques sont représentées par:
LDL: Low Density Lipoproteins qui transportent le cholestérol de fois vers les vaisseaux sanguins.
HDL: High Density Lipoproteins qui transportent le cholestérol des vaisseaux aux LDL ayant subi une modification oxydative en conduisant à la progression de l’athérosclérose.
Une étude sur des rats a montré que les triglycérides à moyenne chaine contenant des esters d’acides gras caproïque, caprique et caprylique ont un effet sur l’inhibition de l’accumulation du cholestérol sur les tissus (Tilahun et al ., 2014).
Une étude in vitro, sur des gens avaient bu du lait de chèvre de diverses races, montre que ce lait induit la libération d’oxyde nitrique; ce dernier dés son arrivé au sang il provoque une vasodilatation offrant un effet cardio-protecteur et antiathérogène.
4.2. Traitement des maladies gastro-intestinales:
Deux cas représentatifs de ces maladies au niveau de l’intestin:
La colite ulcéreuse : Elle atteint l’intestin au niveau de muqueuse
La maladie de Crohn: Elle se manifeste comme inflammation transmurale peut toucher tout le segment du tractus gastro-intestinal, c’est pourquoi les atteintes iléo-colique sont très répandues.
Ces maladies sont un problème sérieux car elles influencent négativement la vie de patient.
Les oligosaccharides du lait de chèvre ont montré un effet anti-inflammatoire puisqu’ils préviennent la perte du poids, l’extension du colon et les lésions nécrotiques prévues.
11 4.3. Traitement du cancer:
L’acide linoléique conjugué est abondamment présent dans le lait de chèvre a un effet anti-carcinogène contre le cancer des seins et du colon selon des expériences réalisées sur des animaux.
4.4. Effet anti- microbien:
La flore normale du lait de chèvre fermenté est d’une grande activité bactériocine et sans danger (Tilahun et al ., 2014).
III.fromage frais
III.1. Historique:Le fromage était occasionnellement découvert 8000 ans avant JC entre le Tigre et les Fleuves de l’Euphrate par un voyageur qui après une longue marche a décidé de prendre une pause et de prendre son lait pour se rafraichir, et à ce moment était la surprise, il a trouvé que son lait a changé de texture (en devenant ferme) et de gout, la cause de ceci est que la bourse dans laquelle il avait mis le lait était un estomac séché d’un mouton.
III.2. Définition du fromage:
Il est un produit laitier fermenté, d’une grande stabilité et sécurité, une transformation offrant une longue durée de vie au lait (Chandan et Kilara, 2011). Le fromage peut être un produit affiné ou non, molle, semi-dur, dur ou extra-dur, qui peut être enrobé, et dans lequel le rapport protéines de lactosérum / caséine ne dépasse pas celle du lait, obtenue par:
a) la coagulation totale ou partielle de la protéine du lait par l'action de la présure ou d'autres agents coagulants appropriés, et en drainant partiellement le petit-lait résultant de la coagulation, tout en respectant le principe selon lequel la fabrication du fromage entraîne une concentration de protéines du lait (en particulier la portion caséine).
b) les techniques de traitement impliquant la coagulation de la protéine du lait et / ou les produits obtenus à partir de lait qui donnent un produit final ayant des propriétés physiques, des caractéristiques chimiques et organoleptiques du produit obtenu par la coagulation (Muehlhoff et al., 2013).
12 III.3. Définition du fromage frais:
Le fromage frais est un fromage prêt à la consommation des heures après sa fabrication, c'est-à-dire qu’il n’est pas affiné. Il a une durée de vie très courte à cause de sa teneur élevée en eau, elle dure d’un à sept jours ou 12 mois s’il est mariné dans une saumure ou dans l’huile.
Il est très facile de le distinguer grâce à sa couleur blanche, à sa brillance et à l’absence de croute (Harbutt et al ., 2009).
Figure 03: Fromage frais (Harbutt et al ., 2009).
III.4. Etapes de fabrication du fromage frais traditionnel: III.4.1. Collecte du lait cru:
Le lait doit être frais et de bonne qualité chimique et microbiologique. Sa conservation nécessite de basses températures avant la transformation.
Le lait de chèvre ne subit pas une homogénéisation au cours de sa transformation parce qu’elle cause la réduction de la taille de globules gras et elle abime leur membrane protectrice en provoquant leur association à la caséine et par conséquent il y aura un empêchement de crémage et de fusion.
III.4.2. Pasteurisation:
C’est une étape primordiale pour avoir un produit fini sain et sûr.
La pasteurisation du lait permet l’élimination de bactéries pathogènes telles que Listéria monocytogenes; Cette dernière a causé la mort des dizaines de personnes ayant consommées du fromage frais à base du lait non pasteurisé (Tunick, 2014).
Elle se fait à 73°c pendant 15 secondes suivie d’un chauffage à une température inférieure à celle de pasteurisation (Harbutt et al ., 2009).
13 III.4.3. Coagulation:
C’est l’étape la plus importante dans la fabrication de tous les fromages. Il existe deux types de coagulation:
• Acide: En ajoutant des cultures bactériennes acidifiantes ou en ajoutant directement de l’acide lactique ou chlorhydrique.
• Enzymatique: Par l’ajout des enzymes protéolytiques d’origine animale (chymosine, pepsine) (Tunick, 2014), d’origine végétale (ficine, papaiine), (Rawlings et Salvesen, 2013) ou d’origine microbienne (protéases de Mucor pusillus et Mucor miehei) (Meunier, 1999, Boughellout, 2017).
La coagulation se fait selon le mécanisme suivant:
Figure 04: Micelles de caséine intactes lors de l’addition d’enzyme coagulante (Park et Haenlein, 2013).
Hydrolyse de κ-caséine:La caséine κ est constituée de 169 acides aminés, elle est attirée par l’eau et sort de micelle comme un cheveu; Elle empêche l’interaction avec les autres micelles.
Lorsque le pH du lait devient acide l’enzyme protéolytique hydrolyse la liaison Phe 105- Met106 de la caséine κ en provoquant sa scission. Les deux segments résultant sont la caseinomacropeptide (CMP: 106-169) qui se diffuse dans la phase aqueuse, et la para caséine κ (1-105) qui reste dans la micelle à cause de son incapacité de se dissoudre dans le lactosérum.
14
Figure 05: Micelles de caséine après addition d’enzyme coagulante (Park et Haenlein, 2013).
Formation du gel: Les micelles de la caséine κ déstabilisées s’agrègent en formant un gel s’il y a suffisamment d’ions Ca 2+.
Figure 06: Agrégation de micelles de caséine(Park et Haenlein, 2013).
Consolidation du caillé: Après la formation du gel, de nouvelles liaisons se forment entre les micelles en provoquant l’élimination de lactosérum encore présent (Horne et Lucey, 2014).
15 III.4.4. Egouttage:
Le fromage frais ne nécessite pas le découpage il est versé soigneusement dans des récipients spéciaux afin de permettre l’évacuation du lactosérum.
III.4.5. Salage:
Le salage se fait par Na Cl qui est impliqué dans le but d’exhausser le goût et de contrôler la croissance microbienne en empêchant leur développement et la libération d’acide. Le fromage frais est salé par immersion dans des saumures à 22% (Tunick, 2014).
16
I. Materiel et méthodes
I.1. Matières premières:
I.1.1. Lait:Le lait utilisé est un lait écrémé obtenu par dissolution de 12 g de lait écrémé en poudre dans 100 ml de solution de CaCl2 à 0.01M selon le protocole de Berridge (1995).Il est conservé à 4°C pendant 12 heures. Le lait de chèvre utilisé est cédé aimablement par monsieur Ali du village de Haizer.
I.1.2. Latex:
Le latex est une substance liquide visqueuse de couleur blanche, elle circule dans tout le figuier (sève végétale), elle permet de protéger l’arbre contre les ravageurs; Nous l’avons cueilli à partir des figuiers de différentes variétés et de régions différentes à la fin du mois d’Avril. Le latex est récupéré dans des contenants en plastique propres et maintenu à froid de sorte qu’il ne perd pas sa fraicheur le long du trajet.
I.1.3. Extraction de ficine:
L’extraction de la ficine est une étape très importante, elle sert à séparer l’extrait enzymatique de la gomme. Elle se fait par centrifugation à 3200 g pendant 15 minutes à 4℃, pour récupérer l’extrait enzymatique (phase aqueuse) qui ensuite conservé à 18°c pour des utilisations ultérieures (Nouani et al., 2009 et SIAR et al., 2017).
.
I.2. Caractéristiques physiques du lait reconstitué (solution de Berridge): I.2.1. Acidité titrable:
L’acidité nous renseigne sur l’état de fraicheur des produits alimentaires, elle est exprimée par la masse de l’acide lactique contenu dans un litre du lait. Elle est définie par le volume de base nécessaire pour neutraliser le pH (Jensen, 1995).
C’est une réaction acido-basique qui exige la présence d’un indicateur coloré phénolphtaléine dont la base (Na OH) neutralise l’acide lactique contenu dans le lait. La neutralité est obtenue avec l’apparition de la couleur rose qui persiste environ 5 secondes dont la durée de l’expérience ne doit pas dépasser 40 secondes (JORA 1998).
17 Mode opératoire:
Dans un bécher, on met 10mL de la solution de Berridge, à laquelle on ajoute quelques gouttes de phénolphtaléine puis on fait le titrage par une solution de la soude dornique à 0.1N, jusqu’à l’obtention d’une couleur rose pale. Le degré dornique est l’équivalent de 0.1 g /L d’acide lactique (FAO, 1995). L’acidité titrable est calculée selon la relation suivante:
Acidité = 10 (V/V1) 0,9 V: volume de la soude usée.
V1: volume de la solution de Berridge.
I.2.2. Détermination du pH:
Le pH représente la concentration des ions H+ dans un aliment donné, dans notre cas c’est la solution de Berridge, il renseigne sur l’alcalinité ou l’acidité de celui-ci.
Mode opératoire:
La détermination du pH est faite à l’aide d’un pH-mètre type HANNA/HI 2211. Une fois le pH-mètre est étalonné par des solutions à pH= 7 et pH= 4, on met dans un bécher un volume de la solution de Berridge, on rince l’éléctrode du pH-mètre avec de l’eau distillée puis on l’immerge dans cette dernière et on attend jusqu’à la stabilisation de la valeur affichée sur l’écran pour faire la lecture.
I.2.3. Détermination de l’extrait sec total:
L’extrait sec total représente la teneur en matière sèche totale, c'est-à-dire la différence entre le poids de l’aliment et sa teneur en eau.
Mode opératoire:
D’abord nous avons pesé la capsule vide puis nous l’avons mis à l’étuve une heure au minimum à 105 ℃, après on l’a fait sortir en la plaçant directement dans le dessiccateur pendant 30 minutes et on refait la pesée. Après on place 3mL de l’échantillon dedans et on l’a remis à l’étuve pour trois heures.L’extrait sec total est calculé comme ce suit:
H
= –18 H: Humidité.
m0: Masse de la capsule.
m1: Masse de la prise d’essai et la capsule avant dessiccation (g). m2: Masse De la prise d’essai et la capsule après dessiccation (g).
EST=100-H
II.3.Caractérisation de l’extrait enzymatique :
II.3.1. L’activité coagulante:
L’activité coagulante s’exprime par la rapidité avec laquelle l’enzyme coagule le lait ; Elle est déterminée selon la méthode de Berridge. Elle est basée sur l’évaluation visuelle de l’apparition des premiers flocons de la coagulation du substrat de Berridge et qui s’exprime en termes d’unité d’activité coagulante (U.A.C) ou d’unité présure (UP). Cette dernière est définie par la quantité d'enzyme contenue dans 1mL de la solution enzymatique qui peut coaguler 10 mL de substrat standard de Berridge en 100 secondes à 30°C (Alais, 1974; Ramet, 1997).
Le temps de floculation correspond au temps s’écoulant entre l’addition de l’extrait enzymatique (ficine) et l’apparition des premiers flocons de caséines visibles à l’oeil nu sur la paroi interne de tube incliné subissant un lent mouvement de rotation (Benyahia-krid et al., 2016). L’activité coagulante exprimée en Unité Présure (UP) est calculée selon l’expression suivante:
U.A.C=
×
× Où:
UP = unité présure; V = volume de lait;
10 = volume du substrat standard (10 mL); v = volume de l’extrait d’enzyme;
19 II.3.2. La force coagulante :
La force coagulante représente le volume du lait coagulable par unité de volume d’une enzyme ou d’un extrait enzymatique, en 40 minutes, à 35°C et pH égale à 6,4 (Tsouli, 1979 ; Alais, 1984). La force coagulante est exprimée par la formule suivante:
= ×
× F: Force de l’enzyme ;
V: Volume du lait ajusté (pH: 6.4, T°: 35°C) v: Volume de la solution enzymatique ; T: Temps de coagulation du lait (en seconde); Temps standard du test = 2400 sec (40 min).
Le procédé est le même que celui pour la détermination de l’activité coagulante, la seule différence est que dans ce cas les tubes sont maintenus à 35°C au bain marie afin de stabiliser le lait.
II.4. Détermination de conditions optimales de l’activité de l’extrait enzymatique :
Plusieurs facteurs peuvent affecter l’activité enzymatique, c’est pourquoi il faut les étudier à fin de déterminer les conditions optimales de notre extrait enzymatique. Parmi ces facteurs, on peut citer:
II.4.1. Température :
La dépendance de la coagulation enzymatique de la température était reconnue depuis longtemps mais il n’y a aucune explication claire pour définir profondément le type des interactions produites au cours de ce phénomène (Horne et Lucey, 2014).
Pour définir la température optimale de notre extrait enzymatique, nous avons étudié l’activité coagulante de la solution de Berridge sur un interval de température défini en fixant les autres conditions et en jouant sur la température qui sera changée à chaque fois allant de 30℃vers 85℃ (30,35, 40,45, 50,55, 60, 65,70, 75, 80 et 85℃).
Le choix de cet interval est que les fabricants du fromage utilisent généralement des températures supérieures à 30℃ et inférieures à 85℃pour ne pas risquer d’avoir une inactivation de l’extrait enzymatique (Siar, 2014).
20
A chaque température, on réalise trois essais dont l’activité coagulante sera calculée à partir de la moyenne de trois valeurs obtenues.
Mode opératoire:
Pour déterminer l’influence de la température sur la coagulation, nous avons calculé le temps de coagulation pour la solution de Berridge à différentes températures: 30,35, 40,45, 50,55, 60,65, 70, 75, 80 et 85 ℃
II.4.2. pH:
L’activité enzymatique nécessite un certain seuil d’acidité c'est-à-dire un pH relativement bas. Pour définir l’activité de l’extrait enzymatique obtenu, on a étudié les changements en activité coagulante à un interval de pH bien déterminée de 5, 5.5, 6, 6.5 à 7. Nous avons choisi cet interval pour éviter la coagulation spontanée (acide) à un pH inférieur à 5, et pour ne pas perdre l’activation de l’extrait enzymatique à un pH supérieur à 7 (Siar, 2014).
Pour chaque valeur de pH, nous avons fait trois répétitions dont l’activité coagulante sera déterminée en utilisant la moyenne de ces valeurs.
Mode opératoire:
L’effet du pH est déterminé par la méthode suivante:
On ajuste le pH de la solution de Berrigde soit en ajoutant de HCl à 1N pour le baisser, soit en ajoutant de NaOH à 1 N pour l’augmenter. Les pH utilisés sont: 5; 5,5; 6; 6,5; 7.
Puis on calcule le temps de coagulation à 30°c en fixant la concentration en CaCl2.
II.4.3.Concentration en CaCl2:
La concentration du calcium joue un rôle important dans la coagulation enzymatique du lait.
Afin de déterminer la concentration optimale en CaCl2 compatible à une meilleure activité de notre extrait enzymatique on a changé la concentration de CaCl2 dans la solution de Berridge allant de 0.005 M à 0.05M (0.05M, 0.01M, 0.02M, 0.03M, 0.04M ,0.05M).
Les essais sont répétés trois fois à chaque concentration, puis l’activité coagulante sera déterminée à partir de leur moyenne. Ensuite, on a calculé le temps de coagulation à 30℃ et à pH fixe.
21
II.5.Essai de fabrication d’un fromage frais selon la méthode traditionnelle :
La fabrication du fromage frais à base du lait de chèvre a été faite au niveau de laboratoire de recherche de l’INATAA, dont on a lancé la coagulation de 4 litres du lait de chèvre en utilisant une dilution de 1/100 de l’extrait enzymatique qu’on a préalablement préparé car à une dilution de 1/10 nous avons marqué une coagulation spontanée.
D’abord on a procédé au chauffage du lait à 35°c au bain-marie, puis on y a ajouté l’extrait enzymatique de sorte que pour chaque litre du lait on additionne 1mL de l’extrait. Après presque une heure on a observé la coagulation complète du lait, ensuite on a séparé le caillé du lactosérum en utilisant une passoire couverte d’un tissu perméable. En outre, on a fermé le tissu en le fixant sur une cuillère de sorte qu’il soit suspendu et le lactosérum est récupéré dans le bécher placé dessous. En fin, on a récupéré le fromage après l’avoir pesé nous l’avons conservé à une température de congélation de 4°c, jusqu’à son utilisation.
II.5.1.Analyses physico-chimiques du lait utilisé pour la fabrication du fromage: II.5.1.1. Détermination de l’acidité titrable:
Pour déterminer l’acidité du lait utilisé pour la fabrication du fromage nous avons pris 10 ml du lait de chèvre nous l’avons additionné quelques gouttes de phénolphtaléine puis on l’a titré avec une solution d’hydroxyde de sodium (NaOH) à 1N.
Expressions de résultats:
A= V×10 A: Acidité titrable (°D).
V: Volume de NaOH utilisé.
II.5.1.2.Détermination du pH:
Elle était déterminée comme celle du lait reconstitué, par immersion de l’électrode du pH-mètre dans uns bécher contenant du lait de chèvre.
II.5.1.3. Détermination de l’extrait sec total :
Elle s’est faite selon la même méthode utilisée pour le lait reconstitué, en mettant 3 ml du lait de chèvre dans l’étuve à 103℃pendant trois heures.
22
II.5.2. Analyses physicochimiques du fromage fabriqué: II.5.2.1.Acidité titrable:
On a dilué 10 g du fromage dans 100 ml d’eau distillée, ensuite nous l’avons agité vigoureusement et nous l’avons chauffé à 70°c, puis on a filtré ce mélange. Puis nous avons prélevé 10 ml du filtrat auquel nous avons additionné quelques gouttes de solution de phénolphtaléine et enfin c’était le titrage par une solution d’hydroxyde du sodium à 0.1N (Fiol et al., 2016).
II.5.2.2. pH:
La détermination du pH est faite pour 10 g du fromage fabriqué dilué dans 10 ml d’eau distillée ayant subi une agitation vigoureuse.
II.5.2.3. Extrait sec total:
La détermination de l’extrait sec du fromage fabriqué était par la mise de 3 g du fromage dans l’étuve pendant trois heures après avoir calculé les masses que la relation citée auparavant exige (Yabrir et al., 2011).
II.5.2.4. Rendement :
Le rendement fromager est un facteur très important dans la fabrication du fromage, les producteurs cherchent toujours à augmenter le rendement comme but économique de cet exercice.
Expression de résultats:
Le rendement se calcule selon la relation suivante: % = é
é .
R%: Rendement (BenYahia-Krid, 2016).
II.5.3.
Analyses sensorielles:
II.5.3.1. Panel de dégustation:On a choisi 20 personnes intéressées pour participer à la dégustation, les dégustateurs sont des étudiants en graduation de la Faculté de Sciences de la Nature et la Vie. Des explications comment procéder au remplissage des tableaux ont été données et des mesures pratiques pour une bonne dégustation ont été adoptées.
23
La dégustation a étéréalisée au niveau des laboratoires de recherche de la faculté de sciences de la nature et de la vie.
Pour réaliser le test d’intensité, on a coupé le fromage préalablement décongelé en petits dés et on l’a présenté aux dégustateurs afin de noter sur une échelle de 9 les 13 critères organoleptiques selon le bulletin de l’annexe 1.
II.5.3.3. Test d’intensité:
Ce test est réalisé sur la base d’un bulletin établi avec un tableau afin d’évaluer les attributs (les caractères recherchés) du fromage fabriqué en donnant des notes de un à neuf selon leur détection de sorte que plus l’attribut est intenseselon le dégustateur plus la note sera grande. Si le caractère recherché n’est pas identifié le dégustateur peut y mettre un zéro.
Traitement de résultats :
Les résultats obtenus après le test d’intensitésont traités par Excel, puis représentés graphiquement afin de visualiser les caractéristiques organoleptiques du fromage fabriqué et pour faciliter leur interprétation.
23
III.1. Caractéristiques physico-chimiques de lait reconstitué:
Dans le tableau 3, on observe que l’acidité du lait obtenu par reconstitution est de 18° Dornic, son pH est de 6.48 avec un extrait sec total égal à 10.95 %; ces valeurs coincident avec celles recommandées par le CODEX STAN207-1999 (Jensen et al., 1995) pour ce qui est de l’acidité et du pH mais l’extrait sec est légèrement inférieur en pourcentage.
Tableau 2: Caractéristiques physico-chimiques de solution de Berridge:
II. 2. Caractéristiques physicochimiques de l’extrait enzymatique:
Les caractéristiques physicochimiques de l’extrait enzymatique de la ficine obtenu par centrifugation de latex du figuier à 3200g pendant 15 minutes à 4℃sont présentées dans le tableau 4. L’extrait enzymatique obtenu peut être défini comme un liquide visqueux, dotée d’une couleur brune claire avec une odeur fruitière prononcée. Sa disponibilité est faible à cause de mode d’obtention qui reste primitif par incision du figuier et récupération manuelle du latex. Le rendement estimé par Bouacherine et Ouchene, (2017) est d’environ 75% (15 ml de la ficine brute pour 20 ml de latex) avec 25% de matière gommeuse enlevée du latex après la centrifugation. Ce résultat est proche à celui obtenu par Siar, (2014) à 71,42%. Cette différence peut être expliquée par les différences climatiques entre les régions de collection du latex ainsi que les caractéristiques du sol pouvant influencer sur la composition du latex.
L’activité enzymatique de l’extrait de ficine qu’on a utilisé est de 23.88 UP cette valeur est inférieure à celle obtenue par Siar (2014) et Leulmi (2016) de l’ordre de 121,09 U.P de même pour celle obtenue par Bouacherine et Ouchene (2017) 103,458 ± 1,69UP.
Cet extrait est un peu puissant présentant une force coagulante de 1/10 892.59 c'est-à-dire qu’1mL de cet extrait est capable de coaguler environ 10 litres du lait; Cette valeur est inférieure à celles calculée par Siar (2014) qui égale à 1/ 42 059,76 et celle rapportée par
Solution de Berridge Normes acidité titrable 18 °D 18 ° D max
pH 6.48 6.22-6.77
24
Nouani et al., (2009) de l’ordre de 1/ 40 000 et la moitié de celle de Bouacherine et Ouchene (2017) de 1/21 258,911.
Tableau 3: Caractéristiques physico-chimiques de l’extrait enzymatique:
Caractéristiques : Extrait enzymatique : Activité coagulante 23.88 UP
Force coagulante 1/10 892.59
Couleur Brune claire
disponibilité Faible
Odeur Prononcée fruitière
Texture Visqueuse
II.3. Conditions optimales de la coagulation: II.3.1. Effet de température:
Figure 8: Effet de la température sur la coagulation.
Pour étudier l’effet de la température du lait sur l’activité coagulante de l’extrait enzymatique étudié nous avons mesuré l’activité coagulante à différentes températures d’incubation (de 40 à 80°C). La figure 8 montre que l’évolution de l’activité coagulante de la ficine dépend fortement de la température. L’optimum d’activité coagulante pour l’extrait de
0,00 1000,00 2000,00 3000,00 4000,00 5000,00 6000,00 30 35 40 45 50 55 60 65 70 75 80 85 U.P Température
25
ficine est obtenu à une température du lait égale à 75°C avec une valeur de 5000 U.P. Ce résultat est proche de ceux donnés par Nouani et al., (2009) évalué à 80°C, Fadyloglu, (2001) estimé à 60°C et Payne, (2009) qui est de 65°C. Ces résultats confirment la grande stabilité thermique de la ficine déja signalée par plusieurs auteurs (Grzonka et al., 2007, et Bekhit et al., 2013, Siar, 2014 et Bouacherine et Ouchene, 2017).
II.3.2. Effet du pH:
Figure 9: Effet du pH sur la coagulation.
L’effet du pH sur l’activité coagulante de l’extrait de ficine, a été étudié en ajustant le pH du lait (substrat de Berridge) aux valeurs de l’intervalle 5 à 7. La température d’incubation est fixée à 30°C et la concentration en CaCl2 est de 0,01M. Le pH optimal de coagulation du lait est déterminé par observation du temps de floculation le plus court. La figure 9 donne l’évolution de l’activité coagulante de l’extrait enzymatique étudié en fonction du pH du lait. Les résultats présentés sur la figure 9 montrent une diminution de l’activité coagulante de la ficine au fur et à mesure que le pH du lait augmente. En effet, l’optimum d’activité est à pH 5,0 avec une activité coagulante de 144,96 UP. Ces résultats confirment ceux de Nouani et al.,
(2009) et Fadyloglu, (2001) qui ont estimé que le pH optimal d’activité pour la ficine est de 5. D’après ces résultats on constate que le pH joue un rôle très important dans la
coagulation de lait, sur la solubilisation du phosphate du calcium micellaire, diminution de la
0,00 20,00 40,00 60,00 80,00 100,00 120,00 140,00 160,00 5 5,5 6 6,5 7 7,5
U.P
pH
26
charge nette des molécules de caséine et la dissociation de caséines de la micelle avec un pH optimum pour l’hydrolyse de la κ-caséine entre 5.1 et 5.3.
II.3.3. Effet de concentration en CaCl2:
Figure 10: Effet de la concentration en CaCl2 sur la coagulation.
La concentration optimale en CaCl2 du lait est déterminée en mesurant le temps de coagulation du lait additionné de quantités de CaCl2 variant de 0,005 à 0,05 M car le Ca 2+ joue un rôle important sur la fermeté du caillé dont son ajout renforce le gel (Najera et al., 2003).
La figure 10 montre l’influence de la concentration en CaCl2 sur l’activité coagulante de la ficine. D’après ces résultats obtenus on constate que dans l’interval de concentration en CaCl2 étudié l’activité coagulante augmente avec la concentration en CaCl2. L’optimum d’activité pour la ficine estimé à 74,08 UP est obtenu à une concentration de 0,02 M. Cette concentration est similaire à celle signalée par Nouani et al., (2009), Bouacherine et Ouchène (2017) quant a elles ont observé un optimum d’activité de la ficine a une concentration de CaCl2 de l’ordre de 0.03.
II.4.1. Caractéristiques physico-chimiques du lait utilisé:
Les caractéristiques physicochimiques du lai de chèvre utilisé pour la fabrication de fromage sont résumées dans le tableau 5.
0 10 20 30 40 50 60 70 80 0,005 0,01 0,02 0,03 0,04 0,05 U.P [ CaCl2] M
27
Tableau 4: Caractéristiques physicochimiques du lait de chèvre
Paramètres Lait utilisé La norme (FAO, 1995) Acidité titrable 17 °D 14-18 °D
pH 6.55 6.45-6.60
Extrait sec total 19.73 % 13,4 %
L’acidité du lait de chèvre qu’on a utilisé pour fabriquer notre fromage est de 17°D et son pH est de 6.55, ce qui correspond aux normes définies par la FAO (1995), nos résultats sont inférieurs à ceux cités par Boumendjel et al., (2017) dont l’acidité est de l’ordre de 18°D et le pH de 7.14. L’extrait sec total obtenu est très élevé par rapport a la valeur fixée par la FAO (1995).
II.4.2. Paramètres physicochimiques du fromage fabriqué:
Après sept jours de la fabrication du fromage on a procédé à la détermination des trois paramètres; acidité titrable, pH et extrait sec total dont les valeurs sont rapportées dans le tableau 6.
Tableau 5: Paramètres physicochimiques du fromage fabriqué:
II.4.2.1. Acidité:
L’acidité du fromage fabriqué est 9.55°D, elle est inférieur à celle obtenue par Kouniba et al., (2007) pour le même type de fromage obtenu et qui est de l’ordre de 13.6°D.
L’acidité du fromage frais augmente progressivement dans le temps, ce qui explique la durée de vie limitée de ce type du fromage car plus l’acidité augmente, plus le fromage devient aigre et parfois insupportable.
II .4.2.2. pH:
Le pH du fromage fabriqué est de 5.67 cette valeur est supérieure à celle de (Boumendjel et al., 2017) 4.75 obtenue par coagulation du lait de chèvre en utilisant des cultures
Paramètres Fromage fabriqué acidité titrable 9.55 °D
pH 5.67
28
bactériennes et la présure. Par contre elle est inférieure à celle cité par Smith (2005) qui est de l’ordre de 4.5 pour les fromages frais en général.
II.4.2.3. Extrait sec total:
L’extrait sec total du fromage fabriqué est de 39.23%, il est supérieur à 35.04% déterminé par (Kouniba et al., 2007) pour un fromage frais à base du lait de chèvre obtenu par coagulation acide.et supérieur à celui de Siar (2014) qui était de 31.13% pour un fromage à base du lait de vache enutilisant la ficine comme agent coagulant.
II.4.2.4. Rendement:
Le rendement du fromage fabriqué est de 12.93 %, il est inférieur à celui trouvé par (Kouniba et al, 2007) qui est de 14 % pour un fromage frais à base du lait de chèvre obtenu par coagulation acide.
II.4.3. Caractéristiques organoleptiques:
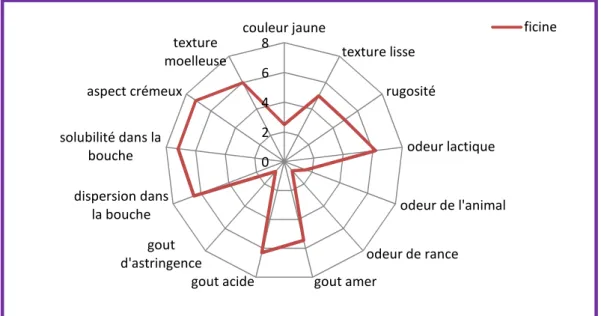
Les résultats du test d’intensité réalisé par vingt dégustateurs qui ont remplis des fiches contenant 13 attributs en les évaluant de 0 à 9 sont représentés sous forme de toile d’araignée dans la figure 14. On observe que le fromage frais fabriqué par la coagulation du lait de chèvre avec la ficine présente une couleur blanche, cela est probablement dû à la transformation de béta carotène en vitamine A (Tilahun et al., 2014) .
Le fromage obtenu se distingue par sa texture moelleuse avec un aspect crémeux et dans la bouche, les dégustateurs ont signalés sa dispersion lors de sa mastication avec une bonne solubilité. Seulement que, ils ont signalé le gout acid et amer très prononcé, ceci est peut être du a la durée de conservation car Siar, (2014) a rapporté pour le même type de fromage; que la durée de vie courte du fromage frais ne permet pas l’apparition du gout amer qui commence à apparaitre sur des fromages fabriqués en utilisant la ficine comme agent coagulant qu’à partir du 13ème jour de sa fabrication.
29 0 2 4 6 8 couleur jaune texture lisse rugosité odeur lactique odeur de l'animal odeur de rance gout amer gout acide gout d'astringence dispersion dans la bouche solubilité dans la bouche aspect crémeux texture moelleuse ficine
Figure 11: Profil sensoriel du fromage fabriqué.
D’après les résultats obtenus on peut dire que:
La couleur du fromage frais qu’on a fabriqué était blanche un peu jaunâtre, elle est probablement due à la transformation de béta carotène en vitamine A. (Tilahun et al., 2014); Son odeur était semblable à celle du lait, outre l’odeur animale n’était pas prononcée dont les dégustateurs n’ont même pas arrivé à distinguer partir du quel animal ce fromage était fabriqué .L’odeur de rance était absolument faible. En résume, d’après les dégustateurs, elle était agréable; Ils étaient en accord que le fromage avait un gout acide, et une amertume peu prononcée. Par contre il n’avait pas un gout d’astringence.
Le fromage fabriqué, d’après les remarques rapportées par les dégustateurs avait une texture lisse ainsi moelleuse avec une bonne solubilité et dispersion dans la bouche .Outre, l’aspect du fromage était jugé comme crémeux cet attribut est grâce à la richesse de ce fromage en matière grasse.
En comparant nos résultats d’analyses sensorielles avec ceux de Siar (2014) d’un fromage à pâte molle type camembert fabriqué en utilisant la ficine comme agent coagulant dans le premier jour de fabrication on a remarqué que notre fromage avait une texture et un aspect semblables à ceux de l’autre fromage
30
On a réalisé ce travail dans le but d’étudier la possibilité d’utiliser la ficine, enzyme végétale, comme succédané de la présure afin de l’impliquer dans la fabrication du fromage frais selon la méthode traditionnelle. Cette étude rentre dans le cadre de la valorisation du savoir faire ancestrale typique de l’agriculture familiale de montagne, où les pasteurs utilisaient le latex du figuier pour élaborer un fromage “Agougli” à partir du lait de leurs chèvres comme source d’aliment complet.
La démarche suivie a consisté: Premièrement en la récupération de la matière première renfermant le système enzymatique recherché, l’extraction de la ficine et sa caractérisation de point de vue activité et force coagulante et conditions optimales d’activité (température, pH et [CaCl2]).
Deuxièmement on a essayé de fabriquer un fromage frais à base du lait de chèvre en utilisant la ficine du figuier comme agent coagulant selon la méthode traditionnelle.
Les résultats de ce travail de recherche ont démontré la force de coagulation élevée de la ficine, qui est de l’ordre de 10 Foix plus celui de la présure avec une force coagulante de l’ordre de 1/ 10 892.59 sur le fromage fabriqué. Cela permet d’économiser en temps et en argent à l’échelle industrielle dans le domaine de transformation fromagère, tout en préservant la culture du figuier comme patrimoine nationale en voix de disparation.
Selon les résultats obtenus on conclu que la ficine est thermophile, sa température optimale est de l’ordre de75°c avec une activité maximale de 5000 UP;
C’est une enzyme qui supporte l’acidité puisque son pH optimum est égal à 5 avec une activité de 144.96 UP;
La ficine preserve son pouvoir coagulant en présence de sel jusqu’a une concentration optimale de 0.02M de Cacl2 avec une activité de 74.08 UP, mais au de la de 0.03 M son activité est réduite.
Le lait de chèvre est très rentable pour sa transformation fromagère, on a enregistré un rendement d’environ 12.93% en fromage frais fabrique à partir de lait de chèvre.
Le fromage fabriqué se distingue par sa couleur blanche, sa texture onctueuse et sa dispersion avec une bonne solubilité dans la bouche. En général les caractéristiques organoleptiques du fromage fabriqué sont acceptables par les dégustateurs.
31
D’après les résultats obtenus on peut dire que la ficine est un meilleur substituant de la présure, plus efficace et plus rentable dans la production fromagère à l’échelle industrielle autre que dans les pratiques traditionnelles.
Malgré la collaboration de ce travail à la valorisation des produits de terroir, des études sur le contrôle des peptides de l’hydrolyse des caséines ainsi que l’amélioration organoleptique des fromages obtenus par la ficine sont à envisager dans le futur.
32
Alais , C. (1984) : Science du lait. Principes des techniques laitières. Ed. SEPAIC, 4ème édition : 814.
Alais, C. (1971): Les enzymes coagulantes, les techniques laitières 79 : 719.
Al-Snafi, A. E. (2017): Nutritional and pharmacological importance of ficus carica.A review. International Organization of Scientific Research. Journal of Pharmacy, 7(3): 33-48.
Arrêt interministériel du 29 Safar 1414 correspondant au 18 aout 1993 relatif aux specifications et la presentation de certains laits de consummation P.16 (N° JORA: 069 du 27-10-1993).
Azarkan, M. A., Matagne, R., Wattiez, L., Bolle, J., Vandenameele and D, Baeyens-Volant. (2011): Selective and reversible thiol-pegylation, an effective approach for purification and characterization of five fully active ficin (iso) forms from Ficus carica latex. Phytochemistry, 72: 1718-1731.
Banga-Mboko, H., Thilman, P., Desbuleux, H., Aoumeur N., Youssao, I., Perenyi Z., de Sousa N.M., El Amiri B., Beckers J. F. (2002): Pepsinogen and progesterone concentration during pregnancy in sows. Journal of Biotechnology. Agronomy.Sociology. Environnement, 6, 12-13.
Barolo, M. I. Ruiz Mostacero, N. Lopez. S. N. (2014): Ficus carica L (Moraceae): An ancient source of food chemistry.
Bekhit, A.Hopkins, D. Geesink, G.Bekhit, A.Philip, F. (2013): Exogenous proteases for meat tenderization. Critical Review in Food Science and Nutrition, 89p.
Benyahia-Krid, F. A., Aissaoui-Zitoun. O., Boughellout. H., Harkati. A., Bakou, R. C., Wodo. D., Zidoune, M .N. (2016): Fresh cheese “Peulh Type”: Characterization and Sensory Aspects. Journal Advances in Dairy Research 4: 163.
Berridge, N.J. (1955): Purification and assay of rennin. Methods in enzymology. Ed.
Bouacherine, M. et Ouchene, Z. (2017): Valorisation d’un savoir faire Kabyle son application industrielle: Caractérisation d’un fromage à pate molle fabriqué à partir du lait de vache coagulé avec l’enzyme de Ficus carica L. Mémoire de fin d’étude en vue de l’obtention du diplome de Master.
Boughellout, H. (2007): Coagulation du lait par la pepsine de poulet. Mémoire en vue de l’obtention du diplome de MAGISTER en Sciences Alimentaires.
Boumendjel, M. Feknous. N, Mekideche. F, Dalichaouche .N, Feknous .I, Touafchia .L, Metlaoui. N, Zenki. R. (2017): Caractérisation du lait de chèvre produit dans la région du
33
Nord-est algérien. Essai de fabrication du fromage frais. Algerian Journal of Natural Products5 (2):492-506.
Chandan. R. C, Kilara. A. (2011): Dairy Ingredients for Food Processing, Blackwell Publication. Journal Dairy Science. (87): 3138-3152.
CODEX STAN 207-1999, Norme pour les laits en poudre et la crème en poudre
Devaraj, K. B., Latilha, R., Gowda., Prakash, V. (2008): An usual thermostable aspartic protease from the latex of Ficus racemosa (L). Phytochemistry 69: 647-655.
Fadyloglu, (2001): Immobilisation and characterisation of ficin, Nahrung/Food 45 N 2, p 143-146.
Fallico , V., McSweeney, P. L. H., Siebert, K. J., Horne, J., Carpino, S., and FAO, (1995) : Chapitre 2 Laits d'animaux laitiers, Rome.
Feijoo, S., Blasco, L., Luis, R. J. (2014): Recent patents en microbial proteases for the dairy industry, n 1, 8: 44-55.
Feijoo-Siota, L. et Villa,T. G. (2011): Native and Biotechnologically Engineered
Fiol, C., Prado, D., Mora, M., Alva, I. J. (2016): Nettle cheese: Using nettle leaves (Urtica dioica) to coagulate milk in fresh cheese making process. International Journal of Gastronomy and Food Science 4: 19-24.
Fischer, J. W. (2011): Cheese Identification –Classification- Utilization.Cengage Learning: 8.
Grzonka, Z., Kasprzykowski, F., Wiezk, W. (2007): Cysteine proteases. Chapter11. Journal Polaina and A. P, Marccabe (eds.), Industrial Enzymes, p 181-195.
Haard, N.F. (1992): Journal of Aquatic Food Product Technology 1 (1): 17-31.
Harbutt, J., Aspinwall, M., Blohorn, S ., Bozzetti, V. , Broome, K. J., Buck, R., Cooper, S., Curtin, D., Davies, J., Davis, S., Gray, A., Hijikata, R., Honma, R., Jarvis, K., Linton, M., Pretty, G., Renz, H., Sutton, R., Studd, W., Warwick , J., Vernooij , A.(2009): World Cheese Book, Dorling Kindersley Limited: 8-11.
Horne, D.S., Lucey, J. A. (2014): Revisiting the temperature dependence of coagulation of renneted bovine micelles/ Food Hydrocolloids 42:75-80.
Jensen, R. G. (1995): Handbook of Milk Composition. Academic Press: 82-89.
Joseph, B., Raj, J. S. (2011): Pharmacognostic and phytochemical properties of Ficus carica Linn. An overview.
Khadivi, A., Anjam, R., Anjam, K. (2008): Morphological characterization of edible fig (Ficus carica L.) to select the superior trees. Scientia Horticulturae 238: 66-74.
34
Kouniba, A., Berrada, M., El Marakchi, A. (2007): Etude Comparative de la composition chimique du lait de chèvre de la race locale Marocaine et la race alpine et évaluation de leur aptitude fromager. Revue de Médecine Vétérinaire, 158(03):152-160.
Lazreg-Aref, H., Gaaliche, B., Ladhari, A., Hammami, M. (2018): Co-evolution of enzyme activities and latex in fig (Ficus carica L) during fruit maturity process. South African journal on Botany.
Leulmi, I. (2016): Hydrolyse enzymatique des caséines bovines par la ficine et les cardosines, mémoire en vue d obtenir des peptides antimicrobiens en vue de l’obtention de diplôme de magister.
Mazri, (2001): Etude phénologique et socioéconomique de trois variétés du figuier Ficus carica de la Kabylie. Mémoire d’Ingéniorat en Agronomie, Université Mouloud Mammeri, Tizi Ouzou.
Meunier, N. (1999): Evaluation du potentiel de production de protéines bactériennes à partir de boues d’épuration municipales, mémoire pour obtention de grade de maitre en sciences (M.Sc).
Muehlhoff, E., Bennett, A., Mc Mahon, D. (2013): Milk and dairy products in humain nutrition, FAO, Rome, 2013.
Najera, A. I., de Renobales, M., Barron, L. J. R. (2003): Effects of Ph temperature Ca Cl2
and enzyme concentrations on the rennet-clotting properties of milk: multifactorial study. Food chemistry, 80: 345-352
Nouani, A., Dako, E., Morsli, A., Belhamiche, N., Belbraouet, S., Bellal, M.M. et Dadie, A (2009) : characterization of the Purified Coagulant Extracts Derived from Artichoke Flowers (Cynara scolymus) and from Fig Tree Latex(Ficus carica) in light of their Use in the Manufacture of Traditional Cheeses in Algeria. Journal of Food Technology7: 20-29.
Oliveira, A.P., Baptista., P.Andrade. P. B., Martins, F. et Pereira, J. A. (2012): Characterization of Ficus carica L. cultivars by DNA and secondary metabolite analysis: Is genetic diversity reflected in the chemical composition. Food Research International. (49): 710-719.
Park, Y. W., Haenlein, G. F.W. (2013): Milk and Dairy Products in Human Nutrition. A John Wiley publication: 6-10.
Payne, T. (2009): Enzymes in Meat Systems Enzymes. Chapter 8. R. Tarte (ed.), Ingredients in Meat Products: Properties, Functionality and Applications: 26.