1
N° d’ordre 208-2014 Année 2014
Thèse présentée devant
L’UNIVERSITE CLAUDE BERNARD LYON 1 ECOLE DOCTORALE DE CHIMIE 206
Spécialité Chimie
soutenue publiquement le 24 Octobre 2014 pour l’obtention du DIPLOME DE DOCTORAT (arrêté du 7 août 2006) Par
Léa CHANCELIER
DEVELOPPEMENT
DE SOLUTIONS INNOVANTES D’ELECTROLYTES
POUR SECURISER
LES ACCUMULATEURS LITHIUM-ION
Directrice de thèse Dr Catherine C. SANTINI CNRS
Co-encadrants Dr Sophie MAILLEY CEA, LITEN
Dr Thibaut GUTEL CEA, LITEN
JURY
Pr Giovanni B. APPETECCHI ENEA, Rome, Italie Rapporteur Dr Corinne LAGROST Université de Rennes Rapporteur
Dr Cécile TESSIER SAFT, Bordeaux Examinateur
Pr Bruno ANDRIOLETTI Université de Lyon 1 Examinateur
3
UNIVERSITE CLAUDE BERNARD - LYON 1
Président de l’Université
Vice-président du Conseil d’Administration Vice-président du Conseil des Etudes et de la Vie Universitaire
Vice-président du Conseil Scientifique Directeur Général des Services
M. François-Noël GILLY
M. le Professeur Hamda BEN HADID M. le Professeur Philippe LALLE M. le Professeur Germain GILLET M. Alain HELLEU
COMPOSANTES SANTE
Faculté de Médecine Lyon Est – Claude Bernard Faculté de Médecine et de Maïeutique Lyon Sud – Charles Mérieux
Faculté d’Odontologie
Institut des Sciences Pharmaceutiques et Biologiques Institut des Sciences et Techniques de la Réadaptation Département de formation et Centre de Recherche en Biologie Humaine
Directeur: M. le Professeur J. ETIENNE Directeur: Mme la Professeure C. BURILLON
Directeur: M. le Professeur D. BOURGEOIS Directeur: Mme la Professeure C. VINCIGUERRA Directeur: M. le Professeur Y. MATILLON Directeur: M. le Professeur P. FARGE
COMPOSANTES ET DEPARTEMENTS DE SCIENCES ET TECHNOLOGIE
Faculté des Sciences et Technologies Département Biologie
Département Chimie Biochimie Département GEP
Département Informatique Département Mathématiques Département Mécanique Département Physique
Département Sciences de la Terre
UFR Sciences et Techniques des Activités Physiques et Sportives
Observatoire des Sciences de l’Univers de Lyon Polytech Lyon
Ecole Supérieure de Chimie Physique Electronique Institut Universitaire de Technologie de Lyon 1 Institut Universitaire de Formation des Maîtres Institut de Science Financière et d'Assurances
Directeur: M. le Professeur F. DE MARCHI Directeur: M. le Professeur F. FLEURY Directeur: Mme le Professeur H. PARROT Directeur: M. N. SIAUVE
Directeur: M. le Professeur S. AKKOUCHE Directeur: M. le Professeur A. GOLDMAN Directeur: M. le Professeur H. BEN HADID Directeur: Mme S. FLECK
Directeur: Mme la Professeure I. DANIEL Directeur: M. C. COLLIGNON Directeur: M. B. GUIDERDONI Directeur: M. P. FOURNIER Directeur: M. G. PIGNAULT Directeur: M. C. VITON Directeur: M. A. MOUGNIOTTE
5
Thèse préparée au sein de:
Laboratoire des Composants pour Batteries (LCB)
CEA, LITEN
(Laboratoire d’Innovation pour les Technologies des Energies Nouvelles) 17 rue des martyrs
38054 Grenoble France
et
Laboratoire de Chimie OrganoMétallique de Surface (LCOMS)
C2P2
(Chimie, Catalyse, Polymères et Procédés) UMR 5265 CNRS-Université Lyon 1-ESCPE
43 Bd du 11 Novembre 1918
69616 Villeurbanne
7
N'allez pas là où le chemin peut mener ;
Allez là où il n'y a pas de chemin et laissez une trace.
9
Acknowledgments
First I would like to thank Giovanni Appetecchi and Corinne Lagrost, who accepted to review this work, for their fruitful questions and remarks. Thank you for helping me to improve this manuscript. Thanks to Cécile Tessier, Guy Marlair and Bruno Andrioletti for their interest in this work, their presence to my defense, and the sincerely interesting discussion.
Merci à mes encadrants, grâce à qui je suis heureuse du travail accompli :
Catherine, merci de m’avoir poussée dans les bonnes directions scientifiques, d’avoir été à l’écoute professionnellement et humainement. Merci pour votre aide, votre patience, votre positivisme, votre confiance, et votre suivi.
Thibaut, merci pour ta compréhension, ta disponibilité, pour les discussions et conseils. Merci pour ton soutien et tes encouragements tout au long de la thèse.
Sophie, merci pour ton encadrement, la confiance et la liberté accordées.
Merci à Bernadette Charleux puis Timothy Mckenna pour m’avoir accueillie au sein du laboratoire C2P2. Merci à Sébastien Patoux et Marlène Rey pour leur accueil chaleureux au sein du LMB, LCB et SCGE.
Merci de m’avoir permis d’effectuer de l’enseignement durant ces trois ans, et merci de m’avoir offert l’opportunité de participer à des congrès, expériences ô combien enrichissantes.
Merci maintenant à tous les collègues qui sont devenus bien plus :
Tout d’abord, ceux avec qui j’ai commencé mais qui sont partis, plus ou moins loin:
Hassan, merci pour ton aide, ton efficacité et tes multiples réponses à mes multiples questions en synthèse. Merci pour les footings, les discussions, les délicieux repas et thés libanais. Merci pour le petit dej au Hilton et les selfies à Miami !
Inga, merci d’avoir tant couru et discuté avec moi. Merci pour ton écoute, ta culture, merci de m’avoir fait découvrir ton pays, le café Juliette, et pour ton art de faire de belles soirées! Laurent, merci pour les défoulements au squash, les découvertes de bonnes adresses et de m’avoir tant fait rire. Merci pour tes mails adorables même de si loin.
Ensuite, ceux qui ont toujours été là, que j’ai adoré savoir dans les parages:
Philippe, merci pour tes conseils “végétariens”, merci d’être absolument toujours prêt à aider. Merci pour les idées de balade jamais réalisées… et les autres sorties !
Anthony, merci pour les randos, les conseils sportifs, littéraires, cinématographiques... Merci pour les réservations de “notre table” pour les quiz du Bryans !
Walid, Cherif, merci d’avoir été toujours dispo pour un coup de main et pour discuter.
Sylwia, ma Sylwia… Merci ! Pour nos fous rires, nos discussions passionnées, notre perséverance, nos sorties… Thank you for awesome moments, for example with Hulk and megarich !
10
Enfin les collègues qui ont été suffisamment là pour que ça compte
♣ à Lyon:
Fred, merci pour une belle collaboration cruciverbiste, pour être parmi ceux qui se bougent au labo et hors labo, ce qui a créé de beaux souvenirs. Merci.
Teresa, merci pour ton soutien les jours moyens. Merci pour ta bonne humeur, ta réactivité, ton dynamisme, ton adorabilité… La motivation mutuelle fut splendide, même en Août… Je ne serai jamais bien loin !
Thibault, Ewelina, Phillip, Giuliana, Andreia, Walid, merci pour votre joie de vivre, pour les discussions plus ou moins sérieuses, votre enthousiasme pour sortir, pour l’ambiance multiculturelle que j’adore … Oui, vous méritez chacun plus que cette phrase, a lot more ! ! ! By the way, special thanks to our lovely Anoocoms team !
Merci à Nico pour les BBQ, David, Delphine, Fadila, Guilhem, Iuliia, Stéphane, Popoff, Henri, Leila… Merci aux stagiaires avec qui j’ai eu l’occasion de travailler : Piotr, Elodie et Cristina. Pierre et Arthur, merci pour la bonne ambiance pendant ma période dans l’open space. Merci Emmanuelle pour ton aide et ta disponibilité. Mos, Aimery, Emile, Laurent, Alessandra, et le reste de l’équipe, merci à tous pour l’ambiance richissime.
♣ Et à Grenoble:
Greg, merci pour tes conseils en salle anhydre, merci pour les coups de main successifs, merci pour ta bonne humeur, ton écoute, tes blagues, ta sincérité !
Djamel, merci pour ton aide, indispensable (Arbin, électrodes…). Merci pour ton humour et pour les sorties au top !
Kim, merci d’avoir simplifié toutes les complications administratives, avec le sourire ! Et, aussi, merci pour l’organisation des évènements non professionnels hyper sympas !
Merci Charles pour ton assistance régulière (informatique, technique, hébergement…). Merci Isabel (après t’avoir perdue de vue c’est vraiment génial de te retrouver pour discuter, nager, boire un verre…) ! Merci Adriana, Melody, Hanaa, JBé, Mathieu, Elise (pour les nombreuses requêtes sur mes électrodes), Céline, Aurélien, Justin, Vincent, Lise, Géraldine (et ta grand-mère). Merci à Sandra (l’inattendu) et Marco (hôtel Suisse et Bordeaux) pour avoir agrémenté de discussions sympas mes soirées à Grenoble en solo!
Cette thèse m’a permis de travailler avec beaucoup de personnes que je remercie vivement, et en particulier :
En XPS, merci Jean-Luc et Laurence pour votre courage avec mes électrodes. Merci Anass pour ta patience, ta gentillesse, ta pédagogie. En ATG, merci Olivier pour la formation, et la confiance accordée. En DRIFT-GC-MS, merci Kai pour ton aide, ta disponibilité. En RMN, merci Christine et Frédéric. En MS, merci Philippe et Johann pour l’aide avec le spectro, malgré les fuites… En GC-IR, merci Isabel.
Hamed, merci infiniment pour ton écoute, ta réactivité, ton enthousiasme. Ce fut un réel plaisir de m’investir dans l’enseignement sous ta tutelle. Arnaud, merci pour m’avoir formée de A à Z sur les TPs, merci pour ta patience et ton enthousiasme.
11
I would like also to thank the great people I met in congresses around the world, for their participation to my very very very good time there ! In particular I would like to name Claudiu (ECS), Mei (COIL and London or Berlin soon and for the proofreading mon chou !), Marco (IMLB), Edgard (ECS and Miami), Giuseppe (IMLB), Tomáš (IMLB), Andreas (XPS in Roscoff), Paul (COIL, Netherlands), Max (COIL), Jakub (IMLB), Sigelinde (XPS in Roscoff), Carmen (EUCHEM, COIL)… I really hope to keep in touch with you all !
Claire et Mélissa, merci d’avoir emménagé à Lyon, merci pour les sessions piscine, les longues discussions, profondes ou légères, et les conseils, ponctués de fous rires. Sur la vie, les mecs, les vernis, la piscine, les cheveux, la vie quoi… Merci Margaux, parce que je sais que je peux compter sur toi depuis … toujours ! Merci Camille et Kelly retrouvées ! Et merci Ebru …
Parce que 10 ans d’amitié, c’est beau, c’est bon, c’est drôle, c’est fort, c’est grand, c’est magique, c’est magnifique ! ! !
Merci Rom, Alex, Denis, Seb, Fred, Tomtom, Marina, Simon… Merci d’être toujours motivés pour que l’on reste en contact. Merci pour les sorties (ski, soutenances 2014… ne perdons pas le rythme !) et les discussions !
Merci Kevin, pour ton soutien, tes blagues, tes réflexions et tes textos philosophiques mûrement réfléchis, et merci pour la totale disponibilité de ton luxueux appart. Merci Juliette, Benji, Ben, Bastien, Brice, l’autre Brice, Camille, Sami, pour des soirées et des vacances au top !
Pierre, merci de m’avoir soutenue, voire poussée. Merci pour le succès international des animations powerpoint. Un immense merci pour tant d’autres choses.
Merci à la famille ! Merci au soutien de tous les oncles, tantes, cousines, cousins. De près, de loin, c’est tellement important de vous savoir à mes côtés ! Merci à mes Mamies pour leur force, leur générosité, leur écoute. Entre autres qualités.
Maman, Papa, merci pour votre écoute inlassable, votre soutien incommensurablement indéfectible, votre confiance inébranlable. Bro, merci pour tout. On parle moins mais ce n’en est pas moins fort…
Merci à toutes les personnes qui sont venues assister à ma soutenance, et à celles qui m’ont envoyé leurs encouragements. Merci à tous ceux et toutes celles que je ne citerai pas mais avec qui j’ai eu plaisir à passer ou repasser du temps, avec qui j’ai pu discuter, rire, danser, pleurer, courir, délirer, jouer, vivre...
Bref, merci à toutes les personnes qui ont contribué à créer de beaux moments. Merci à toutes les personnes qui m’ont aidée à me construire jusqu’ici, grâce à qui je me sens heureuse et épanouie, et merci par avance à tous ceux et celles qui feront que ça dure !
Table of contents
13
Abstracts
Summary in french
Introduction
Chapter 1 State of the art
General context Lithium-ion batteries Strategy of the work References
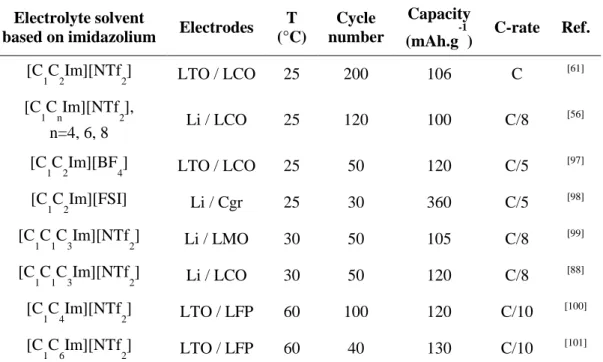
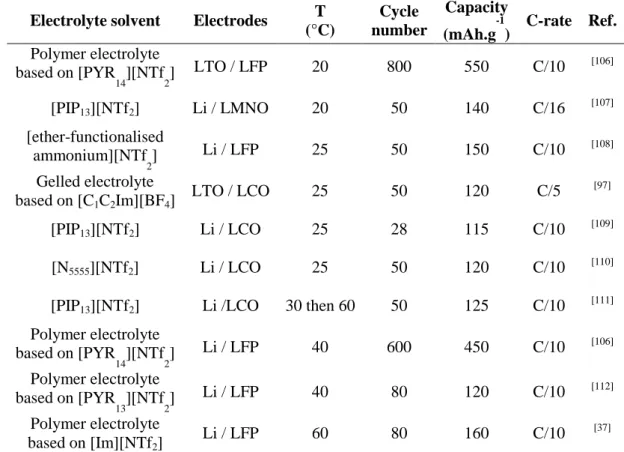
Chapter 2 Decomposition temperatures of ionic liquids
Introduction
General synthesis procedure Experimental parameters for TGA
Gathering of decomposition temperatures Stability trends
Conclusion
Experimental part References
Chapter 3 Thermal stability
Introduction
Decomposition temperatures Isothermal experiments
Maximum operating temperatures Effect of lithium salt concentration Effect of atmosphere
Thermal treatment of IL-based electrolytes Combustion behaviour
Thermal stability of electrodes
Conclusion
Experimental part References
Chapter 4 Electrochemical stability
Introduction
Electrochemical windows Cycling tests in coin cells Lithium diffusion coefficients Lithium insertion
Cycling tests in pouch cells Overcharge behaviour
Conclusion
Experimental part References
Conclusion and outlooks
Appendixes
15
19
31
37
40 41 55 5765
68 69 70 75 78 91 92 94101
104 104 106 110 112 115 117 124 128 132 133 135139
142 143 145 148 151 153 155 166 167 171175
183
15
Développement de solutions innovantes d’électrolytes
pour sécuriser les accumulateurs lithium-ion
Mots-clefs
batterie lithium-ion; électrolyte; sécurité; liquide ionique;
stabilités thermique et électrochimique; combustion; surcharge; cyclage
Résumé
Les batteries lithium-ion dominent le marché des appareils nomades et celui des véhicules électriques. Néanmoins elles posent des problèmes de sécurité liés à leur électrolyte, contenant des carbonates inflammables et volatils. Pour sécuriser ces systèmes, les liquides ioniques (LI) sont étudiés comme électrolytes alternatifs. Ce sont des sels liquides à température ambiante, réputés stables thermiquement et non inflammables. Ce caractère sécuritaire des LI, souvent avancé, est pourtant peu étayé par des expériences probantes. Les travaux de cette thèse visent à comprendre le comportement de ces LI en situations abusives, telles qu’un échauffement de la batterie, un feu ou une surcharge. Les températures de décomposition de LI contenant les cations imidazolium ou pyrrolidinium différemment substitués et l’anion bis(trifluoromethanesulfonyl)imide ont été déterminées par analyse thermogravimétrique (ATG). Une analyse critique des données (de la littérature et de nos mesures) a permis de définir une procédure optimisée, pour obtenir des résultats reproductibles et comparables. Des électrolytes constitués de mélanges de carbonates ou de LI et de sels de lithium ont été analysés par ATG dynamique et isotherme, et leurs produits de décomposition ont été identifiés. Leur comportement au feu a été testé par la mesure des chaleurs de combustion, des délais d’inflammation et l’identification des gaz générés. Des tests de cyclage électrochimique ont été menés avec ces mêmes électrolytes dans des systèmes lithium-ion constitués des électrodes Li4Ti5O12 et LiNi1/3Mn1/3Co1/3O2. L’évolution des électrolytes et des surfaces des électrodes en situation de surcharge a été examinée.
17
Development of innovative electrolytes
for safer lithium-ion batteries
Keywords
lithium-ion; battery; electrolyte; safety; ionic liquid;
thermal and electrochemical stabilities; combustion; overcharge; cycling
Abstract
Lithium-ion batteries are dominating both the nomad device and electric vehicle markets. However they raise safety concerns related to their electrolyte, which consists of flammable and volatile carbonate mixtures and toxic salts. The replacement of the latter by ionic liquids (IL), liquid salts claimed to be thermally stable and non-flammable, could provide a safer alternative. Yet this often claimed feature has been poorly examined by experiments. The work of this thesis investigates IL behaviour under abuse conditions such as overheating, fire or overcharge. Decomposition temperatures of IL based on differently substituted imidazolium or pyrrolidinium cations and the bis(trifluoromethanesulfonyl)imide anion were determined by thermogravimetric analysis (TGA). A critical study of gathered data (from literature and our work) led to the determination of an optimised procedure to obtain reproducible and comparable results. Electrolytes based on carbonates mixtures or IL and containing lithium salt were studied by dynamic and isothermal TGA, and their decomposition products were identified. Their combustion behaviour was also tested by measuring heats of combustion and ignition delays. Emitted gases were analysed and quantified. Electrochemical cycling tests were carried out with these electrolytes in lithium-ion systems based on Li4Ti5O12 and LiNi1/3Mn1/3Co1/3O2 electrodes. The evolution of the electrolytes and electrodes surface was also examined under overcharge.
RÉSUMÉ SUBSTANTIEL
EN FRANÇAIS
French summary 21
1. Introduction générale
Le stockage de l’énergie est au cœur des enjeux de notre société, notamment avec l’essor des énergies renouvelables et des véhicules électriques. Du fait de leurs performances, les batteries de technologie lithium-ion sont actuellement les plus utilisées, notamment pour les appareils nomades (63% du marché mondial). Si leur dangerosité reste limitée pour des appareils de petite taille, elles peuvent poser des problèmes de sécurité pour des applications telles que les véhicules électriques. Ces accumulateurs doivent en effet pouvoir résister à des situations de surchauffe, surcharge, surdécharge, court-circuit ou choc.
Les batteries lithium-ion stockent de l’électricité par insertions-désinsertions successives des ions lithium dans chaque matériau d’électrode. L’électrode positive est généralement un oxyde métallique à base de métaux de transition tels que le cobalt, le fer, le nickel ou le manganèse. L’électrode négative est constituée de graphite. Ces deux électrodes sont séparées par un isolant électronique, imbibé d’une solution conductrice ionique, appelée électrolyte. Pendant l’utilisation (décharge), les ions Li+
s’insèrent dans l’électrode positive, générant un flux d’électrons dans le circuit extérieur, qui alimente l’appareil connecté, Figure 1.[1] Lors de la recharge, un courant est imposé pour forcer la migration des ions Li+ vers l’électrode négative. L’alternance de charges et décharges est appelée cyclage électrochimique.
Figure 1: De gauche à droite, Schéma d’une batterie en décharge, carbonate d’éthylène (EC), carbonate de diéthyle (DEC) et hexafluorophosphate de lithium (LiPF6)
L’électrolyte est constitué de mélanges de carbonates, Figure 1, qui solubilisent bien le sel de lithium et fournissent de bonnes performances électrochimiques. Dans notre cas l’électrolyte utilisé, noté [EC:DEC][LiPF6], est un mélange équi-volumique de EC et DEC contenant 1 mol.L-1 de LiPF6. Cependant ces liquides volatils et inflammables peuvent mener à des problèmes de sécurité (incendie, explosion…). De plus le sel LiPF6 mène à la formation de composés toxiques comme l’acide fluorhydrique (HF). Pour les remplacer, certains sels fondus appelés liquides ioniques (LI) (sels fréquemment liquides à température ambiante)
French summary 22
sont des candidats potentiels, pouvant présenter de bonnes performances.[2-5] Ils sont composés d’un cation souvent issu d’une amine et d’un anion généralement fluoré, et présentent une bonne conductivité ionique. Les LI sont liquides sur une large gamme de température,[6] dont la limite supérieure est leur température de décomposition (et non leur ébullition) généralement assez élevée. De plus, ils possèdent une pression de vapeur saturante négligeable, ce qui leur confère une faible inflammabilité[7] et les rend plus sécuritaires.
Cet aspect de sureté des LI est un argument souvent avancé,[8] mais peu étayé par des expériences probantes. Les travaux menés dans le cadre de cette thèse visent à comprendre le comportement des LI lorsqu’ils sont soumis à des conditions dites abusives, telles qu’un échauffement de la cellule, un feu, une surcharge etc.
2. Stabilité thermique des électrolytes
Parmi les plus utilisés, les cations imidazolium et pyrrolidinium combinés à l’anion fluoré bis(trifluoromethanesulfonyl)imide [NTf2] ont été sélectionnés, Figure 2. Les électrolytes correspondants, contenant 1 mol.L-1 de sel de lithium LiNTf2, seront notés [cation][Li][NTf2]. Ces LI, dont la synthèse et la purification sont maitrisées, présentent une haute stabilité thermique et des propriétés physicochimiques adaptées à leur utilisation en batteries (viscosité, conductivité).
Figure 2: de gauche à droite, les cations 1-butyl-3-methylimidazolium [C1C4Im],
N-butyl-N-methylpyrrolidinium [PYR14], et l’anion [NTf2]
La détermination de la température de décomposition (Td) par Analyse ThermoGravimétrique
(ATG) est couramment utilisée pour définir la stabilité thermique des LI. Il s’agit de suivre la décomposition de l’échantillon (révélée par une perte de masse) pendant une montée en température dans des conditions contrôlées (atmosphère, rampe de chauffe). Suivant les
paramètres expérimentaux utilisés, les valeurs de Td pour un même produit varient de plus de
100 °C. Une analyse critique des données de la littérature et de nos résultats nous a menés à définir une procédure optimisée, permettant d’obtenir des résultats reproductibles et comparables. Ces électrolytes ont des températures de décomposition supérieures de plus de 200 °C à celle des carbonates, Figure 3.
French summary 23 Figure 3: Profils de stabilité thermique établis par ATG entre 30 et 500 °C pour
[C1C4Im][Li][NTf2] (Td: 357 °C), [PYR14][Li][NTf2] (Td: 339 °C), [C1C1C4Im][Li][NTf2] (Td: 339 °C)
and [EC:DEC][LiPF6] (Td: 50 °C). Echantillons de 10 mg; vitesse de chauffe de 5 °C.min -1
sous argon; creusets en aluminium scellés
Néanmoins l’ATG ne permet pas d’identifier les produits de décomposition. Les deux électrolytes [C1C4Im][Li][NTf2] et [PYR14][Li][NTf2] ont été traités sous vide deux heures à 350 °C et analysés. Pour les deux solutions, des hydrocarbures gazeux inflammables (typiquement des butènes) issus de l’élimination des chaines alkyles cationiques ont été identifiés par spectrométrie de masse, résonance magnétique nucléaire et chromatographie en phase gazeuse, Figure 4. La décomposition de l’anion, contenant du fluor et du soufre, a mené à la formation d’espèces toxiques telles que de l’acide fluorhydrique et le dioxyde de soufre.[9]
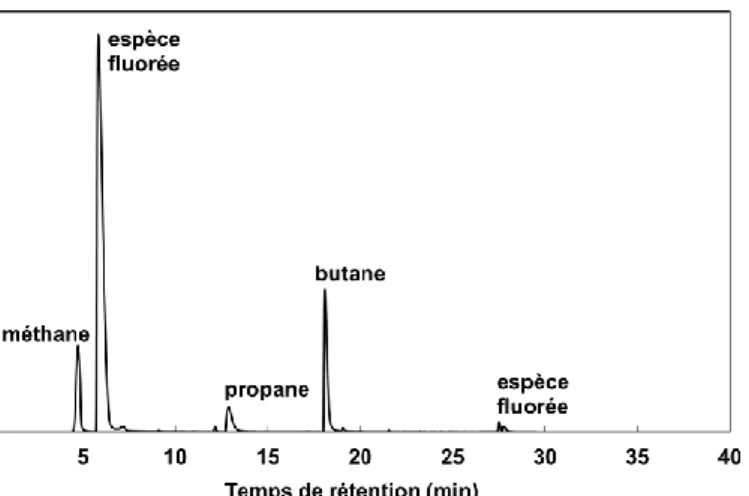
Figure 4: Analyse par chromatographie en phase gaz des constituants de la phase gaz issue de la décomposition thermique des électrolytes (temps de rétention des butènes: 5.85 min)
100 200 300 400 500 0 20 40 60 80 100 Ma s s e (% ) Température (°C) [C1C4Im][Li][NTf2] [PYR 14][Li][NTf2] [C1C1C4Im][Li][NTf2] [EC:DEC][LiPF6] Td < 100 °C > 330 °C 0 1 2 3 4 5 6 7 8 9 10 2,14 7,64 1,31 Int ensité
Temps de rétention (min)
[C 1C4Im][Li][NTf2] [PYR14][Li][NTf2] 1,77 3,70 5,70 5,85 6,01 7,48 7,96
French summary 24
3. Comportement en combustion des électrolytes
Le comportement au feu de ces électrolytes a été également testé. Les chaleurs de combustion et les délais d’inflammation de chaque électrolyte ont été déterminés par calorimétrie incendie (norme ISO:12136), confirmant que ces LI ont une faible inflammabilité, en particulier celui basé sur l’imidazolium. Le délai d’inflammation est d’environ cinq minutes pour les électrolytes basés sur les LI, alors qu’il est de trente secondes pour les carbonates, Tableau 2. Une fois leur combustion amorcée, les électrolytes à base de LI dégagent presque deux fois moins de chaleur (~ 8 vs 14 MJ.kg-1) que les carbonates. A titre de comparaison, la chaleur de combustion du bois est de 15 MJ.kg-1.
[C1C4Im][Li][NTf2] [PYR14][Li][NTf2] Carbonates [10]
Délai d’inflammation (min) 5 5.5 0.5
Chaleur de combustion (MJ.kg-1) 7.7 8.2 14
Tableau 1: Comportement au feu des différents électrolytes
Afin d’établir la toxicité en cas de feu, les produits asphyxiants (HCN, CO) ou irritants (NOx,
SO2, et HF) émis lors de la combustion ont été quantifiés. Les espèces émises sont les même
pour les électrolytes [C1C4Im][Li][NTf2] et [PYR14][Li][NTf2], avec une émission de gaz toxiques provenant de la décomposition de l’anion NTf2. La décomposition des cations produit des espèces inflammables.
Facteurs d’émission
(mg.g-1) [C1C4Im][Li][NTf2] [PYR14][Li][NTf2]
CO2 552 531 CO 21.6 25.1 Suies 11 37.7 Hydrocarbures 4.8 0.6 SO2 353 317 NO 4.9 3.0 HF 294.8 216.6 HCN 6.9 8.3
Tableau 2: Facteurs d’émission de différents gaz formés pendant la combustion des électrolytes [C1C4Im][Li][NTf2] et [PYR14][Li][NTf2]
French summary 25
4. Caractérisations electrochimiques
Les électrolytes [EC:DEC][LiPF6], [C1C4Im][Li][NTf2], [PYR14][Li][NTf2] et
[C1C1C4Im][Li][NTf2] ont été utilisés en tant qu’électrolytes dans des batteries (de formats pile bouton et sachet souple) avec Li4Ti5O12 (LTO) et LiNi1/3Co1/3Mn1/3O2 (NMC) en tant que matériaux d’électrodes négative et positive. Les cyclages galvanostatiques ont été effectués à 25 et 60 °C, à un régime de C/10 (charges et décharges en 10 h), Figure 5.
Figure 5: Performances en cyclage des quatre électrolytes à 25 °C (gauche) et 60 °C (droite); 5 cycles à C/20 suivis de 95 cycles à C/10 entre 1 et 3.5 V
A 25 °C, les cellules démontrent un cyclage réversible et très stable. L’électrolyte
[EC:DEC][LiPF6] donne la plus haute capacité (181 mAh.g-1) comparée à celle de
[C1C4Im][Li][NTf2] (110 mAh.g-1) et de [PYR14][Li][NTf2] (33 mAh.g-1).
[C1C1C4Im][Li][NTf2] n’a pas permis de cycler les cellules. A 60 °C, les capacités initiales sont plus élevées qu’à 25 °C, probablement grâce à une diminution de la viscosité. Cependant les performances chutent de façon continue pour chaque électrolyte. En particulier après environ 60 cycles, une diminution brutale est observée pour les électrolytes [C1C4Im][Li][NTf2] et [EC:DEC][LiPF6].
Les performances des cellules contenant des liquides ioniques sont inférieures à celles des carbonates pour les deux températures et peuvent être attribuées à la viscosité plus élevée des liquides ioniques. Pour vérifier ceci, les cinétiques de diffusion des ions lithium au sein des électrodes et de l’électrolyte ont été étudiées par voltammétrie cyclique et par RMN en phase liquide. La diffusion du lithium s’est avérée dix fois plus rapide au sein des carbonates que dans les LI, Tableau 3. Pour tous les électrolytes, la diffusion dans la phase liquide s’est révélée 10 000 fois plus rapide que dans l’électrode.
0 20 40 60 80 100 0 50 100 150 200 [EC:DEC][LiPF6] [C1C4Im][Li][NTf2] [PYR14][Li][NTf2] [C1C1C4Im][Li][NTf2] C a p a c ité d é c h a rg é e ( m A h .g -1) Numéro de cycle 0 20 40 60 80 100 0 50 100 150 200 [EC:DEC][LiPF6] [C1C4Im][Li][NTf2] [PYR14][Li][NTf2] [C1C1C4Im][Li][NTf2] C a p a c ité d é c h a rg é e ( m A h .g -1) Numéro de cycle
French summary 26 [EC:DEC][LiPF6] [C1C4Im][Li][NTf2] [C1C1C4Im][Li][NTf2] [PYR14][Li][NTf2]
DLi par VC 3.53.10 -10 2.68.10-11 1.40.10-11 1.60.10-12 DLi par RMN 3.08.10 -6 1.69.10-7 2.24.10-7 1.44.10-7
Tableau 3: Coefficients de diffusion de Li+ (cm².s-1) déterminés à 60 °C, dans les électrodes par voltammétrie cyclique (VC) et en solution par RMN du 7Li
Cependant, ces résultats montrant de meilleures performances des carbonates à 60 °C diffèrent de la littérature. Généralement les liquides ioniques sont plus performants que les carbonates à haute température, ces derniers n’étant pas stables thermiquement.[9, 11-13] D’autre part, [PYR14][Li][NTf2] s’est révélé moins performant que [C1C4Im][Li][NTf2] alors qu’il fournit de plus hautes capacités en demi-piles Li // graphite.[14] Enfin, l’électrolyte [C1C1C4Im][Li][NTf2] n’a pas permis de cycler les batteries basées sur LTO // NMC (capacité de décharge nulle après 10 cycles) alors qu’il donne de meilleures performances dans le cas de batteries graphite // LiFePO4.[15] Ces résultats laissent penser que l’électrode positive NMC joue un rôle déstabilisant. Pour vérifier cette hypothèse des tests ont été menés par voltammétrie cyclique (VC) pour analyser les mécanismes d’insertion du lithium dans les électrodes.
Figure 6: Comparaison des seconds cycles par VC des quatre électrolytes à 60°C dans des cellules LTO // NMC
Les processus d’insertion et de désinsertion du lithium sont observés pour tous les électrolytes étudiés, Figure 6. Les intensités de courant sont plus faibles dans le cas des liquides ioniques que pour [EC:DEC][LiPF6], donnant lieu à un aplatissement des pics. Le décalage entre le potentiel d’insertion et de désinsertion est plus important dans le cas des LI (~ 0.45 V contre 0.14 V). De plus, les pics sont élargis dans le cas des LI, ce qui permet de visualiser plusieurs processus d’oxydation et de réduction des métaux de l’électrode positive. D’après la
1,0 1,5 2,0 2,5 3,0 -1,5 -1,0 -0,5 0,0 0,5 1,0 1,5 D e n s ité d e c o u ra n t (m A .c m -2) Tension (V) [EC:DEC][LiPF6] [C1C4Im][Li][NTf2] [C1C1C4Im][Li][NTf2] [PYR14][Li][NTf2]
French summary 27
littérature le manganèse ne joue pas de rôle dans ces procédés et les réactions redox se font dans l’ordre Ni2+
/Ni3+, Ni3+/Ni4+ puis Co3+/Co4+.[16, 17] Il est possible que la présence d’ions métalliques au degré d’oxydation (+II) mène à la formation d’agrégats de type [M(NTf2)n] x-(M = Ni, Co ou Mn), qui favoriserait la dissolution de la matière active et donc diminuerait la capacité disponible lors du cyclage.[18]
5. Analyses en surcharge
Des cellules en sachets souples LTO // NMC de plus grande capacité (~10 mAh) ont été assemblées avec les électrolytes [EC:DEC][LiPF6], [C1C4Im][Li][NTf2] et [PYR14][Li][NTf2] afin d’identifier les espèces volatiles formées lors de la décomposition des électrolytes
pendant une surcharge. Une charge jusqu’à 4.5 V a été appliquée (6 V vs Li+/Li) à un régime
de charge de C/10, et cette tension a été maintenue pendant 20 h à 60 °C. Pendant la phase à tension constante, le courant utilisé pour maintenir cette tension était plus important dans le cas de [C1C4Im][Li][NTf2] (0.4 vs 0.1 mA, Tableau 4), révélant une moins bonne stabilité de cet électrolyte dans ces conditions. Cela a été confirmé par les mesures des volumes des
cellules, qui ont augmenté de 2.81 mL pour [C1C4Im][Li][NTf2], de 0.30 mL pour
[EC:DEC][LiPF6], et de 0.12 mL pour [PYR14][Li][NTf2].
Courant de fuite (mA) Augmentation de volume (mL) [EC:DEC][LiPF6] 0.13 0.30 [C1C4Im][Li][NTf2] 0.40 2.81 [PYR14][Li][NTf2] 0.05 0.12
Tableau 4: Courants de fuite et augmentations de volume des cellules à la fin de la surcharge
Pour comprendre cette instabilité du liquide ionique contenant le cation imidazolium, les gaz générés dans le sachet souple ont été analysés par chromatographie en phase gaz couplée avec un spectromètre infrarouge (GC-IR). Les gaz formés étaient notamment du dioxyde de carbone, des fragments issus de l’anion et des alcanes issus du cation, Figure 7. Ces produits sont donc différents de ceux observés lors de la décomposition thermique de cet électrolyte.
French summary 28 Figure 7: Chromatogramme des gaz générés dans la cellule contenant l’électrolyte
[C1C4Im][Li][NTf2] après une surcharge à 60 °C
Des analyses de diffraction des rayons X et microscopie électronique ont été réalisées sur les électrodes, après leur utilisation en cellules surchargées. La morphologie des deux électrodes n’a pas été modifiée, et la structure de LTO est stable. Pour la NMC, la structure cristallographique a évolué vers une phase délithiée, Figure 8.
Figure 8: Diffractogrammes (DRX) des électrodes négatives (LTO, gauche) et positive (NMC, droite) avant utilisation et après surcharge; #: dome en polymère utilisé pour garder l’échantillon sous
atmosphere inerte; *: collecteur de courant en aluminium
Une étude détaillée des électrodes après surcharge par Spectroscopie des Photoélectrons X (XPS) a démontré que les surfaces des électrodes étaient masquées. Elles étaient recouvertes de liquide ionique dans le cas de la positive, et de ses produits de décomposition dans le cas de l’électrode négative. 10 20 30 40 50 60 70 u .a . 2 (1 1 1 ) # (2 2 0 ) (3 1 1 ) (4 0 0 ) (2 2 2 ) (3 3 1 ) (3 3 3 ) (4 4 0 ) * (5 3 1 )
LTO originel (bas) LTO après surcharge (haut)
10 20 30 40 50 60 70 # u .a . 2 (°) * (0 0 3 ) (1 0 1 ) (0 0 6 ) (1 0 2 ) (10 4 ) (1 0 5 ) (1 0 7 ) (1 1 0 ) (1 0 8 ) (1 1 3 ) NMC originel (bas) NMC après surcharge (haut)
French summary 29
6. Conclusion
Les électrolytes formés par dissolution de 1 mol.L-1 de LiNTf2 au sein de [C1C4Im][NTf2] et
[PYR14][NTf2] présentent une grande stabilité thermique comparés aux carbonates
[EC:DEC][LiPF6], avec des températures de décomposition supérieures à 300 °C. Les
produits dérivés de l’imidazolium sont plus stables thermiquement que les pyrrolidinium. Ces deux LI sont des espèces très peu combustibles, avec des délais d’inflammation supérieurs à cinq minutes (augmentés d’un facteur 10 par rapport aux électrolytes classiques). La formation de gaz toxiques ou inflammables lors de la combustion est néanmoins à prendre en compte selon les applications visées.
En ce qui concerne les performances électrochimiques, l’utilisation de carbonates conduit à de meilleures capacités, y compris à 60 °C. La meilleure stabilité électrochimique dans les
batteries LTO // NMC est observée pour [EC:DEC][LiPF6], suivi de [PYR14][Li][NTf2] puis
[C1C4Im][Li][NTf2], ce qui est un ordre inverse à celui de la stabilité thermique. En situation de surcharge, l’électrolyte [C1C4Im][Li][NTf2] s’est révélé le moins stable, générant 10 fois plus de gaz que [EC:DEC][LiPF6] et [PYR14][Li][NTf2].
French summary 30
7. Références
[1] J. M. Tarascon, "Vers des accumulateurs plus performants", L'actualité Chimique, 2002, 3(251), p130
[2] A. Lewandowski and A. Swiderska-Mocek, "Ionic liquids as electrolytes for Li-ion batteries-An
overview of electrochemical studies", J. Power Sources, 2009, 194(2), p601
[3] M. Armand, F. Endres, D. R. MacFarlane, H. Ohno and B. Scrosati, "Ionic-liquid materials for the
electrochemical challenges of the future", Nat. Mater., 2009, 8(8), p621
[4] D. R. MacFarlane, N. Tachikawa, M. Forsyth, J. M. Pringle, P. C. Howlett, G. D. Elliott, J. H. Davis, M. Watanabe, P. Simon and C. A. Angell, "Energy applications of ionic liquids", Energy Environ. Sci.,
2014, 7(1), p232
[5] A. Balducci, S. S. Jeong, G. T. Kim, S. Passerini, M. Winter, M. Schmuck, G. B. Appetecchi, R. Marcilla, D. Mecerreyes, V. Barsukov, V. Khomenko, I. Cantero, I. De Meatza, M. Holzapfel and N. Tran, "Development of safe, green and high performance ionic liquids-based batteries (ILLIBATT
project)", J. Power Sources, 2011, 196(22), p9719
[6] H. Ohno, Electrochemical aspects of ionic liquid, 2nd ed., Wiley, N. Y., 2011
[7] A. O. Diallo, C. Len, A. B. Morgan and G. Marlair, "Revisiting physico-chemical hazards of ionic
liquids", Sep. Purif. Technol., 2012, 97, p228
[8] M. Galinski, A. Lewandowski and I. Stepniak, "Ionic liquids as electrolytes", Electrochim. Acta, 2006, 51(26), p5567
[9] L. Chancelier, A. O. Diallo, C. C. Santini, G. Marlair, T. Gutel, S. Mailley and C. Len, "Targeting
adequate thermal stability and fire safety in selecting ionic liquid-based electrolytes for energy storage", Phys. Chem. Chem. Phys., 2014, 16(5), p1967
[10] G. G. Eshetu, S. Grugeon, S. Laruelle, S. Boyanov, A. Lecocq, J. P. Bertrand and G. Marlair, "In-depth
safety-focused analysis of solvents used in electrolytes for large scale lithium ion batteries", Phys. Chem. Chem. Phys., 2013, 15(23), p9145
[11] S. Menne, R. S. Kühnel and A. Balducci, "The influence of the electrochemical and thermal stability of
mixtures of ionic liquid and organic carbonate on the performance of high power lithium-ion batteries", Electrochim. Acta, 2013, 90, p641
[12] J. Li, S. Jeong, R. Kloepsch, M. Winter and S. Passerini, "Improved electrochemical performance of
LiMO2 (M=Mn, Ni, Co)-Li2MnO3 cathode materials in ionic liquid-based electrolyte", J. Power Sources, 2013, 239(0), p490
[13] N. Wongittharom, T.-C. Lee, C.-H. Hsu, G. Ting-Kuo Fey, K.-P. Huang and J.-K. Chang,
"Electrochemical performance of rechargeable Li/LiFePO4 cells with ionic liquid electrolyte: Effects of Li salt at 25 °C and 50 °C", J. Power Sources, 2013, 240, p676
[14] A. Guerfi, S. Duchesne, Y. Kobayashi, A. Vijh and K. Zaghib, "LiFePO4 and graphite electrodes with
ionic liquids based on bis(fluorosulfonyl)imide (FSI)(-) for Li-ion batteries", J. Power Sources, 2008,
175(2), p866
[15] H. Srour, "Développement d'un électrolyte à base de liquide ionique pour accumulateur au Lithium", Thesis from Université Claude Bernard Lyon 1 (Lyon), 2013
[16] K. M. Shaju, G. V. S. Rao and B. V. R. Chowdari, "Performance of layered Li(Ni1/3Co1/3Mn1/3)O-2
as cathode for Li-ion batteries", Electrochim. Acta, 2002, 48(2), p145
[17] A. Deb, U. Bergmann, S. P. Cramer and E. J. Cairns, "In situ x-ray absorption spectroscopic study of
the Li[Ni1/3Co1/3Mn1/3]O2 cathode material", J. Appl. Phys., 2005, 97(11), p113523
[18] H. Zheng, Q. Sun, G. Liu, X. Song and V. S. Battaglia, "Correlation between dissolution behavior and
electrochemical cycling performance for LiNi1/3Co1/3Mn1/3O2-based cells", J. Power Sources, 2012,
GENERAL
General introduction 33
Both the nomad device and electric vehicle markets are growing, requiring a fast development of energy storage systems (ESS). These systems must be capable of addressing a number of technical challenges for the sustainable development of electromobility (terrestrial, maritime and aerial to some extent). They should efficiently store intermittent renewable sources of energy (wind, solar, water) and be part of smart grids applications.[1] ESS previously had to rely on lead-acid, nickel cadmium and nickel metal hydride technologies. Commercialized since the 90s for the consumer market, lithium-ion (Li-ion) technology and its variants have taken the lead regarding those emerging applications, as they offer significantly higher power and energy densities (up to 2 000 W.kg-1 and 120 Wh.kg-1).[2]
However safety has been identified in a number of studies as a potential market restraint.[3, 4] In the aim of improving the safety of these systems, all components of the cell have to be considered. Major improvements were already made in the domains of battery management systems, cell designs and separators. The electrodes were also developed in order to provide safer batteries, as for the negative one, metallic lithium can be replaced by graphite (Cgr) or a metallic oxide such as Li4Ti5O12 (LTO). These electrodes could reduce the risk of shortcircuit due to the growth of lithium dendrites on the surface.[5, 6] In the case of the positive electrode material, the state of the art Li-ion batteries use mostly LiCoO2 (LCO), but this oxide has a low thermal stability. Mixed metallic oxides were widely examined with varying compositions of cobalt, manganese, nickel and aluminium metals. In particular LiNi1/3Mn1/3Co1/3O2 (NMC) showed good cycling stability and rate capability, higher thermal stability in the charged state, lower cost and reduced toxicity.[7, 8]
The electrolyte is commonly a mixture of organic solvents such as propylene carbonate (PC), ethylene carbonate (EC), dimethyl carbonate (DMC) or diethyl carbonate (DEC), containing a dissolved inorganic lithium salt, typically lithium hexafluorophosphate (LiPF6). These solvents are very flammable, possess low flash points and are highly volatile.[9] Their decomposition under moderate thermal stress can lead fast to thermal runaway of the cell, which can cause the electrolyte ignition or even explosion.
General introduction 34
In order to solve these safety issues, other types of electrolytes are studied, in particular ionic liquids (IL), widely considered both in literature[10-12] and in industrial projects.[13-15] IL are defined as salts liquid below 100 °C and result from the association of an organic cation with an organic or inorganic anion. Consequently, they can be designed for a chosen application by tuning the nature of the anion or/and of the cation. IL exhibit negligible vapour pressure, similar to solid salts, and unlike most organic solvents, they do not vaporize unless heated to the point of thermal decomposition, typically 200 °C to 300 °C.[16] They have flash points higher than 200 °C[17] and are considered as non-flammable.[18, 19]
Contrarily to the current carbonate-based electrolytes,[20] thermal stability of IL for use as electrolytes in case of abuse conditions (fire, shortcircuit, impact, overcharge or overdischarge) has been poorly examined by experiments.[19] In the vast domain of IL, imidazolium and pyrrolidinium cations associated to [NTf2] anion were selected for their high decomposition temperatures.[21, 22]
The aim of this thesis is to investigate thermal stability up to combustion and electrochemical behaviour up to overcharge of these IL and their corresponding electrolytes (defined as solution of lithium salt in IL) for Li-ion cells. The possible routes of degradation of IL and electrolytes during thermal and electrochemical abuse tests will be investigated under different experimental conditions. In the first chapter, the state of the art of lithium-ion batteries will be described. The choice of positive and negative electrodes and electrolytes will be discussed and the objectives of the work will be described.
In the second chapter, the thermal stability of selected IL will be evaluated. A critical study of gathered data (from literature and our work) will lead to the determination of an optimised procedure to obtain reproducible and comparable results. The stability of imidazolium IL associated to bis(trifluoromethanesulfonyl)imide anion NTf2 will be investigated according to several modifications of the alkyl chains.
General introduction 35
The third chapter will focus on the thermal stability of the cell components by different techniques. Decomposition temperatures will be determined by TGA technique. Combustion behaviours will be investigated by measuring heats of combustion, ignition delays and analysing emitted gases.
The fourth chapter will be devoted to the study of full Li-ion cells constituted of Li4Ti5O12 and LiNi1/3Mn1/3Co1/3O2 electrodes using electrochemical techniques. The stability of the systems will be studied under cycling and overcharge. The evolution of the system will be analysed by volume measurements and surface techniques such as SEM, XRD or XPS.
Finally conclusions of this work will be presented, and some perspectives will be given for future work.
General introduction 36
References
[1] C. J. Barnhart and S. M. Benson, "On the importance of reducing the energetic and material demands
of electrical energy storage", Energy Environ. Sci., 2013, 6(4), p1083
[2] "History of battery invention and development", http://blog.genport.it/?p=133, accessed August 2014
[3] R. S. Kühnel, N. Böckenfeld, S. Passerini, M. Winter and A. Balducci, "Mixtures of ionic liquid and
organic carbonate as electrolyte with improved safety and performance for rechargeable lithium batteries", Electrochim. Acta, 2011, 56(11), p4092
[4] "World Hybrid Electric and Electric Vehicle Lithium-ion Battery Market", 2009, report from in Frost &
Sullivan, http://www.frost.com (accessed September 24, 2013)
[5] X.-W. Zhang, Y. Li, S. A. Khan and P. S. Fedkiw, "Inhibition of Lithium Dendrites by Fumed
Silica-Based Composite Electrolytes", J. Electrochem. Soc., 2004, 151(8), pA1257
[6] C. Brissot, M. Rosso, J. N. Chazalviel and S. Lascaud, "Dendritic growth mechanisms in
lithium/polymer cells", J. Power Sources, 1999, 81, p925
[7] A. Deb, U. Bergmann, S. P. Cramer and E. J. Cairns, "In situ x-ray absorption spectroscopic study of
the Li[Ni1/3Co1/3Mn1/3]O2 cathode material", J. Appl. Phys., 2005, 97(11), p113523
[8] H. Zheng, Q. Sun, G. Liu, X. Song and V. S. Battaglia, "Correlation between dissolution behavior and
electrochemical cycling performance for LiNi1/3Co1/3Mn1/3O2-based cells", J. Power Sources, 2012,
207(0), p134
[9] G. G. Eshetu, S. Grugeon, S. Laruelle, S. Boyanov, A. Lecocq, J. P. Bertrand and G. Marlair, "In-depth
safety-focused analysis of solvents used in electrolytes for large scale lithium ion batteries", Phys. Chem. Chem. Phys., 2013, 15(23), p9145
[10] D. R. MacFarlane, N. Tachikawa, M. Forsyth, J. M. Pringle, P. C. Howlett, G. D. Elliott, J. H. Davis, M. Watanabe, P. Simon and C. A. Angell, "Energy applications of ionic liquids", Energy Environ. Sci.,
2014, 7(1), p232
[11] B. Scrosati and J. Garche, "Lithium batteries: Status, prospects and future", J. Power Sources, 2010, 195(9), p2419
[12] M. Armand, F. Endres, D. R. MacFarlane, H. Ohno and B. Scrosati, "Ionic-liquid materials for the
electrochemical challenges of the future", Nat. Mater., 2009, 8(8), p621
[13] Z. Zheng, B. Gu, H. Wang, L. Ke and Y. Nie, "Lithium ion secondary battery including ionic liquid
electrolyte", Microvast New Materials patent, China, US 2013/0029232 A1, 2013
[14] A. Balducci, S. S. Jeong, G. T. Kim, S. Passerini, M. Winter, M. Schmuck, G. B. Appetecchi, R. Marcilla, D. Mecerreyes, V. Barsukov, V. Khomenko, I. Cantero, I. De Meatza, M. Holzapfel and N. Tran, "Development of safe, green and high performance ionic liquids-based batteries (ILLIBATT
project)", J. Power Sources, 2011, 196(22), p9719
[15] C. Siret, L. Caratero and P. Biensan, "Lithium-ion battery containing an electrolyte that comprises an
ionic liquid", SAFT patent, France, WO 2009/007540, 2009
[16] P. Wasserscheid and T. Welton, Ionic liquids in synthesis, 2nd Ed., Wiley-VCH, Weinheim, 2008
[17] D. M. Fox, J. W. Gilman, A. B. Morgan, J. R. Shields, P. H. Maupin, R. E. Lyon, H. C. De Long and P. C. Trulove, "Flammability and thermal analysis characterization of imidazolium-based ionic liquids",
Ind. Eng. Chem. Res., 2008, 47(16), p6327
[18] A. O. Diallo, C. Len, A. B. Morgan and G. Marlair, "Revisiting physico-chemical hazards of ionic
liquids", Sep. Purif. Technol., 2012, 97, p228
[19] C. S. Stefan, D. Lemordant, P. Biensan, C. Siret and B. Claude-Montigny, "Thermal stability and
crystallization of N-alkyl-N-alkyl'-pyrrolidinium imides", J. Therm. Anal. Calorim., 2010, 102(2), p685
[20] P. Andersson, P. Blomqvist, A. Lorén and F. Larsson, "Investigation of fire emissions from Li-ion
batteries", 2013, report from SP Technical Research Institute of Sweden
[21] C. Maton, N. De Vos and C. V. Stevens, "Ionic liquid thermal stabilities: decomposition mechanisms
and analysis tools", Chem. Soc. Rev., 2013, 42(13), p5963
[22] S. A. Forsyth, S. R. Batten, Q. Dai and D. R. MacFarlane, "Ionic Liquids Based on Imidazolium and
CHAPTER 1
Chapter 1 39
Table of contents
1. General context ... 40 2. Lithium-ion batteries ... 41 2.1. Safety issues ... 43 2.2. Electrolytes ... 45 2.3. Ionic liquids ... 47 2.4. Electrodes ... 51 3. Strategy of this work ... 55 4. References ... 57Chapter 1 40
1. General context
Energy storage is a crucial driving force to develop major markets. The nomad device one is growing, in particular for smartphones and laptops, requiring a fast development of energy storage systems (ESS), Figure 1, left. Indeed lots of functionalities are developed, calling for
more energy and power. Furthermore, pushed by the global warming and in order to limit CO2
emissions, the part of renewable energies (related to wind or sun) in the world is strongly increasing. But their development is refrained by the need to store their intermittent produced energy. ESS have to be further developed, to allow the storage of these energy sources, and to be part of smart grids applications, Table 1.[1] In the same context, electric vehicle market is also expanding, asking for reliable, safe and long range cars, Figure 1, right. Different types of ESS are required for these applications, as electric vehicles (EV), hybrid electric vehicles (HEV) and plug-in electric vehicle (PEV) do not have the same specifications. Electrochemical energy storage turned out to be very attractive for this kind of applications, as they convert chemical energy into electric one with high efficiencies. They include various devices such as batteries, supercapacitors, fuel cells combined with electrolyser etc, batteries being the most popular among them.
Figure 1: Left: Battery sales worldwide for the phones and laptops between 2000 and 2011[2] Right: EV, HEV and P-HEV battery needs estimated between 2005 & 2020[2]
Capacities (GW) 2010 2011 2012 Total renewable power 1250 1355 1470 Solar photovoltaic 40 71 100
Wind power 198 238 283
Chapter 1 41
2. Lithium-ion batteries
In this context requiring large capacities and stationary setups, secondary batteries are the most relevant, as they can be charged and discharged several times. Contrarily, primary batteries mainly based on alkaline cells are used in toys, remote controls, clocks etc since their price is low and they provide one-time use.[4] Secondary batteries previously relied on lead-acid (Pb), nickel cadmium (NiCd) and nickel metal hydride (NiMH) technologies. Since the ’90s, lithium-based chemistries were commercialised for the consumer market, and they took the lead regarding emerging applications, Figure 2.
Figure 2: Estimation of total lithium-ion transportation battery revenue by regions, world markets[5]
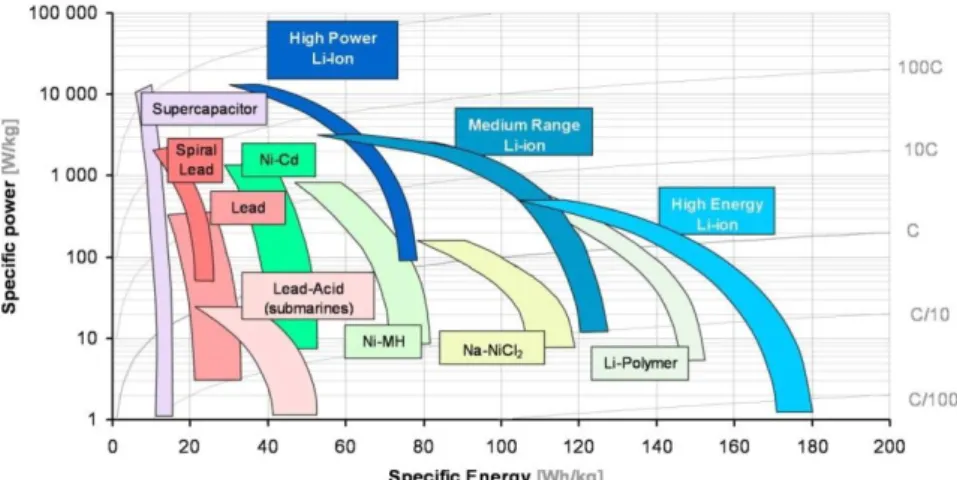
The enthusiasm shown for this technology is due to the significantly higher power and energy
densities of Li-ion batteries compared to Ni-MH chemistry (250-360 Wh.L-1 vs
140-300 Wh.L-1 and 100-160 Wh.kg-1 vs 30-80 Wh.kg-1). Also, the specific energy density (in Wh.kg-1) of a lithium-ion cell is three times the one of a Ni-Cd one, Figure 3.[6, 7] In addition to this significant increase in energy density, Li-ion cells present several other advantages, such as reliability, good cycle life and no memory effect, i.e. they do not self-discharge, Table 2. Li-ion batteries also permit wide design flexibility, they can be designed for high power or high energy density, and they can be commercialised in various formats such as cylindrical, coin, flat, and prismatic.[8]
Chapter 1 42 Figure 3: Ragone plot presenting energy and power densities of different battery technologies[9]
Ni-Cd Ni-MH Li-ion
Power capability + + + + Energy density - + + + Specific energy o + + + Cycle life + + o o Calendar life + + ++ + Price + + + - Self discharge - - + + Temperature behaviour + + o o Reliability + + + o Fast charging + + + o
Table 2: Comparison of performance parameters by chemistries for use in power tools; ++: very good, +: good, o: neutral, -: disadvantage[10]
Their development is further favoured by the price decrease, from 1250 $ per kWh in 2009, to 210 $ per kWh in 2014 and which is expected to fall to 160 $ per kWh in 2025.[11-13] Still a lot of research is devoted to increase the energy density delivered by Li-ion batteries, e.g. in the context of electric vehicles (EV) for extended autonomy, ideally achievable with one fast charge. For these applications, higher power densities are also sought for initiation, acceleration and breaking of the vehicle, requiring innovative chemistries for both the electrode and electrolyte components.
A lithium-ion (Li-ion) battery is the gathering of several cells in parallel or series circuits. Each cell is constituted of three main components which are the negative electrode, the positive electrode and the electrolyte. The electrodes are set apart via a separator, soaked with the electrolyte. The role of the separator is to insulate electronically the positive from the negative electrode, while conducting lithium ions (Li+). During discharge (when the cell is used as energy supply), Li+ cations move from the negative electrode to the positive one,
Chapter 1 43
through the electrolyte and the separator, Figure 4. It generates an electron flow in the external circuit, from the negative electrode to the positive electrode. During the charge of the cell, an external electrical power source forces an electron flow in the opposite direction. To compensate these negative charges, the Li+ ions migrate from the positive electrode to get intercalated into the porous negative electrode, in three steps. First, the solvated Li+ cations migrate through the liquid electrolyte and separator. Then, they separate from the solvation shell to penetrate the electrode material, while an electron from the external circuit balances the charge by reducing metallic elements of the electrode. Finally, Li+ can diffuse into the host electrode.
Figure 4: Schema of lithium-ion cell during discharge (in use)[14]
2.1. Safety issues
Despite all these advantages, the deployment of this technology for electric and hybrid cars is restrained by a number of accidents caused by Li-ion batteries, Table 3.
Date Device catching fire Place Fire causes
February 2014 Tesla car Canada Unknown
November 2013 Tesla car USA Impact
January 2013 Boeing 787 Dreamliner battery Japan Overheated lithium battery July 2011 EV bus China Overheated LiFePO4 batteries
April 2011 EV taxi China 16 Ah LiFePO4 batteries
September 2010 Boeing B747 cargoplace Dubai Overheated lithium battery March 2010 IPod Nano Japan Overheated lithium battery January 2010 EV buses China Overheated LiFePO4 batteries
July 2009 Cargo plane China Spontaneous combustion
June 2008 Laptop Japan Overheated battery
June 2008 Honda HEV Japan Overheated LiFePO4 batteries
2006 up to now Mobile phone Short-circtuit, overheating Table 3: Examples of lithium ion battery accidents in the past few years inspired from reference[15]
Chapter 1 44
The rate of charge or discharge and the engineering of the battery pack also influence its safety. When one cell undergoes thermal runaway, the adjacent ones may also heat up and fail, causing the entire battery to ignite or stop, Figure 5.[15] Thermal management is thus crucial to limit the propagation of such thermal event, focusing on cell-to-cell thermal
conduction. To overcome this aggravation, many external safety mechanisms exist. At the cell
level, a pressure vent can reduce the risk of explosion by lowering the internal pressure, or an interrupt can stop current to avoid overcharge. Also shut-down separators are developed to melt at a critical temperature, isolating the cell from further damage and preventing from thermal runaway.[16, 17] At the battery level, Battery Management System (BMS) can supervise each cell voltage and temperature, balance the cells, warn the operator or stop the battery if required.[18]
Figure 5: Thermal management between battery cells to limit thermal runaway[18]
In order to enhance the safety of lithium-ion batteries, active research is carried out on a variety of approaches, from material design to packaging. In particular, electrolytes are under strong development.
Chapter 1 45
2.2. Electrolytes
Electrolytes are constituted of a lithium salt dissolved in a solvent or a mixture of solvents. Its role is to provide a good conduction of lithium ions in the potential range used to cycle the cell. The required properties are electrochemical stability, embodied by electrochemical window (EW), thermal stability, represented by decomposition temperature and flash point, and ionic conductivity, Figure 6. These properties are desired as high as possible in the application temperature range, e.g. in the case of electric vehicles, from -40 °C to 70 °C. Furthermore electrolytes must be chemically compatible (i.e. inert) with both negative and positive electrode materials, in the voltage range of the cell.
Figure 6: Electrochemical window and conductivities of several electrolytes families[19]
Electrochemical stability of electrolytes can be measured by linear sweep voltammetry or cyclic voltammetry. It reveals the limits in oxidation and reduction of the solution. Thermal stability must be considered, in order to ensure the stability of the system, and can be represented by decomposition temperature. It is measured by thermogravimetric analyses, which shows the decomposition observed by mass loss. The flashpoint is the temperature at which the electrolyte forms an ignitable vapour mixture, i.e. it requires an ignition source. The
Chapter 1 46
autoignition temperature can also be considered, representing the minimum temperature required to ignite a gas or vapour in air without any ignition source. Ionic conductivity can be measured by impedance spectroscopy, and it translates the capacity of the lithium cations to move through the solvent. This property is linked to the viscosity, which influences diffusion coefficients.[20]
The electrolyte is usually a mixture of carbonates, to which a lithium salt is added. The mixture combines low viscosity solvent such as diethylcarbonate (DEC, < 1 cP)[21] or dimethyl carbonate (DMC), and a high dielectric constant solvent such as ethylene carbonate (EC, > 80)[22] or propylene carbonate (PC), Figure 7.[23, 24] These non-aqueous electrolytes generally use lithium salts with non-coordinating anions such as hexafluorophosphate (PF6), perchlorate (ClO4), tetrafluoroborate (BF4) or triflate (CF3SO3). In this work a binary and equi-volumic mixture of EC and DEC was chosen as a reference, the electrolyte was formed by adding 1 mol.L-1 of LiPF6, and this solution will be referred to as [EC:DEC][LiPF6].
Figure 7: From left to right, dimethyl carbonate (DMC), diethyl carbonate (DEC), ethylene carbonate (EC), propylene carbonate (PC) and lithium hexafluorophosphate (LiPF6)
These solvents present inherent drawbacks rising safety concerns, associated to their low thermal stability, little electrochemical stability at low potentials, and high flammability and volatility. Thermal runaway is the major malfunction of this type of battery, occurring when an exothermic reaction goes out of control. It typically happens after exposition to high temperature or after a short-circuit. First the solid electrolyte interphase (SEI) on the negative electrode can break from relatively low temperature (~ 70 °C), allowing the electrolyte to react with the carbon electrode and intercalated lithium, generating heat. This energy release accelerates the reaction, which causes further temperature rise. Gases such as hydrocarbons from the electrolyte and hydrogen, oxygen, carbon dioxide or carbon monoxide from the electrodes can be generated, leading to a pressure increase inside the cell.[25, 26] When both pressure and temperature rise too much, it can cause ignition or even explosion of the cell. These electrolytes based on carbonates also suffer from low thermal stability, as in particular
Chapter 1 47
their flashpoints are lower than 40 °C.[27] The electrolyte can irreversibly deteriorate from 60 °C, and performances are diminished below -20 °C, close to their freezing point.
To improve the safety of the electrolytes, considerable effort is underway. A wide variety of additives are designed for specific roles, including flame retardant, overcharge protector, SEI or lithium salt stabilizer etc.[21, 28-31] Novel lithium salts are also synthesised and tested as alternatives to LiPF6, to reduce toxicity related to HF formation by hydrolysis.[32-35] Another approach is the replacement of conventional liquid electrolyte solvents. In this approach polymers are intensively studied as they provide solid-state safer properties with good conductivities.[36-40] A new category of solvents is also widely considered and studied, namely ionic liquids.
2.3. Ionic liquids
Ionic liquids (IL) are defined as salts, liquid below 100 °C. They result from the association of an organic cation, Figure 8, with an organic or inorganic anion, Figure 9. Consequently, they can be theoretically designed for a chosen application by tuning the nature of the anion or/and of the cation. However this was found to be difficult to predict properties of novel IL.
Figure 8: Common IL cations, from left to right: imidazolium [Im], pyrrolidinium [PYR], piperidinium, ammonium and phosphonium;
R represent alkyl chains, e.g. [C1CnIm] is alkylmethylimidazolium
Figure 9: Common IL anions, from left to right: tetrafluoroborate (BF4),
hexafluorophosphate (PF6), bis(trifluoromethanesulfonyl)imide (NTf2),
dicyanamide (dca) and acetate (OAc)
One of the first reported IL, ethylammonium nitrate, [N(C2H5)H3][NO3], was synthesised and reported by Walden in 1914.[41] The first generations of IL were mainly based on
Chapter 1 48
chloroaluminate anions (AlCl4 or Al2Cl7),[42, 43] affording water sensitive, toxic and corrosive solutions. Then in the 1990s, an important breakthrough was the use of water stable anions such as BF4 and NO3.[44] Since then, IL were used in a large range of applications such as catalysts solvents,[45-49] separation media,[50-52] electrolytes,[53-62] or heat transfer fluids.[63-66] They are generating high interest from the scientific community as shown by an increasing number of publications, Figure 10.[67, 68]
Figure 10: Evolution of the number of publications containing the term “ionic liquid” or “ionic liquids” in the topic from Web of knowledge from 1988 to 2014
These salts possess low melting points thanks to the large volume and the asymmetry of their constituting ions. It sterically prevents the formation of a regular network like e.g. in the case of sodium chloride (NaCl), Figure 11.[69] IL exhibit negligible vapour pressure, similarly to solid salts,[70] hence they do not vaporize unless heated to the point of thermal decomposition, typically 200 to 300 °C.[53] Their viscosity can be of 30-60 cP,[53, 71-73] they have flash points higher than 200 °C,[74, 75] and are hardly flammable.[76-79]
Figure 11: Structure of NaCl (left) and [Im][PF6] (right) salts;
![Figure 1: Left: Battery sales worldwide for the phones and laptops between 2000 and 2011 [2]](https://thumb-eu.123doks.com/thumbv2/123doknet/14668422.741281/40.892.222.676.657.900/figure-left-battery-sales-worldwide-phones-laptops.webp)
![Figure 2: General scheme of imidazolium-based ionic liquid synthesis Top: quaternarisation reaction; Bottom: anion metathesis reaction [18, 19]](https://thumb-eu.123doks.com/thumbv2/123doknet/14668422.741281/69.892.111.786.721.920/figure-general-imidazolium-synthesis-quaternarisation-reaction-metathesis-reaction.webp)
![Figure 3: Comparison of the T d values of [C 1 C 4 Im][NTf 2 ] (5 °C.min -1 , argon flow) according to the definitions T onset , T start and T peak ;](https://thumb-eu.123doks.com/thumbv2/123doknet/14668422.741281/71.892.232.671.564.857/figure-comparison-values-argon-according-definitions-onset-start.webp)
![Figure 4 : Effect of the heat rate on the TGA profile of [C 1 C 4 Im][NTf 2 ], this work](https://thumb-eu.123doks.com/thumbv2/123doknet/14668422.741281/72.892.255.636.693.987/figure-effect-heat-rate-tga-profile-ntf-work.webp)
![Figure 12 : Influence of the alkyl chain length on the T onset and T start for [C 1 C n Im][NTf 2 ]](https://thumb-eu.123doks.com/thumbv2/123doknet/14668422.741281/82.892.282.666.483.768/figure-influence-alkyl-chain-length-onset-start-ntf.webp)