ROYAUME DU MAROC
UNIVERSITE MOHAMMED V - RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
M
M
é
é
m
m
o
o
i
i
r
r
e
e
P
P
o
o
u
u
r
r
L
L
’
’
o
o
b
b
t
t
e
e
n
n
t
t
i
i
o
o
n
n
d
d
u
u
D
D
i
i
p
p
l
l
ô
ô
m
m
e
e
N
N
a
a
t
t
i
i
o
o
n
n
a
a
l
l
d
d
e
e
S
S
p
p
é
é
c
c
i
i
a
a
l
l
i
i
t
t
é
é
O
O
p
p
t
t
i
i
o
o
n
n
:
:
AANNEESSTTHHEESSIIEE RREEAANNIIMMAATTIIOONNP Prrééppaarrééppaarr:: D Doocctteeuur r :: MMOOUULL--DDOOUUIIRRAA SSAAFFAAEE E Ennccaaddrrééppaarr:: P Prrooffeesssseeuur r :: DDOOUUMMIIRRII MMOOUUHHSSSSIINNEE D Diirriiggéé ppaarr:: P Prroofefesssseeurur :: MMAAAAZZOOUUZIZI AHAHMMEEDD WWAAJJDDII
Utilisation de l’échographie pour la confirmation
de la position correcte de la sonde gastrique chez
les patients intubés en réanimation
Etude observationnelle prospective à propos de 89 cas au service de
réanimation de l’hôpital des spécialités de Rabat
N
Remerciements
Monsieur le professeur Adil BENSOUDA
Chef de l’unité pédagogique et de recherche
d’anesthésie-réanimation de Rabat
Service de réanimation de la chirurgie cardio-vasculaire B
Nous remercions notre maitre le professeur A. BENSOUDA,
Chef de l’unité pédagogique et de recherche
d’anesthésie-réanimation de Rabat, qui nous a apporté aide, conseil, et
formation pratique et théorique très utile. Il nous a appris les
règles de cette spécialité, la responsabilité envers nos malades
et il restera pour nous, à tout jamais, une grande référence.
Nous apprécions sa sympathie, ses qualités humaines et
professionnelles et nous lui présentons notre dévouement et
notre grand respect.
Monsieur le professeur ABDELOUAHED BAITE
Chef du pole Anesthésie-réanimation
Hôpital militaire Mohammed V
Nous remercions notre maître le Professeur A , BAITE chef du pole
Anesthésie réanimation au service de réanimation chirurgicale à
l’hôpital militaire de Rabat pour ses grandes qualités humaines, sa
maîtrise de ce métier, ses vastes connaissances scientifiques et la
clarté de son enseignement ainsi que pour tous les efforts qu’il a
déployés pour assurer notre formation aussi bien sur le plan théorique
que pratique. Il restera pour nous, à tout jamais, une grande
référence.
A Monsieur le professeur Ahmed EL HIJRI
Chef du service d’anesthésie-réanimation chirurgicale Au CHU
Ibn Sina de Rabat
Nous remercions notre maitre le professeur A. EL HIJRI, chef du
service d’anesthésie réanimation chirurgicale, pour la qualité de son
enseignement, sa sympathie, sa disponibilité et ses conseils très
constructifs. Nous garderons toujours un souvenir immense de sa
sympathie, ses qualités humaines et de la valeur de son
enseignement.
Aucun mot ne saurait exprimer notre gratitude de vous savoir
parmi les juges
Veuillez accepter, cher maitre, l’expression de notre profond
respect.
A Monsieur le professeur Zakaria BELKHADIR chef de service
de réanimation à l’institut national d’oncologie de Rabat
Nous adressons toute notre reconnaissance et nos vifs
remerciements à Professeur Z. BELKHADIR, chef de service de
réanimation à l’institut national d’oncologie de Rabat, pour ses
nombreux conseils, et pour nous avoir fait profiter de ses
compétences et de son expérience.
Maitre, votre image a toujours reflété à nos yeux l’excellence et la
détermination de votre pratique et de votre enseignement de
l’anesthésie et de la réanimation.
Puissions-nous vous exprimer le témoignage de notre profond
respect.
A Monsieur le professeur Ahmed Wajdi MAAZOUZI
Chef de service de réanimation de l’hôpital des spécialités de Rabat
CHU Ibn Sina et Directeur de mémoire
Nous tenons à remercier tout particulièrement mon directeur de
mémoire Pr A W. MAAZOUZI chef du service de réanimation de
l’hôpital des spécialités de Rabat au CHU Ibn Sina, dont la
gentillesse, la présence et la compétence nous a toujours émus.
Monsieur, votre bienveillance à l’égard de vos élèves ne peut être
que source d’admiration.
Nous avons le privilège de compter parmi eux. Nous espérons être
dignes de votre enseignement.
Puissions-nous vous exprimer le témoignage de notre profond
respect
A tous mes Maitres et Enseignants
Dans l’espoir d’être digne de leur enseignement.
Vous m’avez guidée avec bienveillance, implication et
compréhension, pour l’acquisition du savoir nécessaire à l’exercice
de ma profession, j’espère être digne de votre confiance et à la
hauteur de vos attentes.
Vos conseils, votre disponibilité et votre dévouement à
l’enseignement m’ont permis d’apprécier toute la richesse de cette
spécialité.
Je n’oublierais jamais de faire bon usage de ce que vous m’avez
appris.
SOMMAIRE
INTRODUCTION ... 1
MATERIELS & METHODES ... 4
RESULTATS & ANALYSES ... 11
DISCUSSION ... 16
CONCLUSION ... 25
RESUME ... 27
REFERENCES ... 29
INTRODUCTION
La pose d’une sonde gastrique (SG) est l'une des procédures les plus courantes de la pratique clinique chez un patient intubé. [1]. Elle est indiquée pour décomprimer et vidanger l’estomac après la distension gastrique secondaire à la ventilation mécanique après une intubation endotrachéale ou à une ventilation non invasive [2].
Elle est fréquemment utilisée pour l’administration de médicaments et pour l'alimentation entérale qui constitue un élément fondamental de soins des patients en unité de soins intensifs [3].
Si le placement d’une sonde naso-gastrique (SNG) est généralement une procédure rapide et inoffensive, une position incorrecte de la sonde peut toujours avoir des conséquences fatales telles qu'une pneumonie grave par inhalation ou un pneumothorax [4]. Des localisations intracrâniennes de la sonde gastrique ont même était décrites [5].
La SG est classiquement vérifiée par le test d’insufflation-aspiration de 50 ml d’air à la seringue combiné à une auscultation épigastrique et perception d’un borborygme caractéristique au stéthoscope et par le test d’aspiration à la seringue de liquide gastrique [2].
D’autres techniques telles que la mesure du pH (< 5) du liquide aspiré ou la mesure de la capnométrie sont utilisées par certaines équipes pour le contrôle de la position de la SG, voire combinées [6,7]. D'autres options pour le contrôle de la position comprennent des mesures de la bilirubine, de la trypsine ou de la pepsine dans liquide d’aspiration [8, 9].
Toutes ces méthodes ont des sensibilités et spécificités variables et ne peuvent pas pour la plupart se substituer au contrôle radiologique thoracique qui reste le « Gold Standard » [10,11].
Selon certains auteurs, seule la combinaison du test d’insufflation d’air à la seringue et de mesure du pH du liquide aspiré pourrait permettre, de confirmer la bonne position de la SNG en évitant un contrôle radiologique [12]. Mais il faut noter que de nombreux patients de réanimation reçoivent un traitement antiacide qui peut perturber la fiabilité de la mesure du pH et aussi le manque de fiabilité de la méthode d'auscultation seule sans aspiration.
La recherche de moyens non radiologiques, simples et sûrs pour vérifier la position des sondes gastriques a conduit à l’utilisation de l’échographie gastrique comme un moyen prometteur de contrôle de la bonne position de la sonde gastrique.
De nombreuses procédures dans les unités de soins intensifs et en réanimation sont effectuées sous repérage échographique comme la voie veineuse centrale [13], mais les données relatives au positionnement de la SG guidé par l’échographie sont rares [14, 15].
L’objectif de notre travail est de comparer la performance d’une bonne position du SNG par l’échographie gastrique en réanimation versus la technique d’insufflation d’air par une seringue suivie d’aspiration et le contrôle radiologique qui reste le test de référence.
MATERIELS
& METHODES
Il s’agit Il s'agit d'une étude prospective monocentrique observationnelle. L'étude a été menée dans le service de réanimation de l’hôpital des spécialités du Chu Ibn Sina de Rabat, sur une période de 6 mois entre le 06 mai 2019 et le 06 novembre 2019.
Les critères d'inclusion étaient les suivants :
1. Sujets de plus de 18 ans (l’étude est réservée à l’âge adulte) ; 2. Les indications de pose de SG suivants :
1. La nutrition entérale ;
2. Les troubles de déglutition ;
3. Les cérébrolésés graves intubés ventilés ; 4. L’administration des médicaments ; 5. La décompression de l'estomac.
Les critères d'exclusion étaient les suivants : 1. Sujets ayant moins de 18 ans ;
2. Les sténoses œsophagiennes post caustiques ou tumorales ;
3. Une suspicion de fracture des os de la base du crâne ; 4. Des antécédents de chirurgie gastrique.
Après la stabilisation des patients inclus dans l’étude, la sonde orogastrique a été placée par un infirmier diplômé d’état ou un médecin résident responsable de la prise en charge du patient. La longueur de la SG a été déterminée en mesurant la distance allant de la pointe du nez à la pointe du lobe de l’oreille du patient, puis au processus xiphoïde, en ajoutant 10 cm à cette mesure.
Les sondes disponibles utilisées dans notre service étaient en polychlorure de vinyle de calibres de 14 à 18 French.
Après insertion de la sonde, une vérification classique à la seringue (test d’insufflation d’air et d’aspiration) suivie après chez le même patient par un contrôle échographique de la position de la SG qui est effectué par un autre médecin résident ayant reçu une formation de base sur l'utilisation de l'échographie gastrique, sous surveillance de son senior mais qui n’ont pas assisté à la pose de la sonde gastrique au début. Un contrôle radiologique était réalisé après ces deux procédures.
Nous disposons au sein de notre service de réanimation d’appareil échographique M-turbo (Sonosite, Bothell, WA, états- Unis).
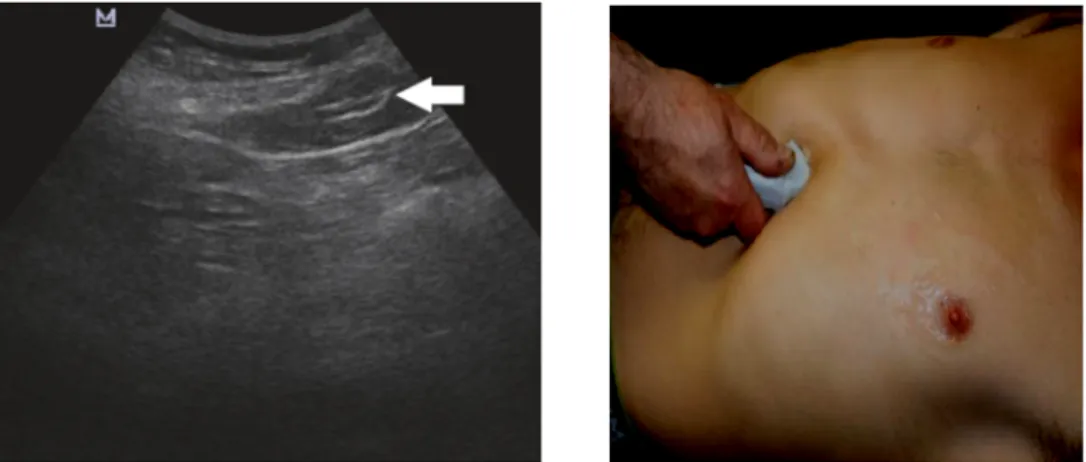
Une sonde convexe de 3,5 MHz a été utilisée pour visualiser la région sous-xiphoïde et la jonction œsogastrique à partir d’une fenêtre échographique sous costale gauche transversale. (Figure 1).
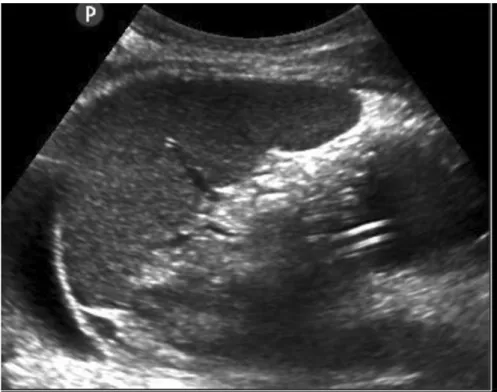
La sonde gastrique était directement visualisée avec des coupes sagittales de l'épigastre (Figure 2).
:
Figure 1 : Contrôle échographique de position de la sonde gastrique à partir d’une fenêtre échographique sous-costale gauche transversale.
L'antre est un repère situé en arrière du lobe hépatique gauche et en avant du pancréas (l'antre est délimité en avant du pancréas dans une coupe épigastrique transversale). Chez un patient à jeun, l'antre se présente comme un doigt de gant en coupe transversale, avec des parois hypoéchogènes et un contenu homogène (air-liquide).
Dans une coupe épigastrique sagittale moyenne, l’antre a un aspect ovoïde, souvent décrit comme un « œil de bœuf ». Lorsque le volume augmente (sécrétions gastriques, eau), l'antre apparaît rond avec des parois minces. Il est évident qu’il est plus difficile de visualiser l’antre par échographie sans préparation préalable. Le fundus gastrique, situé dans l’hypochondre gauche peut être difficile à visualiser en raison de sa position profonde. Son approche peut être facilité par deux coupes : une coupe trans-splénique intercostale latérale gauche ou une autre longitudinale sur la ligne médio-axillaire (Figure 2).
Figure 2 : image de la sonde dans le fundus gastrique sur une coupe sagittale
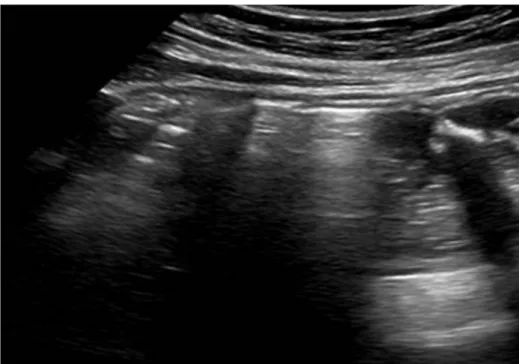
La sonde gastrique parait comme une image linéaire, hyperéchogéne avec cône d’ombre postérieur (figure 3). Lorsqu’elle ne soit pas visualisée au niveau de la région sous-xiphoïdienne, sont injectés 10 cc d'air et 40 cc de sérum salé physiologique 9% à l’aide d’une seringue de 50 cc à embout conique. Ensuite, l'évaluation échographique est répétée à la recherche des artéfacts de réflexions multiples ou de réverbérations générées par l’air contenu dans la sonde qui caractérise la bonne position de la SNG (Figure 4) [4].
Figure 3 : contrôle échographique d'une sonde gastrique. La pointe de la sonde apparaît comme une image hyperéchogène à cône d’ombre postérieur
Figure 4 : Un mélange de 40 ml de solution salée avec 10 ml d'air a été injecté dans la sonde pour visualiser le "brouillard" hyperéchogène existant à l'extrémité de la sonde (flèches blanches).
Ce repérage échographique facilité devait démasquer la localisation gastrique de la sonde ou à défaut devait confirmer sa position dans le tube digestif.
Le contrôle radiologique était systématique par une radiographie thoracique « technique de référence » permettant de certifier le positionnement gastrique ou non de la sonde et de comparer les résultats obtenus par les différentes méthodes.
Les radiographies thoraciques ont été interprétées par un autre médecin qui n'a pas effectué les examens échographiques. L'intervalle de temps entre l'insertion de la sonde gastrique et le contrôle radiographique était inférieur à 3 heures.
L’ensemble des données était colligé sur une fiche d’exploitation précisant les circonstances cliniques de pose, le temps de vérification et les résultats des différents contrôles.
Analyses statistiques :
Pour l’analyse descriptive, les variables quantitatives étaient exprimées en moyenne (écart-type ou en médiane) et les variables qualitatives en valeurs absolues ou pourcentages. Pour comparer les variables quantitatives, le test t de Student ou le test de Mann-Whitney étaient utilisés et pour les variables qualitatives, le test chi2 ou le test exact de Fisher. La sensibilité et la spécificité ont été calculées pour chaque méthode. Les valeurs de p inférieures à 0,05 ont été considérées comme indiquant une signification statistique.
RESULTATS
& ANALYSES
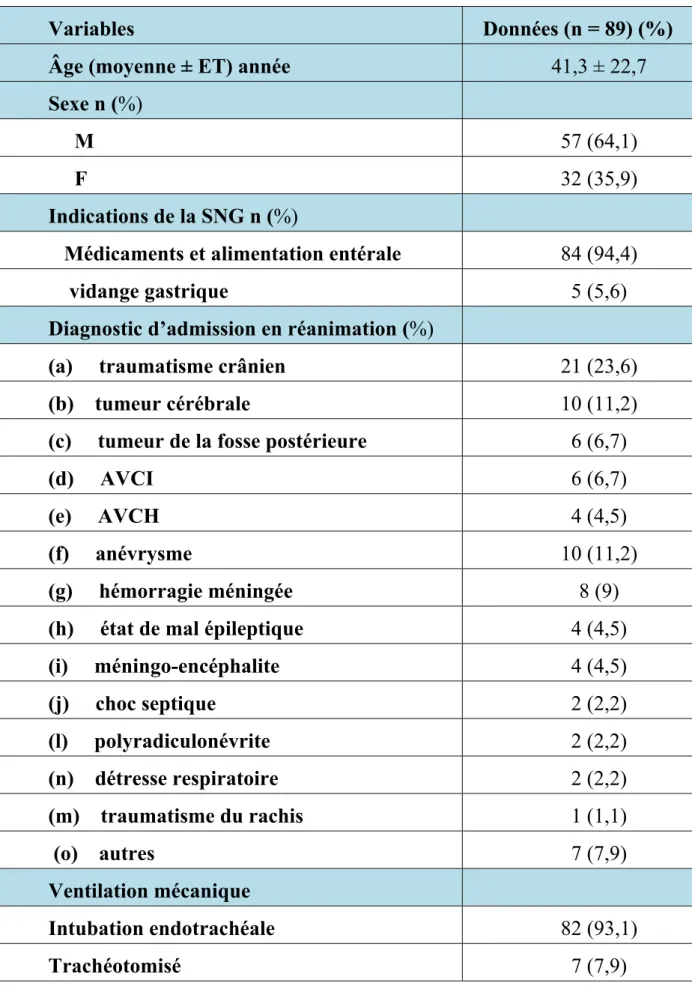
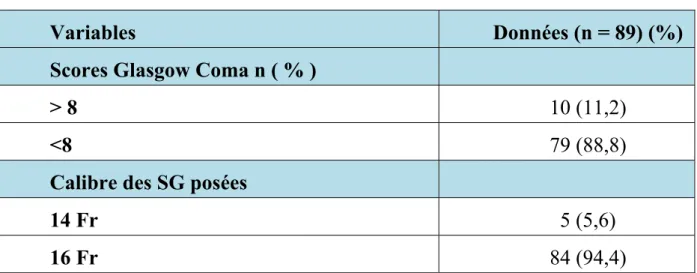
Un total de 89 patients (57 hommes, 32 femmes) avec un âge moyen de 41,3 ± 22,7 ans ont été inclus. Les caractéristiques cliniques et démographiques sont résumées dans le tableau 1
Quatre-vingt-deux sondes ont été posées lors de l’admission des patients en réanimation après l’intubation. Les sept autres patients étaient trachéotomisés.
L’indication de la pose de sonde était surtout l’alimentation, la prise médicamenteuse, les troubles de déglutition.
Le calibre de la sonde était dans la majorité des cas de 16 Fr soit 94,4% des cas.
Tableau I : Les caractéristiques cliniques et démographiques
Variables Données (n = 89) (%)
Âge (moyenne ± ET) année 41,3 ± 22,7
Sexe n (%)
M 57 (64,1)
F 32 (35,9)
Indications de la SNG n (%)
Médicaments et alimentation entérale 84 (94,4)
vidange gastrique 5 (5,6)
Diagnostic d’admission en réanimation (%) (a) traumatisme crânien 21 (23,6)
(b) tumeur cérébrale 10 (11,2)
(c) tumeur de la fosse postérieure 6 (6,7)
(d) AVCI 6 (6,7)
(e) AVCH 4 (4,5)
(f) anévrysme 10 (11,2)
(g) hémorragie méningée 8 (9)
(h) état de mal épileptique 4 (4,5)
(i) méningo-encéphalite 4 (4,5) (j) choc septique 2 (2,2) (l) polyradiculonévrite 2 (2,2) (n) détresse respiratoire 2 (2,2) (m) traumatisme du rachis 1 (1,1) (o) autres 7 (7,9) Ventilation mécanique Intubation endotrachéale 82 (93,1) Trachéotomisé 7 (7,9)
Tableau I : Les caractéristiques cliniques et démographique (suite) :
Variables Données (n = 89) (%)
Scores Glasgow Coma n ( % )
> 8 10 (11,2)
<8 79 (88,8)
Calibre des SG posées
14 Fr 5 (5,6)
16 Fr 84 (94,4)
Soixante-dix-neuf sondes gastriques était visualisées en position gastrique par échographie.
Huit contrôles échographiques ne mettaient pas en évidence la SG en position gastrique.
Pour ces huit cas, l’écho repérage était facilité par l’insufflation d’air à la seringue. La mise en évidence d’artéfacts de réverbérations produits par le bullage. Ceci ne permettait pas de confirmer la position gastrique de la SG mais indirectement sa position digestive.
Le contrôle radiologique confirmait le bon positionnement des 79 SG écho repérés et une localisation œsophagienne basse ou cardiale des huit SG non visualisées à l’échographie.
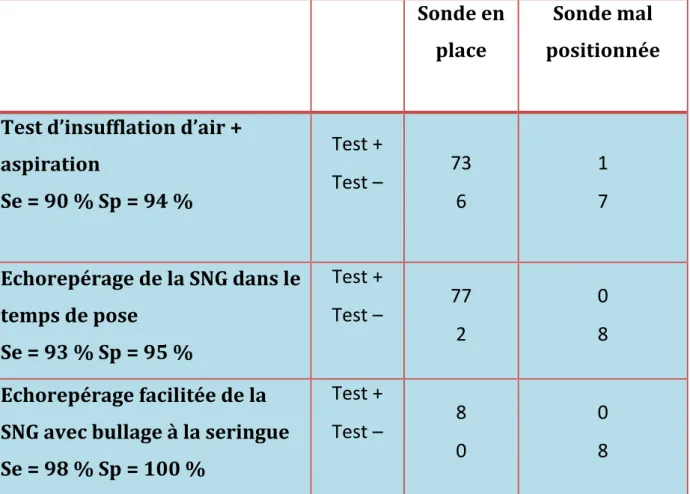
La sensibilité et spécificités des différents tests sont présentées dans le Tableau II.
Tableau II : Comparaison de la sensibilité et des spécificités des différents tests de contrôle de position de la sonde gastrique.
Sonde en place Sonde mal positionnée Test d’insufflation d’air + aspiration Se = 90 % Sp = 94 % Test + Test – 73 6 1 7 Echorepérage de la SNG dans le temps de pose Se = 93 % Sp = 95 % Test + Test – 77 2 0 8 Echorepérage facilitée de la SNG avec bullage à la seringue Se = 98 % Sp = 100 % Test + Test – 8 0 0 8 Se : sensibilités ; Sp : spécificités.
Aucune lésion majeure n’était constatée lors de la pose des SNG dans notre série, seules deux épistaxis spontanément résolutives ont été notées.
DISCUSSION
Le taux de mauvaise position est faible dans la littérature et les fréquences varient suivant les séries entre 0,5 et 11 %. Les complications peuvent être très graves telles qu'un pneumothorax, un pneumomédiastin, un emphysème sous-cutané, une pneumonie, une hémorragie pulmonaire, un empyème, un hémothorax, une fistule bronchopleurale, une perforation de l'œsophage, une malposition intracrânienne de la SG [1,16]
Si les patients ayant une respiration spontanée, présentent des signes cliniques de mauvais positionnement (toux, désaturation), les patients intubés ou inconscients ont une déglutition inhibée et une altération du réflexe nauséeux et de la toux ce qui rend difficile l'interprétation de la position correcte. La procédure est difficile chez les patients non coopérants, chez les patients présentant des anomalies anatomiques où le risque de complications augmente [17]. Il faut noter que La sonde gastrique peut être dirigée vers la trachée même si le patient est intubé [17, 18].
Le contrôle de la position de la sonde gastrique, souvent utilisée en pratique clinique, n'est pas encore standardisé.
Plusieurs méthodes ont été suggérées pour vérifier la mise en place d'une SNG, y compris l'auscultation, la mesure du pH des aspirations de la sonde et la radiographie pulmonaire. De plus, l'utilisation de la capnographie colorimétrique a été démontrée récemment [6, 19].
L'échographie est de plus en plus utilisée par les médecins de l'USI et de réanimation pour positionner le cathéter veineux central, pour évaluer l'état hémodynamique et pour diagnostiquer un pneumothorax, un épanchement pleural ou une tamponnade cardiaque [20].
En ce qui concerne le contrôle échographique de la SG, il existe un nombre limité d'études dans la littérature [21-23]. Ces études abordent l'échographie comme une méthode prometteuse pour la vérification des SG avec une sensibilité et une spécificité élevée, mais cette technique n'est pas encore considérée comme la norme de référence.
Tian Lin. et al ont publié une revue systématique sur le contrôle échographique de la position de la sonde gastrique et ont constaté que la sensibilité et la spécificité étaient de 93% et 97%, respectivement [24].
Selon nos résultats, l’échographie est assez sensible et spécifique pour détecter la bonne position par rapport à la radiographie.
Le contrôle radiologique hospitalier est irradiant, nécessite la mobilisation du patient et expose au risque de déplacement accidentel des cathéters, drains et sondes d’intubation. Il a également un coût et nécessite la disponibilité et l’intervention d’un manipulateur en radiologie. L'exposition radiographique doit être adéquate pour permettre à la sonde d'être visible au bas du cliché, qui doit être centré plus bas que la normale pour montrer l'abdomen aussi loin que possible sous le diaphragme [25, 26].
L’aspiration de liquide gastrique est une technique couramment proposée pour le contrôle de la position de la SNG, mais elle peut être difficile, voire impossible, notamment si la sonde est souple, de petit calibre ou en cas d’estomac vide. Les valeurs de sensibilité étaient comparables celles de la littérature avec une spécificité toutefois meilleure [11].
L’insufflation d’air avec auscultation épigastrique est la méthode de vérification la plus couramment utilisée, car facile à mettre en œuvre. Toutefois, cette méthode n’est pas fiable selon certains auteurs en raison de faux positifs [21, 22, 24]. En effet, plusieurs études montrent que l’auscultation épigastrique de borborygmes est sensible, mais peu spécifique, car des sons transmis de l’œsophage peuvent tout à fait reproduire ceux d’une sonde correctement placée dans l’estomac. Cependant le son provenant du site bronchique peut être confondu avec le son de l'épigastre.
Dans une étude menée par Metheny et al en 1990, ils ont conclu que l'auscultation était précise que dans 34,4% des cas. [27]
La plupart des auteurs soulignaient que l’insufflation d’air avec auscultation de l’épigastre comme seule méthode de prédiction du bon positionnement de SNG n’est pas suffisante et qu’un contrôle radiologique est de toute façon nécessaire pour confirmer le positionnement intra gastrique de la sonde [3,12].
Dans une étude menée par Maazouzi et al, la technique d’évaluation consistait à réaliser une insufflation de 50 ml d’air à l’aide d’une seringue, suivie d’une aspiration. L’auscultation d’un borborygme au niveau de l’épigastre concomitant d’une aspiration facile d’air et/ou de liquide digestif confirmait la positivité du test. Durant la période d’étude, 200 sondes gastriques ont été mises en place. Le contrôle radiologique a confirmé le bon positionnement de la sonde chez tous les patients. La sensibilité et la spécificité de cette technique étaient de 100 %. [28].
Dans notre étude, la combinaison des tests d’insufflation et d’aspiration améliorait significativement la sensibilité (90%) et la spécificité (94 %). Des résultats similaires dans la littérature médicale ont été notés chez des patients présentant un niveau de conscience altéré ou des patients en soins intensifs [24,29].
En 2011, l'Agence nationale de sécurité des patients (NPSA) a émis une alerte concernant le mauvais positionnement des sondes gastriques [30]. L'alerte recommandait un test avec du papier indicateur de pH comme première ligne de contrôle. Il avait conseillé de vérifier par les images radiographiques comme test de deuxième ligne, lorsque le résultat n'était pas clair ou qu'il n'y avait aucune possibilité d'obtenir un échantillon d'aspiration. La détermination de la valeur du pH, en considérant une valeur inférieure à 5 comme seuil pour la position correcte, n'était pas indiquée chez les patients qui prennent certains médicaments, tels que les anti-H2, et ne faisait pas la distinction entre la position intestinale ou trachéale [31].
En cas de positionnement correct, la mesure du pH était comprise entre 0 et 6,0 chez 85% des patients, alors que dans les sécrétions intestinales, le pH était supérieur à 6,0. Dans cette étude de 605 patients, quatre cas de positionnement incorrect dans les voies respiratoires ont été décrites, 2 dans l'arbre trachéobronchique, 2 dans l'espace pleural dans les quatre aspirations, le pH était supérieur à 6,5 [32].
Dans une autre étude qui a examiné le lien entre le pH et la bilirubine, il a été possible de distinguer entre l'aspiration trachéobronchique et le liquide gastrique et intestinal [9] en utilisant une valeur de pH supérieure à 5,0 et une valeur de bilirubine inférieure à 5 mg
Le contrôle échographique du positionnement de la sonde est de sensibilité supérieure aux précédentes techniques et de spécificité maximale.
Les sondes entièrement fabriquées à partir de PVC sont largement utilisés. De même, nous avons également utilisé des sondes de 16 Fr NG, entièrement en PVC, non métallisé et ayant atteint une sensibilité de 95,74%.
Dans une étude menée auprès de 33 patients en soins intensifs par Vigneau et al, la mise en place de sonde gastrique sous contrôle échographique s’est avérée plus rapide que la radiographie thoracique directe et a une sensibilité de 97%, en utilisant des sondes gastriques avec un bec métallique ce qui rend facile la détection échographique car le métal est très hyperéchogéne et provoque des artéfacts (ombres acoustiques). [15]
Dans une autre étude pilote de Lock et coll. en 2003, la mise en place des sondes d'alimentation a été vérifiée par insufflation de 50 mL d'air chez 55 patients en réanimation médicale. Dans 43 des 60 sondes d'alimentation (72%), la position correcte a été vérifiée par échographie [33].
Il est évident que le contrôle du positionnement de la sonde gastrique par échographie a l'avantage de réduire les complications, de gagner du temps pour d'autres procédures et de diminuer l'exposition aux rayonnements. Dans certains cas, cependant, l'examen échographique est difficile en raison des caractéristiques et des conditions des patients. Pour cette raison, nous devons faciliter les manœuvres pour obtenir et interpréter les images. Notre étude pilote a démontré que les sondes gastriques sans embouts lestés, couramment utilisées en soins intensifs, sont visibles à l’échographie, contrairement aux résultats de l’étude de Vigneau [15]. De plus, nous avons utilisé une sonde gastrique sans guide métallique, et les images échographiques étaient clairement visibles. L'étude pilote a confirmé la haute sensibilité de l'échographie dans la vérification du positionnement correct de la sonde gastrique chez les patients adultes en USI.
La sensibilité du contrôle échographique était à 98,3% en utilisant uniquement des coupes épigastriques dans une étude menée par Chenaita et al. [34]. Ce taux très élevé de sensibilité est dû également aux médecins urgentistes effectuant le geste de contrôle échographique et ayant une bonne expérience en échographie. Comparativement à notre étude où le geste était effectué par un résident du service acquis une expérience moyenne en échographie.
Pour les huit autres cas où l’extrémité de la sonde n’était pas visible, la réalisation d’un bullage à la seringue devait faciliter la localisation de l’extrémité de la SNG par les artéfacts de réverbérations générés par l’air insufflé.
Lors de l'utilisation de l'échographie de la région sous xiphoïdienne, la sensibilité était de 78,72%, tandis que la sensibilité atteignait 91,5% avec l'ajout d'un mélange air-eau [29].
Dans une autre étude, la sensibilité était de 97% avec un mélange air-eau [22]. Dans notre étude la sensibilité atteignait 98 % et spécificité de 100 %
Plusieurs études (Chenaitia et al, 2012 ; Kim et al, 2012 ; Vigneau et al, 2005) ont rapporté que l'échec de l'échographie pour confirmer la position correcte de la sonde était dû à l'interposition de gaz, qui reste une limitation majeure de l’échographie.
Une récente revue systématique faite par Tsujimoto en 2017 [35] et publiée dans la Cochrane sur la place actuelle de l’échographie dans le contrôle de la position de la sonde gastrique a permis de mettre le point sur la plupart des séries publiés en essayant de prouver l’utilité de la technique échographique de contrôle de la position de la SG. 7 études sur 10 ont une sensibilité et spécificité supérieures à 90%, cela pourrait permettre de disposer d’un outil de contrôle plus performant que les tests précédemment cités et traditionnellement utilisés [24, 36].
En effet, dans la dernière méta-analyse faite par Tian et al en 2017, la spécificité de l'échographie était de 0,97 (IC à 95% de 0,23 à 1,00) avec une valeur de spécificité extrêmement élevée.
Les limites de cette étude résident dans la nécessité d’études complémentaires pour confirmer ces résultats et pour détailler une technique standardisée, reproductible, fiable et sécurisée de contrôle du positionnement correct de la sonde. La taille de notre échantillon pourrait être plus grande. Mais il reste acceptable par rapport aux études précédentes.
Même si les résultats sont prometteurs, notre étude demeure monocentrique.
Enfin, dans notre étude les patients inclus sont en majorité à estomac plein, ce qui a pu également faciliter la détection échographique des SG. Le calibre des sondes a pu également participer à une facilitation de leurs détections.
La population est exclusivement constituée de patients adultes de plus de 18 ans. Il semblerait que la détection échographique des SNG de petit calibre comme en néonatologie soit plus complexe à identifier [37].
La pose d’une SG est un geste de réalisation simple et courant en réanimation, mais qui peut potentiellement occasionner des lésions sévères.
Les méthodes de contrôle de la position classiquement employées telles que le test d’insufflation à la seringue ou d’aspiration du liquide gastrique ou même combinées n’offrent pas une sensibilité et spécificité suffisantes pour s’affranchir d’un contrôle radiologique.
Nous proposons une méthode de contrôle par écho repérage, non irradiante, simple, rapide, fiable, adapté aux conditions notamment bruyantes de la réanimation, plus performante que les techniques de contrôle classiquement proposées et qui pourrait si les résultats étaient confirmés permettre de disposer d’un contrôle de positionnement de la SG aussi performant que son référent radiologique.
Introduction :
La pose d’une sonde gastrique (SG) est l'une des procédures les plus courantes de la pratique clinique chez un patient intubé. L’échographie gastrique est parmi plusieurs méthodes qui ont été suggérées pour vérifier la mise en place d'une SG et dont les résultats sont très prometteurs.
Objectif :
L’objectif de notre travail est de comparer la performance d’une bonne position du SG par l’échographie gastrique en réanimation versus la technique d’insufflation d’air par une seringue suivie d’aspiration et le contrôle radiologique qui reste le test de référence.
Matériel et méthode :
C’est une étude prospective monocentrique observationnelle menée dans le service de réanimation de l’hôpital des spécialités de Rabat, sur une période de 6 mois (mai 2019 à novembre 2019). Le positionnement correct des SG de patients intubés en réanimation de l’hôpital des spécialités de Rabat a était contrôlé par échographie et était confronté systématiquement aux résultats du test d’insufflation-aspiration à la seringue. L’échorepérage a était fait avec deux méthodes ; au moment de la pose de la sonde puis si besoin facilité avec bullage à la seringue. Un contrôle systématique radiologique a été effectué dans un délai de 3 heures.
Résultats :
Nous avons inclus 89 patients intubés. L’âge moyen était de 41 ans avec un écart-type de 23 ans. 79 sondes gastriques était visualisées en position gastrique par échographie. 8 contrôles échographiques ne mettaient pas en évidence la SG en position gastrique. Pour huit cas, un échorepérage facilité par l’insufflation d’air à la seringue permettait de démasquer la position digestive de la SG, sans toutefois confirmer sa position gastrique.
Le contrôle radiologique confirmait le bon positionnement des 79 SG écho repérés et une localisation œsophagienne basse ou cardiale des huit SG non visualisées à l’échographie
Discussion :
Le contrôle de la position de la SG n'est pas encore standardisé. Les méthodes classiquement employées telles que le test d’insufflation à la seringue ou d’aspiration du liquide gastrique ou même combinées n’offrent pas une sensibilité et spécificité suffisantes pour s’affranchir d’un contrôle radiologique.
Dans notre étude, la combinaison des tests d’insufflation et d’aspiration améliorait significativement la sensibilité (90%) et la spécificité (94 %). Des résultats similaires dans la littérature médicale ont été notés chez des patients intubés
Le contrôle échographique du positionnement de la sonde est de sensibilité supérieure aux techniques précédentes et de spécificité maximale. Dans une récente méta-analyse faite par Tian et al en 2017, la spécificité de l'échographie était de 97% avec une valeur de spécificité extrêmement élevée.
Conclusion :
Le contrôle échographique du positionnement correct de la sonde gastrique dans notre étude est faisable en réanimation. Cette technique rapide, non irradiante, plus sensible et spécifique que les tests à la seringue couramment utilisés en réanimation pourrait s’y substituer.
REFERENCES
[1] Sorokin R, J. E. Gottlieb, “Enhancing Patient Safety During Feeding-Tube Insertion: A Review of More Than 2000 Insertions,” Journal of Parenteral and Enteral Nutrition, vol. 30, no. 5, pp. 440–445, 2006.
[2] McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, McCarthy MS, Davanos E, Rice TW, Cresci GA, Gervasio JM, Sacks GS, Roberts PR, Compher C. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN). J Parenter Enter Nutr. 2016;40:159–211.
[3] Chassard D, Boulétreau P, Tournadre JP. Du « bon usage » de la sonde nasogastrique. In: Sfar, editor. Conférences d’actualisation. Congrés national d’anesthésie et de réanimation. Paris: Elsevier; 1998 [p. 489–98].
[4] Kaufman JP, Hughes WB, Kerstein MD (2001) Pneumothorax after nasoenteral feeding tube placement. Am Surg 67:772–773
[5] Psarras et al. Inadvertent insertion of a nasogastric tube into the brain: case report and review of the literature/ Clinical Imaging 36 (2012) 587– 590
[6] Meyer P, Henry M, Maury E, Baudel JL, Guidet B, Offenstadt G. Colorimetric capnography to ensure correct nasogastric tube position. J Crit Care 2009;24:231–5.
[7] Fernandez RS, Chau JPC, Thompson DR, Griffiths R, Lo HS. Accuracy of biochemical markers for predicting nasogastric tube placement in adults - A systematic review of diagnostic studies. Intern J Nurs Studies 2010; 47:1037–46
[8] Metheny NA, Stewart BJ, Smith L, Van H, Diebold M, Clouse RE (1997) pH and concentrations of pepsin and trypsin in feeding tube aspirates as predictors of tube placement. J Parenter Enteral Nutr 21:279– 285
[9] Metheny NA, Stewart BJ, Smith L, Yan H, Diebold M, Clouse RE (1999) pH and concentration of bilirubin in feeding tube aspirates: predictors of tube placement. Nurs Res 48:189–197
[10] Seguin P, Le Bouquin V, Aguillon D, Maurice A, Laviolle B, Malle´dant Y. Evaluation prospective de trois méthodes de positionnement de la sonde nasogastrique en réanimation. Ann Fr Anesth Reanim 2005;24:594–9.
[11] Abords digestifs pour l’alimentation entérale chez l’adulte en hospitalisation et à domicile. ANAES. Service recommandations et références professionnelles. Mai 2000.
[12] Neumann MJ, Meyer CT, Dutton JL, Smith R. Hold that x-ray: aspirate pH and auscultation prove enteral tube placement. J Clin Gastroenterol 1995; 20:293–5.
[13] Frankel HL, Kirkpatrick AW, Elbarbary M, Blaivas M, Desai H, Evans D, Summerfield DT, Slonim A, Breitkreutz R, Price S, Marik PE, Talmor D, Levitov A. Guidelines for the appropriate use of bedside general and cardiac ultrasonography in the evaluation of critically ill patients—part I: general ultrasonography. Crit Care Med. 2015;43:2479– 502
[14] Gok F, Kilicaslan A, Yosunkaya A. Ultrasound-guided nasogastric feeding tube placement in critical care patients. Nutr Clin Pract. 2015;30:257–60.
[15] Vigneau C, Baudel JL, Guidet B, Offenstadt G, Maury E. Sonography as an alternative to radiography for nasogastric feeding tube location. Intensive Care Med. 2005;31:1570–2.
[16] Pillai JB, Vegas A, Brister S. Thoracic complications of nasogastric tube: review of safe practice. Interact Cardiovasc Thorac Surg. 2005;4: 429-433.
[17] Roubenoff R, Ravich WJ. pneumothorax due to nazogastric feeding tubes. Arch Intern Med. 1989;149:184-188
[18] Bankhead R, Boullata J, Brantley S, et al; A.S.P.E.N. Board of Directors. A.S.P.E.N. enteral nutrition practice recommendations. JPEN J
Parenter Enteral Nutr. 2009;33:122-167.
[19] B. Krauss et D. R. Hess, “Capnography for Procedural Sedation and Analgesia in the Emergency Department,” Annals of Emergency
Medicine, vol. 50, no. 2, pp. 172–181, 2007.
[20] Chaney JC (2002) Derdak. Minimally invasive hemodynamic monitoring for the intensivist: current and emerging technology. Crit Care Med 30:2338–2345
[21] H.M. Kim, B.H. So,W. J. Jeong, S.M. Choi, et K.N. Park, “The effectiveness of ultrasonography in verifying the placement of a nasogastric tube in patients with low consciousness at an emergency center,” Scandinavian Journal of Trauma, Resuscitation and Emergency
Medicine , vol. 20, article no. 38, 2012
[22] G. Piton, R. Parel, E. Delabrousse, et G. Capellier, “Echography for nasogastric tube placement verification,” European Journal of Clinical
[23] R. Dâglı, H. Bayır, Y. Dadalı, T. T. Tokmak, and Z. A. Erbesler, “Role of ultrasonography in detecting the localisation of the nasoenteric tube,” Turk Anesteziyoloji ve Reanimasyon Dernegi Dergisi, vol. 45, no. 2, pp. 103–107, 2017.
[24] T. Lin, W. Gifford, Y. Lan et al, “Diagnostic accuracy of ultrasonography for detecting nasogastric tube (NGT) placement in adults: A systematic review and meta analysis,” International Journal of Nursing
Studies, vol. 71, pp. 80–88, 2017.
[25] Law R (2014) Radiographers, ‘‘never events’’ and the nasogastric tube. Radiography 20:1–92
[26] Royal College of Radiologists. Chest X-ray confirmation of nasogastric
tube placement: radiographer responsibility.
http://www.rcr.ac.uk/audittemplate.aspx?PageID=1020&AuditTempla
teID=258. Accessed 6 Jan 2014
[27] N. Metheny, M. McSweeney, M. A. Wehrle, and L. Wiersema, “Effectiveness of the auscultatorymethod in predicting feeding tube location,” Nursing Research , vol. 39, no. 5, pp. 262–267, 1990
[28] W. Maazouzi, Y. Alaoui A, Moussaoui, S. Kabba. Pour vérifier le bon positionnement de la sonde gastrique, un seul test ? Annales Françaises d’Anesthésie et de Réanimation 26 (2006) 263–268
[29] M. Zatelli and N. Vezzali, “4-Point ultrasonography to confirm the correct position of the nasogastric tube in 114 critically ill patients,” Journal of Ultrasound, vol. 20, no. 1, pp. 53–58, 2017.
[30] National Patient Safety Agency (Patienty Safety Alert 2011) Reducing the harm caused by misplaced nasogastric feeding tubes in adults, children
and infants (online). Available from:
http://www.nrls.npsa.nhs.uk/alerts/?entryd45=129640. Accessed 10 Mar 2011
[31] Stroud M, Duncan H, Nightingale J (2003) Guidelines for enteral feeding in adult hospital patients. Gut 52(Suppl VII):vii–vii12
[32] Maruyama K, Shiojima T, Koizumi T: Sonographic detection of a malpositioned feeding tube causing esophageal perforation in a neonate. J Clin Ultrasound 2003, 31:108–110.
[33] Lock G, Reng CM, Ko¨llinger M, Rogler G, Scho¨lmerich J, Schlottmann K (2003) Sonographische Kontrolle von Magensonden bei Intensivpatienten. Intensivmed 40:693–697
[34] H. Chenaitia, P.-M. Brun, E. Querellou et al, “Ultrasound to confirm gastric tube placement in prehospital management,” Resuscitation, vol. 83, no. 4, pp. 447–451, 2012.
[35] Tsujimoto H, Tsujimoto Y, Nakata Y, Akazawa M, Kataoka Y. Ultrasonography for confirmation of gastric tube placement. Cochrane Database of Systematic Reviews 2017, Issue 4. Art. No.: CD012083. [36] P.-M. Brun et al. Contrôle échographique de la position de la sonde
nasogastrique en pré hospitalier/ Annales Françaises d’Anesthésie et de Réanimation 31 (2012) 416–420
[37] Metheny NA, Meert KL, Clouse RE: Complications related to feeding tube placement. Curr Opin Gstroenterol. 2007, 23(2):178–182.