2
Remerciement
A tous mes maîtres Qui nous ont guidés avec
bienveillance, sollicitude et compréhension pour
l’acquisition du savoir nécessaire à l’exercice de notre
profession, nous espérons être dignes de leur confiance
et à la hauteur de ce qu’ils attendent de nous
Veuillez recevoir ici, l’expression de notre
dévouement, de notre reconnaissance et de notre
grande admiration.
3
Résumé
Les performances du test de diagnostic rapide (TDR) du paludisme OptiMal-IT® ont été évaluées à l'Hôpital Militaire d'Instruction Mohammed V de Rabat où les cas étudiés ont été du type du Paludisme importé.
La microscopie a été prise comme méthode de diagnostique de référence. L’inclusion des patients fébriles venus en consultation aux urgences de l'hôpital, s’est déroulée de Mars 2018 à Novembre 2018 et d’août. Au total, 102 patients ont été inclus dont la totalité avaient à la fois un résultat de TDR et de goutte épaisse.
La lecture des 102 lames, dont 50 étaient positives, a décelé P. falciparum ou P. ovale dans
les proportions respectives de 46 % (23/50) et 40 % (20/50), et la co-infection P. falciparum/P. ovale a représenté 2 % (1/50) ainsi que la co-infection P. falciparum/P.
malariae 2% (1/50). Il a été difficile d'identifier l'espèce dans 10 % (5/ 50)des lames positives.
Les valeurs prédictives positives (VPP) et négatives (VPN) étaient de 100 % [86,3-100] et 64,2 % [53,5-74,5].
Les valeurs diagnostiques trouvées étaient comparables à celles généralement rapportées pour les VPP, mais diminuées pour les VPN.
L'utilisation de TDR seul comme un outil du diagnostic du paludisme, en remplaçant la goutte épaisse et le frottis sanguin reste un sujet à discuté.
4
Sommaire
INTRODUCTION ... 8 REVUE DE LITTERATURE ... 10 1-Généralités ... 10 2-Épidémiologie ... 10 2.1-Agents pathogènes : ... 102.2-Vecteur et modes de transmission : ... 11
2.3-Cycle parasitaire ... 11 2.4-Répartition géographique ... 12 3-Clinique ... 13 3.1-Paludisme simple ... 13 3.2-Paludisme grave ... 13 4-Diagnostic ... 14
4.1-Goutte épaisse et frottis sanguin: ... 14
4.2-Test de diagnostic rapide (technique immunochromatographique): ... 17
PATIENTS ET METHODES ... 20 1-Objectif ... 20 2-Plan expérimental ... 20 3-Critères d'exclusion: ... 20 4-Méthodologie ... 20 5-Prélèvement : ... 21
6-Test de référence: examen microscopique (GE et FSM) ... 21
7-TDR "OptiMal-IT": ... 22
8-Détermination des performances diagnostiques ... 24
RESULTATS ... 26
1-Prévalence du paludisme dans la population d'étude ... 26
2-Prévalence des espèces identifiées par l'examen microscopique ... 26
3-Résultats du TDR ... 27
4-Performance diagnostiques du test OptiMal-IT® par rapport à la GE (Technique de référence) ... 27
5
DISCUSSION ... 30
1-Prévalence ... 30
2-Comparaison du TDR à la méthode de référence ... 30
2.1-Par rapport au principe de la technique ... 30
2.2-Par rapport à la manipulation pratique ... 31
2.4-Par rapport aux performances diagnostiques... 31
CONCLUSION ... 33
6
LISTE DES TABLEAUX
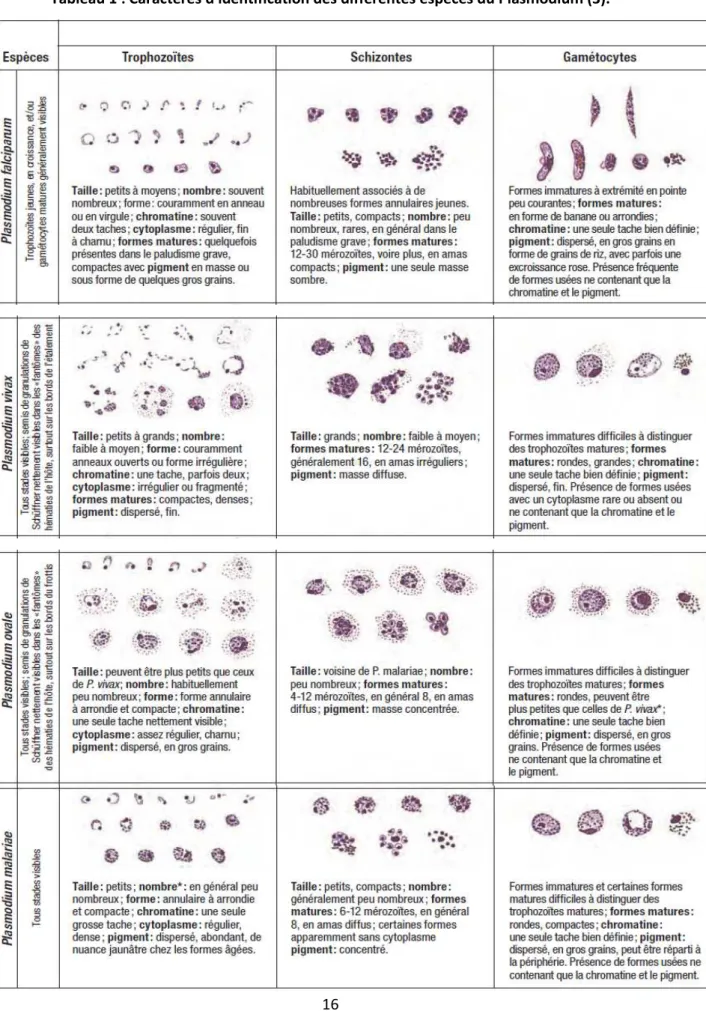
Tableau 1 : Caractères d'identification des différentes espèces du Plasmodium (3). 8 Tableau 2 : Protéines plasmodiales associées au diagnostic des différentes espèces du
Plasmodium (4) 9
Tableau 3 : Prévalence du paludisme par les deux méthodes 16
Tableau 4 : Résultats de la goutte épaisse 16
Tableau 5 : Nombre de résultats positifs par rapport à la parasitémie. 16
Tableau 6 : Résultats TDR 17
Tableau 7 : Résultats croisés du TDR par rapport à la goutte épaisse 17 Tableau 8 : Sensibilité, spécificité et valeurs prédictives du TDR (Toutes les espèces) 17 Tableau 9 : Paramètres de performance TDR vis à vis le P.falciparum 18
LISTE DES FIGURES
Figure 1 : Cycle Biologique de Plasmodium spp 4
Figure 2 : Principe d’un test de détection antigénique 10
Figure 3 : Schéma d'une cassette TDR OptiMal-IT 13
7
Liste des abréviations
EDTA: Acide éthylènediaminetétra acétique FN: Faux négatif
FP: Faux positif FS: Frottis sanguin GE: Goutte épaisse
HRP: Histidine Rich Protein MGG: May-Grünwald Giemsa
OMS: Organisation mondiale de la santé
pfLDH: Plasmodium falciparum lactate déshydrogénase pLDH: Plasmodium lactate déshydrogénase
TDR : Test Diagnostic Rapide VN: Vrai négatif
VP: Vrai positif
VPN: Valeur prédictive négative VPP: Valeur prédictive positive
8
INTRODUCTION
Le paludisme ou Malaria représente un problème de santé publique mondial, près de la moitié de la population mondiale est exposée au risque de contracter la maladie. Au niveau mondial, l’incidence du paludisme a reculé entre 2010 et 2018, passant de 71 cas pour 1 000 habitants exposés au risque de paludisme à 57 pour 1 000. Néanmoins, cette baisse a considérablement ralenti entre 2014 et 2018, l’incidence ayant diminué à 57 pour 1 000 en 2014 pour rester à un niveau similaire jusqu’en 2018 (1).
Le Maroc fut déclaré comme pays indemne de paludisme en 2010 par l'OMS, vu qu’aucun cas de paludisme autochtone n’avait été déclaré depuis 2005. Mais on y enregistre toujours des cas de paludisme d'importation.
Le diagnostic biologique de l’infection repose toujours sur des moyens microscopiques de mise en évidence des parasites à l’examen direct, sur frottis sanguin mince et par des techniques de concentration comme la goutte épaisse (GE).
En utilisation de routine, le frottis mince est de réalisation aisée, mais il est peu sensible. La goutte épaisse est sensible et bon marché, mais reste de réalisation longue et d’interprétation délicate. Elle est peu compatible avec l’urgence et requiert, comme le frottis sanguin, une grande compétence de l’opérateur.
Les limitations de ces techniques, associées au besoin de tests rapides et facilement utilisables sur le terrain par des médecins non biologistes, ont justifié l’apparition de nouvelles trousses de diagnostic permettant le diagnostic des infections palustres par la recherche d’antigènes parasitaires dans le sang des malades. Les premières trousses commercialisées permettaient la mise en évidence de l’antigène HRP2 par immunochromatographie sur bandelette. Plus récemment, est apparu des tests immuno-chromatographiques sur bandelette permettant le diagnostic de l’infection à Plasmodium falciparum ainsi que celui de l’infection par autres espèces plasmodiales, mais sans permettre de les distinguer. Ce test est basé sur la mise en évidence les lactates deshydrogénases parasitaires (pLDH) communes à toutes les espèces (Plasmodium
9
falciparum, Plasmodium vivax, Plasmodium ovale et Plasmodium malariae) couplée à celle d’une isoforme spécifique de Plasmodium falciparum.
A ce jour de nombreuses études ont été publiées sur l'évaluation des performances des Tests de Diagnostic Rapide (TDR) à travers le monde avec des résultats très variables selon les fabricants, les contextes, les régions et les populations d'études.
Le but de ce travail est d'évaluer un test de diagnostic rapide (OptiMal-IT) dans le diagnostic des accès palustres d'importation au laboratoire de Parasitologie Mycologie de l'Hôpital Militaire d'Instruction Mohamed V de rabat.
10
REVUE DE LITTERATURE
1-Généralités
Le paludisme encore appelé malaria est la maladie infectieuse à transmission vectorielle la plus répondue au monde. Elle est essentiellement présente dans les régions chaudes tropicales d'Afrique, d'Amérique latine et d'Asie où les conditions climatiques sont favorables au développement des anophèles le vecteur du Plasmodium spp.
En 1961, le Maroc s’est engagé dans un programme de pré-éradication avec l’OMS, Le Maroc fut déclaré comme pays indemne de paludisme en 2010 par cette dernière, vu qu’aucun cas de paludisme autochtone n’avait été déclaré depuis 2005. Le risque de la réapparition du paludisme autochtone n'est pas écarté, vu la persistance des facteurs favorisants le développement du moustique vecteur.
Le Maroc comme d’autre pays où le paludisme autochtone a été éradiqué reste toujours confronté à un autre type de paludisme dit « d’importation ».
2-Épidémiologie
2.1-Agents pathogènes :
Le paludisme est transmis par un protozoaire appartenant au genre Plasmodium. Il existe de très nombreuses espèces de Plasmodium, plus de 140, mais seulement cinq sont incriminées en pathologie humaine.
Plasmodium falciparum, responsable des formes cliniques graves, notamment du neuropaludisme.
Plasmodium ovale Il provoque une fièvre tierce bénigne. Son évolution n'est pas grave mais on peut observer des rechutes tardives.
Plasmodium vivax L’affection par P.vivax est classiquement considérée comme bénigne, mais en zone d'endémie il peut avoir des répercussions graves sur l'état de sante des populations, notamment par l'intermédiaire des anémies chez l'enfant. De plus on commence à voir survenir quelques résistances médicamenteuses à la chloroquine.
11
Plasmodium malariae : présente une répartition plus clairsemée grossièrement superposable à celle de P. falciparum. Il est responsable de la fièvre quarte et d’accès même après un très long délai
Plasmodium knowlesi : Il se différencie des autres espèces par un cycle érythrocytaire de 24 heures responsable d'une fièvre quotidienne. Il existe de rares formes graves, voire mortelles, avec forte parasitémie. A ce jour aucune chimiorésistance n'a été observée pour cette espèce.
2.2-Vecteur et modes de transmission :
Le paludisme est transmis à l’homme par la piqure d’un moustique du genre Anopheles au moment de son repas sanguin. Seule la femelle, hématophage, transmet la maladie. Elle ne pique qu’à partir du coucher du soleil avec un maximum d’activité entre 23 heures et 6 heures. Cela explique que l’utilisation des moustiquaires est le moyen de prévention individuelle le plus efficace.
La phase sanguine du cycle rend possible d'autres modes de contamination : transmission congénitale, transfusionnelle, par greffe d'organe ou transmission accidentelle chez des personnels de sante manipulant du sang contamine. En pratique ces transmissions sont tout à fait exceptionnelles et n'influencent pas l'épidémiologie.
Figure 1
Le cycle se déroule successivement c (phase sexuée).
Chez l'homme le cycle est lui
- la phase hépatique ou pré
correspond a la phase d'incubation, cliniquement asymptomatique.
- la phase sanguine ou érythrocytaire : elle correspond à la phase clinique de la maladie.
2.4-Répartition géographique
Le Paludisme est une affection cosmopolite; cependant, c'est une endémie majeure dans les zones tropicales chaudes de l'Afrique, d'Amériqu
comme suit :
12
Figure 1 : Cycle Biologique de Plasmodium spp
Le cycle se déroule successivement chez l'homme (phase asexuée) et chez l'
Chez l'homme le cycle est lui-même divisé en 2 phases :
la phase hépatique ou pré-érythrocytaire (= exo-érythrocytaire) : elle correspond a la phase d'incubation, cliniquement asymptomatique.
la phase sanguine ou érythrocytaire : elle correspond à la phase clinique de la
Répartition géographique
Le Paludisme est une affection cosmopolite; cependant, c'est une endémie majeure dans les zones tropicales chaudes de l'Afrique, d'Amérique et d'Asie. Les 5 espèces réparties (phase asexuée) et chez l'anophèle
érythrocytaire) : elle correspond a la phase d'incubation, cliniquement asymptomatique.
la phase sanguine ou érythrocytaire : elle correspond à la phase clinique de la
Le Paludisme est une affection cosmopolite; cependant, c'est une endémie majeure e et d'Asie. Les 5 espèces réparties
13
- P. falciparum: Afrique, Asie du sud, Amérique Centrale et du Sud (la plus fréquente)
- P.vivax: Bassin Méditerranéen, Madagascar, toute l’Asie, Amérique Centrale et du Sud
- P.ovale: Afrique Centrale et Occidentale
- P.malariae: Afrique Centrale, Amérique Centrale et du Sud
- P. knowlesi: Asie du Sud-Est (zoonose > hôte habituel : singe macaque)
On distingue :
- Paludisme autochtone : accès chez quelqu'un qui n’a pas voyagé en zone d’endémie depuis >1 an
- Paludisme d’importation : voyage en zone d’endémie avec accès au retour au pays d’origine.
3-Clinique
3.1-Paludisme simple
Se manifeste par une triade successive frissons - chaleur - sueur accompagnés de fièvres périodiques (Tierce ou quarte). Dans la pratique, d'autre signes peuvent accompagnés la fièvre: Céphalées, courbatures, myalgies, troubles digestifs...
En absence de traitement deux évolutions sont possibles: Splénomégalie et anémie ou alors en cas de P.falciparum, le passage vers un tableau critique (le paludisme grave).
3.2-Paludisme grave
Le paludisme à P.falciparum du sujet non immun (jeune enfant en zone d'endémie, femme enceinte, expatrie, voyageur) est potentiellement mortel. Il peut prendre différentes formes cliniques dont la plus importante est l'atteinte cérébrale.
Selon l'OMS (2006), on parle de paludisme grave lorsqu'un malade avec une parasitémie des formes asexuées de P.falciparum, présente une ou plusieurs caractéristiques cliniques ou biologiques suivante:
14
-Manifestations cliniques: Prostration, troubles de conscience, Détresse respiratoire; convulsions multiples, collapsus cardio-vasculaire; œdème pulmonaire, saignement anormal, hémoglobinurie, IR.
-Signe biologiques: anémie sévère, hypoglycémie, acidose, hyperlactatémie, ictère. L’infection palustre peut entrainer, de manière directe ou indirecte d’autres complications, notamment le paludisme viscéral évolutif, la splénomégalie palustre hyper réactive et la fièvre bilieuse hémoglobinurique.
4-Diagnostic
Repose d'abord sur des éléments d'orientation épidémiologiques et cliniques
● Épidémiologie: Notion de séjour en zone d'endémie (lieu, type et durée de séjour), origine du patient...
● Clinique: fièvre, céphalées, troubles digestifs, ictère...
● Signes biologiques non spécifiques: anémie hémolytique, thrombopénie, hyperleucocytose, syndrome néphrotique...
Le diagnostic biologique est une urgence. Les résultats doivent être rendus dans un délai maximum de 2 heures. Ce diagnostic fait appel aux :
● Techniques directes (examen microscopique): Goutte épaisse et frottis sanguins. C'est la méthode de référence.
● Techniques indirectes: détection d'antigène (immunochromatographie sur bande) ou détection de gènes par amplification génique (PCR traditionnelle, PCR quantitative).
4.1-Goutte épaisse et frottis sanguin:
La GE permet la concentration du parasite sur une surface de moins de 1 cm2. Le prélèvement est réalisé au niveau de l’annulaire, la goutte de sang est par la suite étalée sur la lame. Des mouvements d’étalement circulaires doivent être répétés plusieurs fois pour défibriner la préparation si le prélèvement est capillaire. Si le prélèvement est veineux, il doit être recueilli dans un tube contenant l’anticoagulant, de préférence l’EDTA. Dans ce cas il suffit d’étaler la goutte du sang sans la défibriner.
15
Après séchage, la lame est trempée dans un flacon contenant l’eau ou mieux une solution hémolysante et fixante à base de saponine, de méthanol et de formaldéhyde. Cette solution permet une déshémoglobinisation rapide sans qu’il y ait un détachement de la couche fine blanchâtre qui persiste sur la lame et qui est censée contenir d’éventuels éléments parasitaires. La coloration se fait par le Giemsa ou May-Grünwald Giemsa (MGG) et la lecture se fait à l’huile à immersion au grossissement x1000.
Le seuil de détection est de 10 à 20 parasites/microlitre, la sensibilité de l’ordre de 90 % et la spécificité de 80 % (2).
Le frottis sanguin consiste tout d’abord à étaler une petite goutte de sang sur une lame. Après séchage, comme pour la goutte épaisse, la coloration se fait par le Giesma ou MGG. Des kits de coloration rapides permettent d’obtenir la coloration en quelques minutes.
La sensibilité de cette technique est de 100 à 300 parasites par microlitre, moins bonne que celle de la goutte épaisse (2). Cependant elle présente l’avantage de ne pas lyser les hématies, ce qui permet d’observer leur aspect qui est fondamentale pour l’identification de l’espèce plasmodiale. Le frottis sanguin permet aussi de calculer le taux de parasitémie en pourcentage (nombre des hématies parasitées parmi 100 hématies).
16
17
4.2-Test de diagnostic rapide (technique immunochromatographique):
Les TDR sont des tests immunochromatographiques qui combinent des propriétés immunologiques basées sur la reconnaissance anticorps-antigènes et la chromatographie sur un test de diagnostic.
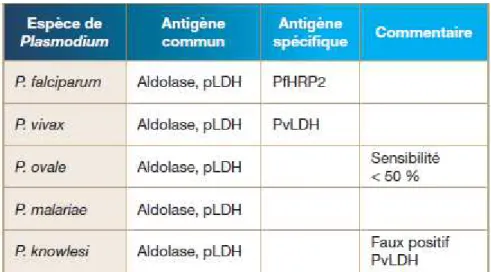
Ils détectent des protéines synthétisées par les plasmodiums, soit spécifiques d’une seule espèce, soit communes à plusieurs espèces (Tableau 2).
Protéines pan-plasmodiales
L'aldolase: C’est une enzyme clé du cycle du glucose, commune aux cinq espèces de Plasmodium. Cet antigène commun aux cinq espèces de Plasmodium est une cible détectée par certains tests de diagnostic rapide combinée à la recherche de l’antigène PfHPR2. De nombreuses études ont montré sa capacité de détecter P.falciparum et P. vivax mais sa réactivité est fréquemment en défaut avec P.ovale alors que sa sensibilité est modérée dans la détection de P. malariae (5).
Le pLDH: La Plasmodium lactate déshydrogénase (pLDH) est une enzyme présente chez tous les Plasmodiums. Cette enzyme qui est la dernière enzyme impliquée dans le cycle du glucose, est synthétisée par les stades érythrocytaires asexués et par les gamétocytes.
Il a été démontré que P.falciparum, P.malariae, P.ovale et P.vivax synthétisent des isoformes de pLDH avec des épitopes propres à chaque espèce et des épitopes communs aux différentes espèces. La pLDH est produite par les parasites viables, par conséquent sa recherche peut être utilisée pour suivre l’efficacité d’un traitement anti-malarique.
Protéines spécifiques d'une espèce plasmodiale:
Les hématies infectées par P.falciparum synthétisent plusieurs protéines riches en histidine. Au moins trois protéines, dénommées PfHRP1, PfHRP2 et PfHRP3 dans l’ordre de leur découverte, sont produites par les stades sanguins du parasite. Parmi ces trois protéines, c'est la PfHRP2 qui est utilisée dans le diagnostic du paludisme par des tests de diagnostic rapide ou par ELISA.
18
Tableau 2 : Protéines plasmodiales associées au diagnostic des différentes espèces du Plasmodium (4)
Principe:
En général, il s'agit de membranes en plastique sur lesquelles ont été fixés les anticorps spécifiques des antigènes à détecter (zone de réaction). En cas de présence des Ag dans le sang, ils seront fixés par les Ac combinés à une poudre colorée (Conjugué) avant d'être entrainée grâce à un tampon le long de la membrane en plastique. Au passage sur la zone de réaction, les complexes Ag-Conjugué se fixent aux Ac spécifiques, d'où l'apparition d'un trait coloré. L'excédent de conjugué poursuit son parcours jusqu'à la zone contrôle où, il se fixe formant un deuxième trait rouge.
Figure 2
19
20
PATIENTS ET METHODES
1-Objectif
L'objectif de cette étude est d'évaluer des performances diagnostiques d'un test de diagnostic rapide (TDR): OptiMal-IT®.
C'est un test immunochromatographique utilisant des anticorps monoclonaux dirigés contre l’enzyme métabolique pLDH (lactate déshydrogénase du parasite) de Plasmodium spp.
Ces anticorps monoclonaux correspondent à deux groupes: ● un anticorps spécifique pour Plasmodium falciparum,
● un anticorps monoclonal pan-spécifique réagissant avec les quatre espèces de Plasmodium responsables du Paludisme chez l’homme: P. falciparum, P. vivax, P. ovale, P. malariae.
2-Plan expérimental
Il s'agit d'une étude d'évaluation des performances diagnostiques d'un TDR sur les prélèvements des patients de retour de zones d'endémie palustre et se présentant avec une suspicion d'accès palustre au service des urgences de l'hôpital Militaire d'Instruction Mohamed V de Rabat.
L'étude s'étale sur une période de 10 mois (entre Mars 2018 et Novembre 2018).
3-Critères d'exclusion:
Seuls les patients suspectés avoir un accès palustre de primo-invasion sont inclus (OptiMal-IT® détecte la pLDH uniquement quand les parasites sont vivants, les patients sous traitement paludique peuvent avoir un TDR négatif et une GE positive).
4-Méthodologie
L'ensemble des prélèvements reçus au laboratoire de Parasitologie de l'hôpital Militaire Mohamed V de Rabat, dans le cadre d'un diagnostic de cas suspectés avoir un
21 accès palustre, bénéficient des 2 types de tests.
5-Prélèvement :
Sang total prélevé par ponction veineuse dans un tube EDTA. Aucun prélèvement n’a été effectué sur tube capillaire.
6-Test de référence: examen microscopique (GE et FSM)
Un cas positif de paludisme est défini par la présence sur la goutte épaisse de stades asexués de Plasmodium. Le frottis sanguin mince doit préciser l'espèce(s) et la parasitémie.
Le résultat doit être rendu dans les deux heures qui suivent la demande.
Le test de référence est considéré comme positif si la goutte épaisse est positive. Goutte épaisse
Dépôt de quelques microlitres du sang sur une lame
Étalement avec un mouvement circulaire sur 1 cm de diamètre (le sang veineux n'a pas besoin d'être défibriner)
Séchage : pendant quelques minutes à l'étuve à 37 °C. Ne jamais fixer à la chaleur ou à l'alcool.
Déshémoglobinisation : en trempant la lame dans une solution hémolysante (à base de saponine), laisser agir pendant 3 à 5 minutes jusqu'à hémolyse complète. Fixer ensuite à l'alcool méthylique.
Coloration à May-Grünwald Giemsa (MGG) 10 %. Frottis Sanguin
Étalement d'une petite goutte de sang sur une lame à laide d’une autre lame inclinée à 45°.
Après séchage, la coloration se fait par coloration classique au Giemsa, au MGG ou par des kits de coloration rapides.
22 Lecture des lames
Lecture au grossissement 1000 à l'immersion pendant au moins 20 min, par un biologiste. On a effectué une double ou triple lecture des lames dans un but de réduire les erreurs de lecture.
La positivité du prélèvement est déterminée par la goutte épaisse.
L'identification de l'espèce et la détermination de la parasitémie sont réalisées à l'aide du frottis mince.
Les parasitémies sont calculées en rapportant le nombre des parasites observés par au moins 10 champs sur le frottis mince au nombre de globules rouges et ont été également exprimées en parasites/μl.
7-TDR "OptiMal-IT":
Pour réaliser le test nous avons suivi les étapes et les recommandations décrites sur la notice.
Le protocole de réalisation du test est le suivant : 1 goutte de sang total du patient à tester est mélangée dans une coupelle avec 2 gouttes d’une solution de tampon qui permet la lyse érythrocytaire et la libération des pLDH. Des anticorps marqués se fixent alors sur les pLDH libérées. La bandelette réactive est ensuite mise à tremper dans la coupelle afin de permettre la migration de l’échantillon.
Après 10 à 15 min, la bandelette est lavée par capillarité à l’aide de 4 gouttes de tampon.
23
Figure 3 : Schéma d'une cassette TDR OptiMal-IT ● Interprétation des résultats:
Validation du test: Le résultat est valide si
✓
la bande de contrôle est bien visible. ✓
il n’y a plus de sang dans la zone de réaction. Le résultat n'est pas valide si:
✓ la bandelette est insuffisamment lavée (la zone de réaction reste rouge) ✓
la bande de contrôle n’apparaît pas. ✓
la bande de contrôle n’est pas visible, même si une bande de diagnostic ou les deux apparaissent.
✓ la bande de contrôle et la bande «Pf» (P.falciparum) sont présentes, mais la bande «P» n’apparaît pas.
Seuls les tests avec un résultat valide sont inclus dans l'étude. Interprétation de la réaction selon le fabricant:
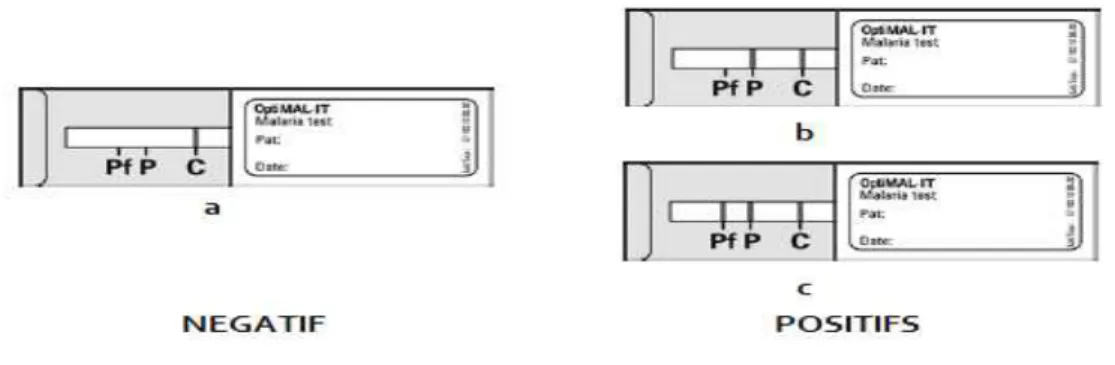
24
Figure 4 : Interprétation du TDR (OptiMal-IT) (a) Réaction négative: Pas de pLDH détectable dans l'échantillon.
Réaction positive: la pLDH présente dans l'échantillon réagit avec le conjugué pLDH et migre sur la bandelette où elle sera capturée par un ou les deux anticorps anti-pLDH spécifiques:
(b) Positif pour P.vivax, P.malaiae ou P.ovale, et négatif our P.falciparum
(c) Positif pour P.falciparum (la possibilité d'une coïnfection par les 3 autres espèces ne peut pas être exclue)
8-Détermination des performances diagnostiques
Sensibilité
Elle est déterminée sur une population de patients dont on sait qu'elle est porteuse de la maladie, suite à un diagnostic par un test de référence (Goutte épaisse dans notre étude).
Elle est définie par la proportion % des vrais positifs (VP). Spécificité
Elle est déterminée sur une population de patients dont on sait qu'elle n'est pas porteuse de la maladie, suite à un diagnostic par un test de référence.
Elle est définie par la proportion % des vrais négatifs (VN). Valeur prédictive positive (VPP)
C'est la probabilité d'avoir la maladie en cas de test positif. Elle est donnée par le rapport des vrais positifs sur l'ensemble des tests positifs.
25 VPP% = VP*100/VP+FP
Valeur prédictive négative (VPN)
C'est la probabilité de ne pas avoir la maladie en cas de test négatif. Elle est donnée par le rapport des vrais négatifs sur l'ensemble des tests négatifs.
26
RESULTATS
La présente étude a inclus 102 patients. Pour chaque patient on a réalisé une goutte épaisse et un test rapide OPTIMAL-IT®, en effet les deux méthodes ayant été exécutées parallèlement.
Sur les 102 cas 96 % (n = 98) étant de sexe masculin et 3% (n= 4) avec un sexe ration H/F de 24.5.
La moyenne d'âge des sujets inclus dans cette étude est de 31 ± 2 ans.
1-Prévalence du paludisme dans la population d'étude
Prévalence Nombre de positifs 49% 50 Goutte épaisse 20.6 % 21 TDR (OptiMal-IT®)
Tableau 3 : Prévalence du paludisme par les deux méthodes
2-Prévalence des espèces identifiées par l'examen microscopique
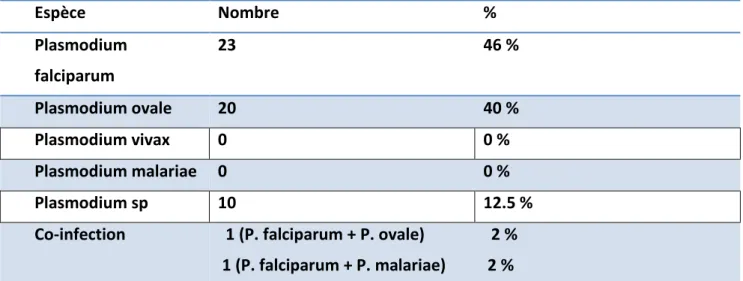
Les pourcentages sont donnés par rapport au nombre des résultats positifs pour chaque méthode: % Nombre Espèce 46 % 23 Plasmodium falciparum 40 % 20 Plasmodium ovale 0 % 0 Plasmodium vivax 0 % 0 Plasmodium malariae 12.5 % 10 Plasmodium sp 2 % 2 % 1 (P. falciparum + P. ovale) 1 (P. falciparum + P. malariae) Co-infection
27 OptiMal-IT Positifs GE positive Parasitémie estimée par microscopie 0 1 < 100 parasites /μl 21 49 >100 parasites /μl
Tableau 5 : Nombre de résultats positifs par rapport à la parasitémie.
NB: 100 parasites /μl est le seuil de détection des parasites défini par le fabricant de l'OptiMal-IT.
3-Résultats du TDR
16 cas (76 % des TDR +) Réaction positive avec protéines
spécifique du P.falciparum
5 cas (24% des TDR +) Réaction positive avec pan-protéines
uniquement (P.vivax, P.ovale. P.malariae)
Tableau 6 : Résultats TDR
4-Performance diagnostiques du test OptiMal-IT® par rapport à la
GE
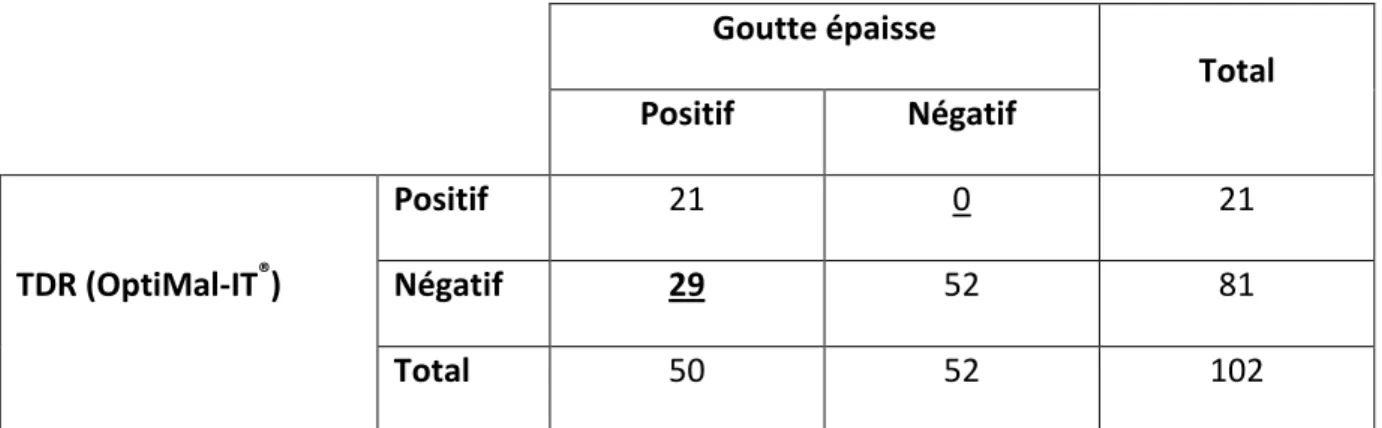
(Technique de référence) Goutte épaisse Total Positif Négatif TDR (OptiMal-IT®) Positif 21 0 21 Négatif 29 52 81 Total 50 52 10228
Par rapport à la GE considérée comme technique de référence, nous avons observé 29 faux négatifs (TDR - / GE +).
Aucun test faux positif n'a été noté.
•
Sensibilité et spécificité du test OptiMal-IT
®:
IC 95% Résultats Formules Paramètres de performance du TDR 28.3% - 55.7% 42 % 21*100/50 Sensibilité 94.2 % - 100% 100 % 52*100/52 Spécificité 86,3 % - 100 % 100 % 21*100/21 Valeur Prédictive Positive (VPP) 53.5 % - 74.5 % 64.2 % 52*100/81 Valeur Prédictive Négative (VPN)
29
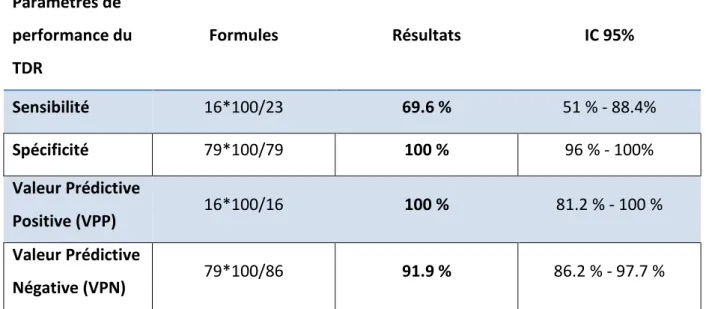
Tableau 9 : Paramètres de performance TDR vis à vis le P.falciparum
L’OptiMal-IT s’avère relativement moins performant pour la détection des espèces autres que P.falciparum. Il est positif dans 16 des 23 cas d’infection par P.falciparum, alors qu'il n'est positif que dans 4 des 20 cas d’infection par Plasmodium ovale.
IC 95% Résultats Formules Paramètres de performance du TDR 51 % - 88.4% 69.6 % 16*100/23 Sensibilité 96 % - 100% 100 % 79*100/79 Spécificité 81.2 % - 100 % 100 % 16*100/16 Valeur Prédictive Positive (VPP) 86.2 % - 97.7 % 91.9 % 79*100/86 Valeur Prédictive Négative (VPN)
30
DISCUSSION
1-Prévalence
En tant que test de référence, nous avons considéré que la spécificité de la GE était par définition absolue. Cette référence est valide en ce qui concerne la comparaison avec les TDR (2).
Les cas positifs retrouvés (50 sujets) ont été répartis majoritairement entre deux espèces P.falciparum et P.ovale avec des pourcentages, respectivement, de 46 % et 40 %. Même si, le P.falciparum était l’espèce prédominante au Maroc, le P.ovale est de plus en plus incriminé. Ceci serait dû à la prise de la chimioprophylaxie qui est d’ailleurs moins efficace sur le P.ovale comparativement au P.falciparum.
Deux sujets avec une coïnfection ont été rencontrés (P.falciparum + P.ovale et P.falciparum + P.malaria). Aucun cas de P.vivax n'a été diagnostiqué durant cette étude.
2-Comparaison du TDR à la méthode de référence
2.1-Par rapport au principe de la technique
Les deux méthodes de diagnostic n'exploraient pas les mêmes caractéristiques du Plasmodium.
L'examen microscopique consiste en l'étude des caractéristiques morphologiques par observation microscopique du Plasmodium, alors que le TDR se base sur la détection antigénique, grâce à une réaction immuno-chromatographique.
L'association goutte épaisse et frottis mince, permet d'identifier les différentes espèces Plasmodiales, ainsi que toutes les formes parasitaires (trophozoïtes et gamétocytes). Elle permet également d'estimer la parasitémie, alors que le TDR ne permet pas l'identification d'une autre espèce que P.falciparum, ni la mise en évidence d'une coïnfection.
31
2.2-Par rapport à la manipulation pratique
L'outil pour la réalisation des TDR est simple. Le temps pour rendre un résultat est beaucoup moins long qu'en cas de l'examen microscopique (varie entre 20 et 30 minutes). Il répond donc à l'urgence du diagnostic.
2.4-Par rapport aux performances diagnostiques
* La sensibilité évalue la capacité d'un test à détecter les vrais positifs et par conséquent à exclure les faux négatifs. Elle a été estimée dans la présente étude en prenant compte de toutes les espèces à 42 %, elle se situe à une valeur très basse par rapport aux valeurs rapportées dans la littérature, qui prouvaient une sensibilité supérieure à 80 % dans la plupart des études. En effet, une étude rétrospective (6) regroupant 17 évaluations du test OptiMal (8 réalisées en Afrique, 8 en Asie et 1 en Amérique du Sud), montre que l’IC 95 % (Indice de confiance 95%) de la sensibilité de ce TDR est compris entre [84,7%-95,3%] et [96,9-99,5]. Une étude réalisée en Mauritanie (7), a montré une sensibilité de 89 % avec un IC 95% [84,7 %-93,3%].
Concernant cette faible sensibilité dans notre série, dans 96 % des faux négatifs la parasitémie est supérieure à 100 parasites / μl, qui est le seuil de détection donné par le fabricant. Donc on ne peut pas lier cette sensibilité diminuée à une faible parasitémie.
Ce résultat peut être dû à plusieurs raisons:
✓ Altération du kit du TDR suite à une mauvaise conservation (thermostabilité). ✓ Erreurs de manipulation.
✓ Manque de renseignements cliniques et thérapeutiques (le test ne détecte que les formes parasitaires vivantes qui sécrètent la pLDH).
• Sensibilité par rapport au P.falciparum :
L’étude de la valeur diagnostique de l’OptiMal-IT pour la détection de P.falciparum montre une sensibilité de 69.6 % avec un IC 95% qui varie entre 51 % et 88.4 %.
• La spécificité mesure la capacité d'un test à détecter les vrais négatifs et donc exclure les faux positifs.
32
Selon les recommandations de l'OMS pour le choix d'un TDR le pourcentage des faux positifs ne doit pas dépasser 10% (2).
Cette étude a confirmé que l'OptiMal-IT® ne manque pas de spécificité. Elle a été chiffrée à 100% avec un IC 95% de 94.2 % - 100 %; pour toutes les espèces et un IC 95% de 96 % - 100% pour le P.falciparum.
Des facteurs liés à la parasitémie (8,9), au rhumatisme (10) et à la non-observance des normes techniques définies par le fabricant du TDR peuvent être à l’origine de faux positifs.
Il est important de rechercher les raisons d’apparition des faux positifs afin de les limiter. L’altération de la qualité intrinsèque du TDR suite à une mauvaise conservation n’est pas à exclure, des auteurs ont montré une variabilité des performances des TDR en fonction des saisons et en fonction de différents lots d’une même zone.
La Valeur prédictive positive (VPP) et la valeur prédictive négative (VPN) sont respectivement à 100 % et à 61%. La VPN pour le P.falciparum seul est beaucoup plus élevée que celle pour toutes les espèces, elle est estimée à 91.7 %.
Cette étude a prouvé que l'OptiMal-IT a une meilleure performance pour le diagnostic du P.falciparum par rapport au P.ovale. Contrairement à une étude effectuée en France dans un cadre de l'évaluation de ce test, où il a montré une sensibilité inférieure pour le P.falciparum par rapport aux autres espèces (11).
33
CONCLUSION
Les TDR sont d’utilisation facile et donnent des résultats simples relativement à interpréter, avec un rendu des résultats possible en moins de 30 minutes.
Au terme de la présente étude, nous avons trouvé que les performances de l'OptiMal-IT® pour la mise en évidence d'un accès palustres à P.falciparum comparées à celles de la goutte épaisse, ont été jugées insatisfaisantes. Ces résultats peuvent être liés à plusieurs raisons notamment les conditions de conservation, la bonne manipulation par les opérateurs et la prise médicamenteuse antipaludiques. Des investigations plus poussées sont nécessaires pour identifier ces raisons.
Vu sous cet angle, nous ne pouvons pas suggérer leur utilisation à l'hôpital en pratique quotidienne. La goutte épaisse associée au frottis sanguin mince reste la méthode à choix pour diagnostiquer un accès palustre.
34
REFERENCES
[1]. OMS (2019) Le Rapport sur le paludisme dans le monde 2019 [en ligne].
[2]. Diagnostic microscopique du paludisme : manuel d’assurance qualité - version 2 [Malaria microscopy quality assurance manual – version 2]. Genève : Organisation mondiale de la Santé ; 2017. Licence : CC BY-NC-SA 3.0 IGO.
[3]. DIAGNOSTIC MICROSCOPIQUE DU PALUDISME Techniques de base pour le Partie I. Guide du stagiaire. Organisation Mondiale de Santé 2014.
[4]. Houzé S, Paris L. Apport des tests de diagnostic rapide en parasitologie: intérêt et limites. Revue Francophone des Laboratoires 2015 ; 2015(474): 29-36.
[5]. Houzé S, Boutron I, Marmorat A, et al. Performance of rapid diagnostic tests for imported malaria in clinical practice: results of a national multicenter study. PLoS One 2013;8(9):e75486. doi: 10.1371/journal.pone.0075486. eCollection 2013.
[6]. Abba K, Deeks JJ, Olliaro P, et al (2011) Rapid diagnostic tests for diagnosing uncomplicated P. falciparum malaria in endemic countries. Cochrane Database Syst Rev (7):CD008122
[7]. BA, H., AHOUIDI, A. D., DUFFY, C. W., et al. Evaluation du test de diagnostic rapide du paludisme OptiMal-IT® pLDH à la limite de la distribution de Plasmodium falciparum en Mauritanie. Bulletin de la Société de pathologie exotique, 2017, vol. 110, no 1, p. 31-37.
[8]. Diarra A, Nébié I, Tiono A, et al (2012) Seasonal performance of a malaria rapid diagnosis test at community health clinics in a malaria-hyperendemic region of Burkina Faso. Parasit Vectors 5:103
[9]. Heutmekers M, Gillet P, Maltha J, et al (2012) Evaluation of the rapid diagnostic test Care Start pLDH malaria (pf-pldh/pan-pldh) for the diagnosis of malaria in a reference setting. Malar J 11:204
[10]. Laferi H, Kandel K, Pichler H (1997) False Positive Dipstick Test for Malaria. N Engl J Med 337(22):1635–6
35
[11]. HERNANDEZ, E., DE PINA, J. J., FABRE, R., et al. Evaluation du test OptiMAL dans le diagnostic des accès palustres d’importation. Méd Trop, 2001, vol. 61, no 2, p. 153-57.