HAL Id: tel-01613506
https://tel.archives-ouvertes.fr/tel-01613506
Submitted on 9 Oct 2017
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Optimisation thermique de nanostructures
plasmoniques : conception, modélisation et
caractérisation
Adrien Lalisse
To cite this version:
Adrien Lalisse. Optimisation thermique de nanostructures plasmoniques : conception, modélisation et caractérisation. Physique [physics]. Université Pierre et Marie Curie - Paris VI, 2017. Français. �NNT : 2017PA066081�. �tel-01613506�
O P T I M I S AT I O N T H E R M I Q U E D E N A N O S T R U C T U R E S P L A S M O N I Q U E S : C O N C E P T I O N , M O D É L I S AT I O N E T
C A R A C T É R I S AT I O N
adrien lalisse
Thèse de Doctorat de l’Université Pierre et Marie Curie Spécialité Physique
École doctorale 564 : «Physique en Île-de-France»
Soutenance prévue le 03 mars 2017 devant le jury composé de
M. Alexandre Bouhelier Rapporteur
M. Philippe Ben-Abdallah Rapporteur
Mme. Agnès Maitre Examinateur
M. Guillaume Baffou Invité
M. Gilles Tessier Directeur de thèse
M. Jérôme Plain Co-Directeur de thèse
O P T I M I S AT I O N T H E R M I Q U E D E N A N O S T R U C T U R E S P L A S M O N I Q U E S : C O N C E P T I O N , M O D É L I S AT I O N E T
C A R A C T É R I S AT I O N adrien lalisse
Thèse de Doctorat de l’Université Pierre et Marie Curie
Spécialité Physique
École doctorale 564 : «Physique en Île-de-France»
Soutenue le 03 mars 2017 devant le jury composé de
M. Alexandre Bouhelier Rapporteur
M. Philippe Ben-Abdallah Rapporteur
Mme. Agnès Maitre Examinateur
M. Guillaume Baffou Invité
M. Gilles Tessier Directeur de thèse
R E M E R C I E M E N T S
Je voudrais tout d’abord remercier mes directeurs de thèse : Gilles Tessier et Jérôme Plain qui m’ont encadré durant ces trois années de thèse. Merci à Gilles pour sa disponibilité et ses conseils. Merci à Jérôme pour avoir porté le projet ANR NATO et m’avoir accordé sa confiance.
Je tiens ensuite à exprimer ma gratitude envers les membres du jury, en par-ticulier aux rapporteurs, Alexandre Bouhelier et Philippe Ben-Abdallah, qui ont accepté de prendre leur temps pour évaluer mon travail.
Je souhaite également saluer les membres du projet ANR NATO qui ont con-tribué de manière significative à l’élaboration de mon travail. Merci à Guillaume Baffou pour son aide précieuse et son expertise en thermoplasmonique qui se sont concrétisées par deux publications jointes. Merci à Rémi Carminati pour les dis-cussions qui ont abouti sur une modélisation théorique du signal photothermique. Je voudrais, par ailleurs, remercier symboliquement Alexandra Elbakyan, qui a fondé le moteur de recherche scientifique Sci-Hub, permettant la libre diffusion des connaissances scientifiques.
Enfin, je tiens à remercier l’ensemble des personnes avec qui j’ai pu travailler ou simplement partagé le quotidien durant ces trois années passées dans les labora-toires de neurophotonique à Paris et du LNIO à Troyes.
R É S U M É
Un des défis majeurs auquel la communauté de la nano-optique aura à répon-dre dans les années à venir sera de concentrer l’énergie lumineuse à l’échelle du nanomètre de façon à créer une nanosource optique ou thermique intense à même d’alimenter les futurs dispositifs. Les nanoparticules métalliques, supportant une résonance plasmon de surface, sont idéales pour de telles applications. Parmi les applications potentielles les plus prometteuses, il est possible de citer le traitement du cancer par hyperthermie, le transfert de médicaments in vivo, le stockage de données informatiques et la thermophotovoltaïque pour lesquelles l’effet recher-ché n’est autre qu’un échauffement optimal. Les échelles spatiales nanométriques exigent cependant le développement de techniques de mesure de température aux petites échelles. La caractérisation et la quantification du champ thermique d’une nanostructure métallique représentent encore aujourd’hui un défi majeur. Dans ce contexte, cette thèse a pour vocation d’apporter, au moins partiellement, un élément de réponse aux problématiques d’optimisation thermique aux échelles nanométriques et de proposer une nouvelle technique de nanothermométrie. L’ob-jectif principal de cette thèse est l’étude et la caractérisation de nanostructures métalliques optimisées thermiquement.
TA B L E D E S M AT I È R E S
1 introduction xi
2 elements théoriques de plasmonique et de
thermoplasmo-nique 1
2.1 Applications de la thermoplasmonique . . . 3
2.1.1 Thérapie photothermique du cancer (hyperthermie) . . . 3
2.1.2 Transfert de médicaments . . . 6
2.1.3 Thermophotovoltaïque . . . 7
2.1.4 Imagerie photothermique . . . 10
2.1.5 Conclusion . . . 11
2.2 Réponse optique des métaux . . . 12
2.2.1 Equations de Maxwell dans les milieux . . . 12
2.2.2 Modèle de Drude des métaux . . . 13
2.3 Modes électromagnétiques . . . 15
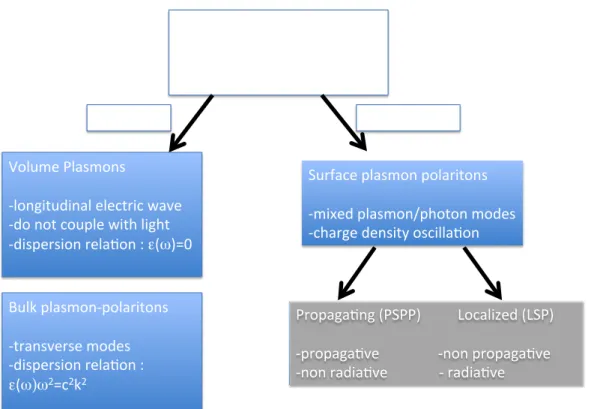
2.3.1 Quasi-particules : Photons, Polaritons, Plasmons . . . 15
2.3.2 Modes électromagnétiques en présence d’interface . . . 17
2.4 Propriétés optiques des nanoparticules métalliques . . . 18
2.4.1 Théorie de Mie . . . 20
2.4.2 Modèle dipolaire . . . 21
2.4.3 Propriétés spectrales de l’or et de l’argent . . . 24
2.5 Description physique des transferts thermiques . . . 26
2.5.1 Convection . . . 26
2.5.2 Rayonnement thermique . . . 27
2.5.3 Conduction . . . 28
2.5.4 Conclusion . . . 32
2.6 Propriétés thermiques des nanoparticules métalliques . . . 32
2.6.1 Dynamique de l’échauffement au sein d’une nanoparticule . 33 2.6.2 Nanoparticule sous échauffement modulé . . . 35
2.6.3 Nanostructure sous échauffement statique . . . 37
2.6.4 Dépendance de la résonance plasmon avec la température . . 38
2.6.5 Photoluminescence . . . 39
2.6.6 Conclusion . . . 40
3 optimisation thermique des nanoantennes optiques 43 3.1 Hétéroplasmonique . . . 45
3.1.1 Nanoparticule dipolaire . . . 45
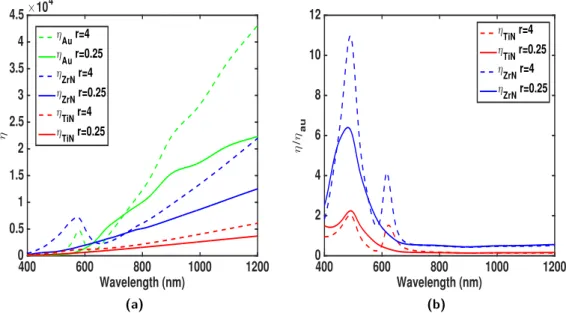
3.1.2 Nanoparticule de nitrure métallique dans le régime retardé . 57 3.2 Optimisation de la morphologie de nanoantennes . . . 68
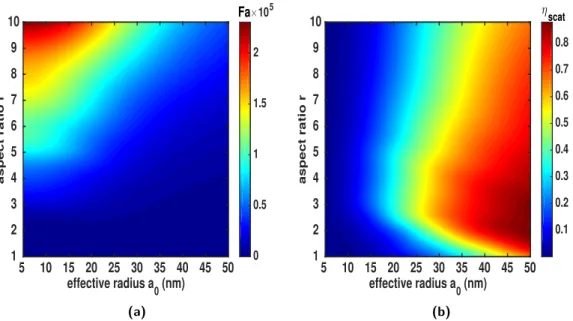
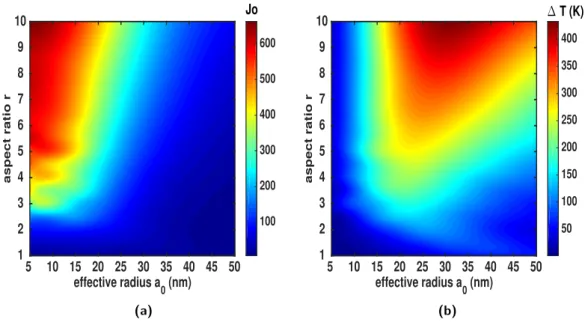
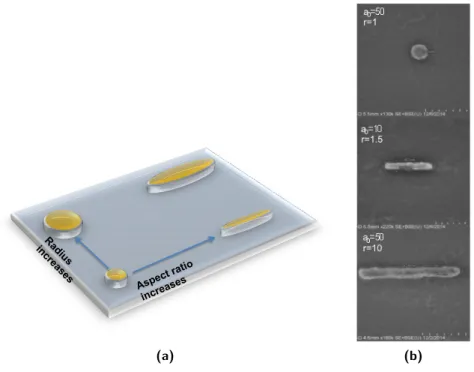
3.2.1 Géométries simples : ellipsoïdes . . . 68
3.2.2 Optimisation heuristique de la mophologie de nanoparticules 77 3.2.3 Conclusion . . . 84
4.1 Fabrication de nanostructure par lithographie électronique . . . 87
4.1.1 Microscopie électronique . . . 87
4.1.2 Lithographie électronique . . . 88
4.2 Caractérisation des échantillons . . . 92
4.2.1 Imagerie électronique . . . 92
4.2.2 Spectroscopie optique de diffusion . . . 94
4.3 Conclusion . . . 99
5 holographie digitale pour l’imagerie de diffusion et d’ab-sorption 101 5.1 Holographie digitale hétérodyne . . . 103
5.1.1 Principes de l’holographie digitale . . . 103
5.1.2 Suppression des ordres de diffraction parasites . . . 103
5.1.3 Montage expérimental . . . 107
5.1.4 Reconstruction digitale d’un hologramme . . . 108
5.2 Imagerie de diffusion en champ lointain par holographie digitale . . 113
5.2.1 Cartographie du champ de nanostructures . . . 114
5.2.2 Section efficace de diffusion . . . 115
5.2.3 Imagerie de phase . . . 118
5.3 Montage d’holographie photothermique . . . 123
5.4 Validation expérimentale du montage d’holographie photothermique 125 5.4.1 Dépendance fréquentielle et en puissance de l’intensité pho-tothermique . . . 125
5.4.2 Imagerie photothermique de nanostructures négatives . . . . 126
6 imagerie thermique de nanostructures métalliques 139 6.1 Mesures de température à l’échelle nanométrique . . . 141
6.1.1 Mesures de température par sonde locale en champ proche . 141 6.1.2 Mesures de température par thermopolymérisation . . . 142
6.1.3 Mesures de température par imagerie optique en champ loin-tain . . . 142
6.1.4 Conclusion . . . 151
6.2 Modélisation des signaux photothermiques . . . 152
6.2.1 Diffusion par une nanostructure soumise à un échauffement 152 6.2.2 Holographie photothermique . . . 153
6.2.3 Uniformité du champ thermique dans une nanostructure . . 154
6.2.4 Approximation de Born . . . 156
6.2.5 Conclusion . . . 158
6.3 Holographie photothermique d’amplitude . . . 159
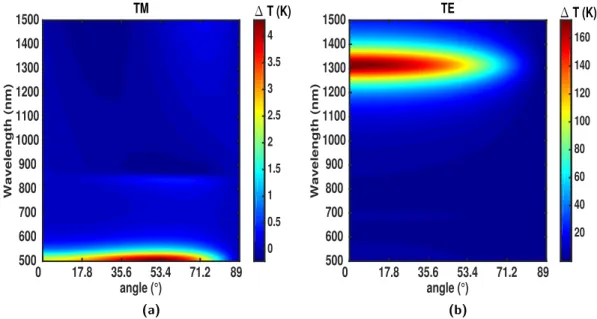
6.3.1 Caractéristiques de l’échauffement . . . 159
6.3.2 Principe de détermination quantitative de la température par holographie photothermique . . . 164
6.3.3 Résultats expérimentaux . . . 170
6.3.4 Conclusion . . . 180
6.4 Etude préliminaire de la phase optique en holographie photother-mique . . . 182
6.4.2 Détermination expérimentale de la température d’une
nanos-tructure avec la phase optique . . . 184
6.4.3 Conclusion . . . 188
7 conclusion 191
a diffusion en hétéroplasmonique 195
b propriétés optiques du nitrure de titane et de zirconium 197
c boundary element method 199
d déphasage d’une onde traversant un milieu homogène chauffé201
d.1 Cas modulé . . . 201
d.2 Cas statique . . . 201
1
I N T R O D U C T I O N
Depuis une vingtaine d’années, les nanotechnologies connaissent un essor formi-dable et suscitent régulièrement l’attention des médias en tant que technologie du futur. Les nanotechnologies consistent à concevoir, fabriquer et manipuler des dispositifs à l’échelle du nanomètre, défini comme un milliardième de mètre.
Au-jourd’hui, près de 1.5 milliards de dollars [123] sont investis chaque année aux
Etats-Unis dans la recherche en nanosciences et le marché de l’emploi dans les nanotechnologies, toujours en expansion, est estimé permettre la création de près
de 2 millions de postes au niveau mondial [115]. Aussi versatiles que soient les
domaines d’applications des nanotechnologies, allant de la cosmétique au textile, il n’en demeure pas moins que seuls quelques secteurs d’intérêt comme le biomé-dical, l’environnement, les nouveaux matériaux ou encore la production d’énergie cristallisent la majorité des recherches en nanosciences.
Ce développement récent des nanotechnologies repose essentiellement sur l’éme-rgence de nouvelles techniques de détection microscopique, notamment la
micro-scopie à force atomique (1986 [32] ) et la microscopie à effet tunnel (1983 [33]),
les progrès de la nanofabrication ainsi que l’avénement de nouvelles méthodes de calcul numérique et de la puissance des processeurs modernes. Ces avancées scien-tifiques permettent désormais une fabrication et une caractérisation contrôlée de nano-objets.
Dans ce domaine des nanotechnologies, la plasmonique occupe une place
fonda-mentale dans des secteurs porteurs d’avenir comme la médecine [81],
l’environne-ment [9], les communications [102], la micro-électronique [127] ou encore l’énergie [12].
La plasmonique fait référence à l’oscillation collective des charges élémentaires dans un métal dont la spécificité est de présenter une bande de conduction par-tiellement remplie. La nanoplasmonique correspond, en outre, au champ de la plasmonique se penchant sur l’interaction entre la lumière et les nanostructures métalliques. Par définition, ces nanostructures métalliques sont des structures mé-talliques de dimensions généralement variant entre la dizaine et la centaine de
na-nomètres. Le nombre réduit d’atomes (∼ 2000 atomes dans une nanosphère d’or
de 4 nm de diamètre ) constituant alors une nanostructure métallique se traduit par une proportion accrue d’atomes de surface lui conférant des propriétés physiques différentes du matériau massif. Ainsi, une couche mince d’or de 10 nm d’épaisseur présente, par exemple, une couleur bleue-verte se distinguant fortement du célèbre éclat jaune de l’or.
Soumis à un champ électromagnétique externe, l’oscillation collective des élec-trons d’une nanostructure métallique devient cohérente avec l’excitation démon-trant alors un phénomène de résonance. Cette résonance, appelée résonance plas-mon, se révèle déterminante dans la réponse optique des nanostructures métal-liques. Cette dernière se caractérise, notamment, par une exaltation locale de
l’éner-gie à proximité des nanostructures ainsi qu’une absorption et une diffusion lumi-neuse intense.
Toutefois l’intérêt principal de ces nanostructures métalliques réside dans la pos-sibilité de contrôler les propriétés de cette résonance plasmon permettant alors de façonner leurs propriétés optiques par l’intermédiaire de leur morphologie,de leur taille, de leur composition et de leur environnement.
Une nanostructure métallique illuminée absorbe l’énergie incidente de manière directe et par couplage résonant avec les modes plasmons, avant de relaxer cette énergie absorbée de manière radiative et non radiative dans son environnement. La relaxation non radiative de l’énergie absorbée est, en outre, déterminée par les transferts de chaleur entre la nanostructure métallique et son milieu environnant. Aussi, l’échauffement d’une nanostructure métallique dépend de ses propriétés d’absorption, lesquelles, tributaires de la résonance plasmon, offrent un contrôle de la température à l’échelle nanométrique. Les nanostructures métalliques peuvent dès lors se comporter à la fois comme des nanosources optiques, confinant l’éner-gie lumineuse aux petites échelles, ou des nanosources thermiques dont l’efficacité constitue une paramètre ajustable.
Historiquement, elles ont d’abord été exploitées pour leurs propriétés de
nano-sources optiques [31]. Pour ces nanoantennes optiques, l’échauffement se révèle
alors un effet néfaste susceptible de dégrader leurs performances. Cependant, la capacité de génération de chaleur des nanostructures métalliques a conduit ré-cemment au développement d’une nouvelle branche de la nanoplasmonique, la thermoplasmonique, dans laquelle celle-ci peut s’avèrer un effet bénéfique.
Le contrôle de l’énergie lumineuse et thermique à l’échelle du nanomètre ouvre ainsi de nouvelles perspectives intéressantes dans de nombreuses applications où les transferts thermiques jouent un rôle prépondérant. Parmi les applications po-tentielles les plus prometteuses de la thermoplasmonique, il est possible de citer
le traitement du cancer par hyperthermie [1], le transfert de médicaments in vivo
[136], le stockage de données informatiques [132] et la thermophotovoltaïque [135] pour lesquelles l’effet recherché n’est autre qu’un échauffement maximal.
Optimiser la conversion énergie lumineuse – énergie thermique à l’échelle du nanomètre constitue ainsi un enjeu crucial des futurs dispositifs envisageant l’uti-lisation de nanosources optiques présentant un chauffage local minimal ou bien, au contraire, de nanosources de chaleur.
Cependant, les échelles spatiales nanométriques exigent le développement de techniques de mesure de température aux petites échelles. La caractérisation et la quantification du champ thermique d’une nanostructure métallique représente encore aujourd’hui un défi majeur.
Dans ce contexte, cette thèse a pour vocation d’apporter, au moins partiellement, un élément de réponse aux problématiques d’optimisation thermique aux échelles nanométriques et de proposer une nouvelle technique de nanothermométrie. L’ob-jectif principal de cette thèse est l’étude et la caractérisation de nanostructures métalliques optimisées thermiquement.
Ce manuscrit aborde ces deux problématiques de thermoplasmonique en s’arti-culant autour de cinq Chapitres ; les deux premiers Chapitres théoriques traitent de l’optimisation thermique de nanostructure métalliques alors que les trois derniers
Chapitres expérimentaux sont consacrés à la fabrication et s’évertuent à présenter une nouvelle technique de nanothermométrie en champ lointain. Par ailleurs, les Figures sont en anglais dans un souci d’harmonisation avec les Figures reprises dans la litérature et, autorisant également plus de flexibilité pour d’éventuels tra-vaux/publications ultérieurs.
Dans le Chapitre 1, nous présentons les éléments théoriques de plasmonique et de thermoplasmonique qui serviront de base à la compréhension des phéno-mènes physiques décrits dans ce manuscrit. Après avoir proposé un état de l’art sur les quelques applications les plus prometteuses en thermoplasmonique, la ré-ponse optique des métaux est ensuite présentée. Nous nous concentrons sur le cas de nanostructures métalliques en détaillant leurs propriétés optiques résul-tant du phénomène de résonance plasmon. Nous proposons enfin une description physique des transferts thermiques avant d’aborder les propriétés thermiques des nanostructures métalliques.
Dans le Chapitre 2, nous recherchons les caractéristiques optimales d’une nano-source thermique pour la thermoplasmonique. En réalisant des simulations numé-riques, nous étudions les paramètres permettant de contrôler l’énergie thermique d’une nanostructure métallique. Ainsi, dans un premier temps, nous comparons l’efficacité d’un large panel de matériaux pour la plasmonique. Dans un second temps, nous tentons d’évaluer l’influence de la morphologie sur la génération de chaleur d’une nanostructure métallique.
Le Chapitre 3 est consacré à la fabrication de nanostructures d’or sur un substrat de verre par lithographie électronique ainsi qu’à leur caractérisation expérimentale par microscopie électronique et spectroscopie de diffusion.
Dans le Chapitre 4, nous présentons la technique microscopique d’holographie digitale hétérodyne qui permet d’obtenir l’amplitude et la phase optique de la lu-mière diffusée en champ lointain par une nanostructure métallique. Nous mon-trons ensuite la possibilité d’adapter cette technique microscopique afin de re-cueillir des informations thermiques sur ces nano-objets. Enfin, nous tentons de valider le principe de cette technique d’holographie photothermique en présentant une étude qualitative thermique de nanoantennes optiques.
Le Chapitre 5 est dévolu à la détermination expérimentale de la température générée par une nanostructure métallique avec le montage d’holographie pho-tothermique. Afin de mieux rendre compte des difficultés impliquant l’imagerie thermique à l’échelle du nanomètre, nous proposons d’abord un état de l’art sur les techniques de nanothermométrie récentes. A partir du champ électrique diffusé par une nanostructure métallique chauffée, nous nous efforçons de déterminer sa température de manière quantitative. Pour ce faire, dans un premier temps, nous avons recours aux informations d’amplitude fournies par l’holographie photother-mique avant de tenter, dans un second temps, l’exploitation de la phase optique.
2
E L E M E N T S T H É O R I Q U E S D E P L A S M O N I Q U E
E T D E T H E R M O P L A S M O N I Q U E
s o m m a i r e
2.1 Applications de la thermoplasmonique . . . 3
2.1.1 Thérapie photothermique du cancer (hyperthermie) . . . 3
2.1.2 Transfert de médicaments . . . 6
2.1.3 Thermophotovoltaïque . . . 7
2.1.4 Imagerie photothermique . . . 10
2.1.5 Conclusion . . . 11
2.2 Réponse optique des métaux . . . 12
2.2.1 Equations de Maxwell dans les milieux . . . 12
2.2.2 Modèle de Drude des métaux . . . 13
2.3 Modes électromagnétiques . . . 15
2.3.1 Quasi-particules : Photons, Polaritons, Plasmons . . . 15
2.3.2 Modes électromagnétiques en présence d’interface . . . 17
2.4 Propriétés optiques des nanoparticules métalliques . . . 18
2.4.1 Théorie de Mie . . . 20
2.4.2 Modèle dipolaire . . . 21
2.4.3 Propriétés spectrales de l’or et de l’argent . . . 24
2.5 Description physique des transferts thermiques . . . 26
2.5.1 Convection . . . 26
2.5.2 Rayonnement thermique . . . 27
2.5.3 Conduction . . . 28
2.5.4 Conclusion . . . 32
2.6 Propriétés thermiques des nanoparticules métalliques . . . 32
2.6.1 Dynamique de l’échauffement au sein d’une nanoparticule . . . 33
2.6.2 Nanoparticule sous échauffement modulé . . . 35
2.6.3 Nanostructure sous échauffement statique . . . 37
2.6.4 Dépendance de la résonance plasmon avec la température . . . 38
2.6.5 Photoluminescence . . . 39
2.6.6 Conclusion . . . 40 Ces dernières années, les nano-objets métalliques connaissent un regain d’en-gouement en raison de leurs propriétés exaltées d’absorption de la lumière qui se caractérisent par un échauffement permettant alors un contrôle de la température à l’échelle nanométrique. Dans le domaine des nanotechnologies, contrôler la tem-pérature à ces échelles s’avère un enjeu crucial des futurs dispositifs, en particulier pour la réalisation de nanosources optiques et thermiques.
Dans ce premier Chapitre, nous regroupons les éléments théoriques qui servi-ront de base pour comprendre les propriétés optiques et thermiques de ces nano-objets. Nous introduisons ainsi le phénomène de résonance plasmon de manière à décrire le processus d’absorption de l’énergie lumineuse, et présentons le contexte de l’étude thermique des nanostructures métalliques.
Dans un premier temps, nous dressons un bref état de l’art des applications potentielles des nano-objets métalliques en relation avec la thermoplasmonique. Nous étudions, dans un second temps, la réponse optique des métaux et, de ma-nière plus générale, les différents modes électromagnétiques. Nous nous penchons ensuite sur la réponse optique des nanoparticules métalliques en particulier sur le phénomène de résonance de plasmon localisé. Enfin nous proposons une descrip-tion physique des transferts thermiques avant d’aborder les propriétés de nano-sources thermiques des nanoparticules métalliques.
2.1 Applications de la thermoplasmonique
Dans cette section, nous présentons quelques applications potentielles tributaires des propriétés thermoplasmoniques des nanoparticules métalliques. La variété des domaines d’application, allant du biomédical au secteur énergétique en passant par la détection chimique, semble alors porteur d’avenir pour la thermoplasmo-nique. Nous nous concentrons, dans cette section, sur les applications les plus prometteuses, dans lesquelles la génération de chaleur constitue l’effet recherché. 2.1.1 Thérapie photothermique du cancer (hyperthermie)
En 2003, Pitsillides et ses collègues [137] ont publié pour la première fois une
utilisation expérimentale des nanoparticules métalliques en tant que nanosources de chaleur pour détruire sélectivement des cellules d’un organisme vivant. Ces nanoparticules plasmoniques présentent alors l’avantage d’être inertes et de rester stables dans les cellules pendant une longue période de temps.
2.1.1.1 Principe
En chauffant sélectivement des cellules cancéreuses ciblées par des nanoparti-cules métalliques, il est possible d’induire une température cellulaire suffisam-ment élevée qui provoque la mort de la cellule. Des températures comprises entre 41°C et 48°C suffisent en théorie pour tuer une cellule cancéreuse. Il existe plu-sieurs moyens de chauffer les nanoparticules, le laser, les ondes micro-ondes, les ondes radiofréquences, les ondes ultrasonores ou les champs magnétiques oscil-lants permettent ainsi de provoquer cet échauffement recherché (hyperthermie).
Le choix du matériau des nanoparticules repose en grande partie sur sa biocom-patibilité avec un organisme vivant afin de ne pas compromettre les tissus sains environnants. Les nanoparticules d’or font partie des candidats les plus promet-teurs car la cytotoxicité de l’or n’a pas été démontrée à ce jour, et son absorption optique exaltée autorise l’utilisation d’un éclairement laser de moyenne intensité. Après illumination laser, les nanoparticules d’or, localisées à l’intérieur des cel-lules cancéreuses, absorbent fortement l’énergie incidente et relaxent leur énergie par échauffement conductif de l’environnement cellulaire détruisant les zones de tumeur.
Pour pouvoir traiter de manière efficace les tumeurs avec l’utilisation de nano-particules d’or, il est nécessaire d’adresser les trois principaux mécanismes de cette thérapie photothermique, le ciblage spécifique des cellules cancéreuses par les na-noparticules d’or, la zone de transparence des tissus humains et la mort cellulaire. Pour cibler spécifiquement les cellules cancéreuses avec les nanoparticules d’or, il existe principalement deux méthodes employées dans la litérature. La première consiste à cibler de manière passive les cellules cancéreuses en injectant les nano-particules d’or de manière intraveineuse au niveau de la tumeur. Le phénomène d’exaltation de la perméabilité et rétention (EPR) des cellules cancéreuses, dû à une prolifération vasculaire et à un drainage lymphatique réduit, permet, au bout de quelques heures, d’y accumuler les nanoparticules d’or dans des concentrations cinq à dix fois supérieures que dans les tissus sains. La seconde méthode employée
pour cibler les cellules cancéreuses est active dans la mesure où les nanoparticules d’or sont fonctionalisées (anticorps, peptides) par des récépteurs surfaciques spéci-fiques aux membranes des cellules cancéreuse. Par endocytose, les nanoparticules d’or peuvent également pénétrer à l’intérieur des cellules cancéreuses à condition
que leur diamètre reste suffisamment petite (<100 nm).
L’utilisation des nanoparticules d’or requiert une illumination laser qui doit être choisie de manière à exciter efficacement les nanoparticules d’or tout en préservant l’intégrité des tissus biologiques. Deux zones de transparence des tissus humains sont connues : entre 700 nm et 900 nm, la lumière a une profondeur de pénétration importante (jusqu’à un centimètre), et entre 1000 nm et 1400 nm où la diffusion réduite compense l’absorption de l’eau. Le contrôle de la morphologie des na-noparticules d’or permet de sélectionner la longueur d’onde d’excitation afin de pouvoir les chauffer efficacement.
Par ailleurs, il est possibles d’identifer trois mécanismes thermiques pour dé-truire une cellule. A partir d’une température interne de 45°C , la cellule dégénère rapidement puis meurt mais il est difficile d’atteindre une température uniforme sans diffusion dans l’environnement. Pour contourner cette difficulté, la distribu-tion de température peut être localisée en utilisant un laser impulsionnel (ns ou f s ). L’élévation de température soudaine peut atteindre près de 300°C sans former de bulles ce qui induit une perforation de la membrane cellulaire entraînant la
mort de la cellule [137]. En augmentant la puissance du laser impulsionnel, il peut
également se former des bulles dans la cellule dont le cycle de formation/destruc-tion génère une onde de choc dégradant les lysosomes et la membrane cellulaire. 2.1.1.2 Etat de l’art
En 2003, le groupe de Lin [137] a introduit l’utilisation des nanoparticules métal-liques en tant que générateur de microbulles dégradant thermiquement les cellules
et, le groupe de Halas a poursuivi cette idée [74] mais en s’appuyant sur des
na-noparticules d’or et des nanocoquilles composées d’un coeur de silicium et d’une coquille d’or sous une illumination continue. In vitro, des cellules de carcinôme humain du sein incubées avec ces nanocoquilles ont montré une forte morbidité
[107] alors qu’in vivo des expériences sur des souris se sont révélées probantes
[126]. Après dix jours de traitement sous une illumination infrarouge (808 nm,
4 W·cm−2, 5min), les tumeurs des souris ont été complètement résorbées
durable-ment. Halas a ensuite introduit expérimentalement les deux méthodes de ciblages
spécifiques, active et passive, des cellules cancéreuses [106]. Le groupe de El-Sayed
a mené des expériences in vitro avec des nanosphères et des nanobâtonnets d’or
fonctionnalisées pour des cellules de carcinomes [80] puis a démontré l’avantage
des nanobâtonnets d’or qui résonnent dans l’infrarouge et ne nécessitent pas une puissance surfacique aussi intense pour aboutir à la dégradation thermique des
cel-lules [81]. Chen et son groupe ont proposé l’utilisation de nanocages (nanocubes
vides avec des coins arrondis) [45] pour réduire encore la puissance surfacique
incidente requise pour détruire les cellules cancéreuses. Suite aux nombreuses dé-monstrations de l’efficacité de l’hyperthermie par des expériences in vitro et in vivo [58, 81, 140, 158, 159], les publications se sont plutôt penchées sur l’explora-tion de nouvelles morphologies exotiques de nanoparticules comme les nanocubes [46], ou les structures hybrides [11].
Laser Photonics Rev. 7, No. 2 (2013)
REVIEW ARTICLE
179
case of cancer, the main idea of this emerging therapy is to artificially enhance the optical absorption contrast between cancerous and healthy tissues. This way, a suitable illumina-tion enables specific photo-damage of cancer tissues without affecting the healthy surrounding. Among available pho-tothermal agents, plasmonic NPs are very good candidates to achieve photo-damage using moderate laser intensity.
To eventually end up with an efficient treatment using gold NPs, several requirements have to be fulfilled. First, gold NPs need to be specifically delivered to the cancer cells in order to limit the heat generation to the malignant tissues and not to the surrounding healthy tissues. Targeting of can-cer cells with gold NPs can be either passive or active [73]. The passive approach exploits the fact that, due to their rapid growth, cancer cells are endowed with vasculatures (up to 2 µm in size) that facilitate NP uptake. Additionally, the lymphatic drainage of tumors is reduced compared with healthy tissues, making it harder for NPs to leave the tumor once they get into it. In the active approach, targeting of cancer cells is achieved by coating the NP surface with anti-bodies, proteins or other ligands that have a specific binding affinity with receptors overexpressed at the membrane of cancer cells.
The second aspect that has to be considered is the wave-length of the incident light used to heat the NPs. Indeed, light absorption of human tissues is minimum in the so-called transparency window (between 700 and 900 nm). Working in this region of the spectrum allows reaching tumors that can be up to several centimeters deep, along with minimum absorption and thus less heating from the rest of the exposed tissues that are not targeted with NPs. While light absorption of spherical gold NPs peaks in the green, LSP resonances can be shifted to the infrared by using non-spherical NPs. This explains why hyperthermia experiments are mainly based on the use of gold nanoshells [74, 76–78] (formed by a dielectric core surrounded by a thin gold layer), gold nanorods [79] or gold nanocages [80], which allow ac-curate tuning of LSPs to the NIR spectral region. In some
cases, the use of spherical gold NPs can also be efficient due to agglomeration of NPs that tends to red-shift the NP absorption spectrum [81–83].
In the original work introducing the use of gold NPs for plasmonic photothermal therapy (PPTT), Hirsch and co-workers used human breast carcinoma cells incubated with gold nanoshells in vitro [84]. The cells were found to have undergone photothermally induced morbidity upon exposure to NIR light (820 nm, 35 W/cm2). Conversely,
cells without nanoshells displayed no loss in viability using the same NIR illumination conditions. Also, exposure to low doses of NIR light (820 nm, 4 W/cm2) in solid tumors
treated with metal nanoshells reached average maximum temperature increases capable of inducing irreversible tissue damage (DT = 37.4 ±6.6 °C) within 4–6 min. Importantly, controls treated without nanoshells demonstrated signifi-cantly lower average temperature increase on exposure to NIR light (DT < 10 °C). Shortly after [85], the feasibil-ity of this approach was successfully tested in vivo on a mouse model. Gold nanoshells coated with polyethylene glycol (PEG) were intravenously injected into mice. The tumor was then illuminated with a diode laser over sessions of 3 min. After 10 days of treatment, complete resorption of the tumor was observed. More than 90 days after the treatment, all treated mice remained healthy and free of tumors. At about the same time, Pitsillides et al. proposed to use nanosecond-pulsed laser irradiation for more efficient PPTT [86]. This series of experiments was performed in the visible range using spherical gold NPs. Those authors demonstrated that when using pulsed laser illumination, the brief but intense temperature increase following a short laser pulse yields a fast vaporization of a thin layer around the NPs causing more efficient cancer cell denaturation as com-pared with CW illumination. The use of gold nanorods was first proposed by the El-Sayed group a few years later [79]. In 2008, Stern et al. carried out NP-based laser ablation on an apparent subcutaneous tumor around 1 cm in diameter (Fig. 9) [66]. In this work, gold NPs were introduced by
a
b Figure 9 (online color at: www.lpr-journal.org) a) Schematic illustrating the usual
ap-proach in PPTT. First, gold NPs are functionalized with small molecules or antibodies that specifically target the cancer cells. Then, a NP solution is directly injected into the tumor location or intravenously through the tails of nude mice. After a given period of incubation, the tumor is illuminated to heat the NPs and generate hyperthermia. This procedure is repeated until healing occurs. b) Plasmonic-assisted laser ablation of a subcutaneous tumor [66]. Gold nanoshells (110 nm) with a 10 nm gold shell were used as NIR absorbers. Cancer (PC-3) cells were injected in the dorsum of nude mice. Animals received 8.5 ml/g body weight nanoshells via tail vein injection. An 810 nm NIR laser with an energy setting of 4 W/cm2was aimed at the tumor bed for 3 min. Eschar fell off at 21 days. Top: before
treatment; bottom: after treatment. (Reprinted with permission of Elsevier.)
www.lpr-journal.org © 2012 by WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
A
Nanoshells as Contrast Agents
In addition to being strong near-IR absorbers, nanoshells can be strong scatterers of NIR light. This opens up the potential for diagnostic imaging of tumors for early detection. Optical techniques have the advantage of being minimally invasive and offer high resolution images using biocompatible non-photobleaching nanoshells to improve contrast. Compared with molecular contrast agents such as indocyanine green, nanoshells have far larger scattering cross sections and a tun-able optical response over a wide wavelength range. Nanoshells synthesized with high scattering cross sections have been used as contrast agents in numerous imaging modalities,25,26,29,30enhancing the sensitivity of these imag-ing techniques.
Loo et al. have demonstrated the use of scattering nanoshells targeted with anti-HER2 as a contrast agent in dark-field microscopy. HER2 positive SK Br3 and HER2 nega-tive MCF7 cell cultures were incubated with anti-HER2 and anti-IgG immunonanoshells.29After 1 h, the cells were rinsed and visualized under a high-magnification dark-field micro-scope. Analysis of the dark-field images shows significantly higher contrast values for anti-HER2 targeted nanoshells com-pared with the nonspecific IgG targeted nanoshells or untar-geted bare nanoshells. HER2-negative MCF 7 cells show significantly less contrast providing additional evidence that enhanced contrast is attributable to the nanoshell binding to SK Br3 cells.
Combined Cancer Imaging and Therapy
Nanoshells have been successfully used for photothermal ablation of cancer cells and for imaging contrast in numer-ous imaging techniques. It is therefore reasonable to envi-sion a dual diagnostic-therapeutic modality for nanoshells, where the same laser source used for imaging the tumor could at higher laser powers be used to heat and destroy the tumor.
Loo, Lowery, et al.23have demonstrated this dual imaging/ therapy approachin vitro using anti-HER2 immunonanoshells.
Nanoshells were designed with a 60 nm core radius, a 10 nm thick shell, and a plasmon resonance at 800 nm. Anti-HER2 or nonspecific anti-IgG were conjugated to nanoshells. SK Br3 breast carcinoma cells were cultured and incubated with immunonanoshells for 1 h. Following rinsing to remove unbound nanoshells, the cells were imaged in a dark-field microscope. Next the cells were irradiated with NIR laser (820 nm wavelength laser 0.008 W/m2for 7 min).
Following irradiation the cells were stained and evaluated for nanoshell binding and viability. Figure 5 shows the results of combined imaging and therapy using nanoshells. The con-trols with no nanoshells or the nonspecific antibody show no contrast in either imaging or therapy. The anti-HER2 nanoshells show a distinct enhancement in the dark-field scat-tering image and a dark circular area of cell death correspond-ing to the beam spot upon laser irradiation. The silver stain assay also shows a high density of nanoshells bound to the carcinoma cells.
Gobin et al.26have demonstratedin vivo imaging via Opti-cal Coherence Tomography (OCT) and therapy using nanoshells. The bifunctional nanoshell designed for the dual role of OCT contrast enhancer and therapeutic heat absorber in tissue has a silica core of 119 nm diameter and a 12 nm gold shell. Mie scattering theory predicts that these particles have approximately 67% of their extinction due to absorp-tion and 33% due to scattering at 800 nm.
Subcutaneously grown tumors in mice (∼5 mm in diam-eter) were injected with PEGylated nanoshells via tail vein injection. The control mice received phosphate buffered solu-tion instead of the nanoshell solusolu-tion. Twenty hours post injec-tion the tumors were imaged using a commercial OCT setup by applying the probe directly over the tumor touching the skin. Representative OCT images from normal tissue and tumor sites with either PBS or nanoshells are shown in Fig-ure 6. The enhanced brightness in FigFig-ure 6, panel D compared with panel C demonstrates that nanoshells provide substan-tial contrast for OCT imaging. After imaging, the tumors were
FIGURE 4. Photothermal tumor ablation: (A) tumor before treatment; (B) complete ablation of tumor in the high dose group. The eschar formed over the laser-treated region fell off by day 21 exposing healthy skin. Figure reproduced with permission from ref 28. Copyright 2008 Elsevier.
Nanoshell-Enabled Photothermal Cancer Therapy Lal et al.
Vol. 41, No. 12 December 2008 1842-1851 ACCOUNTS OF CHEMICAL RESEARCH 1847
B
When thesame series of sampleswere exposed to thesame laser at a power density of 0.5 W cm!2, the rate of temperature increase became markedly slower. Table 1 lists the temperature increase (DT) for aqueous suspensions of Au nanocages that were exposed to laser irradiation for 10 min. In the absence of nanocages, the temperature only increased by 2–38C, indicat-ing that laser irradiation for 10 min at this power density poses minimal risk of adversely affecting cells or tissues. In the presence of 109nanocage/mL (or "1 ppm in terms of Au content), the temperature increased dramatically by 5–108C. Such a change could increase tissue temperature from 378C to >428C and cause an irreversible damage to the cells or tissues due to the denaturation of biomolecules.[21]Unlike the pulsed lasers with immense instantaneous power-per-pulse that can melt the nanocages to nanoparticles,[17]the continuous-wave (CW) diode laser caused no change to the optical properties of the Au nanocages (Figure 2C), indicating that the nanocages were stable under the irradiation conditions.
We further investigated the photothermal effect of the Au nanocages for selective destruction of the neoplastic tissue using a bilateral tumor model. Athymic mice were subcuta-neously injected into the right and left rear flanks with U87wtEGFR cells. After the tumor volume had reached 200– 400 mm3, the mice were randomly divided into Groups 1 and 2 (n ¼ 5 per group). The mice in Group 1 were intravenously administrated with 100 mL of 10 mg mL!1 (15 nM or
9 $ 1012particle/mL) PEGylated Au nanocages in PBS. The mice in Group 2 served as control and were injected intravenously with 100 mL of saline. At 72 h post injection, the tumor on the right rear flank of each mouse was subjected to photothermal treatment by exposure to the diode laser at a power density of 0.7 W cm!2for 10 min. The spot size of the laser beam was adjusted to cover the entire tumor (Figure 3A). During the laser treatment, full-body thermographic images were captured using an infrared camera, as shown in Figure 3B– I. The average temperature of the irradiated area was plotted as a function of the irradiation time (Figure 3J). For the nanocage-injected mice, the tumor surface temperature increased rapidly within one minute to reach 508C and began to plateau after 2 min at "54 8C. In the case of saline-injected mice, the surface temperature remained below 378Cduringtheentiretreatment. Changes to tumor metabolism due to photothermal treatment were monitored using18F-FDG PET. Several human
studies have shown that the use of18F-FDG as a surrogate marker for tumor metabolism in patients undergoing therapy is superior to the responsive evaluation criteria in solid tumors (RECIST), a method that simply evaluates the size of the tumor using an anatomical imaging technique such as computed
with18F-FDG PET/CT imaging was performed before and
after laser treatment for mice that had been intravenously injected with either saline or nanocages. Before laser irradia-tion, the 18F-FDG PET/CT imaging showed no significant
Table 1. Temperature increase (DT) for aqueous suspensions of Au nanocages upon irradiation by the diode laser for 10 min.
Power density [W cm!2]
Nanocage concentration [particles/mL]
0 109 1010 1011
1 3.58C 10.28C 34.98C 43.98C
0.5 2.38C 6.18C 23.78C 34.58C
Figure 3. A) Photograph of a tumor-bearing mouse under the photothermal treatment. 100 mL of PEGylated nanocages at a concentration of 9 $ 1012particles/mL or saline was administrated intravenously through the tail vein as indicated by an arrow. After the nanocageshadbeenclearedfromthecirculation(72 hafterinjection),the tumor on the right flank was irradiated by the diode laser at 0.7 W cm!2
with a beam size indicated by the dashed circle. B–G) Thermographic imagesofB–E)nanocage-injectedandF–I)saline-injectedtumor-bearing mice at different time points: B,E) 1 min, C,F) 3 min, D,G) 5 min, and E,I) 10 min. J) Plots of average temperature within the tumors (dashed
When thesame seriesof sampleswere exposed to thesame laser at a power density of 0.5 W cm!2, the rate of temperature
increase became markedly slower. Table 1 lists the temperature increase (DT) for aqueous suspensions of Au nanocages that were exposed to laser irradiation for 10 min. In the absence of nanocages, the temperature only increased by 2–38C, indicat-ing that laser irradiation for 10 min at this power density poses minimal risk of adversely affecting cells or tissues. In the presence of 109nanocage/mL (or "1 ppm in terms of Au content), the temperature increased dramatically by 5–108C. Such a change could increase tissue temperature from 378C to >428C and cause an irreversible damage to the cells or tissues due to the denaturation of biomolecules.[21]Unlike the pulsed lasers with immense instantaneous power-per-pulse that can melt the nanocages to nanoparticles,[17]the continuous-wave (CW) diode laser caused no change to the optical properties of the Au nanocages (Figure 2C), indicating that the nanocages were stable under the irradiation conditions.
We further investigated the photothermal effect of the Au nanocages for selective destruction of the neoplastic tissue using a bilateral tumor model. Athymic mice were subcuta-neously injected into the right and left rear flanks with U87wtEGFR cells. After the tumor volume had reached 200– 400 mm3, the mice were randomly divided into Groups 1 and 2 (n ¼ 5 per group). The mice in Group 1 were intravenously administrated with 100 mL of 10 mg mL!1 (15 nM or
9 $ 1012particle/mL) PEGylated Au nanocages in PBS. The mice in Group 2 served as control and were injected intravenously with 100 mL of saline. At 72 h post injection, the tumor on the right rear flank of each mouse was subjected to photothermal treatment by exposure to the diode laser at a power density of 0.7 W cm!2for 10 min. The spot size of the laser beam was adjusted to cover the entire tumor (Figure 3A). During the laser treatment, full-body thermographic images were captured using an infrared camera, as shown in Figure 3B– I. The average temperature of the irradiated area was plotted as a function of the irradiation time (Figure 3J). For the nanocage-injected mice, the tumor surface temperature increased rapidly within one minute to reach 508C and began to plateau after 2 min at "54 8C. In the case of saline-injected mice, the surface temperature remained below 378Cduringtheentiretreatment. Changes to tumor metabolism due to photothermal treatment were monitored using18F-FDG PET. Several human studies have shown that the use of18F-FDG as a surrogate marker for tumor metabolism in patients undergoing therapy is superior to the responsive evaluation criteria in solid tumors (RECIST), a method that simply evaluates the size of the tumor using an anatomical imaging technique such as computed tomography (CT).[22–25]Measurement of tumor metabolism
with18F-FDG PET/CT imaging was performed before and after laser treatment for mice that had been intravenously injected with either saline or nanocages. Before laser irradia-tion, the18F-FDG PET/CT imaging showed no significant
Table 1. Temperature increase (DT) for aqueous suspensions of Au nanocages upon irradiation by the diode laser for 10 min.
Power density [W cm!2]
Nanocage concentration [particles/mL]
0 109 1010 1011
1 3.58C 10.28C 34.98C 43.98C
0.5 2.38C 6.18C 23.78C 34.58C
Figure 3. A) Photograph of a tumor-bearing mouse under the photothermal treatment. 100 mL of PEGylated nanocages at a concentration of 9 $ 1012particles/mL or saline was administrated intravenously through the tail vein as indicated by an arrow. After the nanocageshadbeenclearedfromthecirculation(72 hafterinjection),the tumor on the right flank was irradiated by the diode laser at 0.7 W cm!2 with a beam size indicated by the dashed circle. B–G) Thermographic imagesofB–E)nanocage-injectedandF–I)saline-injectedtumor-bearing mice at different time points: B,E) 1 min, C,F) 3 min, D,G) 5 min, and E,I) 10 min. J) Plots of average temperature within the tumors (dashed circle) as a function of irradiation time. All scale bars are 1 cm.
small 2010, 6, No. 7, 811–817 ! 2010 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim www.small-journal.com 813 When thesame series of sampleswere exposed to thesame laser
at a power density of 0.5 W cm!2, the rate of temperature increase became markedly slower. Table 1 lists the temperature increase (DT) for aqueous suspensions of Au nanocages that were exposed to laser irradiation for 10 min. In the absence of nanocages, the temperature only increased by 2–38C, indicat-ing that laser irradiation for 10 min at this power density poses minimal risk of adversely affecting cells or tissues. In the presence of 109nanocage/mL (or "1 ppm in terms of Au content), the temperature increased dramatically by 5–108C. Such a change could increase tissue temperature from 378C to >428C and cause an irreversible damage to the cells or tissues due to the denaturation of biomolecules.[21]Unlike the pulsed lasers with immense instantaneous power-per-pulse that can melt the nanocages to nanoparticles,[17]the continuous-wave
(CW) diode laser caused no change to the optical properties of the Au nanocages (Figure 2C), indicating that the nanocages were stable under the irradiation conditions.
We further investigated the photothermal effect of the Au nanocages for selective destruction of the neoplastic tissue using a bilateral tumor model. Athymic mice were subcuta-neously injected into the right and left rear flanks with U87wtEGFR cells. After the tumor volume had reached 200– 400 mm3, the mice were randomly divided into Groups 1 and 2
(n ¼ 5 per group). The mice in Group 1 were intravenously administrated with 100 mL of 10 mg mL!1 (15 nM or
9 $ 1012particle/mL) PEGylated Au nanocages in PBS. The mice in Group 2 served as control and were injected intravenously with 100 mL of saline. At 72 h post injection, the tumor on the right rear flank of each mouse was subjected to photothermal treatment by exposure to the diode laser at a power density of 0.7 W cm!2for 10 min. The spot size of the
laser beam was adjusted to cover the entire tumor (Figure 3A). During the laser treatment, full-body thermographic images were captured using an infrared camera, as shown in Figure 3B– I. The average temperature of the irradiated area was plotted as a function of the irradiation time (Figure 3J). For the nanocage-injected mice, the tumor surface temperature increased rapidly within one minute to reach 508C and began to plateau after 2 min at "54 8C. In the case of saline-injected mice, the surface temperature remained below 378Cduringtheentiretreatment. Changes to tumor metabolism due to photothermal treatment were monitored using18F-FDG PET. Several human studies have shown that the use of18F-FDG as a surrogate marker for tumor metabolism in patients undergoing therapy is superior to the responsive evaluation criteria in solid tumors (RECIST), a method that simply evaluates the size of the tumor using an anatomical imaging technique such as computed tomography (CT).[22–25]Measurement of tumor metabolism
with18F-FDG PET/CT imaging was performed before and after laser treatment for mice that had been intravenously injected with either saline or nanocages. Before laser irradia-tion, the 18F-FDG PET/CT imaging showed no significant
Table 1. Temperature increase (DT) for aqueous suspensions of Au nanocages upon irradiation by the diode laser for 10 min.
Power density [W cm!2]
Nanocage concentration [particles/mL]
0 109 1010 1011
1 3.58C 10.28C 34.98C 43.98C
0.5 2.38C 6.18C 23.78C 34.58C
Figure 3. A) Photograph of a tumor-bearing mouse under the photothermal treatment. 100 mL of PEGylated nanocages at a concentration of 9 $ 1012particles/mL or saline was administrated intravenously through the tail vein as indicated by an arrow. After the nanocageshadbeenclearedfromthecirculation(72 hafterinjection),the tumor on the right flank was irradiated by the diode laser at 0.7 W cm!2
with a beam size indicated by the dashed circle. B–G) Thermographic imagesofB–E)nanocage-injectedandF–I)saline-injectedtumor-bearing mice at different time points: B,E) 1 min, C,F) 3 min, D,G) 5 min, and E,I) 10 min. J) Plots of average temperature within the tumors (dashed circle) as a function of irradiation time. All scale bars are 1 cm.
small 2010, 6, No. 7, 811–817 ! 2010 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim www.small-journal.com 813 When thesame seriesof sampleswere exposedto thesame laser
at a power density of 0.5 W cm!2, the rate of temperature increase became markedly slower. Table 1 lists the temperature increase (DT) for aqueous suspensions of Au nanocages that were exposed to laser irradiation for 10 min. In the absence of nanocages, the temperature only increased by 2–38C, indicat-ing that laser irradiation for 10 min at this power density poses minimal risk of adversely affecting cells or tissues. In the presence of 109nanocage/mL (or "1 ppm in terms of Au content), the temperature increased dramatically by 5–108C. Such a change could increase tissue temperature from 378C to >428C and cause an irreversible damage to the cells or tissues due to the denaturation of biomolecules.[21]Unlike the pulsed lasers with immense instantaneous power-per-pulse that can melt the nanocages to nanoparticles,[17]the continuous-wave (CW) diode laser caused no change to the optical properties of the Au nanocages (Figure 2C), indicating that the nanocages were stable under the irradiation conditions.
We further investigated the photothermal effect of the Au nanocages for selective destruction of the neoplastic tissue using a bilateral tumor model. Athymic mice were subcuta-neously injected into the right and left rear flanks with U87wtEGFR cells. After the tumor volume had reached 200– 400 mm3, the mice were randomly divided into Groups 1 and 2 (n ¼ 5 per group). The mice in Group 1 were intravenously administrated with 100 mL of 10 mg mL!1 (15 nM or
9 $ 1012particle/mL) PEGylated Au nanocages in PBS. The mice in Group 2 served as control and were injected intravenously with 100 mL of saline. At 72 h post injection, the tumor on the right rear flank of each mouse was subjected to photothermal treatment by exposure to the diode laser at a power density of 0.7 W cm!2for 10 min. The spot size of the laser beam was adjusted to cover the entire tumor (Figure 3A). During the laser treatment, full-body thermographic images were captured using an infrared camera, as shown in Figure 3B– I. The average temperature of the irradiated area was plotted as a function of the irradiation time (Figure 3J). For the nanocage-injected mice, the tumor surface temperature increased rapidly within one minute to reach 508C and began to plateau after 2 min at "54 8C. In the case of saline-injected mice, the surface temperature remained below 378Cduringtheentiretreatment. Changes to tumor metabolism due to photothermal treatment were monitored using18F-FDG PET. Several human
studies have shown that the use of18F-FDG as a surrogate marker for tumor metabolism in patients undergoing therapy is superior to the responsive evaluation criteria in solid tumors (RECIST), a method that simply evaluates the size of the tumor using an anatomical imaging technique such as computed tomography (CT).[22–25]Measurement of tumor metabolism
with18F-FDG PET/CT imaging was performed before and after laser treatment for mice that had been intravenously injected with either saline or nanocages. Before laser irradia-tion, the18F-FDG PET/CT imaging showed no significant
Table 1. Temperature increase (DT) for aqueous suspensions of Au nanocages upon irradiation by the diode laser for 10 min.
Power density [W cm!2]
Nanocage concentration [particles/mL]
0 109 1010 1011
1 3.58C 10.28C 34.98C 43.98C
0.5 2.38C 6.18C 23.78C 34.58C
Figure 3. A) Photograph of a tumor-bearing mouse under the photothermal treatment. 100 mL of PEGylated nanocages at a concentration of 9 $ 1012particles/mL or saline was administrated
intravenously through the tail vein as indicated by an arrow. After the nanocageshadbeenclearedfromthecirculation(72 hafterinjection),the tumor on the right flank was irradiated by the diode laser at 0.7 W cm!2 with a beam size indicated by the dashed circle. B–G) Thermographic imagesofB–E)nanocage-injectedandF–I)saline-injectedtumor-bearing mice at different time points: B,E) 1 min, C,F) 3 min, D,G) 5 min, and E,I) 10 min. J) Plots of average temperature within the tumors (dashed circle) as a function of irradiation time. All scale bars are 1 cm.
small 2010, 6, No. 7, 811–817 ! 2010 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim www.small-journal.com 813
C
Figure 2.1 – A Schéma de l’approche active en hyperthermie sur des souris. Des nano-particules d’or sont fonctionnalisées pour cibler spécifiquement les cellules cancéreuses. Une solution de nanoparticules d’or est injectée au niveau de la tumeur, puis irradiée après une période d’incubation pour chauffer les cellules cancéreuses. La procédure est répétée jusqu’à guérison [16]. B Sou-ris avant (a) traitement photothermique et (b) après [159]. C Comparaison d’images thermographiques entre une solution de nanocages d’or et une so-lution saline pour une souris après injection intraveineuse dans la queue [46].
2.1.1.3 Limitations et perspectives
Malgré la nature très ambitieuse de cette hyperthermie du cancer, aucun résul-tat de tests cliniques [94] n’a été publié durant ces dernières années. Les dernières publications continuent de vanter les mérites et promesses de cette thérapie photo-thermique mais semblent passer sous silence les véritables difficultés rencontrées [1].
Tout d’abord, il est intéressant de constater que les tests précliniques n’ont été réalisés que sur des tumeurs facilement accessibles et peu profondes. Ceci sou-lève la question de la transparence du corps humain à la lumière. En effet, même dans l’infrarouge la tâche se révèle ardue à cause de l’absorption de l’eau et du sang couplée aux milieux naturellement diffusants que sont les tissus biologiques. L’utilisation d’une fibre optique a été proposée pour outrepasser cette difficulté mais comporte aussi un problème similaire à savoir un échauffement localisé à son extrêmité.
En utilisant une illumination continue, la distribution de température des nano-particules métalliques risque d’être inhomogène au sein d’une tumeur et de diffu-ser dans l’environnement proche. Avec une excitation impulsionnelle, le profil de température reste très confiné autour des nanoparticules, permettant de facilement s’affranchir de cette limitation.
Les seuls tests cliniques par illumination laser réalisés à ce jour, ont été me-nés par la compagnie Nanospectra Biosciences fondée en 2002 par West et Halas. L’approche repose sur l’injection intraveineuse de nanocoquilles silicium-or ciblant passivement les cellules cancéreuses du cou et de la tête des patients. Les résultats de ces tests n’ont pas encore été publié alors que l’approche magnétothermique a déjà montré des résultats de tests cliniques.
Ainsi, il semblerait qu’à court terme le traitement du cancer par hyperthermie rencontre encore quelques sérieux problèmes, notamment l’opacité des tissus hu-mains. Les différent moyens d’excitation des nanoparticules pourraient néanmoins apporter une alternative à moyen-long terme. A court terme, il n’en demeure pas moins que la thérapie photothermique s’avère prometteuse pour des applications plus modestes comme la destruction des glandes sébaccées responsables de l’acné [129].
2.1.2 Transfert de médicaments
Dans le domaine biomédical, la thermoplasmonique peut également s’avérer intéressante pour le transfert de médicaments in vivo. En fonctionnalisant des nanoparticules d’or avec des agents thérapeutiques, il est possible de contrôler précisément l’instant et la quantité de médicaments délivrés à l’organisme. Les na-noparticules d’or transportent les médicaments aux cellules cibles et relâchent les agents thérapeutiques suite à une excitation externe. Celle-ci peut être de nature différente, la lumière, les ultrasons ou les champs magnétiques oscillants sont ainsi plusieurs moyens d’induire un échauffement suffisant des nanoparticules pour la libération des médicaments. Bien que l’idée de ce transfert de médicaments
as-sisté par résonances plasmons localisés ait été proposé en 2000 par West [151],
2005-2006[136,165]. Chen a réussi une transfection cellulaire en attachant des protéines
fluorescentes à des nanobâtonnets d’or par l’intermédiaire d’un brin d’ADN [44].
Un changement de forme des nanobâtonnets en nanosphères induit par une ex-citation femtoseconde dans l’infrarouge provoque la libération du brin d’ADN dans des cellules HeLa qui deviennent alors fluorescentes. En 2007, Paasonen et
ses collègues ont proposé [128] l’utilisation de liposomes (vésicules artificielles
formées par des bicouches lipidiques concentriques) fonctionnalisés avec des na-noparticules d’or dont l’élévation de température entraîne une perméabilisation de la paroi des liposomes relâchant alors les médicaments. Outre les mécanismes de rupture thermique et de déformation thermique, la formation de bulles per-met également de modifier la perméabilité des membranes de liposomes. Skirtach a introduit une approche se basant sur les globules rouges remplis de molécules fluorescentes et fonctionnalisés avec des nanoparticules d’or [54].
Le transfert de médicaments assisté par thermoplasmonique se révèle promet-teur en raison de la diversité des méthodes de libération des agents thérapeutiques et de la nature des composés actifs. En parallèle avec l’hyperthermie des tumeurs, les limitations restent intrinsèques aux tissus biologiques (opacité, diffusivité). 2.1.3 Thermophotovoltaïque
La limitation théorique du rendement de conversion de l’énergie solaire est
donnée par la limite de Shockley-Queisser (≈ 30% )[73]. Les panneaux solaires
conventionnels ne peuvent pas outrepasser cette limite, quel que soit le matériau semiconducteur utilisé, nécessitant le développement de nouvelles techniques afin d’améliorer ce faible rendement énergétique. Les principales pertes d’énergie pro-viennent des photons d’énergie différente de l’énergie de la bande interdite du semiconducteur utilisé. Les photons d’énergie supérieure thermalisent les paires électrons-trous alors que les photons d’énergie plus faible contribuent à l’échauf-fement du matériau. A cela s’ajoutent notamment les pertes dues au rayonnement thermique, aux réflexions, ainsi qu’aux recombinaisons radiatives et non radiatives des paires électrons-trous.
L’intégration de la plasmonique dans les cellules photovoltaïques connaît un en-gouement certain depuis quelques années. Plusieurs techniques ont été proposé afin de réduire l’épaisseur de la couche semiconductrice tout en conservant (ou
améliorant) l’absorption optique et réduisant les pertes par recombinaison [92].
Une publication de Atwater [10] dresse un état de l’art sur ces nouveaux projets
pour intégrer la plasmonique aux cellules photovoltaïques. Trois stratégies diffé-rentes en ressortent afin de piéger les photons dans le semiconducteur. La première repose sur la diffusion exaltée des nanoparticules métalliques qui, localisées dans la couche supérieure du semiconducteur, génèrent des diffusions multiples dans le semiconducteur. La deuxième consiste à utiliser l’exaltation de champ proche des nanoparticules métalliques à la résonance plasmon afin de localiser l’énergie incidente à la jonction p-n. La dernière configuration se base sur l’excitation des plasmons de surface propagatifs au niveau d’une interface métal/semiconducteur permettant de confiner la lumière dans le semiconducteur.
NATURE MATERIALS | VOL 11 | MARCH 2012 | www.nature.com/naturematerials 177
commentary
can be used to develop spectral splitters and integrate them with the subcells to realize the planar, optically-in-parallel architecture in Fig. 3b. In a further advanced design, the subcells can be integrated with dedicated photonic structures that enable light trapping and angular restriction of emitted photons optimized for each subcell, thus also mitigating entropy losses in photon-to-electron conversion described above.
At first sight, the architecture in Fig. 3b seems relatively complex, as it involves the layer-transfer of multiple ultrathin semiconductor slabs, their integration with a microphotonic spectrum-splitting structure, and the realization of an electrical interconnection scheme. However, similarly complex architectures are routinely made today in components in optical telecommunication networks, where photonic integrated circuits such as wavelength-division multiplexers, optical splitters, filters and detector arrays are fabricated on a single chip. Indeed, in the new ultrahigh-efficiency solar-cell design proposed here, the solar cell must be seen as a complex optical integrated circuit that is optimized to convert light from the Sun to electricity.
The planar multi-junction design can be realized in a practical and scalable way using recent advances in the research and commercial development of epitaxial liftoff26 and layer-transfer printing
techniques for thin-film single-crystal
Si and III–V compound semiconductor absorbers (Fig. 4a,b). Indeed, using epitaxial liftoff, world-record 1-sun single-junction solar-cell efficiencies have been recently achieved1; near-record efficiencies have
been obtained using cells fabricated by transfer printing27. Furthermore, we note
that soft-imprint lithography provides a scalable method for the synthesis of low-cost large-area arrays of nanopatterned light directors, light-trapping structures or structures with engineered optical density of states (Fig. 4c). It is now well established that soft-imprint lithography has a deep-subwavelength resolution, maintained over a large area, which is required to realize the light-management structures described here.
In conclusion, we describe several solar-cell architectural features that may pave the way towards achieving ultrahigh-efficiency photovoltaics. Our current work at the DOE Light–Material Interactions in Energy Conversion Center at CALTECH and the Light Management in new Photovoltaics Materials Programme at AMOLF is centred on investigation of these structures for improved solar-energy conversion. Whereas much effort in the past has focused on materials and device design in photovoltaics, we suggest that renewed focus on the science and technology of nano- and microphotonics for light management inside the solar cell has considerable potential. The photonic
architectures described here address several distinct entropic and energy losses incurred in a conventional solar cell, as summarized in Fig. 5. Although many practical challenges await, the directions described here have considerable potential to enable very high photovoltaic efficiencies that have previously only been a wish rather than a
concrete objective. ❐
Albert Polman is in the FOM Institute AMOLF, Science Park 104, 1098 XG Amsterdam, the Netherlands; Harry A. Atwater is in the California Institute of Technology, Pasadena California 91125, USA.
e-mail: polman@amolf.nl; haa@caltech.edu
References
1. Green, M. A., Emery, K., Hishikawa, Y., Warta, W. & Dunlop, E. D. Prog. Photovolt. Res. Appl. 20, 12–20 (2012). 2. Yuen, H. in Renewable Energy and the Environment SRWB3
(OSA Technical Digest, 2011).
3. Technology Roadmap — Solar Photovoltaic Energy (International Energy Agency, 2010); http://www.iea.org/papers/2010/pv_ roadmap.pdf
4. Shockley, W. & Queisser, H. J. J. Appl. Phys. 32, 510–519 (1961). 5. Green, M. A. Third-generation Photovoltaics: Advanced Solar
Energy Conversion (Springer, 2006).
6. Martí, A. & Luque, A. Next Generation Photovoltaics: High Efficiency through Full Spectrum Utilization (Institute of Physics, 2003).
7. Landsberg, P. T. & Tonge, G. J. Appl. Phys. 51, R1–R20 (1980). 8. Ruppel, W. & Würfel, P. IEEE Trans. Electron. Dev.
27, 877–882 (1980).
9. Würfel, P. Physica E 14, 18–26 (2002). 10. Campbell, P. & Green, M. A. IEEE Trans. Elec. Dev.
33, 234–239 (1986).
11. Araújo, G. L. & Martí, A. Solar Energy Mater. Solar Cells
33, 213–240 (1994).
12. Tiedje, T., Yablonovitch, E., Cody, G. D. & Brooks, B. G. IEEE Trans. Electron. Dev. 31, 711–716 (1984). 13. Yablonovitch, E. J. Opt. Soc. Am. 72, 899–907 (1982). 14. Yu, Z. F., Raman, A. & Fan, S. H. Proc. Natl Acad. Sci. USA
107, 17491–17496 (2010).
15. Callahan, D. M., Munday, J. N. & Atwater, H. A. Nano Lett.
12, 214 (2011).
16. Luque, A. Solar Energy Mater. Solar Cells 23, 152–163 (1991). 17. Atwater, H. A. & Polman, A. Nature Mater. 9, 205–213 (2010). 18. Atwater, J. H. et al. Appl. Phys. Lett. 99, 151113 (2011). 19. Laux, E., Genet, C., Skauli, T. & Ebbesen, T. W. Nature Photon.
2, 161–164 (2008).
20. Coenen, T., Vesseur, E. J. R. & Polman, A. ACS Nano http://dx.doi.org/10.1021/nn204750d (2012).
21. Spinelli, P., Verschuuren, M. A. & Polman, A. Nature Commun. http://dx.doi.org/ 10.1038/ncomms1691 (in the press). 22. Ferry, V. E. et al. Nano Lett. 11, 4239–4245 (2011). 23. Imenes, A. G. & Mills, D. R. Solar Energy Mater. Solar Cells
84, 19–69 (2004).
24. Barnett, A. et al. Prog. Photovolt. Res. Appl. 17, 75–83 (2009). 25. Green, M. A. & Ho-Baille, A. Prog. Photovolt. Res. Appl.
18, 42–47 (2010).
26. Yablonovitch, E., Hwang, D. M., Gmitter, T. J., Florez, L. T. & Harbison, J. P. Appl. Phys. Lett. 56, 2419–2421 (1990). 27. Yoon, J. et al. Nature 465, 329–333 (2010).
Acknowledgements
The authors acknowledge helpful discussions with Eli Yablonovitch, John Rogers, Paul Braun, Nathan S. Lewis, Ralph Nuzzo and Enrique Canovas. The Caltech portion of this work was supported by DOE Office of Basic Energy Sciences ‘Light–Material Interactions in Energy Conversion’ Energy Frontier Research Center under grant DE-SC0001293. Work at AMOLF is part of the research programme of FOM which is financially supported by NWO; it is also supported by the European Research Council. This work is also part of the Global Climate and Energy Project (GCEP).
Problem Solution Effi ciency (%) 100 80 60 40 20 0
Energy loss in Carnot cycle
Entropy loss in absorption or emission Entropy loss due to non-reciprocity
Energy loss due to thermalization or lack of absorption
Entropy loss due to lack of angle restriction Entropy loss to incomplete light trapping and reduced QE
Conventional single-junction solar cell
Intrinsic loss Multi-junction solar cell Surface light directors Light-trapping structures, density of states engineering
Figure 5 | Thermodynamic losses in solar-energy conversion. The maximum efficiency realized for a conventional single-junction solar cell is 28.3% (indicated in green). Dark blue bars indicate entropy-related losses and light blue bars indicate energy-entropy-related losses. The main energy loss is due to
thermalization and lack of absorption. The solutions to reducing the entropy- and energy-loss problems are listed in the right-hand column.
© 2012 Macmillan Publishers Limited. All rights reserved
Figure 2.2 – Schéma des pertes en photovoltaïque et des solutions technologiques propo-sées [138].
2.1.3.1 Principe
Le principe de cellules thermophotovoltaïques consiste à introduire un trans-ducteur qui va accorder la large distribution spectrale du rayonnement thermique du Soleil avec la bande étroite de conversion énergétique efficace d’une jonction p-n. En éclairant ainsi le semiconducteur exclusivement avec des photons d’éner-gie proche de la bande interdite, les pertes dues à l’énerd’éner-gie incidente des photons peuvent être grandement réduites. Les pertes par recombinaison radiative et ré-flexion sur le semiconducteur sont également limitées car les photons émis sont réabsorbés par le transducteur. Les pertes restantes sont alors inhérentes à l’émis-sion du transducteur et à l’efficacité de génération de photocourants la cellule pho-tovoltaïque. Le transducteur est composé d’un système absorbeur-émetteur qui consiste à absorber une large gamme spectrale du rayonnement incident, de ma-nière efficace en minimisant les réémissions radiatives afin de chauffer un émetteur dont les propriétés optiques sont conçues pour émettre un rayonnement spectra-lement étroit énergétiquement proche de la bande interdite du semiconducteur. Les structures plasmoniques représentent des candidats pertinents pour ce sys-tème absorbeur-émetteur en raison du contrôle morphologique de leurs propriétés optiques. En théorie, en négligeant toutes les pertes possibles à l’exception des recombinaisons radiatives, le rendement idéal, atteint 85% dans le cas d’un ab-sorbeur parfait. Il semble alors possible d’envisager des rendements maximums
de l’ordre de∼50%−60% pour une cellule thermophotovoltaïque dans un futur
assez proche.
2.1.3.2 Etat de l’art
L’intérêt de la thermoplasmonique pour l’énergie solaire reste récent [48, 135]