S w i s s - N O S O
I n f e c t i o n s n o s o c o m i a l e s e t h y g i è n e h o s p i t a l i è r e : a s p e c t s a c t u e l s Volume 11 N°2, 2004
Editorial
Optimalisation de l’utilisation
des antibiotiques en réanimation
Didier Pittet, Philippe Eggimann, Stephan Harbarth, Hugo Sax, Genève
La résistance aux agents microbiens se développe de plus en plus rapidement et de manière quasi universelle, tant du point de vue des bacilles à Gram-négatif que de celui des coques à Gram-positif, et ce phénomène est particulièrement marqué pour les microrganismes respon-sables d’infections nosocomiales. Dans de nombreuses situations, seul un nombre restreint d’antibiotiques de-meure efficace, et le traitement d’infections à germes résistants est l’un des défis importants de la décennie. En effet, ces infections sont caractérisées par un traitement moins efficace, une survie souvent moins bonne, et une prise en charge impliquant l’utilisation de ressources addi-tionnelles importantes (1).
Les services de réanimation, dans lesquels le taux d’in-fections nosocomiales est cinq à dix fois plus élevé que dans les autres secteurs hospitaliers, ont en commun plusieurs caractéristiques qui peuvent les transformer en épicentres du développement de la résistance bactérienne. Les facteurs de risque d’acquisition et de développement de cette résistance sont constitués par les éléments sui-vants: consommation élevée d’agents antimicrobiens; pa-tients en situation critique souffrant d’affections multiples et victimes de nombreuses comorbidités; usage de mesu-res invasives, telles que les accès vasculaimesu-res ou la ventila-tion mécanique, associées au bypass des résistances de l’hôte, ainsi qu’une exposition continue à un réservoir environnemental de micro-organismes hospitaliers; diffi-culté de respect des mesures d’hygiène hospitalière, compte tenu de la surcharge chronique de travail (2).
Les données du Réseau national nord-américain de surveillance des infections nosocomiales (National Nosocomial Infections Surveillance, NNIS system) ont révélé l’importance du problème de la résistance bacté-rienne parmi les germes nosocomiaux responsables d’in-fections en réanimation. Ces données ont permis de dé-terminer que le risque d’infection nosocomiale variait en fonction du type de secteur de réanimation. Actuellement, les principaux germes responsables d’infections
En 1996, Andreas Widmer de Bâle me débauchait de mes activités en médecine interne en me proposant de m’intéresser au domaine de l’hygiène hospitalière qui, selon lui, devait devenir l’un des domaines principaux en matière de santé publique. Il avait raison: les activités de prévention et de contrôle de l’infection constituent aujourd’hui la clé de voûte de la qualité des soins aux patients. Les contraintes liées aux compressions budgétaires et à l’évolution des systèmes de santé ne font qu’augmenter la problématique.
Ainsi, le chantier est vaste et la tâche abondante. Par un tirage de 22 000 exemplaires et environ 100’000 accès annuels au site , le bulletin fait partie intégrante du domaine de la prévention des infections et est devenu une référence en santé publique. C’est pour moi ainsi à la fois un défi et un grand honneur de poursuivre le travail précieux réalisé jusqu’à aujourd’hui par Patrick Francioli, qui, depuis 1994, a assuré la coordination de la parution de 40 numéros de manière à la fois élégante et efficace. Un résumé des dix premières années de Swiss-NOSO paraîtra prochainement.
Notre bulletin doit certes continuer de constituer un guide pratique pour notre pays dans les domaines de l’hy giène et de l’épidémio-logie hospitalière, basé sur les évidences scientifiques reconnues au plan international et adapté aux spécificités nationales. Il est temps de présenter l’éventail des articles parus au cours des dix derniers numéros sous une forme organisée, d’en revoir le contenu, éven-tuellement de le réviser. A l’aide du NOSOmail, le bulletin deviendra encore plus efficace. Celui-ci doit aussi servir de plate-forme d’échange: ainsi, vous êtes sollicités en tant que lecteurs à nous faire connaître vos opinions et vos questions.
Ce nouveau numéro traite de l’utilisation des antibiotiques en réanimation, ainsi que des mesures applicables afin de lutter contre les résistances bactériennes dans ces secteurs. Alors que conformé-ment aux données de l’étude snip03, la moitié des patients hospita-lisés sont sous traitement antibiotique, ce problème est de toute évidence d’actualité.
En renouvelant son mandat auprès de Swiss-NOSO, l’Office fédéral de la santé publique (OFSP) souhaite que notre groupe poursuive sur sa lancée et trouve l’énergie d’accepter de nouvelles tâches dépassant le domaine de la simple information d’une part, et les limites de l’hôpital d’autre part. La coopération opération-nelle concerne en effet aujourd’hui en outre la surveillance des infections au niveau national, la formation des professionnelles en prévention et contrôle de l’infection, la préparation contre les situations émergentes comme SARS, CJD, fièvres hémorragiques, ou multi-résistance aux antibiotiques, de façon à coordonner de manière toujours plus efficace les interventions préventives. Au plan stratégique, un nouveau mandat nous a été confié par l’OFSP ; celui d’élaborer, au cours de cette année encore, les priorités en matière de prévention et contrôle des infections pour notre pays, ainsi que les axes de coopération avec les organes centraux, et l’OFSP en particulier. Une opportunité à ne pas manquer et dont le bulletin sera témoin.
nosocomiales sont les coques à Gram-positif, tels que les staphylocoques à coagulase négative, Staphylococcus
aureus et les entérocoques, qui sont responsables de la
plupart des bactériémies et infections du sang, ainsi que les bacilles à Gram-négatif, tels que Pseudomonas
aeruginosa, Enterobacter spp. et Klebsiella pneumoniae, responsables avec S. aureus de la plupart
des pneumonies liées à la ventilation mécanique. Selon les données du réseau NNIS, le degré de résistance antimicrobienne des principaux agents responsables d’in-fections nosocomiales en réanimation a nettement aug-menté au cours des cinq dernières années. Entre janvier 1998 et juin 2003, la proportion de souches de staphylo-coques dorés résistant à la méticilline était en moyenne de 52%, celle des entérocoques résistant à la vancomycine de 12%, celle de Klebsiella pneumoniae résistant aux céphalosporines de troisième génération de 6%, celles de
Enterobacter spp. de 27%, et enfin 19% des souches de P. aeruginosa étaient résistantes à l’imipenem. Ce
phé-nomène de résistance touche également différentes espè-ces de Candia (www.cdc.gov/ncidod/hip/ARESIST/ AR_ICU.htm).
Cette revue est centrée sur les différentes stratégies destinées à optimiser l’utilisation des antibiotiques en réa-nimation. Pour les médecins en charge d’un tel service, ces stratégies sont primordiales, car elles sont de nature à influencer très directement l’épidémiologie des infections nosocomiales dont l’augmentation est en partie liée à une mauvaise prise en charge antimicrobienne des patients qui y sont admis (3). En dehors des facteurs de risque évo-qués ci-dessus, une attention particulière doit être portée sur les patients nécessitant une hospitalisation prolongée en réanimation. Ces derniers, souvent sévèrement atteints dans leur santé, sont presque systématiquement colonisés par des bactéries résistantes. Ils représentent un risque particulièrement élevé de transmission de germes résis-tants de patient à patient et de développement de réser-voirs de germes résistants au sein des secteurs de réani-mation.
A. Prévention des infections nosocomiales
Les stratégies de prévention des infections nosocomiales constituent l’un des piliers importants de la réduction de l’utilisation des agents antimicrobiens. La plupart des hô-pitaux, dans lesquels un programme efficace de préven-tion des infecpréven-tions a été introduit, sont parvenus à réduire l’incidence des infections hospitalières par les stratégies de prévention mises sur pied et les interventions dirigées sur les principaux sites de ces infections (2).
L’impact à long terme d’interventions complexes, résul-tant de démarches visant à une amélioration globale et durable de la qualité des soins, est souvent notable et
associé à une réduction de la nécessité d’utiliser des antibiotiques.
Concernant l’hygiène des mains par exemple, dont il est bien établi qu’elle est souvent déficiente, la conduite d’in-terventions multimodales est préférable sur le long terme. Les paramètres importants de ces stratégies comprennent les rappels sur les lieux de travail, l’emploi préférentiel de la friction hydro-alcoolique par rapport au lavage des mains conventionnel; la mesure répétée du taux d’obser-vance et la restitution de la performance, ainsi que le soutien institutionnel (www.hopisafe.ch). Globalement, les résultats obtenus à Genève ont consisté en une améliora-tion notable et soutenue de l’observance moyenne institu-tionnelle à l’hygiène des mains, associée à une diminution de près de 50% des taux de prévalence des infections nosocomiales, sur une période de 4 ans. Ces résultats ont largement été repris par un groupe d’experts internatio-naux au terme d’un processus de revue systématique de toutes les données publiées au cours de la dernière dé-cennie. Ces travaux ont abouti entre autres à la publica-tion de recommandapublica-tions pratiques pour l’hygiène des mains en milieu de soins sous l’égide de plusieurs sociétés et groupements nord-américains (www.cdc.gov/mmwr/ preview/mmwrhtml/rr5116a1.htm).
De même, des programmes d’éducation spécifiquement destinés à prévenir les infections liées aux accès vasculai-res ont été développés (2). Fondés sur la démonstration de leur efficacité dans la littérature, ces programmes com-prennent en général des directives précises sur la pose des différents accès vasculaires (préparation du matériel, désinfection de la peau, précautions stériles maximales, technique détaillée d’insertion), sur leur utilisation (désin-fection systématique des mains, manipulation des réseaux) et sur les soins qui leur sont apportés (schéma de rempla-cement, type et fréquence de réfection des pansements). A titre d’exemple, à Genève, l’ensemble des médecins et infirmiers(ères) en charge des patients ont été spéciale-ment et régulièrespéciale-ment entraînés à appliquer de telles re-commandations en réanimation médicale. Dans les 8 mois suivant l’introduction d’un tel programme, l’incidence des bactériémies liées aux accès vasculaires a diminué de 67% (de 6.6 à 2.3 bactériémies primaires par 1000 jour-cathéters) et celle des infections des sites d’insertion des cathéters, de 64% (de 9.2 à 3.3 bactériémies primaires par 1000 jour-cathéters). Parallèlement, une réduction de 35% de l’incidence globale des infections nosocomiales acquises en réanimation a été observée. Cette réduction s’est maintenue pendant deux ans et demi après l’inter-vention (2). Une démarche comparable a conduit d’autres équipes à développer des programmes spécifiques, dont l’introduction a également été suivie d’une réduction si-gnificative des taux d’infection. Le concept d’introduction coordonnée d’une stratégie préventive s’est imposé
pre-nant en compte l’ensemble des mesures de prévention dans le processus de prise en charge des patients. Il est désormais à la base des nouvelles directives de préven-tion des infecpréven-tions liées aux accès vasculaires, publiées en août 2002 (http://www.cdc.gov/mmwr/preview/ mmwrhtml/rr5110a1.htm) regroupant environ 15 organi-sations scientifiques.
B. Stratégie d’optimisation de l’utilisation
des antibiotiques
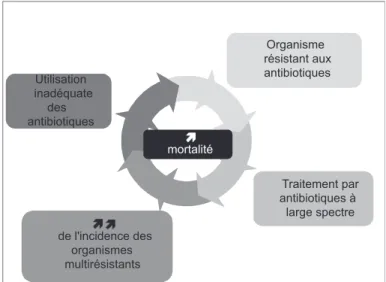
En sélectionnant le choix et en orientant l’utilisation des antibiotiques au sein des secteurs de réanimation, non seulement la qualité et la survie des patients s’en trouvent améliorées, mais lorsqu’un traitement antibiotique adé-quat est prescrit, les chances de développement futur de résistance antimicrobienne sont minimisées (Figure 1) (2). De nombreuses stratégies ont été développées afin d’op-timiser l’utilisation des agents antimicrobiens et de limiter le développement de la résistance (4) (Tableau 1). Seule une partie a été testée, et dans une faible proportion, des essais cliniques répondent aux critères de qualité de la médecine basée sur les preuves. Il paraît cependant im-portant de revoir ces stratégies au sens large, afin de ne pas se restreindre aux trop rares essais cliniques conduits dans le respect complet des règles de cet art, au risque de méconnaître certaines stratégies qui s'avéreront efficaces dans le futur.
1. Directives et protocoles
La plupart des directives ou protocoles concernant l’ad-ministration d’antibiotiques ont été élaborés soit locale-ment, soit au sein de sociétés nationales ou de groupe-ments internationaux afin d’éviter la prescription inutile d’antibiotiques et/ou d’accroître leur efficacité. Malheu-reusement, ces recommandations sont souvent difficiles à transformer en algorithmes simples et unanimement ac-ceptées, et l'on observe un certain degré de déviance par rapport au respect de ces recommandations. Cela tient probablement au fait que le processus de décision est très souvent guidé en pratique quotidienne par les particulari-tés des patients pris en charge, ainsi que par le jugement et l’expérience du médecin traitant. Les directives déve-loppées au sein d’un service ont davantage de chance d’être acceptées par les équipes de soins, et leur implan-tation d’être couronnées de succès.
De nombreux systèmes d’aide à la décision ont été élaborés, certains bénéficiant de développements infor-matiques complexes. Ainsi, par exemple, un guide auto-matisé de l’administration des antibiotiques a été édité au Latter Day Saints Hospital de Salt Lake City, Utah, USA. Il combine un guide du choix des antibiotiques et des règles précises d’administration destinée à diminuer le
taux d’inadéquation des traitements prescrits, et à réduire les effets secondaires potentiels. Selon les données pu-bliées en mai 1996, ce système a effectivement permis de diminuer la fréquence de prescriptions d’antibiotiques aux patients allergiques, l’incidence globale des effets secon-daires induits par les antibiotiques, le nombre total de doses d’antibiotiques prescrites, ainsi que les coûts asso-ciés à l’administration des antimicrobiens (Ann Intern Med 1996; 124:884).
L’implication des pharmaciens hospitaliers, par l’orga-nisation d’interactions systématiques avec les médecins prescripteurs, en cas de situations hors des règles de base prédéfinies, est une autre méthode qui a prouvé son efficacité.
D’autres types de recommandations ont été édictées dans des situations cliniques plus spécifiques à la réanima-tion, telles que dans les cas de traitement de la pneumonie nosocomiale liée à la ventilation mécanique. Ainsi, Singh et coll. ont proposé d’identifier, au troisième jour de traitement, les patients suspects de pneumonie par rap-port à ceux qui ne l’étaient pas, et d’interrompre le traitement chez ces derniers. Les auteurs ont constaté une évolution similaire des cas non traités, suggérant que ce groupe de patients n’avait pas de pneumonie, ainsi qu’un taux réduit de surinfection à germes pathogènes résistants (Am J Respir Crit Care Med 2000; 162:505). Comme
Utilisation inadéquate des antibiotiques Organisme résistant aux antibiotiques Traitement par antibiotiques à large spectre de l'incidence des organismes multirésistants mortalité
Figure 1: Conséquences de l’utilisation inadéquate des antimocrobiens
Tableau 1: Stratégies de prévention de la résistance antimicrobienne
1. Directives des choix et protocoles d’utilisation 2. Formulaires de restriction
3. Changement programmé des régimes antimicrobiens 4. Traitements antimicrobiens combinés
5. Rotation des agents antimicrobiens 6. Désescalade du traitement antimicrobien
subtilement démontré par un groupe d’investigateurs coor-donnés par JY Fagon, le recours systématique à des prélèvements obtenus par fibroscopie bronchique, qui augmente la spécificité diagnostique, permet de ne traiter que les épisodes infectieux clairement documentés, et de réduire l’utilisation des antibiotiques de manière très signi-ficative (Ann Intern Med 2000; 132:621).
2. Formulaires de restriction des agents
antimicrobiens
La restriction de l’utilisation de certains antibiotiques ou de certaines classes d’agents antimicrobiens par l’édition de formulaires restrictifs a permis une réduction des dé-penses hospitalières, ainsi que des effets secondaires liés aux antibiotiques. Cette approche concerne généralement la prescription d’agents antimicrobiens à large spectre dont l’usage immodéré est directement associé au déve-loppement rapide de résistances, ainsi que dans les cas où la toxicité de certains agents est fréquente et/ou facilement décelable. Des expériences très variables ont été repor-tées dans la littérature par rapport à l’emploi de ces formulaires de restriction. Compte tenu des différents problèmes méthodologiques des études à disposition, il est difficile d’affirmer aujourd’hui que l’instauration systé-matique de formulaires de restriction serait une mesure réellement efficace pour réduire l’émergence de résistan-ces ou pour améliorer l’efficacité potentielle des agents antimicrobiens. Les formulaires de restriction sont toute-fois très utiles dans des situations d’épidémies, d’infec-tions à germes multirésistants, en particulier lorsqu’ils sont combinés aux différentes mesures de prévention des in-fections mises en place, ou lorsqu’ils sont associés à un programme d’éducation sur l'utilisation des agents antimicrobiens.
En revanche, les formulaires de restriction ne peuvent pas être considérés comme une alternative suffisante à la nécessité impérative d’un choix judicieux des agents antimicrobiens. En effet, la résistance microbienne peut apparaître pour des antibiotiques non restreints par la liste, voire pour ceux inclus dans cette liste. Ainsi, dans un travail publié en 1998, au cours d'une situation d’épidé-mie d’infections à Klebsiella spp. productrices de B-lactamase à spectre élargi, Rahal et coll. ont introduit des recommandations pour le traitement antibiotique rédui-sant l’utilisation des céphalosporines. Celui-ci fut diminué de 80% et accompagné d’une réduction de 44% des conditions d’infection ou de colonisation par ces micro-organismes multirésistants. Dans un même temps, cepen-dant, l’utilisation d’imipenem augmentait de 141% et était associée à un accroissement de 69% de l’incidence des
P. aeruginosa résistant à cet antibiotique (JAMA 1998;
280:1233).
3. Changement programmé des régimes
antimicrobiens
Dans une étude publiée en 1997, Kollef et coll. ont évalué l’influence d’un changement programmé des régi-mes antimicrobiens sur l’incidence des infections nosocomiales chez des patients au cours d’une chirurgie cardiaque. Durant les six mois précédant l’intervention, une céphalosporine de troisième génération a été utilisée pour traiter les infections bactériennes à bacilles à Gram-négatif. Au cours des six mois suivants, c’est une fluoroquinolone (ciprofloxacine) qui a été utilisée en pre-mière intention. De manière surprenante, l’incidence de pneumonies liées à la ventilation mécanique a été réduite significativement dans les six mois au cours desquels l’administration d’une fluoroquinolone a été recomman-dée. On a noté une réduction significative de l’incidence des pneumonies et bactériémies dues au Gram-négatif. Cette expérience a été suivie d’une série de changements programmés des régimes antimicrobiens proposés dans le traitement de première intention des infections bacté-riennes à bacille à Gram-négatif chez les patients admis en réanimations médicale et chirurgicale (Am J Respir Crit Care Med 1997; 156:1040). Globalement, le même auteur rapporte, dans une revue publiée en 1999, que l’adéqua-tion de la prescripl’adéqua-tion d’antibiotiques dans ce type d’in-fection s’est améliorée (Clin Chest Med 1999; 20:653). Cependant, l’impact à long terme de tels changements, programmés et répétés des régimes antimicrobiens pro-posés en première intention, demeure inconnu, en parti-culier lorsque l’on considère les capacités extraordinaires des pathogènes responsables des infections nosocomiales à développer des résistances sélectives envers certaines classes d’antibiotiques.
4. Traitements antimicrobiens combinés
La recommandation de prescrire des traitements antimicrobiens combinés a souvent été présentée comme l’une des stratégies permettant de réduire le développe-ment de résistances bactérienne, telle qu’elles sont con-nues dans le cas du traitement de Mycobacterium
tuberculosis (4). Malheureusement, hormis cet exemple
historique, il n’existe actuellement pas de données con-vaincantes à ce jour permettant d’affirmer définitivement le bien-fondé de cette hypothèse pour d’autres bactéries que les mycobactéries. L’absence de données définitives, démontrant l’avantage potentiel des traitements combi-nés, est regrettable en particulier pour les infections sévè-res, telles que bactériémies ou pneumonies en réanimation ou chez les patients neutropéniques (2).
Cependant, l’intérêt potentiel des traitements combinés, visant à réduire l’émergence possible des résistances bac-tériennes, pourrait résider dans le fait qu’un traitement
initial adéquat, en améliorant le pronostic vital, limiterait la possibilité de développement de germes résistants et se-rait d’un bénéfice clinique accrû. De plus, certaines com-binaisons antibiotiques pourraient être associées à une meilleure efficacité microbiologique dans certains essais cliniques et situations épidémiologiques particulières. Ainsi, quoique l’avantage de traitements antimicrobiens combi-nés ne soit pas définitivement prouvé, et n’ait pas fait l’objet d’essais cliniques contrôlés, conduits dans les rè-gles de l’art de la médecine basée sur les preuves, cette approche nécessite la poursuite d'investigations cliniques, avant qu’une conclusion définitive puisse être proposée.
5. Rotation des agents antimicrobiens
Des données épidémiologiques mentionnent que la ré-sistance antimicrobienne semble devoir suivre un schéma cyclique. En effet, l’introduction de tout nouvel agent antibiotique est souvent associée à une utilisation exagé-rée de ce composé. Ainsi, il est probable que, lorsqu’un certain niveau d’utilisation est dépassé, la résistance bac-térienne se développe, rendant l’antibiotique inefficace à terme, et donc progressivement abandonné, le cycle se terminant par l’introduction d’un nouvel agent antimicrobien. La durée d’un tel cycle dépend de la capacité des micro-organismes de développer une résistance et de la façon dont l’antibiotique est utilisé. Par exemple, une seule mutation chromosomique permet à S. aureus de déve-lopper une résistance aux fluoroquinolones, alors que celle de Enterococcus faecium à la vancomycine re-quiert différentes mutations chromosomiques qui ne sont pas influencées par l’utilisation prolongée de cet antibioti-que.
L’ère post-antibiotique est parfois définie comme une période durant laquelle les antibiotiques n’auraient plus d’utilité clinique, sans qu’aucun substitut ne soit disponi-ble. Ainsi, la stratégie de rotation des agents antimicrobiens a été ainsi conçue afin de tenter de maîtriser le cycle infernal du développement de résistances et d’éviter d’en-trer dans l’ère post-antibiotique. Cette stratégie consiste en l’utilisation contrôlée d’un antibiotique, ou d’un nom-bre limité d’antibiotiques dans un secteur défini, complé-tée par un changement programmé de ces derniers, rem-placés par d’autres agents antimicrobiens; ceci afin d’évi-ter le développement de résistances bactériennes. Aujourd'hui on ne sait pas précisément de quelle manière la rotation des agents antimicrobiens doit être conçue et appliquée dans la pratique.
Afin d’assurer une activité persistante et continue de tous les agents antimicrobiens inclus dans les cycles répé-tés dans leur utilisation, il est concevable que les agents antimicrobiens initiaux soient réintroduits au cours d’un cycle ultérieur. L’objectif final du principe de cette rota-tion des agents antimicrobiens est de maintenir la quantité
globale d’antibiotiques utilisés au-dessous du niveau criti-que aucriti-quel la résistance bactérienne se développe, per-mettant ainsi de préserver l’efficacité des agents antimicrobiens les plus utiles (2).
Le principe de rotation des antibiotiques est essentielle-ment orienté sur le traiteessentielle-ment empirique des infections, mais il importe qu’il concerne également le traitement dirigé de toutes les infections cliniquement et/ou microbiologiquement documentées. De plus, il est fonda-mental de simplifier le traitement empirique prescrit dès l’identification des micro-organismes responsables de l’in-fection, en préservant l’administration des antibiotiques réservés aux cycles des agents antimicrobiens suivants. Au début de chaque nouveau cycle, il est important de retirer tous les antibiotiques du cycle en cours, et d’intro-duire ceux du cycle à venir simultanément. Les antibioti-ques ou les combinaisons d’antibiotiantibioti-ques, inclus dans les cycles, doivent garantir un niveau élevé d’efficacité et de sécurité pour les patients. Ils ne doivent pas partager les mêmes mécanismes de résistances, et ne doivent pas faciliter le développement de résistances aux antibiotiques utilisés simultanément au cours du cycle en question.
Dans un travail publié en 1991, Gerding et coll., ont évalué l’impact de la rotation des aminoglycosides durant une période de dix ans, utilisant en alternative amikacine et gentamicine. L’émergence de résistance à la gentamicine était un problème clinique documenté, limitant progressi-vement l’emploi de cet antibiotique dans l'institution. Pré-conisant des cycles d’utilisation de l’un ou l’autre de ces antibiotiques, pendant des durées variant de 12 à 51 mois, les auteurs ont pu démontrer une réduction très significative de la résistance à la gentamicine, lorsque l’amikacine a été utilisée, mais un retour aux niveaux antérieurs de résistance lorsque la gentamicine a été réintroduite. Dans un deuxième temps, lorsque cet anti-biotique a été réintroduit plus graduellement, aucune aug-mentation de la résistance n’a été observée (Antimicrob Agents Chemother 1991; 35:1284). Cette expérience prouve que la stratégie de rotation des agents antimicrobiens peut s’avérer efficace à l’intérieur d’une même classe d’antibiotiques pour prévenir et limiter le développement de résistances.
Plusieurs travaux ont été conduits plus récemment afin de déterminer l’impact de la rotation des agents antimicrobiens. L’effet d’une telle stratégie a été rapporté en 2001, dans le cadre de patients traumatisés, hospitali-sés dans une unité de réanimation chirurgicale. Les auteurs ont ainsi comparé les taux de mortalité et l’incidence des infections nosocomiales durant une période de deux ans. Au cours de la première période, l’emploi d’antibiotiques n’a fait l’objet d’aucun protocole. Durant la seconde phase, une stratégie de rotation des agents antimicrobiens variant par cycles de deux mois a été instaurée. Par cette
observation, les auteurs rapportent une réduction signifi-cative de la mortalité associée aux infections à cocci à Gram-positif et à bacilles à Gram-négatif (Crit Care Med 2001; 29:1101).
Gruson et coll. ont observé une réduction de l’incidence des pneumonies liées à la ventilation mécanique suite à l’introduction d’une stratégie de contrôle de l’utilisation des antibiotiques, consistant en une rotation supervisée des agents antimicrobiens couplée à la restriction de l’em-ploi de ceftazidine et de ciprofloxacine, largement utilisés dans l’institution avant l’instauration du programme. Dans ce travail publié en 2001, la sélection des agents antimicrobiens utilisés a été revue mensuellement en fonc-tion de l’épidémiologie des agents pathogènes identifiés au sein du secteur de réanimation et de leur profil de résistances. Les cliniciens effectuaient une rotation des régimes antimicrobiens employés, basée sur une informa-tion en temps réel, permettant ainsi d’améliorer l’efficacité potentielle des antibiotiques au moment où ils étaient prescrits. Par ce travail, la diminution de l’incidence des pneumonies liées à la ventilation mécanique a été princi-palement associée à une réduction du nombre des épiso-des d’infections causées par les bacilles à Gram-négatif et particulièrement P. aeruginosa, Burkholderia cepacia,
Stenotrophomonas maltophilia, et Acinetobacter baumanii ( Am J Respir Crit Care Med 2000; 162:837).
Malgré de nombreux essais cliniques, réalisés dans dif-férentes conditions épidémiologiques, il impossible à ce jour de préciser la place de la rotation prédéterminée des agents antimicrobiens dans la stratégie de lutte contre la résistance bactérienne. En effet, la durée des cycles, le choix des agents antimicrobiens, des stratégies thérapeu-tiques, l’interrelation entre les différents agents pathogè-nes et les diverses classes d’antibiotiques, constituent actuellement des éléments trop complexes pour avoir été complètement investigués en clinique. Ici encore, seul le recours à des essais thérapeutiques conduits dans les règles de l’art pourront répondre à la question.
6. Désescalade du traitement antimicrobien
Il est désormais établi qu’un traitement antimicrobien inadéquat en cas d’infections graves, telles qu’une pneu-monie ou une bactériémie nosocomiale, est associé non seulement à une réponse thérapeutique insuffisante, mais également à une augmentation significative de la morbidité et de la mortalité (2). Un régime antibiotique initial inapproprié est habituellement défini comme l’absence d’un agent antimicrobien efficace contre une classe de pathogènes (exemple: absence de traitement antifongique en cas de candidémie), ou la prescription d’un agent antimicrobien auquel le germe responsable de l’infection est résistant (exemple: administration de flucloxacilline
pour le traitement d’une infection causée par staphyloco-que résistant à la méticilline). L’augmentation de l’inci-dence des infections nosocomiales dues aux bactéries multirésistantes impose aux cliniciens de tenir compte des données épidémiologiques pour établir des recommanda-tions susceptible de fixer le choix d’un traitement antibio-tique initial.
A titre d’exemple, les germes pathogènes les plus cou-ramment associés à l’administration inadéquate d’un trai-tement antimicrobien chez les patients victimes de pneu-monies nosocomiales, incluent les bactéries à Gram-né-gatif capables de développer des résistances aux antibio-tiques (Pseudomonas aeruginosa, Acinetobacter spp.,
Klebsiella pneumoniae, Enterobacter spp.) et les
sta-phylocoques dorés résistant à la méticilline. En ce qui concerne les patients souffrant de bactériémies nosocomiales, les cocci à Gram-positif (MRSA, VRE),
Candida et, moins fréquemment les bactéries à
Gram-négatif, sont les pathogènes le plus souvent associés à un choix antibiotique inadéquat.
Une stratification relative au risque de portage ou d’in-fections à germes résistants peut permettre d’identifier précocement les patients nécessitant des stratégies théra-peutiques. Les facteurs de risque à considérer sont: un traitement antibiotique initial à large spectre, particulière-ment s’il est hospitalier; un séjour prolongé; la présence de matériel médical invasif (accès vasculaires, tubes endotrachéaux, sondes urinaires). Les patients à haut risque infectieux ou colonisés par des germes résistants doivent être traités initialement de manière agressive au moyen d’une combinaison d’antibiotiques, assurant une couverture des agents pathogènes les plus probables, basée sur la situation épidémiologique du secteur de réa-nimation en question. Le choix antibiotique initial peut être modifié par rapport à chaque situation, en examinant les spécimens cliniques et microbiologiques disponibles du patient considéré. Ensuite, le traitement empirique doit être adapté, aussitôt que l’agent pathogène responsable de l’infection est identifié. Il doit être immédiatement interrompu lorsque le diagnostic d’infection a été exclu, ou serait devenu fort improbable. Ce principe de déses-calade du traitement antibiotique est une stratégie qui permet un juste équilibre entre la nécessité d’instaurer un traitement antibiotique initial adéquat chez les patients à haut risque infectieux, et d’éviter l’utilisation inadéquate et inutile d’antibiotiques liés au développement et à l’acqui-sition de résistances. L’application d’une telle stratégie est possible et acceptable lorsque la durée optimale a été définie de tout traitement antibiotique, pour chaque con-dition infectieuse spécifique, et lorsque les différents grou-pes de patients ont été stratifiés par rapport au risque infectieux au sein de l’institution en question, tenant compte
de l’épidémiologie locale en terme de résistances bacté-riennes (4).
Conclusions
Les praticiens en charge d’un service de réanimation doivent développer et promouvoir les stratégies visant à une meilleure utilisation des agents antimicrobiens. Certai-nes, telles que la rotation des antibiotiques, les traitements combinés, les changements programmés des régimes antimicrobiens, ou encore le principe de désescalade, sont extrêmement prometteuses. Ces stratégies ont dé-montré des effets favorables parmi des populations, pour l’instant restreintes, de patients en réanimation. Elles ont permis une réduction des taux d’infections nosocomiales, particulièrement en cas de germes à Gram-négatif
Articles Intéressants
Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower
respiratory tract infections: cluster-randomised, single-blinded intervention trial.
Effet d’un traitement guidé à la procalcitonine sur l’utilisation d’antibiotique et résultat sur les infections des voies respiratoires basses: essai d’une intervention en simple aveugle sur un groupe de patients randomisés.
Christ-Crain M, Jaccard-Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M, Muller B. Lancet 2004;363:600-607.
Les infections des voies respiratoires basses sont fré-quentes, souvent dues à des virus et ne nécessitent pas tous les traitements antibiotiques qu’elles motivent. La distinction entre une infection bactérienne justifiant un tel traitement et une autre pathologie est cependant notoire-ment difficile sur la base des examens cliniques et paracliniques habituellement disponibles lors de la prise de décision. Il en résulte une sur-utilisation des antibioti-ques contribuant à la sélection de micro-organismes ré-sistants. Cette étude a évalué l’utilité du dosage ultra-sensible de la procalcitonine (PCT) sérique, un marqueur précoce et relativement spécifique de l’infection bacté-rienne grave, chez 243 patients vus aux urgences de l’hôpital universitaire de Bâle avec un tableau clinique d’infection des voies respiratoires basses (pneumonie ac-quise à domicile, exacerbation aiguë de bronchopneumopathie chronique obstructive [BPCO], bronchite ou asthme). Après une randomisation garantis-sant la répartition semblable des cas et de leurs caracté-ristiques en deux groupes, la décision d’entreprendre ou de poursuivre une antibiothérapie fut prise selon les critè-res habituels (119 patients, dont 45 pneumonies) ou en recourant en plus à la concentration sérique de la PCT (124 patients, dont 42 pneumonies). Pour ce deuxième groupe, bien que la décision finale soit laissée au libre
choix du médecin en charge du patient, il était fortement recommandé de renoncer aux antibiotiques si la PCT était 0.1 µg/L et recommandé d’y renoncer si elle était entre 0.1 et 0.25 µg/L. Par contre, les antibiotiques étaient recommandés si la PCT était entre 0.25 et 0.5 µg/L et fortement recommandés si elle était > 0.5 µg/L. L’utilisa-tion des antibiotiques fut significativement moindre dans le groupe bénéficiant du dosage de la PCT, que ce soit en termes de fréquence (44% vs 83%, p<0.0001), de durée moyenne de traitement (10.9 ± 3.6 vs 12.8 ± 5.5 jours, p=0.03) ou de coût moyen (96.3 ± 172.8 vs 202.5 ± 250.6 $ US, p<0.0001). L’utilité du dosage de la PCT fut cependant mise en évidence en particulier pour les exacerbations de BPCO et les bronchites aiguës (deux indications controversées à un traitement antibiotique) et pour les personnes âgées. Aucune différence ne fut cons-tatée entre les deux groupes pour la mortalité, la qualité de vie ou la durée du séjour hospitalier. Les auteurs de l’étude concluent que le dosage ultra-sensible et rapide-ment disponible de la PCT sérique peut contribuer à coup sûr à réduire l’utilisation des antibiotiques en cas d’infec-tion des voies respiratoires basses. Ce test aurait donc une utilité clinique, épidémiologique et économique, mais il convient de noter pour ce dernier point que les coûts induits par le dosage de la PCT ne sont pas mentionnés. multirésistants et, plus important, de la mortalité. Des études contrôlées, réalisées selon les règles de l’art de la médecine basée sur les preuves, sont indispensables afin que des décisions et des recommandations plus générales puissent être proposées. Dans tous les cas, les stratégies les plus efficaces sont multidisciplinaires, nécessitant la coopération des médecins traitants, de l’ensemble de l’équipe médico-soignante, des membres du programme de prévention des infections, de la pharmacie et des médecins consultants spécialisés en microbiologie et en maladies infectieuses. Ces programmes hospitaliers, qui peuvent être inclus dans la perspective d’amélioration continue de la qualité des soins, doivent permettre de conserver l’efficacité de ces agents antimicrobiens et de limiter au maximum le développement de résistances bac-tériennes et fongiques dans le futur.
Swiss-NOSO est publié trimestriellement avec le soutien de l'Office Fédéral de la Santé Publique (OFSP), de la Société Suisse d'Hygiène Hospitalière (SSHH), et de la Société Suisse d'Infectiologie (SSI).
Rédaction Enos Bernasconi (Lugano), Karim Boubaker (BAG), Patrick Francioli (Lausanne), Kathrin Mühlemann (Bern), Didier Pittet (Genève), Pierre-Alain Raeber (OFSP), Christian Ruef (Zürich), Hugo Sax (Genève), Nicolas Troillet (Sion), Andreas F. Widmer (Bâle)
Mise en page Zo0m Créations (Lutry)
Correspondance Dr Hugo Sax, SPCI, Hôpitaux Universitaires de Genève, Rue Micheli-du-Crest 24, 1211 Genève 14
Internet http://www.swiss-noso.ch
Annonces
ESCMID / SHEA
Cours en épidémiologie hospitalière à Freiburg i.P. (Allemagne), 17 – 20 octobre 2004
Ce programme de formation intensive est organisé pour les professionnels engagés dans des activités de prévention et de contrôle de l’infection aux seins des hôpitaux. Il est soutenu par le Study Group of Nosocomial Infections (ESGNI), l’European Society for Clinical Microbiology and Infectious Diseases (ESCMID), la Society for Healthcare Epidemiology of America (SHEA), la Société Suisse d’Hygiène Hospitalière (SSHH), et la Société Suisse d’Infectiologie (SSI). Les cours sont donnés par des experts renommés européens et américains (en anglais) et ont pour objectif l’amélioration continue de la qualité des soins appliquée au domaine de la prévention des infections par l’application des principes de l’épidémiologie dans un contexte hospitalier. Pour davantage d’informations, veuillez consulter le site web sous www.hosp-epi-course.org. Vous pouvez également vous inscrire directement en ligne sous https:// kuk.unifreiburg.de/escmid/anmeldung_shea.php.Effect of antibacterial home cleaning and handwashing products on infectious disease
symptoms: a randomized, double-blind trial.
Effet antibactérien du nettoyage ménager et des produits de lavage des mains sur les symptômes de maladies infectieuses: un essai randomisé, en double-aveugle.
Larson EL, Lin SX, Gomez-Pichardo C, Della-Latta P. Ann Intern Med 2004;140:321-329.
Cette étude randomisée prospective a examiné l’impact possible sur le risque infectieux des produits d’entretien de ménage avec et sans désinfectant (Triclosan ou/et produits à base d’ammonium quaternaire). 1178 indivi-dus au sein de 238 ménages ont été randomisés dans les deux groupes et le nombre d’infections a été enregistré sur une période d’une année environ. Les participants à cette étude ont été contactés toutes les semaines par téléphone et visités personnellement sur place tous les mois. Pendant la période d’observation, aucune diffé-rence n’a été observée concernant la fréquence des infec-tions respiratoires, des épisodes de diarrhées, ou des épisodes fébriles. En conséquence, que ce soit dans le cadre de l’hôpital ou des institutions de soins, un
net-toyage est suffisant et l’utilisation de produits d’entretien ménager comportant des antiseptiques ne semble pas apporter d’avantages supplémentaires (Swiss-NOSO bull 2002;9:7). Les produits désinfectants peuvent être res-ponsables d’allergies, nuisibles pour l’environnement, et associés au développement de résistances bactériennes (en particulier pour le Triclosan). Les produits d’entretien ménager et de nettoyage ne contiennent généralement que de faibles concentrations d’agents désinfectants, ce qui favorise d’autant plus le développement potentiel d’une résistance. Ainsi, malgré la suggestion faite par certaines publicités, aucune preuve n'existe que l’application de produits d’entretien ménager contenant des désinfectants ait une action préventive contre les infections.
NOSOmail est le serveur automatique de Swiss-NOSO qui vous transmet de brèves informations sur les sujets
actuels concernant la prévention et le contrôle de l’infection, de même que sur le contenu du Bulletin futur. Les lecteurs intéressés peuvent s’y abonner selon la marche à suivre que vous trouverez sous: www.swiss-noso.ch. Il va de soi que votre adresse e-mail sera traitée en toute confidentialité et ne sera pas mise à disposition de tiers.