-UNIVERSITÉ MOHAMMED V - SOUISSI
FACULTÉ DE MÉDECINE ET DE PHARMACIE
- RABAT-
L’apport de la biopsie rénale dans les
néphropathies chroniques
Mémoire Présenté par
Dr Wissal DAILAMI
Sous la direction du Pr Loubna BENAMAR
En vue de l’obtention du
Diplôme National de Spécialité
enNéphrologie
2
3
A TOUS MES MAÎTRES
Nous vous remercions d’avoir partagé
avec nous votre
passion pour la néphrologie, vous avez
guidé nos pas
durant toutes ces années. Nous resterons à
jamais
Reconnaissants.
4
PLAN :
LISTE DES ABREVIATIONS………..………..……..……….5
INTRODUCTION ET OBJECTIFS………..……….6
MATERIEL ET METHODES..……….………….9
RESULTATS ………...……….…………13
I-Caractéristiques épidémiologiques ………..………..14
II- les antécédents……… ……….………..15
III-Caractéristiques clinique à l’admission………..…….…….15
IV-Caractéristiques biologiques à l’admission………..…..……...16
V- Caractéristiques échographiques……….………18
VI-Caractéristiques histologiques ……….….…...……...19
VII-Corrélation radio-histologique……… ………20
VIII- complications post-biopsiques………...21
IX- caractéristiques thérapeutiques et évolutives ………..21
DISCUSSION………23
I-Caractéristiques épidémiologiques……….…26
II-Indication de la biopsie rénale………...27
III-Caractéristiques cliniques ……….…28
IV-Caractéristiques biologiques ……….…28
V-Caractéristiques échographiques et histologiques ………30
VI)Biopsie des reins en insuffisance chronique :balance bénéfice risque..32
CONCLUSION………...………..…34
REFERENCES BIBLIOGRAPHIQUES ………...…………36
5
Liste des abréviations :
PAC : pain à cacheté GS : Glomérulosclérose BR : biopsie rénale
IRC : insuffisance rénale chronique CHU : centre hospitalier universitaire FTI : fibrose tubulo-interstitielle
HTA ; hypertension artérielle
IRRP : insuffisance rénale rapidement progressive
IR + SN : insuffisance rénale avec un syndrome néphrotique IR + SUA : insuffisance rénale avec sédiment urinaire actif IR : insuffisance rénale
TP : taux de prothrombine
TCA : temps de céphaline activé
6
Introduction et
objectifs :
7
La progression de la maladie rénale chronique est caractérisée histologiquement par la perte de cellules rénales et leur remplacement par la matrice extracellulaire, indépendamment de la maladie associée [1]. Il en résulte [2] :
- Une destruction progressive des glomérules : glomérulosclérose (GS), puis leur disparition : lésion en “pain à cacheter“ (PAC).
- Une fibrose interstitielle conduisant à l’atrophie par perte de l’architecture rénale.
Deux mécanismes concourent à cet aboutissant. Ils sont plus ou moins impliqués selon la néphropathie initiale : [2]
- Lésion glomérulaire directe (atteinte primitive du glomérule) : • Lésion immunologique,
• Atteinte vasculaire intraglomérulaire,
• Lésion de surcharge (diabète sucré, amylose).
- Lésion glomérulaire indirecte, au cours des atteintes de voisinage : • Lésions artérielles ;
• Néphropathies interstitielles chroniques.
L’évolution de l’insuffisance rénale chronique (IRC) s’accompagne souvent d’une réduction de la longueur bipolaire des reins, du volume des reins, de l’épaisseur corticale et de la différenciation cortico-médullaire [3].
Lésion glomérulaire
Lésion interstitielle
Glomérulosclérose
Fibrose interstitielle
8
Cependant, dans certains cas, où la morphologie rénale est limite, l’indication de la biopsie rénale (BR) s’impose.
La biopsie rénale permet de poser le diagnostic étiologique de la néphropathie et orienter le traitement. Mais, dans certaines situations, le risque est plus élevé que le bénéfice [4]. En effet, l’étude histologique conclue à des lésions de chronicité avec immunofluorescence négative ne permettant pas une orientation étiologique et thérapeutique et exposant à un risque de complications hémorragiques qui est d’autant plus important que les lésions de chronicité sont avancées [5] .
Il est important d’évaluer le bénéfice risque de la réalisation de la biopsie rénale.
L’objectif de notre étude est d’analyser le profil clinico-biologique et radiologique des patients présentant une fibrose rénale sur la biopsie, corréler les lésions histologiques aux données de l’échographie rénale, et évaluer la prise en charge thérapeutique et évolutive afin de déterminer l’apport de la BR chez les patients présentant une fibrose rénale histologique.
9
10
Il s’agit d’une étude rétrospective menée au sein du service de néphrologie du centre hospitalier universitaire (CHU) de Rabat de Janvier 2015 à Décembre 2018.
Patients :
Ils ont été sélectionnés à partir du registre d'anatomopathologie du service de Néphrologie.
Nous avons inclus tous les patients ayant bénéficié d'une biopsie de rein natif avec la présence de signes de chronicité histologiques. Ces signes sont définis par une fibrose glomérulaire à type de GS ou un taux de PAC supérieur à 50% des glomérules et/ou une fibrose tubulo-interstitielle (FTI) supérieure à 50%.
Ont été exclus de l'étude les patients transplantés ayant bénéficié d'une biopsie du greffon rénal et ceux hospitalisés dans les autres services.
Eléments recueillis :
Les données ont été recueillies à partir des dossiers médicaux des patients.
Nous avons relevé les données d’ordre démographique : sexe et âge, Nous avons noté les antécédents des patients représentés essentiellement par l’hypertension artérielle (HTA), le diabète qui représentent la 1ère cause
d’insuffisance rénale chronique.
Nous avons défini les indications de la biopsie rénale par 4 cas de figure : une insuffisance rénale isolée (IR), une insuffisance rénale rapidement progressive (IRRP), une insuffisance rénale associée à un syndrome néphrotique (IR + SN) définie par une protéinurie supérieure à 3g/24h, protidémie inférieure à 60g/l et albuminémie inférieure à 30g/l ou
11
une insuffisance rénale associée à un sédiment urinaire actif (IR+ SUA) (une leucocyturie et/ou hématurie).
Nous avons colligé les signes cliniques notamment la moyenne de la tension artérielle à l’admission, la diurèse et les œdèmes des membres inférieures (OMI).
Sur le plan biologique, nous avons recueillis la clairance de la créatinine à l’admission calculée selon la formule MDRD, la protéinurie en gramme par 24h avec la protidémie et l’albuminémie définissant ainsi la présence ou non d’un syndrome néphrotique, les anomalies du sédiments urinaires qui sont caractérisé par une leucocyturie et /ou une hématurie. Nous avons également rapporté les bilans d’hémostase qui sont le taux de prothrombine (TP) le temps de céphaline activé (TCA) et taux de plaquette dont les anomalies peuvent retentir sur le délai de réalisation de la biopsie rénale par rapport à la date de découverte de l’insuffisance rénale. Concernant le retentissement de la maladie rénale chronique, nous avons recherché l’anémie définie par un taux d’hémoglobine <13g/dl chez l’homme et 12g/dl chez la femme ainsi que son caractère et le bilan phosphocalcique.
Sur le plan échographique nous avons relevé la taille des reins représenté par la longueur bipolaire et la différenciation cortico-médullaire classé subjectivement par le radiologue en 3 stades : bonne, moyenne et mauvaise.
Sur le plan histologique, nous avons analysé les lésions glomérulaires et tubulo-interstitielle en précisant la présence d’au moins un des signes de fibrose rénale définie dans les critères d’inclusion, et nous avons corrélé ces données avec les critères échographiques.
Sur le plan thérapeutique, nous avons noté le traitement étiologique reçu et l’évolution.
12 L’analyse statistique :
➢ La saisie et l’analyse des données sont effectuées sur le logiciel SPSS® (version 21)
➢ Les variables qualitatives sont décrites par leurs effectifs et pourcentages et les variables quantitatives par leurs moyennes et écarts types en cas de variables à distribution gaussienne et par leurs médianes et intervalles interquartiles (25ème percentile - 75ème percentile) en cas de variables à distribution non gaussienne.
➢ La comparaison des variables qualitatives fait appel au test de Khi deux.
o L'analyse univariée est effectuée à l'aide de modèle régression de Cox permettant de calculer les ratios de risque (HR) et les intervalles de confiance (IC) à 95%.
13
14
I) Caractéristiques démographiques :
Entre janvier 2015 et décembre 2018, 569 biopsies rénales ont été réalisées au service de néphrologie du CHU de Rabat. 58 répondent à nos critères. Age et sexe :
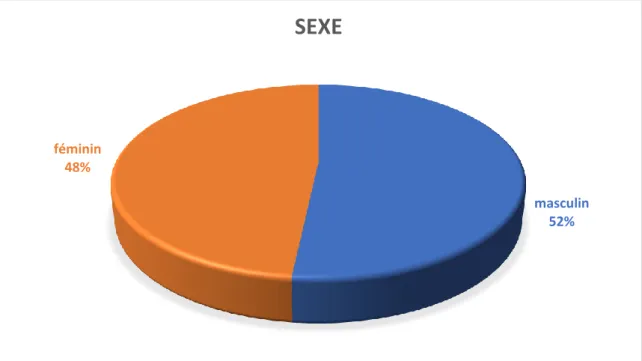
L’âge moyen de nos patients au moment de la biopsie rénale est de 44 ±17 ans avec des extrêmes entre 19 et 75 ans. Le sexe-ratio est de 1.06 avec une prédominance masculine (Figure I).
Figure I : répartition selon le sexe
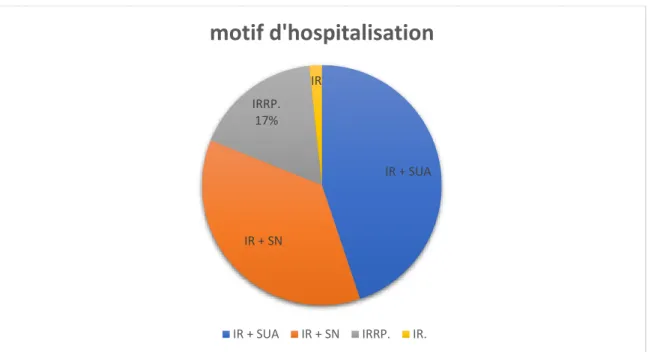
L’indication de la biopsie rénale :
Elle est représentée par ordre de fréquence par : (Figure II) - Insuffisance rénale avec sédiment urinaire actif (44.8%) - Insuffisance rénale avec syndrome néphrotique (36.2%) - Insuffisance rénale rapidement progressive (17.2%) - Insuffisance rénale isolée (1. 7%)
masculin 52%
féminin 48%
15
Figure II : répartition selon l’indication de la biopsie rénale
II)Les antécédents :
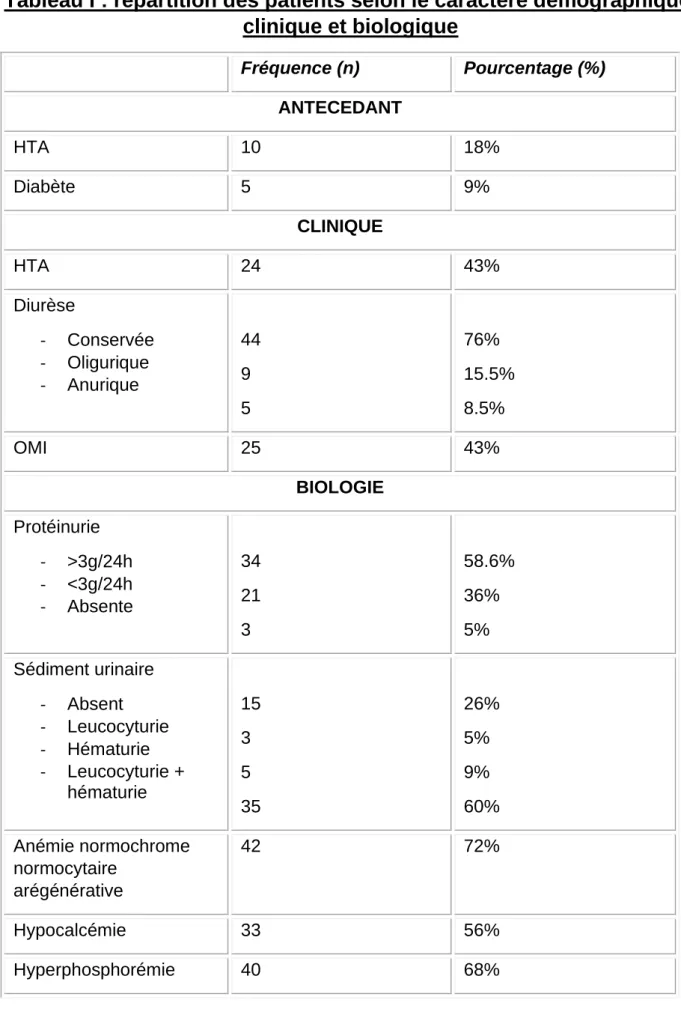
L’ancienneté de l’hypertension artérielle est notée chez 18% des patients et 9% des patients sont diabétiques (Tableau I).
III) Caractéristiques cliniques à l’admission :
HTA :
A l’admission la pression artérielle systolique moyenne est de 145 ±21mmHg et diastolique 83 ± 11mmHg. (Tableau I). L’hypertension artérielle est nouvellement découverte chez 43% des patients.
Diurèse :
La diurèse est conservée chez 76% des patients, 15.5% sont oligurique et 8.5% anurique (Tableau I).
Les œdèmes des membres inférieures :
On note que 43% ont des œdèmes des membres inférieurs.
IR + SUA IR + SN IRRP. 17% IR
motif d'hospitalisation
16
IV) Caractéristiques biologiques à l’admission :
La clairance de la créatinine à l’admission :
La clairance moyenne de la créatinine à l’admission selon la formule MDRD est à 18 ± 14ml/min avec des extrêmes de 2 et 60ml/min.
La protéinurie :
La protéinurie est présente dans 94.8% des cas. Elle est supérieure à 3g/24h dans 58.6% et inférieure à 3g/24h dans 36% des cas (TableauI).
Le sédiment urinaire :
Le sédiment urinaire est actif dans 83.5% des cas. 5% ont une leucocyturie, 9% une hématurie et 60% associent leucocyturie et hématurie (Tableau I)
Bilan de crase :
Le taux moyen des plaquettes est de 397000 ± 127085 éléments /mm3. Tous les patients ont un TP normal avec une moyenne de 93 ± 10%. Le TCA est allongé chez 30% des patients avec une moyenne de 1.13 ± 0.14 fois le témoin (24s)
Retentissement biologique de la maladie rénale chronique :
L’anémie est retrouvée chez 48 patients avec une prévalence de 82%. La moyenne d’hémoglobine est de 9 ± 2g/dl normochrome normocytaire dans la totalité des cas et arégénérative dans 72% des cas (Tableau I).
L’hypocalcémie est retrouvée chez plus que la moitié des patients (56%) et l’hyperphosphorémie chez 68% des patients (Tableau I).
17
Tableau I : répartition des patients selon le caractère démographique, clinique et biologique Fréquence (n) Pourcentage (%) ANTECEDANT HTA 10 18% Diabète 5 9% CLINIQUE HTA 24 43% Diurèse - Conservée - Oligurique - Anurique 44 9 5 76% 15.5% 8.5% OMI 25 43% BIOLOGIE Protéinurie - >3g/24h - <3g/24h - Absente 34 21 3 58.6% 36% 5% Sédiment urinaire - Absent - Leucocyturie - Hématurie - Leucocyturie + hématurie 15 3 5 35 26% 5% 9% 60% Anémie normochrome normocytaire arégénérative 42 72% Hypocalcémie 33 56% Hyperphosphorémie 40 68%
18
V) Caractéristiques échographiques :
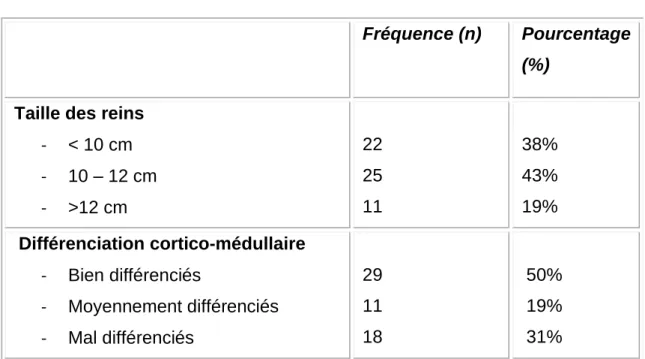
La taille moyenne des reins en échographie est 106 ±11mm [87-140]. Elle est supérieure à 120 mm dans 19% des cas, entre 100 et 120 mm dans 43% des cas et inférieure à 100 mm 38% des cas. (Tableau II).
La différenciation cortico-médullaire est conservée chez 29 patients ce qui est équivalent à 50%. Elle est moyenne et mauvaise simultanément dans 19% et 31% des cas (Tableau II).
Tableau II : données échographiques des patients
Uniquement 7 patients ont des reins mal différenciés avec une taille inférieure à 10cm et 3 patients ont des reins bien différenciés avec une taille supérieure à 12cm (Tableau III).
Fréquence (n) Pourcentage
(%) Taille des reins
- < 10 cm - 10 – 12 cm - >12 cm 22 25 11 38% 43% 19% Différenciation cortico-médullaire - Bien différenciés - Moyennement différenciés - Mal différenciés 29 11 18 50% 19% 31%
19
Tableau III : répartition des patients selon la taille et la différenciation cortico-médullaires des reins :
< 10cm 10 et 12cm > 12cm Bien différenciés 12 14 3 Moyennement différenciés 3 5 3 Mal différenciés 7 6 5
VI) Caractéristiques histologiques :
La médiane du délai entre la découverte de l’insuffisance rénale et la réalisation de la biopsie rénale est de 30 jr [15,50].
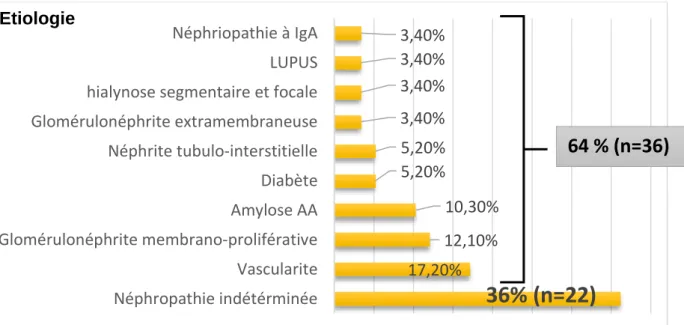
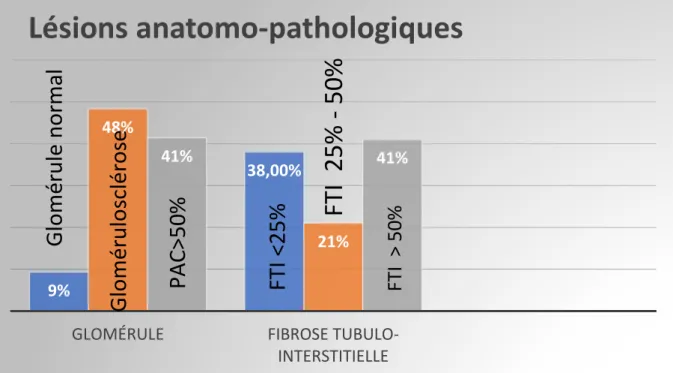
L’analyse histologique de ces biopsies rénales a permis un diagnostic étiologique dans 64% des cas. Les néphropathies retrouvées sont dans la figure III. La lecture histologique a montré une GS dans 48.5% de cas, PAC>50% dans 41.5% de cas et une FTI>50% dans 41% des cas (FigureIV).
Figure III : Répartition des néphropathies
36% (n=22)
17,20% 12,10% 10,30% 5,20% 5,20% 3,40% 3,40% 3,40% 3,40% Néphropathie indétérminée Vascularite Glomérulonéphrite membrano-proliférative Amylose AA Diabète Néphrite tubulo-interstitielle Glomérulonéphrite extramembraneuse hialynose segmentaire et focale LUPUS Néphriopathie à IgAEtiologie
20
Figure IV : fréquence des lésions anatomopathologiques de la chronicité
VII) Corrélation radio-histologiques
Il existe une corrélation significative entre les paramètres échographiques et les lésions histologiques. En effet, la taille rénale est d’autant plus réduite que les lésions glomérulaires sont sévères (p<0.005), et la différenciation cortico-médullaire est d’autant plus mauvaise que la FTI est importante (p<0.005). (Tableau III).
Tableau IV : le coefficient de corrélation de Spearman entre les lésions histologiques et les données échographiques
9%
38,00% 48%
21%
41% 41%
GLOMÉRULE FIBROSE
TUBULO-INTERSTITIELLE
Lésions anatomo-pathologiques
FTI
25%
-50%
PAC>50
%
FTI > 50 %FTI
<2
5
%
Gl
omé
rul
osclér
ose
Gl
omé
rul
e
norm
al
Lésions glomérulaires La Fibrose
tubulo-interstitielle
r p r p
Taille des reins 0.697 < 0.005 0.700 0.600
Différenciation cortico-médullaire
21
Dans 3 cas, on a noté une taille rénale supérieure à 12cm avec une bonne différenciation cortico-médullaire. L’indication de la BR était une insuffisance rénale, avec syndrome néphrotique chez 2 patients et avec un sédiment urinaire actif chez le 3ème. Sur le plan histologique il s’agissait d’une glomérulosclérose nodulaire, une néphrite tubulo-interstitielle et une glomérulonéphrite membrano-proliférative. Les lésions histologies élémentaire ont été de sévérité variable. Une GS et FTI< 25% chez le 1er patient, glomérule normale et FTI >50% chez le 2ème patient et des PAC >50% avec FTI>50% chez le 3ème patient.
Une taille rénale inférieure à 10 cm avec une mauvaise différenciation cortico-médullaire a été noté chez 3 patients. La biopsie rénale était indiquée pour une insuffisance rénale avec sédiment urinaire actif. Elle a diagnostiqué une néphropathie à IgA, une glomérulonéphrite membrano-proliférative et une vascularite pauci-immune. Les lésions histologiques de fibrose étaient sévères chez les 3 patients.
VIII) Complications post-biopsiques :
Les complications post biopsie rénale sont faibles, elles ont intéressé 2 patients avec une prévalence de 3.4%. Il s’agit d’hématome périrénale spontanément résolutif.
IX) Caractéristiques thérapeutiques et évolutives :
Parmi les 58 patients avec fibrose rénale, 36 avaient un diagnostic étiologique (figure 1). Parmi ces patients, 15 ont bénéficié d’un traitement immunosuppresseur par corticothérapie et cyclophosphamide indiqué devant une prolifération exctracapillaire et un cas de lupus. Une corticothérapie isolée a été indiquée chez 3 patients pour hialynose segmentaire et focale, néphrite tubulo-interstitielle et glomérulonéphrite
22
membrano-prolifératve. L’évolution était une amélioration avec stabilisation de la fonction rénale sans recours à l’hémodialyse. Concernant les 22 patients à néphropathie indéterminée, 8 patients ont évolué vers l’insuffisance rénale chronique terminale avec recours à l’hémodialyse.
23
24
La biopsie rénale est l’examen indispensable au diagnostic histologique de la plupart des maladies rénales parenchymateuses. Les résultats de la biopsie rénale guident le traitement étiologique, permettent de mieux définir les mécanismes physiopathologiques des atteintes rénales et aide à établir un pronostic rénal. La présence des lésions de fibrose présage d’une moins bonne réponse aux traitements immunosuppresseurs et d’un pronostic rénal plus défavorable [6].
La technique actuelle de biopsie rénale est réalisée chez un patient en décubitus ventral après une légère prémédication. Des mesures d’asepsie chirurgicale sont recommandées. Une anesthésie locale des plans superficiels et profonds est réalisée à la xylocaïne 1%. En l’absence de splénomégalie, le rein gauche est préféré pour la biopsie rénale par la majorité des opérateurs car le risque de plaie de la veine cave est moindre à gauche et le rein droit est plus mobile [7]. Le repérage du pôle inférieur du rein est réalisé par échographie en temps réel (Image I). Bien qu’il n’existe pas d’étude comparant le repérage échographique au repérage tomodensitométrique, l’incidence des complications sévères ne semble pas différente entre les deux méthodes [8]. La tomodensitométrie ne permet pas d’obtenir une image en temps réel et ne doit pas être considérée comme une technique de choix chez les patients à risque hémorragique [9]. Toutefois, la tomodensitométrie paraît utile lorsque le repérage échographique est difficile notamment en cas de malformation rénale, de rein mal visualisé à l’échographie ou de rein ne migrant pas au-dessous du grill costal lors des mouvements respiratoires [9].
Le pistolet à biopsie automatique de 18 G (Image I) est actuellement l’outil le plus couramment utilisé pour la biopsie rénale percutanée et permet d’obtenir entre 10 et 14 glomérules en moyenne par procédure [10,11]. Il est recommandé de faire une compression hémostatique pendant une heure, à
25
l’aide d’un drap roulé placé sous les côtes en décubitus dorsal. Le décubitus dorsal doit être maintenu pendant 24 heures [8,12].
Image I : technique de la biopsie rénale échoguidée [13]
26
C’est un geste invasif qui n’est pas dénué de complications, notamment hémorragiques. D’autant plus en l’absence, dans notre contexte, de la biopsie rénale trans-jugulaire dont ce risque est moins important. Dans les séries récentes le taux global de complications oscille entre 13 et 34 % [10,12].
Selon C.Graig Tisher et al. en cas d’insuffisance rénale chronique avec des reins de petite taille, ils existent des lésions parenchymateuses importantes notamment la glomérulosclérose et la fibrose interstitielle qui majore le risque de complications hémorragiques [5].
Ainsi, il s’avère essentiel, de rechercher les signes indirects de chronicité et d’évaluer le bénéfice risque de la réalisation d’une biopsie dans ces conditions dont le risque de complications est important.
Dans notre unité, la biopsie rénale est réalisée systématiquement devant tout tableau clinico-biologique et rénale aigue malgré les limites des données échographiques.
I) Caractéristiques épidémiologiques :
La prévalence de l’insuffisance rénale chronique confirmée histologiquement est de 25% au cours d’une période s’étalant de janvier 2015 à décembre 2018. Cette fréquence pourrait être expliquée par le retard de réalisation de la biopsie rénale, lié le plus souvent à la consultation tardive chez cette population, ainsi qu'à l'absence de bilan antérieur pouvant orienter vers le caractère aigu ou chronique de la maladie rénale.
L’âge moyen de nos patients est de 44 ans avec des extrêmes de 19 ans à 75ans. Dans une étude portant sur l’insuffisance rénale chronique, les malades sont âgés de 23 ans à 82 ans avec un âge moyen de 45.9 ans. Kokodé. A.T [15] et M Sadou [16] ont enregistré respectivement un âge moyen de 47,2 ± 15 ans et 42,63 ± 14,54 ans.
27
L’échantillon est composé de 51.7% d’hommes et 48.3% de femmes soit un sexe ratio de 1.06 en faveur du sexe masculin. Cette prédominance du sexe masculin a été retrouvée par plusieurs études sur l’insuffisance rénale chronique réalisées au Mali [15,17–19] au Sénégal, en Côte d’Ivoire, au Maroc et au Burkina Faso [20–23].
II) Indications de la biopsie rénale :
Dans notre contexte, la biopsie rénale a été indiqué devant une insuffisance rénale avec un sédiment urinaire actif (hématurie et/ou leucocyturie et/ou protéinurie non néphrotique) dans 44.8% des cas. Cette association représentent notre 1ère indication de biopsie rénale. Ce qui n’est
pas en faveur de l’étude menée au CHU de Fès[24] qui est concordante avec une étude tchèque[25] dont cette indication vient en second plan après le syndrome néphrotique.
Notre 2ème indication est le syndrome néphrotique associé à une
insuffisance rénale avec une fréquence de 36.2%. Elle est au 1er plan dans
l’étude de CHU de Fès[24] vraisemblablement à celle menée en Afrique du Sud [26] avec une fréquence de 52,5% et à celles d'autres études réalisées dans d'autres régions du monde [27,28]. Cependant, le syndrome néphrotique venant au 1er plan dans ces études inclus les patients avec une
fonction rénale normale qui sont exclus dans notre contexte.
L’insuffisance rénale rapidement progressive constitue la 3ème indication
de -biopsie rénale avec une fréquence de 17.2%. Ce qui est en faveur de l’étude de Fès mais avec une fréquence de 12% [24].
L'inuffisance rénale isolée est le syndrome clinique le moins fréquent chez les patients ayant bénéficié de la biopsie rénale dans notre étude (1.7%). La même constatation est notée dans l'étude du CHU de Fès [24] et de Naumovic [27].
28
III) Caractéristiques cliniques :
Les signes cliniques retrouvés à l’examen sont par ordre de fréquence l’hypertension artérielle 43% ; les œdèmes des membres inférieures 43% ; l’anurie 8.5%.
La prédominance de l’hypertension artérielle est retrouvée par plusieurs études réalisées au Mali [15,29,30]. Elle représente la principale manifestation clinique en Côte d’Ivoire et au Sénégal soit respectivement dans 76%, 68,5 [20,21] chez les patients en insuffisance rénale chronique.
L’hypertension artérielle constitue un critère important à contrôler avant la biopsie rénale pour éviter le risque de complications. Dans notre contexte, le seuil toléré est une tension artérielle inférieure à 140/90mmHg qui est identique au seuil suggéré par certaines études [31–33]. Une enquête de pratique de ponction biopsie rénale réalisée en France retient un seuil supérieur avec une médiane à 160/92mmHg[34].
La diurèse est conservée chez 75.9% de nos patients, 15.5% sont oligurique et 8.6% anurique. Dans la littérature, les patients en insuffisance rénale chronique terminale sont oligo-anurique avec une fréquence à 30% dans l’étude réalisée au point G et 64.4% selon Zongo.J et col [35].
IV) Caractéristiques biologiques :
L’anémie est constante chez 48 patients ce qui fait une prévalence de 82%. Elle est de caractère normochrome normocytaire dans la totalité des cas et arégénérative dans 72% des cas par défaut de synthèse de l’érythropoïétine conformément aux données de la littérature : Diallo à Abidjan [36], de Kane à Dakar [37] et d’Edoh - Bedy à Lomé[38].
Le taux moyen des plaquettes était de 397000 ± 127085 éléments /mm3. Tous les patients ont un TP normal avec une moyenne de 93 ± 10%.
29
Le TCA est allongé chez 30% des patient avec une moyenne de 1.13 ± 0.14 fois le témoin (24s)
La recherche des troubles de l’hémostase est primordiale avant la réalisation de la biopsie rénale. Elle se fait par l’évaluation clinique et l’interrogatoire
• Si absence d’anomalie évoquées à l’évaluation clinique, on réalise une numération formule sanguine (NFS) et plaquette, TP et TCA.
• Si suspicion d’une anomalie d’hémostase, une consultation spécialisée est nécessaire.
Ces paramètres hématologiques, aussi bien que l’hypertension artérielle conditionnent le délai de réalisation de la biopsie rénale par rapport à la date de découverte de l’insuffisance rénale et donc l’installation des lésions chroniques. Dans notre étude le délai est de 30 jours avec un écart interquartile à 25.
L’insuffisance rénale chronique est caractérisée par des perturbations du métabolisme phosphocalcique. Elle est marquée par une hypocalcémie dans 87,12 % des cas, une hyperphosphorémie dans 51,43 % des cas et une hyperparathyroïdie secondaire, en rapport avec la sévérité de la maladie dans 87,12 % des cas[39]. Dans notre échantillon, l’hypocalcémie est
retrouvée chez plus que la moitié des patients (56%) et l’hyperphosphorémie chez 68% des patients. Le dosage de parathormone n’a pas été rapporté.
La protéinurie est un signe de glomérulopathie, et non d'insuffisance rénale. Une protéinurie modérée est constatée dans de nombreux cas d’IRC, en particulier d’origine glomérulaire. Mais la protéinurie peut être totalement absente tout au long de l'évolution de l’IRC. Inversement, une très forte
30
protéinurie (syndrome néphrotique) peut ne s’accompagner d’aucun signe d’insuffisance rénale.
Cependant, une forte protéinurie représente un facteur d’aggravation de l’IRC.
Ce risque justifie les tentatives de réduction de la protéinurie par un traitement :
♦ physiopathologique (immunosuppresseurs en cas de syndrome néphrotique);
♦ symptomatique. L’utilisation d’un inhibiteur d’enzyme de conversion dans la néphropathie diabétique (même en l’absence d’HTA) a notamment pour but de protéger les glomérules en réduisant à la fois la pression artérielle (on vise la pression artérielle optimale la plus basse possible) et la protéinurie.
Ces signes clinico-bilogiques sont fréquents dans d’insuffisance rénale chronique, mais ne sont pas spécifique de la chronicité. Après une revue de la littérature, nous n'avons trouvé aucune étude corrélant les données clinico-biologiques à la fibrose rénale histologique. C’est essentiellement une corrélation radiologique
V) Caractéristiques échographiques et histologiques :
Plusieurs études se sont intéressées au rôle de l’échographie rénale dans l’orientation vers l’atteinte aigue ou chronique de l’insuffisance rénale. D’autre ont même rechercher des corrélations entre les images échographiques et l’atteinte histologiques.
L’échographie permet de préciser la taille des reins. Il est traditionnellement connu que la longueur bipolaire du rein est corrélée avec l’insuffisance rénale chronique, elle est donc systématiquement signalée [40]. Par ailleurs, cette mensuration échographique du rein est opérateur dépendant. Elle peut varier au cours du même examen échographique et lors des examens successifs. Elle varie également selon l’âge du patient, le
31
sexe, la race et la taille [41]. Elle baisse à partir de l’âge de 70ans, les valeurs normales généralement citées sont 110 ± 20mm [42]. Le rein est considéré de petite taille si la taille est inférieure à 80mm[43]. En revanche, dans notre étude, La longueur des reins biopsiés varie de 87 à 140mm avec une moyenne de 106 ± 11 mm.
D’autres études, ont démontré la supériorité du volume rénale calculé à l’échographie par rapport à la longueur dans la prédiction de la taille du rein. De plus, il est stable avec relativement peu de changement avec l’âge et il est significativement corrélé avec le débit de filtration glomérulaire [44].Dans notre pratique courante, le volume rénale n’est pas calculé. Cette entité peut être proposé pour d’autre étude prospective permettant ainsi une bonne corrélation échographique et histologique.
L’échographie permet d’identifier d’autre éléments pouvant orienter vers la chronicité de l’insuffisance rénale notamment la différenciation cortico-médullaire[45,46]. Cette différence de l’échogénicité du cortex rénal est comparée à celle du foie [9], elle est classée en 4 stades[47] :
- stade 0 (rein normal) : cortex rénal hypoéchogène par rapport au foie - stade I : cortex rénal iso-échogène par rapport au foie ;
- stade II : cortex rénal hyperéchogène par rapport au foie, mais hypoéchogène par rapport au sinus rénal avec conservation de la différenciation cortico-médullaire ;
- stade III : cortex rénal hyperéchogène par rapport au foie, et iso-échogène par rapport au sinus rénal avec disparition de la différenciation cortico-médullaire.
Dans notre contexte, la description de la différenciation n’a pas respecté cette classification, mais elle a été définie en 3 types : mauvaise, moyenne et bonne selon la description subjective du radiologue. Chez nos patients, la
32
différenciation cortico-médullaire est conservée chez 50%. Elle est moyenne et mauvaise simultanément dans 19% et 31% des cas.
Il existe une corrélation entre le degré de l’anomalie échographique et la sévérité des modifications histologiques. Dans une étude multivariée, L’échogénicité a été significativement corrélée à l’atrophie tubulaire et l’inflammation interstitielle[48], ceci est confirmé par notre étude : la FTI est d’autant plus sévère que la dédifférenciation est importante (r= 0.8 ; p <0.005). Concernant la taille des reins, dans notre étude, la corrélation est significative avec l’atteinte glomérulaire. En effet, la présence de GS et un taux élevé de PAC est d’autant plus important que la taille des reins est réduite (r=0.9 ; p<0.005). Ce qui est concorde avec l’étude de sammy moghazi et al. [49] et HRIRACK et al [50].
VI) Biopsie des reins en insuffisance chronique : balance bénéfice risque :
Une étude koweïtienne s’est intéressée à réaliser des BR à des patients connus en insuffisance rénale chronique avec des reins de taille inférieure à 90mm et mauvaise différenciation cortico-médullaire. Parmi 36 patients, 81% ont eu un diagnostic histologique précis de la néphropathie [51]. Dans notre étude, parmi les 58 biopsies réalisées, 64% (n=36) ont eu un diagnostic précis malgré les lésions histologiques fibrosés et 26%(n=15) ont reçu un traitement étiologique adaptés ce qui a permis une amélioration avec stabilisation de la fonction rénale. Elle a également permis une confirmation de la chronicité de l’insuffisance rénale avec instauration précoce de traitement néphroprotecteur retardant ainsi le déclin de la fonction rénale ainsi qu’une mise en dialyse précoce en cas d’insuffisance rénale terminale. Les complications post biopsiques étaient rare, uniquement 2 patients ont présenté un hématome périrénal spontanément résolutif. Cependant, dans l’étude koweitienne, les complications post biopsiques ont intéressé la
33
totalité des patients, il s’agit d’une hématurie macroscopique spontanément résolutives associé à un hématome périrénale chez 2 patients avec bonne évolution sous surveillance [51].
Le bénéfice de la BR est plus important que le risque de complications quel que soit le stade de l’insuffisance rénale chronique. En effet, elle permet de poser le diagnostic, adapter le traitement étiologique, évaluer le pronostic et orienter le projet de transplantation rénale
34
35
La fibrose rénale est le stade avancé de toutes les néphropathies. Elle s’accompagne de différents troubles cliniques, biologiques et radiologiques. Sa confirmation est plus simple en présence de créatininémie élevée au-delà de 3 mois. En absence de cet élément, il est difficile de trancher entre le caractère aigu ou chronique de l’insuffisance rénale.
La biopsie rénale permet d’identifier le caractère aigu ou chronique de l’insuffisance rénale, d’apprécier le degré de la chronicité, de poser le diagnostic étiologique et d’évaluer le pronostic. Quelque soit le degré de la fibrose à l’histologie rénale, la BR garde son indication dans les cas limite parce qu’elle permet d’établir un diagnostic étiologique dans plus de 50% des cas pour une orientation thérapeutique et pronostic avec un risque négligeable de complications.
L’échographie rénale reste le seul moyen pour prédire l’indication d’une biopsie rénale, ainsi l’amélioration de ses données (échogénicité, taille précise et volume) permettra une bonne orientation pour le néphrologue.
36
37
[1] Nogueira et al. Renal Fibrosis: Animal Models and Therapeutic Strategies. In vivo. 2017 ; 31(1): 1-22
[2] J. Fourcade. Insuffisance rénale chronique. Cours Module intégré Néphrologie.2006 ; (253) : 1-35. [3] Yamashita SR, Atzingen AC von, Iared W, Bezerra AS de A, Ammirati AL, Canziani MEF, et al. Value
of renal cortical thickness as a predictor of renal function impairment in chronic renal disease patients. Radiol Bras 2015;48:12–6. https://doi.org/10.1590/0100-3984.2014.0008.
[4] El-Reshaid K, El-Reshaid W, Al-Bader D, Varro J, Madda J, Sallam H. Biopsy of small kidneys: A safe and a useful guide to potentially treatable kidney disease. Saudi J Kidney Dis Transpl 2017;28:298. https://doi.org/10.4103/1319-2442.202767.
[5] C. Craig Tisher, MD, and Byron P. Croker, MD, PhD. Renal biopsy. Nephrology Secrets 3th Edition. Elsevier. 2011. P 38 - 41
[6] Heng A, Ackoundounguessan C, Gazuy N, Deteix P, Souweine B. Place de la ponction biopsie rénale dans l’insuffisance rénale aiguë en réanimation. Réanimation 2005;14:483–90.
https://doi.org/10.1016/j.reaurg.2005.09.009.
[7] Lantz B, Appay MD, Hinglais N. Techniques et méthodes d’étude de la biopsie rénale. In: Droz D, Lantz B, editors. La biopsie rénale. Paris: Inserm; 1996. p. 11–26.
[8] Andreucci VE, Fuiano G, Stanziale P, Andreucci M. Role of renal biopsy in the diagnosis and prognosis of acute renal failure. Kidney Int Suppl 1998; 66, S91–95.
[9] Stiles KP, Yuan CM, Chung EM, Lyon RD, Lane JD, Abbott KC. Renal biopsy in high-risk patients with medical diseases of the kidney. American Journal of Kidney Diseases 2000;36:419–33.
https://doi.org/10.1053/ajkd.2000.8998.
[10] Manno C, Strippoli GFM, Arnesano L, Bonifati C, Campobasso N, Gesualdo L, et al. Predictors of bleeding complications in percutaneous ultrasound-guided renal biopsy. Kidney International 2004;66:1570–7. https://doi.org/10.1111/j.1523-1755.2004.00922.x.
[11] Kim D, Kim H, Shin G, Ku S, Ma K, Shin S, et al. A randomized, prospective, comparative study of manual and automated renal biopsies. American Journal of Kidney Diseases 1998;32:426–31. https://doi.org/10.1053/ajkd.1998.v32.pm9740159.
[12] Whittier WL. Timing of Complications in Percutaneous Renal Biopsy. Journal of the American Society of Nephrology 2004;15:142–7. https://doi.org/10.1097/01.ASN.0000102472.37947.14. [13] marie-cécile fournier. Labcom [enligne]. C2020 [consulté le 9 juin 2020]. Disponible sur :
https://www.labcom-risca.com/single-post/2018/08/17/2-nouveaux-articles-sur-les-biopsies-de-surveillance-%C3%A0-1-an-post-transplantation-r%C3%A9nale
[14] Agarwal S, Dinda A, Sethi S. Basics of kidney biopsy: A nephrologist′s perspective. Indian J Nephrol 2013;23:243. https://doi.org/10.4103/0971-4065.114462.
[15] KOKODE A.T. Aspects cliniques et prise en charge de l’H.T.A maligne chez l’insuffisant rénal à propos de 33 cas dans le service de néphrologie et hémodialyse de l’H.N.P.G Thèse de médecine : Bamako 1998
[16] SADOU M. Les facteurs d’aggravation de l’I.R.C Thèse de médecine. Bamako 2005 – M 39
[17] CISSE I. Aspects épidémio-cliniques de l’I.R.C. dans le service de médecine interne de l’Hôpital du Point G. Thèse de médecine 1990. 47. M. 90
[18] SOW H. D. I.R.C : aspect clinique préventif et pris en charge à l’Hôpital du Point G. Thèse de médecine 1999
[19] KASADJI B. D. Etude épidémio-clinique de l’I.R.C dans le service de néphrologie et hémodialyse de l’H.N.P.G Thèse de médecine 2002 ; 04 M 1
[20] DIA K. I.R.C. en milieu hospitalier dakarois : Etude épidémio clinique. Thèse de médecine : Dakar 1996
38
[22] BOURQUIA A. Etat actuel du traitement de l’I.R.C au Maroc. Néphrologie 1999 ; vol 20, p. 6-7. [23] LENGANI A. Epidémiologie de l’I.R.C sévère au Burkina, cahiers de santé 1997 ; p. 7-379
[24] Mbarki H, Belghiti KA, Harmouch T, Najdi A, Arrayhani M, Sqalli T. Ponction biopsies rénales dans le Service de Néphrologie de Fès: indications et résultats: à propos de 522 cas. Pan Afr Med J
2016;24. https://doi.org/10.11604/pamj.2016.24.21.3982.
[25] Rychlik I, Jancova E, Tesar V, Kolsky A, Lacha J, Stejskal J, et al. The Czech registry of renal biopsies. Occurrence of renal diseases in the years 1994-2000. Nephrology Dialysis Transplantation
2004;19:3040–9. https://doi.org/10.1093/ndt/gfh521.
[26] Okpechi I, Swanepoel C, Duffield M, Mahala B, Wearne N, Alagbe S, et al. Patterns of renal disease in Cape Town South Africa: a 10-year review of a single-centre renal biopsy database. Nephrology Dialysis Transplantation 2011;26:1853–61. https://doi.org/10.1093/ndt/gfq655.
[27] R Naumovic, S Pavlovic, D Stojkovic, G Basta-Jovanovic and V Nesic. Renal biopsy registry from a single centre in Serbia: 20 years of experience. Nephrology dialysis transplantation. 2009 ; 24: 877– 885
[28] G Polito, L.A Ribeiro de Moura and G M Kirsztajn. An overview on frequency of renal biopsy diagnosis in Brazil: clinical and pathological patterns based on 9617 native kidney biopsies. Nephrology dialysis transplantation. 2010 ; 25: 490–496
[29] BEN A. A. Les complications cardio-vasculaires chez l’I.R.C : facteurs de risques, aspects cliniques et écho cardiographiques dans le service de néphrologie et hémodialyse de l’H.N.P.G. Thèse de médecine : 2001 – 70 P.
[30] NGNONGUIA M. Exploration de l’H.T.A maligne chez l’I.R.C dans le service de néphrologie et hémodialyse de l’H.N.P.G Thèse de médecine : Bamako 2002 – 66 P
[31] Simard-Meilleur M-C, Troyanov S, Roy L, Dalaire E, Brachemi S. Risk Factors and Timing of Native Kidney Biopsy Complications. Nephron Extra. 22 mars 2014;4(1):42-49.
[32] Shidham GB, Siddiqi N, Beres JA, Logan B, Nagaraja H, Shidham SG, et al. Clinical risk factors associated with bleeding after native kidney biopsy. Nephrology. juin 2005;10(3):305-10.
[33] Lindequist S, Knudsen U, Pedersen RS. ULTRASOUND-GUIDED RENAL BIOPSY WITH BIOPSY GUN TECHNIQUE - EFFICACY AND COMPLICATIONS. :4
[34] Bollée G, Moulin B, Martinez F, Meulders Q, Rougier J-P, Baumelou A, et al. Pratique de la biopsie rénale : résultat d’une enquête en France, revue de la littérature et recommandations.
Néphrologie & Thérapeutique 2012;8:168–76. https://doi.org/10.1016/j.nephro.2011.12.005. [35] Zabsonre P, Bamouni A, Zongo J, Lengani A, Dyemkouma FX. Echographie rénale et insuffisance
rénale chronique au cours de l’hypertension artérielle en Afrique sub-saharienne 2001:5. [36] Diallo AD, Niamkey E, Yao BB. L’insuffisance rénale chronique en Côte d’Ivoire : étude de 800 cas
hospitaliers. n.d.:3.
[37] Kane A, Diouf B, Niang A, Diop IB, Moreira Diop T, Hane L et al. Données échocardiographiques de patients en dialyse chronique à Dakar. Dakar Med 1997 ; 42(1) : 25-9..
[38] Edoh-Bedi L. Hypertension artérielle et insuffisance rénale chronique dans les CHU de Lomé. Thèse de doctorat en médecine. 2005
[39] Mondé AA, Kouamé-Koutouan A, Lagou DA, Camara-Cissé M, Achy BO, Tchimou L, et al. Variations du calcium, du phosphore et de la parathormone au cours de l’insuffisance rénale chronique (IRC) en Côte d’Ivoire. Médecine Nucléaire 2013;37:451–4.
https://doi.org/10.1016/j.mednuc.2013.09.017.
[40] Beland MD, Walle NL, Machan JT, Cronan JJ. Renal Cortical Thickness Measured at Ultrasound: Is It Better Than Renal Length as an Indicator of Renal Function in Chronic Kidney Disease? American Journal of Roentgenology 2010;195:W146–9. https://doi.org/10.2214/AJR.09.4104.
[41] YAME N.R. Morphométrie du rein. Etude échographique chez l’Africain mélanoderme. Thèse Méd. Abidjan 1992..
[42] Emamian SA, Nielsen MB, Pedersen JF, Ytte L. Kidney dimensions at sonography: correlation with age, sex, and habitus in 665 adult volunteers. American Journal of Roentgenology 1993;160:83–6. https://doi.org/10.2214/ajr.160.1.8416654.
39
[43] Aitchison F, Page A. Diagnostic imaging of renal artery stenosis. J Hum Hypertens 1999;13:595– 603. https://doi.org/10.1038/sj.jhh.1000871.
[44] Sanusi AA, Arogundade FA, Famurewa OC, Akintomide AO, Soyinka FO, Ojo OE, et al. Relationship of ultrasonographically determined kidney volume with measured GFR, calculated creatinine clearance and other parameters in chronic kidney disease (CKD). Nephrology Dialysis
Transplantation 2009;24:1690–4. https://doi.org/10.1093/ndt/gfp055.
[45] Hedvig Hricak, M.D. Thomas L. Slovis, M.D. Charles W. Callen, M.D. Peter W. Callen, M.D. Raymond N. Romanski, M.D. Neonatal Kidneys: Sonographic Anatomic Correlation. Radiology. Radiology 1983 ; 147: 699-702,
[46] Araújo NC, Rioja L da S, Rebelo MAP. [Renal parenchymal disease: histopathologic-sonographic correlation]. Rev Assoc Med Bras (1992) 2008;54:48–54. https://doi.org/10.1590/s0104-42302008000100020.
[47] Mounier-Vehier C, Lions C, Devos P, Jaboureck O, Willoteaux S, Carre A, et al. Cortical thickness: An early morphological marker of atherosclerotic renal disease. Kidney International 2002;61:591–8. https://doi.org/10.1046/j.1523-1755.2002.00167.x.
[48] Page JE, Morgan SH, Eastwood JB, Smith SA, Webb DJ, Dilly SA, et al. Ultrasound findings in renal parenchymal disease: Comparison with histological appearances. Clinical Radiology 1994;49:867– 70. https://doi.org/10.1016/S0009-9260(05)82877-6.
[49] Moghazi S, Jones E, Schroepple J, Arya K, Mcclellan W, Hennigar RA, et al. Correlation of renal histopathology with sonographic findings. Kidney International 2005;67:1515–20.
https://doi.org/10.1111/j.1523-1755.2005.00230.x.
[50] Hricak H, Slovis TL, Callen CW, Callen PW, Romanski RN. Neonatal kidneys: sonographic anatomic correlation. Radiology 1983;147:699–702. https://doi.org/10.1148/radiology.147.3.6844606. [51] El-Reshaid K, El-Reshaid W, Al-Bader D, Varro J, Madda J, Sallam HT. Biopsy of small kidneys: A safe
and a useful guide to potentially treatable kidney disease. Saudi J Kidney Dis Transpl 2017;28:298– 306. https://doi.org/10.4103/1319-2442.202767.
40
41
La biopsie rénale est un examen clé en néphrologie. Elle permet le diagnostic étiologique, l’orientation thérapeutique et l’évaluation du pronostic rénal. Cependant, dans les cas où l’indication est limite, l’évaluation du bénéfice risque de la biopsie rénale est indispensable. L’objectif de notre étude est d’analyser le profil clinico--biologique et radiologique des patients présentant une fibrose rénale sur la biopsie, corréler les lésions histologiques aux données de l’échographie rénale, et évaluer la prise en charge thérapeutique et évolutive afin de déterminer l’apport de la biopsie rénale chez les patients présentant une fibrose rénale.
MATERIEL ET METHODES :
Notre étude menée entre Janvier 2015 et Décembre 2018, est rétrospective. Nous avons inclus tous les patients du service de Néphrologie du CHU Ibn Sina de Rabat ayant bénéficié d'une biopsie de reins natifs et chez qui l’histologie a objectivé une fibrose rénale.
RESULTATS :
58 patients répondent à nos critères d’inclusion. La taille moyenne des reins est 106 ± 11mm (87-140). La biopsie rénale a permis un diagnostic étiologique chez 64% (n=36) des patients dont 41% (n=15) ont reçu un traitement adapté avec bonne évolution et un faible taux de complications post-biopsique.
CONCLUSION :
La biopsie rénale garde tout son intérêt quelque soit le stade de l’insuffisance rénale.