T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Sciences et Génie des Matériaux
JURY
Pr Manuel Dauchez (Présisent du jury, Rapporteur) Pr Faustino Bisaccia (Rapporteur)
Dr Claudine Lavergne (Examinateur) Dr Emile Perez (Examinateur) Pr Colette Lacabanne (Directeur de thèse) Dr Valérie Samouillan (Directeur de thèse)
Ecole doctorale : Sciences de la Matière
Unité de recherche : Laboratoire de Physique des Polymères - CIRIMAT Directeur(s) de Thèse : Dr Valérie SAMOUILLAN, Pr Colette LACABANNE
Rapporteurs : Pr Manuel Dauchez, Pr Faustino Bisaccia
Présentée et soutenue par Doris TINTAR Le 4 Mars 2010
Titre : Etude de la dynamique de chaîne des protéines de la matrice extracellulaire par
A celui qui m’a toujours soutenue
A mes parents, mon frère et ma grand-mère
Ce travail a été réalisé au Laboratoire de Physique des Polymères (Université Paul Sabatier,
Toulouse).
Je remercie M. Manuel DAUCHEZ, Professeur à l'Université de Reims, pour m’avoir fait
l'honneur de présider ce Jury de thèse et pour l'intérêt qu'il a manifesté pour ce travail en
acceptant de l'examiner et de le juger. Qu'il trouve ici l'expression de ma sincère
reconnaissance.
Je tiens à exprimer mes sincères remerciements à Mr. Faustino BISACCIA, Professeur à
l’Université de la Basilicate de Potenza, pour avoir accepté de lire et de juger ce manuscrit.
Qu'il trouve ici l'expression de mon profond respect et de toute ma gratitude.
Que Mme. Claudine LAVERGNE, Responsable du secteur recherche et développement à
Tecknimed trouve ici l’expression de ma reconnaissance pour avoir examiné avec attention ce
mémoire.
J’exprime à Mr. Emile PEREZ, Chargé de recherche au laboratoire des IMRCP, toute ma
gratitude pour avoir bien voulu examiner ce manuscrit.
J'exprime toute ma reconnaissance à Mme. Colette LACABANNE, Professeur à
l'Université Paul Sabatier, pour m'avoir accueillie au Laboratoire de Physique des
Polymères. Je la remercie de m'avoir fait bénéficier de son expérience, de son enthousiasme et
de sa rigueur qui ont contribué à la réussite de cette thèse.
Mes vifs remerciements vont à Melle. Brigida BOCHICCHIO, Docteur à l’Université de la
Basilicate de Potenza, qui m'a permis, grâce sa collaboration, d'enrichir et d'élargir ces
J’exprime toute ma gratitude et ma sympathie à Mme. Valérie SAMOUILLAN, Directeur
de cette thèse pour sa confiance, sa disponibilité, ses précieux conseils et ses encouragements.
Je tiens également à remercier Mr. Michel SPINA, Professeur à l’Université de Science de
Padoue, qui grâce à sa collaboration, m'a permis d'aborder l'étude des matériaux biologiques.
Je voudrais remercier très chaleureusement l'équipe du Professeur TAMBURRO de
l’Université de la Basilicate de Potenza que j’ai eu le plaisir de côtoyer au cours de mon
séjour. Je leur témoigne ici toute ma sympathie.
Je suis très reconnaissante à Mme. Jany DANDURAND, Ingénieur au laboratoire de
Physique des Polymères, pour son appui technique, ses conseils et ses encouragements durant
toute la période de la thèse. Qu’elle trouve ici toute ma gratitude et ma sympathie pour l’aide
qu’elle m’a apportée.
Je voudrais remercier tous les membres du Laboratoire de Physique des Polymères, pour leur
bonne humeur et leur convivialité au cours de ces trois années.
J’adresse mes sincères remerciements à toute l’équipe de la cryogénie, pour tous les moments
agréables passés en leur compagnie et leur bonne humeur, qui ont rendu ces trois années de
thèse agréables. Je leur exprime ici toute ma sympathie.
Enfin, je ne saurais terminer sans remercier ma famille sans qui tout cela n’aurait pas été
possible. Merci, d’avoir toujours cru en moi.
Les relations structure-propriétés de deux protéines majeures de la matrice extracellulaire, le collagène et l’élastine, ont été analysées.
L’élastine étant insoluble, l’approche dite “réductionniste” a consisté à étudier des séquences polypeptidiques codées par les exons de la tropoélastine humaine. Des études de RMN, IRTF et dichroïsme circulaire ont montré que la conformation de telles séquences était spécifique au solvant. Notre objectif était de compléter ces études locales par une analyse de la dynamique « basse fréquence » de ses séquences, donnant des informations sur une mésoéchelle. La fonctionnalité mécanique de la fibre élastique a été étudiée par analyse mécanique en milieu physiologique, afin d’établir la carte d’identité du tissu sain pour pouvoir par la suite étudier l’influence de divers facteurs (pathologiques ou pharmacologiques). Enfin, en parallèle à ce travail, nous avons étudié un collagène fonctionnalisé réalisé dans le cadre de la conception d’un biomatériau de substitution du tissu conjonctif. Ce collagène fonctionnalisé a été modifié grâce au peptide RGD connu pour son implication dans l’adhésion cellulaire.
Mots clés : élastine, collagène, exons, solvant, mobilité moléculaire, relaxation diélectrique, spectroscopie diélectrique, spectroscopie mécanique, calorimétrie.
Structure-properties relationships of two major proteins of the extracellular matrix, collagen and elastin, were analyzed.
Elastin being insoluble, the approach known as “reductionist” consisted in studying polypeptide sequences coded by exons of human tropoélastine. NMR, IRTF and circular dichroism studies have shown that the conformation of such sequences was solvent specific. Our objective was to supplement these local studies by an analysis of dynamics “low frequency” giving information on mesoscale. The mechanical functionality of elastic fiber was studied by mechanical analysis in physiological state, in order to establish the identity card of healthy tissue to study the influence of various factors (pathological or pharmacological). Simultaneously with this work, we studied a functionalized collagen carried out within the framework of the conception of a biomaterial of substitution of conjunctive tissue. This functionalized collagen was modified thanks to RGD peptide known for its implication in cellular adhesion.
Keywords: elastin, collagen, exons, solvent, molecular mobility, dielectric relaxation, dielectric spectroscopy, mechanical spectroscopy, calorimetry.
Introduction
19
I Etude Bibliographique
23
1 Matrice extracellulaire (MEC)
1.1 Définition
25
1.2 Différents types de matrices extracellulaires
25
1.3 Principaux constituants de la matrice extracellulaire
28
1.3.1 Protéoglycanes (PG) et Glycoprotéines de structure
29
(GPS)
1.3.2 Elastine
30
1.3.3.1 Gène de l’élastine
30
1.3.3.2 Tropoélastine : Structure primaire
32
1.3.3.3 Mécanisme d’élasticité et structure secondaire 34
1.3.3.4 Fibre élastique
41
1.3.4 Collagène
42
1.3.4.1 Structure primaire
43
1.3.4.2 Structure secondaire
44
1.3.4.3 Structure tertiaire
45
1.3.4.4 Structure quaternaire
47
1.4 Rôle des solvants dans les protéines
48
1.4.1 Propriétés des solvants
48
1.4.1.1 Liaison hydrogène de l’eau
48
1.4.1.2 Phénomènes de solvatation et
49
interactions hydrophobes
1.4.2 Stabilité des protéines
52
1.5 Propriétés physiques des matériaux
53
1.5.1 Propriétés thermiques
53
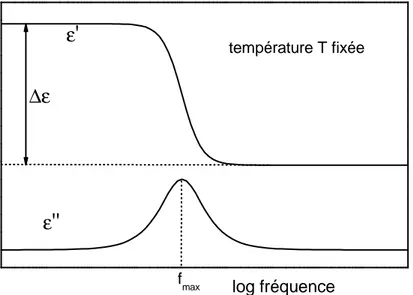
1.5.2 Propriétés diélectriques
55
II Matériaux et Méthodes
61
1 Matériaux
1.1 Constituants majeurs
63
1.1.1 Elastine
63
1.1.2 Exons
63
1.1.3 Collagène
64
1.2 Biomatériaux à base collagène
65
1.3 Tissu conjonctif : Ligament de nuque de bœuf
67
2 Méthodes
2.1 Analyse Thermo Gravimétrique couplée InfraRouge à
69
Transformée de Fourier (ATG/IRTF)
2.1.1 Principe
69
2.1.2 Dispositif expérimental
69
2.2 Analyse Calorimétrique Diatherme (ACD)
70
2.2.1 Principe
70
2.2.2 Dispositif expérimental
71
2.3 Analyse Diélectrique
72
2.3.1 Origine de la polarisation
72
2.3.2 Analyse Diélectrique Dynamique (ADD)
75
2.3.2.1 Principe
75
2.3.2.2 Dispositif expérimental
77
2.3.3 Courants Thermo Stimulés (CTS)
79
2.3.3.2 Dispositif expérimental
82
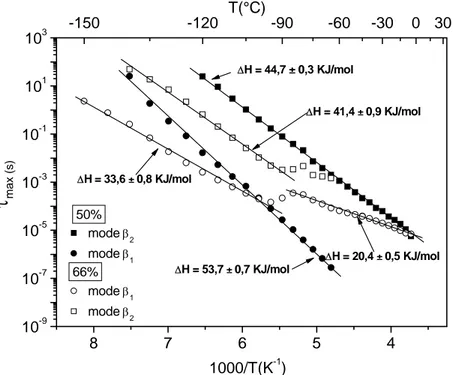
2.3.4 Dépendance en température des temps de relaxation
82
2.3.4.1 Comportement de type Arrhénius
83
2.3.4.2 Phénomène de compensation
84
2.4 Analyse Mécanique Dynamique (AMD)
88
2.4.1 Principe
88
2.4.2 Relaxation mécanique dynamique
89
2.4.2.1 Conditions opératoires
89
2.4.2.2 Balayage en fréquence : Spectroscopie
90
Mécanique Dynamique
2.4.2.3 Balayage en température : Analyse
91
Dynamique Mécanique
2.4.3 Dispositif expérimental
93
III Macromolécules constitutives de la matrice extracellulaire
95
1 Elastine
1.1 Transitions
97
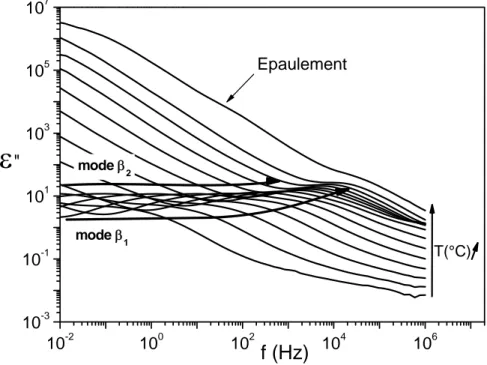
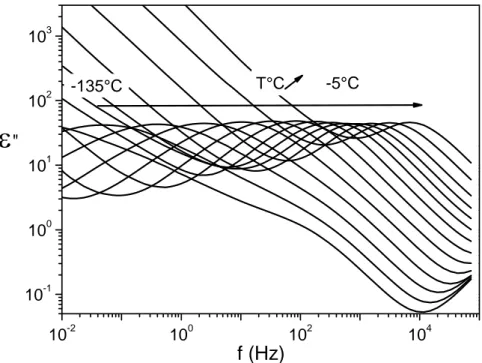
1.2 Relaxations dipolaires
98
1.3 Discussion
101
1.3.1 Transitions thermiques
101
1.3.2 Relaxations dynamiques
104
1.3.2.1 Mode
β
2: polymère/eau
104
1.3.2.2 Mode
β
1: eau en masse
106
2 Exons
2.1 Transitions
109
2.1.1 Exon 6, 10 et 24 déshydratés
109
2.2 Relaxations dipolaires
115
2.2.1 Exon 6 en solution
115
2.2.2 Exon 24 en solution
120
2.3 Discussion
125
2.3.1 Transitions : exons déshydratés
125
2.3.1.1 Transition endothermique : de 20 à 60°C
125
2.3.1.2 Transition vitreuse
126
2.3.1.3 Transition endothermique : de 200 à 250°C
127
2.3.2 Transitions : exons en solution
128
2.3.3 Relaxations : exons en solution
130
2.3.3.1 Exons en solution aqueuse
130
2.3.3.2 Exons en solution dans un cosolvant TFE
132
3 Collagène
3.1 Transitions
134
3.1.1 Collagène à l’état déshydraté
134
3.1.2 Collagène à l’état hydraté
135
3.2 Relaxation diélectrique
136
3.3 Discussion
138
3.3.1 Transitions : état déshydraté/état hydraté
138
3.3.2 Relaxations diélectriques
139
IV Nouveau Biomatériau à base collagène
141
4.1 Transitions
143
4.1.1 Peptide seul
143
4.1.2 Echantillon de collagène groupe 1
146
4.1.3 Echantillon de collagène groupe 2
149
4.2.1 Peptide seul
151
4.2.2 Echantillon de collagène groupe 1
153
4.2.3 Echantillon de collagène groupe 2
157
4.3 Discussion
161
4.3.1 Transitions thermiques
161
4.3.1.1 Collagènes/peptide : comparaison des
161
thermogrammes
4.3.1.2 Echantillon à base de collagène : transition
161
extrinsèque
4.3.1.3 Echantillon à base de collagène : transition
163
intrinsèque
4.3.2 Collagènes/peptide : relaxations diélectriques
166
4.3.2.1 Mode
β
166
4.3.2.2 Structure fine
167
V Tissu conjonctif : Ligament de nuque de bœuf
177
5.1 Caractérisation Physico-Chimique
179
5.1.1 Thermogrammes d’analyse thermogravimétrique
179
5.1.2 Spectroscopie infrarouge
181
5.2 Transitions thermiques
183
5.2.1 Analyse thermique en système ouvert
183
5.2.2 Analyse thermique en système fermé
185
5.2.3 Quantification : eau cristallisable et eau
187
non cristallisable
5.3 Comportement mécanique dynamique à l’état physiologique
188
5.3.1 Comportement isotherme
188
5.4.2 Comportement sous liquide physiologique
196
5.4.2.1 Organisation macromoléculaire et
196
déformation statique en élongation
5.4.2.2 Organisation macromoléculaire et
197
relaxation dynamique en cisaillement
Conclusion
205
Références bibliographiques
213
La matrice extracellulaire est un système complexe de par sa composition, sa structure et sa grande variabilité en fonction des conditions physiologiques et pathologiques.
L’eau constitue le milieu naturel dans lequel les protéines manifestent normalement leur activité biologique. L’hydratation des macromolécules joue un rôle essentiel dans le maintien de la stabilité de toutes les structures biologiques. Ainsi, la connaissance des interactions eau-protéines et leur dynamique associée constituent un axe de recherche crucial, tant au niveau fondamental qu’appliqué.
Dans cette thèse, nous nous proposons d’étudier la structure physique des biopolymères majeurs de la matrice extracellulaire à l’état hydraté et déshydraté afin de contribuer à une meilleure compréhension des interactions eau-protéines.
Le premier objectif de cette thèse a été d’étudier la dynamique de chaîne de l’élastine et de certaines séquences d’acides aminés particulières de la tropoélastine (motif constitutif de l’élastine), afin d’obtenir des informations sur les conformations fortement dépendantes des conditions de solvatation, responsables du mécanisme d’élasticité de l’élastine. Dans ce mémoire, pour des raisons de commodité, les séquences polypeptidiques de la tropoélastine humaine encodées par les exons seront appelées « exons ».
Actuellement, l’augmentation de la durée de vie implique une utilisation croissante des biomatériaux de substitution de la matrice extracellulaire. Le deuxième objectif de ce travail de thèse a ainsi été de contribuer à la conception d’un nouveau collagène fonctionnalisé, dans le but de développer une bioprothèse de valve cardiaque.
En parallèle, les propriétés thermiques et mécaniques de la fibre élastique seront étudiées en milieu physiologique, afin d’établir une carte d’identité du tissu sain. Cette base de données permettra par la suite d’étudier l’influence de divers facteurs pathologiques ou pharmacologiques.
Ce mémoire se divise en cinq chapitres :
Le premier chapitre sera consacré à une synthèse bibliographique sur les principales macromolécules de la matrice extracellulaire. Par la suite seront abordés le rôle des solvants dans le tissu et les interactions solvant-protéines.
Dans le deuxième chapitre seront présentés les matériaux biologiques étudiés ainsi que les différentes techniques d’analyse.
L’étude des transitions thermiques et diélectriques de l’élastine, des exons et du collagène fera l’objet du troisième chapitre. L’évolution de la dynamique moléculaire des différentes macromolécules sera suivie en fonction de leur état d’hydratation.
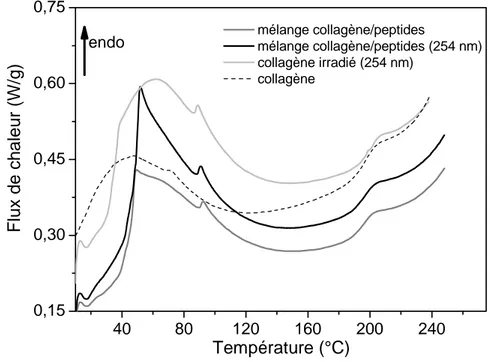
Le quatrième chapitre sera consacré à l’étude du collagène fonctionnalisé. La pertinence des différents traitements sur la dynamique de chaîne du collagène sera évaluée et des conclusions seront apportées pour le développement d’un biomatériau de substitution.
Enfin, l’étude du tissu biologique modèle, le ligament de nuque de bœuf sera présenté dans le cinquième chapitre. L’influence des traitements biochimiques sur la structure physique de la matrice extracellulaire et sur son hydratation sera étudiée en analyse thermique et en spectrométrie mécanique dynamique.
1 Matrice extracellulaire (MEC)
1.1 Définition
La matrice extracellulaire est un ensemble complexe composé de protéines, d’eau et de petites molécules dissoutes (sucres, ions, oligopeptides). Elle remplit les espaces entre les cellules (espace extracellulaire), et possède plusieurs fonctions [Wang et al. 2006] :
- elle aide à l’association des cellules pour former un tissu cohérent, - elle contrôle la mobilité cellulaire,
- elle assure la résistance mécanique dans certains tissus comme les os, les parois des artères, les tendons et les ligaments.
La matrice extracellulaire est présente à tous les niveaux de l’organisme, mais son abondance et sa composition varient selon les tissus [Adams et al. 1993]. Elle peut prendre différentes formes dans les tissus ; elle peut être liquide, gélatineuse ou très dure. Chaque tissu possède ses propres caractéristiques biologiques, fonctionnelles et morphologiques. Cette diversité est essentiellement due :
- à la nature des cellules,
- à la composition moléculaire de la matrice extracellulaire,
- à la proportion relative entre cellules et matrice extracellulaire dans les tissus.
1.2 Différents types de matrices extracellulaires
On distingue généralement quatre grandes familles de tissus : les épithéliums, les tissus conjonctifs, les tissus musculaires et les tissus nerveux. Dans le cadre de notre étude, nous nous sommes principalement intéressés aux tissus conjonctifs, et plus précisément aux tissus conjonctifs denses. Afin de rendre compte de la grande variété des tissus conjonctifs, nous présentons dans le Tableau 1.1 quelques exemples.
Catégorie de tissu Tissus Quelques exemples de localisation
Tissu conjonctif lâche Peau
Tissu réticulaire Moelle osseuse, rate, foie, rein Tissu muqueux (Gelée de Wharton) Cordon ombilical
Tissu Lymphoïde Moelle osseuse, rate
Tissu adipeux Derme
Tissu conjonctif dense Ligament, Tendon, Péricarde, Artère
Tissus cartilagineux Cartilage
Tissus conjonctifs
Tissu osseux Os
Tableau 1.1 : Quelques exemples de tissus conjonctifs.
En général, les tissus conjonctifs denses sont des tissus riches en fibres et pauvres en cellules. Ils ont essentiellement une fonction mécanique et peuvent être divisés en trois groupes :
- Les tissus fibreux non orientés : Ils contiennent essentiellement des fibres de collagène. On les retrouve par exemple au niveau du derme profond ou encore au niveau des capsules des organes pleins comme le foie, la rate ou les reins.
- Les tissus fibreux orientés : Ils se différencient des précédents par leurs fibres très nettement orientées. Ces tissus se répartissent en deux sous-groupes :
- Les tissus fibreux unitendus, comme les ligaments ou les tendons. Les fibres forment des faisceaux parallèles, et les cellules, peu nombreuses, sont alignées entre les fibres serrées qui les déforment. Ces tissus sont faiblement vascularisés, ce qui limite par exemple les possibilités de cicatrisation après une section tendineuse ou ligamentaire. - Les tissus fibreux bitendus, comme les aponévroses (membrane recouvrant et séparant les muscles en loges musculaires) ou le stroma de la cornée (représentant la majeure partie de l’épaisseur de la cornée ∼ 400 µm). Les fibres y sont organisées en couches superposées d’orientation différente.
- Les tissus élastiques : Cette variété de tissu conjonctif fibreux dense contient une grande quantité de fibres (ou lames) élastiques, qui se disposent entre de rares
fibroblastes (par exemple dans le ligament jaune de la nuque) ou entre les cellules musculaires lisses (par exemple dans la média des artères élastiques de gros calibre).
La teneur en macromolécules fibrillaires dans les tissus varie et est souvent liée à leur fonctionnalité.
La composition en élastine et en collagène, les deux protéines fibreuses majeures de la MEC, est adaptée à la fonctionnalité du tissu. Ainsi, parmi les tissus que nous avons étudiés, le ligament de nuque de bœuf est essentiellement constitué d’élastine (70% de la masse sèche) lui conférant les propriétés d’extension/compression spécifiques, tandis que le péricarde, riche en collagène (77% de la masse sèche), possède la résistance mécanique adéquate à sa fonction.
Nous avons présenté à titre d’exemple des images de microscopie électronique du ligament et du péricarde.
Un réseau de fibres de collagène disposé en couches fines et orientées dans plusieurs directions compose la couche fibreuse du péricarde. Le péricarde se distendant pendant les mouvements diastoliques, l'arrangement multidirectionnel des fibres de collagène garantit la restriction de ce mouvement, aidant à la stabilisation du péricarde et empêchant une super dilatation.
Figure 1.1 : Surface pariétale fibreuse du péricarde de bœuf [Gandaglia 2001] (microscopie électronique agrandissement x 600)
Le ligament de nuque de bœuf possède un rôle primordial dans le soulèvement de la tête et permet le soutien passif de l’encolure. Dans ces ligaments, les fibres élastiques se présentent généralement comme des structures orientées et parallèles.
Figure 1.2 : Images en microscopie du ligament [Daamen et al. 2007]
A : fibres élastiques du ligament en noir et en blanc pour le matériel collagènique, B : organisation des fibres élastiques (vue en microscopie à balayage), C : interface élastine collagène (les flèches
indiquant les microfibrilles) (vue en microscopie en transmission) (Les traits représentent 10 µm pour A et B, 1 µm pour C)
1.3 Principaux constituants de la matrice extracellulaire
Dans la matrice extracellulaire, coexistent quatre familles majeures de macromolécules : les collagènes, l’élastine, les protéoglycanes et les glycoprotéines de structure. L’échafaudage fibreux de la matrice est formé par le collagène et l’élastine. Les protéoglycanes et les glycoprotéines de structure comblent les interstices et les interfaces entre les cellules et la MEC [Labat-Robert et al. 1990 ; 2005].
A
B
1.3.1 Protéoglycanes (PG) et Glycoprotéines de structure (GPS)
Protéoglycanes (PG)
Les protéoglycanes sont constitués de glycosaminoglycanes (GAG) (chaînes polysaccharidiques, non ramifiées, sulfatées ou non sulfatées), sur lesquelles se greffe de façon covalente une protéine. Ils sont généralement connus pour jouer un rôle dans les relations cellule-matrice. Leur double nature biochimique fait d’eux des molécules remarquables.
Dans la littérature, les GAG sont considérés comme les éléments fonctionnels majeurs des protéoglycanes [Wang et al. 2006].
Dans les protéoglycanes, des GAG de différente nature peuvent se lier à une même protéine et former des complexes macromoléculaires de taille variable. Il en existe une grande variété pouvant atteindre d’importantes masses moléculaires avec plus de 100 chaînes de GAG, et d’autres bien plus petits ne possédant que 1 à 10 chaînes de GAG. Nous pouvons citer comme exemple la décorine, protéoglycane de petite taille généralement répandu dans les tissus conjonctifs à la surface des fibres de collagène [Ruoslahti 1989 ; Mochida et al. 2009]. Néanmoins, toutes les interactions des protéoglycanes ne sont pas « dirigées » par leur composante GAG, les noyaux protéiques pouvant également interagir avec d’autres macromolécules [Mukaratirwa 2002]. En effet, selon Mukaratirwa, les fonctions spécifiques des protéoglycanes varient considérablement en raison de la diversité de la structure du noyau protéique. Ils sont généralement impliqués dans les phénomènes d’adhésion cellulaire.
Dans les tissus conjonctifs, les protéoglycanes assurent la régulation des échanges moléculaires en se liant par exemple au collagène par leur axe protéique et aux glycoprotéines de structure par les chaînes polysaccharidiques, organisant et orientant la MEC et la migration des cellules conjonctives.
Glycoprotéines de structure (GPS)
Les glycoprotéines sont constituées elles aussi de complexes protéine-polysaccharide. Elles sont synthétisées par la glycosylation d’une protéine.
Les glycoprotéines se distinguent des protéoglycanes par leur nature, la quantité et la disposition de leurs chaînes latérales de sucre [Fahem 2007]. En effet, les glycoprotéines contiennent entre 1 et 60% de glucides en masse sous forme de chaînes relativement courtes d’oligosaccharides ramifiés, tandis que les protéoglycanes peuvent contenir jusqu’à
95% de glucides en masse, sous forme de longues chaînes de GAG non ramifiées, avec une longueur typique de 80 sucres.
Les glycoprotéines de structure sont particulièrement impliquées dans les phénomènes d’adhésion entre cellules et MEC. Selon Robert et al, les glycoprotéines de structure sont des composants omniprésents dans la MEC, et plusieurs d’entre eux comme la fibronectine ou la laminine jouent un rôle dans l’association des cellules aux macromolécules de la MEC, tels que les collagènes, les protéoglycanes et l’élastine [Robert 1986 ; Laurie et al. 1986 ; Aumailley et al. 2003].
1.3.2 Elastine
L'élastine est synthétisée et sécrétée dans l’espace extracellulaire par les fibroblastes. Elle s’obtient via la réticulation des molécules de tropoélastine, précurseur soluble de l’élastine -isolé la première fois d’animaux déficients en cuivre. La réticulation des molécules de tropoélastine s’effectue dans l’espace extracellulaire. L’élastine est le principal constituant des fibres élastiques. Présente dans la plupart des tissus conjonctifs, elle possède des propriétés d’élasticité remarquables. En effet, elle possède un module de Young de 0,3 MPa compris dans la gamme des élastomères (0,1 - 10 MPa) et une élongation maximale à la rupture de 100 à 150%. C’est une protéine insoluble et très résistante aux agents chimiques. Toutefois, certaines enzymes comme les élastases (métalloprotéases, papaïnes, sérines) sont capables d’hydrolyser plus ou moins spécifiquement l’élastine [Bode et al. 1989].
L’élastine possède une forte proportion de résidus apolaires, lui conférant son caractère hydrophobe. Cette hydrophobicité est un facteur déterminant des propriétés caoutchoutiques, intensivement étudiées. De nombreuses études ont permis de révéler les structures primaire et secondaire du monomère précurseur de l’élastine, donnant lieu à plusieurs modèles concernant l’élasticité de l’élastine [Vrhovski et al. 1998]. Toutefois, la structure tridimensionnelle de la tropoélastine, ainsi que la manière dont elle s’agence en fibres élastiques, restent pour l’instant peu connues.
1.3.3.1 Gène de l’élastine
Le gène de l’élastine présent en exemplaire unique dans le génome humain est situé sur le chromosome 7 [Fazio et al. 1991].
Les gènes qui codent les protéines sont constitués d'une suite d'exons et d'introns alternés. Les ARN messagers (ARNm) issus de la transcription des séquences de l’ADN codant (ADNc) peuvent subir des épissages alternatifs [Bashir et al. 1989]. En effet, lors de la
synthèse protéique, certaines régions de l’ARN messager sont supprimées (introns) tandis que d’autres régions (exons) sont conservées et permettent alors la construction de la protéine. Toutefois, certains exons qui ne sont pas nécessaires au codage de la protéine peuvent aussi être éliminés lors d’un épissage alternatif.
Figure 1.3 : Structure de l’ADNc du gène de l’élastine bovin et humain [Cleary et al. 1996]
Les flèches indiquent les exons qui peuvent être potentiellement éliminés lors de l’épissage alternatif
Le gène de l’élastine spécifique à l’espèce humaine possède 34 exons alors que celui spécifique à l’espèce bovine en possède 36. Les exons 34 et 35 manquants dans le gène humain, encodent respectivement un domaine de réticulation et un domaine hydrophobe dans le gène bovin, démontrant que des variations inter-espèces existent [Vrhovski et al 1998]. Toutefois, l’exon 36 reste particulièrement bien conservé pour un bon nombre d’espèces (> 70%). L’exon 26A spécifique à l’espèce humaine est rarement exprimé sauf dans certaines maladies telles que l’hypertension artérielle pulmonaire [Liptay et al. 1991 ; Bisaccia et al. 1998 ; Ostuni et al. 2002]. L’hypertension artérielle pulmonaire est caractérisée par un important épaississement de l’intima. Dans l’intima des vaisseaux hypertensifs, les cellules produisent d’abondantes quantités d’élastine mais sont incapables de les organiser en des fibres élastiques fonctionnelles.
L’organisation particulière en « cassette » du gène de l’élastine, où chaque exon encode pour un domaine particulier (domaine hydrophobe ou de réticulation) a permis d’étudier
séparément sous forme de peptide chacun des exons de la tropoélastine [Tamburro et al. 2003].
1.3.3.2 Tropoélastine : Structure primaire
La tropoélastine est synthétisée dans le réticulum endoplasmique rugueux, qui traduit l’ARNm et assemble les acides aminés selon les « instructions » du code génétique, afin de fabriquer la protéine.
La structure primaire complète de la tropoélastine humaine [Indik et al. 1987] et bovine [Raju et al. 1987] ont été déterminées par le clonage de l’ADN codant. Les séquences de la tropoélastine encodées contiennent 786 acides aminés chez l’humain (avec le peptide signal) et 760 chez les bovins. Elles présentent une forte homologie tant au niveau du gène que de la protéine. Seuls 20 acides aminés sont représentés dans le code génétique « universel », qui est pratiquement le même pour tous les organismes (cf. Annexe 1.1). La tropoélastine contient environ 30% de glycine, 35 % de proline, valine, leucine et isoleucine et 20 % d’alanine. Les résidus fonctionnels tels que la lysine, l’acide aspartique, l’acide glutamique, l’arginine sont présents en moindre quantité.
Bien que la lysine soit présente en moindre quantité, ce résidu a un rôle fonctionnel important car il permet à l’élastine de subir des déformations relativement élevées via la formation des liaisons croisées. L’élastine possède des résidus d’acides modifiés, tels que la desmosine et l’isodesmosine qui sont formées à partir de quatre résidus lysine responsables de la formation des liaisons croisées dans l’élastine. La réaction initiale est une désamination oxydative des résidus lysine par la lysyl oxydase afin de produire l’allysine. Elle est suivie par des réactions spontanées de condensation de résidus lysine et allysine proches afin de former des ponts de réticulation tels que l’allysine aldol, la lysinonorleucine, la merodesmosine et les liaisons croisées tétrafonctionnelles spécifiques à l’élastine : la desmosine et l’isodesmosine [Partridge, 1964].
COO -N (CH2)2 (CH2)4 (CH2)2 (CH2)3 CH CH -OOC NH3+ NH3+ CH NH3+ COO -CH COO -NH3+ COO -N (CH2)2 (CH2)4 (CH2)2 CH CH -OOC NH3+ NH3+ CH COO -NH3+ COO -(CH2)3 CH NH3+ Desmosine Isodesmosine
Figure 1.4 : Résidus spécifiques à l'élastine formés lors de la réticulation
La tropoélastine possède deux types de domaine distincts : les régions hydrophobes riches en valine (V), glycine (G), proline (P) et alanine (A), et les régions de réticulation hydrophiles riches en alanine (A) et lysine (K) contenant habituellement deux résidus lysine séparés par deux ou trois résidus alanines. Il existe une autre région de réticulation possédant un résidu lysine près d’un résidu proline [Indik et al. 1989]. Les domaines hydrophobes et de réticulation s’alternent, excepté aux extrémités de la molécule.
Les régions hydrophobes qui souvent contiennent des motifs répétés et courts de 3, 5 ou 6 acides aminés, montrent une variation considérable de la séquence entre espèces. Par exemple, la séquence VPGVG est trouvée 11 fois près du centre de la tropoélastine bovine, mais cette région est plus irrégulière dans la molécule humaine [Indik et al. 1990]. En revanche, les domaines de réticulation sont plus hautement conservés.
Le clonage moléculaire a permis d’identifier une séquence hautement basique de la partie terminale carboxylée de la tropoélastine. La séquence GGACLGKACGRKRK dans la tropoélastine humaine est le seul domaine de la molécule contenant des résidus cystéine [Indik et al. 1990 ; Parks et al. 1990]. Ce domaine peut être important lors de la fibrogénèse élastique, car il pourrait interagir avec les protéines microfibrillaires acides.
1.3.3.3 Mécanismes d’élasticité et structure secondaire
De nombreux travaux ont été entrepris afin de comprendre le mécanisme de l'élasticité de l'élastine. Pour cela divers modèles structuraux ont été proposés, basés sur différentes hypothèses pour la structure de l’élastine.
Le modèle des chaînes aléatoires de Hoeve et Flory [Hoeve et al. 1974] considère l’élastine comme un caoutchouc, composé de chaînes aléatoires et flexibles qui sont cinétiquement libres et en constant mouvement dû à l’agitation thermique (Figure 1.5). Les chaînes sont liées par des liaisons croisées aléatoires et permanentes semblables à un élastomère. Dans ce modèle, l’élasticité est d’origine purement entropique. A l’état relaxé, les chaînes aléatoires peuvent adopter un certain nombre de conformations leur conférant une entropie élevée, et à l’état étiré les chaînes tendent à s’orienter, diminuant ainsi l’entropie totale du système.
Figure 1.5 : Modèle des chaînes aléatoires [Vrhovski et al. 1998].
Cependant ce modèle possède des limites : contrairement au caoutchouc, l’élastine n’est pas auto-lubrifiante et est seulement élastique lorsqu’elle est gonflée d’eau. Les interactions hydrophobes sont considérées comme une force importante dans l’élasticité, ayant pour résultat quelques modifications du modèle des chaînes aléatoires. Compte tenu de la large proportion d’acides aminés hydrophobes dans l’élastine, Gosline suggère que les interactions hydrophobes entre les chaînes latérales non-polaires de l’élastine et l’eau jouent un rôle majeur dans le mécanisme d’élasticité de l’élastine. Sur la base d’études calorimétriques, il a été proposé que l’eau soit absorbée par l’élastine et donc soit forcée de s’associer aux résidus non-polaires lorsque l’élastine est étirée [Gosline 1978]. Il apparaît donc une organisation des molécules d’eau avec un changement de l’entropie résultante fournissant une force de rappel additionnelle [Gosline 1978 ; 1980]. L’effet de l’eau comme
plastifiant a été démontré par une augmentation de la rigidité et une perte de résilience observées lorsque la teneur en eau est réduite [Lillie et al 1990]. Le mécanisme d’hydrophobicité comme force motrice dans l’élasticité d’origine entropique est compatible avec le modèle des chaînes aléatoires.
Le modèle de la goutte liquide suppose que l’élastine gonflée dans l’eau peut être considérée comme un système biphasique composé de domaines globulaires connectés par des liaisons croisées (Figure 1.6) [Weis-Fogh et al. 1970]. Pendant l’étirement, la déformation des gouttelettes expose les groupes hydrophobes, confinés à l’intérieur, à l’eau environnante et de ce fait diminue l’entropie du système. La force de rappel est conduite par une augmentation de l’entropie dans le processus inverse.
Figure 1.6 : Modèle de la goutte liquide [Vrhovski et al. 1998].
Bien que ce modèle ait été critiqué [Hoeve 1974 ; Gosline 1976], les résultats de Gosline s’accordent avec l’idée de base, à savoir l’implication des interactions hydrophobes dans le mécanisme de l’élasticité, mais sont en désaccord avec les principes structuraux du modèle de la goutte liquide.
Des études en spectroscopie optique de l’élastine et de la κ-élastine ont proposé comme base architecturale des domaines globulaires reliés par des liaisons croisées en accord avec le modèle de la goutte liquide. Toutefois, le mécanisme d’élasticité hydrophobe a été rejeté à cause de l’évidente mobilité élevée des régions hydrophobes [Debelle et al. 1995]. Ces résultats contredisent également les autres modèles, à savoir le modèle des chaînes aléatoires, le modèle « oiled-coil » ainsi que le modèle fibrillaire.
Un modèle alternatif « modèle oiled-coil » basé sur le modèle de la goutte liquide a été proposé par Gray Figure 1.7 [Gray 1973].
Figure 1.7 : Modèle « oiled-coil » [Vrhovski et al. 1998].
A la place des unités globulaires, ce modèle est basé sur des unités fibrillaires alternant des hélices α (Figure 1.8), des domaines de réticulation et de larges enroulements (oiled-coil) comprenant des unités répétitives hydrophobes enrichies en glycine, valine et proline. L’hélice α est l’une des conformations les plus courantes dans la structure secondaire d’une protéine. C’est une hélice de pas droit comportant 3,6 résidus par tour. Cette structure est très stable grâce à la présence de liaisons hydrogène entre le C=O du résidu i et le N-H du résidu i+4. Récemment, des études ont encore confirmé la stabilité de l’hélice au travers des liaisons hydrogène [LaPointe et al. 2009]. De plus, le cœur de l’hélice est très compact ; les atomes qui s’y trouvent établissent des interactions de Van der Waals à travers l’hélice, d’où des énergies d’association maximales.
Figure 1.8 : Hélice
α
Le modèle fibrillaire présenté sur la Figure 1.9 proposé par Urry en 1974 [Urry 1974a], est basé sur les études de différents segments hydrophobes de la tropoélastine en particulier l’hexapeptide APGVGV, le pentapeptide VPGVG et le tétrapeptide VPGG.
Figure 1.9 : Modèle fibrillaire [Vrhovski et al. 1998].
Des études en Dichroïsme Circulaire (DC) et en Résonnance Magnétique Nucléaire (RMN) ont montré que ces polypeptides sont capables de former des conformations en coude β II (Figure 1.10) [Urry et al. 1976 ; Urry et al. 1974b].
Les coudes permettent à la chaîne polypeptidique d’effectuer un changement de direction à 180°. Il existe plusieurs structures en coude. Ces coudes sont classés selon le nombre de
résidus impliqués dans le changement de direction (ces résidus peuvent aller de 2 à 6) [Chou 2000]. Le coude β possède quatre résidus et est généralement stabilisé par une liaison hydrogène entre le C=O et le N-H des résidus terminaux. Les coudes β de type I et II sont les plus répandus dans les protéines [Gunasekaran et al. 1998]. Ils diffèrent principalement dans l’orientation de l’unité peptidique centrale. Cette interconversion facile est possible par un flip de l’unité centrale.
Figure 1.10 : Coudes β (type I et II)
La structure globale de l’élastine proposée par Urry dans le modèle fibrillaire, est composée de spirales β (Figure 1.11) formées par les domaines hydrophobes alternant avec des domaines de réticulation en hélice α, les chaînes individuelles étant liées ensemble par des réticulations et des interactions hydrophobes.
La spirale β de forme hélicoïdale se compose de plusieurs coudes β qui peuvent être identiques ou de nature différente, parfois stabilisés par une ou plusieurs liaisons hydrogène. Les interactions hydrophobes des chaînes latérales constituent la force stabilisatrice dominante de la spirale β [Lagúnez-Otero et al. 2002].
Dans le modèle fibrillaire, l’élasticité de nature entropique est expliquée par le mécanisme de « libration ». Les spirales β sont des enroulements « lâches » (non restreints) et contiennent des molécules d’eau contiguës avec l’eau en masse environnante. Les segments d’oligopeptides entre les coudes β sont dynamiques et subissent à basse amplitude, des mouvements de basculement de fréquence élevée connus sous le nom de libration. Lorsque la spirale est étirée, les librations diminuent en amplitude et induisent de l’ordre dans la protéine. L’entropie est diminuée et provoque la force élastique de rappel.
Toutefois la validité de ce modèle a été remise en cause. Des études de simulation moléculaire dynamique ont montré que la spirale β n’est pas stable et peut seulement être considérée comme une structure labile [Li et al. 2001a ; 2001b]. D’autres études spectroscopiques sur le polypeptide poly(VPGVG) ont montré qu’il n’adopte pas cette structure en spirale β [Gross et al. 2003].
Tamburro et ses collaborateurs ont proposé un modèle alternatif [Tamburro et al. 1990] dans lequel la structure en coudes β de type II a été suggérée pour les séquences récurrentes (GXGGX), très labiles et pouvant s’interconvertir, donnant lieu à des coudes β dynamiques [Tamburro et al. 1990 ; Lelj et al. 1992 ; Debelle et al. 1999]. Dans ce modèle, l’élastine à l’état relaxé est caractérisée par des structures en coude très labiles glissant le long de la chaîne peptidique. L’état relaxé de la structure possède une grande entropie, favorisée par une hydratation importante augmentant les mouvements de la chaîne peptidique. A l’état étiré, l’équilibre entre conformations doit se déplacer vers les conformations étirées (plus structurées et moins hydratées), et de ce fait une diminution de l’entropie est générée. Les modèles d’Urry et de Tamburro présentent un point commun, à savoir la présence de coudes β de type II.
Ces mêmes auteurs ont affiné leur modèle en étudiant les séquences de polypeptides codées par tous les exons de la tropoélastine humaine [Tamburro et al. 2003 ; Tamburro et al. 2005]. Ces études ont permis de montrer la présence de différentes conformations provenant de séquences spécifiques comme les conformations de type polypropline II (PPII) (Figure 1.12), les coudes β mais aussi les conformations non-ordonnées.
L’hélice gauche de type polyproline II ne possède pas de liaison hydrogène stabilisante. Elle est constituée de trois résidus par tour. Des études ont montré que cette conformation était stable dans l’eau [Sreerama et al.1999], probablement via des liaisons hydrogène intrachaînes formées grâce à des ponts de molécules d’eau.
Figure 1.12 : Hélice gauche de type polyproline II (PPII)
Plus récemment, grâce à des mesures de dichroïsme circulaire, ces mêmes auteurs ont suggéré un équilibre multiconformationnel commun à toutes les protéines élastomériques étudiées (élastine, lamprine et résiline) [Bochicchio et al. 2008].
Le brin β est la conformation de base des feuillets β (parallèle ou antiparallèle) (Figure 1.13). Deux ou plusieurs brins peuvent s’associer en feuillet β grâce aux nombreuses liaisons hydrogène qu’ils peuvent établir. Toutefois, ces liaisons hydrogène s’établissent entre chaînes polypeptidiques voisines plutôt qu’à l’intérieur de la chaîne comme dans les hélices α.
D’un point de vue conformationnel, l’ensemble de ces protéines élastomériques possèdent un équilibre dynamique entre conformations repliées et étendues.
1.3.3.4 Fibre élastique
Différentes organisations des fibres élastiques ont pu être observées selon les tissus : en réseaux de fibres dans les ligaments, les poumons et la peau, en feuillets concentriques minces dans les vaisseaux sanguins, et en larges structures tridimensionnelles alvéolées dans les cartilages élastiques.
Les fibres élastiques sont des structures complexes composées de deux composants majeurs :
- Une composante amorphe constituée d’élastine hautement réticulée constituant plus de 90% de la fibre.
- Une composante fibrillaire constituée de microfibrilles riches en glycoprotéines acides et organisées en fibrilles de 8 à 16 nm [Cleary 1987].
Les microfibrilles sont constituées de différentes protéines incluant les fibrillines (glycoprotéines) et les glycoprotéines associées aux microfibrilles telles que la MAGP 1 et 2. Il a été confirmé expérimentalement par certains auteurs que la tropoélastine peut se lier à la protéine microfibrillaire MAGP-1 [Bashir et al. 1994 ; Brown-Augsburger et al. 1994]. L’attache a été localisée sur la partie C-terminale de la tropoélastine et sur la partie N-terminale de la MAGP-1 [Brown-Augsburger et al. 1994 ; 1996] avec un peptide de 10 acides aminés supposé être le site d’attache [Finnis et al. 1997].
D’autres composants sont présents dans la fibre élastique, tels que la lysyl oxidase, enzyme initiant la réticulation de l’élastine [Kagan et al. 1986], les protéoglycanes [Baccarani-Conti et al. 1990], l’émiline à l’interface élastine-microfibrilles [Bressan et al. 1993], la fibuline-1 [Roark et al. 1995].
Avant que l’élastine ne soit déposée, les microfibrilles sont sécrétées dans l’espace extracellulaire proche de la surface de la cellule, réalisant ainsi la première étape dans l’élastogénèse [Cleary 1987]. Les molécules de tropoélastine sont réticulées les unes aux autres grâce au cuivre et à la vitamine B6, ce qui entraîne la formation de liaisons croisées spécifiques comme la desmosine et isodesmosine. La réticulation aboutit à une élastine mature insoluble et extrêmement stable.
Le contenu relatif d’élastine augmente au fur et à mesure des dépôts en petits blocs qui graduellement fusionnent pour former les fibres amorphes. Les composantes microfibrillaires agissent comme un renfort sur lequel l’élastine est déposée. Les microfibrilles se trouvent
finalement réparties de façon homogène dans la fibre élastique. Elles restent liées à l'élastine en début d'assemblage mais disparaissent graduellement lorsque la fibre atteint la maturité [Kozel et al. 2004].
Figure 1.14 : Fibre élastique d’artère pulmonaire de bœuf [Wight 1996] (microscopie électronique agrandissement x 80) (à gauche) et fibre élastique de ligament de nuque de
bœuf [Gandaglia 2001] (microscopie électronique agrandissement x 300) (à droite)
1.3.4 Collagène
Le collagène est la substance protéique la plus abondante chez les vertébrés (soit 30 à 35 % en masse des protéines de l’organisme chez les mammifères). Le terme collagène est utilisé comme terme générique pour les protéines formant une triple hélice composée de trois chaînes associées de polypeptides [Van der Rest et al. 1990 ; Ricard-Blum et al. 2005]. La super famille des collagènes présente une remarquable diversité tant au niveau de l’organisation moléculaire que supramoléculaire. Plus d’une vingtaine de types de collagène est dénombrée à ce jour, qui sont classés en plusieurs sous familles déterminées en fonction de leur homologie de séquence, de leur similitude au niveau de l’architecture de chaîne et de leur assemblage supramoléculaire. Dans la grande famille des collagènes, on distingue les collagènes fibrillaires, les collagènes associés aux fibrilles, les collagènes non fibrillaires et les collagènes transmembranaires. Dans le cadre de notre étude, nous nous limiterons à la description des collagènes fibrillaires et plus particulièrement aux collagènes de type I et III, composants majeurs des tissus étudiés.
De par sa capacité à former des fibres, le collagène est une protéine résistant aux forces mécaniques; il apporte solidité aux tissus. Contrairement à l’élastine, il est peu extensible, hautement structuré et ses structures primaire, secondaire, tertiaire et quaternaire sont mieux connues.
1.3.4.1 Structure primaire
Les trois chaînes qui constituent les collagènes possèdent 1050 à 1060 acides aminés, avec environ un tiers de résidus glycine et un quart de résidus proline et d’hydroxyproline. Dans tous les collagènes fibrillaires, les chaînes polypeptidiques sont composées dans leur région centrale d’une succession de triplets G-X-Y (avec le plus souvent en position X la proline et en position Y l’hydroxyproline) flanquées par des domaines terminaux beaucoup plus courts de composition différente.
Des études ont indiqué que la glycine est présente exactement tous les trois résidus excepté dans les régions terminales (télopeptides) comportant une vingtaine d’acides aminés [Bateman et al. 1996].
A l’heure actuelle, les structures primaires du collagène sont connues. Toutefois, il convient de noter que dans de nombreux cas, la séquence de nucléotides est bien mieux connue que la séquence d’acides aminés [Ottani et al. 2002]. La correspondance nucléotide/acide aminé est loin d’être garantie, à cause des considérables modifications post-traductionnelles que subissent les collagènes, en particulier l’hydroxylation des résidus lysine et proline en hydroxylysine et hydroxyproline, très importante pour les propriétés structure/fonction du collagène. Ces acides aminés hydroxylés sont formés après la synthèse des polypeptides du collagène.
Il existe divers modèles et motifs de la structure primaire du collagène [Arquès et al. 1996]. Beaucoup d’entre eux consistent en une distribution périodique de certaines séquences ou caractéristiques. On peut citer en particulier la distribution de quelques acides aminés (lysine, glutamine et arginine), qui montreune périodicité de18 résidus, reflétant la longueur des exons.
Un autre modèle, basé sur le rassemblement des résidus polaires et hydrophobes montre une distribution périodique tous les 234 résidus approximativement.
Par ailleurs, des études antérieures [Yannas 1972], ont assimilé le collagène à un « copolymère à blocs » caractérisé par des séquences « polaires » et « apolaires » alternées :
-(Gly-A-B)m-(Gly-Pro-C)n- polaire apolaire
avec A et B des acides aminés basiques, acides ou hydroxylés tels que l'arginine, la lysine, l'acide aspartique, l'acide glutamique et la sérine.
et C représentant le plus souvent l'hydroxyproline, et dans une moindre mesure l'alanine, la glycine, l'acide glutamique, l'acide aspartique, l'arginine, la phénylalanine, la thréonine et la sérine.
L’alternance des séquences « polaires » et « apolaires », confirmée par des études de spectroscopie Raman [Frushour et al. 1975] a permis de rendre compte de certaines caractéristiques dans les propriétés des types de collagène, comme :
- une différence dans les niveaux d’hydratation et de gonflement, - une différence de résistance à l'extension,
- une différence dans le niveau d'ordre et la nature des conformations.
1.3.4.2 Structure secondaire
Chaque chaîne polypeptidique de la molécule de collagène forme une hélice de type polyproline II gauche étirée, stabilisée par une teneur en amino-acide élevée. La présence de glycine tous les trois résidus permet à la chaîne dans sa région centrale de se replier de façon hélicoïdale. En ce qui concerne la proline et l’hydroxyproline, leur chaîne latérale (cycle pyrollidine) apporte des restrictions de rotation particulières, donnant aux chaînes cette conformation en hélice δ gauche de type PPII (cf. Figure 1.12). Cette conformation est donc hautement dépendante des hydroxylations post-traductionnelles de la proline [Ottani et al. 2002].
Dans la littérature, l’hélice gauche du collagène est généralement appelée hélice α. Cette dénomination n’a absolument rien à voir avec la conformation hélice α droite observée dans l’élastine. Contrairement à l’hélice α de l’élastine, il n’y a pas de liaisons hydrogène stabilisantes entre les résidus d’une même hélice de collagène. L’hélice α gauche du collagène possède un pas d’environ 0,29 nm par résidu et compte un peu moins de trois résidus par tour.
1.3.4.3 Structure tertiaire
La structure tertiaire (molécule de tropocollagène) est formée par l’enroulement de trois chaînes α en une superhélice droite avec un pas de 8,6 nm [Ramachandran et al. 1967 ; 1976 ; Nimni et al. 1988].
8,6 nm 0,87 nm
Figure 1.15 : Triple Hélice du collagène : assemblage des trois chaînes α
Selon le type de collagène, les triples hélices peuvent être des homo-trimères (chaînes α identiques) ou hétéro-trimères (chaînes α différentes). Les collagènes de type II et III sont des homo-trimères de forme α1(II)3 et α1(III)3 alors que le type I est habituellement un
hétéro-trimère de la forme α1(I)2 + α2(I).
Chaque troisième résidu de chaque chaîne polypeptidique se trouve au centre de la triple hélice, qui est si encombrée que seul l’hydrogène du résidu glycine y contient. Il faut également un décalage des trois chaînes polypeptidiques pour que les résidus glycine, X et Y soient au même niveau. Ainsi, les groupes peptidiques décalés sont orientés afin que le N-H de chaque glycine établisse une liaison hydrogène avec l’oxygène du carbonyle d’un résidu X de la chaîne voisine.
La structure en triple hélice est donc stabilisée par des liaisons hydrogène entre les hélices. Elle est très dépendante de l’hydroxyproline. En l’absence de cette dernière, la triple hélice est très instable à température ambiante et ne se forme pratiquement pas à la température corporelle.
La formation de la triple hélice mène à la formation d’une longue structure en tige, rigide mais flexible, d’environ 1,5 nm de largeur et de plus de 300 nm de longueur, complétée aux
deux extrémités par des domaines globulaires. C’est sous cette forme nommée procollagène que la molécule est excrétée dans l’espace extracellulaire. Après clivage protéolytique, la forme mature de la triple hélice, longue de 300 nm et appelée tropocollagène est obtenue.
Bien que la triple hélice soit le point commun à tous les collagènes et représente la partie majeure des collagènes formant des fibrilles, les domaines non-collagéniques flanquant la partie centrale hélicoïdale sont également des composants structuraux importants (Figure 1.16).
Figure 1.16 : Superhélice collagénique avec ses divers sous-domaines ainsi que les sites de clivage des N- et C-procollagénases [Gelse et al. 2003]
Les chaînes α des collagènes fibrillaires possèdent des extensions globulaires N- et C- terminaux appelées propeptides (Figure 1.16). Le C-propeptide est supposé jouer un rôle fondamental dans le déclenchement de la formation de la triple hélice, alors que le N-propeptide est supposé être impliqué dans la régulation des diamètres des fibrilles principales [Gelse et al. 2003].
Certaines régions des C-propeptides peuvent encoder une information qui dirige l’assemblage sélectif des chaînes de procollagène (chaîne α comprenant les domaines globulaire N- et C-terminaux) lorsque différents types de collagène sont co-exprimés dans la même cellule.
La formation de la triple hélice est précédée par l’alignement des domaines C-terminaux des trois chaînes α et engage la formation de la triple hélice progressant jusqu’aux domaines N-terminaux. L’efficacité de la formation et du repliement des chaînes de procollagène dépend de la présence d’autres enzymes comme la peptidyl-prolyl cis-trans-isomérase (PPI) [Lang et al. 1987] et les collagènes spécifiques chaperons comme le HSP47 [Clarke et al. 1991].
Après la sécrétion dans l’espace extracellulaire, les domaines N- et C-propeptides sont protéolytiquement supprimés pour produire les monomères du collagène (tropocollagène) composés de la triple hélice, et des séquences de télopeptides courts aux C- et N- terminaux non hélicoïdaux.
Les résidus lysine des C- et N-télopeptides sont des sites importants de réticulation dans les collagènes I, II et III, suggérant que la principale fonction des télopeptides est la stabilisation des fibrilles de collagène extracellulaire.
1.3.4.4 Structure quaternaire
Le tropocollagène est une molécule hautement réactive qui subit facilement une fibrillogénèse spontanée conduite par un processus entropique pour créer des structures supramoléculaires. Il faut noter que ces structures sont stabilisées initialement par des interactions polaires, hydrophobes et d’autres interactions non-covalentes. Les réticulations covalentes interviennent seulement dans une étape ultérieure [Ottani et al. 2002].
Les télopeptides ont un rôle spécifique dans la formation des zones de réticulations [Kuznetsova et al. 1999]. L’étape d’hydroxylation des résidus lysine du télopeptide est cruciale à la stabilisation des structures supermoléculaires des microfibrilles de collagène. L’hydroxylation de la lysine à l’intérieur des télopeptides est catalysée par un système d’enzymes différent de la lysyl hydroxylase des résidus hélicoïdaux. La plupart des réticulations sont localisées au niveau du chevauchement connectant les télopeptides N et C. Ces réticulations intermoléculaires sont nécessaires pour les propriétés mécaniques des fibrilles de collagène et la formation d’un réseau stable, minimisant les interactions électrostatiques et hydrophobes entre les différentes molécules.
Les molécules de tropocollagène s’assemblent côte à côte, avec un décalage de 67 nm. Des lysines de la partie N-terminale d’une molécule sont alors pontées de manière covalente à d’autres lysines de la partie C-terminale d’une voisine, via la lysyl oxydase. Ceci permet aux molécules de tropocollagène de s’assembler en fibrilles de 50 nm de diamètre, qui par la suite s’agrègeront en fibrilles d’ordre supérieur de 500 nm de diamètre, pouvant former à leur tour une fibre de collagène de 1 à 10 µm de diamètre.
1.4 Rôle des solvants dans les protéines
L’eau constitue le milieu naturel dans lequel les protéines manifestent normalement leur activité. L’hydratation des macromolécules joue un rôle essentiel dans le maintien de la stabilité de toutes les structures biologiques. La structure même des macromolécules et les interactions entre les molécules d’eau des couches d’hydratation concourent mutuellement à cette stabilité.
1.4.1 Propriétés des solvants
1.4.1.1 Liaison hydrogène de l’eau
Les propriétés physiques et les propriétés de solvatation de l’eau proviennent de sa cohésion interne. La liaison hydrogène est linéaire, c’est à dire que l’atome d’oxygène de la molécule est aligné avec le groupe OH de la molécule voisine. En effet, les interactions électrostatiques entre les dipôles de deux molécules d’eau tendent à les orienter de sorte que la liaison O-H d’une molécule d’eau soit dirigée vers le nuage d’électrons d’un doublet non partagé de l’oxygène de l’autre molécule d’eau. La présence spécifique de l’atome d’hydrogène s’explique par sa petite taille. Seul le noyau de l’hydrogène peut s’approcher suffisamment du nuage d’électrons du doublet non partagé de l’atome accepteur pour établir une interaction électrostatique conséquente.
L’énergie de rupture d’une liaison hydrogène (20 KJ/mol dans le cas de l’eau) est faible lorsqu’on la compare à celle d’une liaison covalente (par exemple 460 KJ/mol pour une liaison OH covalente). Toutefois, malgré cette faible valeur, les liaisons hydrogène sont d’une importance capitale dans les associations intermoléculaires des molécules biologiques et dans l’élaboration de leurs structures tridimensionnelles, de par leur nombre.
Diverses études sur les propriétés de l’eau soulignent l’importance de la liaison hydrogène. En effet, ces études suggèrent que les propriétés de l’eau dépendent plus des interactions angulaires fixes de l'eau issue de la géométrie de la liaison hydrogène, que des détails atomiques ou de la coordination des molécules d'eau intrinsèquement [Dill et al. 2005]. Une autre caractéristique intéressante de l’eau est sa dynamique. L’eau à l’état liquide présente une structure très labile [Chumaevskii et al. 2006]. Les liaisons hydrogène dans l’eau liquide se font et se défont à grande vitesse, chaque molécule d’eau se réorientant environ une fois toutes les 10-12s.
Les interactions protéine-eau sont fréquemment décrites en terme d’effet de la macromolécule sur les mouvements diffusionnels des molécules d’eau. Les différents types d’eau généralement observés dans les protéines, à savoir l’eau liée, l’eau proche de la protéine et l’eau libre présentent des propriétés physiques différentes. Des études ont permis de distinguer des temps caractéristiques pour chaque type d’eau [Francks 1988]. Les molécules d’eau liées ont une rotation moléculaire proche de celle de la macromolécule avec des temps de diffusion rotationnelle τ > 10-7s. Pour les temps intermédiaires τ de l’ordre de 10-9s, les molécules d’eau sont alors considérées comme lentes et semblables à l’eau que l’on trouve dans les pores ou à proximité de la surface des protéines. Enfin, les temps inférieurs à 10-11s (τ<10-11s) sont associés à l’eau qui n’est presque pas affectée par la protéine, autrement dit à l’eau libre.
1.4.1.2 Phénomènes de solvatation et interactions hydrophobes
L’assemblage des molécules de charges opposées peut être décrit en première approximation par une loi de l’électrostatique classique.
2 0 2 1
4
r
q
q
F
rε
πε
=
Avec F le module de la force qui naît entre les deux charges (q1 et q2), séparées par la
distance r,
ε
r étant la constante diélectrique relative du milieu etε
0 la permittivité du vide.Lorsque la constante diélectrique du milieu augmente, la force entre les charges diminue ; en d’autres termes, la constante diélectrique d’un solvant est une mesure de sa capacité à séparer des charges de signe opposé.
Les forces hydrophobes ou interactions hydrophobes résultent de la tendance de l’eau à exclure les groupes hydrophobes. Les interactions hydrophobes sont relativement faibles comparées aux liaisons hydrogène et ne sont pas orientées. Elles sont particulières à un environnement aqueux. L’effet hydrophobe est la conséquence des propriétés spécifiques de l’eau, et plus particulièrement de sa constante diélectrique élevée (
ε
r = 78,5 à 20°C).La plupart des molécules biologiques sont simultanément hydrophiles et hydrophobes (molécules amphiphiles). Les molécules amphiphiles auront tendance à former des agrégats structurés dispersés dans l’eau. Selon la forme de la molécule, elle peut s’organiser sous forme de micelles (molécules possédant une tête polaire et une queue apolaire) ou former des feuillets en bicouche (molécules possédant une tête polaire et deux queues apolaires). Dans ce type d’organisation les groupes polaires sont en contact avec la phase aqueuse et les groupes apolaires se regroupent au centre afin de s’en exclure (Figure 1.17).
![Figure 1.3 : Structure de l’ADNc du gène de l’élastine bovin et humain [Cleary et al. 1996]](https://thumb-eu.123doks.com/thumbv2/123doknet/2260389.19686/31.892.107.760.268.651/figure-structure-adnc-gene-elastine-bovin-humain-cleary.webp)