T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier Discipline ou spécialité : Micro et nano systèmes
JURY
Pr. Jean-Baptiste Béguéret Dr. Dominique Fourmy
Pr. Alain Cazarré Pr. Alain Thiéry
Ecole doctorale : GEET Unité de recherche : LAAS-CNRS
Directeur(s) de Thèse : Dr.David DUBUC, Dr.Katia GRENIER Rapporteurs : Pr. Jean-Baptiste Béguéret, Dr. Dominique Fourmy
Présentée et soutenue par Tong CHEN Le 18 Décembre 2012
Titre : Développement de biocapteurs hyperfréquences microfluidiques pour la
spectroscopie diélectrique non-invasive de la cellule unique. Applications en cancérologie
Remerciements
Trois ans et trois mois sont passés pour réaliser ces travaux de thèse, répartis au sein du Laboratoire d’Analyses et d’Architecture des Systèmes (LAAS) du Centre National de la Recherche Scientifique (CNRS) de Toulouse et Institut National de la Santé et de la Recherche Médicale(INSERM) de Toulouse.
Je voudrais en premier lieu remercier chaleureusement David DUBUC et Katia GRENIER de m’avoir accueilli au sein de l’équipe Micro et nanosystèmes Hyper Fréquences Fluidiques et m’ont encadré mes travaux de recherche avec leur rigueur et leur expertise scientifique. Un grand merci à eux, toujours disponible malgré leurs multiples responsabilités, et qui voit toujours clair dans les explications parfois tortueuses du étudiant étranger. Remercie pour leurs conseils, leurs aides, leurs patiences, leurs soutiens et leurs confiances.
Je voudrais aussi remercier tous Maire POUPOT et Jean Jaque FOURNIE qui sont membres d’INSERM pour leurs gentillesses, leurs aides et leurs conseils précieux.
Je souhaite remercier monsieur Jaque GRAFFEUIL et Alain CAZARRE qui m’a accueilli au l’école doctorat et de tous leurs aides gentils et conseils précieuse.
Je remercie également Jean-Baptiste BEGUERET et Dominique FOURMY d’avoir accepté la tache de rapporteur, ainsi que Alain THIERY pour son présence dans le jury.
Je souhaite remercier François ATRIS, Thomas CHRETIENNOT, et Pierre qui sont camarades dans notre groupe pour leur aide.
Je tiens à remercier au groupe TEAM, en particulier à Laurent MAZENQ, Frank CARCENAC, Emmanuel DARAN, Djaffar BELAHRET, Pascal DUBREUIL, Adrien DESMOULIN pour m’avoir aidé sur la technologie en salle blanche. Et je remercier Marie-Charline BLATCHE pour m’aider les techniques biologiques.
Merci à ma chère femme Junlin CHEN, qui m’avait beaucoup aidé dans la vie et son soutien et amour. Et merci à papa et maman, pour tous leurs soutient et l’amour qui me donne.
TABLE DES MATIERES
INTRODUCTION GENERALE ... 1
CHAPITRE I ... 5
METHODES D’ANALYSE CELLULAIRES EN BIOLOGIE ... 5
1.INTRODUCTION ... 7
2.LES METHODES OPTIQUES USUELLES D’ANALYSE CELLULAIRE :« METHODES SUR TABLE »... 9
2.1 La microscopie ... 10
2.2 La cytométrie en flux ... 17
2.3 Conclusions ... 21
3.METHODES D’ANALYSE SUR PUCE ... 22
3.1 Biocapteurs ... 23
3.2 Détection mécanique ... 24
3.3 Détection optique ... 25
3.4 Détection électronique ... 26
3.5 Micro-cytométrie et détection électrique ... 28
3.6 Discussions... 30
4.LES POTENTIALITES DE LA DETECTION ELECTRIQUE HAUTE FREQUENCE POUR LA BIOLOGIE (CELLULAIRE) .. 31
5.BUT DE NOTRE TRAVAIL ET CONCLUSIONS... 35
CHAPITRE II ... 43
SPECTROSCOPIE DIELECTRIQUE HF : LIQUIDES BIOLOGIQUES ET SUSPENSIONS DE CELLULES... 43
1.INTRODUCTION ... 45
2.INTERACTION ONDES HF ET MATIERES BIOLOGIQUES/LIQUIDES ... 46
2.1 Propriétés diélectriques de matériaux ... 47
2.2 Permittivité complexe et comportement fréquentiel ... 49
2.3 La relaxation diélectrique ... 51
3.CONCEPTION D’UN MICROSYSTEME DE SPECTROSCOPIE HF DE MATERIAUX BIOLOGIQUES ... 53
3.1 Principe de mesure des propriétés HF d’un matériau ... 54
3.2 Méthodes de mesures des propriétés HF d’un matériau ... 55
3.3 Choix de l’architecture du biocapteur ... 56
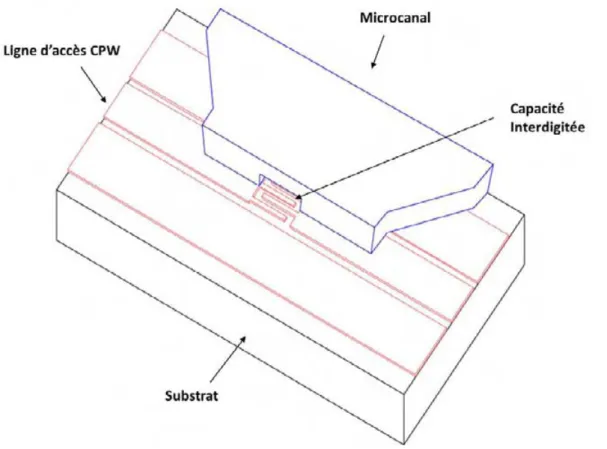
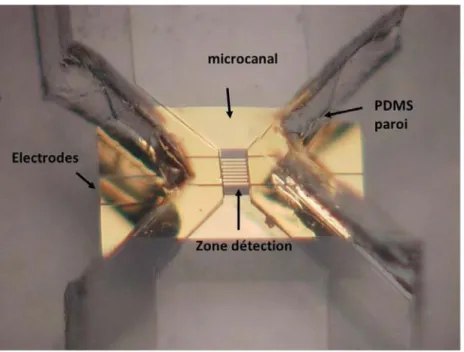
3.4 Conception du biocapteur ... 56
4.FABRICATION DU BIOCAPTEUR ... 61
4.2 Elaboration des micro-canaux en PDMS ... 63
4.3 L’assemblage de circuit HF et des micro-canaux ... 67
5.EXPERIMENTATIONS ... 71
5.1 Matériels et méthodes... 71
5.2 Procédure d’extraction de paramètres du liquide et validation ... 72
5.2 Mélange binaire éthanol/eau ... 77
5.3 Milieu biologique : sérum de veau fœtal en milieu aqueux ... 81
5.4 Cellules en suspension dans leur milieu de culture ... 82
5.5 Différentiation de cellules vivantes/mortes en suspension dans leur milieu de culture ... 86
6.CONCLUSIONS ET PERSPECTIVES ... 87
CHAPITRE III ... 91
SPECTROSCOPIE DIELECTRIQUE HF : JUSQU’A LA CELLULE UNIQUE ... 91
1.INTRODUCTION ... 93
2.DISPOSITIF DE PIEGEAGE DE CELLULE UNIQUE ... 94
2.1 Manipulation des cellules ... 94
2.2 Piégeage hydrodynamique d’une cellule unique ... 98
2.3 La fabrication des composants ... 104
3.CONCEPTION DE CIRCUITS HF COMPATIBLE L'ANALYSE D'UNE CELLULE UNIQUE ... 106
3.1 Simulations électromagnétiques ... 107
3.2 Fabrication finale des dispositifs. ... 111
4.EXPERIMENTATIONS ... 112
4.1 Validation avec des microbilles polystyrènes ... 112
4.2 Lien contrastes capacitif/conductif et contraste diélectrique ... 118
4.3 Spectroscopie hyperfréquence d’une cellule de type Lymphome B ... 121
5.CONCLUSIONS ... 127
CHAPITRE IV: ... 131
OPTIMISATION ET AMELIORATION DU SYSTEME DE SPECTROSCOPIE DIELECTRIQUE HF DE CELLULE UNIQUE ... 131
1.INTRODUCTION ... 132
2.OPTIMISATION DU BIOCAPTEUR DE CELLULE UNIQUE ... 133
3.OPTIMISATION DU PIEGEAGE (BLOQUEUR) DE CELLULE UNIQUE ... 138
4.OPTIMISATION DE LA TECHNOLOGIE BIOCAPTEUR HF DE CELLULE UNIQUE ... 141
4.1 Améliorations de la technologie d’intégration « circuit HF » / « circuit microfluidique » ... 141
4.2 Technologie d’élaboration des bloqueurs optimisées pour la capture efficace de cellule unique ... 143
4.3 Optimisation des volumes de liquide consommé ... 144
5.CARACTERISATION AVEC DES CELLULES ... 157
5.1 Comparaison avec la technologie du chapitre III ... 157
5.2 Impact de la diminution du gap de capacité de détection ... 158
5.3 Mesures de cellules vivante et morte ... 159
6.CONCLUSIONS ... 163
Int ro duc tio n gé né ra le
Introduction générale
Les sciences évoluent exponentiellement. Plus les connaissances augmentent sur un thème et plus les découvertes qui s’en suivent sont nombreuses et riches.
Nous assistons notamment à l’explosion des applications de l’électronique portable, nos téléphones portables n’ont jamais autant évolués : autonomie, ergonomie, fonctionnalités sont sans cesse repoussées. Les technologies et l’ingénierie œuvrent de concert pour suivre ce que l’on nomme le more-moore1
: c’est à dire la miniaturisation des circuits intégrés électroniques mais aussi, de façon complémentaire (perpendiculaire) le more-than-moore qui consiste en la co-intégration des fonctionnalités côte à côte : les circuits radiofréquences, analogiques et numériques, les composants actifs et passifs, les fonctions basses-consommations et hautes-tensions, les capteurs et actionneurs.
Plus récemment, l’International Technologie Roadmap for Semiconductor (ITRS) a projetée dans sa « roadmap » l’intégration de fonctionnalités microfluidiques sur les circuits électroniques pour des applications biomédicales.
Les domaines de la biologie et de la médecine aspirent en effet à disposer de nouveaux outils d’analyse et de diagnostic du vivant et les domaines qui se font les plus pressants sont ceux des biologies cellulaire et moléculaire. Ces domaines requièrent en effet des résolutions nanométrique à micrométrique, ce qui n’est pas sans poser des problèmes de sensibilité. Il est de plus nécessaire que les études faites sur des objets uniques soient menées en batterie et l’on pressent ainsi tout ce que peut apporter la microélectronique.
Ainsi les micro et nanotechnologies permettent de miniaturiser les systèmes d’analyse tout en assurant des analyses jusqu’ici non accessibles par des techniques traditionnelles. Notre premier chapitre illustre cette tendance de passer de systèmes d’analyse sur table aux systèmes sur puce. Nous présentons de plus, au-delà de l’aspect miniaturisation, les avantages apportées par certaines techniques telles que celle que nous proposons : l’analyse par ondes hyperfréquences. Outre leurs avantages, et sans masquer leurs inconvénients, ces nouvelles
1
Gordon Moore a prédit en 1965 que la densité des circuits intégrés doublerait tous les 18 mois, loi encore vérifiée aujourd’hui
Int ro duc tio n gé né ra le
techniques permettent, en complémentarité avec les autres techniques existantes ou en développement, d’apporter une nouvelle vision du vivant.
L’exploitation des ondes hyperfréquences est en effet judicieuse à bien des égards pour l’analyse de milieux biologiques. Utiliser depuis longtemps pour chauffer des milieux aqueux (chauffage micro-ondes et hyperthermie) ou mesurer le taux d’humidité de produits alimentaire ou de sols, les ondes électromagnétiques ont une interaction particulière et forte avec les molécules dans la gamme des hyperfréquences. Ainsi nous décrivons au chapitre 2 nos développements sur l’analyse par ondes hyperfréquences de milieux aqueux intégrés grâce aux microtechnologies. Les réponses en fréquence obtenues, qui sont significativement différentes pour des suspensions de cellules vivantes et mortes, pointent les potentialités des techniques hyperfréquences pour la biologie.
Ce résultat est une réelle preuve de concept du bien-fondé de l’emploi conjugué des hyperfréquences et des microtechnologies pour de l’analyse biologique. Toujours dans un souci d’apporter de nouveaux moyens aux biologistes, nous avons ambitionné de prouver que notre technique pouvait analyser une cellule unique. Analyser les mécanismes biologiques à l’échelle de la cellule est en effet devenu une part importante de la cancérologie. Les chapitres 3 et 4 résument nos travaux qui aboutissent, pour la première fois à notre connaissance, à la spectroscopie hyperfréquence d’une cellule unique ; montrant de plus des contrastes significatifs entre cellules vivante et morte.
Nous avons, pour toutes nos études impliquant des milieux biologiques, collaboré avec Mary Poupot et Jean-Jacques Fournié du Centre de Recherche en Cancérologie de Toulouse. Ces biologistes consacrent leurs travaux de recherche à l’identification des mécanismes immunologiques responsables de la destruction thérapeutique de lymphomes (cellules cancéreuses) et des modes précis d'action d'anticorps thérapeutiques. Ils étudient de plus comment le microenvironnement de lymphomes promeut des échecs thérapeutiques et des rechutes.
Nous espérons que dans un futur proche, nos travaux sur la spectroscopie non-invasive de cellule unique dans son microenvironnement, leur fourniront une technique complémentaire aux techniques traditionnelles (ou même en rupture) d’investiguer les cellules et leurs mécanismes [1].
Int ro duc tio n gé né ra le
Ces développements devront de plus rapidement s’opérer en co-intégration avec des circuits intégrés de traitement des signaux hyperfréquences (sur technologie CMOS ou BiCMOS et avec lesquelles de nombreuses fonctions HF ont dores et déjà été développées et continuent de l’être pour des applications télécom [2]) pour aboutir à des systèmes sur puce miniatures, portables, autonomes, ... et pouvant analyser de façon parallélisée un grand nombre de cellule individuelle pour du screening de médicament par exemple [3].
Bibliographie
[1] L. Martinet, R. Poupot, P. Mirshahi, A. Rafii, J. J. Fournié, M. Mirshahi and M. Poupot; Hospicells derived from ovarian cancer stroma inhibit T-cell immune responses; Int J Cancer ; 126 : 2143-2152; 2010.
[2] T. Taris, R. Severino, Y. Deval, J.B. Begueret ; mm-Waves design trends in BiCMOS technology; Circuits and Systems and TAISA Conference; 2008.
[3] S. H. Kim, T. Yamamoto,D. Fourmy,and T. Fujii; An electroactive microwell array for trapping and lysing single-bacterial cells ; Biomicrofluidics; 5(2): 024114; 2011.
Int ro duc tio n gé né ra le
Cha pit re I
Chapitre I
Méthodes d’analyse
cellulaires en biologie
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
1. Introduction
La discipline d’étude des cellules : ‘la biologie cellulaire’ est née après l’observation et la description des microorganismes par Antoni van Leeuwenhoek en 1677, qui réussit à en obtenir de forts grossissements (300 ×) grâce à un microscope simple composé d'une seule petite lentille quasi sphérique [1]. Une photographie du microscope utilisé par Antoni van Leeuwenhoek pour observer les bactéries et microorganismes est présentée à la figure I.1.
Figure I.1. Le microscope utilisé par Antoni van Leeuwenhoek permettant la première observation de bactéries et microorganismes [1].
Il a fallu attendre les années 1830 pour que l'importance de l’analyse des cellules s’établisse. En 1838, Matthias Schleiden, un Allemand avocat, devenu botaniste, a conclu que, malgré les différences de structure des tissus, les plantes sont constituées de cellules et l'embryon végétal est issu d'une seule cellule. En 1839, Theodor Schwann, un zoologiste allemand et collègue de Schleiden, a publié un rapport détaillé sur la base cellulaire de la vie animale [2].
Aujourd’hui, la biologie cellulaire (anciennement cytologie) est devenue une discipline à l’état de l’art : elle présente une des plus fortes croissantes dans les sciences biologiques contemporaines. Cette discipline étudie les cellules, leurs propriétés physiologiques, leur structure, les organites qu'elles contiennent, les interactions avec leur environnement, leur cycle de vie, la division et la mort, qui s’établissent à la fois à un niveau microscopique et moléculaire. Des recherches en biologie cellulaire englobent à la fois la grande diversité des organismes unicellulaires, comme les bactéries et les protozoaires, ainsi que les nombreuses
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
cellules spécialisées dans les organismes pluricellulaires comme les humains [3]. Connaître les constituants des cellules et le fonctionnement des cellules est fondamental pour toutes les sciences biologiques. Apprécier les similitudes et les différences entre les types de cellules est particulièrement important dans les domaines de la biologie cellulaire et moléculaire, et des domaines biomédicaux tels que les recherches sur la cancérologie.
En raison de la très petite taille des objets biologiques cellulaires et moléculaires, la biologie cellulaire est de plus en plus dépendante des développements de nouveaux instruments ainsi que des technologies associées. En conséquence, il est impératif pour tout biologiste cellulaire et moléculaire de connaître et maîtriser les technologies nécessaires à la collecte de données biologiques [4]. Après plus de 150 ans de développements, les techniques (traditionnelles) et l’instrumentation associée (et commercialisée) pour l’étude des cellules sont matures et très bien établies dans les laboratoires de biologie.
Mais les derniers développements de la biologie cellulaire, notamment dans le contexte de la compréhension des mécanismes du cancer, ont amené, depuis les dix dernières années, le développement de nouvelles technologies pour étudier finement et extensivement les cellules : via une approche nommée ‘lab-on-a-chip’. Les méthodes à l’échelle « micrométrique » sont des technologies nouvellement développées qui tirent profit des micro (et nano) technologies (souvent nommées MEMS pour Micro Electro Mechanical System) servant à miniaturiser des instruments traditionnels ou à développer de nouvelles méthodes d’analyse. Ces nouvelles techniques, connues sous le nom de ‘bio-MEMS’, deviennent une tendance importante dans le domaine de recherche cellulaire ; et l’exemple le plus frappant consiste à établir la carte génétique de cellules à l’aide d’un réseau de milliers de chambres élémentaires de réaction intégré sur une puce (d’où la notion de lab-on-a-chip), comme illustré à la figure I.2.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.2: Puce à identification de gènes (Affymetrix)
Dans ce chapitre, nous allons introduire et discuter les méthodes et les instruments les plus couramment utilisés dans le domaine de la biologie cellulaire ; puis nous présenterons de nouvelles technologies d’analyse cellulaire miniaturisées.
2. Les méthodes optiques usuelles d’analyse cellulaire :
« méthodes sur table »
Les méthodes d’analyse cellulaire usuelles utilisant des instrumentations commercialisées peuvent être divisées en deux catégories principales: (1) l’analyse de cellules fixées et (2) les techniques de cytométrie en flux.
Pour l’analyse de cellules fixées, la technique reine reste la microscopie avec toutes ses variantes. Les échantillons de cellules sont fixés sur une lame ou boîte de Pétri et observés par un microscope en acquérant des images ou en analysant quantitativement des paramètres morphologiques de la cellule ou encore en étudiant leur contenu intracellulaire par marquage via des composants biochimiques. Cela comprend le microscope optique, la microscopie par fluorescence, la microscopie à contraste de phase, le microscope électronique à transmission, le microscope électronique à balayage, etc.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
La cytométrie en flux (CMF) est une technique permettant de faire défiler des particules, molécules ou cellules à grande vitesse dans le faisceau d'un laser, en les comptant et en les caractérisant [5]. C'est la lumière réémise (par diffusion ou par fluorescence) qui permet de classer la population suivant plusieurs critères et de les trier. La cytométrie en flux est définie comme l’étude précise de particules isolées ou de cellules, bactéries, etc. (vivantes ou mortes) entraînées par un flux liquide ou gazeux. C’est une technique de caractérisation individuelle, quantitative et qualitative de particules en suspension dans un liquide [6-8].
2.1 La microscopie
Il y a trois branches connues de la microscopie : optique; électronique et la microscopie à sonde de balayage. [9]. La microscopie optique et électronique implique la diffraction, la réflexion, la réfraction des rayonnements électromagnétiques ou de faisceaux d'électrons en interaction avec l'échantillon, et collecte ces rayonnements afin de créer une image. La microscopie à sonde locale forme des images de surface à l'aide d'une sonde physique qui balaye l'échantillon [10], un type connu est le microscope à force atomique (AFM).
2.1.1Microscopie optique
Le microscope optique est muni d'un objectif et d'un oculaire qui permet de grossir l'image d'un objet de petites dimensions et de séparer les détails de cette image (et son pouvoir de résolution) afin qu'il soit observable par l'œil humain [11]. Les microscopes optiques peuvent être très simples. La figure I.3 montre l’image et le schéma constitutif d’un microscope optique simple, mais il existe beaucoup de conceptions complexes qui visent à améliorer la résolution et le contraste de l'échantillon. De plus, l'image d'un microscope optique peut être capturée par les caméras qui sont sensibles à la lumière pour produire une micrographie. Initialement les images ont été capturées par film photographique, mais les développements modernes dans le CMOS et Charge-Coupled Device (CCD) ont grandement amélioré la qualité des appareils photo numériques permettant la capture d'images numériques avec une résolution suffisante [12]. Des microscopes purement numériques sont maintenant disponibles et utilisent une caméra CCD qui permet d'examiner un échantillon, montrant l'image obtenue directement sur un écran d'ordinateur sans avoir besoin d'oculaires.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.3. Le microscope optique et son schéma constitutif.
Parfois, les petits objets translucides, comme une cellule vivante, sont très difficile à observer avec un microscope optique normal (Figure I.4 (A)). Le microscope à contraste de phase permet de rendre les objets très transparents visibles. Le principe de ce microscope est d’exploiter les changements de phase d'une onde lumineuse traversant un échantillon [13-14]. On peut distinguer les différentes parties d'un objet parce qu'elles affectent (réfractent) la lumière différemment les unes des autres (Figure I.4 (B)). Le contraste ainsi obtenu relate des différences d'indice de réfraction. Les organites cellulaires sont en effet constitués de différentes proportions de molécules: ADN, ARN, protéines, lipides, glucides, des sels et de l'eau qui sont susceptibles d'avoir des indices de réfraction différents. Normalement, ces différences ne peuvent pas être détectées par nos yeux. Toutefois, le microscope à contraste de phase convertit ces différences d'indice de réfraction en intensité (luminosité relative à l'obscurité) visible à l'œil [15].
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.4. Une comparaison des cellules observée avec différents types de microscopes optiques. (A) Microscope optique normal (champ clair). (B) Le microscope à contraste de phase. (Micrographes par M. I. Walker/Photo Researchers, INC)
Une autre variation de la microscopie optique est la microscopie en fluorescence, tirant profit du phénomène de fluorescence et de phosphorescence, au lieu de, ou en plus de l'observation classique par réflexion (physique) ou absorption de la lumière visible naturelle ou artificielle [16-17]. La microscopie en fluorescence est un excellent outil pour l'étude des matériaux qui peuvent être amené à fluorescer, soit sous sa forme naturelle ou lorsqu'ils sont traités avec des produits chimiques susceptibles d'entrer en fluorescence [18], soit par des techniques d'étiquetage par des tags fluorescents [16]. Dans l'une de ses applications les plus courantes, un fluorochrome est lié de manière covalente (conjugué) à un anticorps pour produire un anticorps fluorescent qui peut être utilisé pour déterminer l'emplacement d'une protéine spécifique à l'intérieur de la cellule. Les protéines ainsi marquées par fluorescence
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
peuvent ainsi être utilisées pour étudier un processus dynamique comme il peut se produire dans une cellule vivante. Par exemple, un fluorochrome spécifique peut être lié à une protéine cellulaire, telle que l'actine ou la tubuline, et la protéine marquée par fluorescence est injectée dans une cellule vivante : on peut ainsi observer et suivre leurs emplacements par microscopie, révélant les activités dynamiques dans lesquelles la protéine participe [19]. Deux images de cellules sous microscope à fluorescence sont illustrées à la figure I.5. La microscopie en fluorescence est un des plus importants moyens d’analyse utilisé dans le domaine de biologie cellulaire, souvent employé par des instruments sur table mais aussi utilisé dans les systèmes miniaturisés.
Figure I.5. Image des cellules sous microscope à fluorescence, à gauche : les cellules endothéliales ; à droite : une cellule épithéliale de rein de rat kangourou masculin (Photo par Nikon.Inc). Les différentes parties des cellules sont marquées par différentes couleurs de fluorochrome.
Un des gros avantages des microscopes optiques est la possibilité d'observer les cellules vivantes. Il est possible d'observer un large éventail de l'activité biologique. De plus, le faible coût des microscopes optiques les rend utiles dans une large gamme de domaines différents. Cependant, leurs résolutions sont réduites par une limite physique imposée par la longueur d'onde de la lumière. Et en biologie, il est nécessaire, au préalable, de pré-conditionner l’échantillon : soit il faut placer la coupe de tissu (ou le liquide contenant des organismes vivants) entre deux lames par exemple, soit il faut au préalable marquer par un ou plusieurs fluorochromes les objets que l’on souhaite observer, soit les deux à la fois. Du fait de la
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
préparation, la microscopie optique nécessite une importante quantité d'appareils complémentaires pour la seule destination de l'observation microscopique [20].
2.1.2 Microscope électronique
Un microscope électronique est un type de microscope qui utilise un faisceau de particules d'électrons pour illuminer un échantillon et en créer une image très agrandie. Les microscopes électroniques ont un plus grand pouvoir de résolution que les microscopes optiques qui utilisent des rayonnements électromagnétiques et peuvent obtenir des grossissements beaucoup plus élevés allant jusqu'à 2 millions de fois, alors que les meilleurs microscopes optiques sont limités à un grossissement de 2000 fois [21]. On trouve deux types principaux de microscope électronique : microscope électronique en transmission (MET) utilisant des électrons qui sont transmis à travers un échantillon, tandis que les microscopes électroniques à balayage (MEB) utilisent des électrons qui rebondissent sur la surface de l'échantillon [22-23]. Le MET a été exploité plus largement à l'examen de la structure interne des cellules. En revanche, le MEB est utilisé principalement pour examiner les surfaces d'objets. Notons que les échantillons biologiques observés dans les deux types de microscope électronique nécessitent un traitement préalable afin d’aboutir à un échantillon approprié [20]. La figure I.6(A) (B) présente quelques images de cellules prises avec un MET et (C) (D) les images des cellules humaines avec un MEB.
Malheureusement, les microscopes électroniques présentent une série de désavantages : ils sont extrêmement coûteux et les échantillons doivent être complètement secs, il est donc impossible d'observer des spécimens vivants ; la préparation des échantillons est souvent complexe, etc…
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.6. Images prises par des microscopes électroniques (A) Cette image montre une cellule morte par MET. (B) du cytoplasme de cellules hépatiques par MET (Photos par Björn Afzelius). (C) La queue d’un spermatozoïde par MEB (D) Un caillot de sang sur les fibres d’un pansement de gaze par MEB. (Photos par FEI.Inc)
2.1.3 Microscope à force atomique
Le microscope à force atomique (AFM pour Atomic Force Microscope) est un type de microscope à sonde locale permettant de visualiser la topographie de la surface d'un échantillon. Inventé en 1985, par G.Binning, F.Quate et C. Gerber, ce type de microscope est essentiellement basé sur l'analyse d'un objet point par point au moyen d'un balayage via une sonde locale, assimilable à une pointe effilée. Ce mode d'observation permet alors, de réaliser la cartographie locale de grandeurs physiques caractéristiques de l'objet sondé (rigidité, capacité, résistivité, …) mais également de travailler dans des environnements particuliers tels que des milieux sous vide, liquides ou ambiants [24]. La microscopie à force atomique (AFM) est donc une technique qui constitue une plate-forme polyvalente pour l'imagerie (et même la manipulation) de cellules vivantes jusqu’à la molécule unique, ce qui permet de répondre à des questions pertinentes dans les domaines clés de la biologie cellulaire, y compris l'adhésion
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
cellulaire et la signalisation, la division cellulaire, la pathogenèse microbienne … [25]. La figure I.7 présente la photographie d’une poutre AFM à gauche, et à droite 4 images de l'organisation nanométrique de peptidoglycane dans des cellules vivantes de lactis (travail effectué par Guillaume Andre et al [26]).
Figure I.7. A gauche : photographie d’une poutre AFM. A droite : Image AFM de l'organisation nanométrique de peptidoglycane dans des cellules vivantes de lactis [26].
Par rapport au microscope électronique à balayage, la microscopie à force atomique présente de nombreux avantages. Elle offre une véritable vision de surface en trois dimensions. En même temps, l'AFM ne nécessite aucun traitement particulier des échantillons (certaines techniques MEB utilisent des traitements à base de cuivre ou de carbone, qui provoque des dommages irréversibles). De plus, alors que les analyse MEB doivent être exécutées dans des conditions de vide poussé, le microscope à force atomique peut opérer sous pression atmosphérique et même en environnement liquide, et ce sans compromis sur les résultats. L’AFM peut de plus être utilisée pour étudier des cellules, des bactéries ou molécules biologiques, ou même de tissus biologiques. La figure I.8 présente une image optique (A) et de la rigidité (module d’Young) (B) d’une bactérie vivante 27. Une telle analyse permet de suivre l’état de rigidité d’objets biologiques au cours de processus et de les relier avec des états biologiques. Dans 27, par exemple, il est démontré que des bactéries vivantes et mortes ne présentent pas le même état de rigidité, ce qui permet d’envisager l’utilisation de cet outil pour la détection voir le criblage de la viabilité cellulaire.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.8 : Image optique (A) et de la rigidité (B) d’une bactérie vivante 27.
Les inconvénients de l'AFM (conséquence de la forte résolution de cette technique) sont qu’il fournit une image de faible dimension (quelques centaines de µm2
typiquement), qu’il est assez lent pour effectuer cette acquisition et que beaucoup de phénomènes influencent la réponse de la sonde (cela nécessite une maîtrise parfaite de la technique).
2.1.4 Discussions
Les développements des microscopes sont incessants afin d’améliorer leurs performances, leur résolution, et d’ajouter de nouvelles fonctionnalités. Ils ont toujours un rôle très important en biologie pour l’étude de cellules, éventuellement de la cellule unique, en particulier pour l’étude des cellules cancéreuses.
2.2 La cytométrie en flux
La cytométrie en flux (en abrégé: FCM) est une technique de comptage et d'étude de particules microscopiques, telles que les cellules et les chromosomes. Ces derniers sont suspendus dans un flux de liquide et passés devant un appareil de détection optique ou électronique. Il permet simultanément une analyse multiparamétrique des caractéristiques physiques ou chimiques de quelques milliers de particules par seconde. La technologie a des applications dans un certain nombre de domaines, y compris la biologie moléculaire, la pathologie, l'immunologie, la biologie végétale et biologie marine. Elle est un outil particulièrement puissant pour la biologie cellulaire. En effet, cette technique permet de déterminer énormément de caractéristiques d'une suspension de cellules : son état d'activation,
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
de maturation, de prolifération, ou de mort. Elle permet également de séparer des informations concernant des cellules différentes, présentes dans la même suspension ; elle permet même de trier ces cellules, de les séparer physiquement, pour pouvoir obtenir des populations pures à partir d'un mélange [28].
2.2.1 Principes
Il s'agit d'analyser les signaux optiques ou physiques émis par une particule coupant le faisceau lumineux d’un laser ou d’une lampe à arc. Les signaux mesurés sont essentiellement relatifs aux propriétés optiques intrinsèques des particules qui correspondent aux phénomènes de diffusion lumineuse liés aux dimensions de la particule, à leur structure interne ou à l’auto-fluorescence de certaines cellules comme les végétaux, le phytoplancton, etc . Ils sont relatifs aussi aux propriétés optiques induites de fluorescence obtenues par des marquages spécifiques de structures ou de fonctions cellulaires [29]. Le procédé d’analyse individuelle (cellule par cellule) est multiparamétrique et peut s’effectuer à la vitesse de plusieurs milliers d’événements par seconde.
Le cytomètre en flux comprend trois parties :
- un réseau fluidique constitué d'une veine liquide s'écoulant à vitesse constante qui entraîne et focalise un deuxième flux liquide contenant l'échantillon,
- un banc optique avec une ou plusieurs sources lumineuses et ses détecteurs de type photodiode (pour la diffusion de la lumière) et des photomultiplicateurs et filtres optiques qui permettent de quantifier les diverses fluorescences émises par chaque objet,
- un microprocesseur qui convertit les signaux électriques en signaux numériques, coordonne les données, prépare les représentations graphiques et les analyses statistiques.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.9. Schéma du principe d’un FCM.
2.2.2 Une fonctionnalité importante : tri de cellule activé par fluorescence
Le tri de cellules activé par fluorescence est une option de la cytométrie en flux. Il fournit une méthode pour un mélange hétérogène de cellules biologiques de trier les particules dans des (2 ou plus) contenants, cellule par cellule, et basé sur les réponses (signaux fluorescents) de chaque élément [30].
Par rapport au FCM, on trouve un mécanisme de vibration qui provoque des ruptures en gouttelettes individuelles du flux de cellules. Le système est réglé de sorte que la probabilité soit faible d’avoir plus d'une cellule par gouttelette. Juste avant que le flux ne se brise en gouttelettes, il traverse la partie optique/électronique mesurant la fluorescence de chaque cellule. En fonction des réponses, une charge électrique est induite dans chaque gouttelette. Les gouttelettes chargées passent ensuite par un système de déflexion électrostatique qui détourne les gouttelettes dans des conteneurs en fonction de leur charge. [30-31]. La figure I.10 démontre le schématique de tri cellulaire activé par fluorescence [32].
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.10 Schéma expliquant le tri cellulaire activé par fluorescence [32].
2.2.3 Discussions
En 1973, BD corporation, en coopération avec l'Université de Stanford, a développé et produit le premier cytomètre de flux commercial : FACS I. Depuis les équipements de cytométrie en flux sont entrés dans une ère de rapide développement. Le succès du CMF est basé sur la disponibilité de l'équipement commercial qui est à la fois robuste et polyvalent. Il permet de plus l'acquisition de données biologiques « modernes » et le logiciel d'interprétation est très puissant. Le CMF doit aussi son succès au développement des méthodes de marquage qui offrent à l’heure actuelle une panoplie gigantesque de possibilités [33]. La figure I.11 présente le nouveau produit de BD Corporation-‘ Influx™ cell sorter’, qui dispose d'une architecture modulaire et d’une puissante combinaison de capacités de détection et des performances élevées pour permettre aux chercheurs de répondre aux exigences essentielles d’efficacité et de précision d’analyse.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.11 A gauche, vue d'ensemble de l’instrument BD influx, à droite, le système de miroir dichroïque et photomultiplicateur. (Photos par BD.INC).
Les cytomètres sont largement utilisés dans les laboratoires et cliniques pour les analyses et diagnostics cellulaires. Plusieurs applications de la cytométrie en flux peuvent actuellement être appliquées à l'étude du cancer : la détection de l'ADN des cellules tumorales aneuploïdie, l'analyse de la prolifération des cellules tumorales et l'immunophénotypage des leucémies [34]. Cependant, leur encombrement et leur prix ainsi que le coût des consommables pour le marquage sont parmi les points faibles de cette techniques, ce qui laisse des degrés de liberté aux techniques alternatives.
2.3 Conclusions
Les méthodes d’analyse cellulaire sur table traditionnelles ont évolué sur plusieurs décennies et sont désormais la base d’instruments commerciaux « populaires dans les laboratoires de biologie » permettant l’étude morphologique des cellules, leur caractérisation biologique, la composition et le contenu de la composition cellulaire biochimique et la sorte cellulaire grâce à la capture et au traitement d'images et à l'analyse des données. Ils sont largement utilisés dans les laboratoires et cliniques pour étudier et analyser des cellules telles que les cellules cancéreuses et des cellules de différentes pathologies. Face à la (grande) puissance de ces techniques sur table, nous opposons un inconvénient majeur :
Toutes les techniques évoluées optiques reposent sur une étape de marquage (par tag fluorescent) préalable des cellules : cette étape est longue, parfois coûteuse, interdite pour certaines études/configurations. L’on est de plus en droit de se questionner sur l’interférence que peut avoir le tag avec le processus que l’on désire observer. Cette invasivité est de plus totale lors de l’utilisation du MEB (échantillons fixés et séchés puis mis dans un vide pour analyse), et une solution innovante est apportée par l’utilisation de l’AFM en milieu liquide qui mobilise de plus en plus de recherches, mais encore non accessible en routine par les biologistes et médecins.
C’est pour apporter une réponse à cette déficience que de nombreuses techniques alternatives sont étudiées. De plus afin d’obtenir des systémes faible coût, largement
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
diffusables dans le monde et aux grandes capacités d’analyse, ces nouvelles voies d’analyse doivent être intégrées grâce aux micro-(nano-) technologies. Ceci fait l’objet du paragraphe suivant.
3. Méthodes d’analyse sur puce
Depuis la création des MEMS : Micro Electro Mechanical Systems dans les années 1970 et leur large succès commercial consécutif, cette technologie s’est rapidement étendue aux domaines de la biologie et médical. En plus des composants de base, tels que les microcanaux, microvannes, micropompes, micromélangeurs et microréacteurs pour la gestion des flux de volumes microscopiques, divers nouveaux capteurs et plates-formes de détection ont été développés en conjonction de la microfluidique : les “BioMEMS” qui sont aussi connus sous les noms de “biosensors”, “lab on chips” ou “μ-TAS” (pour Micro-Total Analysis Systems) [35-36]. Les bioMEMS regroupent maintenant un domaine en plein essor de recherche de fortes potentialités dans une grande variété d’applications biomédicales [37]. Les domaines « chauds » de recherche incluent le diagnostic de l'ADN, les micro-réseaux d’analyse de protéines; le développement de nouveaux matériaux pour Bio-MEMS ; la microfluidique ; l’ingénierie de surface des BioMEMS, les BioMEMS implantables; les systèmes de délivrance de médicaments, etc. [38]. Un grand nombre de MEMS pour la biologie et médecine a déjà été publié. Le récent rapport de Yole Développement prévoit quant à lui une augmentation du marché de 1000 M$ en 2009 à 4500 M$ en 2015 (Figure I.12) [39].
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.12 Evolution et perspectives du marché mondial des BioMEMS depuis l’année 2009 [39].
Avec les bioMEMS, les échantillons biologiques peuvent être traités sous très faibles volumes (du microlitre jusqu’au picolitre), et analysés dans une manière rapide. Ils réduisent considérablement l'implication nécessaire de l'homme dans de nombreuses étapes de manipulation des échantillons et le traitement de données, et par conséquent, diminuent les problèmes de contamination, de fiabilité et de risques sécuritaires. Ils permettent ainsi d’améliorer la qualité des analyses, de réduire leur coût et leur durée tout en assurant une parallélisation massive des expérimentations [40].
Nous allons, dans les paragraphes suivants, discuter quelques exemples d’applications des bioMEMS dans le domaine de la biologie cellulaire notamment.
3.1 Biocapteurs
Les biocapteurs sont des dispositifs d'analyse qui combinent un élément biologiquement sensible avec un transducteur physique ou chimique pour sélectivement et quantitativement détecter la présence de composés spécifiques dans un environnement externe [41]. Ces biocapteurs peuvent être utilisés pour détecter des cellules, des protéines, de l’ADN, ou de petites molécules.
Les concepts de base de fonctionnement d’un biocapteur peuvent être illustrés à l'aide de la figure I.13. Un bioélément spécifique ou appelé biorécepteur, telle qu'une enzyme, identifie un échantillon spécifique et l'élément transducteur transforme cette identification en un signal électrique [42].
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Les biocapteurs peuvent être classés soit par leurs types de bio-récepteurs soit par leur type de transducteur (notre choix pour de ce chapitre). Certains types de capteurs couramment utilisés sont présentés ci-dessous, notamment à transduction : mécanique, optique, électrique, etc.
3.2 Détection mécanique
La détection mécanique d’entités ou de réactions biochimiques a été récemment miniaturisée par l'utilisation de poutres vibrantes micro- et nanométriques intégrées sur puce. En statique, une structure de type poutre se plie lorsque la contrainte mécanique n'est pas uniforme sur sa longueur. La contrainte sur l'une des surfaces de la poutre peut être modifiée par adsorption physique ou liaison chimique des molécules analysées, par exemple l’ADN [43], comme illustré à la figure I.14.
Figure I.14. Schéma de principe de la détection d’ADN en utilisant des poutres micromécanique [43].
En dynamique, lorsque la poutre vibre, le raisonnement est basé sur la modification des propriétés de résonance de la poutre. Une modification de sa masse se traduira par une variation de la fréquence de résonance [44]. La détection des particules grosses comme des cellules ou des micro-organismes a été démontrée à l'aide de cette méthode [45-46].
Dans tous les modes de détection, un tel biocapteur devra transformer (= transduction) sa déformation mécanique en un signal électrique. Un certain nombre de principes de transduction ont été utilisés au cours des années pour convertir les déplacements mécaniques
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
en signaux électriques, tels que ceux basés sur l’optique (même principal que celui de l’AFM), la transduction capacitive, l’effet piézorésistif, etc. De plus, afin d’augmenter la sensibilité et la résolution des mesures, des éléments du traitement du signal peuvent être intégrés à côté du capteur mécanique sur une technologie CMOS [44, 47]. La figure I.15 présente une poutre résonnante intégrée en technologie CMOS.
Figure I.15. Biocapteur mécanique intégré sur technologie CMOS [47].
La détection mécanique ne demande quant à elle, et à contrario des techniques optiques, pas de marqueur, ce qui représente une propriété intéressante pour un biocapteur. Cependant il exige une très grande précision de réalisation et une bio-fonctionnalisation. Le paragraphe suivant présente un cas particulier (important) de la détection mécanique qui a l’avantage d’utiliser un outil commercialement disponible.
3.3 Détection optique
Les techniques de détection optique tendent elles-aussi à se miniaturiser. T. Vo-Dinh et al [48] présente la détection optique sur puce CMOS (surface totale dans la gamme de la dizaine de mm2) d’E.Coli en utilisant des anticorps marqués par fluorescence. Un autre exemple exploite la bio-chimiluminescence (technique optique sans marquage) : génération de la lumière par la libération de l'énergie à la suite d'une réaction chimique. Dans [49], l'émission de lumière d’un réseau de microchambres imprimées dans un polymère (dénommé ChemChip) a été observée via un capteur CCD.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Nous ne nous attarderons pas plus sur toutes ces voies possibles de réaliser des biocapteurs miniaturisés. Elles sont toutes pertinentes, chacune ayant ses points forts et ses points faibles. Nous proposons de terminer notre tour d’horizon des techniques d’analyses biologiques par celles qui exploitent les ondes électriques.
3.4 Détection électronique
Les techniques de détection électrique ou électrochimique ont également été utilisées couramment dans les biocapteurs. Ils peuvent être déclinés en plusieurs familles suivant les techniques : ampérométrique, potentiométrique, conductimétrique [38], mais aussi capacitive, diélectrique, …
Les biocapteurs électriques sont utilisés classiquement pour détecter le glucose ou la valeur du pH (il existe des instruments commerciaux de ce type depuis fort longtemps). Ils permettent aussi d’analyser des cellules : en 1991 Erwin Neher et Bert Sakmann à Götingen reçoivent le prix Nobel de physiologie et médecine pour le développement (datant de1976) de la technique dite de « patch-clamp » (technique de mesure du potentiel transmembranaire d’une cellule).
Des travaux récents, visent l’intégration de ces techniques sur puce, tirant ainsi profit des capacités d’intégration de circuits actifs (transistors) pour faire cohabiter biocapteur et circuit de traitement du signal. Par exemple, la respiration cellulaire et l'acidification due à l'activité des cellules ont été mesurées avec un ISFET-CMOS (Ions-Sensible Field Effect Transistor intégré en technologie Complementary Metal Oxyde Semiductor) grâce à la diffusion de protons (H+) et des molécules d’oxygène (Lehmann et.al. [50]), comme illustré à la figure I.16.
Figure I.16. Schéma de principe du biocapteur ISFET pour détecter la respiration cellulaire et l'acidification due à l'activité des cellules [50].
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Mohamad Sawan et al présentent dans 51 un biocapteur capacitif qui intègre, sur technologie CMOS, le circuit de traitement des signaux (figure I.17, schéma de gauche). Le système de détection permet le suivi de la croissance de bactéries et est basé sur une architecture de mesure capacitive différentielle (figure I.17, schéma de droite) : le canal de référence contient du milieu de culture pur (de type Luria-Bertani –LB dans la figure I.14, à droite-), l’autre canal contient des bactéries Escherichia Coli (E. Coli) suspendues dans du LB et en prolifération.
Figure I.17: à gauche : la vue schématique du système sur puce, à droite : le principe de mesure capacitive différentielle
Il y a un fort potentiel pour ces biocapteurs à fort degré d’intégrabilité sur technologie CMOS. En effet leur fabrication collective permet de réaliser des biocapteurs à faible coût qui peuvent être soit jetables, soit utilisables en batterie pour du criblage pharmaceutique par exemple. De plus ils peuvent être co-intégrés avec des circuits de communication sans fils et des circuits de récupération d’énergie en vue d’aboutir à des systèmes autonomes de surveillance de la santé des personnes. C’est donc à notre avis une voie attractive de recherche et, avant de présenter la famille « hautes fréquences » de ces biocapteurs, nous présentons un type de détecteur électrique reprenant le concept du cymomètre en flux (instrument vu dans le paragraphe « systèmes sur table » et pour lequel la détection est optique).
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
3.5 Micro-cytométrie et détection électrique
Les cytomètres conventionnels (« sur table ») basés sur la focalisation hydrodynamique des cellules et leur « lecture » optique sont des instruments complexes et coûteux. Le développement récent des technologies micro-électromécaniques (MEMS) fournit une réponse à ces inconvénients, car en raison de leurs aptitudes à la miniaturisation, les dispositifs MEMS peuvent manipuler efficacement les objets micrométriques (tels que les cellules biologiques), peuvent intégrer des systèmes de détections – électriques notamment- et peuvent être fabriqués en grandes quantités et à des faibles coûts [52].
Les efforts visant à miniaturiser un cymomètre en flux peuvent se scinder en trois activités : (1) la mise en place d'un système microfluidique pour la focalisation des particules, (2) l'intégration d'un système de détection, et (3) le développement d’un trieur et d’un compteur de cellules [52].
La focalisation de cellules par phénomène hydrodynamique est classiquement utilisée dans plusieurs microcytomètres. Dans la conception de Hodder et al [53], le flux de l’échantillon liquide est « pris en sandwich » entre deux flux latéraux. Les canaux fluidiques sont réalisés dans du polymère obtenu par moulage dans un répliquât de silicium gravé anisotropiquement, comme il est montré à la figure I.18 [54]. Lorsque les trois canaux fluidiques fusionnent en un, la focalisation hydrodynamique dans la direction latérale se produit. Une autre technique importante de focalisation de cellules repose sur le principe de la diélectrophorèse : la concentration du flux se faisant par champs électriques [55-57].
Figure I.18. Image MEB de moule en silicium servant de répliquât à un focaliseur de cellules microfluidique [54]. Photographie du dispositif microfluidique de focalisation de cellules montrant que le resserrement du flux de particules.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Pour la méthode de détection, malgré les défis de miniaturisation, le système de détection optique est toujours utilisé dans plusieurs modèles de microcytomètre. Ceci s’explique par la très bonne connaissance des propriétés optiques des particules biologiques. Par exemple, de petites diodes laser ou des diodes électroluminescentes (LED) sont montées ou fabriquées sur le canal microfluidique pour servir de source d'excitation [55-57]. Les propriétés des cellules peuvent être également analysées à l'aide d’un système de détection d’impédance intégré sur un cytomètre en microflux. Dans cette approche, l'impédance d'un milieu est surveillée. Lorsqu’un flux de particules traverse la zone de détection, l’impédance (en fait le signal associé) varie ce qui sert au comptage des cellules ainsi qu’à la mesure de leurs tailles. Cette technique est beaucoup moins compliquée que la méthode de détection optique, car elle ne nécessite pas de modification (marquage fluorescent) des cellules [58-60]. La figure I.19 présente un dispositif cytomètre en microflux mesurant le spectre d’impédance de particule biologique et développé au sein de l’équipe de Philippe Renaud [61].
Figure I.19. Vues de dessus (a) et de côté (b) du canal microfluidique et des électrodes de mesure de l’impédance. Les impédances des deux paires d'électrodes sont comparées lors du passage d'une particule dans la région d'interrogation [61].
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Un trieur ou un compteur de particules peuvent être ajoutés en aval du système de focalisation et de détection. Les auteurs de [62] ont utilisé la diélectrophorèse pour trier des particules biologiques. Dans les travaux de [54] et [63], le tri est hydrodynamique : les canaux horizontaux fluidiques sont utilisés pour dévier l'écoulement de particules, l'extrémité du canal principal pouvant être séparé en deux ou en plusieurs trajets afin de collecter les différents types de particules. Le système de tri de cellule de [54] est présenté à la figure I.20.
Figure I.20. Image MEB de moule en silicium de microcanal en PDMS de tri hydrodynamique [54]. Photographie d'un dispositif de tri hydrodynamique montrant que le flux de particules sans fluide de commutation (photo de gauche), avec un fluide de commutation injecté à gauche (photo du milieu), avec un fluide de commutation injecté à droite (photo de droite).
3.6 Discussions
La plupart des méthodes usuelles d'analyse cellulaire utilise des instruments commercialisés : microscopes optiques, microscopes à fluorescence, cytomètre en flux (ou FACS), etc. Ils sont couramment utilisés dans les laboratoires de biologie et les hôpitaux, car ils sont multifonctionnels et capables de fournir des résultats précis et rapides. Cependant ces instruments sont complexes, volumineux et coûteux.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Grâce au développement rapide des technologies MEMS de ces dernières décennies, de nouveaux instruments pour la biologie cellulaire, et notamment pour la cancérologie, émergent : les puces à cellules. Ces systèmes miniaturés d’analyse de cellules (et même d’une cellule) combinent des techniques microfluidiques, biochimiques, optiques, électriques, etc… et intègrent de nouveaux matériaux (pour la bio-fonctionnalisation). D’intenses travaux de recherche sont donc en cours depuis une dizaine d’années afin de proposer des techniques d’analyse compactes : intégration de systèmes optiques, développement de systèmes de détection électriques ou mécaniques. Chaque technique présente ses avantages et ses inconvénients et notre conviction est qu’elles cohabiteront toutes, chacune ayant sa spécificité et/ou toutes réunies afin de fournir des analyses multiparamétriques riches en potentiel de diagnostic.
Nous allons présenter dans le paragraphe suivant un (4ème) compétiteur à la détection biologique qui, outre la capacité de fournir une vision nouvelle du vivant, rassemble bon nombre d’atouts :
sans marqueur ni altération des échantillons biologique,
grande capacité d'intégration,
… à découvrir dans ce manuscrit …
4. Les potentialités de la détection électrique haute fréquence pour
la biologie (cellulaire)
Les applications exploitant les ondes électromagnétiques (la figure I.21) dans les domaines de la biologie et de la médecine sont nombreuses. Outre l’optique (microscopes, microscopes à fluorescence, cytométrie en flux pour ne citer qu’eux), les rayons X (X-rays) sont largement exploiter dans les instruments hospitaliers tels que le scanner (à rayons X). Les ondes radio de quelques dizaines de MHz sont aussi à la base de l’Imagerie par Résonance Magnétique (IRM).
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.21. Le spectre électromagnétique.
De plus, les hyperfréquences (parfois nommées Micro-ondes comme à la figure I.18) et allant typiquement du Gigahertz à la centaine de Gigahertz) ont ouvert la voie sur de nouvelles méthodes thérapeutiques et diagnostiques en médicine et biologie. Des applications thérapeutiques dans la gamme de fréquence du Mégahertz jusqu’à la dizaine de Gigahertz sont actuellement à l'étude pour des domaines tels que la cardiologie, l'urologie, la chirurgie, ophtalmologie, traitement du cancer et d'autres. Cette gamme fréquentielle est de plus exploitée par des applications de diagnostic pour la détection du cancer, l'imagerie d'organes, l’imagerie corporelle pour la sécurité aéroportuaire et plus encore [64]. De nombreuses recherches sont aussi focalisées sur l’étude des effets thermiques des ondes électromagnétiques hyperfréquences pour la thérapie ainsi que sur l’imagerie d’organe notamment [65-68].
L'utilisation des ondes électromagnétiques pour caractériser et étudier les propriétés diélectriques de substances biologiques telles que des tissus ou des fluides biologiques (sang) est bien établie notamment grâce au travail de Schwan et Stuchly [69-72]. L’essentiel des études a été mené à une échelle « macroscopique », c'est-à-dire aux échelles des organes (foie par exemple) ou des tissus (échantillons centimétrique d’organe ou de peau) [73]. Diverses autres techniques toujours volumineuses ont été investiguées, utilisant différents types de guides d'onde [74-76]. Ces études à échelle centrimétrique n'en sont pas moins très précieuses. En effet, une très large variété de tissus, d'os, de liquides biologiques variés ont été mesurés et présentent tous des signatures électriques distinctes. Un autre fait marquant a également été démontré dans [73], [74] et [77] notamment : il existe un contraste important entre les paramètres diélectriques de tissus sains et de tissus cancéreux sur une large gamme de fréquence au-delà du Gigahertz, comme illustré à la Figure I.22.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.22. Paramètres électriques de tissus mammaires sains et pathogènes (NT : Non-Tumorous Tissue and TT : Tumorous Tissue) [77].
Nous décrirons ci-après uniquement les techniques non-invasives (c'est-à-dire celles qui maintiennent la viabilité des cellules lors de l’analyse). En effet, [82] et [83] opèrent en milieu biologique séché, ce qui, outre la modification apportée du vivant sous étude, tue le matériel biologique. Ce caractère « non-invasif » est, à nos yeux, une propriété chère à la technique hyperfréquence de détection, propriété qu’il est donc capital d’assurer.
Quelques références [79, 83] mettent en œuvre des micro-réservoirs (au-dessus de circuits hyperfréquences) dans lesquels sont placés par seringue les matériaux biologiques à analyser : hémoglobine, ADN-λ, E-coli [79], et cellules en suspension [83]. Les mesures effectuées sont de plus effectuées sur une large gamme de fréquence ce qui permet l’acquisition de signatures des milieux biologiques (cf. Figure I.23 et Figure I.24).
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Figure I.23 Ligne coplanaire à micro-puit, testée avec de l'hémoglobine [79].
Figure I.24 Ligne coplanaire à microréservoir testé avec des cellules HEK-293 et 10% de DMSO [83].
La publication de Pavlidis et.al. [83] est particulièrement intéressante car elle montre également la capacité de suivi en temps réel de processus biologique par la technique hyperfréquence. En effet, la mort induite de cellules en suspension a été suivi durant une trentaine de minutes : les auteurs ont démontré des contrastes consécutifs sur la permittivité du fluide biologique comme l’illustre le graphique de droite sur la Figure I.24.
La caractérisation large-bande de population de cellules dans leur milieu de culture, donc sans altération de ces dernières, est faite par Katia Grenier et al [78]. Un contraste significatif sur la permittivité relative du liquide a été mesuré entre les 2 solutions : avec et sans cellules, ce qui montre la possibilité de détecter des cellules par la technique HF en milieu liquide
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
(Figure I.25). D’autres mesures ont également permis de quantifier et même d’identifier des cellules suivant leur état : vivante, morte à l'aide d'un circuit résonant [84].
Figure I.25 Photographie de cellules en suspension dans le biocapteur RF et détection associée [78].
5. But de notre travail et conclusions
Dans ce chapitre nous avons introduit et discuté différentes méthodes d’analyse biologique : des instruments commercialisés aux solutions à base de bio-MEMS. Les méthodes d’analyses cellulaires usuelles sont capables d’analyser des matériaux, molécules biologiques, cellules, tissus, organe, corps entier ; mais pêchent par certains aspects qui peuvent cacher certains phénomènes biologiques et empêcher leurs études. Parmi ces inconvénients, on trouve notamment :
La nécessite de marquage qui, bien que conduisant à de grande sensibilité et spécificité des analyses, impose des étapes « invasives » assez fastidieuses avant toute analyse. Par « invasive », nous entendons les faits suivants : (1) après analyse, les cellules sont générales inutilisables et (2) pendant l’analyse, on peut se poser la question des interférences des marqueurs avec le processus que l’on souhaite étudier.
Certaines techniques (sauf le cytométrie en flux, mais qui lui souffre de l’étape de marquage et du fait qu’après analyse les cellules ne sont « plus tout à fait en forme » car un laser les a éclairées) ne sont pas parallélisables.M éthode s d’ an al ys e ce llu la ir es e n biol og ie
C’est donc pour compléter les approches existantes, apporter des solutions aux inconvénients précédemment cités, développer une nouvelle manière de sonder le vivant que nous nous sommes orientés vers le développement de circuits hyperfréquences, intégrés avec les microtechnologies, pour l’analyse cellulaire.
Le but de notre travail de thèse est le développement un biocapteur hyperfréquence permettant la caractérisation diélectrique large-bande (que nous nommerons par la suite spectroscopie diélectrique hyperfréquence ou simplement spectroscopie) de cellules, jusqu’à la cellule unique. Nous visons à combiner le micro dispositif hyperfréquence avec des fonctionnalités microfluidiques assurant ainsi une compatibilité avec la concept de lab-on-a-chip au sein duquel notre biocapteur pourra cohabiter avec des fonctions microfluidiques de manipulation, tri, mélange, chauffage, …. Nous devrons de plus assurer des propriétés, remarquables pour un système de détection lorsque toutes réunies, d’opération en milieu de culture, sans-contact et sans marquage : ceci assurant la bonne viabilité des cellules étudiées (non-invasivité), qui pourront par la suite être réutilisées pour d’autres analyses ou réintroduites dans d’autres expériences.
Enfin, l’intégration par les microtechnologies de l’approche hyperfréquence-fluidique permet d’envisager une forte miniaturisation de la détection (miniaturisation jusqu’à quelques micromètres de la zone d’analyse, ce qui correspond aux dimensions d’une cellule), ainsi qu’une forte parallèlisation des analyses de part la fabrication collective des composants, ce qui ouvre des perspectives pour des applications de criblage pharmaceutique.
Le chapitre suivant présente le premier composant développé permettant d’effectuer une spectroscopie diélectrique hyperfréquence de milieu liquide sub-nanolitre (assurant une forte miniaturisation des volumes d’analyse), incluant des suspensions cellulaires localisées microfluidiques.
Les chapitres suivants sont quant à eux dédiés à l’analyse jusqu’à la cellule unique dans son milieu de culture et pour laquelle tant la technique hyperfréquence que l’intégration par les microtechnologies ont été optimisées.
M éthode s d’ an al ys e ce llu la ir es e n biol og ie
Bibliographes
du Chapitre I
:
[1] P. Boutibonnes ; L'œil de Leeuwenhoek et l'invention de la microscopie, Alliage, 39: 58-66 ; 1999. [2] K. Gerald; Cell and molecular biology: Concepts and Experiments, 6th edition; chapter 1; 2009. [3] Wikipedia; LA definition of cell biology; 2009.
[4] K. Gerald, Cell and molecular biology: Concepts and Experiments, 6th edition; chapter 18; 2009. [5] J. Paul Robinson, et al; Handbook of Flow Cytometry Methods; 1993.
[6] A.L. Givan, Flow Cytometry First Principles; 2001. [7] H. M. Shapiro, Practical Flow Cytometry; 2003. [8] L. A. Sklar, Flow Cytometry for Biotechnology; 2005.
[9] M . Abramowitz, M.W. Davidson, Introduction to Microscopy. Molecular Expressions. [10] J.W. Cross, Scanning Probe Microscopy.
[11] S. Bradbury and B. Bracegirdle; Introduction to Light Microscopy; BIOS Scientific Publishers Ltd., Oxford, UK; p-123; 1998.
[12] M. Abramowitz; Photomicrography: A Practical Guide; OlympusAmerica, Inc.; Melville, New York, p-73; 1998.
[13] F. Zernike; Phase-contrast, a new method for microscopic observation of transparent objects; Part I, Physica: 9, 686-698; 1942.
[14] F. Zernike; Phase-contrast, a new method for microscopic observation of transparent objects. Part II.., Physica: 9, 974-986; 1942.
[15] K. Gerald; Cell and molecular biology: Concepts and Experiments, 6th edition, chapter 18; p-718, 2009.
[16] K.R. Spring, M.W. Davidson; Introduction to Fluorescence Microscopy; Nikon Microscopy, 2008.
[17] The Fluorescence Microscope, the Nobel Foundation, Microscopes—Help Scientists Explore Hidden Worlds, 2008.
[18] M.W. Davidson and M. Abramowitz, optical microscopy, p-35; 2002.
[19] K. Gerald, Cell and molecular biology: Concepts and Experiments, 6th edition, chapter 18, p719-720, 2009.
[20] S. Bhawsar; Sample preparation for microscopy; www.biotecharticles.com; 2012.
[21] E. Rolf, M.D. Rossell, C. Kisielowski, U. Dahmen; Atomic-Resolution Imaging with a Sub-50-pm Electron Probe; Physical Review Letters 102 (9): 096101; 2009.
[22] The Transmission Electron Microscope, www.Nobelprize.org.
[23] D. McMullan; "Scanning Electron Microscopy, 1928–1965". 51st Annual Meeting of the Microscopy Society of America. Cincinnati, OH; 1993.
[24] G. Binnig, C. F. Quate, Ch. Gerber: Atomic Force Microscope. In: Physical Review Letters. 56, Nr. 9, S. 930–933; 1986.
[25] D.J. Müller and Y.F. Dufrêne; Atomic force microscopy: a nanoscopic window on the cell surface, Trends in Cell Biology, Vol. 21, No. 8; 2011.
[26] A. Guillaume: Imaging the nanoscale organization of peptidoglycan in living Lactococcus lactis cells, Nature Communications 1, Article number: 27; 2010.
![Figure I.1. Le microscope utilisé par Antoni van Leeuwenhoek permettant la première observation de bactéries et microorganismes [1]](https://thumb-eu.123doks.com/thumbv2/123doknet/2219492.14709/12.892.130.762.339.560/microscope-utilise-leeuwenhoek-permettant-premiere-observation-bacteries-microorganismes.webp)
![Figure I.7. A gauche : photographie d’une poutre AFM. A droite : Image AFM de l'organisation nanométrique de peptidoglycane dans des cellules vivantes de lactis [26]](https://thumb-eu.123doks.com/thumbv2/123doknet/2219492.14709/21.892.116.728.225.490/figure-gauche-photographie-organisation-nanometrique-peptidoglycane-cellules-vivantes.webp)
![Figure I.20. Image MEB de moule en silicium de microcanal en PDMS de tri hydrodynamique [54]](https://thumb-eu.123doks.com/thumbv2/123doknet/2219492.14709/35.892.196.692.385.681/figure-image-meb-moule-silicium-microcanal-pdms-hydrodynamique.webp)
![Figure I.24 Ligne coplanaire à microréservoir testé avec des cellules HEK-293 et 10% de DMSO [83]](https://thumb-eu.123doks.com/thumbv2/123doknet/2219492.14709/39.892.144.749.319.723/figure-ligne-coplanaire-microreservoir-teste-cellules-hek-dmso.webp)
![Figure I.25 Photographie de cellules en suspension dans le biocapteur RF et détection associée [78]](https://thumb-eu.123doks.com/thumbv2/123doknet/2219492.14709/40.892.153.744.181.413/figure-photographie-cellules-suspension-biocapteur-rf-detection-associee.webp)