FACULTÉ DES SCIENCES
Rabat
N° d’ordre 2321
THÈSE DE DOCTORAT
Présentée par
Mlle EL ANDROUSSE Amal
Discipline : Biologie
Spécialité : Mycologie et biotechnologie végétale
Contribution à l’étude de quelques Oomycètes du barrage Sidi
Mohammed Ben Abdellah : Aspects mycologique
et phytopathologique
Soutenue le 23 décembre 2006
Devant le jury
Président :
BENKHEMMAR O. Professeur à la Faculté des Sciences de Rabat
Examinateurs :
CHEKTI R. Professeur à la Faculté des Sciences de Rabat
EL AISSAMI A. Professeur à la Faculté des Sciences de Rabat
PAUL B. Professeur à l’Université de Bourgogne Dijon
ZAID E. Professeur à la Faculté des Sciences de Rabat
Invité :
El AMRI H. Directeur du Laboratoire de Toxicologie de la
Gendarmerie Royale de Rabat
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 37 77 18 34/35/38, Fax : +212 (0) 37 77 42 61, http://www.fsr.ac.ma
Vos encouragements et vos prières m’ont toujours soutenus et guidés.
En ce jour, j’espère réaliser un de vos rêves et être digne de vous.
Veuillez trouver, mes très chers parents, dans ce travail le fruit de votre
dévouement ainsi que l’expression de ma gratitude et de mon profond
amour.
Que Dieu vous garde et vous procure santé et longue vie…
A mes très chères sœurs Imane, Aya et Hasnaa
A mes très chers frères Adnane, Abdou, Mehdi et Inane
A mon très cher neveu Adib
A ma meilleure amie Hakima
Avant Propos
Ce travail a été réalisé au Laboratoire de Botanique de la Faculté des Sciences de
Rabat. Qu’il me soit permis tout d’abord de remercier très vivement le Professeur EL AISSAMI A. qui a su m’accompagner, me guider et me soutenir tout au long de cette
thèse. L’intérêt exceptionnel qu’elle a toujours manifesté pour mon travail, ses compétences scientifiques et ses conseils m’ont été d’un grand réconfort. Je tiens à lui exprimer ma reconnaissance et lui suis grée de la confiance qu’elle a placée en moi.
Ce travail a bénéficié de plusieurs subventions. Tout d’abord le Programme Thématique d’Appui à la Recherche Scientifique PROTARS I n° P1T1/28, ensuite le contrat de recherche intitulé «étude des champignons aquatiques des eaux à potabiliser» et la convention de recherche intitulée «les champignons des eaux à potabiliser. Inventaire et impact sur la qualité de l’eau de boisson» signés entre le Laboratoire de Botanique du Département de Biologie de la Faculté des Sciences de Rabat et l’Office National de l’Eau Potable à Rabat (ONEP) ; et enfin le soutien du Comité Mixte Franco-Marocain, Action Intégrée n°MA/02/51.
Je saisis cette occasion pour exprimer toute ma reconnaissance au Professeur RAHOUTI M., Responsable des Partenariats Scientifiques précités et Directeur de l'UFR « Pathologie et bioprotection végétales »
Je tiens à remercier très vivement le Professeur Paul B. qui m’a accueilli à plusieurs reprises dans son Laboratoire de Mycologie à l’Institut Jules Guyot, Université de Bourgogne de Dijon ou j’ai pu réaliser la plus grande partie des études de caractérisation. J’ai pu bénéficier de ses compétences scientifiques et de son savoir faire. Qu’il trouve ici l’expression de ma profonde gratitude.
Mes vifs remerciements vont au Professeur SEIGLE-MURANDI F. responsable du Laboratoire de Botanique et Cryptogamie, Université Joseph Fourier Grenoble, pour sa collaboration dans le cadre de l’action intégrée n° MA/02/51 suite auquel j’ai pu bénéficier de plusieurs stages en France.
Je remercie profondément Mademoiselle BENABDELLAH S. et Messieurs LAMGHARI M., ASSAFI M., BOULOUD A. et ALAMI M., du Laboratoire central de l’office National de l’Eau Potable (ONEP) pour leur collaboration et leurs encouragements.
Mes sincères remerciements sont adressés au Professeur BENKHEMMAR O., pour son aide, ses conseils fructueux et pour l’honneur qu’il m’a fait en acceptant d’être le président du jury.
Que le Professeur CHEKTI R. trouve ici l’expression de ma reconnaissance pour sa grande collaboration et pour son soutien.
Je remercie profondément le Professeur ZAID E. qui m’a fait un grand honneur en acceptant de participer à ce jury.
Le Professeur EL AMRI H., Directeur du Laboratoire de Toxicologie de la Gendarmerie Royale, a accepté de juger ce travail. Je saisis cette occasion pour l’en remercier.
Que Monsieur BENCHAKRI M. trouve ici le témoignage de ma reconnaissance pour son aide technique efficace.
Je me permets d’exprimer ma sympathie et toute mon amitié aux personnels des laboratoires ou ce travail a été réalisé.
Je ne saurais oublier toutes les personnes qui m’ont permis, de prés ou de loin, de mener à bien ce travail. Je leur exprime toute ma gratitude.
SOMMAIRE
INTRODUCTION GENERALE
………1Première partie
Caractérisation de quelques Oomycètes du barrage SMBA
INTRODUCTION……….7
Chapitre 1 : Isolement et caractérisation morphologique
INTRODUCTION……….9I) MATERIEL ET METHODES………...10
1- Isolement et purification……….10
1-1- Choix et localisation de la station d’étude……….10
1-2- Echantillonnage……….10
1-3- Etude des Oomycètes de la retenue………...13
1-3-1- Isolement des Oomycètes………..13
1-3-1-1- Eau brute ………13
a) Etalement sur milieux gélosés………...13
b) Surfusion………...13
c) Technique des appâts……….13
1-3-1-2- Concentration des échantillons………...14
a) Centrifugation………14
b) Filtration………14
1-3-2- Conservation……….14
1-3-2-1- Conservation sur milieu solide………14
1-3-2-2- Conservation sur milieu liquide………..15
2- Caractérisation morphologique des isolats……….15
2-1- Observation macroscopique………..15
2-2- Observation microscopique………...15
2-2-1- Culture dans l’eau………15
2-2-2- Etude microscopique:………..16
II) RESULTATS ET INTERPRETATIONS………...18
1- Population des oomycètes de la retenue du barrage SMBA………18
2- Identification et taxonomie des espèces isolées………...21
2-1- Pythiacèes………..22
2-1-1- Pythium diclinum………….……….22
I) MATERIEL ET METHODES………..51
1- Matériel biologique………..51
2- Extraction de l’ADN…..………..51
3- Amplification par PCR………52
4- Séquençage………..53
II) RESULTATS ET INTERPRETATIONS………...53
1- Comparaison des séquences………57
2- Identification moléculaire des six espèces………..57
2-1- Pythiacèes……..………57
2-2- Saprolegniacèes.………60
III) DISCUSSION ET CONCLUSION……….65
Chapitre 3 : Identification des composés volatiles des Pythium identifiés
INTRODUCTION………..69I) MATERIEL ET METHODES………..70
1- Culture des isolats………70
2- Extraction……….70
3- Analyse des extraits des trois Pythium par chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG-SM)………...71
II) RESULTATS ET INTERPRETATIONS………...71
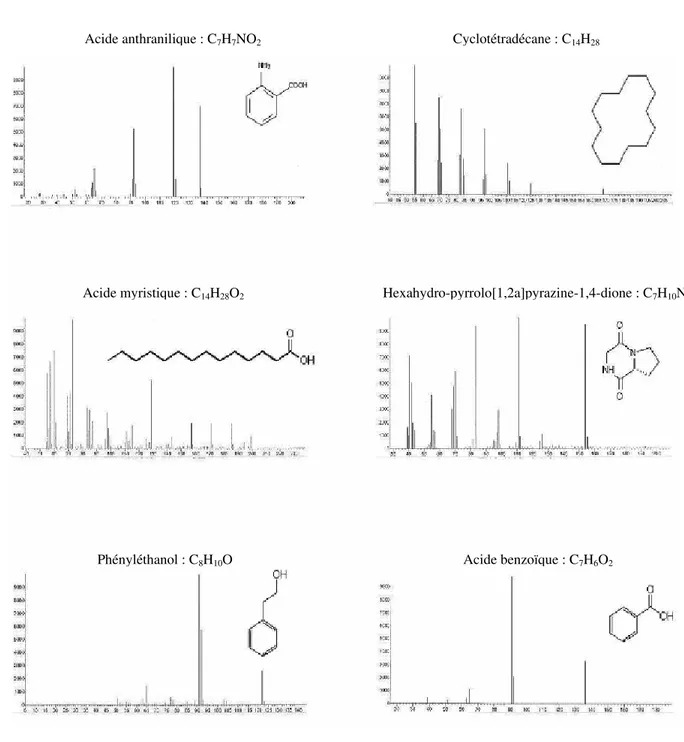
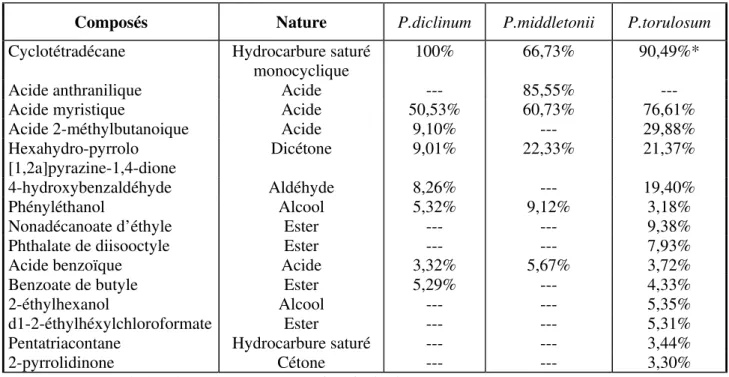
1- Identification des composés volatiles des trois Pythium……….71
1-1- Extraits chloroformiques……….………..71
1-1-1- Milieu PYG……….………..71
1-1-2- Milieu PCB……….………...75
1-2- Extraits d’acétate d’éthyle.……….………...79
1-2-1- Milieu PYG……….………..79
2- Comparaison des extraits (par le chloroforme et l’acétate d’éthyle) des trois Pythium
cultivés sur milieux PYG et PCB………..88
III) DISCUSSION ET CONCLUSION……….92
Deuxième partie
Etude de la pathogénicité de Pythium et de la bioprotection de la luzerne
contre la fonte de semis
INTRODUCTION
………...98Chapitre 1 : Etude de la pathogénicité des trois Pythium
INTRODUCTION……….100I) MATERIEL ET METHODES……….102
1- Les isolats de Pythium..………..102
2- Le matériel végétal : La luzerne (Medicago sativa L.)………..102
3- Technique d’inoculation des semences de luzerne in vitro…..……….103
3-1- Stérilisation des graines..……….………103
3-2- Inoculation des graines....……….………...103
3-2-1- Contamination en pré-levée………103
3-2-2- Contamination en post-levée………...103
3-3- Conditions de culture………...103
3-4- Lecture des résultats………105
3-4-1- Germination des graines….……….105
3-4-2- Croissance racinaire…..….……….105
3-4-3- Taux de mortalité……..….……….105
4- Inoculation des plantules de luzerne in vivo……….…..………...106
4-1- Conditions de culture…..……….………106
4-2- Inoculation des plantules..……….………..106
4-3- La chambre de culture……….106
4-4- Lecture des résultats………108
II) RESULTATS ET INTERPRETATIONS……….108
1- Inoculation de la luzerne in vitro………...108
1-1- Action sur la germination des graines de luzerne………108
1-1-1- Contamination en pré-levée..………..108
1-1-2- Contamination en post-levée..……….108
1-1-3- Comparaison de l’impact des Pythium sur la germination de la luzerne selon le type de contamination……….112
1-2- Action sur la croissance racinaire………112
1-2-1- Contamination en pré-levée..………..112
1-2-2- Contamination en post-levée………...114
1-2-3- Comparaison de l’impact des Pythium sur la croissance racinaire selon le type de contamination……….114
INTRODUCTION……….121
I) Antagonisme in vitro des trois bactéries bénéfiques vis à vis de Pythium
diclinum………122
INTRODUCTION……….122
A) MATERIEL ET METHODES………...123
1- Le Pythium étudié…....………..123
2- Les bactéries antagonistes……….……….123
3- Protocole de la confrontation………..…….…..………123
3-1- Confrontation simultanée.……….………..123
3-2- Confrontation déphasée...……….………...123
3-3- Estimation de l’effet antagoniste……….123
B) RESULTATS ET INTERPRETATIONS……….124 1- Confrontation simultanée……….……….124 1-1- Milieu PDA……….………124 1-2- Milieu PCA…………....……….124 2- Confrontation déphaseé………….………127 2-1- Milieu PDA……….………127 2-1-1- Délai de 2jours…………...……….127 2-1-2- Délai de 4jours…………...……….127 2-1-3- Délai de 6jours…………...……….127 2-2- Milieu PCA…………....……….124 2-2-1- Délai de 2jours…………...……….124 2-2-2- Délai de 4jours…………...……….124 2-2-3- Délai de 6jours…………...……….124
3- Comparaison des deux types de confrontations……….129
3-1- Milieu PDA.……….………131
3-2- Milieu PCA.……….………131
4- Comparaison des deux milieux de culture…….………132
II) Bioprotection de la luzerne contre la fonte de semis causée par P.
diclinum………134
INTRODUCTION……….134 A) MATERIEL ET METHODES………..….1351- Préparation de l’inoculum.……….135
1-1- Inoculum de P. diclinum……….………...1351-2- Inoculum de Pseudomonas aeruginosa « Ps1 »………..136
2- Protocole de bioprotection des graines………..………136
2-1- Préinoculation avec Pseudomonas aeruginosa « Ps1 »………...136
2-2- Inoculation avec P. diclinum……….…….………...………..136
3- Lecture des résultats……….………..136
3-1- Le pourcentage de plantes saines……….………136
3-2- Le poids frais des parties aériennes et racinaires des plantes………..137
B) RESULTATS ET INTERPRETATIONS………..………...137
1- Effet de la bactérisation des graines par Pseudomonas aeruginosa sur l’expression de la
maladie………1371-1- Effet sur le pourcentage des plantes saines….………137
1-2- Effet sur le poids frais des parties aériennes et racinaires des plantes…………137
2- Effet du délai de pré-inoculation par Pseudomonas aeruginosa sur l’expression de la
maladie………1402-1- Effet sur le pourcentage des plantes saines….………140
2-2- Effet sur le poids frais des parties aériennes et racinaires des plantes…………140
C) DISCUSSION ET CONCLUSION……….…143
CONCLUSION GENERALE
………..145REFERENCES BIBLIOGRAPHIQUES
………152ARN : Acide Ribonucléique
ARNr : Acide Ribonucléique Ribosomique CMA : Corm Meal Agar
cfu : Colony forming unit
ETS : External Transcribed Spacer
Fig. : Figure
IGS : Intergenic spacer
ITS : Internal Transcribed Spacer
min : minute
Moy. : Moyenne nt : nucleotide
pb : paire de base
PCA : Potato Carrot Agar
PCR : Polymerase Chain Reaction PDA : Potato Dextrose Agar PDB : Potato Dextrose Broth Pl. : Planche
PRCD : Pourcentage de réduction de la croissance diamétrale SDS : Sodium Dodecyl Sulphate
SMBA : Sidi Mohammed Ben Abdellah TTH’s : Tripartite Tubular Hairs
INTRODUCTION GENERALE
Les écosystèmes aquatiques sont le siège d’une vie foisonnante, tant animale que végétale, qui joue un rôle primordial dans le fonctionnement des milieux aquatiques. Parmi les microorganismes peuplant les eaux douces, les Oomycètes sont l’un des groupes les plus actifs.
Les Oomycètes longtemps classés avec les Eumycètes car ils possèdent d’une manière très frappante une morphologie et un mode de vie similaire, font désormais partie d’une grande ligne monophylétique : le règne Straménipila. Ce règne défini sur la base des séquences moléculaires, regroupe de nombreux ensembles d’organismes caractérisés par la présence à un moment de leur cycle de zoospores avec deux flagelles dissemblables dont l’un porte deux rangées de mastigonèmes [Dick, 2001].
La grande répartition de ces champignons straménopiles dans le monde et la diversité de leur impact sur l’environnement en général et sur l’homme en particulier, en font des microorganismes d’importance majeure. En effet, les Oomycètes peuvent vivre en saprophyte sur les débris végétaux et animaux jouant dans ce cas un rôle de décomposeurs de la matière organique. Comme ils peuvent parasiter de nombreux animaux. Prenons comme exemple,
Aphanomyces astaci parasite des crustacées et responsable de la peste des écrevisses
[Alderman, 1996], Saprolegnia ferax et Saprolegnia parasitica agents des saprolegnioses de poissons [Kiziewicz, 2004]. Ils peuvent également être de redoutables phytopathogènes tel que Pythium ultimum responsable de la fonte de semis de nombreuses cultures [Middleton, 1943 ; Plaats-Niterink, 1981 ; Kageyama & Nelson, 2003]. La santé de l’homme peut également être affectée par les Oomycètes parasites. Pythium insidiosum a effectivement été identifié comme l’agent étiologique de plusieurs pythioses humaines causant des symptômes comme les arthrites [Thitithanyanont et al., 1998], et les infections cutanées et subcutanées [Shenep et al., 1998].
Ainsi, l’étude des Oomycètes dans les milieux aquatiques a fait l’objet d’un grand nombre de travaux [Roberts, 1963 ; Dick, 1971 ; Park et al., 1978 ; Khulbe, 1980 ; Hallet & Dick, 1981 ;
influencée par les techniques d’isolement choisis. Le piégeage des zoospores avec divers appâts notamment les graines de chanvre s’est avéré une des techniques les plus efficaces [Plaats-Niterink, 1981 ; Paul, 1994 ; Steciow, 2001a-c ; Paul & Steciow, 2004 ; Paul et al., 2005].
Fondamentalement, l’identification des Oomycètes isolés est basée sur l’étude microscopique d’un grand nombre de critères morphologiques. La description des structures de reproduction asexuée est nécessaire à la détermination du genre. Ainsi, pour différencier les genres de la famille des Saprolégniacèes, des observations microscopiques minutieuses au moment de la libération des zoospores sont exigées. En effet, Chez Saprolegnia les sporocystes libèrent à travers une papille des zoospores réniformes (primaires) qui commencent à nager immédiatement après leur émission. Alors que chez Achlya les zoospores s’enkystent et se rassemblent en un amas sphérique dès leur émission formant une boule de spores à l’apex des sporocystes. Les spores de Dictyuchus, par contre, s’enkystent à l’intérieur des sporocystes. Le protoplasme de chaque kyste est projeté à travers la paroi du sporocyste par une papille individuelle puis il est réorganisé en une zoospore de type secondaire [Fuller & Jaworski, 1987 ; Daugherty et al., 1998].
Une fois le genre est déterminé, une description précise des structures de reproduction sexuée incluant la présence ou l’absence des anthéridies, l’origine des branches anthéridiales, la taille des oogones, le type de la paroi des oogones, le nombre d’oospores par oogone, la position des gouttelettes lipidiques dans les oospores,…. est primordiale pour arriver au niveau espèce. Or, ces manipulations microscopiques sont très délicates et nécessitent beaucoup de temps et de patience. Parfois les isolats ne forment pas les structures sexuées ni en culture simple ni en confrontation avec des espèces hétérothalliques connues [Hendrix &Papa, 1974 ; Plaats-Niterink, 1981] ce qui oblige les chercheurs à arrêter l’identification au niveau du genre pour la majorité des isolats.
Avec l’introduction de techniques plus récentes comme la biologie moléculaire, l’identification de ces champignons straménopiles ne s’arrête plus à la caractérisation morphologique. En effet, l’étude de l’ADN ribosomique, qui consiste en des régions transcrites et non transcrites, s’est avérée très adaptée aux analyses taxonomiques. Les espaces internes des régions transcrites (ITS1 et ITS2) sont peu conservés au cours de l’évolution et présentent une variabilité interspécifique élevée ce qui permet de comparer des organismes proches.
L’amplification par PCR (Polymerase chain reaction) des régions ITS grâce aux amorces universelles et le séquençage des régions amplifiés ont fournis un matériel de choix pour les études comparatives, taxonomiques et phylogéniques [Lévesque et al., 1994 ; Daugherty et
al., 1998 ; Leclerc et al., 2000 ; Lévesque & De Cock, 2004].
Parmi les Oomycètes les plus étudiés, le genre Pythium occupe une place de marque en raison de sa grande dispersion dans le monde et son impact considérable sur l’économie. En effet, plusieurs espèces de Pythium sont de redoutables pathogènes des plantes cultivées comme le blé [Abdelzaher, 2004], la betterave sucrière [Lee & Hoy, 1992], le concombre [Sánchez et
al., 2001], le soja [Forbes & Davet, 1990 ; Zhang & Yang, 2000 ; Dorrance et al., 2004] et la
tomate [Eden & Hill, 1998]. Ce sont également des pathogènes de certains animaux notamment les poissons [Sati, 1991 ; Czeczuga et al., 2002] et les chevaux [Mendoza & Alfaro, 1986 ; Rivierre et al., 2005]. De Moraes Gimenes Bosco et al. [2005], ont montré qu’ils attaquent même l’homme.
Ces microorganismes agissent sur leur cible par un éventail d’outils. Plusieurs auteurs ont démontré la capacité des Pythium à sécréter des phytotoxines et des enzymes lytiques impliquées dans la pathogénicité [Chen et al., 1998 ; Rey et al., 2001 ; Bell & Walker, 2004]. D’autres ont rapporté la détection dans les filtrats de culture de Pythium sp, de métabolites d’une grande importance économique tel que l’Omega 3 et l’acide arachidonique [Gandhi & Weete, 1991 ; Obrien et al., 1993 ; Stredansky et al., 2000 ; Zhu, 2002]. Il en ressort que les métabolites produits par Pythium sp sont de natures différentes et qu’ils dépendent principalement du mode d’action des espèces étudiées.
Les Pythium phytopathogènes sont d’autant plus dangereux qu’une même espèce peut s’attaquer à un grand nombre de cultures [Eden & Hill, 1998]. Ils infectent en général les graines en germination, les jeunes plantules et les tissus succulents et provoquent leur pourriture [Kucharek & Mitchell, 2000]. Les symptômes des Pythioses sont aussi divers que sévères. Dans la majorité des cas, c’est la fonte des semis qui est observée. On distingue deux
souvent aveugle des fongicides. Ce traitement chimique rencontre rapidement ses limites en raison du développement de résistance aux fongicides, de la destruction de l’équilibre microbien et de la phytotoxicité.
La présence dans le sol de microorganismes antagonistes de ces agents pathogènes est une capacité naturelle qui reste non exploitée et la succession des traitements la fait souvent disparaître [Besnard & Davet, 1993].
Parmi les rhizobactéries, les Pseudomonas et les Bacillus ont suscité un grand intérêt. Elles sont connues depuis longtemps pour leur aptitude à réduire l’incidence des maladies racinaires dans certains champs, ainsi qu’à inhiber la croissance d’un grand nombre d’agents phytopathogènes in vitro [Becker & Cook, 1988 ; Nielsen et al., 1998 ; Tambong & Höfte, 2001 ; Dorrance et al., 2004]. Cette capacité d’inhibition peut se faire selon plusieurs mécanismes incluant la production d’une large gamme de métabolites antagonistes et de sidérophores [Gurusiddaiah et al., 1986 ; Fukui et al., 1994 ; Buysens et al., 1996 ; Tambong & Höfte, 2001 ; Chin-A-Woeng et al., 2003 ; Sunish Kumar et al., 2005].
La lutte par des antagonistes microbiens du sol semble être une solution à la fois élégante et respectueuse de l’environnement. Elle répond aux exigences économiques, toxicologiques et écologiques. Cette forme de bioprotection consiste en l’utilisation de microorganismes pouvant contrer la croissance des agents pathogènes et par conséquent l’atteinte de la plante. Des études dans ce sens ont mené à des résultats satisfaisants. Elles déterminent des antagonistes efficaces pouvant bloquer le développement du pathogène et parfois même stimuler la croissance des plantes hôtes.
Il ressort de tout ce qui précède, que les Oomycètes constituent un matériel de choix pour de nombreuses études tout en sachant qu’au Maroc, et jusqu’à présent, aucune étude n’a été rapportée en ce qui concerne ces microorganismes.
Ainsi, nous nous sommes proposés:
- dans la première partie de ce travail, de caractériser quelques Oomycètes du barrage Sidi Mohammed Ben Abdellah (SMBA), en effectuant leur isolement, leur identification et l’analyse de certains des métabolites secondaires des isolats les plus représentatifs.
- et dans la deuxième partie, d’étudier le pouvoir pathogène des Pythium identifiés vis à vis de la luzerne et d’établir une stratégie de lutte contre les Pythioses grâce à des bactéries telluriques.
Première partie
Caractérisation de quelques Oomycètes
du barrage SMBA
INTRODUCTION
La Classe des Oomycètes a depuis longtemps constitué un challenge pour les chercheurs taxonomistes. Les analyses ultra-structurales, biochimiques et moléculaires récentes ont démontré l’inexistence d’une relation phylogénétique entre ces microorganismes et les Eumycètes [Dick, 2001]. Les Oomycètes, en effet, sont caractérisés par un mycélium diploïde, une paroi cellulaire constituée de β-glucan et de cellulose, des gamètes femelles
(oosphères) et mâles (anthéridies) non flagellées formées dans des gamétocystes ou se déroule la méiose, une reproduction sexuée par oogamie et des zoospores avec deux flagelles dissemblables dont un porte des mastigonèmes tubulaires tripartites (TTH’s). Cette dernière caractéristique constitue une des principales raisons qui ont introduit les Oomycètes dans le règne des Straménopiles [Dick, 2001].
Plusieurs de ces champignons straménopiles vivent en saprophyte dans les milieux aquatiques et jouent un rôle important dans la décomposition et le recyclage de la matière organique, d’autres sont de redoutables parasites qui ont causé d’énormes pertes soit en détruisant les cultures [Hendrix & Campbell, 1973 ; Forbes & Davet, 1990 ; Lee & Hoy, 1992 ; Moorman
et al., 2002 ; Sanchez & Gallego, 2002 ; Abdelzaher, 2004 ; Polashock et al., 2005] ou en
attaquant les animaux d’élevage [Sati, 1991 ; Czeczuga et al., 2002 ; Kiziewicz, 2004 ; Rivierre et al., 2005]. En outre, il a été récemment démontré qu’une espèce du genre Pythium,
P. insidiosum est l’agent responsable de plusieurs insidioses humaines signalées dans
différents pays notamment l’Australie, le Brésil, les Etats Unis, Haïti et la Malaisie suites à des activités associées au milieu aquatique tel la natation et la pêche [De Moraes Gimenes Bosco et al., 2005].
Ainsi, plusieurs équipes se sont intéressées à l’étude des Oomycètes dans les écosystèmes aquatiques [Dick, 1971 ; Park et al., 1978 ; Khulbe, 1980 ; Hallett & Dick, 1981 ; Paul, 1984 ; El-Hissy et al., 2001 ; Paul & Steciow, 2004]. Ces travaux ont porté sur l’isolement puis l’identification des espèces isolées en se basant principalement sur leur caractérisation morphologique [Plaats-Niterink, 1981 ; Johnson et al., 2002]. Toutefois, les différentes difficultés rencontrées au cours de cette dernière et qui ne se limitent pas au temps et au
mais également de fournir les données nécessaires pour les études phylogénétiques [Lévesque
et al., 1994 ; Lévesque & De Cock, 2004 ; Tambong et al., 2006].
Malgré l’importance des Oomycètes aquatiques, aucune étude n’a été faite en ce qui concerne ces microorganismes au Maroc. Dans cette optique, nous avons choisi de combler en partie cette lacune.
Aussi, la première partie de ce travail sera consacrée à l’isolement et à l’identification de quelques Oomycètes du barrage Sidi Mohammed Ben Abdellah (SMBA). Identification qui sera effectuée en premier d’une manière classique par la caractérisation morphologique des isolats puis complétée par une analyse moléculaire et l’étude d’un aspect du métabolisme secondaire notamment les composés volatiles chez les isolats les plus représentatifs.
Chapitre 1 : Isolement et caractérisation morphologique
INTRODUCTION
La présence et la distribution des Oomycètes dans les écosystèmes aquatiques ont fait l’objet d’un grand nombre de travaux notamment ceux de Roberts [1963], Dick [1971], Park et al. [1978], Hallett & Dick [1981] et El-Hissy et al. [2001]. Les techniques de détection et d’isolement utilisées ont été principalement l’analyse des substrats naturellement infestés, l’étalement sur des milieux gélosés et l’utilisation de différents appâts pour le piégeage des zoospores.
La caractérisation morphologique des isolats en vue de les identifier est une des étapes les plus délicates dans l’étude des Oomycètes. En effet, les différentes clés utilisées reposent sur l’examen microscopique des structures de reproduction asexuée et sexuée et sur un grand nombre de critères taxonomiques tel que le type, la forme et la taille des sporocystes, des zoospores, des oogones, des anthéridies et des oospores [Fitzpatrick, 1930 ; Waterhouse, 1967 ; Seymour, 1970 ; Plaats-Niterink, 1981 ; Dick, 1990 ; Khulbe, 2001 ; Johnson et al., 2002]. Ces structures sont difficiles à mettre en évidence et nécessitent beaucoup de temps et de patience. Ainsi, dans plusieurs études, l’identification est bloquée au niveau du genre [Roberts, 1963 ; Park et al., 1978 ; Hallett & Dick, 1981 ; El-Hissy et al., 2001].
Selon ces études, la plupart des isolats appartiennent aux familles des Saprolegniacées (ordre des Saprolegniales, communément appelé « water mold ») et des Pythiacées (ordre des Peronosporales). La première est considérée comme l’une des plus primitives familles des Oomycètes. Elle est caractérisée par des filaments de grand diamètre, des sporocystes cylindriques et terminaux, deux types de zoospores (primaires et secondaires) et des oogones avec une à plusieurs oosphères [Fuller & Jaworski, 1987; Johnson et al., 2002]. Les Pythiacées, par contre, possèdent des filaments fins, des zoospores secondaires formées à l’intérieur des sporocystes ou au niveau de vésicules externes et des oogones avec une seule oosphère [Plaats-Niterink, 1981 ; Fuller & Jaworski, 1987].
L’abondance des Oomycètes d’un écosystème aquatique dépend des lieux et des périodes d’échantillonnage. Certains auteurs, ont trouvé que les Oomycètes sont plus fréquemment isolés des rives que du centre des lacs [Park et al., 1978]. D’autre part, Hallett & Dick [1981]
1- Isolement et purification :
1-1- Choix et localisation de la station d’étude :
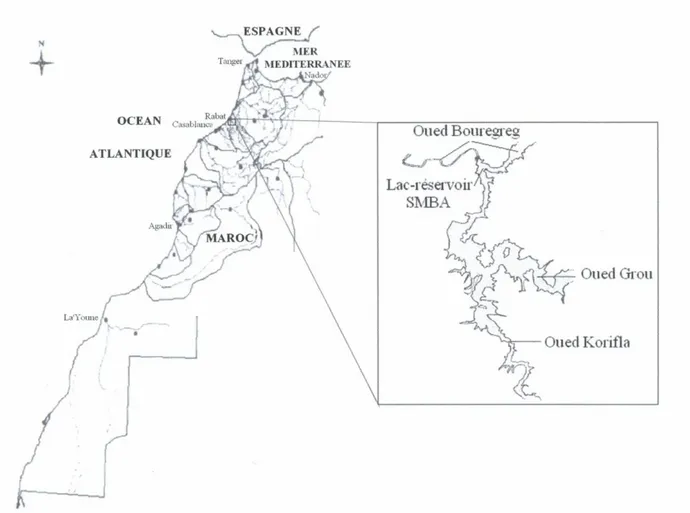
L’échantillonnage a été effectué dans la retenue du barrage Sidi Mohammed Ben Abdellah (SMBA), construite sur la rivière de Bou Regreg prés de Rabat (fig. 1). Ayant une hauteur sur fondation de 98m, une longueur en crête de 340m, une capacité de 500 millions de m3, une surface du bassin versant de 9500 Km² et une surface normale de 32 Km² ; c’est l’une des plus importantes retenues du Maroc. Depuis sa mise en service en 1974, elle alimente en eau potable les villes de Casablanca, Rabat et Kénitra [ONEP, 1996].
Cette station d’étude a été choisie essentiellement pour son importance et sa proximité de notre laboratoire.
1-2- Echantillonnage :
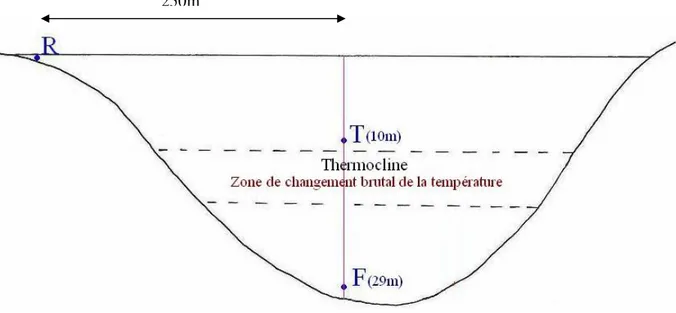
Nous avons effectué 9 échantillonnages répartis sur les quatre saisons de l’année. Chaque échantillonnage comprend trois points de prélèvement. Au total, nous en avons réalisé 27. Les points de prélèvement sont (fig. 2):
Le point R : situé au niveau du rivage, il est riche en débris et en matière organique.
Le point T : situé au centre du lac à environ 250m du rivage et à une profondeur de 10m
(au-dessus de la thermocline)
Le point F : situé également au centre du lac, à une profondeur de 29m (au-dessus du fond)
Les échantillons d’eau sont prélevés dans des flacons de verre stérilisés puisstockés dans des glacières et transportés au laboratoire pour analyse.
Au niveau du rivage (R), en plus des échantillons d’eau, nous avons également prélevé de la
Figure 1 : Situation géographique de la retenue du barrage Sidi Mohammed Ben Abdellah.
Figure 2 : Schéma représentant les trois points de prélèvement ; (R) point situé au niveau du
rivage, (T) point situé au-dessus de la thermocline, (F) point situé au-dessus du fond.
1-3- Etude des Oomycètes de la retenue :
1-3-1- Isolement des Oomycètes :
L’isolement des Oomycètes a été effectué à partir de l’eau brute directement ramenée du barrage et également à partir de l’eau concentrée que se soit par centrifugation ou par filtration sur membrane.
1-3-1-1- Eau brute :
Les échantillons d’eau, ramenés du barrage, sont directement traités par les techniques d’isolement suivantes:
a) Etalement sur milieux gélosés :
Un ml de chaque échantillon est étalé sur différents milieux gélosés, PCA (Potato Carrot Agar), CMA (Corn Meal Agar) et PDA (Potato Dextrose Agar, Difco). Les compositions des deux premiers milieux sont donnés dans l’annexe 1.
b) Surfusion :
Des portions de 1ml sont pipetées de chaque échantillon et déposées dans des boites de pétri puis elles sont mélangées avec 15ml de PDA bouilli et refroidi à 45°C.[Godfrey & Mehdi, 1982 ; Celio & Padgett, 1989].
c) Technique des appâts :
Les appâts utilisés sont : les graines de chanvres, de sésames, de pin et de cyprès
[Plaats-Niterink, 1981 ; Fuller & Jaworski, 1987]. - Stérilisation des graines:
La stérilisation des graines de sésame, de pin et de cyprès a été réalisée à 121°C pendant 20min. Les graines de chanvres, par contre, ont été bouillies, décortiquées puis divisées en moitiés.
- Mise en culture:
15ml de l’échantillon à étudier sont mis dans une boite de pétri stérile en présence de l’un des graines, préalablement stérilisées, destinées au piégeage des zoospores présentes dans les échantillons. Ces cultures sont examinées au microscope 48 heures après incubation à 20-24°C. Cet examen est suivi régulièrement jusqu’à la colonisation des appâts. Une fois la
1-3-1-2- Concentration des échantillons:
a) Centrifugation :
100 ml d’échantillon d’eau sont centrifugés à une vitesse de 6000t/min pendant 20min. Le culot est prélevé dans 10ml d’eau du barrage. L’échantillon d’eau ainsi concentré est utilisé dans les différentes techniques d’isolement des Oomycètes [Hallett & Dick, 1981].
b) Filtration :
500 ml d’échantillon sont filtrés, à travers des filtres millipores de 0,4µm. Les membranes sont prélevées soigneusement et déposées dans des boites de pétri stériles avec 10ml d’eau distillée stérile et quelques graines de l’un des appâts préalablement cités. Les membranes ont été également déposées sur les milieux gélosés [Von Broembsen & Wilson, 1998].
1-3-2- Conservation:
La conservation des Oomycètes est très difficile. Ces microorganismes, à l’opposer des autres champignons, levures, bactéries et actinomycètes, ne donnent pas de bons résultats avec les méthodes usuelles de conservation, à savoir la lyophilisation et la congélation [Smith, 1982 ; Nagai et al., 2005]. Pour remédier à ce problème, nous avons conservé les isolats de deux façons différentes :
1-3-2-1- Conservation sur milieu solide:
Chaque isolat est repiqué sur un milieu riche PDA (Potato Dextrose Agar, Difco). Lorsque la boite est entièrement colonisée, elle est scellée et conservée à 4°C. Les cultures ainsi conservées ne doivent pas dépasser un mois, audela duquel le mycélium meurt.
1-3-2-2- Conservation sur milieu liquide:
Chaque isolat est ensemencé dans un flacon contenant 30ml d’un milieu liquide riche PYG modifié (Peptone Yeast Glucose, annexe 1). Quand l’oomycète est bien développé, le tout est recouvert d’une couche d’huile de paraffine stérile permettant une diffusion très lente de l’oxygène et par conséquent un ralentissement du métabolisme du champignon [Paul, communication personnelle]. Puis, les flacons sont scellés et conservés à 4°C. Cette méthode est plus efficace que la précédente, néanmoins, le contrôle de ces flacons est nécessaire après une période de 3mois afin de s’assurer de la non-contamination et surtout de la viabilité des cultures.
2- Caractérisation morphologique des isolats :
Les isolats ainsi développés sont ensuite caractérisés par des observations macroscopiques et microscopiques [Plaats-Niterink, 1981 ; Fuller & Jaworski, 1987 ; Johnson et al., 2002].
2-1- Observation macroscopique :
Les isolats sont cultivés sur le milieu PCA à 25°C. La croissance journalière est suivie pendant une période allant de 5 jours à 1 mois, selon la vitesse de développement des espèces cultivées, sur un nombre de 10 boites de pétri par isolat. La valeur moyenne de croissance (en mm) de chaque colonie est effectuée toutes les 24 heures. Ces boites sont également observées à l’œil nu et l’aspect des colonies noté [Plaats-Niterink, 1981].
2-2- Observation microscopique :
L’identification des Oomycètes est essentiellement basée sur la caractérisation des structures reproductrices asexuées et sexuées [Plaats-Niterink, 1981 ; Fuller & Jaworski, 1987 ; Johnson
et al., 2002]. L’obtention de ces dernières nécessite la présence de l’eau, indispensable pour la
production des sporocystes et la libération des zoospores. Pour ce, nous avons utilisé la technique des cultures dans l’eau avec deux appâts différents: graines de chanvres et morceaux de gazon.
2-2-1- Culture dans l’eau :
A partir d’une colonie de trois jours on découpe, au niveau du front de croissance du thalle, des boutures de 4mm3 qu’on met dans des boites de pétri stériles contenant 10ml d’eau
Les dessins et les mesures des structures de reproduction asexuée et sexuée sont effectués à divers grossissements. Les résultats que nous présentons sont une moyenne de 50 mesures pour chacune des structures considérées.
L’identification microscopique des isolats a été effectuée à l’aide des clés de détermination de Fitzpatrick [1930], Waterhouse[1967], Seymour [1970], Plaats-Niterink [1981], Dick [1990], Khulbe [2001] et Johnson et al. [2002]. Ces clés reposent sur l’examen des caractères morphologiques des structures asexuées et sexuées.
Les éléments à étudier concernant la reproduction asexuée, sont notamment, le type, la forme et les dimensions des sporocystes ; le mode de libération des zoospores et le diamètre des zoospores enkystées.
La reproduction sexuée, quant à elle, est basée sur : la position des oogones sur le mycélium ; le diamètre des oogones ; le type des parois des oogones ; le diamètre et le type des oospores ; l’épaisseur de la paroi des oospores (pour le genre Pythium) ; le nombre des oospores par oogone ; le nombre des anthéridies par oogone et le point d’origine de l’anthéridie par rapport à l’oogone.
Ces structures sont difficiles à obtenir. L’addition de facteurs physiques et chimiques s’avère nécessaire pour stimuler la reproduction sexuée de certaines souches [Ko, 1998 ; Wu et al., 2003], notamment, l’extrait du sol (annexe 1) pour les cultures dans l’eau [Johnson et al., 2002] ; les stérols exogènes dans les milieux solides [Bazireau-Galland, 2000] ; le maintien des cultures à faibles températures (5-10°C) [Hallett & Dick, 1981] et la confrontation des souches du même type dans les milieux solides (PCA et CMA) [Plaats-Niterink, 1981].
Colonie de 3 jours
Une moitié de graine de chanvre
Boutures
+ 10 ml d’eau distillée stérile
Fragment de gazon stérile
Incubation à température ambiante pendant quelques jours
Formation d’une colonie autour des appâts
Figure 3 : Technique des cultures dans l’eau
Changement quotidien de l’eau
Bouture prélevée à partir du front du thalle
Cet inventaire n’est certainement pas exhaustif et ne dévoile pas la liste complète des espèces, en raison de nombreuses difficultés pratiques qui résident dans les techniques d’échantillonnage, d’isolement, de culture et de conservation qui font que certaines espèces ont échappé à l’isolement et à l’identification.
Les observations macroscopiques et microscopiques des souches isolées au niveau des trois points de prélèvements ; à savoir les points (R), (T) et (F), nous ont permis de faire une première sélection. 60% des souches sont des non-Oomycètes isolées principalement par les méthodes classiques à savoir l’étalement en surface et la surfusion. Et 40% des isolats sont des Oomycètes appartenant à deux familles, les Pythiacées et les Saprolegniacées.
La majorité des Oomycètes est isolée du rivage (R) à l’aide des graines de chanvre (tableau1). La plupart des espèces isolées appartiennent au genre Pythium avec une nette dominance des
Pythium à sporocystes filamenteux (tableaux 1 et 2). Les Saproleniacées isolées sont Achlya, Dictyuchus et Saprolegnia représentées chacune par une seule espèce. L’espèce appartenant
au genre Saprolegnia (S-1) est la plus fréquente, isolée 9 fois de suite et à partir des trois points de prélèvement.
En ce qui concerne la variation saisonnière, les Oomycètes isolés présentent deux pics d’abondance correspondant à deux saisons l’hiver et l’été avec respectivement 16 et 15 isolats (tableau 1).
Hors, en considérant séparément les deux familles, nous remarquons que pour les Saprolegniacées la saison hivernale est la plus importante (tableau1). En effet, Achlya et
Dictyuchus n’ont été isolés qu’en hiver. Concernant Saprolegnia, bien qu’elle soit isolée
Tableau 1 : La distribution spatiale et saisonnière des isolats et les appâts qui les ont piégés : Points de prélèvement Saisons
Isolats
R T F Eté Aut Hiv Pri
Nombre Appâts Achlya ++++ - - - - +++ + 4 Graines de chanvre et
graines de sésame
Dictyuchus ++ - - - - ++ - 2 Graines de chanvre
Pythium 1 Pythium 2 Pythium 3 Pythium 4 Pythium 5 Pythium 6 Pythium 7 Pythium 8 Pythium 9 Pythium 10 Pythium 11 Pythium 12 Pythium 13 Pythium 14 Pythium 15 Pythium 16 Pythium 17 Pythium 18 Pythium 19 Pythium 20 Pythium 21 Pythium 22 +++ + +++ ++ ++ ++ + + + + + + + + + + - + + + + + - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - + - - - - - - + - ++ ++ ++ + + + + + + - - - - - - - - - - + - - - - - - - - - - - + - + - - - - - - - + - ++ - - - - - - - - - - + - - - - - - + + + - + - - - - - - - - - - - - + + + + + - - 3 1 3 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de chanvre Graines de sésame Graines de chanvre Graines de cyprès Graines de pin Graines de chanvre Graines de chanvre Graines de chanvre Saprolegnia ++++ ++ ++ + ++ + +++ ++ + 9 Graines de chanvre et graines de sésame Oomycètes 40 2 2 15 4 16 9 44
R: Rivage, T:Thermocline, F: Fond ; Aut: automne, Hiv: hiver, Pri: printemps.
Pythium 4 Pythium 5 Pythium 6 Pythium 7 Pythium 8 Pythium 9 Pythium 10 Pythium 11 Pythium 12 Pythium 13 Pythium 14 Pythium 15 Pythium 16 Pythium 17 Pythium 18 Pythium 19 Pythium 20 Pythium 21 Pythium 22 Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux Filamenteux
En revanche, pour le genre Pythium, famille des Pythiacées, ce sont les prélèvements effectués pendant les saisons chaudes, principalement l’été puis le printemps, qui présentent le plus grand nombre d’isolats.
Pour l’étude et l’identification des souches, nous avons retenu les espèces qui ont été isolées plus d’une fois et qui ont l’aptitude de former des structures reproductrices.
Ainsi, les souches qui ont été sélectionnées pour la description morphologique sont : Pythium
diclinum (P-1), P. middletonii (P-3), P. torulosum (P-4) ; Saprolegnia longicaulis (S-1) ; Dictyuchus pseudodictyon (S-2) et Achlya abortispora (S-3).
2- Identification et taxonomie des espèces isolées:
2-1- Pythiacèes:Les trois espèces de Pythium, famille des Pythiacèes, ont été identifiées selon les clés taxonomiques de Plaats-Niterink [1981]. En effet, dans sa monographie du genre Pythium, Plaats-Niterink a subdivisé les espèces en trois groupes : espèces à oogones à paroi lisse, espèces à oogones à paroi ornementée et espèces hétérothalliques ou asexuées (ne formant pas d’oogones ni en culture simple ni en culture double avec les espèces compatibles). La morphologie des sporocystes est ensuite prise en compte pour séparer les espèces à l’intérieur de ces groupes. D’autres caractéristiques sont considérées pour une description complète à savoir :
- Les dimensions des sporocystes et des zoospores enkystées. - Les dimensions des oogones.
- Le type de l’oogone unique ou en série, la forme sphérique ou allongée et la position terminale ou intercalaire.
- Les dimensions et les types des oospores, plérotiques (remplissant totalement l’oogone) ou aplérotiques (ne remplissant pas totalement l’oogone).
- La taille de la paroi des oospores.
- La morphologie de l’anthéridie, qui est un critère difficile à utiliser dans l’identification car elle disparaît souvent après la fécondation. Elle peut être monocline ou dicline selon qu’elle est portée par le même filament que l’oogone ou non. Parfois c’est la branche oogoniale qui se différencie en anthéridie et dans ce cas elle est hypogyne. Elle est dite sessile lorsqu’elle ne possède pas de pédoncule.
- Enfin la croissance et l’aspect des colonies de Pythium développés sur PCA à 25°C sont également considérés.
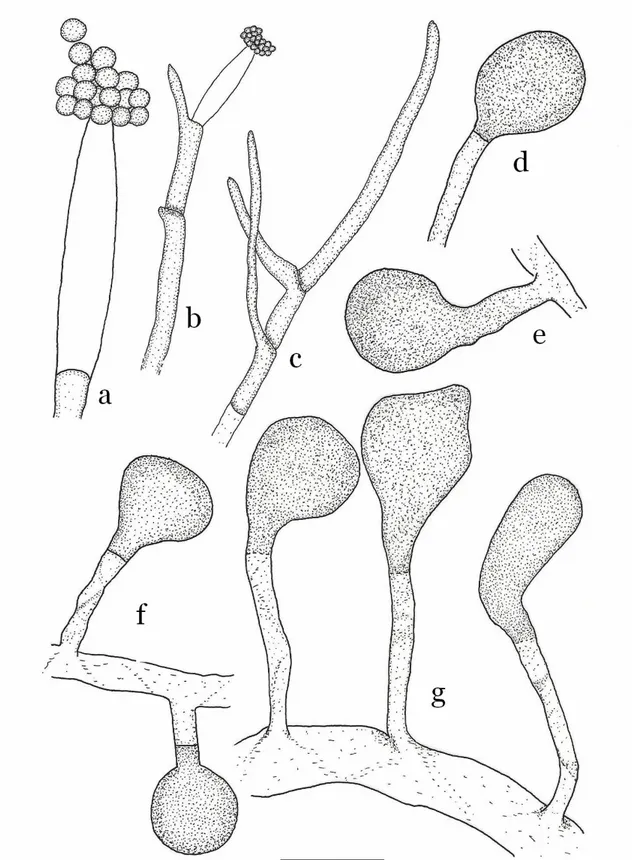
10µm de largeur. Les vésicules et les zoospores sont abondamment produites aux températures 18-24°C. Les zoospores enkystées mesurent entre 6,5 et 9µm de diamètre (fig.4, c ; pl.1, b).
Les oogones sont sphériques ou subsphériques à paroi lisse, en position terminale (fig.4, f) ou intercalaire (fig.4, e ; pl.1, b), parfois elles sont en série de 2 à 4 oogones formant de courtes chaînes (fig.4, k ; pl.1, e et f). Ces gamétocystes femelles ont un diamètre de 18 à 24µm (moy.21µm). Les anthéridies sont généralement diclines (fig.4, h-j ; pl.1, c et d) rarement monoclines (fig.4, g), terminales mais peuvent être en position intercalaire. Il y a une à deux cellules anthéridiales par oogone, leur dimension est de ~13×7µm. Les oospores sont uniques, sphériques à paroi lisse, aplérotiques (fig.4, m et n) et parfois plérotiques (fig.4, l). Elles mesurent entre 16 à 21µm (moy.18µm). La paroi des oospores est de 1 à 3µm.
Se basant sur l’analyse comparative de l’ensemble de ces caractères macroscopiques et microscopiques avec les clés de déterminations du genre Pythium [Plaats-Niterink, 1981 ; Dick, 1990], nous avons identifié la souche P-1 comme Pythium diclinum [El Androusse et
Figure 4 : Pythium diclinum ; (a) sporocyste filamenteux ; (b) projections sous forme de doigts ;
(c) zoospores enkystées ; (d) zoospores en germination ; (e) oogone intercalaire ; (f) oogone terminale ; (g) oogone intercalaire avec une anthéridie monocline ; (h) oogone terminale avec deux anthéridies diclines ; (i, j) oogones et anthéridies diclines (une anthéridie par oogone) ; (k) oogones en chaîne ; (l) oospore plérotique ; (m, n) oospores aplérotiques.
Planche 1 : Pythium diclinum ; (a) sporocyste filamenteux avec des projections sous forme de
doigts ; (b) oogone intercalaire et une zoospore enkystée ; (c, d) oogones et anthéridies ; (e, f) oospores plérotiques et aplérotiques en série.
Echelle : Barres = 10 µm
a
b
c
d
2-1-2- Pythium middletonii:
Sur PCA, les colonies de « P-3 » sont rases avec un aspect chrysanthémique. La vitesse
moyenne de cette souche à 25°C est de 13,75 ± 0,41 mm/j.
Le mycélium est hyalin et bien ramifié, les filaments principaux peuvent avoir jusqu’à 7µm de diamètre. Les sporocystes sont généralement limoniformes ou ovoïdes (fig.5, a ; pl.2, a et b), parfois sphériques et globuleux, en position terminale (fig.5, c ; pl.2, a et b) ou intercalaire (fig.5, b), 23-40 × 15-30µm (moy. 28×23µm). A maturité, les sporocystes forment des tubes de décharge courts au bout desquels apparaissent les vésicules zoosporiques (fig.5, c ; pl.2, c et d). Les zoospores libérées puis enkystées mesurent entre 9 et 11µm de diamètre (fig.5, d). Dans le sporocyste vide se développe un filament et forme un nouveau sporocyste, c’est la prolifération interne (fig.5, b).
Les oogones sont sphériques à paroi lisse, en position intercalaire (fig.5, e-g ; pl.2, e) et parfois terminale. Leur diamètre varie de 20 à 30µm (moy. 22,6µm). Les anthéridies sont monoclines, portés par des pieds (fig.5, g et h) ou émergeant directement de la base des oogones (fig.5, f ; pl.2, f), hypogynes (fig.5, e1) ou diclines (fig.5, e2), une à deux par oogone. Les oospores sont sphériques à paroi lisse, une à deux par oogone, aplérotiques (fig.5, e-h ; pl.2, e) et quelques fois plérotiques. Elles mesurent entre 16,5 à 24µm (moy. 20µm) et ont une paroi de 0,75 à 2µm d’épaisseur.
En tenant compte de la systématique des Pythium adoptée par Plaats-Niterink [1981] et Dick [1990], l’ensemble des caractères culturaux et morphologiques de P-3 suffisent à identifier l’espèce P. middletonii.
Figure 5 : Pythium middletonii; (a) sporocyste limoniforme ; (b) sporocystes limoniformes
présentant une prolifération interne ; (c) sporocyste terminal vide ; (c1) tube de décharge court ; (c2) vésicule zoosporique avec des zoospores partiellement différenciées ; (d) Zoospores enkystées ;
(e) Oogone intercalaire avec deux anthéridies ; (e1) anthéridie hypogyne ; (e2) anthéridie dicline ; (f) Oogone intercalaire avec une anthéridie monocline s’élevant de la base de l’oogone ; (g) Oogone intercalaire avec une anthéridie monocline ; (h) Oospores aplérotiques (deux par oogone) avec une anthéridie monocline.
a
b
c
d
e
f
Planche 2 : Pythium middletonii; (a, b) sporocystes limoniformes; (c, d) vésicules zoosporiques ;
(e) oogone intercalaire avec une anthéridie dicline ; (f) Oogone avec une anthéridie monocline s’élevant de la base de l’oogone.
Echelle : b et d : barre
a
= 25µm ; a et c : barrea
= 50µm.e et f : barre
b
= 20µm.a
zoospores sont produites abondement dans l’eau (pl.3, b-d). Les zoospores enkystées mesurent entre 6.5 et 9µm de diamètre.
Figure 6 : Pythium torulosum ; (a) sporocyste filamenteux enflé; (b) oogone avec deux
anthéridies monoclines ; (c, d) oogones terminales avec des anthéridies monoclines (une anthéridie par oogone ; (e) oogone intercalaire avec une anthéridie monocline ; (f-i) oospores plérotiques.
Les oogones sont terminales (fig.6, b-d) parfois intercalaires (fig.6, e), sphériques avec un diamètre compris entre 12 et 20µm (moy. 17µm). La paroi de l’oogone est lisse et mince. Les anthéridies sont monoclines, généralement s’élevant du pied de l’oogone (fig.6, b-d). Une à deux anthéridies par oogone.
Les oospores sont sphériques à paroi lisse, uniques et plérotiques (fig.6, f-i). Elles mesurent entre 10 et 19µm (moy.15µm) et ont une paroi de 1 à 2µm d’épaisseur.
Par analogie aux descriptions proposées par Plaats-Niterink [1981] et Dick [1990], ces diverses observations nous ont permis d’identifier « P-4 » comme P. torulosum.
a
b
c
d
Planche 3: Pythium torulosum ; (a) sporocyste filamenteux avec des structures gonflées ;
(b) vésicule zoosporique jeune ; (c) les zoospores sont complètement différenciés à l’intérieur de la vésicule ; (d) eclatement de la vésicule et libération des zoospores.
Pour la première espèce (S-1), le sporocyste libère des zoospores mobiles qui se dispersent immédiatement après leur émission, ce type de décharge est caractéristique du genre
Saprolegnia (décharge saprolegnoïde).
Pour la deuxième espèce (S-2), chaque zoospore s’échappe du sporocyste par une pore individuelle, ce qui donne au sporocyste une fois vide l’aspect d’une toile d’araignée caractéristique du genre Dictyuchus (décharge dictyuchoïde).
Enfin pour la troisième espèce (S-3), les zoospores s’enkystent immédiatement après leur émission et forment une masse de spores à l’orifice des sporocystes, caractéristique du genre
Achlya (décharge achlyoïde).
La deuxième étape est la description complète des structures de reproduction notamment : - Les formes et les dimensions des sporocystes
- Le mode de rajeunissement des sporocystes - Le diamètre des zoospores enkystées - La forme des chlamydospores - La forme et le diamètre des oogones
- La position de l’oogone par rapport au mycélium (terminale, latérale ou intercalaire) - Le type de la paroi des oogones (lisse ou ornementée)
- La présence ou l’absence des cavités dans la couche interne de la paroi des oogones - La forme et la taille des pieds portant les oogones (droits, courbés, en spirale…) - La présence ou l’absence des anthéridies
- La morphologie des branches anthéridiales (comme pour les Pythium les anthéridies sont monoclines ou diclines selon qu’elles proviennent du même filament que les oogones ou non. En plus chez les Saprolegniacées, les anthéridies peuvent émerger à partir du pied
portant l’oogone et dans ce cas, les anthéridies sont dites androgynes). - Le nombre des oosphères par oogone
- Le degré de maturité des oosphères (les oosphères peuvent mûrir et se transformer en oospores ou se désintégrer et avorter)
- Le type des oospores (les oospores peuvent être centriques, subcentriques ou eccentriques. Elles sont centriques lorsque l’ooplaste est en position centrale et qu’il est entouré uniformément par une ou deux couches de globules lipidiques. Elles sont subcentriques lorsque l’ooplaste est comprimé d’un côté par un plus grand nombre couches de globules lipidiques que de l’autre côté. Et enfin, elles sont eccentriques lorsque l’ooplaste est situé latéralement à l’un des côtés de l’oospore et que le cytoplasme et les globules lipidiques sont rassemblées de l’autre côté).
2-2-1- Saprolegnia longicaulis:
La souche « S-1 » se développe très bien dans l’eau ainsi que sur le milieu solide. Sur PCA,
cette souche forme des colonies rases presque invisibles. Sa croissance moyenne à 25°C est de 17,5 ± 0,7mm/j.
Le mycélium de « S-1 » est dense et légèrement ramifié. Les filaments principaux sont épais,
ils ont un diamètre moyen de 22µm.
Les sporocystes sont cylindriques (fig.7, a), fusiformes, droits ou courbés (pl.4, a), généralement terminaux mais parfois intercalaires. Chaque sporocyste est muni d’une à deux papilles d’émission qui peuvent être apicales ou latérales (fig.7, b et c). Comme pour la plupart des Saprolegnia, les sporocystes sont rajeunis par prolifération interne, le nouveau sporocyste émerge à l’intérieur du vieux sporocyste vide (fig.7, e ; pl.4, a). Les sporocystes de la souche « S1 » mesurent entre 95-600 × 15-50µm (moy. 225 × 30µm). Les zoospores sont libérées les unes après les autres et se mettent à nager immédiatement après leur émission. Les zoospores enkystées mesurent entre 10 et 12,5µm (fig.7, d ; pl.4, d). Les chlamydospores sont très abondantes et ont différentes formes (fig.7, f-k ; pl.4, b et c). Elles peuvent être sphériques, piriformes, cylindriques, lobées ou très irrégulières, terminales ou intercalaires, simples ou en série, parfois elles se convertissent en oogones (fig.8, c).
Les oogones sont peu fréquentes, terminales ou latérales (fig.8, a et b ; pl.4, e et f), rarement intercalaires, sphériques (fig.8, a ; pl.4, f) ou piriformes (fig.8, b ; pl.4, e), elles ont un diamètre compris entre 50 et 90µm (moy. 68µm). Leurs parois sont lisses et peuvent présenter au niveau de la couche interne des discontinuités (fig.8, a et b ; pl.4, e et f).
Figure 7 : Saprolegnia longicaulis. Reproduction asexuée ; (a) sporocyste jeune, (b) sporocyste
mature, (c) sporocyste vidé, (d) zoospores enkystées, (e) sporocystes renouvelés par prolifération interne, (f) chlamydospores piriformes en série, (g) chlamydospores renouvelées par prolifération interne, (h-k) Différentes sortes et formes de chlamydospores.
Figure 8 : Saprolegnia longicaulis. Reproduction sexuée ; (a, b) oogones latérales immatures
portées par des pieds de différentes longueurs , (c) chlamydospore irrégulière convertie en oogone, (d) oogone latérale piriforme remplie totalement par les oosphères, (e) oogone latérale sphérique avec des oospores centriques et subcentriques, la paroi interne de l’oogone présente des discontinuités.
c
d
e
f
g
h
Planche 4 : Saprolegnia longicaulis : (a-d) Reproduction asexuée ;(a) deux sporocystes cylindriques
courbés l’un présente une prolifération interne ; (b) chlamydospore irrégulière ; (c) chlamydospore
présentant une prolifération interne ; (d) zoospores enkystées ; (e-h) Reproduction sexuée ;
(e) oogone latérale immature ; (f) oogone latérale mature ; (g) oospores remplissant l’oogone ; (h) oospores centriques (à droite) et subcentriques (à gauche).
Les oogones sont portées par des pieds épais, droits ou courbés, non ramifiés (fig.8, a, b et e ; pl.4, e et f). La longueur de ces derniers est très variée, elle peut atteindre jusqu’à 350µm. Les oospores sont subcentriques, centriques, sphériques à elliptiques (fig.8, e ; pl.4, f et g). Elles sont au nombre de 5-30 par oogone, et peuvent occuper totalement l’oogone (fig.8, e ; pl.4, f et g), leur diamètre est compris entre 17 et 28µm (moy. 23µm). Les anthéridies sont rares et, lorsqu’elles sont présentes, elles disparaissent rapidement. Elles sont diclines, parfois monoclines, ramifiées. Les cellules anthéridiales sont simples ou branchées, attachées latéralement aux oogones.
En référence aux ouvrages de taxonomie du genre Saprolegnia [Seymour, 1970 ; Khulbe, 2001 ; Johnson et al., 2002] et en tenant compte des descriptions de plusieurs nouvelles espèces récemment signalées [Inaba & Tokumasu, 2002 ; Steciow, 2001b, 2002, 2003 ; Steciow & Eliades, 2002a ; Paul & Steciow, 2004], l’ensemble des caractères décrits ci-dessus nous ont permis d’identifier la souche S-1 en tant que Saprolegnia longicaulis.
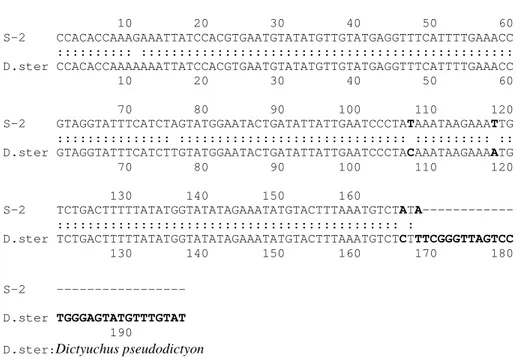
2-2-2- Dictyuchus pseudodictyon:
La souche « S-2 » se développe peu dans l’eau et sur les milieux solides. Sur PCA, les colonies sont rases avec un aspect radial, leur croissance moyenne à 25°C est de 3,64 ± 0,38mm/j.
Le mycélium est dense et ramifié. Les filaments principaux sont relativement épais, et ont un diamètre moyen de 14µm.
Les sporocystes sont cylindriques, fusiformes, droits, parfois courbés (fig.9, a ; pl.5, a-d), renouvelés sympodialement, et mesurent 64-668 × 10-34µm (moy. 370 × 21,4µm). Les zoospores s’échappent à l’extérieur des kystes (fig. 9, a1) par des pores individuels, ce qui donne au sporocyste une fois vide l’aspect d’une toile d’araignée (fig.9, a ; pl.5, d). Parfois les spores germent in situ par des tubes de germination qui traversent la paroi du sporocyste vers l’extérieur (pl.5, b-c). Les zoospores enkystées mesurent entre 9 et 15µm de diamètre. Les chlamydospores sont absentes. Les oogones sont latérales (fig.9, b-e ; pl.6, a), parfois terminales, sphériques ou ovoïdes, généralement groupées par endroit dans le mycélium (pl.6, c), leur diamètre est compris entre 21 et 42µm (moy. 31,6µm). La paroi des oogones est lisse et ne présente pas de discontinuités au niveau de la couche interne.
Figure 9 : Dictyuchus pseudodictyon ; (a) sporocyste avec une structure en toile d’araignée,
(a1) kyste avant l’émission de la zoospore, (a2) kyste vide, (b) oogone latérale enveloppée par une
anthéridie, (b1) androgyne et ramifiée, (c) oogone et anthéridies monoclines et diclines,
(d) oogone et anthéridies androgynes et diclines, (e) oospore eccentrique enveloppée par les anthéridies.
Les pieds porteurs des oogones sont droits (fig.9, b), courbés (fig.9, e) ou irréguliers. Leur longueur est comprise entre 15 et 250µm. Les oospores sont eccentriques (fig.9, e), sphériques, uniques et souvent elles remplissent entièrement l’oogone, leurs diamètres est compris entre 18-36µm (moy. 28µm).
Les anthéridies sont androgynes (fig.9, b et d ; pl.6, a), monoclines (fig.9, c et e) ou diclines (fig.9, c et d ; pl.6, b), irrégulières ou tordues, peu à très ramifiées et enveloppent l’oogone (fig.9, b-e ; pl.6, a-d). Les cellules anthéridiales sont simples, larges (pl.6, d), tubulaires ou irrégulières, ramifiées ou lobées.
Selon les clés de détermination du genre Dictyuchus proposées par Khulbe [2001] et Johnson
et al. [2002], les caractères morphologiques décrits ci-dessus nous ont permis d’aboutir à
l’espèce Dictyuchus pseudodictyon.
Planche 5 : Dictyuchus pseudodictyon. Reproduction asexuée ; (a) sporocyste jeune,
(b et c) sporocystes matures avec la germination in situ des spores, (d) sporocyste presque vide avec une structure en toile.
Echelle : a : barre = 80µm ; b,c et d : barre = 50µm.
a
b
2-2-3- Achlya abortispora:
La souche « S-3 » se développe faiblement dans l’eau et sur les milieux solides. Sur PCA, les colonies sont légèrement aériennes et ont un aspect radial, leur croissance moyenne à 25°C est de 7,5 ± 0,45mm/j.
Le mycélium de « S-3 » est dense. Les filaments principaux sont très épais, peu ramifiés et mesurent entre 30-50µm de diamètre.
Les sporocystes sont souvent fusiformes, (fig.10, a et b ; pl.7, b), droits ou courbés. Occupant une position terminale, ils serenouvellent latéralement et mesurent 120-350 × 20-40µm (moy. 280 × 29,7µm).
Planche 6 : Dictyuchus pseudodictyon. Reproduction sexuée ; (a) oogone avec des anthéridies
androgynes et diclines ; (b, c) oogones avec des anthéridies enveloppant l’oogone ; (d) oogone entourée par des cellules anthéridiales.
Echelle : a, b et c : barre = 50µm et d : barre = 30µm.
a
b
Figure 10 : Achlya abortispora; (a et b) les spores sont groupées en amas sphérique à l’orifice
du sporocyste, (c) chlamydospores en série, (d) oogone terminale, (e et f) oogones latérales, (g) oogones latérales de différentes formes.
Figure 11 : Achlya abortispora; (a et b) : oogones munies d’appendices, (c) oogone avec des
anthéridies androgynes, (d) oogone latérale (contenant une seule oosphère) avec une anthéridie dicline, (e) oogone latérale avec des anthéridies diclines et monoclines.
Planche 7 : Achlya abortispora; (a et b) libération achlyoïde des zoospores, (c et d) sporocystes
avec la germination in situ des spores, (e) chlamydospores cylindriques en série, (f) chlamydospores intercalaires désarticulées , (g) chlamydospore irrégulière, (h) zoospores
enkystées et en germination à l’intérieur du sporocyste.
Echelle : a, b, c et e : barre = 200µm, d, f et g : barre = 80µm, h : barre = 25µm.
a
b
c
d
e
f
Planche 8 : Achlya abortispora; (a et b) oogones terminales munies de deux appendices,
(c) oogones intercalaires, (d) oogone terminale avec une seule oosphère, les anthéridies enveloppent l’oogone en un nœud compliqué, (e) oogone latérale avec des anthéridies diclines et monoclines, (f) oogone immature entourée par des anthéridies diclines, (g) oogone terminale complètement enveloppée par les anthéridies, (h) oosphères avortées ne remplissant pas entièrement l’oogone.
Echelle : a, c et e : barre = 200µm ; d, f et g : barre = 80µm ; b et h : barre = 50µm.