Polymères Amphiphiles :
Des Films Langmuir-Blodgett au Transistor
Thèse
Mariane Ouattara
Doctorat en Chimie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Mariane Ouattara, 2016
iii
RÉSUMÉ
Au cours des 25 dernières années, l’intérêt pour l’utilisation de semi-conducteurs organiques comme couche active dans les transistors à effet de champ (TOECs), à la place du silicium, a crû spectaculairement. L’utilisation de polymères π-conjugués dans ce domaine a grandement entraîné cet essor. Au fil du temps, on observe une amélioration des performances atteintes contribuant à l’émergence de nouveaux matériaux. Par contre, différents paramètres tels que la mobilité et la stabilité demeurent moins impressionnants que ceux des semi-conducteurs à base de matériaux inorganiques. De meilleurs résultats pourraient être obtenus si le transport de charges se faisait sans entraves. Ainsi, une très bonne organisation au sein des matériaux utilisés est nécessaire. Dans cette optique, des polymères conjugués amphiphiles constitués d’unités thiéno [3,4-c] pyrrole-4,6-dione (TPD) ont été synthétisés. En se servant de la technique Langmuir-Blodgett (LB) pour optimiser l’organisation des molécules au sein des films, il a été possible de réaliser des films stables avec des pressions de collapse de 60 mN/m. Les microscopies à angle de Brewster (BAM) et à force atomique (AFM) nous ont démontré l’homogénéité des films à l’interface air-eau (BAM) et une fois transférés sur un substrat solide (AFM). L’orientation a été étudiée principalement par spectroscopie infrarouge à réflexion totale atténuée (ATR). D’autres techniques spectroscopiques comme l’UV-visible, la spectroscopie infrarouge de réflexion absorption par modulation de polarisation (PM-IRRAS) et l’ellipsométrie ont permis de corroborer les résultats obtenus via l’ATR. Les mesures ont permis de confirmer l’obtention de l’orientation préférentielle hors du plan. Pour compléter ce projet, des tests ont été effectués avec des transistors organiques. Des valeurs de mobilité intéressantes de 1,2 × 10-3 cm2/(V.s) ont été enregistrées pour des transistors
v
Summary
Over the past 25 years, interest in the use of organic semiconductors as active layers in field effect transistors (TFTs) instead of silicon has grown dramatically. The use of π-conjugated polymers in this area has greatly driven this growth. Over time, there has been an improvement in performance achieved contributing to the emergence of new materials. However, the performances of organic semiconductors remains inferior that of their inorganic counterpart regarding parameters such as the mobility and stability. Better results could be achieved if the charge transport was done without hindrance. Thus, a very good organiza- tion within the material is needed. In this regard, amphiphilic polymers based on thieno [3,4-c] pyrrole-4,6-dione (TPD) units were synthesized. By using the Langmuir-Blodgett technique (LB) to optimize the organization of the molecules within the films, it was possible to achieve stable films with a collapse pressure of 60 mN/m. Brewster angle (BAM) and atomic force (AFM) microscopies have demonstrated that homogeneous films are obtained at the air-water interface (BAM) and remain so once transferred onto a solid substrate (AFM). Orientation has been studied mainly by attenuated total reflection infrared spectroscopy (ATR). Other spectroscopic techniques such as UV-visible, absorption polarization modulation infrared reflection spectroscopy (PM-IRRAS) and ellipsometry have confirmed the ATR results. Measurements show that molecules adopted an edge-on orientation in the polymer films. To complete this project, organic transistors were fabricated. Interesting mobility values of 1.2 × 10-3 cm2/(V.s) were recorded for organic LB film transistors.
vii
TABLE DES MATIÈRES
Résumé ... iii
Summary ... v
Table des matières ... vii
Liste des tableaux ... xiii
Liste des schémas ... xv
Liste des figures ... xvii
Liste des équations ... xxiii
Liste des symboles et abréviations ... xxv
Remerciements ... xxxiii
INTRODUCTION ... 1
Références ... 7
Chapitre I : Transistors organiques à effet de champ ... 15
I. A.) Semi-conducteur organique ... 15
I. A. 1. Caractère semi-conducteur ... 15
I. A. 2. Conduction dans un semi-conducteur organique ... 16
I. A. 2. a) Polaron ... 16
I. A. 2. b) Conduction par saut ... 17
I. A. 3. Les différents types de matériaux semi-conducteurs ... 18
I. B.) Les transistors organiques à effet de champ ... 20
I. B. 1. Architecture des transistors organiques ... 20
I. B. 2. Fonctionnement des transistors organiques ... 23
I. C.) Polymères conjugués ... 27
I. C. 1. Principales méthodes de déposition des polymères conjugués ... 27
I. C. 2. État de l’art des polymères de type p pour les transistors organiques ... 30
Références ... 33
Chapitre II : Concepts généraux des techniques expérimentales ... 41
II. A.) Les monocouches moléculaires à l’interface air-eau ... 41
II. A. 1. Historique ... 41
II. A. 2. Films de Langmuir ... 44
viii
II. A. 2. b) Définition du caractère amphiphile ... 45
II. A. 2. c) Mesure de la pression de surface ... 46
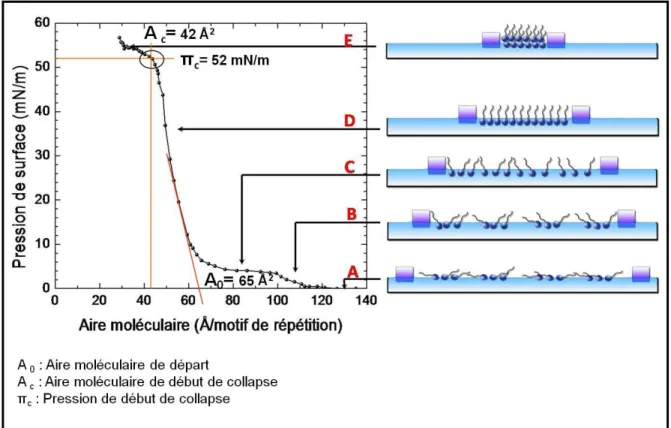
II. A. 2. d) Isotherme de compression ... 47
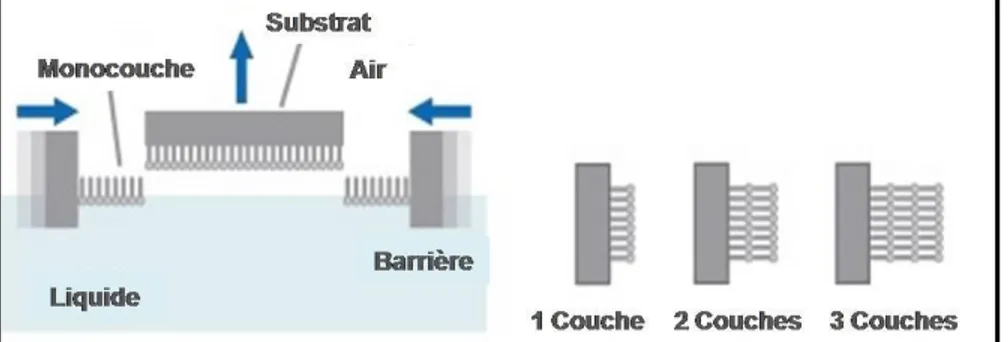
II. A. 2. e)Transfert de monocouches ... 50
II. a. 3. Intérêt des films Langmuir-Blodgett ... 54
II. B.) Microscopie à angle de Brewster (BAM) ... 55
II. B. 1. : Historique ... 55
II. B. 2. : Appareillage et Principe de fonctionnement du Microscope à angle de Brewster ... 57
II. C.) Spectroscopie infrarouge ... 65
II. C. 1. : Spectroscopie infrarouge à réflexion totale atténuée (IR-ATR) ... 65
II. C. 1. a) Généralités ... 65
II. C. 2. b) Détermination de l’orientation moléculaire ... 69
II. C. 2. : Spectroscopie infraRouge de réflexion absorption par modulation de polarisation (PM-IRRAS) ... 71
II. D.) Ellipsométrie... 75
II. D. 1. : Historique ... 75
II. D. 2. : Appareillage et fonctionnement ... 75
Références ... 79
Chapitre III : Méthodes expérimentales ... 85
III. A.) Produits chimiques ... 85
III. B.) Résonance magnétique nucléaire (RMN) ... 85
III. C.) Spectrométrie de masse haute résolution (SMHR) ... 85
III. D.) Chromatographie d'exclusion stérique (SEC) ... 86
III. E.) Diffraction des rayons X ... 86
III. F.) Calorimétrie différentielle à balayage (DSC)... 87
III. G.) Analyse thermogravimétrique (TGA) ... 87
III. H.) Enregistrement des isothermes π-A... 87
III. H. 1. Appareillage ... 87
III. H. 2. Procédure de nettoyage du bain et de la verrerie ... 88
III. H. 3. Les isothermes π-A ... 90
III. H. 4. Transfert ... 91
III. I.) Observation des films Langmuir par microscope à angle de Brewster (BAM) ... 91
ix
III. J.) Spectroscopie infrarouge à réflexion totale atténuée (IR-ATR) .... 92
III. K.) Spectroscopie infrarouge de réflexion absorption par modulation de polarisation (PM-IRRAS) ... 92
III. L.) Spectroscopie d'absorption UV-visible ... 92
III. M.) Observation des films Langmuir-Blodgett par AFM ... 93
III. N.) Fabrication des transistors organiques à effet de champs (TOECs) ... 93
III. N. 1. Fabrication des TOECs ... 93
III. N. 2. Caractérisation des TOECS ... 93
III. O.) Caractérisation des films des transistors organiques à effet de champs (TOECs) ... 94
III. O. 1. Mesure de l’angle de contact avant dépôt du film ... 94
III. O. 2. Ellipsométrie ... 94
III. O. 3. Observation des films LB par AFM ... 95
Chapitre IV : Synthèse de polymères amphiphiles à base d’unités thieno[3,4-c]pyrrole-4,6-dione ... 99
IV. A.) Introduction ... 99
IV. B.) Synthèses des monomères ... 99
IV. C.) Synthèse des polymères ... 104
IV. D.) Caractérisation des polymères ... 108
IV. D. 1. Masse molaire et propriétés thermiques ... 108
IV. D. 2. Diffraction des rayons X ... 110
IV. E.) Conclusion ... 112
Références ... 115
Chapitre V : Conception de films Langmuir-Blodgett ... 119
V. A.) Introduction ... 119
V. B.) Résultats et discussion ... 120
V. B. 1. Formation des films Langmuir des dérivés thieno [3,4-c]pyrrole-4,6-dione ... 120
V. B. 2. Polymères à base d’unités TPD hydrophile : effet des comonomères 124 V. B. 3. Polymères à base d’unités thiophène hydrophile : effet de la chaîne latérale ... 124
V. B. 4. Polymères à base d’unités TPD hydrophile : effet de la longueur de la chaîne latérale ... 125
x
V. B. 5. Polymères à l’interface air-eau : impact du caractère amphiphile ... 126
V. B. 6. Étude de la stabilité des films des polymères P1 à P4 ... 127
V. C.) Conclusion ... 129
Références ... 131
Chapitre VI : Caractérisation des films Langmuir-Blodgett ... 135
VI. A.) Introduction ... 135
VI. B.) Morphologie des films de polymères étudiés par microscopie à angle de Brewster (BAM) ... 136
VI. B. 1. Polymères à base d’unités TPD hydrophile ... 136
VI. B. 1. a) Polymère P1 ... 136
VI. B. 1. b) Polymère P2 ... 138
VI. B. 1. c) Polymères P1 et P2 : Impact du monomère TPD hydrophile ... 140
VI. B. 2. Polymères à base d’unités thiophène hydrophile ... 141
VI. B. 2. a) Polymère P3 ... 141
VI. B. 2. b) Polymère P4 ... 142
VI. B. 2. c) Polymères P3 et P4 : Impact du monomère thiophène hydrophile et de la nature de la chaîne latérale sur l’azote ... 143
VI. B. 3. Polymères régioréguliers ... 144
VI. B. 3. a) Polymère P5 ... 144
VI. B. 3. b) Polymère P6 ... 145
VI. B. 4. Comparatif ... 147
VI. B. 4. a) Polymère P7 : impact de la longueur de la chaîne POE sur les TPD hydrophiles ... 147
VI. B. 4. b) : Polymères P8 : Impact du monomère thiophène hydrophile et importance de l’amphiphilicité ... 149
VI. C.) Transfert des films LB suivi par spectroscopie UV-visible ... 152
VI. C. 1. Polymères P1 et P2 : unité TPD hydrophile ... 152
VI. C. 2. Polymères P3 et P4 : unité thiophène hydrophile ... 155
VI. C. 3. Polymères P5 et P6 : polymères régioréguliers avec des unités thiophène hydrophiles ... 160
VI. D.) Étude de l’orientation des molécules ... 164
VI. D. 1. Spectroscopie UV-visible ... 164
VI. D. 2. Spectroscopie UV-visible polarisée ... 166
VI. D. 3. Spectroscopie infrarouge à réflexion totale atténuée (IR-ATR) ... 167
xi VI. D. 5. Spectroscopie InfraRouge de Réflexion Absorption par Modulation de
Polarisation (PM-IRRAS) ... 173
VI. E.) Conclusion ... 175
Références ... 179
Chapitre VII: Transistors organiques à base de films Langmuir-Blodgett ... 183
VII. A.) Introduction ... 183
VII. B.) Structure des transistors organiques ... 184
VII. B. 1. Architecture des substrats en silicium ... 184
VII. B. 2. Préparation des substrats pour les dépôts ... 185
VII. B. 3. Méthode de déposition des films Langmuir-Blodgett constituant les semi-conducteurs des transistors organiques ... 187
VII. C.) Caractérisations des transistors organiques à couches minces 189 VII. C. 1. Préambule aux mesures ... 189
VII. C. 2. Polymère P5 : caractéristiques électriques des transistors à couches minces Langmuir-Blodgett ... 191
VII. C. 3. Polymère P6 : caractéristiques électriques des transistors à couches minces Langmuir-Blodgett ... 193
VII. D.) Analyses des performances des transistors organiques à couches minces ... 195
VII. D. 1. Analyses des caractérisations électriques des transistors de P5 et P6 ... 195
VII. D. 2. Évolution des performances des transistors en fonction du nombre de couches ... 196
VII. D. 3. Évolution des performances des transistors en fonction de la longueur de canal ... 198
VII. D. 4. Comparaison entre transistor organique à film LB et transistor organique à film par tournette ... 199
VII. D. 5. Étude de la morphologie des films LB dans les transistors organiques par microscopie à force atomique (AFM) ... 201
VII. E.) Étude approfondie du polymère P6 en tant que semi-conducteur organique ... 205
VII. E. 1. Fonctionnement du transistor ... 205
VII. E. 2. Hystérésis ... 208
VII. F.) Conclusion ... 211
xii
CONCLUSION ET PERSPECTIVES ... 215
Références ... 221
xiii
LISTE DES TABLEAUX
Tableau I.1. Récapitulatif des performances de polymères conjugués de
type p ... 31
Tableau II.1. Valeurs limites du <P2> et leur signification ... 71
Tableau IV.1. Résumé des masses molaires et caractéristiques thermiques ... 108 Tableau V.1. Résumé des résultats des isothermes ... 123 Tableau VI.1. Résumé des analyses BAM ... 151 Tableau VI.2. Positions principales des bandes IRTF et paramètre d’ordre des
molécules du polymère P3 au sein des films Langmuir-Blodgett (20 mN/m de pression de surface à 20 °C ... 171
Tableau VI.3. Intensité par densité d’unité répétitive (IN) en fonction de l’aire moléculaire occupée par un monomère à différentes pressions de surface pour la bande carbonyle du TPD ... 174
Tableau VII.1. Mesures d’épaisseurs des films LB de P5 et P6 par
Ellipsométrie ... 195
Tableau VII.2. Valeurs des transistors organiques pour des nombres de
couches différentes de P5 et P6 avec L= 2 m et W= 1000 m ... 196
Tableau VII.3. Valeurs des transistors organiques pour des nombres de
couches différentes de P5 et P6 avec L= 2 m et L= 5 m (W = 1000 m) ... 199
Tableau VII.4. Valeurs des transistors organiques pour les films de polymères
de P5 et P6 déposés à la tournette ou non avec L = 2 m et L= 5 m (W = 1000 m) ... 200
xv
LISTE DES SCHÉMAS
Schéma IV.1. Synthèse du
5-(2-(2-méthoxyéthoxy)éthyl)-5H-thiéno[3,4-c]pyrrole-4,6-dione ... 100
Schéma IV.2. Synthèse du 5-{2-[2-(2-méthoxyéthoxy)éthoxy]éthyl}-4H-thieno[3,4-c]pyrrole-4,6 (5H)dione ... 101
Schéma IV.3. Synthèse du 3((2-(2-méthoxyéthoxy)éthoxy)méthyl)-2,5-dibromothiophène ... 101
Schéma IV.4. Synthèse du 4H-thiéno[3,4-c]pyrrole-4,6(5H)-dione,
5-alkyl-1,3-bis(5-bromo-4-[[2-(2-méthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 103
Schéma IV.5. Synthèse de polymères amphiphiles à base d’unité thieno pyrrole
dione P1à P4... 106
Schéma IV.6. Synthèse de polymères amphiphiles régioréguliers à base d’unité
thieno pyrrole dione P5 et P4 ... 107
Schéma IV.7. Synthèse du polymère amphiphile P7 et du polymère P8 à base
xvii
LISTE DES FIGURES
Figure I.1. Diagramme des orbitales moléculaires d'oligothiophènes (n = 1 à 4)
et du polythiophène (n = ∞) ... 15
Figure I.2. Diagramme d'énergie et structure du polythiophène à l'état neutre, polaronique et bipolaronique lors d'un dopage de type « p » ... 17
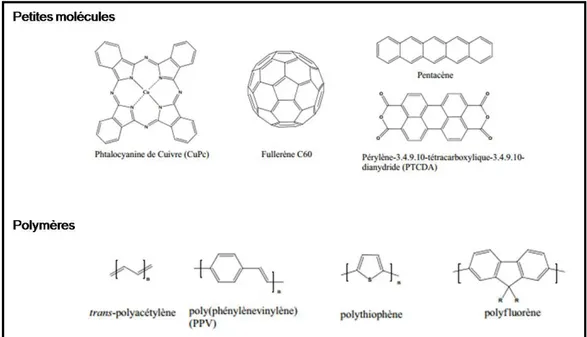
Figure I.3. Exemple de matériaux communément utilisés comme semi-conducteurs... 19
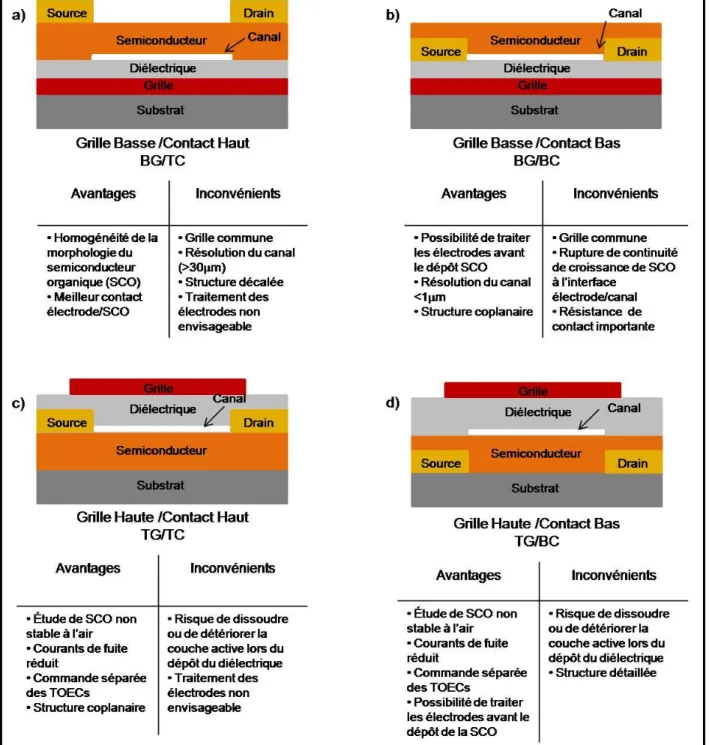
Figure I.4. Représentation schématique des 4 configurations possibles des TOECs ... 22
Figure I.5.Courbes caractéristiques des TOECs : a) La courbe de transfert IDS = f (VG) (axe gauche) et graphique semi-logarithmique d’IDS en fonction de VG (axe droit). b) Les courbes de sortie IDS = f (VDS) Courant mesuré entre la source et le drain en fonction du potentiel source-drain à différents VG ... 25
Figure I.6. Méthodes de déposition et images AFM des films correspondants : a) et b) Déposition de gouttes. c) et d) Déposition par immersion. e) et f) Technique de cisaillement ... 28
Figure II.1. Prototype de la première balance de Langmuir ... 42
Figure II.2. Bain Langmuir-Blodgett ... 43
Figure II.3. Schéma en coupe d’une balance de Langmuir ... 45
Figure II.4. Molécule amphiphile ... 45
Figure II.5. Ménisque autour d’une plaque verticale ... 46
Figure II.6. Schéma des forces d’attraction entre les molécules dans un liquide ... 47
Figure II.7. Isotherme de compression caractéristique d’une monocouche de phospholipides ... 48
Figure II.8. Collapse d’une monocouche ... 50
Figure II.9. Transfert Langmuir-Blodgett d’une monocouche ... 50
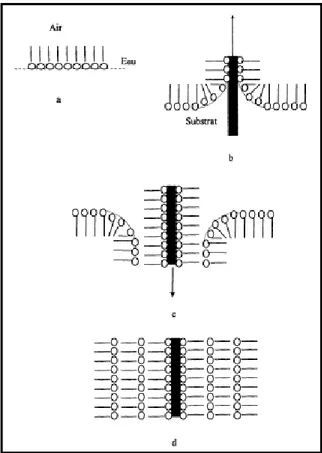
Figure II.10. Schémas du transfert de type Y sur un substrat hydrophile a) Film Langmuir. b) Dépôt d’une première monocouche lors du retrait de substrat. c) Dépôt d’une seconde monocouche lors de l’immersion. d) Film multicouche avec arrangement moléculaire tête-queue ... 51
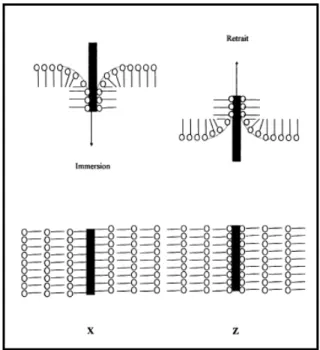
Figure II.11. Schémas des transferts de type Y et Z ... 52
Figure II.12. Transfert Langmuir-Schaefer ... 54
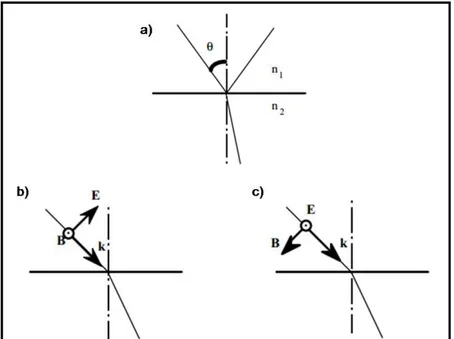
Figure II.13. a) Réfraction et réflexion de la lumière sur une interface. Polarisation des ondes électromagnétiques : b) Onde électromagnétique polarisée p. c) Onde électromagnétique polarisée s ... 58
Figure II.14. Réflexion sur une interface de Fresnel ... 58
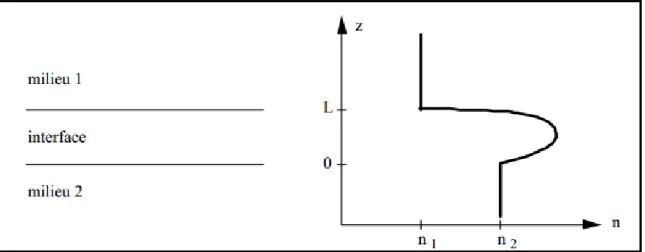
Figure II.15. Interface entre deux milieux ... 60
Figure II.16. Illustration du principe du BAM ... 63
Figure II.17. Microscope à angle de Brewster et schéma du montage sur un bain de Langmuir ... 65
Figure II.18. Principe de la réflexion totale atténuée ... 66
Figure II.19. a) Réfraction d'un rayon lumineux pour θ1<θc, le rayon incident est aussi partiellement réfléchi dans le premier milieu. b) Rayon critique lorsque θ1= θc. c) Réflexion totale interne pour θ1>θc ... 67
xviii
Figure II.20. Schéma de la propagation de la radiation dans un cristal ATR ... 67
Figure II.21. Référentiel utilisé pour la réflexion totale atténuée ... 68
Figure II.22. Système de référence utilisé pour exprimer l’orientation des molécules ... 70
Figure II.23. Montage expérimental en spectroscopie PM-IRRAS ... 72
Figure II.24. Règles de sélection de surface en PM-IRRAS ... 74
Figure II.25. États de polarisation des différents éléments d’un ellipsomètre à modulation par polariseur tournant ... 76
Figure II.26. Réflexion des axes de polarisation à la surface ... 76
Figure II.27. Principe de l’ellipsométrie sur une multicouche ... 78
Figure III.1. Image d’une goutte d’eau sur le dispositif après traitement à l’OTS; l’angle de contact mesuré étant de 105°±1 ... 89
Figure III.2. Image d’une goutte d’eau sur le dispositif avant nettoyage au piranha; l’angle de contact mesuré étant de 59,8°±1... 90
Figure IV.1. Diffractogrammes de rayons X des poudres de polymères P1 à P4 ... 110
Figure IV.2. Diffractogrammes de rayons X des poudres de polymères P1 à P4 ... 111
Figure V.1. Isothermes de compression de P1 à 15 °C et P2 à 20 °C ... 121
Figure V.2. Isothermes de compression de P3 et P4 à 20 °C ... 121
Figure V.3. Isothermes de compression de P5 et P6 à 20 °C ... 122
Figure V.4. Isothermes de compression de P3 et P4 à 20 °C ... 122
Figure V.5. Cycles de compression-expansion de P1 à P4 à 20 et 35 mN/m .. 127
Figure V.6. Cycles de compression-expansion de P1 à P4 à 50 mN/m ... 129
Figure VI.1. Images BAM pendant un cycle de compression de P1 à 15 °C (Taille des images 430x535 µm2) et isotherme de P1 avec les pressions correspondantes ... 137
Figure VI.2. Images BAM pendant un cycle de compression de P2 à 20 °C (Taille des images 430x535 µm2) et isotherme de P2 avec les pressions correspondantes ... 139
Figure VI.3. Images BAM pendant un cycle de compression de P3 à 20 °C (Taille des images 430x535 µm2) et isotherme de P3 avec les pressions correspondantes ... 142
Figure VI.4. Images BAM pendant un cycle de compression de P4 à 20 °C (Taille des images 430x535 µm2) et isotherme de P4 avec les pressions correspondantes ... 143
Figure VI.5. Images BAM pendant un cycle de compression de P5 à 20 °C (Taille des images 430x535 µm2) et isotherme de P5 avec les pressions correspondantes ... 145
Figure VI.6. Images BAM pendant un cycle de compression de P6 à 20 °C (Taille des images 430x535 µm2) et isotherme de P6 avec les pressions correspondantes ... 146
Figure VI.7. Images BAM pendant un cycle de compression de P7 à 20 °C (Taille des images 430x535 µm2) et isotherme de P7 avec les pressions correspondantes ... 148
xix
Figure VI.8. Images BAM pendant un cycle de compression de P8 à 20 °C
(Taille des images 430x535 µm2) et isotherme de P8 avec les pressions correspondantes ... 149
Figure VI.9. Analyse UV-visible des multicouches de films LB de P1 déposés à
20 mN et à 15 °C. a) Spectres d’absorbance UV-visible b) Variation de l’absorption à 571 nm en fonction du nombre de couches ... 153
Figure VI.10. Images AFM de 15 couches de P1 déposé sur une face de
substrat de verre. a) Échelle de 50 m, b) Échelle de 25 m et c) Échelle de 10 m ... 154
Figure VI.11. Analyse UV-visible des multicouches de films LB de P3 déposés à
20 mN et à 20 °C. a) Spectres d’absorbance UV-visible b) Variation de l’absorption à 548 nm en fonction du nombre de couches ... 156
Figure VI.12. Images AFM de 15 couches de P3 déposé sur une face de
substrat de verre. a) Échelle de 50 m, b) Échelle de 25 m et c) Échelle de 10 m ... 157
Figure VI.13. Analyse UV-visible des multicouches de films LB de P4 déposés à
20 mN et à 20 °C. a) Spectres d’absorbance UV-visible b) Variation de l’absorption à 562 nm en fonction du nombre de couches ... 159
Figure VI.14. Analyse UV-visible des multicouches de films LB de P5 déposés à
20 mN et à 20 °C. a) Spectres d’absorbance UV-visible b) Variation de l’absorption à 545 nm en fonction du nombre de couches ... 161
Figure VI.15. Analyse UV-visible des multicouches de films LB de P6 déposés à
20 mN et à 20 °C. a) Spectres d’absorbance UV-visible b) Variation de l’absorption à 570 nm en fonction du nombre de couches ... 163
Figure VI.16. Spectres UV-Vis de P3 à température ambiante: solution (trait
plein), film obtenu à la tournette (spin coating), film LB (pointillé) ... 165
Figure VI.17. Les spectres de polarisation des multicouches de P3 à la
température ambiante: polarisation parallèle (pointillé); polarisation perpendicu-laire (trait plein). a) 30 couches. b) 18 couches ... 166
Figure VI.18. Spectres d’absorption polarisés ATR d’une monocouche de P3
déposée à 20 mN/m à 20 °C ... 168
Figure VI.19. L’orientation suggérée de la chaîne rigide de P3 sur le substrat 171 Figure VI.20. Représentation dessinée via Hyperchem du monomère de P3 .. 172 Figure VI.21. Spectres PM-IRRAS d’une monocouche de P3 à l’interface air/eau
à des pressions de surface différentes ... 174
Figure VII.1. a) Représentation schématique d’un substrat de silicium avec des
transistors. b) Représentation schématique du transistor de type « bottom gate/bottom contact » ... 184
Figure VII.2. Protocole de préparation des substrats de silicium ... 185 Figure VII.3. Réactions chimiques lors du nettoyage UV-ozone ... 186 Figure VII.4.Modèle de la silanisation proposé par Brzoska et al. 1) la physisorption, 2) l’hydrolyse, 3) la réticulation et 4) le greffage covalent ... 187
Figure VII.5. Processus de déposition d'un film de polymère comme
semi-conducteur pour les transistors organiques. (a) Des électrodes en or ont été fabriquées sur le substrat de silicium. (b) Le dispositif a été collé sur un substrat de verre. (c) Les films LB ont été déposés sur le substrat en utilisant la
xx
technique LB. (d) Le dispositif de transistor à film LB a finalement été scellés avec de la colle conductrice d'argent sur un substrat de cuivre, qui agit comme une électrode de grille ... 188
Figure VII.6. Mesure de la conductivité dans le plan d’un transistor sans film de
polymère ... 190
Figure VII.7. Mesure de la conductivité dans le plan d’un transistor avec un film
de polymère P5 de 5 couches ... 190
Figure VII.8. Mesure de la conductivité dans le plan d’un transistor avec un film
de polymère P5 de 5 couches sous éclairement et dans l’obscurité ... 191
Figure VII.9. Courbe de transfert d’un transistor organique avec cinq couches
de P5 (L= 2 um et W= 1 000 um), en utilisant une polarisation VDS de -30 V et un
balayage VG [-50, + 50]... 192 Figure VII.10. Courbe de transfert d’un transistor organique avec cinq couches
de P5 (L= 2 um et W= 1 000 um), en utilisant une polarisation VDS de -30 V et un
balayage VG [-40, + 40]... 193 Figure VII.11. a) Comparaison de la mobilité moyenne de P5 et P6 en fonction
du nombre de couches. b) Comparaison du rapport moyen Ion / Ioff de P5 et P6 par rapport au nombre de couches ... 198
Figure VII.12. a) Courbe de transfert d’un transistor organique avec un film de
P5 déposé à la tournette (L= 2 um et W= 1 000 um), en utilisant une polarisation VDS de -30 V et un balayage VG [-50, + 50]. b) Courbe de transfert d’un transistor
organique avec un film de P6 déposé à la tournette (L= 2 um et W= 1 000 um), en utilisant une polarisation VDS de -30 V et un balayage VG [-40, + 40] ... 200 Figure VII.13. Images AFM d’un transistor organique à cinq couches de film LB
de P5 : a) Images topographiques à trois dimensions pour L= 2 m. b) Images AFM vue de dessus pour L= 2 m. c) Images topographiques à trois dimensions pour L= 5 m. d) Images AFM vue de dessus pour L= 5 m ... 202
Figure VII.14. Images AFM d’un transistor organique à cinq couches de film LB
de P5 : a) Images topographiques à trois dimensions pour L= 50 m. b) Images AFM vue de dessus pour L= 50 m. c) Images topographiques à trois dimensions dans une zone sans électrodes. d) Images AFM vues de dessus dans une zone sans électrode ... 203
Figure VII.15. Images AFM d’un transistor organique à dix couches de film LB
de P6 : a) Images topographiques à trois dimensions pour L= 2 m. b) Images AFM vue de dessus pour L= 2 m. c) Images AFM vue de dessus dans une zone sans électrodes ... 204
Figure VII.16. Images AFM d’un transistor organique à trois couches (a-c) et
cinq couches (d-f) de film LB de P6 : a) Images topographiques à trois dimensions pour L= 2 m. b) Images AFM vue de dessus pour L= 2 m. c) Images AFM vue de dessus dans une zone sans électrodes. Images AFM d’un transistor organique à dix couches de film LB de P6 : a) Images topographiques à trois dimensions pour L= 2 m. b) Images AFM vue de dessus pour L= 2 m. c) Images AFM vue de dessus dans une zone sans électrode... 204
Figure VII.17. Images AFM d’un transistor organique déposé à la tournette de
xxi dessus pour L= 5 m. c) Images AFM vue de dessus dans une zone sans électrodes... 205
Figure VII.18. Courbe de sortie IDS= f(VDS) du transistor de P6 à dix couches
(L= 2m et w= 1000 m) ... 206
Figure VII.19. Courbe de sortie ID= f(VDS) du transistor de P6 : a) 3 couches (L=
2m et w= 1000 m) et b) 5 couches (L= 2m et w= 1000 m) ... 207
Figure VII.20. Courbe de sortie IDS= f(VDS) du transistor de P6 déposé à la
tournette (L= 2m et w= 1000 m) ... 208
Figure VII.21. Courbe de transfert d’un transistor organique avec dix couches
de P6 (L= 2 um et W= 1 000 um) a) Balayage VG [-50, 0] avec VDS de -30V. b)
Balayage VG [-50, -10] avec VDS de -30V. c) Balayage VG [-50, -10] avec VDS
différents ... 210
Figure VII.22. Courbe de transfert d’un transistor organique avec dix couches
de P6 (L= 2 um et W= 1 000 um) a) Balayage VG [-50, 0] avec VD de -30V. b)
Balayage VG [-50, -10] avec VD de -30V. c) Balayage VG [-50, -10] avec VDS
différents ... 211
Figure C.1. Candidats proposes pour des synthèses futures de polymères .... 219 Figure A.1. RMN 1H du 5-(2-(2-Méthoxyéthoxy)éthyl)-5H-thiéno[3,4-c]pyrrole-4,6-dione ... 229
Figure A.2. RMN 13C du
5-(2-(2-Methoxyéthoxy)éthyl)-5H-thiéno[3,4-c]pyrrole-4,6-dione ... 229
Figure A.3. RMN 1H du
5-{2-[2-(2-Méthoxyéthoxy)éthoxy]ethyl}-4H-thiéno[3,4-c]pyrrole-4,6(5H)-dione ... 230 Figure A.4. RMN 13C du 5-{2-[2-(2-Méthoxyéthoxy)éthoxy]ethyl}-4H-thiéno[3,4-c]pyrrole-4,6(5H)-dione ... 230 Figure A.5. RMN 1H du 3-((2-(2-Méthoxyéthoxy)éthoxy)méthyl)thiophène ... 231
Figure A.6. RMN 13C du 3-((2-(2-Méthoxyéthoxy)éthoxy)méthyl)thiophène ... 231 Figure A.7. RMN 1H du
3-((2-(2-Méthoxyéthoxy)éthoxy)méthyl)-2,5-dibromothiophène ... 232
Figure A.8. RMN 13C du
3-((2-(2-Méthoxyéthoxy)éthoxy)méthyl)-2,5-dibromothiophène ... 232
Figure A.9. RMN 1H du
3-((2-(2-Méthoxyéthoxy)éthoxy)méthyl)-2-(2-(trimethylétain) thiophène ... 233
Figure A.10. RMN 13C du 3-((Méthoxyéthoxy)éthoxy)méthyl)
2-(2-(trimethylétain) thiophène ... 233
Figure A.11. RMN 1H du 4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-heptadecan-9-yl-1,3-bis(4-[[2-(2-méthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 234
Figure A.12. RMN 13C du
4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-heptadecan-9-yl-1,3-bis(4-[[2-(2-méthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 234
Figure A.13. RMN 1H du 4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-octyl-1,3-bis(4-[[2-(2-méthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 235
Figure A.14. RMN 13C du
4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-octyl-1,3-bis(4-[[2-(2-méthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 235
Figure A.15. RMN 1H du 4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-heptadecan-9-yl-1,3-bis(5-bromo-4-[[2-(2-méthoxyéthoxy)éthoxy]
xxii
Figure A.16. RMN 13C du
4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-heptadecan-9-yl-1,3-bis(5-bromo-4-[[2-(2-méthoxyéthoxy)éthoxy]
méthyl]-2-thiényl) ... 236 Figure A.17. RMN 1H du 4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-octyl-1,3-bis(5-bromo-4-[[2-(2-éthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 237 Figure A.18. RMN 13C du
4H-Thiéno[3,4-c]pyrrole-4,6(5H)-dione,5-octyl-1,3-bis(5-bromo-4-[[2-(2-méthoxyéthoxy)éthoxy]méthyl]-2-thiényl) ... 237
Figure A.19. RMN 1H du polymère P1 ... 242
Figure A.20. RMN 1H du polymère P2 ... 243 Figure A.21. RMN 1H du polymère P3 ... 244 Figure A.22. RMN 1H du polymère P4 ... 245 Figure A.23. RMN 1H du polymère P5 ... 246 Figure A.24. RMN 1H du polymère P6 ... 247 Figure A.25. Courbes d’analyses calorimétriques des polymères P1 à P6. .... 247
xxiii
LISTE DES ÉQUATIONS
Équation 1.1. ... 26 Équation 1.2. ... 26 Équation 1.3. ... 26 Équation 2.1. ... 47 Équation 2.2. ... 47 Équation 2.3. ... 49 Équation 2.4. ... 53 Équation 2.5. ... 57 Équation 2.6. ... 59 Équation 2.7. ... 59 Équation 2.8. ... 60 Équation 2.9. ... 60 Équation 2.10. ... 61 Équation 2.11. ... 62 Équation 2.12. ... 62 Équation 2.13. ... 62 Équation 2.14. ... 67 Équation 2.15. ... 68 Équation 2.16. ... 69 Équation 2.17. ... 69 Équation 2.18. ... 69 Équation 2.19. ... 69 Équation 2.20. ... 70 Équation 2.21. ... 73 Équation 2.22. ... 73 Équation 2.23. ... 73 Équation 2.24. ... 73 Équation 2.25. ... 77 Équation 2.26. ... 77 Équation 2.27. ... 77 Équation 2.28. ... 77 Équation 6.1. ... 169 Équation 6.2. ... 169
xxv
LISTE DES SYMBOLES ET ABRÉVIATIONS
α-Si Silicium amorphe hydrogéné
AcOK Acétate de potassium
AFM Microscopie à force atomique
AsPh3 Triphénylarsine
BAM Microscopie à angle de Brewster CES Chromatographie d’exclusion stérique Cs2CO3 Carbonate de césium
d Doublet (RMN)
dd Doublet de doublets (RMN)
DHAP Polymérisation par (hétéro)arylation directe
DMAP 4-Diméthylaminopyridine
DMF Diméthylformamide
DMSO Diméthylsulfoxyde
DP Degré de polymérisation
DPP Pyrrolo[3,4-c]pyrrole-1,4(2H,5H)-dione DRX Diffraction des rayons X
DSC Calorimétrie différentielle à balayage
Eg Largeur de bande interdite
EHOMO Niveau énergétique HOMO
ELUMO Niveau énergétique LUMO
HOMO Orbitale moléculaire de plus haute énergie occupée IDS Courant entre la source et le drain
xxvi
Ion/Ioff Ratio entre le courant à l’état de marche et le courant à l’état
d’arrêt
Ip Indice de polymolécularité
IR-ATR Spectroscopie infrarouge à réflexion totale atténuée
J Constante de couplage (RMN)
L Longueur du canal de conduction
LB Langmuir-Blodgett
LUMO Orbitale moléculaire de plus basse énergie inoccupée
m Multiplet (RMN)
M Moment de transition
Mn Masse molaire moyenne en nombre
Mp Masse molaire moyenne en poids
n-BuLi n-Butyle de Lithium
NBS N-Bromosuccinimide ODCB o-Dichlorobenzène OE Oxyde d’éthylène OTS Trichloro(octadecyl)silane <P2> Paramètre d’ordre Pd(Herrmann) Trans-bis(acétato)bis[2-[bis(2- méthylphényl)phosphino]benzyl] Pd(PPh3)4 Tétrakis(triphénylphosphine)palladium(0)
PivOH Acide pivalique
P3HT Poly(3-hexylthiophène)s
PM-IRRAS Spectroscopie infraRouge de réflexion absorption par modulation de polarisation
xxvii
R Rendement
RMN Résonnance magnétique nucléaire RMN 1H Résonance magnétique du proton
RMN 13C Résonance magnétique du carbone-13
s Singulet (RMN)
SMHR Spectroscopie de masse haute résolution
t Triplet (RMN)
Td Température de dégradation
Tf Température de fusion
Tg Température de transistion vitreuse
TCB 1,2,4-trichlorobenzène
TGA Analyse thermogravimétrique
THF Tétrahydrofuranne
TOEC Transistor organique à effet de champ TPD Thieno[3,4-c]pyrrole-4,6-dione
UV Ultraviolet
V Volt
VDS Différence de potentiel entre la source et le drain
VG Différence de potentiel à la grille
Vis Visible
VT (ou Vs) Potentiel seuil à la grille
W Largeur du canal de conduction
Z La normale
σ Orbitale moléculaire sigma liante
xxviii
π Orbitale moléculaire pi liante
π* Orbitale moléculaire pi antiliante
π(LB) Pression de surface
λ Longueur d’onde
xxix
À Jacqueline et Ouanza Ouattara,
De fiers guerriers…
À ma maman, femme déterminée et mère extraordinaire, À mon papa, homme sage et père exceptionnel, À mes frères et sœur, socle inébranlable de mon existence, À ma fille Fatou, génératrice de courage et de joie, À ma fille Mariama et ses futurs frères, source de bonheur,
xxxi « Telle est bien la beauté de la science : désir sans fin de repousser les frontières du
savoir, de traquer les secrets de la matière et de la vie sans idées préconçues des conséquences éventuelles. »
Marie Curie
« Certaines vérités ne nous paraissent invraisemblables que, tout simplement, parce que notre connaissance ne les atteint pas. »
xxxiii
REMERCIEMENTS
Tout d'abord, je tiens à remercier mes professeurs Josée Brisson et Mario Leclerc de leur soutien, compréhension et patience au cours des cinq dernières années. De par vos personnalités différentes, vous avez forgé une chimiste hardie et autonome. Josée, Mario, merci de m’avoir encadrée et orientée en me transmettant des compétences uniques tout en restant toujours disponibles à mes requêtes. Les aptitudes développées au sein de vos laboratoires : rigueur, persévérance, capacité d’adaptation et d’apprentissage, esprit d’initiative et surtout polyvalence ont consolidé mes fondements pour la vie future.
Mes remerciements au Prof. Michel Pézolet qui a offert une grande contribution à ce travail de par son expertise en spectroscopie. Ces pertinentes suggestions ont renforcé ce projet. Aussi, tous mes respects au Prof. Dominique Vuillaume qui m’a accueilli à Lille, dans son groupe NCM(Nanostructures et Composants Moléculaires) de l’IEMN (Institut d’Électronique, de Microélectronique et de Nanotechnologie). Je vous exprime toute ma gratitude pour votre aide et les belles qualités scientifiques que vous distillez.
Gros merci à Stéphane Lenfant et à David Guérin de m’avoir patiemment guidée et à toute l’équipe de NCM pour la bonne ambiance. Merci à Jeff Rioux de m’avoir formée et assistée à l’utilisation de la majorité des outils expérimentaux. Merci, Rodica Pleasu, de nous fournir ton expertise avec patience et pédagogie. Merci à tout le personnel du département pour l’aide constante, scientifique ou non, ainsi qu’à tous les organismes subventionnaires FQRNT, CRSNG, CQMF, CERMA.
Ma reconnaissance particulière va à Pierre-Olivier. P.O., sans toi je n’aurais jamais pu devenir une « spécialiste synthétiseuse ». Depuis mes débuts, tu m’as épaulée sans faillir. Comme le dit Thomas tu es le MacGyver de la chimie, mais surtout de la vaisselle, je rajouterais (ha ha ha ha). Merci à tous les compagnons du laboratoire Leclerc que j’ai cotoyé : Philippe, David, Lauren,
xxxiv
Stéphane, Simon, Jean-Rémi, Amélie, Agnieszka, Xavier, Jérôme, Réda, Even, Justine, Martin, Marie-Ève, François, Maxime, Mikaël, Nicolas, Thomas, Chiara. Grâce à vous, je peux affirmer qu’évoluer dans un groupe de notoriété ne signifie pas évoluer dans une ambiance délétère. Conservez toujours cette harmonie et gaieté. Merci aux compagnons Brisson pour la bonne humeur et surtout Jean-Michel (JM) et Abdel pour toute l’attention, le soutien et les moments joyeux.
Hamed, je te suis grandement redevable. Tu es devenue plus qu’un frère pour moi et tu m’as toujours épaulée dans toutes les étapes de cette thèse. Tu as été énormément à l’écoute de mes déboires personnels et professionnels avec patience et pertinence. Tu m’as toujours tenu la main, encouragée et guidée sur ce chemin tortueux. Shoukran (اركش) akhi. De même, gros merci Patricia Basque, on s’est rapprochée tardivement, mais tu es devenue un solide soutien, une grande amie, une oreille attentive.
Ma gratitude s’adresse à mon amie et sœur Nefertari Galiba pour cette véritable amitié et ta présence éternelle. Avec toi, j’ai partagé joies et galères et tu m’as poussé à avancer contre vents et marées. Merci Neta d’être toujours là et merci à ma deuxième famille qui est la tienne. Merci particulier à Odile, ABC, Julo et Ben qui depuis nos études secondaires à maintenant ont toujours été à mes côtés. Merci à Alain, Cheikh, Khady, ElHadj, Gougn, Elvire et Dieudoné, FCB, Mage de toutes les attentions que vous me portez. Merci à la communauté qui m’a accuelli à Edmundston grâce à Maly et Lacyna. « kou Lim Dioum » donc je remercie tous mes amis et toutes les personnes qui m’ont soutenu tout le long de cette étape.
Merci à mes grand-mères, Perpethue, Fanta et Na gnin qui nous ont quittés. Du ciel, vous veillez toujours sur moi. Merci à mame Issé et à toute ma famille de Thiès de m’avoir guidé dans la vie. Merci à ma marraine de m’avoir transmis ta force et ton fouleu. Merci à ma grande famille plus particulièrement à tata Régina et Tata Germaine. Merci à ma belle famille.
xxxv Ma profonde et inaltérable gratitude va à ma famille, source de mon envie, ma force et ma volonté de toujours avancer. Maman, merci d’avoir fait de moi la personne que je suis. Merci de ta disponibilité dans les bons et mauvais moments. Tu as toujours fait de tes enfants ta priorité. Papa, merci de m’avoir enseigné à m’acharner au travail, à « rougir les yeux » comme tu aimes tant dire. Tu resteras un homme brave, le socle de notre famille. Je remercie mes frères et ma sœur de m’avoir servi de modèle. Vous avez une grande part de responsabilité dans tous mes apprentissages et aussi dans ma vision de la vie. J’espère que nos enfants vivront cette entente profonde. Mes remerciements particuliers à ma fille Fatou, qui m’a accompagné du début à la fin de mes études. Ma chérie je t’aime énormément. Sans comprendre ce que je faisais, tu m’encourageais toujours à avancer en me donnant tes astuces. Ta joie de vivre m’éclairera toujours comme une étoile au firmament. Que Dieu fasse que votre vie, à tes frères et toi soit jalonnée de merveilles et que vous puissiez atteindre les buts que vous vous serez fixés. Merci à bébé Mariama pour ces « sourires gencives » qui atténuaient ma fatigue. Michel, mon amour, je te retourne ton
jërëjëf. Merci d’être la personne que tu es et de me donner l'amour et le soutien
indéfectible. Je n’ose même pas imaginer comment c’aurait été sans toi! À vous mes éternels amours, je vous dédie ce travail et je m’efforcerai toujours de vous rendre fiers!
1
INTRODUCTION
Actuellement, l’électronique a pris le pas dans plusieurs domaines de notre vie. Tout cela est possible suite à l’invention du transistor, en 1947, par des visionnaires: John Bardeen, Walter Brattain et William Shockley.1 Le premier
dispositif conçu était à base de germanium. Cet élément incontournable de tout circuit électronique avait deux usages principaux qui sont l’amplification du signal et la commutation des circuits. Depuis lors, d’énormes progrès ont été réalisés et les semi-conducteurs actuels sont principalement fabriqués à partir de silicium dopé, amorphe ou cristallin. Le silicium, en abondance sur la croûte terrestre, offre d’excellentes performances ainsi qu’une haute stabilité. Le désavantage majeur est lié aux processus de fabrication relativement coûteux et complexes. Donc, pour pallier cet inconvénient, la recherche de matériaux de substitution s’est enclen- chée.
À la fin des années 70, Heeger, MacDiarmid et Shirakawa démontrèrent les propriétés conductrices du polyacétylène.2 Ces travaux ont ouvert un domaine
entièrement nouveau pour les polymères conjugués; soit l’électronique organique. Par contre, les capacités de conduction des matériaux organiques n’ont été réellement exploitées qu’à partir des années 90 pour offrir la possibilité de fabriquer des composants plastiques à bas coût. D’ailleurs, c’est en 1998 qu’un groupe de chercheurs de Philips laboratories est arrivé à produire un circuit intégré entièrement constitué par des matériaux organiques.3 Ce succès s’est rajouté à la
reconnaissance de la recherche sur le polyacétylène qui a été couronnée par le prix Nobel de Chimie en 2000.
Ces dernières années, les polymères conducteurs et semi-conducteurs sont devenus un champ de recherche majeur pour les chimistes ainsi que les physiciens. Les dispositifs électroniques à base de semi-conducteurs organiques tels que les polymères conjugués ont beaucoup attiré l'attention en raison de leur faible coût de fabrication, de leur facilité de mise en oeuvre, de leur flexibilité, de leur légereté4-8 et de leur panoplie d'applications9-12. En une décennie, les progrès
2
scientifiques et technologiques sont tels que les matériaux organiques plastiques, sont en voie de devenir une technologie clé de la prochaine révolution électronique. Des produits commerciaux, comme les écrans à base de diodes électroluminescentes organiques (OLED), sont déjà sur le marché.
Au sein de cette expansion, le transistor à effet de champ organique (TOECs) a été l'un des dispositifs organiques les plus étudiés dans l'industrie et le milieu universitaire. Cet attrait est suscité par ses caractéristiques intrinsèques uniques et son potentiel d’utilisation.13-15 De là, leur performance a été remarquablement
améliorée. Cependant, certains paramètres, comme le contrôle de l'organisation, restreignent leur développement et demandent encore à être maîtrisés. De ce fait, l’optimisation des structures s’inscrit comme un des facteurs importants à investiguer et de nombreuses études sont axées sur l'obtention de matériaux très organisés.16-17
Depuis 1999, il a été clairement établi que la conduction est intimement liée à l'organisation dans les transistors organiques.18-23 Sirringhaus et al. ont montré que la mobilité peut augmenter d’un facteur 1000 lorsque les molécules adoptent une orientation hors plan dans le semi-conducteur du transistor. Alors, un éventail de stratégies englobant le design des molécules24-32 et l'optimisation des processus
de préparation des films25-29 a été proposé pour améliorer l’orientation et octroyer
un meilleur empilement des polymères. Dès lors, des techniques de déposition en solution, par recuit, les techniques d'orientation uniaxiale et celle de Langmuir-Blodgett (LB) ont été prospectées.33
La technique Langmuir-Blodgett offre une approche unique de conception de films de polymères conjugués avec une architecture hautement définie.20,34-38 Des films
ultraminces renfermant des molécules organisées sont obtenus. Le nombre de défauts est faible ou inexistant et par-dessus tout il y a un contrôle, au niveau moléculaire, de l’épaisseur.39 La technique Langmuir-Blodgett s’avère être la
meilleure méthode pour préparer des films avec un contrôle pointu de la morphologie, bien que des méthodes comme l’évaporation à la tournette soient le
3 plus souvent utilisées.33-34,40 Ainsi, en 1990, le premier transistor organique à base
de film LB a été fabriqué par Paloheimo et al.41-42
Le polymère utilisé était un poly(3-hexylthiophène)s régiorégulier. La mobilité enregistrée fut de l’ordre de 10-7-10-4 cm2/(V.s). La présence de chaînes hexyle en
position tête-queue sur le squelette du polymère ont conduit à des répulsions stériques.43 De plus, les acides gras ont été nécessaires pour transférer des
couches de polymères stables verticalement (méthode Langmuir-Blodgett). Ces additifs sont prouvés réduire considérablement les mobilités.42-44 Dix ans plus tard,
des performances de 10-3-10-2 cm2/(V.s) ont été mesurés avec des molécules de
poly(3-hexylthiophène)s s’orientant hors du plan, mais les dispositifs étaient instables.34,45-46 Dans la même période, des couches stables, ordonnées et denses ont été déposées par LB avec succès grâce à l’utilisation de polymère conjugué amphiphile.40
Par ailleurs, il a été souvent rapporté que l’utilisation des molécules amphiphiles est essentielle pour concevoir des films de semi-conducteur à l'interface air-eau (LB).40-41 Aujourd’hui, divers polymères et petites molécules sont synthétisés pour application dans les transistors organiques. Cependant, les polymères démontrent un meilleur potentiel à former des films ainsi que des propriétés mécaniques élevées. Par conséquent, notre choix s’est porté sur l’unité thiéno [3,4-c] pyrrole-4,6-dione (TPD) pour mener les travaux se rapportant à cette thèse. Du fait de leur structure planaire, les polymères à bases d’unités TPD adopteraient une très bonne organisation à l’interface air-eau.47 Aussi, les polymères constitués par cette
unité démontrent des performances encourageantes comme semi-conducteur organique.48-51
L’engouement suscité par les polymères à base de thiéno[3,4-c]pyrrole-4,6-dione (TPD) dans le milieu académique ne se dément plus depuis l’émergence de ce monomère. Au fil des ans, le TPD est devenu une unité phare dans le domaine de l’électronique organique du fait des propriétés électronique et structurale intéressantes qu’il offre.48-63 Des performances importantes dans les dispositifs
4
8,5% dans les cellules photovoltaïques ainsi que des mobilités de trous d’électrons avoisinant 1,3 cm2/(V.s) dans les transistors.48-51 Ces résultats très prometteurs ont
attisé l’intérêt de notre groupe où différentes recherches se sont axées sur l’unité thiéno[3,4-c]pyrrole-4,6-dione (TPD).49,52,57,63,64-68
Bien que le TPD ait le vent en poupe depuis seulement cinq ans, dès 1954 une ébauche de la molécule fut obtenue suite aux travaux de Sicé. Ces études portaient sur la préparation de différents dérivés d’acides thenoiques.769 Plus tard,
vers la fin des années 70, la synthèse d’autres structures a été aussi rapportée dans des brevets de BASF, notamment celle du diphényl TPD.70 Depuis lors,
différents schémas ont été développés pour l’obtention de cette molécule,47,49,71
conduisant ensuite à la synthèse de poly thieno[3,4-c]pyrrole-4,6-dione. Les méthodes de polymérisation par Stille et Suzuki sont devenues les principales voies de préparation de ces polymères au fil des ans.
Récemment, Berrouard et al. ont démontré une nouvelle méthode de synthèse de polymères à base d’unités TPD, l’hétéroarylation directe ou activation C-H.49,64-65 Cette méthode développée dans notre groupe a permis l’obtention d’une panoplie de polymères en moins d’étapes, dans des conditions plus écologiques et avec un rendement élevé.49,65 De ce fait, toutes les synthèses des polymères qui seront
décrites dans cette thèse ont été préparées via la méthode de polymérisation par hétéroarylation directe pour donner les polymères conjugués amphiphiles subséquents.
En liaison avec les problématiques évoquées ci-dessus, le sujet de cette thèse s’inscrit dans l’optique de concevoir des transistors organiques à base de films Langmuir-Blodgett. Les trois premiers chapitres de ce travail sont très généraux. Nous commencerons dans le chapitre I par rappeler le fonctionnement d’un transistor organique en évoquant différents paramètres tels que le caractère semi-conducteur, les méthodes de déposition ainsi que les matériaux organiques performants. Dans le chapitre II nous effectuerons un survol des techniques utilisées tant pour la préparation des films que pour les caractérisations morphologiques et électriques. Cette partie entraînera une familiarisation aux
5 méthodes expérimentales de formation de film et de caractérisation. Pour clore les généralités nous poursuivrons par un inventaire des méthodes expérimentales utilisées de manière récurrente tout au long de ce travail.
En dehors de la partie purement théorique, nous entamerons le chapitre IV, entièrement consacré à la synthèse des polymères amphiphiles de la famille des TPD. Après avoir présenté quelques généralités sur l’unité TPD, nous nous attarderons sur les processus de préparation des molécules. En synthétisant ces copolymères, notre objectif est l’amélioration de la structure de la couche organique via l’empilement, afin d’y favoriser le transport des porteurs de charge. Nous continuerons avec la présentation des films Langmuir préparés dans le chapitre suivant. On pourra analyser le comportement des molécules à l’interface air-eau. Comme très peu de polymères conjugués amphiphiles sont publiés dans la littérature, cette partie sera essentielle pour illustrer l’apport du caractère amphiphile. Par la suite, la caractérisation morphologique des films sera discutée ainsi que l’orientation des molécules. De l’étape de synthèse à la formation de film, ce chapitre renseignera sur l’orientation des molécules. Enfin, le dernier chapitre sera entièrement consacré aux transistors à effet de champ. Après avoir décrit la fabrication des échantillons, nous effectuerons quelques mesures avec les copolymères TPD. Nous essaierons, dans chaque cas, de comprendre les relations entre la structure du polymère et la mobilité électronique. Nous contrôlerons la mobilité des trous d’électrons en jouant sur le nombre de couches constituant les dispositifs.
7
Références
1. Bardeen, J.; Brattain, W.; Shockley, W.; 1950 US Patent 2, 524,035.
2. Shirakawa, H.; Louis, E. J.; MacDiarmid, A. G.; Chiang, C. K.; Heeger, A. J.
Phys. Rev. Lett. 1977, 39, 1098.
3. Drury, C.J.; Mustaers, C. M. J.; Hart, C. M.; Matters, M.; de Leeuw, D. M. D.
Appl. Phys. Lett. 1998, 73, 108.
4. Murphy, A. R.; Fréchet, J. M. J. Chem. Rev. 2007, 107, 1066.
5. Forrest, S. R. Nature 2004, 428, 911.
6. Allard, S.; Forster, M.; Souharce, B.; Thiem, H.; Scherf, U. Angew. Chem.
Int. Ed. 2008, 47, 4070.
7. (a) Heeger, A. J.; Sariciftci, N. S.; Namdas, E. B. Semiconducting and
Metallic Polymers, Oxford University Press, New-York, 2010, 320 pages.
(b) Bao, Z.; Locklin, J. J. Organic Field Effect Transistor, CRC Press, New York, 2007, 595 pages.
(c) Klauk, H. Organic Electronics: Materials, Manufacturing and
Applications, Wiley-VCH, Weinheim, 2006, 446 pages.
8. Moonen, P. F.; Yakimets, I.; Huskens, J. Adv. Mater. 2012, 24, 5526.
9. Sirringhaus, H. Adv. Mater. 2014, 26, 1319.
10. Abdulrazzaq, O. A.; Saini, V.; Bourdo, S.; Dervishi, E.; Biris, A. S. Particul.
Sci.Technol. 2013, 31, 427.
11. Murawski, C.; Leo, K.; Gather, M. C. Adv. Mater. 2013, 25, 6801.
12. Baeg, K. J.; Binda, M.; Natali, D.; Caironi, M.; Noh, Y. Y. Adv. Mater. 2013, 25, 4267.
13. McCarthy, M. A.; Liu, B.; Donoghue, E. P.; Kravchenko, I., Kim, D. Y., So, F.; Rinzler, A. G. Science 2011, 332, 570.
14. Huang, W.; Yu, J.; Yu, X.; Shi, W. Org. Electron. 2013, 14, 3453
15. Guo, Y.; Yu, G.; Liu, Y. Adv. Mater. 2010, 22, 4427.
16. Fabiano, S.; Musumeci, C.; Chen, Z.; Scandurra, A.; Wang, H.; Loo, Y.-L.; Facchetti, A.; Pignataro, B. Adv. Mater. 2012, 24, 951.
17. ang, S.; appl, M.; Liebe irth, I.; M ller, M.; irchhoff, .; Pisula, .; M llen, K. Adv. Mater. 2012, 24, 417.
8
18. Li, X.-C.; Sirringhaus, H.; Garnier, F.; Holmes, A. B.; Moratti, S.C.; Feeder, N.; Clegg, W.; Teat, S. J.; Friend, R. H. J. Am. Chem. Soc. 1998, 120, 2206.
19. Sirringhaus, H.; Brown, P. J.; Friend, R. H.; Nielsen, M. M.; Bechgaard, K.; Langeveld-Voss, B. M. W.; Spiering, A. J. H.; Janseen, R. A. J.; Meijer, E. W.; Herwig, P. T.; de Leeuw, D. M. Nature 1999, 401, 685.
20. Bao, Z.; Dodabalapur, A.; Lovinger, A. J. Appl. Phys. Lett. 1996, 69, 4108.
21. Sirringhaus, H.; Tessler, N.; Friend, R. H. Science 1998, 280, 1741.
22. Duhm, B. S.; Heimel, G.; Salzmann, I.; Glowatzki, H.; Johnson, R. L.; Vollmer, A.; Rabe, J. P.; Koch, N. Nat. Mater. 2008, 7, 326.
23. Chen, W.; Qi, D.-C.; Huang, H.; Gao, X.; Wee, A. T. S. Adv. Funct. Mater.
2011, 21, 410.
24. Chen, H.;Guo,Y.;Yu, G.; Zhao, Y.;Zhang, J.; Gao,D.; Liu,H.; Liu,Y. Adv.
Mater. 2012, 24, 4618.
25. Sirringhaus, H.; Wilson, R. J.; Friend, R. H.; Inbasekaran, M.; Wu, W.; Woo, E. P.; Grell, M.; Bradley, D. D. C. Appl. Phys. Lett. 2000, 77, 406.
26. Pisula, W.; Menon, A.; Stepputat, M.; Lieberwirth, I.; Kolb, U.; Tracz, A.; Sirringhaus, H.; Pakula, T.; Müllen, K. Adv. Mater. 2005, 17, 684.
27. Duffy, C. M.; Andreasen, J. W.; Breiby, D. W.; Nielsen, M. M.; Ando, M.; Minakata, T.; Sirringhaus, H. Chem. Mater. 2008, 20, 7252.
28. DeLongchamp, D. M.; Kline, R. J.; Jung,Y.; Germack, D. S.; Lin, E. K.; Moad, A. J.; Richter, L. J.;Toney,M. F.; Heeney, M.; McCulloch, I. ACS
Nano 2009, 3, 780.
29. Li, L.; Gao, P.; Schuermann, K. C.; Ostendorp,S.; Wang, W.; Du, C.; Lei,Y.; Fuchs, H.; Cola,L. D.; Müllen, K.; Chi, L. J. Am. Chem. Soc. 2010, 132,
8807.
30. Ying, L.; Hsu, B. B. Y.; Zhan, H.; Welch, G. C.; Zalar, P.; Perez, L. A.; Kramer, E. J.; Nguyen,T.-Q.; Heeger, A. J.; Wong, W.-Y.; Bazan,G. C.
J. Am. Chem. Soc. 2011, 133, 18538.
31. Tsao, H. N.; Cho, D. M.; Park, I.; Hansen, M. R.; Mavrinskiy, A.;Yoon, D. Y.; Graf, R.; Pisula, W.; Spiess, H. W.; K. Müllen J. Am. Chem. Soc. 2011 , 133,
9 32. Kim, B.-G.; Jeong, E. J.; Chung, J. W.; Seo,S.; Koo, B.; Kim, J. Nat. Mater.
2013, 12, 659.
33. Yao, Y.; Dong, H.; Hu, W. Polym. Chem. 2013, 4, 5197.
34. Xu, G. F.; Bao, Z. N.; Groves, J. T. Langmuir 2000, 16, 1834.
35. Watanabe, I.; Hong, K.; Rubner, M. F. Langmuir 1990, 6, 1164.
36. Ahlskog, M.; Paloheimo, J.; Stubb, H.; Dyreklev, P.; Fahlman, M.; Inganäs,
O.; Andersson, M. R. J. Appl. Phys. 1994, 76, 893.
37. Hassenkam, T.; Greve, D. R.; Björnholm, T. Adv. Mater. 2001, 13, 631. 38. Björnholm, T.; Hassenkam, T.; Reitzel, N. J. Mater. Chem. 1999, 9, 1975.
39. Eaker, A. R.; Mengel, C.; Wegner, G. Science 1998, 280, 892.
40. Reitzel, N.; Greve, D. R.; Kjaer, K.; Howes, P. B.; Jayaraman, M.; Savoy, S.; McCullough, R. D.; McDevitt, J. T.; Bjørnholm, T. J. Am. Chem. Soc. 2000, 122, 5788.
41. Ouattara, M. P.; Lenfant, S.; Vuillaume, V.; Pézolet, M.; Rioux-Dubé, J.-F.; Brisson, J.; Leclerc, M. Macromolecules 2013, 46, 6408.
42. Paloheimo, J.; Kuivalainen, P.; Stubb, H.; Vuorimaa, E.; Yli- Lahti, P. Appl.
Phys. Lett. 1990, 56, 1157.
43. Paloheimo, J.; Stubb, H.; Yli-Lahti, P.; Dyre le v, P.; Inganas , O. Thin Solid
Films 1992, 210/211, 283.
44. McCullough, R. D. Adv. Mater. 1998, 10, 93.
45. Sandberg, H. G. O.; Frey, G. L.; Shkunov, M. N.; Sirringhaus, H. R.; Friend, H.; Nielsen, M. M.; Kumpf, C. Langmuir 2002, 18, 10176.
46. Pal, A. J.; Ostergard, T.; Paloheimo, J.; Stubb, H. Appl. Phys. Lett. 1996, 69,
1137.
47. Berrouard, P.; Grenier, F.; Pouliot, J.-R.; Gagnon, E.; Tessier, C.; Leclerc, M. Org. Lett. 2011, 13, 38.
48. Amb, C. M.; Chen, S.; Graham, K. R.; Subbiah, J.; Small, C. E.; So, F.; Reynolds, J. R. J. Am. Chem. Soc. 2011, 133, 10062.
49. Pron, A.; Berrouard, P.; Leclerc, M. Macromol. Chem. Phys. 2013, 214, 7.
50. Guo, X.; Ortiz, R. P.; Zheng, Y.; Kim, M.-J.; Zhang, S.; Hu, Y.; Lu, G.; Facchetti, A.; Marks, T. J. J. Am. Chem. Soc. 2011, 133, 13685.
10
51. Wu, Q.; Wang, M.; Qiao, X.; Xiong, Y.; Huang, Y.; Gao, X.; Li, H.
Macromolecules 2013, 46, 3887.
52. Zou, Y.; Najari, A.; Berrouard, P.; Beaupré, S.; Réda Aïch, B.; Tao, Y.; Leclerc, M. J. Am. Chem. Soc. 2010, 132, 5330.
53. Piliego, C.; Holcombe, T. W.; Douglas, J. D.; Woo, C. H.; Beaujuge, P. M.; Fréchet, J. M. J. J. Am. Chem. Soc. 2010, 132, 7595.
54. Zhang, Y.; Hau, S. K.; Yip, H.-L.; Sun, Y.; Acton, O.; Jen, A. K. Y. Chem.
Mater. 2010, 22, 2696.
55. Zhang, G.; Fu, Y.; Zhang, Q.; Xie, Z. Chem. Commun. 2010, 46, 4997.
56. Yuan, M.-C.; Chiu, M.-Y.; Liu, S.-P.; Chen, C.-M.; Wei, K.-H.
Macromolecules 2010, 43, 6936.
57. Najari, A.; Beaupré, S.; Berrouard, P.; Zou, Y.; Pouliot, J.-R.;Lepage-Perusse, C.; Leclerc, M. Adv. Funct. Mater. 2011, 21, 718.
58. Guo, X.; Xin, H.; Kim, F. S.; Liyanage, A. D. T.; Jenekhe, S. A.; Watson, M. D. Macromolecules 2011, 44, 269.
59. Zhang, Y.; Zou, J.; Yip, H.-L.; Sun, Y.; Davies, J. A.; Chen, K.-S.; Acton, O.; Jen, A. K. Y. J. Mater. Chem. 2011, 21, 3895.
60. Hong, Y.-R.; Wong, H.-K.; Moh, L. C.H.; Tan, H.-S.; Chen, Z.-K. Chem.
Commun. 2011, 47, 4920.
61. Chen, G.-Y.; Cheng, Y.-H.; Chou, Y.-J.; Su, M.-S.; Chen, C.-M.; Wei, K.-H.
Chem. Commun. 2011, 47, 5064.
62. Griffini, G.; Douglas, J. D.; Piliego, C.; Holcombe, T. W.; Turri,S.; Fréchet, J. M. J.; Mynar, J. L. Adv. Mater. 2011, 23, 1660.
63. Chu, T.-Y.; Lu, J.; Beaupré, S.; Zhang, Y.; Pouliot, J.-R.; Wakim, S.; Zhou, J.; Leclerc, M.; Li, Z.; Ding, J.; Tao, Y. J. Am. Chem. Soc. 2011,133, 4250.
64. Berrouard, P.; Najari, A.; Pron, A.; Gendron, D.; Morin, P.-O.; Pouliot, J.-R.; Veilleux, J.; Leclerc, M. Angew. Chem. Int. Ed. 2012, 51, 2068.
65. Mercier, L. G.; Leclerc, M. Acc. Chem. Res. 2013, 46, 1597.
66. Najari, A.; Berrouard, P.; Ottone, C.; Boivin, M.; Zou, Y.; Gendron, D.; Caron, W.-O.; Legros, P.; Allen, C. N.; Sadki, S.; Leclerc,M.
11 67. Jo, J.; Pron, A.; Berrouard, P.; Leong, W. L.; Yuen, J. D.; Moon, J. S.;
Leclerc, M.; Heeger, A. J. Adv. Energy Mater. 2012, 2, 1397.
68. Berrouard, P.; Dufresne, S.; Pron, A.; Veilleux, J.; Leclerc, M. J. F. Org.
Chem .2012, 77, 8167.
69. Sice, J. J. Org. Chem. 1954, 19, 70.
70. Dimmler, M.; Eilingsfeld, H. DE 2538951, Germany, 10 Mars, 1977.
71. a) Cornelis, D.; Peeters, H.; Zrig, S.; Andrioletti, B.; Rose, E.; Verbiest, T.; Koeckelberghs, G. Chem. Mater. 2008, 20, 2133.
b) Pomerantz, M.; Amarasekara, A. S. Synth. Met. 2003, 135–136, 257.
c) Nielsen, C. B.; Bjørnholm, T. Org. Lett. 2004, 6, 3381.
13
Chapitre I
Transistors organiques à effet de champ
I. A.) Semi-conducteur organique
I. A. 1. Caractère semi-conducteur
I. A. 2. Conduction dans un semi-conducteur organique
I. A. 2. a) Polaron
I. A. 2. b) Conduction par saut
I. A. 3. Les différents types de matériaux semi-conducteurs
I. B.) Les transistors organiques à effet de champ
I. B. 1. Architecture des transistors organiquesI. B. 2. Fonctionnement des transistors organiques
I. C.) Polymères conjugués
I. C. 1. Principales méthodes de déposition des polymères conjugués I. C. 2. État de l’art des polymères p-type pour les transistors organiques
Références
15
Chapitre I : Transistors organiques à effet de champ
I. A.) Semi-conducteur organique
I. A. 1. Caractère semi-conducteur
Tel que précité, les professeurs McDiarmid, Shirakawa et Heeger ont stimulé le champ de l’électronique organique de par la découverte des propriétés électriques du polyacétylène en 1977.1 Dans une molécule avec une périodicité de liaisons simples (liaison σ) et doubles (liaison σ et π), les électrons π seront délocalisés, ce qui donne lieu au phénomène de conjugaison. L’addition des orbitales HOMO («Highest Occupied Molecular Orbital») et LUMO («Lowest Unoccupied Molecular Orbital»), de chaque unité de répétition (monomère) forme ainsi un continuum d’orbitales π liantes et π* antiliantes. De façon analogue aux semi-conducteurs inorganiques, on parle ainsi de bande de valence et de conduction.
Figure I.1.: Diagramme des orbitales moléculaires d'oligothiophènes (n = 1 à 4) et du
16
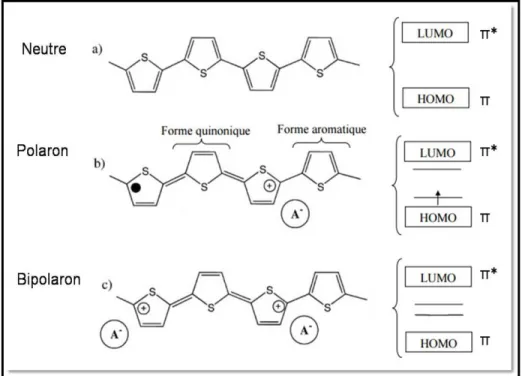
Tel qu’illustré sur la figure I.1, l’énergie séparant la HOMO et la LUMO dépend du nombre de segments conjugués du polymère et est appelée largeur de bande interdite (Eg). La réduction d’Eg ne peut pas tendre vers zéro du fait des défauts structuraux souvent rencontrés au sein des polymères (torsion de chaînes, plis, défaut de conjugaison, …) ainsi que de la différence de longueur entre les chaînes simples et doubles (distorsion de Peierls).3
I. A. 2. Conduction dans un semi-conducteur organique
Les semi-conducteurs organiques sont des isolants à l'état neutre dont la largeur de bande interdite (Eg) se situe en dessous de 3 eV. De par l’ajout
(réduction) ou le retrait (oxydation) d’un électron au polymère π-conjugué, Il est possible de passer à l'état conducteur. On entraîne donc, la création de nouvelles bandes énergétiques entre celles de valence et de conduction. Dans ce cas de figure, il devient plus facile d’induire un saut d’électrons d'une bande à l'autre. Certains polyacétylènes4-5 peuvent ainsi passer d'une conductivité très faible de 10-10 -10-8 S.m-1 à une conductivité de 102-105 S.m-1, proche de celle de métaux
tels que le cuivre et l'or (107 S.m-1). 6-7 I. A. 2. a) Polaron
La théorie des polarons vient expliquer cette augmentation de conduction lors du dopage. Fesser, Bishop et Campbell ont développé un modèle théorique expliquant ce phénomène.8-12 Les polymères conducteurs sont souvent constitués
de cycles aromatiques. Parmi les deux structures de résonance que les cycles possèdent (forme aromatique et forme quinonique), la forme aromatique est la plus stable (Fig. I.2.-a). L’apparition d’une charge sur la chaîne conjuguée, qui la déforme localement, peut être induite par dopage. Elle ne se traduit pas nécessairement par la présence d’un électron dans la bande de conduction ou d’un trou dans la bande de valence. Pour déformer la chaîne avec le moins d’énergie possible, il faut créer un défaut par permutation des simples et doubles liaisons (on passe donc localement d’une forme aromatique à une forme quinonique). Le défaut issu de cette déformation est appelé polaron. Il est associé