L’activation du CD200R par les macrophages alvéolaires
inhibe les fonctions des mastocytes
Mémoire
Kim Santerre
Maîtrise en médecine expérimentale
Maître ès sciences (M.Sc.)
Québec, Canada
L’activation du CD200R par les macrophages alvéolaires
inhibe les fonctions des mastocytes
Mémoire
Kim Santerre
Sous la direction de :
Élyse Bissonnette
iii
Résumé
L’asthme allergique est le résultat d’altérations de plusieurs mécanismes immunorégulateurs. Le maintien de l’homéostasie est assuré principalement par les cellules de première défense, comme les macrophages alvéolaires (MA). Pour empêcher les réponses inflammatoires exagérées, ces cellules expriment des molécules anti-inflammatoires, comme le CD200. Cette molécule est exprimée plus fortement à la surface des MA de rats naïfs suite à l’exposition à un allergène. Le CD200 agit sur les cellules myéloïdes, notamment les mastocytes qui jouent un rôle important dans l’asthme allergique. En somme, l’objectif principal de cette étude est de caractériser l’effet immunomodulateur de l’expression du CD200 à la surface des MA sur les fonctions des mastocytes. Une série d’expériences in vitro de coculture mastocytes-MA permet de conclure que le relâchement de médiateurs préformés, leucotriènes et cytokines produites de novo sont modulés par le CD200 des MA. Ces résultats suggèrent que le CD200 est une cible thérapeutique intéressante dans l’asthme.
iv
Abstract
Allergic asthma may be caused by alterations of many immunoregulatory mechanisms. Alveolar macrophages (AM) are central regulators of pulmonary immune responses. They express anti-inflammatory molecules, such as CD200, to avoid exaggerated immune responses. CD200 is upregulated on AM following allergen challenge in naïve rats. CD200 interacts with its receptor only expressed on myeloid cells, including mast cells that are central effector cells in allergic asthma. Thus, we investigated modulation of mast cell functions by AM CD200. Antigen-stimulated mast cells were investigated in vitro using co-culture and mast cell degranulation, lipid mediator production, and cytokine release were measured. Results suggest that inhibition of antigen-stimulated mast cells by CD200 expression on AM has an important role in asthma regulation.
v
Table des matières
Résumé ... iii Abstract ... iv Table des matières ... v Liste des figures ... vi Liste des abréviations ... vii Remerciements ... viii Chapitre 1: INTRODUCTION ... 1 1.1 ASTHME ... 2 Impact de l’asthme ... 24 Étiologie et signes cliniques ... 4 Cascade inflammatoire asthmatique ... 6 Les éosinophiles et les mastocytes : au cœur de altérations pathophysiologiques. ... 7 1.2 MACROPHAGE ALVÉOLAIRE ... 11 1.3 CD200 ... 16 1.4 CD200 DANS L’ASTHME ... 18 1.5 CD200R ET MASTOCYTES ... 21
Chapitre 2 : HYPOTHÈSE ET OBJECTIFS ... 23
Chapitre 3 : MATÉRIELS ET MÉTHODES ... 26
3.1 Culture cellulaire ... 27 3.2 Stimulation allergénique in vitro ... 27 3.3 Dosage de la β‐hexosaminidase ... 28 3.4 Dosage des médiateurs lipidiques ... 28 3.5 Dosage des cytokines ... 28 3.6 Modèle d’asthme chez le rat ... 28 3.7 Cytométrie en flux ... 29 3.8 Analyses Statistiques ... 29 Chapitre 4 : RÉSULTATS ... 30 Chapitre 5 : DISCUSSION ... 40 Limitations de l’étude ... 45 Perspectives ... 46 Bibiliographie ... 48
vi
Liste des figures
Figure 1. Schéma récapitulatif des traitements proposés pour l’asthme. ... 4 Figure 2. Les cellules impliquées dans la cascade inflammatoire asthmatique atopique ... 6 Figure 3 : Rôles des médiateurs libérés par les mastocytes dans l’asthme ... 9 Figure 4. Spectre de classification des macrophages ... 12 Figure 5. Marqueurs associés aux différents phénotypes de macrophages ... 13 Figure 6. Topologie de l’interaction CD200/CD200R à la surface cellulaire ... 17 Figure 7. Modulation de l’expression du CD200 à la surface des macrophages alvéolaires chez les animaux naïfs (nAM) et sensibilisés (sAM) suite à la stimulation allergénique ... 20 Figure 8. Effet de l’administration de CD200 sur les caractéristiques pathognomoniques de l’asthme expérimental ... 21 Figure 9. Schéma d’hypothèse ... 25 Figure 10. Le CD200 des macrophages alvéolaires (MA) diminue la dégranulation des mastocytes (MC) ... 32 Figure 11. Le CD200 des macrophages alvéolaires (MA) tend à diminuer la production des leucotriènes par les mastocytes (MC) ... 33 Figure 12. Le CD200 des macrophages alvéolaires (MA) ne module pas la production de prostaglandines par les mastocytes (MC) ... 34 Figure 13. Le CD200 des macrophages alvéolaires (MA) inhibe la production d’IL‐4 par les mastocytes (MC) ... 35 Figure 14. Le CD200 des macrophages alvéolaires (MA) inhibe la production d’IL‐13 par les mastocytes (MC) ... 36 Figure 15. Le CD200 des macrophages alvéolaires naïfs (MAn) tend à diminuer plus fortement la production d’IL‐13 par les mastocytes (MC) ... 37 Figure 16. L’expression du CD200 à la surface de différentes lignées de macrophages alvéolaires (MA) de rats ... 38
vii
Liste des abréviations
BN Brown Norway
Dok Downstream of tyrosine kinase
FMO Fluorescence minus one
IFN Interféron
Ig Immunoglobuline
IL Interleukine
MA Macrophage Alvéolaire
MC Mastocyte
MAPK Mitogen-Activated Protein Kinase
nAM Naïve Alveolar Macrophage
OMS Organisation Mondiale de la Santé
PGD2 Prostaglandine D2
PGE2 Prostanglandine E2
RasGAP ras GTPase-activating protein
sAM Sensitized Alveolar Macrophage
SHIP SH2-containing Inositol Phosphatase
TCR T cell receptor
TGF Transforming Growth Factor
Th T helper
viii
Remerciements
Je tiens à remercier ma directrice de recherche Dr. Élyse Bissonnette de m’avoir accueilli dans son équipe. Malgré ses nombreuses tâches extra-laboratoire, elle a su me guider tout au long de mon projet. Je regrette de ne pouvoir rester m’imprégner de sa sagesse plus longtemps. Je remercie également mon codirecteur Dr. Marsolais, Ses commentaires m’ont toujours été très constructifs. Vous êtes de très bon pédagogue, et j’espère avoir retenu beaucoup de vous.
Je tiens également à remercier Jean-François Lauzon-Joset et Anick Langlois d’avoir eu la patience de me guider dans mon projet et d’avoir répondu à mes nombreuses questions.
Je remercie également toutes les personnes que j’ai côtoyées, et que j’espère côtoyer encore, au centre de recherche pour avoir endurer mes nombreuses histoires et d’avoir contribué au maintien de ma bonne humeur.
1
2
1.1 ASTHME
Impact de l’asthme
L’asthme touche environ 10% de la population, variant de 1 à 18% d’un pays à l’autre selon l’Organisation Mondiale de la Santé (OMS) [1]. Cela équivaut à près de 235 millions d’asthmatiques dans le monde et sa prévalence ne cesse d’augmenter [1, 2]. C’est la maladie chronique la plus retrouvée chez les enfants [3]. Puisque l’asthme touche un nombre important de la population, ses coûts monétaires associés sont substantiels [4], s’élevant à près de 56 milliards $US par année [5]. Ceux-ci dépendent directement du niveau de contrôle de la maladie chez chaque individu. En effet, les coûts reliés aux soins d’urgence et aux traitements quotidiens ainsi que les coûts indirects, comme ceux associés à l’absence au travail, sont pris en compte. De plus, lorsque la maladie n’est pas contrôlée, des coûts indirects augmentent [4]. Afin d’améliorer la qualité de vie des patients atteints d’asthme et de contrer le fléau économique engendré par la maladie, plusieurs traitements sont disponibles.
Les traitements pour l’asthme visent le contrôle de la maladie. Celle-ci est dite « non-contrôlée » lorsqu’un patient est symptomatique ou qu’il doit avoir recours à la médication d’urgence plus de 2 fois par semaine, qu’il y a occurrence d’épisodes asthmatiques nocturnes, des effets limitant les activités ou une diminution des fonctions pulmonaires associée à l’obstruction bronchique [6]. Trois types distincts de traitements sont répertoriés : ceux visant le contrôle de la maladie, ceux « de secours » et ceux réservés aux asthmatiques sévères [6-7]. Les traitements varient en fonctions de la sévérité de la maladie et de la réponse du patient face aux traitements administrés (Figure 1). Les corticostéroïdes sont efficaces pour supprimer l’inflammation pulmonaire au quotidien. Les agonistes pour le β2-adrénorécepteur à effets immédiats et prolongés sont des bronchodilatateurs utilisés dans le but de soulager le patient lorsqu’il est en crise, il sert de médication « de secours ». Cette médication bonifie l’effet des corticostéroïdes. Il existe aussi des antagonistes des récepteurs des leucotriènes [7], ces drogues ne ciblent qu’une partie de l’inflammation et sont donc utilisés comme additifs au traitement préalablement mis en place. Les leucotriènes sont de puissants bronchoconstricteurs et ni leur synthèse, ni leur action ne sont empêchés par la prise de corticostéroïdes [8] d’où l’importance de bloquer leur voie d’action. Les stabilisateurs de mastocytes, comme les chromones, sont des médicaments s’attaquant à la
3
dégranulation des mastocytes [7,9]. Leur effet n’est que partiel, il est très limité quant à la réaction à long terme [10]. Des traitements visant la neutralisation des IgE sont disponibles, notamment l’omalizumab utilisé dans les cas d’asthme allergique sévère [11]. Il existe également des thérapies visant la neutralisation des cytokines, comme l’IL-5, nécessaire à la survie et la maturation des éosinophiles. La thérapie visant l’IL-5 permet de diminuer le nombre d’exacerbations seulement chez les individus atteints d’un certain sous-type d’asthme, soit un asthme éosinophilique [12-13]. Cette thérapie est toujours au stade expérimental. Dans les cas d’asthme sévère, la thermoplastie bronchique est un traitement expérimental invasif efficace qui permet la réduction de la masse musculaire lisse et la déposition de collagène sous-épithélial [14]. Malheureusement, aucun traitement n’enraie la maladie et de nombreux patients ont un contrôle imparfait de la maladie [5, 15]. L’asthme est une maladie contrôlable, mais elle est incurable. La recherche sur l’asthme est nécessaire afin de mieux comprendre les mécanismes sous-jacents permettant de développer de nouvelles voies thérapeutiques pour assurer une bonne qualité de vie à ceux qui en souffrent.
4
Figure 1. Schéma récapitulatif des traitements proposés pour l’asthme. Adapté de Global
initiative for asthma [4].
Étiologie et signes cliniques
Plusieurs facteurs influencent le développement de l’asthme. Ces facteurs peuvent être divisés en deux catégories interagissant entre elles; les facteurs liés à l’hôte et ceux liés à l’environnement. La génétique de l’hôte contribue beaucoup à la maladie. Grâce au séquençage de nouvelle génération, de nouvelles approches sont disponibles afin d’identifier des gènes impliqués dans la pathologie. Une multitude de variations géniques ont depuis été associés au développement de l’asthme qui permet de regrouper différents phénotypes d’asthme [16]. Les différentes formes sous lesquelles l’asthme est retrouvé comprennent l’asthme allergique (chez l’enfant et chez l’adulte) qui est le plus commun et celui d’intérêt dans ce projet, l’asthme intrinsèque, l’asthme professionnel et l’asthme à l’exercice [3, 16-17]. L’asthme allergique est généralement associé à un profil inflammatoire de type Th2 et éosinophilique, alors que l’asthme sévère survenant plus
Bronchodilatateur à action rapide (au besoin) Corticostéroïdes inhalés
Antagonistes des LTs (forte éosinophilie)
Corticostéroïdes + agonistes pour le β2-adrénorécepteur à effet prolongés
Étape 1 Étape 2 Étape 3 Étape 4
Corticostéroïdes oraux
5
tard chez l’adulte est associé à un profil inflammatoire Th17 et neutrophilique [17]. L’asthme peut également être classé selon la réfractivité des patients aux traitements [17]. Étant donné la grande variété de présentation de l’asthme, et les différentes réponses aux traitements par les patients, il est important de mettre en place des thérapies individualisées. De plus, il n’y pas seulement la génétique de l’hôte à prendre en compte puisque l’asthme est une combinaison entre facteurs reliés à l’hôte et l’environnement dans lequel il vit.
Parmi les facteurs environnementaux, il y a entre autre la présence des allergènes, la présence de polluants atmosphériques et les épisodes d’infections microbiennes et virales. Les allergènes facilitent le déclenchement d’exacerbations chez les individus atopiques [18]. Le développement de l’asthme allergique est dépendant de la nature de l’allergène, de la dose, du temps d’exposition, de l’âge à laquelle une personne est exposée et de la génétique de cette personne [19]. La réponse asthmatique peut être exacerbée par la pollution de l’air, puisque celle-ci influence l’inflammation bronchique [3-4]. Les infections qui surviennent tôt chez l’enfant agissent sur la probabilité de développer l’asthme. Certaines infections à virus, comme le rhinovirus, sont fortement corrélées au développement de la maladie tôt dans l’enfance [20]. L’hypothèse de l’hygiène postule que les infections bactériennes ou les expositions aux allergènes survenant tôt dans le développement de l’enfant permettent au système immunitaire de ne pas développer d’allergie, en rendant préférentielle une réponse immune de type Th1 plutôt qu’une réponse de type Th2 [20]. Des variations au sein du microbiôme de l’hôte sont aussi susceptibles de faire partie des facteurs déclenchant la pathologie. En effet, une diminution de la diversité microbienne chez l’enfant concorde avec le développement de l’asthme [20]. Évidemment, la maladie qui se développe suite à l’exposition aux facteurs stimulant l’atopie n’a lieu que chez les individus prédisposés.
Lorsque les facteurs génétiques et environnementaux entrent en jeu, l’individu développe des symptômes de détresse respiratoire associés à l’asthme. Cliniquement, l’asthme est une maladie chronique caractérisée par une obstruction réversible des voies respiratoires. Elle se manifeste par une respiration sifflante, un essoufflement, une oppression thoracique, une toux variable et des sécrétions [3]. L’obstruction des voies aériennes est causée par 3 composantes liées entre elles: l’inflammation, le remodelage bronchique et l’hyperréactivité bronchique [6]. Bien que
6
l’asthme soit le résultat d’une collaboration étroite entre ces trois composantes, la cascade inflammatoire représente le point de départ pour établir l’hyperréactivité bronchique et le remodelage.
Cascade inflammatoire asthmatique
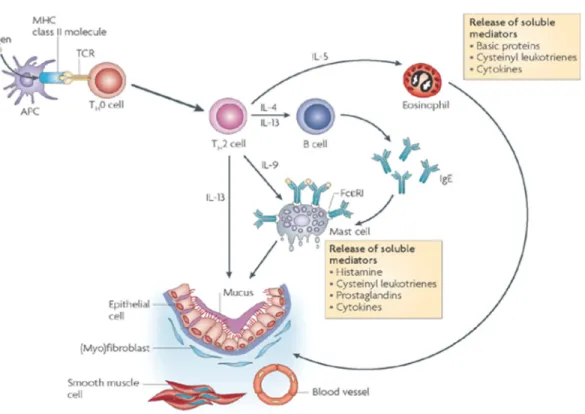
La cascade inflammatoire implique plusieurs cellules ainsi qu’une multitude de médiateurs conduisant à l’instauration des caractéristiques aigues et chroniques de l’asthme atopique (Figure 2).
Figure 2. Les cellules impliquées dans la cascade inflammatoire asthmatique atopique.
Chez les individus prédisposés, l’exposition initiale à un allergène débute par l’activation des cellules Th0 par les cellules présentatrices d’antigènes. Ceci conduit à l’activation des cellules Th2 et à la production d’IgE spécifiques. Cette étape représente l’étape de sensibilisation à un allergène. Suite à une réexposition à l’allergène, les mastocytes et les éosinophiles sont recrutés et leurs divers médiateurs sont libérés causant les réponses immédiate et tardive de l’asthme. [Holgate ST et al, avec la permission d’utilisation]7
7 La présentation de l’antigène et la réponse Th2
Dans le cadre de l’asthme allergique, la cascade débute par l’inhalation d’un allergène qui est capté par les cellules présentatrices d’antigènes, comme les cellules dendritiques. Les cellules présentatrices d’antigènes migrent vers les tissus lymphoïdes afin de présenter les antigènes aux lymphocytes T helper (Th) naïfs via leur TCR (T cell receptor) [17, 21-22]. Cette première étape est appelée sensibilisation à l’allergène.
Les cellules Th2 sont dès lors présentes en nombre accru dans les voies aériennes des patients asthmatiques et libèrent plusieurs cytokines pro-inflammatoires incluant l’interleukine (IL)-3, l’IL-4, l’IL-5, l’IL-9 et l’IL-13 [21-22]. L’IL-3 et l’IL-5 sont responsables de la différenciation et de la survie des éosinophiles et donc perpétuent l’inflammation éosinophilique [23]. L’IL-4 induit la différenciation et la survie des cellules Th2 [23]. L’IL-13 joue un rôle dominant dans la cascade inflammatoire, il a été démontré que cette cytokine était en mesure d’induire à elle seule l’hyperréactivité bronchique et le remodelage [24]. De plus, l’IL-4 et l’IL-13 permettent la commutation isotypique des cellules B afin qu’elles produisent les immunoglobulines (Ig) E [23]. L’augmentation de la présence d’IgE spécifiques favorise l’activation des mastocytes par l’interconnexion à l’allergène. Les mastocytes sont recrutés au site d’inflammation par l’IL-9 [23]. Les cellules T orchestrent donc l’initiation de la cascade inflammatoire en sécrétant diverses cytokines.
Les éosinophiles et les mastocytes : au cœur de altérations pathophysiologiques.
Suite à la sensibilisation à un allergène décrite précédemment, il s’en suit une cascade d’exacerbation reliée au développement des symptômes de l’asthme. La sommation des épisodes d’exacerbations conduit à une inflammation chronique qui cause le remodelage et l’hyperréactivité bronchique. L’implication de cellules proinflammatoires recrutées dans la phase de sensibilisation est primordiale pour la suite.
Les mastocytes sont reconnus pour être au centre des signes et symptômes de l’asthme allergique. Chez les asthmatiques, le nombre de mastocytes est significativement augmenté au niveau de l’épithélium bronchique et des cellules musculaires lisses [25-27]. Ces cellules résident près des surfaces exposées aux pathogènes et aux allergènes et leur activation dans les
8
voies aériennes déclenche la réaction asthmatique allergique. Les mastocytes contiennent des granules contenant une diversité de médiateurs inflammatoires prêts à être libérés en quelques secondes suite à leur activation [28]. Cette activation passe par la liaison du récepteur à haute affinité pour la partie Fc des IgE, FcεRI. Chez les individus déjà sensibilisés à un allergène, les récepteurs à haute affinité sont saturés en IgE. Suite à une seconde exposition à l’allergène, l’interconnexion entre ce dernier, les IgE et le FcεRI est essentiel, par contre, c’est l’agglomération des récepteurs qui, au final, induit le relâchement des médiateurs au site d’inflammation.
Les mastocytes contribuent tant à la crise d'asthme qu'au remodelage tissulaire. Ils exercent leur rôle en libérant une panoplie de médiateurs inflammatoires (protéases, cytokines, chimiokines, facteurs de croissances, etc.). Rapidement après leur activation, les mastocytes relâchent le contenu de leurs granules (histamine, serotonine, protéases, etc.), processus appelé dégranulation. De plus, ils produisent des médiateurs lipidiques (leucotriènes et prostaglandines) qui sont eux aussi libérés très rapidement. Les leucotriènes sont les agents spasmogènes les plus puissants connus à ce jour [27]. Ces réponses rapides font partie de la phase immédiate de l’asthme allergique. Ces médiateurs libérés par les mastocytes ont pour effet d’augmenter la production de mucus par les cellules à gobelet, augmenter la perméabilité vasculaire et induire la bronchoconstriction (Figure 3). Ces effets se traduisent par une respiration difficile et sifflante qui caractérise la crise d’asthme. La perméabilité vasculaire permet un afflux des cellules inflammatoires depuis la circulation sanguine au poumon afin de perpétuer l’inflammation. Quelques-uns des médiateurs libérés rapidement collaborent au remodelage tissulaire, c’est notamment le cas des protéases présentes dans les granules qui ont une activité accrue [29].
Quelques heures plus tard, les mastocytes libèrent d’autres médiateurs qui sont formés de novo (cytokines, chimiokines, facteurs de croissance). Chez certains patients, cette deuxième vague de médiateurs inflammatoires donne lieu à une seconde réponse appelée « réponse tardive ». La réponse tardive donne lieu à un second épisode de détresse respiratoire engendré, entre autres, par la libération d’IL-13 [30]. Les cytokines produites par les mastocytes participent au remodelage des voies respiratoires. Certains de ces médiateurs participent aussi au recrutement
9
d’autres leucocytes au site d’inflammation, comme les éosinophiles qui participent activement à la réponse tardive.
Figure 3 : Rôles des médiateurs libérés par les mastocytes dans l’asthme. Les médiateurs
rapidement relâchés (dégranulation et médiateurs lipidiques) jouent un rôle important dans la réponse immédiate. Quelques heures suivant l’exposition à l’allergène, une seconde vague de médiateurs formés de novo (réponse tardive) entrent en jeu afin d’amplifier la réponse inflammatoire. [Galli SJ et al, avec permission d’utilisation]28
Les éosinophiles sont en nombre accru dans les voies respiratoires des asthmatiques en réponse aux diverses cytokines (IL-5) et chimiokines (CCL11, CCL24 et CCL26) libérées très rapidement suite à une réexposition à l’allergène [31]. Les cystéinyl leucotriène libérées par les mastocytes, particulièrement les leucotriènes E4, sont également des agents chimioattractants
10
pour les éosinophiles [32]. Ces cellules soutiennent le relâchement de médiateurs inflammatoires (IL-3, IL-4, IL-5, IL-13 et leucotriènes C4). Leur rôle est primordial dans le remodelage
bronchique et ils assurent ce rôle en supportant la prolifération des fibroblastes, la synthèse de collagène et la maturation des myofibroblastes par la sécrétion de TGF (Transforming growth factor)- [33]. De plus, les éosinophiles causent des dommages aux cellules structurales du poumon en libérant le contenu toxique de leurs granules.
La réponse mastocytaire et éosinophilique est prédominante chez les asthmatique léger à sévère, toutefois, chez les asthmatiques sévères prédomine également un sous-type d’asthme associé à une augmentation de la réponse neutrophilique [34]. Ce type d’asthme est caractérisé par une obstruction bronchique difficilement réversible [17]. En effet, les patients atteints d’asthme neutrophilique sont souvent réfractaires aux glucocorticoïdes [35]. Pour l’instant la pathophysiologie de l’asthme neutrophilique est mal comprise. Le profil inflammatoire diffère de la réponse Th2 observée, il y a dominance de cytokines de type Th1 et Th17 [17]. Les hypothèses penchent vers un défaut dans la plasticité de la biologie du neutrophile, diminuant ses caractéristiques immunorégulatrices [36].
Ainsi, en conséquence à la sommation temporelle d’épisodes inflammatoires aigus (exacerbations), un changement structural des bronches caractérisé par une fibrose sous-épithéliale, une augmentation de la masse de muscle lisse, de l’angiogenèse et une hyperplasie des cellules à gobelet surproduisant du mucus diminuent le diamètre des voies respiratoires [37]. L’augmentation des agents spasmogènes comme l'histamine, l’IL-13 et les leucotriènes suivant l’exposition à l’allergène se traduit par une augmentation de la contraction du muscle lisse des bronches, ce qui réduit de façon plus importante la lumière bronchique [38]. La réduction du calibre des voies respiratoires a pour effet d’augmenter la résistance d’écoulement de l’air dans ces voies et donc de créer une détresse respiratoire, ce qui caractérise la crise d’asthme [37].
L’asthme est donc le résultat de l’interaction entre plusieurs types cellulaires. Ce débalancement dans la réponse normale altère de façon importante les fonctions respiratoires des patients qui souffrent d’asthme. L’environnement inflammatoire causé par la cascade asthmatique modifie la
11
réponse de plusieurs autres types cellulaires qui contribuent alors eux-aussi à l’altération des fonctions respiratoires.
1.2 MACROPHAGE ALVÉOLAIRE
Un rôle émergeant est reconnu pour les macrophages dans la régulation de la réponse immune pulmonaire. Dans le poumon, il existe plusieurs types de macrophages; les macrophages alvéolaires, les macrophages interstitiels et les macrophages intravasculaires, ces derniers sont présents au niveau endothélial des capillaires sanguins [39-40]. Les trois types de macrophages présents dans le tissu pulmonaire proviennent en grande partie de la maturation des monocytes circulants [41]. Les cellules sont attirées dans différentes partie par des facteurs chimioattractants et y prolifèrent afin d’assurer la défense de l’hôte [40]. Le phénotype des macrophages varie en fonction de leur location, de leur rôle et de leur activation. Dans le cadre de ce projet, nous nous sommes concentrés sur les macrophages alvéolaires, étant donné leur emplacement de première ligne, des alvéoles aux voies aériennes, lors d’inhalation d’allergènes.
En conditions normales, les macrophages alvéolaires sont les cellules qui prédominent dans les la lumières des voies aériennes, des alvéoles jusqu’au larynx [42]. En effet, ils constituent plus de 90% des cellules dans les lavages bronchoalvéolaires de sujets sains [40]. Ces cellules ont une durée de vie d’environ 3 mois en conditions normales [43] et leur taux de changement est estimé à 40% par an [44]. Leur emplacement leur confère un rôle important dans la défense de l’hôte puisqu’ils sont parmi les premiers à rencontrer les pathogènes et les allergènes inhalés [42]. Les macrophages alvéolaires sont de piètres présentateurs d’antigènes aux cellules T et n’expriment pas de molécules de co-stimulation comme le CD86 [45]. Ce qui a pour conséquence d’induire une réponse tolérogénique face aux antigènes inoffensifs. Ils sont également caractérisés par une activité phagocyte et un stress oxydatif réduits [44]. De ce fait, les macrophages alvéolaires ne répondent pas exactement comme leur équivalents interstitiels.
De façon générale, une plasticité dans la réponse à l’environnement des macrophages est observée dans le but de maintenir l’homéostasie pulmonaire [46]. Les macrophages peuvent, en effet, modifier leur phénotype en fonction du statut inflammatoire de leur milieu. Ils sont
12
généralement classés selon leur réponse en deux catégories comme illustré à la figure 4a : les macrophages activés de façon classique (M1) et les macrophages activés de façon alternative (M2) [47]. Les macrophages M1 sont retrouvés lors de l’activation par une réponse immune visant la défense contre une invasion bactérienne. Ils sont induits en réponse à l’activation des TLR et par des cytokines pro-inflammatoires comme le TNF. Les macrophages M2 sont plus spécifiques à une réponse anti-inflammatoire ou de réparation.
Figure 4. Spectre de classification des macrophages [Mosser DM et al, avec la permission
d’utilisation]48
En revanche, cette catégorisation est très simplifiée, les phénotypes des macrophages en réponse à un stimulus s’inscrivent plutôt dans un continuum [47-49]. De manière plus contemporaine, les macrophages se classent en trois catégories selon leurs fonctions (Figure 4b) : la défense de l’hôte, la réparation et la régulation immune [48]. Cette façon de classer les macrophages est plus réaliste selon la variété des phénotypes observés. Chacun des phénotypes d’activation des macrophages peuvent être identifiés par des marqueurs différents [49] (Figure 5). Les marqueurs exprimés par les différents phénotypes de macrophages alvéolaires permettent à ceux-ci
13
d’exercer leur rôle, soit la défense antibactérienne, la réparation, la réponse aux complexes immuns ou la résolution de l’inflammation.
Figure 5. Marqueurs associés aux différents phénotypes de macrophages. M1 représente la
fonction antibactérienne; M2a la fonction réparatrice; M2b en réponse aux complexes immuns et aux agonistes des TLR; M2c la fonction anti-inflammatoire. [Benoit M et al, avec la permission d’utilisation]49
La fonction défense de l’hôte est ce qui est communément représenté par les M1. Ces macrophages sont induits principalement par l’interféron (IFN) –γ et le TNF (Tumor necrosis factor) [39, 49-50]. Ainsi, ces macrophages ont un rôle axé sur les fonctions antimicrobiennes et sont principalement retrouvés lorsqu’une réponse de type Th1 prédomine [48]. Ils sécrètent des cytokines pro-inflammatoires comme l’IL-1, l’IL-6, l’IL-12, l’IL-23 et le TNF [51].
Une deuxième fonction des macrophages, associée à la classification M2, est la réparation. Ce phénotype est induit en réponse à l’IL-4 et l’IL-13 [39], donc lorsqu’une réponse de type Th2
14
prédomine et ces cellules sont en mesure de maintenir cette réponse suite à son initiation [52]. En produisant des chimiokines recrutant les cellules T effectrices au site d’inflammation, les macrophages gardent la réponse inflammatoire active. Pour assurer la réparation, ces macrophages produisent les précurseurs des polyamines et du collagène, contribuant à la production de matrice extracellulaire [53]. Ils produisent aussi des chimiokines [54] et des facteurs anti-inflammatoires comme l’IL-10 [55]. Cette fonction peut être néfaste pour l’hôte lorsqu’il y a perte de contrôle et surproduction de matrice extracellulaire contribuant au remodelage bronchique [56]. C’est ce qui est observé dans le cas de l’asthme expérimental murin [56].
La régulation de la réponse immune est assurée par un troisième type de macrophages induit par de nombreux stimulus, notamment par les complexes immuns, les prostaglandines, les cellules apoptotiques et l’IL-10 [47, 50]. Ces macrophages s’occupent d’inhiber la réponse inflammatoire. Les macrophages régulateurs sécrètent de l’IL-10, une cytokine connue pour inhiber la production de plusieurs cytokines pro-inflammatoires [48].
La classification M1/M2 est toutefois à prendre à la légère chez les macrophages alvéolaires puisque ceux-ci, chez l’individu sain, semblent appartenir aux deux classements. En effet, les macrophages alvéolaires expriment autant des marqueurs de surface retrouvés dans la classe M1 que dans la classe M2 [44]. Les macrophages alvéolaires doivent répondre rapidement et adéquatement aux stimuli qui les bombardent dans les voies aériennes étant les premières défenses du système respiratoire. De plus, l’environnement des macrophages alvéolaire est très malléable afin d’induire une réponse immune adéquate, soit tolérogène ou inflammatoire. La régulation des macrophages alvéolaires se fait tant par des signaux provenant d’interactions directes avec les cellules voisines, que par la présence de médiateurs solubles dans leur environnement. La somme de ces signaux permet de balancer la réponse immune. Finalement, il est également difficile de discerner un phénotype particulier pour les macrophages alvéolaires humains, puisque ceux-ci sont généralement étudiés dans le contexte de maladies et très peu chez les individus sains.
15
Une réponse inappropriée des macrophages peut avoir de graves conséquences sur l’environnement. Les macrophages alvéolaires, puisqu’ils côtoient les particules inhalées, doivent eux aussi être plastiques dans leur réponse. Leur rôle dans l’asthme est fortement controversé puisqu’ils sont susceptibles de générer des effets pro- et anti-inflammatoires [57].
Selon les études effectuées par notre équipe, les macrophages alvéolaires sont dérégulés suite à la sensibilisation à un allergène, et ne sont plus en mesure de protéger contre l’enclenchement de la cascade inflammatoire [58]. La déplétion des macrophages alvéolaires chez les rats résistants à développer les symptômes mimant l’asthme ayant été préalablement sensibilisés à un allergène cause une plus grande réactivité bronchique, une augmentation de la réponse dépendante des IgE et un recrutement important de cellules T activées dans le poumon ce qui démontre leur importance dans le maintien de l’équilibre [58]. Une mauvaise balance de la réponse des macrophages alvéolaires dans les conditions asthmatiques semble être en cause dans l’asthme [59] puisque l’effet protecteur des macrophages alvéolaires provenant d’animaux naïfs dans un contexte asthmatique a déjà été démontré [58, 60, 61]. En effet, le transfert de macrophages alvéolaires de rats naïfs vers des animaux sensibilisés et déplétés de leurs macrophages alvéolaires est en mesure d’empêcher l’augmentation de la réactivité bronchique caractéristique de l’asthme expérimental [61]. Au contraire, le transfert de macrophages alvéolaires provenant d’animaux sensibilisés n’a aucun effet sur la réactivité bronchique. Une altération au niveau des mécanismes de régulation assurés par ces cellules justifie la réponse inadéquate durant la réponse asthmatique allergique. Comme mentionné précédemment, l’environnement dans lequel sont maintenus les macrophages alvéolaires joue un rôle important sur leur effet immunorégulateur. Les macrophages provenant de rats sensibilisés qui sont mis en culture pendant 4 heures dans un milieu neutre retrouvent leur capacité à inhiber l’augmentation de la réactivité bronchique [62], ce qui suggère un dérèglement de la réponse des macrophages alvéolaires dans son milieu et leur donnant un rôle important dans l’initiation de la réponse asthmatique.
Les macrophages alvéolaires provenant d’animaux naïfs sont donc en mesure de protéger contre la réponse excessive observée dans l’asthme [58]. Les mécanismes exacts impliqués dans cette dérégulation du rôle protecteur sont toutefois inconnus. Plusieurs médiateurs synthétisés par les macrophages ont un rôle régulateur, comme le TGF-β, les prostaglandines les endoperoxides 2
16
(PGE2) [63] et l’IL-10 [64]. Des variations dans l’expression de certaines molécules membranaires, comme le CD200 qui joue un rôle important dans la régulation de la réponse immune, sont susceptibles d’être aussi en cause dans l’asthme.
1.3 CD200
Afin de maintenir l’homéostasie, l’organisme doit se munir de mécanismes permettant d’éviter les réponses inflammatoires persistantes ou exagérées. Un débalancement dans la transition entre activation et inhibition de ces mécanismes est l’une des causes de maladies auto-immunes [65]. Les cellules de la réponse innée et de la réponse acquise expriment une panoplie de récepteurs activant et inhibant le déclenchement de la réponse inflammatoire. Parmi les récepteurs inhibiteurs, il y a les familles des lectines et des immunoglobulines [66]. Ceux-ci font partie des immunorécepteurs à motifs d’inhibition dépendante de la tyrosine et les signaux participent, entre autre, à la tolérance du soi.
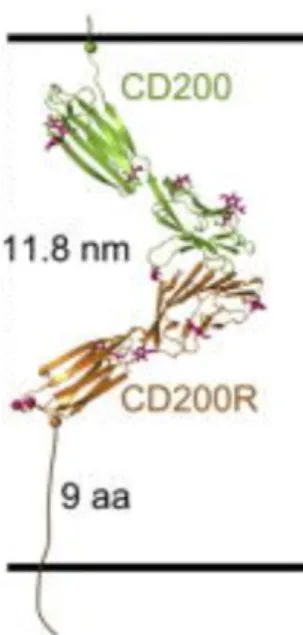
Le CD200 fait partie de la famille des glycoprotéines transmembranaires et des immunoglobulines et est capable d’engendrer un signal inhibiteur [67]. La liaison du CD200 à son récepteur, le CD200R, engendre un signal inhibiteur unidirectionnel chez la cellule exprimant le récepteur. [68] Il n’y a pas d’effet sur la cellule exprimant le CD200, puisque ce dernier possède une région intracellulaire trop courte pour qu’un signal soit transmis (Figure 6). [69] Le signal inhibiteur nécessite un contact cellule-cellule. Dans certaines circonstances, le CD200 peut être coupé de la cellule et se retrouver sous forme soluble dans le système. La molécule transmembranaire est coupée par des protéases qui se situent près de la surface cellulaire [69]. Ses impacts sous forme soluble sont encore incertains, alors que sa forme liée induit un signal immunosuppresseur dans la cellule exprimant le récepteur.
17
Figure 6. Topologie de l’interaction CD200/CD200R à la surface cellulaire [Hatherley et al.
Avec la permission d’utilisation]70
Lorsque la molécule lie son récepteur, une série d’évènements intracellulaires conduisent à la réponse de la cellule. La cascade de signalisation suite à l’activation du récepteur débute avec la phosphorylation des résidus tyrosine présents dans la région cytoplasmique du récepteur [71]. Ceci entraine la phosphorylation des protéines adaptatrices Dok1 (Downstream of tyrosine kinase) et Dok2 [72]. Les protéines Doks sont impliquées dans la phosphorylation et l’activation de la protéine Ras GTPase (RasGAP). Dok1, une fois activée, recrute également SHIP (SH2-containing inositol phosphatase). L’activation de RasGAP et SHIP inhibe la MAPK (mitogen-activated protein kinase) et NF-κB [71-72]. Au final, la cascade de l’activation du récepteur mène à l’inhibition de la réponse inflammatoire de la cellule.
L’activation de la voie CD200/CD200R a été étudiée dans plusieurs contextes inflammatoires. La sévérité des maladies auto-immunes est plus grande chez les souris à qui le gène pour le CD200 est supprimé (CD200 KO) [73]. L’activation de la voie CD200/CD200R est associée au soulagement de l’inflammation dans un modèle d’arthrite induit par la sensibilisation au collagène [74]. Les propriétés immunosuppressives de la liaison CD200-CD200R permettent également une survie prolongée des greffons [75]. Dans le contexte inflammatoire d’une
18
infection à influenza, les souris CD200 KO sont en mesure d’éliminer le virus, mais ces souris ont moins de chances de survie. Les souris meurent puisqu’elles échouent à contrôler l’inflammation pulmonaire [76]. Le CD200, en supprimant les réponses immunes, peut conduire à une perte de la vigilance du système immunitaire [77]. Cette perte de vigilance permet aux cellules cancéreuses, exprimant le CD200, d’échapper au système immunitaire. Ainsi ces cellules prolifèrent et le cancer prend de l’expansion [78-79]. Le CD200 est aussi utilisé comme stratégie d’infection par certains virus [80-81]. Des virus, comme le poxvirus HHV-6, exprime des homologues du CD200, ce qui diminue l’activité des cellules myéloïdes et permet donc au virus d’infecter l’hôte plus librement. [81]
Le CD200 est exprimé par une panoplie de types cellulaires. Les lymphocytes T, les lymphocytes B, les cellules épithéliales, les cellules endothéliales expriment le CD200 [82] et par certains sous-type de cellules de la lignée myéloïde (cellules dendritiques et macrophages). L’expression du CD200R est plus restreinte; il est retrouvé exclusivement à la surface des cellules myéloïdes comme les macrophages, les cellules dendritiques et les mastocytes [83]. La caractérisation du CD200R chez l’humain et la souris a permis d’identifier des différences majeures entre les deux espèces [83]. Par exemple, les sous-types retrouvés chez la souris, dépendamment de la liaison, peuvent envoyer un signal inhibiteur ou activateur [70]. Il a été observé que le CD200 humain ne possédait pas d’isotype, comme son analogue chez le rat, contrairement à ce qui est retrouvé chez la souris [83]. D’où la pertinence d’étudier l’interaction CD200/CD200R chez le rat.
Le rôle du CD200 est bien caractérisé dans plusieurs modèles de maladies inflammatoires. Son rôle dans l’asthme est à ce jour très peu étudié, alors que la composante inflammatoire est centrale dans cette pathologie.
1.4 CD200 DANS L’ASTHME
Des évidences montrent une dérégulation de l’expression du CD200 associée à l’exacerbation de l’asthme. Une étude de profilage génétique chez les enfants asthmatiques a permis d’identifier le CD200 comme une molécule variante dans la pathologie de l’asthme [84]. Son expression est
19
significativement plus faible à la surface des leucocytes circulants de patients asthmatiques lors d’exacerbations suggérant une dérégulation de cette voie chez les asthmatiques.
L’expression du CD200 est modulable en réponse à des mécanismes engendrant une cascade anti-inflammatoire pulmonaire. En effet, l’apport en vitamine D, reconnue pour avoir un effet anti-inflammatoire général, augmente le CD200 à la surface des cellules T CD4 et CD8, sans toutefois moduler l’expression du récepteur à la surface des cellules résidentes du poumon [85]. Cette augmentation de l’expression du CD200 est plus importante chez les cellules T des voies aériennes comparativement aux cellules T périphériques. Par contre, l’administration de vitamine D chez les asthmatiques sévères n’affecte pas l’expression du CD200. Également, les glucocorticoïdes, qui sont eux aussi des agents anti-inflammatoires, augmentent rapidement l’expression du CD200 à la surface des cellules épithéliales bronchiques in vitro [86]. Cet effet atteint son maximum 2 h suivant l’administration des glucocorticoïdes et retrouve le niveau de base 18 h suivant l’administration. Chez les patients asthmatiques sous traitement anti-IgE, une diminution du CD200 soluble dans le sérum suite à la résolution de l’inflammation pulmonaire suggère que cette voie est également impliquée dans le contrôle de l’inflammation asthmatique [87]. Ces études confirment une modulation du CD200 en lien avec la résolution de l’inflammation pulmonaire. Un défaut d’expression de cette molécule aurait donc le potentiel d’engendrer une cascade inflammatoire à partir de stimuli inoffensifs.
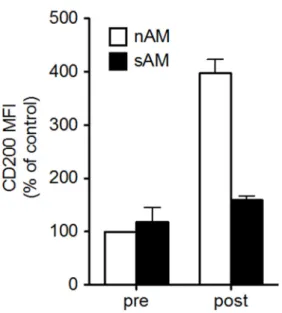
Afin de vérifier la présence d’une une dérégulation endogène d’un point de vue pulmonaire, notre équipe a mesuré l’expression du CD200 à la surface des macrophages alvéolaires avant et après l’exposition à l’allergène (Figure 7) dans le modèle d’inflammation allergique aigüe induit par l’ovalbumine chez le rat. Dans ce modèle, les animaux sensibilisés et exposés à l’allergène développent une hyperréactivité bronchique, alors que les animaux naïfs n’en développent pas. Les niveaux d’expression du CD200 avant l’exposition allergénique sont semblables chez les animaux naïfs et sensibilisés. Suite à l’exposition allergénique, l’expression du CD200 augmente drastiquement chez les animaux naïfs, alors que chez les animaux sensibilisés il n’y a pas d’augmentation. Ce qui confirme une dérégulation de l’expression du CD200 chez les macrophages alvéolaires dans un modèle expérimental d’asthme. Cette dérégulation coïncide avec la perte de l’effet protecteur des macrophages alvéolaires discuté à la section 1.2 [58-61].
20
Figure 7. Modulation de l’expression du CD200 à la surface des macrophages alvéolaires chez les animaux naïfs (nAM) et sensibilisés (sAM) suite à la stimulation allergénique. Les
niveaux d’expression du CD200 avant stimulation allergénique sont similaires chez les deux groupes. Par contre, suite à la stimulation, seuls les macrophages alvéolaires provenant de rats naïfs augmentent l’expression du CD200. (Lauzon-Joset avec son accord, non publié)
Suite à l’observation d’une dérégulation du CD200 des macrophages alvéolaires, l’équipe du Dr Bissonnette s’est intéressée à l’effet de l’administration du CD200 sur les caractéristiques pathognomoniques de ce modèle d’asthme [88]. Le protocole expérimental incluait quatre groupes de rats; naïfs (naïve), sensibilisés (asthmatic/sensitized), sensibilisés et traités avec une molécule contrôle (sham) ainsi que sensibilisés et traités avec le CD200 (rCD200). L’administration intratrachéale de CD200 avant la stimulation allergénique inhibe complètement le développement de l’hyperréactivité bronchique (Figure 8a) ainsi que l’accumulation de cellules dendritiques myéloïdes et de cellules Th2 (Figure 8b). La présence d’IL-13, une cytokine pro-inflammatoire impliquée dans l’hyperréactivité bronchique [24] et la force de contraction du muscle lisse, dans les lavages bronchoalvéolaires est nettement diminuée chez les animaux traités avec le CD200 (Figure 8c). L’administration de CD200 induit, de plus, une production d’IL-10 (Figure 8d), cytokine reconnue pour son effet anti-inflammatoire [64]. Le CD200 semble donc agir sur la réactivité bronchique en modulant la balance d’expression des cytokines pro-inflammatoires et anti-inflammatoires. Le mécanisme exact est toutefois inconnu. La dérégulation du CD200 peut agir sur plusieurs types cellulaires exprimant le CD200R. En
21
revanche, les résultats obtenus suggèrent que le CD200 interfère avec la libération de cytokines. Un des types cellulaires clés dans la production des cytokines menant à l’augmentation de la réactivité bronchique est les mastocytes, ce qui en fait une cible d’intérêt.
Figure 8. Effet de l’administration de CD200 sur les caractéristiques pathognomoniques de l’asthme expérimental; Les animaux ont été sensibilisés 21 jours avant la stimulation
allergénique. Le CD200 ou la molécule contrôle ont été administrés 24h avant l’exposition allergénique pour les animaux du groupe rCD200 et Sham. L’administration de CD200 diminue la réactivité bronchique (A), le recrutement des cellules Th2 au poumon (B) et la production d’IL-13 (C) aux niveaux observés chez les rats naïfs. En contre partie, elle augmente fortement la libération d’IL-10 (D), suggérant un rôle protecteur de cette cytokine dans les effets observés (A, B, C). [Lauzon-Joset et al., avec la permission d’utilisation]88
1.5 CD200R ET MASTOCYTES
Les mastocytes sont une cible thérapeutique intéressante dans l’asthme allergique puisqu’ils contribuent à la réponse immédiate et tardive. Le CD200 est une alternative pour contrer l’activation des mastocytes puisque ces cellules expriment le CD200R [89-90]. Il est intéressant d’étudier son pouvoir inhibiteur, puisque notre équipe a observé une perte des symptômes de l’asthme associés à l’activation des mastocytes dans notre modèle animal [88]. L’activation du
A B
22
CD200R régule les mastocytes. En effet, in vitro, l’ajout de CD200 recombinant à des mastocytes surexprimant le CD200R inhibe significativement leur dégranulation ainsi que leur production d’IL-13 et de TNF [89]. Dans un modèle d’hypersensibilité de la peau, l’administration de l’anticorps activant le récepteur empêche l’activation des mastocytes in vivo, sans toutefois devoir surexprimer le CD200R [89]. Ce qui suggère que les mastocytes sont plus sensibles à l’activation du CD200R in vivo que in vitro. Suite à ces observations, il est intéressant d’investiguer si l’inhibition de l’activation des mastocytes par le CD200 exprimé par les cellules environnantes peut être suffisante pour diminuer le relâchement des médiateurs associés à l’asthme.
23
24
L’asthme est une immunopathologie chronique où divers médiateurs inflammatoires et cellules, comme les mastocytes, contribuent au développement de l’hyperréactivité bronchique [7, 21-23]. Le maintien de l’homéostasie pulmonaire peut être assuré par les macrophages alvéolaires et la perte de leur effet protecteur semble être associée à l’évolution des symptômes de l’asthme [58]. Les macrophages alvéolaires expriment le CD200, une molécule qui démontre des effets immunosuppresseurs importants dans divers contextes inflammatoires, entre autre, en inhibant l’activation des leucocytes [68]. Une dérégulation de l’expression du CD200 concorde avec les caractéristiques pathognomoniques de l’asthme expérimental, qui peuvent être empêchées par l’administration de CD200 [88]. Étant donné que l’interaction entre le CD200 et le CD200R exprimé à la surface des mastocytes conduit à la neutralisation de ces derniers [89-90] et la proximité des mastocytes et des macrophages alvéolaires [26], la modulation des fonctions mastocytaires par le CD200 exprimé par les macrophages alvéolaires a donc été investiguée. Hypothèse :
L’augmentation de l’expression du CD200 à la surface des macrophages alvéolaires diminue l’activation antigénique des mastocytes. (Figure 9)
Objectifs spécifiques :
1. Démontrer l’effet inhibiteur du CD200 des macrophages alvéolaires sur la dégranulation des mastocytes.
2. Démontrer l’effet inhibiteur du CD200 des macrophages alvéolaires sur la libération de médiateurs lipidiques par les mastocytes
3. Démontrer l’effet inhibiteur du CD200 des macrophages alvéolaires sur la sécrétion de cytokines pro-inflammatoires des mastocytes
4. Comparer l’effet de macrophages alvéolaires isolés de rats naïfs et de rats atopiques sur les fonctions des mastocytes ex vivo.
25
Figure 9. Schéma d’hypothèse; L’augmentation de l’expression du CD200 à la surface des macrophages alvéolaires (MA) diminue l’activation antigénique des mastocytes (MC).
MC
MA
26
27
3.1 Culture cellulaire
Une lignée commerciale de basophiles de rats (RBL-2H3) (ATCC, Manassas, VA, États-Unis) a été utilisée pour étudier les fonctions des mastocytes [91-93]. Ces cellules sont utilisées en tant que modèle d’étude des fonctions in vitro des mastocytes puisqu’elles expriment le récepteur FcεRI et sont activées lors de la connexion spécifique récepteur-IgE-antigène. Les cellules ont été cultivées dans le milieu DMEM (Multicell, Wisent Bioproducts, St-Bruno, QC, Canada) additionné de 10% de sérum bovin inactivé (Multicell) et maintenues en incubation à 37°C/5% CO2.
Une lignée commerciale de macrophages alvéolaires de rats Sprague Dawley (NR8383) (ATCC) a été utilisée. Ces rats ne développent pas les caractéristiques de l’asthme expérimental. Pour des biens de simplification, le terme « macrophages alvéolaires » désigne cette lignée dans ce mémoire sauf précision contraire. Les cellules ont été cultivées dans le milieu F12K (Multicell) supplémenté de 15% de sérum bovin inactivé et de 0,5% de HEPES et maintenues en incubation à 37°C/5% CO2.
3.2 Stimulation allergénique in vitro
Les RBL-2H3 ont été ajoutés à une plaque de 24 puits (Starstedt, Newton, MA, États-Unis) à raison d’une concentration de 3,75 x 105 cellules/ml dans du DMEM 10% sérum bovin. Dans
certains puits, un anticorps neutralisant le CD200R (LSBio, Seattle, WA, États-Unis) (10 µg/ml) a été ajouté afin de confirmer la spécificité de la voie. Les cellules ont été incubées toute la nuit à 37°C/5% CO2. Les mastocytes ont été sensibilisés avec des IgE anti-DNP (Sigma, St-Louis,
MO, États-Unis) (1 µg/ml) pour 1 heure à 37°C/5% CO2 dans du RPMI (Multicell) sans additifs.
Des macrophages alvéolaires ont été ajoutés à la culture dans un ratio 1 :1 (7,5 x 105 cellules/ml)
dans du milieu sans sérum et la coculture a été maintenue 3 h à 37°C/5% CO2. La coculture a été
stimulée avec du DNP-ovalbumine (Biosearch Technologies, Novato, CA, États-Unis) (24 µg/ml) pour 30 min ou 18 h. Les conditions observées incluaient les mastocytes seuls et l’ajout de macrophages alvéolaires avec ou sans stimulation. La pré-incubation de l’anti-CD200R avec les mastocytes avant l’ajout de macrophages alvéolaires constituait la condition contrôle quant à la voie CD200/CD200R.
28
3.3 Dosage de la β-hexosaminidase
Suite à une stimulation allergénique de 30 min, les surnageants ainsi que les lysats cellulaires (obtenus avec 400 µl de triton 0,5%) ont été recueillis. Les surnageants ont été dilués avec du milieu sans sérum à un ratio 1 :3 et les lysats 1 :19. Par la suite, dans un ratio 1 :1, 50 µl des échantillons ont été ajoutés à une plaque 96 puits avec 50 µl de substrat de la β-hexosaminidase (4-Methylumbelliferyl N-acetyl-β-D-glucosaminide) (Sigma), lorsque le 4-methylumbelliferone est libéré, sa fluorescence peut être mesurée. Suite à une incubation de 1 h à 37°C, l’ajout de Tris 10X termine la réaction. La plaque a été lue à 360/460 nm (excitation/émission). (Lecteur de plaques Synergy H1, Bio-Tek, Winooski, VT, États-Unis)
3.4 Dosage des médiateurs lipidiques
À partir des surnageants de culture obtenus après 30 min de stimulation allergénique les cystényl leucotriènes et prostaglandines ont été dosés. Des trousses d’essais enzymatiques ont été utilisées (Cayman Chemical, Ann Arbour, MI, États-Unis) en suivant la procédure du fabriquant.
3.5 Dosage des cytokines
Suite à une stimulation allergénique de 18 h, les surnageants ont été recueillis. Les dosages de l’IL-4 et de l’IL-13 ont été effectués par kit ELISA (IL-4; R&D system, Minneapolis, MN, États-Unis. IL-13; Life technologies, Grand Island, NY, États-Unis) en suivant la procédure du fabriquant.
3.6 Modèle d’asthme chez le rat
Le modèle d’asthme utilisé est un modèle d’asthme à l’ovalbumine sur 3 semaines. Au jour 0, un groupe de rats Brown Norway (BN) (Harlan Laboratory, Indianapolis, IN, États-Unis) provenant de notre colonie (d’environ 60 jours) ont été sensibilisés par injection intrapéritonéale d’ovalbumine (Sigma) et d’adjuvant (alum) (Invivo Gen, San Diego, CA, États-Unis). Trois semaines plus tard, les animaux ont été stimulés avec 5 ml de l’allergène aérosolisé (saline + 5% ovalbumine) pendant 5 min.Ving-quatre heures suivant la stimulation allergénique, les animaux
29
ont été sacrifiés. Afin de récolter les cellules des voies aériennes, des lavages bronchoalvéolaires ont été faits (injection de 5 mL de PBS-EDTA jusqu’à concurrence de 50 ml par rat).
Les lavages recueillis ont été centrifugés et les cellules resuspendues dans le milieu RPMI. Les cellules des lavages ont été comptées. Les cellules isolées de rats naïfs ou sensibilisés ont été ajoutées aux mastocytes pour stimulation à raison de 7,5 x 105 cellules/ml dans un ratio 1 :1.
Suite à une stimulation de 18h in vitro, l’IL-13 a été mesuré.
3.7 Cytométrie en flux
Environ 0,5 x 106 macrophages alvéolaires de la lignée commerciale (NR8383) et des lavages
bronchoalvéolaires de rats naïfs BN ont été utilisés pour le marquage. Un seul anticorps a été utilisé, soit un anti-CD200 : PE (Biolegend, San Diego, CA, États-Unis). Afin de sélectionner seulement les macrophages alvéolaires, les doublets ont été éliminés de la sélection de cellules viables. Les macrophages alvéolaires ont été identifiés comme étant les cellules de forte taille. Un échantillon non marqué a permis de confirmer la spécificité du marquage et ainsi identifier les cellules exprimant le CD200.
3.8 Analyses Statistiques
Les données sont exprimées en moyenne ± erreur type. La variance des moyennes de chaque groupe ont été comparées par ANOVA. Les données ont été jugées significatives lorsque p ≤ 0,05 bilatéralement. Les analyses statistiques ont été effectuées avec le logiciel GraphPad Prism version 5 (GraphPad Software, CA, États-Unis).
30
31
Les trois types importants de médiateurs (médiateurs préformés, médiateurs lipidiques rapidement synthétisés et médiateurs formés de novo) relâchés par les mastocytes ont été investigués par une série d’expériences in vitro de stimulation de mastocytes en culture. Dans un premier temps, les macrophages alvéolaires utilisés provenaient d’une ligné commerciale provenant de rats Sprague Dawley qui sont résistants au développement de l’asthme. Par la suite, nous avons établi un parallèle avec des macrophages alvéolaires provenant de rats BN qui développent l’asthme allergique.
La libération des médiateurs préformés (Figure 10), qui a un rôle majeur dans la réponse immédiate suite à l’exposition à un allergène, a d’abord été étudiée. Nous avons utilisé la β-hexosaminidase comme indicateur des médiateurs préformés. Les mastocytes, sans stimulation allergénique, ont un très faible niveau de dégranulation. L’ajout de macrophages alvéolaires n’affecte pas la dégranulation des mastocytes sans stimulation allergénique. L’antigène a significativement augmenté de 550% la dégranulation. Par contre, l’ajout de macrophages alvéolaires réduit la dégranulation causée par l’antigène de façon significative (inhibition de 27%) (Figure 10). Les macrophages alvéolaires seuls produisent très peu de β-hexosaminidase (<10% de la valeur de fluorescence mesuré des mastocytes non stimulés). L’ajout d’un anticorps neutralisant le CD200R élimine l’inhibition de la dégranulation, par les macrophages alvéolaires, suggérant que cette diminution est médiée par le CD200 sur les macrophages alvéolaires.
32
Figure 10. Le CD200 des macrophages alvéolaires (MA) diminue la dégranulation des mastocytes (MC). Résultats obtenus suite à 30 min de stimulation. Chaque barre représente la
moyenne ± erreur type. Les groupes statistiquement différents (p ≤ 0,05) sont identifiés par des lettres différentes. n=5
Les leucotriènes et les prostaglandines sont des médiateurs lipidiques rapidement produits et libérés par les mastocytes suivant leur activation. Leur production a été mesurée 30 min suivant la stimulation in vitro par essais colorimétriques (Figure 11-12). De base, les mastocytes libèrent 780 ± 30 pg de CysLTC4/106 cellules (Figure 11). L’ajout de macrophages alvéolaires ne
modifie pas le relâchement spontané, alors que la stimulation antigénique cause le relâchement de 1240 ± 80 pg de CysLTC4/106 mastocytes. Une tendance à l’inhibition de la production des
leucotriènes en présence des macrophages alvéolaires est observée et cette tendance est renversée par l’ajout de l’anticorps neutralisant le CD200R. Le pourcentage d’inhibition obtenu en soustrayant le niveau de production spontanée de CysLTC4 est de 55%. Pour ce qui est des
prostaglandines (PGD2) (Figure 12), la stimulation antigénique module légèrement la production
(augmentation de 23% entre mastocytes non stimulés et stimulés). L’ajout de macrophages alvéolaires en conditions stimulées et non stimulées augmente la production de PGD2 de 20%,
33
Figure 11. Le CD200 des macrophages alvéolaires (MA) tend à diminuer la production des leucotriènes par les mastocytes (MC). Les résultats ont été obtenus suite à une stimulation à
l’allergène de 30 min. Chaque barre représente la moyenne ± erreur type. Les groupes statistiquement différents (p ≤ 0,05) sont identifiés par des lettres différentes. n=3
34
Figure 12. Le CD200 des macrophages alvéolaires (MA) ne module pas la production de prostaglandines par les mastocytes (MC). Les résultats ont été obtenus suite à 30 min de
stimulation. (p≤0,05). Chaque barre représente la moyenne ± erreur type. Les groupes statistiquement différents (p ≤ 0,05) sont identifiés par des lettres différentes. n = 3.
Finalement, la production de cytokines a été étudiée après 18 h. Les mastocytes libèrent, entre autre, de l’IL-4 et de l’IL-13. Le dosage de ces cytokines a été effectué par ELISA. De base, la production d’IL-4 et d’IL-13 par les mastocytes seuls est très faible (< 10 pg/106 cellules)
(Figure 13-14). Pour les deux cytokines, l’ajout de macrophages alvéolaires à la culture de mastocytes sans stimulation antigénique n’augmente pas significativement leur production. Alors qu’en présence de l’antigène, les mastocytes activent leur production d’IL-4 et d’IL-13 (IL-4 : 50 ± 10 pg/106 cellules, IL-13 : 200 ± 30 pg/106 cellules). L’ajout des macrophages alvéolaires aux
mastocytes stimulés inhibe la production de cytokines (IL-4 : 50% d’inhibition, IL-13 : 60% d’inhibition). Pour ce qui est des macrophages alvéolaires seuls, leur production d’IL-4 est de 13 ± 5 pg/106 cellules, ce qui équivaut à la production des mastocytes en coculture non stimulés. Le
renversement de cette inhibition par l’utilisation d’un anticorps neutralisant le CD200R (IL-4 : p = 0,03; IL-13 : p = 0,04) suggère que les macrophages alvéolaires inhibent leur production via la voie CD200/CD200R (Figures 13-14).
35
Figure 13. Le CD200 des macrophages alvéolaires (MA) inhibe la production d’IL-4 par les mastocytes (MC). Résultats obtenus suite à 18 h de stimulation. Chaque barre représente la
moyenne ± erreur type. Les groupes statistiquement différents (p ≤ 0,05) sont identifiés par des lettres différentes. n = 6.
36
Figure 14. Le CD200 des macrophages alvéolaires (MA) inhibe la production d’IL-13 par les mastocytes (MC). Résultats obtenus suite à 18 h de stimulation. Chaque barre représente la moyenne ± erreur type. Les groupes statistiquement différents (p ≤ 0,05) sont identifiés par des lettres différentes. n = 6.
Étant donné que les macrophages alvéolaires provenant de rats BN naïfs sont en mesure d’augmenter l’expression du CD200 à leur surface suite à l’exposition allergénique et que ceux de rats BN sensibilisés ont perdu cette capacité (Figure 7), nous avons comparé l’effet inhibiteur des macrophages alvéolaires en interaction avec les mastocytes de ces deux groupes de rats. Les macrophages alvéolaires provenaient des lavages bronchoalvéolaires des rats naïfs et de rats sensibilisés 24 h suivant l’exposition à l’allergène en aérosol. Nous avons, par la suite, procédé à la stimulation des mastocytes in vitro tel que décrit précédemment, en utilisant les macrophages alvéolaires des lavages bronchoalvéolaires au lieu de la lignée commerciale pour les cocultures. La production d’IL-13 a été mesurée 18 h après la stimulation antigénique in vitro des mastocytes (Figure 15). Les résultats obtenus sont préliminaires, il est donc impossible de conclure définitivement à partir de ceux-ci, par contre ces résultats nous indiquent une tendance. L’antigène stimule la production d’IL-13 par les mastocytes, tel qu’observé auparavant (Figure 13). La production d’IL-13 semble diminuer de façon plus importante lorsqu’il y a interaction entre les mastocytes et les macrophages alvéolaires de rats naïfs et exposés à l’allergène comparativement à l’interaction entre mastocytes et macrophages alvéolaires de rats sensibilisés
37
et exposés. Un renversement de cette tendance semble avoir lieu lorsqu’il y a ajout de l’anticorps neutralisant le CD200R. Ces résultats préliminaires suggèrent que l’augmentation du CD200 causé par l’exposition in vivo des rats pourrait avoir un pouvoir inhibiteur, mais ces résultats doivent être confirmés par des expériences supplémentaires.
Figure 15. Le CD200 des macrophages alvéolaires naïfs (MAn) tend à diminuer plus fortement la production d’IL-13 par les mastocytes (MC). Les résultats préliminaires
suggèrent que les MAn sont plus efficace pour inhiber la production d’IL-13 par les MC que les macrophages de rats sensibilisés (MAs). La diminution observée est renversée par l’utilisation d’un anti-CD200R. n = 2.
En complément à ces résultats, nous avons évalué les niveaux d’expression de CD200 à la surface des NR8383, des macrophages alvéolaires provenant de rats résistants à développer
38
l’asthme expérimental, et des macrophages alvéolaires provenant de rats BN. Une différence dans l’expression du CD200 pourrait justifier l’inhibition des mastocytes par les NR8383 (Figure 14) et non par les macrophages alvéolaires de rats BN stimulés à l’antigène (Figure 15). L’expression du CD200 chez les deux lignées a été mesurée en cytométrie en flux. Les NR8383 expriment significativement plus de CD200 à leur surface que les macrophages alvéolaires provenant de rats BN naïfs et exposés à l’antigène (Figure 16).
Figure 16. L’expression du CD200 à la surface de différentes lignées de macrophages alvéolaires (MA) de rats. L’expression du CD200 à la surface des macrophages alvéolaires de
rats BN naïfs et de macrophages alvéolaires de rats SD (MA SD) par cytométrie en flux. (A) Stratégie de sélection des macrophages alvéolaires décrite à la section 3.7. Chaque point représente une cellule. (B) Confirmation de marquage (bleu) en comparaison à une population non marquée (rouge). (C) Différence d’expression entre macrophages alvéolaires de BN (bleu) et macrophages alvéolaires de SD (rouge), (D) médiane de fluorescence associée au marquage de CD200. Les macrophages alvéolaires de rats Brown Norway (BN) expriment moins de CD200 que les macrophages alvéolaires de SD. * : p = 0.005 n = 3.
39
La faible expression du CD200 sur les macrophages alvéolaires de rats BN naïfs pourrait expliquer que ceux-ci n’inhibent pas la production d’IL-13 par les mastocytes aussi efficacement que les macrophages alvéolaires de rats BN sensibilisés (Figure 14). Bref, les résultats obtenus tendent à démontrer que la voie CD200/CD200R est importante pour prévenir l’activation des mastocytes. L’augmentation de l’expression du CD200 chez les animaux naïfs contribue à réduire la production d’IL-13, alors que cet effet tend à être moindre chez les animaux sensibilisés.
40
41
Le contrôle de l’asthme demeure imparfait chez bon nombre de sujet, d’où l’importance de mettre en place de nouvelles thérapies [5 ,15]. À ce jour, les traitements existants ne sont pas en mesure de convenir à toute la gamme d’asthmatiques, il faut alors penser à de nouvelles voies à emprunter afin d’améliorer la qualité de vie de ces asthmatiques incontrôlés. Le CD200, une molécule immunosuppressive, gagne en popularité suite à ses évidences curatives dans plusieurs modèles inflammatoires [74-75]. La présente étude s’intéresse à l’asthme allergique qui est le résultat d’une cascade d’interactions entre les cellules immunes des voies respiratoires. Chez les patients asthmatiques, la présence accrue des mastocytes au niveau de l’épithélium [26] favorise les interactions avec les cellules résidentes; les macrophages alvéolaires. Les échanges entre ces cellules peuvent s’effectuer à partir de molécules de surface, comme le CD200. Ce dernier, exprimé par les MA, semble avoir un effet bénéfique dans l’asthme [88]. Par contre, son mode d’action dans la pathologie est, à ce jour, peu connu. Étant donné le rôle important des mastocytes dans l’asthme allergique, nous voulions caractériser l’effet du CD200 sur leur activation par un antigène. Pour se faire, une lignée de macrophages alvéolaires (NR8383) provenant d’une souche de rat résistant au développement de l’asthme expérimental a été utilisée pour étudier la modulation des fonctions mastocytaires par les macrophages alvéolaires.
L’effet du CD200 des macrophages alvéolaires sur la dégranulation des mastocytes n’est pas suffisant pour expliquer la suppression complète de l’hyperréactivité bronchique in vivo. Le relâchement de β-hexosaminidase, indicateur de la dégranulation, dans le milieu diminue de façon significative en présence des macrophages alvéolaires, mais n’est pas totalement inhibée. À l’opposé, le sodium chromoglycate, un médicament ciblant la stabilisation des mastocytes, inhibe complètement la dégranulation de ces cellules [94]. La réduction de la dégranulation des mastocytes n’est peut-être pas suffisante pour expliquer par elle seule les résultats obtenus in vivo démontrant l’inhibition totale de la réponse immédiate par le CD200 [88]. La combinaison de plusieurs signaux inhibiteurs pourrait être nécessaire. En parallèle, des médicaments couramment utilisés pour soulager les symptômes de l’asthme, comme les glucocorticoïdes n’affectent pas la dégranulation, et doivent être combinés avec les agonistes pour le β2-adrénorécepteur, qui eux inhibent la dégranulation des mastocytes humains [95-96]. Le traitement combinatoire permet d’empêcher l’hyperréactivité bronchique, bien que l’inhibition de la dégranulation ne soit que partielle. Donc, bien que la dégranulation soit un évènement
![Figure 1. Schéma récapitulatif des traitements proposés pour l’asthme. Adapté de Global initiative for asthma [4]](https://thumb-eu.123doks.com/thumbv2/123doknet/6490680.173419/12.918.181.720.153.569/figure-schéma-récapitulatif-traitements-proposés-adapté-global-initiative.webp)

![Figure 4. Spectre de classification des macrophages [Mosser DM et al, avec la permission d’utilisation] 48](https://thumb-eu.123doks.com/thumbv2/123doknet/6490680.173419/20.918.290.625.352.662/figure-spectre-classification-macrophages-mosser-avec-permission-utilisation.webp)