HAL Id: dumas-01633895
https://dumas.ccsd.cnrs.fr/dumas-01633895
Submitted on 13 Nov 2017HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Leucémie aiguë chez les patients VIH+ : épidémiologie,
prise en charge thérapeutique et pronostic
Florence Rabian
To cite this version:
Florence Rabian. Leucémie aiguë chez les patients VIH+ : épidémiologie, prise en charge thérapeutique et pronostic. Médecine humaine et pathologie. 2016. �dumas-01633895�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2016
N° 89
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Leucémie aiguë chez les patients VIH+ : épidémiologie,
prise en charge thérapeutique et pronostic
Présentée et soutenue publiquement
le 22 juin 2016
Par
Florence RABIAN
Née le 24 avril 1986 à Paris (75)
Dirigée par M. Le Docteur Emmanuel Raffoux, PH
Jury :M. Le Professeur Hervé Dombret, PU-PH……….. Président M. Le Professeur Éric Oksenhendler, PU-PH
M. Le Professeur Pierre-Marie Girard, PU-PH
Remerciements
A mon président de Jury, Monsieur le Professeur Hervé Dombret pour m’avoir transmis son intérêt pour les leucémies aiguës. Merci pour votre sens critique, votre disponibilité et votre confiance. Soyez assuré de ma grande reconnaissance.
A mon directeur de thèse, Monsieur le Dr Emmanuel Raffoux qui m’a proposé ce sujet de Thèse. Merci pour ton aide, ton écoute, ton énergie et ta gentillesse. Merci pour le temps que tu passes auprès des patients. Merci pour ce semestre à M3 qui m’a tant apporté.
A monsieur le Professeur Eric Oksenhendler pour l’honneur que vous me faites en participant à ce Jury de thèse et pour votre expertise. J’aurai aimé avoir plus de temps dans mon internat pour venir apprendre à vos côtés.
A monsieur le Professeur Pierre Marie Girard pour m’avoir montré la réalité de la prise en charge globale des patients VIH et pour ce semestre très enrichissant que j’ai passé au MIT.
A madame la Professeur Stéphanie Nguyen, pour avoir accepté de faire partie de mon Jury de thèse. Merci pour ton enseignement, ton dynamisme et ton enthousiasme à toute épreuve.
A madame la Professeur Sylvie Chevret pour sa disponibilité et son aide précieuse dans l’analyse des données.
A Mme Dominique Costagliola pour nous avoir permis d’exploiter la base de données nationale des patients VIH+.
A tous les centres, médecins, ARCs, TECs et secrétaires qui m’ont aidé dans ce recueil de données.
Aux chefs de services et aux Professeurs qui m’ont accueillie et formée, me
permettant de m’épanouir tout au long de mon internat : Pr Castaigne, Pr Rousselot, Dr Blot, Pr Dombret, Pr Fermand, Pr Arnulf, Pr Leblond, Pr Socié, Pr Peffault de la Tour, Pr
Delhommeau, Pr Hermine, Dr Rothschild.
A monsieur le Professeur François Dreyfus qui m’a fait découvrir l’hématologie et a contribué à mon plongeon dans cette spécialité passionnante.
Au Professeur Patricia Ernst pour m’avoir fait découvrir le monde de la recherche outre-Atlantique. Merci pour votre encadrement, votre enthousiasme et pour m’avoir permis de vivre cette expérience très enrichissante.
Aux docteurs qui m’ont transmis leur sens clinique ou biologique et qui ont participé à la richesse humaine et médicale de mon internat : Dr Raffoux bien sûr, Dr Malphettes, Dr Asli, Dr Harel, Dr Szalat, Dr Roos-Weil, Dr Pacanowski, Dr Marzac, Dr Sicre de Fontbrune, Dr Wolfromm, Dr Gomez, Dr Lenglet, Dr Rossignol, Dr Frenzel, Dr Delarue, Dr Harroche.
A ceux qui ont partagé les bancs de la Fac avec moi et avec qui je ne me lasserai jamais de partager : Yohann, Lise, Romain, Virginie, Anne, Camille, Jessica et Clara.
A mes co-internes : de ceux qui ont vu mes premiers pas d’interne à Versailles (Arlette, t’en souviens-tu ?), à celles qui auront vu mes derniers à Necker.
Un clin d’œil et un remerciement particulier à ceux de la théorie des « bien peignés » de M3, à la Famille de M4, à Sarah (n’oublies pas, pierre qui roule n’amasse pas mousse), aux poinçonneuses des Lilas ainsi qu’à la Baronne, Nono et Manman, ma formidable équipe de la Pitié.
Aux infirmières, aux aides soignantes, aux secrétaires et aux ARCs pour tous ces moments passés ensemble et pour ce qu’ils apportent quotidiennement aux patients.
A mes parents et à mon frère pour leur soutien, leurs encouragements, leur aide et leur présence si importante pour moi. Je ne pourrai jamais assez vous en remercier.
A Nicko pour tout ce que tu m’apportes au quotidien et tout ce que tu représentes.
A Laura, Florie, Karen et Brice, mes amis de toujours, à Fabrice mon complice depuis le début et à ceux qui nous ont rejoints : Mylène, Pierre Yves, Nicolas, Lotan, Maxime, Romain et Guillaume. Merci d’avoir toujours été là et de tenir une aussi grande place dans ma vie.
A tous ceux que je n’ai pas cités mais qui comptent beaucoup.
Possunt, quia posse videntur,
They can because they think they can, Virgil, Enéide, Chant V
TABLE DES MATIERES
Table des illustrations!...!6!
Abréviations!...!8!
I. Introduction!...!9!
1. Généralités!...!9!
2. Le virus de l’immunodéficience humaine!...!10!
a. Définitions!...!10! i. Le VIH!...!10! ii. Le SIDA!...!14! b. Epidémiologie!...!14! i. Dans le monde!...!14! ii. En France!...!18!
c. Les traitements anti rétroviraux!...!18!
i. Indications du traitement ARV!...!19!
ii. Les classes thérapeutiques!...!20!
d. La fragilité du patient VIH+!...!22!
i. Les comorbidités!...!22!
ii. Le syndrome de fragilité!...!22!
iii. Les cancers non classant au stade SIDA!...!23!
e. Exploration d’une cytopénie chez le patient VIH+!...!23!
i. Cytopénie isolée!...!24!
ii. Bicytopénie ou pancytopénie!...!25!
3. Les leucémies aiguës!...!26!
a. Les leucémies aiguës myéloïdes!...!26!
i. Diagnostic!...!26!
ii. Physiopathologie : une évolution clonale!...!29!
iii. Pronostic!...!31!
iv. Traitement!...!32!
b. Les leucémies aiguës lymphoïdes!...!33!
i. Diagnostic!...!33!
ii. Physiopathologie : une évolution clonale!...!36!
iv. Traitement!...!39!
4. Traitement des hémopathies agressives chez le patient VIH+!...!39!
II. Matériel et Méthodes!...!42!
1. Population d’étude!...!42!
2. Méthodes!...!42!
3. Analyse Statistique!...!43!
III. Résultats!...!45!
1. Caractéristiques des patients VIH ayant une leucémie aiguë!...!46!
a. Patients ayant une LAM!...!46!
i. Caractéristiques des LAM!...!46!
ii. Caractéristiques de la maladie VIH au diagnostic de LAM!...!49!
b. Patients ayant une LAL!...!51!
i. Caractéristiques des LAL!...!51!
ii. Caractéristiques de la maladie VIH au diagnostic de la LAL!...!51!
2. Prise en charge thérapeutique des patients VIH ayant une leucémie aiguë!...!53!
a. Patients ayant une LAP!...!53!
b. Patients ayant une LAM non LAP!...!53!
c. Patients ayant une LAL!...!54!
3. Devenir des patients VIH ayant une leucémie aiguë!...!55!
a. Patients ayant une LAP!...!55!
b. Patients ayant une LAM!...!55!
c. Patients ayant une LAL!...!56!
4. Devenir des patients VIH ayant une leucémie aiguë!...!57!
a. Facteurs pronostiques influençant la survie des patients VIH!...!57!
i. Analyse univariée!...!57!
ii. Analyse multivariée!...!59!
b. Pronostic des patients VIH+ ayant une leucémie aiguë!...!60!
i. Caractéristiques des témoins!...!60!
ii. Comparaison brute du devenir des PPVIH atteints de LA comparés aux témoins!.!63! iii. Comparaison du devenir des PPVIH atteints de LA après appariement par score de propension!...!64!
IV. Discussion!...!67!
2. Association entre VIH+ et développement d’une leucémie aiguë!...!68!
a. Les facteurs de leucémogenèse indépendants de l’infection par le VIH!...!68!
b. Les facteurs de leucémogenèse liés au VIH!...!69!
3. Généralités sur la prise en charge hématologique du PPVIH!...!71!
a. Diagnostic de la séropositivité et de l’hémopathie!...!71!
b. Recommandations de bonnes pratiques!...!71!
4. Traitement par chimiothérapie intensive d’une LA chez un patient VIH+!...!72!
a. Faisabilité d’une chimiothérapie intensive!...!73!
b. Eligibilité des patients à la chimiothérapie intensive!...!77!
c. Pronostic des PPVIH traités par chimiothérapie intensive!...!78!
5. Traitement par allogreffe de moelle d’un PPVIH ayant une LA!...!80!
a. Faisabilité de l’allogreffe de moelle chez le PPVIH!...!80!
b. Eligibilité du PPVIH à une allogreffe de moelle!...!80!
c. Pronostic de l’allogreffe de moelle chez le PPVIH!...!81!
6. Facteurs pronostiques du PPVIH ayant une LA!...!81!
a. Les facteurs pronostiques traditionnels!...!81!
b. Particularités des facteurs pronostiques chez le PPVIH!...!82!
7. Perspectives thérapeutiques!...!82!
a. Perspectives thérapeutiques pour les patients VIH +!...!82!
b. Perspectives thérapeutiques des PPVIH ayant une leucémie aiguë!...!83!
V. Conclusion!...!85! Bibliographie!...!86! Annexes……….93! Résumé………...96! Abstract……….96! ! ! ! ! !
Table des illustrations
!!
Figure 1. Le cycle viral p.11
Figure 2. Evolution du taux de T CD4+, de la charge virale et des manifestations
cliniques après infection par le VIH p.13
Figure 3. Mécanismes d’action des différents ARV p.20
Figure 4. Modèle intégrant les mutations driver et passenger lors de la leucémogenèse p.31
Figure 5. Evènements génétiques leucémogènes des LAL B p.37
Figure 6. Study Flow Chart p.45
Figure 7. A. Antécédents oncologiques des PPVIH p.47
Figure 7. B. Antécédents hématologiques des PPVIH p.47
Figure 8. Caractéristiques cytologiques des LAM p.48
Figure 9. Classification pronostique des PPVIH ayant une LAM selon le groupe
ALFA p.49
Figure 10. Gestion du traitement ARV au diagnostic de LAM p.50
Figure 11. Traitements des patients sous ARV au diagnostic de LAM p.50
Figure 12. Prise en charge thérapeutique des LAM non LAP chez les PPVIH p.53
Figure 13. Survie en fonction du diagnostic p.56
Figure 14. Survie globale en fonction des facteurs pronostiques associés
statistiquement au risque de décès après analyse univariée p.57
Figure 15. Distribution de l’âge des cas et des témoins en fonction des différents
protocoles p.61
Figure 16. A. Survie brute des cas et des témoins en fonction du type de LA p.64
Figure 16. B. Survie globale et survie sans évènement des témoins à 2 ans p.64
Figure 17. Déséquilibre des covariables avant et après appariement p.65
Figure 18. Devenir des patients après appariement par le score de propension excepté
sur le statut VIH p.66
Tableau 1. Classification de l’infection par le VIH du CDC p.15
Tableau 2. Classification de l’infection par le VIH de l’OMS p.16
Tableau 3. Statistiques du VIH et du SIDA dans les le monde p.17
Tableau 4. Initiation d’un traitement ARV chez un adulte symptomatique p.20
Tableau 5. Recommandations de trithérapies antirétrovirales p.21
Tableau 6. Caractéristiques clinico-biologiques des LAM p.27
Tableau 7. Classification OMS des LAM p.28
Tableau 8. Classification ELN des LAM p.29
Tableau 9. Classification des LAL selon l’EGIL p.34
Tableau 10. Classification OMS des LAL p.35
Tableau 11. Définition des groupes cytogénétiques et moléculaires des LAM selon
l’ALFA et des LAL selon le GRAALL p.43
Tableau 12. Caractéristiques de base des patients de notre cohorte p.52
Tableau 13. Caractéristiques des PPVIH ayant une LAM allogreffés p.54
!
!
Tableau 15. Description du devenir des PPVIH atteints de LAM ou de LAL p.56
Tableau 16. A. Description des caractéristiques des patients en fonction du statut
« vivant »/ « décédé » p.58
Tableau 16. B. Résultats de l’analyse univariée p.59
Tableau 17. Modèle pronostique multivarié pour le risque de décès p.60
Tableau 18. Caractéristiques principales des protocoles dont sont issus les témoins p.60
Tableau 19. Caractéristiques des témoins p.62
Tableau 20. Description du nombre de témoins disponibles en fonction du centre de
provenance des cas p.63
Tableau 21. Description du devenir des patients du groupe témoin p.63
Abréviations
5-aza : 5-azacytidineAraC : aracytine
ARL : aids related lymphoma ; lymphomes liés au SIDA ARV : antirétroviraux
ATCD : antécédent
ATRA : acide tout trans rétinoïque ATO : trioxyde d’arsenic
AZT : zidovudine
Biomol : biologie moléculaire
CDC : Center for Disease Control and Prevention CMF : cytométrie en flux
CSH : cellule souche hématopoïétique CV : charge virale
CYP : cytochrome FDR : facteur de risque
GVH : graft versus host disease ; réaction du greffon contre l’hôte HL : hyperleucocytaire
INI : inhibiteur de l’intégrase
INNTI : inhibiteur non nucléosidique de la transcriptase inverse INTI : inhibiteur nucléosidique de la transcriptase inverse INVS : Institut de veille sanitaire
IP : inhibiteur de protéase
IRIS : syndrome inflammatoire de restauration immunitaire LAL : leucémie aiguë lymphoïde
LAM : leucémie aiguë myéloïde LAP : leucémie aiguë promyélocytaire
LBDGC : lymphome B diffus à grandes cellules LNH : lymphome non Hodgkinien
LRA : latency reversing agent ; agents reversant la latence virale
MGUS : monoclonal gammogathy of unknown significance ; gammapathie monoclonale de signification indéterminée
NADCs : non AIDS defining cancers ; cancers non classant au stade SIDA PA : personne année
PMSI : programme de médicalisation des systèmes d’information
PPVIH / PVVIH : patient porteur du VIH / personnes vivant avec le VIH RC : rémission complète
SIDA : syndrome d’immunodéficience acquise SMD : syndrome myélodysplasique
TRM : transplantation related mortality ; mortalité liée à la greffe TT : traitement
VHB : virus de l’hépatite B VHC : virus de l’hépatite C
I. Introduction
!1. Généralités
Les patients infectés par le virus d’immunodéficience humaine (VIH) sont à risque de développer des complications d’ordre infectieuses ou tumorales. Certaines de ces complications tumorales marquent le passage du patient dans la maladie SIDA (syndrome d’immunodéficience acquise). Ces cancers comme le lymphome B non Hodgkinien, le sarcome de Kaposi ou le cancer invasif du col de l’utérus sont dits « classant ». D’autres tumeurs, dont l’incidence augmente depuis l’arrivée des antirétroviraux de nouvelle génération, sont rapportées chez les patients infectés par le VIH sans que leur association éventuelle avec l’infection par le VIH soit démontrée.
Les syndromes myélodysplasiques sont les hémopathies myéloïdes les plus fréquemment observées et donc les plus décrites chez les patients VIH+. Des syndromes myéloprolifératifs ont été plus rarement rapportés. Des cas de leucémies aiguës myéloïdes (LAM) de novo ou secondaires ont également été décrits chez des patients séropositifs mais peu de séries existent.
Pour les hémopathies lymphoïdes de bas grade, le lymphome non Hodgkinien B (LNH) de bas grade reste l’hémopathie la plus fréquemment associée au virus du SIDA. Cependant, un nombre croissant de patients VIH présentant une MGUS (gammapathie monoclonale de signification indéterminée) ont été identifiés. Pour les hémopathies lymphoïdes de haut grade, les leucémies/lymphome de Burkitt et les lymphomes B diffus à grandes cellules sont les plus fréquemment observés chez ces patients à la différence des leucémies aiguës lymphoïdes (LAL) non Burkitt qui ne comptent que quelques cas dans la littérature.
L’épidémiologie des LAM et des LAL non Burkitt reste donc méconnue dans la population des patients VIH+ tout comme la prise en charge thérapeutique optimale de ces patients et leur pronostic car ces patients ne sont pas inclus dans les études cliniques du fait de leur séropositivité.
Nous allons nous intéresser dans cette étude, après avoir défini les différentes entités que sont le VIH et les leucémies aiguës (myéloïdes et lymphoïdes non Burkitt) ainsi que l’évolution de la prise en charge thérapeutique des patients VIH+ atteints d’une hémopathie agressive, aux caractéristiques des patients VIH+ ayant une leucémie aiguë, à leur prise en charge thérapeutique, à leur devenir et à leur pronostic.
2. Le virus de l’immunodéficience humaine
a. Définitions
i. Le VIH !
Le virus de l’immunodéficience humaine appartient à la famille des rétrovirus du genre des lentivirus.
L’origine du VIH serait simienne selon la théorie communément admise issue des analyses phylogénétiques des lentivirus qui relient le VIH au virus d’immunodéficience simien (VIS). Le passage du singe à l’homme aurait eu lieu selon les études à la fin du XIXème siècle ou au début du XXème siècle.
Le VIH a une très grande variabilité génétique et présente ainsi une très grande diversité. Cette très grande variabilité génétique s’explique par des mutations aléatoires fréquentes lors de transcription de l’ARN en ADN par la transcriptase inverse et par des recombinaisons éventuelles lors de l’infection d’une cellule par deux virions génétiquement différents. Cette variabilité est régulée par le processus de sélection naturelle qui favorise la transmission des virions les plus résistants.
On distingue deux sous types de virus principaux : le VIH-1 qui est majoritaire dans le monde et le VIH-2, moins contagieux, que l’on retrouve principalement en Afrique de l’Ouest. Ces 2 sous types sont eux-mêmes divisés en différents sous-groupes.
!Transmission
La VIH peut se transmettre par voie sexuelle, lors de rapports sexuels non protégés (de 4 à 138 pour 10 000 personnes), par voie sanguine (de 23 à 9250 pour 10 000 personnes) après un contact avec du sang contaminé ou par voie materno-fœtale : d’une mère porteuse du virus à son enfant pendant la grossesse, l’accouchement ou lors de l’allaitement (2260 pour 10 000 personnes1).
!Structure
Le VIH-1 et le VIH-2 ont 40% d’homologie au niveau de l’enveloppe et 60% au niveau des gènes gag. Nous décrirons la structure du VIH-1 dans la suite du paragraphe.
Le VIH-1 est un virus sphérique dont l’enveloppe lipidique correspond à un fragment de la membrane de la cellule infectée. Des trimères de glycoprotéines d’enveloppe (Env) sont insérés dans celle-ci, chacun étant composé d’une sous unité de surface gp120 et d’une sous unité transmembranaire gp41.
A l’intérieur de l’enveloppe se trouve une matrice protéique (MA) composée de protéines p17 avec à l’intérieur de celle-ci la capside (CA) elle-même composée de protéines p24. A l’intérieur de la capside se trouve la néocapside (NC) composée de protéines p7. Ces dernières recouvrent l’ARN viral en le protégeant. La protéine p6 se trouve entre la matrice et la capside permettant la sortie par bourgeonnement des virus néoformés dans la cellule.
! 11! La capside contient le génome du VIH, constitué d’un brin d’ARN en double exemplaire et des enzymes suivantes : la transcriptase inverse p66/p51 qui retranscrit l’ARN viral en ADN viral, l’intégrase p32 qui intègre l’ADN viral à l’ADN cellulaire et la protéase p12 qui participe à l’assemblage du virus en clivant les précurseurs protéiques Gag p55 et Gag-Pol p160. Ces trois enzymes étant spécifiques aux rétrovirus, elles représentent les cibles principales des traitements anti rétroviraux.
Le génome du VIH est composé de 9 gènes dont les 3 principaux, gag, pol et env définissent la structure du virus et sont communs à tous les rétrovirus. Les 6 autres codent des protéines régulatrices.
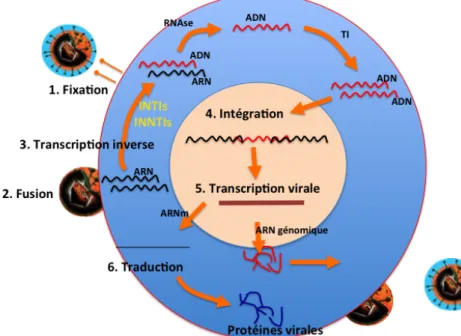
! Cycle viral
Le VIH a pour cible les cellules présentant des récepteurs CD4 à leur surface. Ainsi les principales cellules infectées par le VIH sont les lymphocytes T mais aussi les monocytes/macrophages, cellules dendritiques, cellules de Langerhans ou les cellules micro-gliales.
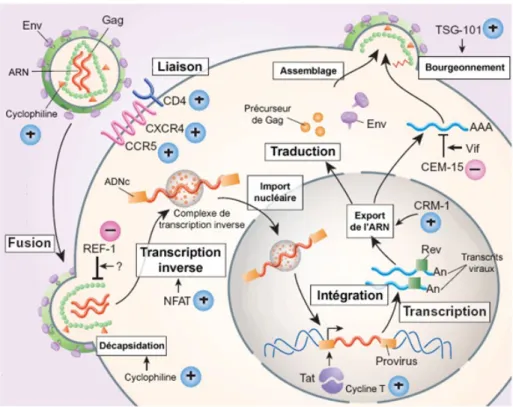
Le virus pénètre donc dans sa cellule cible grâce à la protéine gp120 située sur l’enveloppe du virus qui reconnaît le CD4 et grâce à des corécepteurs : CXCR4 (pour les T CD4+) et CCR5 (pour les macrophages). (Figure 12).
L’union de gp120 avec le co récepteur libère la protéine gp41 qui se fixe sur la membrane cytoplasmique et permet la fusion des membranes cellulaire et virale grâce à un peptide de fusion qu’elle contient. La capside du VIH se désagrège alors dans le cytoplasme de la cellule cible libérant les deux brins d’ARN et les enzymes qu’elle contenait. Survient ensuite l’étape de transcription inverse qui est spécifique aux rétrovirus : la transcriptase inverse permet la synthèse d’une première molécule d’ADN (brin(-)) à partir de l’ARN matrice qui est par la suite dégradée par l’activité ribonucléase H de la transcriptase inverse. Le brin (+) est ensuite synthétisé afin d’obtenir un ADN final double brin. La transcriptase inverse n’étant pas fidèle dans sa transcription, elle contribue à la très grande variabilité génétique du VIH.
L’ADN bi-caténaire étroitement associé à l’intégrase et au complexe de pré-intégration traverse la membrane nucléaire pour intégrer aléatoirement le génome de la cellule cible. Cet import est une des spécificités des lentivirus qui sont capables d’infecter des cellules qui ne sont pas en division.
La transcription de l’ADN et la traduction de l’ARNm ont lieu grâce à la machinerie cellulaire. La maturation des protéines virales est achevée dans l’appareil de golgi après clivage par une protéase virale. Les poly-protéines Gag et Gag-Pol sont transportées à la membrane cellulaire à la sortie du Golgi où elles rejoignent les glycoprotéines virales membranaires. Là, différentes interactions permettent l’assemblage d’une structure globulaire et la formation d’une nouvelle particule virale par bourgeonnement de la membrane plasmique à laquelle ont été préalablement fixées les protéines virales de surface gp120 et gp41.
!Physiopathologie
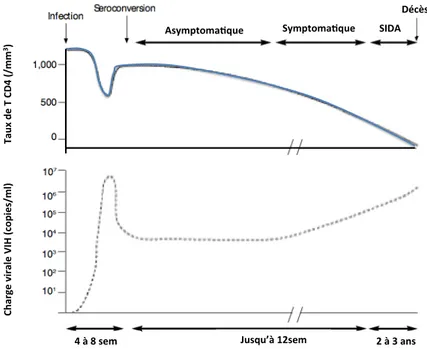
Plusieurs phases pouvant se succéder dans le temps suivent l’infection par le VIH. (Figure 23.).
La primo-infection est une étape qui peut être symptomatique (dans 50 à 75% des cas) ou asymptomatique. Lors de celle-ci, le virus se réplique avec une production quotidienne d’environ 10 milliards de virions entraînant la destruction de 5 milliards de T CD4+.
Une phase de latence lui succède, pendant laquelle la réplication virale se stabilise après quelques semaines à un niveau plus ou moins important selon les sujets. La destruction massive des T CD4+ est alors compensée par une hyperproduction de l’organisme. Il faut noter que la destruction des T CD4+ est souvent liée à leur hyper-activation secondaire à leur interaction avec des structures virales et non par une destruction directe par le VIH : il s’agit du baiser de la mort (« kiss of death »)4. La phase de latence est caractérisée parfois cliniquement par une lymphadénopathie généralisée.
Enfin, une phase d’immunodépression profonde, appelée stade SIDA généralement symptomatique du fait d’infections opportunistes ou de complications tumorales révèle parfois l’infection par le VIH. Cette phase peut survenir plusieurs années après la primo-infection, l’épuisement des organes lymphoïdes centraux (thymus) ne permettant plus de compenser la perte des T CD4+.
Décès& SIDA& Symptoma0que& Asymptoma0que&
4&à&8&sem& Jusqu’à&12sem& 2&à&3&ans&
Tau x&d e& T&CD4&( /mm 3)& Ch arge&vi ra le&VI H&( co pi es/ ml )&
!La notion de réservoir
Dès les premiers jours suivant l’infection par le VIH, apparaissent des cellules infectées par le VIH à l’état latent qui sont invisibles du système immunitaire5. Le VIH a ainsi élaboré plusieurs mécanismes pour échapper à la réponse immune innée et adaptative. Les thérapies anti rétrovirales ont permis une augmentation importante de l’espérance de vie des patients VIH+ mais sont incapables d’éliminer les cellules infectées par le VIH à l’état latent. De nouvelles approches thérapeutiques visent actuellement ce réservoir avec pour but la guérison fonctionnelle de l’infection par le VIH.
!Le dépistage et le diagnostic
Le test actuellement utilisé dans les laboratoires français est un test Elisa de 4ème génération qui permet de détecter simultanément des anticorps contre le VIH-1, le VIH-2 mais également l’antigène p24 permettant ainsi le dépistage des infections récentes (infections supérieures à 6 semaines). Si ce test est positif, un western blot doit être réalisé pour confirmer le diagnostic. On estime en 2015 à 17,1 millions le nombre de personnes vivant avec le VIH (PPVIH) méconnaissant leur séropositivité.
Comme nous l’avons vu précédemment, l’infection par le VIH peut rester asymptomatique pendant de nombreuses années, jusqu’à l’apparition de complications infectieuses et/ ou tumorales liées à la profondeur de l’immunodépression et marquant le passage au stade SIDA.
Figure 2. Evolution du taux de T CD4+, de la charge virale et des manifestations
cliniques après infection par le VIH, tiré de Plasma viral load testing in the management of HIV infection, Mylonakis, American Family physician, 2001
ii. Le SIDA
Le SIDA est le syndrome d’immunodéficience acquise. Il est défini par l’ensemble des symptômes consécutifs à la destruction de cellules du système immunitaire par le virus d’immunodéficience humaine (VIH) et donc à l’ensemble des manifestations des infections opportunistes ou de complications tumorales liées à une déplétion profonde de l’immunité cellulaire. Certains patients ne développent pas le SIDA même en l’absence de traitement. Il s’agit des asymptomatiques à long terme dont une sous population est composée de contrôleurs du VIH (environ 1% des séropositifs). L’année 2016 marque le 35ème anniversaire du premier patient séropositif décrit comme ayant le SIDA.
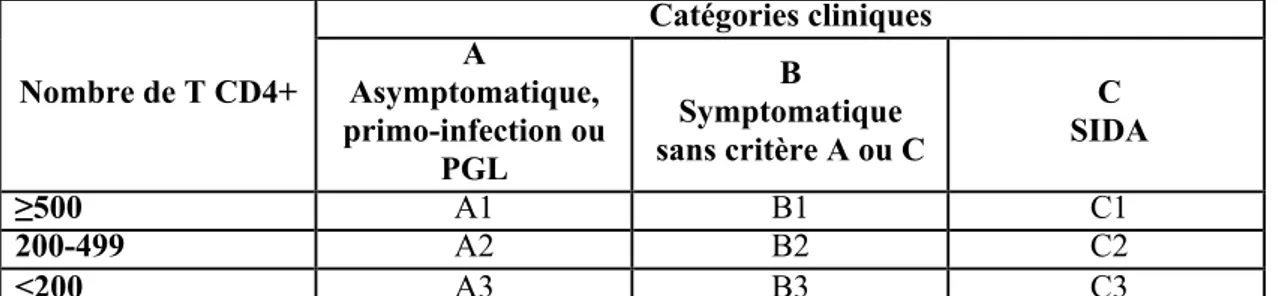
Il existe deux classifications pour décrire la progression de l’infection par le VIH : la
classification du CDC et la classification de l’OMS. Elles sont fondées sur les manifestations cliniques et le taux de T CD4+. (Tableau 16 et 2).
b. Epidémiologie
Depuis 2002, le SIDA est considéré comme une pandémie mondiale.
Avant de parler des données épidémiologiques du VIH et du SIDA dans le monde puis en France, il convient tout d’abord de redonner les définitions d’incidence et de prévalence. L’incidence est le nombre de nouvelles personnes infectées par le VIH par unité de temps dans une entité géographique donnée alors que la prévalence est le nombre de personnes vivants avec le VIH (PVVIH) à un moment donné.
Une des particularités de l’infection par le VIH et que les nouveaux diagnostics ne reflètent pas l’incidence de la maladie. En effet, même si la déclaration est obligatoire dans certains pays comme en France depuis 2003, ces nouveaux diagnostics sont sous tendus par la pratique des tests de dépistage et des tests diagnostiques, ceux-ci étant d’accès hétérogène en fonction des populations.
i. Dans le monde !
Les dernières estimations fournies par le rapport ONUSIDA (2014)7 portent à 36,9 millions le nombre de personnes infectées par le VIH dans le monde avec 2 millions de personnes nouvellement infectées et 1,2 millions de personnes décédées du SIDA la même année. On observe une relative stabilité du taux d’infection mais une augmentation du nombre de patients vivants avec le virus du SIDA à un temps t grâce à l’accès de plus en plus de patients aux trithérapies. En juin 2015, 15,8 millions de personnes avaient accès au traitement anti rétroviral.
! Nombre de T CD4+ Catégories cliniques A Asymptomatique, primo-infection ou PGL B Symptomatique sans critère A ou C C SIDA ≥500 A1 B1 C1 200-499 A2 B2 C2 <200 A3 B3 C3 Catégorie C :
Correspond à la définition du Sida chez l’adulte. Lorsqu’un sujet a présenté une des pathologies de cette liste, il est classé définitivement dans la catégorie C. :
. Candidose bronchique, trachéale ou extra pulmonaire
. Candidose oesophagienne . Cancer invasif du col
. Coccidioidomycose disséminée ou extra pulmonaire
. Cryptococcose extra-pulmonaire . Cryptosporidiose intestinale évoluant
depuis plus d’un mois
. Infection à CMV (autre que foie, rate, ganglions)
. Rétinite à CMV
. Encéphalopathie due au VIH
. Infection herpétique, ulcères chroniques supérieurs à 1 mois ou bronchique, pulmonaire ou oesophagienne . Histoplasmose disséminée ou extra
pulmonaire
. Isosporidiose intestinale chronique (>1m) . Sarcome de Kaposi
. Lymphome de Burkitt
. Lymphome immunoblastique . Lymphome cérébral primaire
. Infection à mycobacterium tuberculosis (quelque soit la localisation)
. Infection à mycobactérie identifiée ou non, disséminée ou extra pulmonaire . Pneumonie à Pneumocystis carinii . Pneumopathie bactérienne récurrente . Leuco-encéphalopathie multifocale
progressive
. Septicémie à salmonelle non typhique récurrente
. Syndrome cachectique dû au VIH . Toxoplasmose cérébrale
!
Tableau 1. Classification de l’infection par le VIH, source : C.D.C. - 1993 Revised
classification system for HIV infection and expanded surveillance Case definition for AIDS among Adolescents and adults
Catégorie A :
Un ou plusieurs critères listés ci-dessous chez un adulte ou un adolescent infecté par le VIH s’il n’existe pas aucun des critères des catégories B et C.
. Infection VIH asymptomatique . Lymphadénopathie persistante
généralisée
. Primo-infection asymptomatique
Catégorie B :
. Manifestations cliniques chez un adulte ou un adolescent infecté par le VIH, ne faisant pas partie de la catégorie C et qui répond au moins à l’une des conditions suivantes :
o Liées au VIH ou indicatives d’un déficit immunitaire o Evolution clinique ou prise
en charge thérapeutique compliquée par l’infection VIH
Par exemple :
. Angiomatose bacillaire . Candidose oropharyngée . Candidose vaginale persistante,
fréquente ou répondant mal au traitement
. Dysplasie du col (modérée ou grave), carcinome in situ
. Syndrome constitutionnel : fièvre (38.5°C) ou diarrhées> à 1 mois . Leucoplasie chevelue de la langue . Zona récurent ou envahissant plus d’un
dermatome . Purpura thrombocytopénique idiopathique . Listériose . Neuropathie périphérique !
Stade Clinique 1
. Patient asymptomatique
. Adénopathies persistantes généralisées . Degré d’activité 1 : activité normale .
Stade Clinique 2
. Perte de poids <10% du poids corporel . Zona (au cours des 5 dernières années)
. Manifestations cutanéo-muqueuses mineurs (dermite séborrhéique, prurigo, ulcérations buccales, chéilite angulaire
. Infections récidivantes des voies aériennes supérieures . Degré d’activité 2 : patient symptomatique, activité normale .
Stade Clinique 3
. Perte de poids >10% du poids corporel . Diarrhées inexpliquées > 1 mois . Fièvre prolongée > 1 mois . Candidose buccale
. Leucoplasie orale chevelue
. Tuberculose pulmonaire au cours de l’année précédente . Infection bactérienne sévère
. Degré d’activité 3 : patient alité < 50% du temps
Stade Clinique 4
. Syndrome cachectisant du au VIH . Pneumocystose
. Toxoplasmose cérébrale
. Cryptosporidiose avec diarrhées > 1 mois . Cryptococcose extra pulmonaire
. CMV
. Herpes virose cutanéo-muqueuse > 1 mois ou viscérale . Leucoencéphalopathie multifocale progressive
. Mycose endémique généralisée (histoplasmose, coccidoidomycose) . Candidose oesophagienne, trachéale, pulmonaire
. Mycobactériose atypique disséminée . Septicémie à salmonelle mineure . Tuberculose extra pulmonaire . Lymphome malin
. Sarcome de Kaposi . Encéphalopathie à VIH
. Degré d’activité 4 : patient alité > 50% du temps
Tableau 2. Classification clinique du VIH/SIDA chez les adolescents et les adultes ayant une
infection VIH confirmée, selon l’OMS.
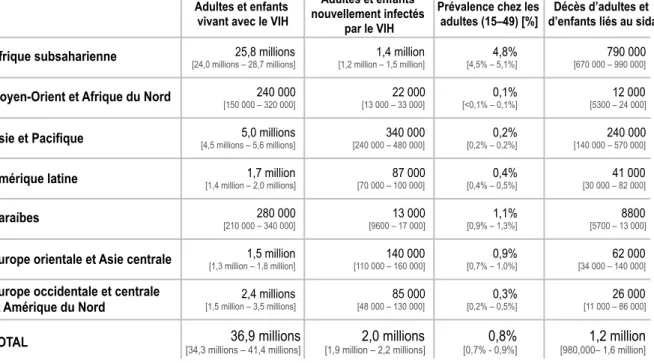
Les fourchettes entourant l’estimation définissent les limites dans lesquelles les chiffres réels se situent, sur la base des meilleures informations disponibles.
Statistiques et caractéristiques régionales – VIH et sida
|
2014
Adultes et enfants nouvellement infectés
par le VIH Adultes et enfants
vivant avec le VIH Prévalence chez les adultes (15‒49) [%] d’enfants liés au sida Décès d’adultes et
TOTAL [34,3 millions – 41,4 millions] 36,9 millions [1,9 million – 2,2 millions] 2,0 millions [0,7% - 0,9%] 0,8% [980,000– 1,6 million] 1,2 million Afrique subsaharienne [24,0 millions – 28,7 millions] 25,8 millions [1,2 million – 1,5 million] 1,4 million [4,5% – 5,1%] 4,8% [670 000 – 990 000] 790 000
Asie et Pacifique [4,5 millions – 5,6 millions] 5,0 millions [240 000 – 480 000] 340 000 [0,2% – 0,2%] 0,2% [140 000 – 570 000] 240 000 Amérique latine [1,4 million – 2,0 millions] 1,7 million [70 000 – 100 000] 87 000 [0,4% – 0,5%] 0,4% [30 000 – 82 000] 41 000
Europe orientale et Asie centrale [1,3 million – 1,8 million] 1,5 million [110 000 – 160 000] 140 000 [0,7% – 1,0%] 0,9% [34 000 – 140 000] 62 000 Moyen-Orient et Afrique du Nord 240 000
[150 000 – 320 000] 22 000 [13 000 – 33 000] 12 000 [5300 – 24 000] 0,1% [<0,1% – 0,1%] Caraïbes 280 000 [210 000 – 340 000] 13 000 [9600 – 17 000] 8800 [5700 – 13 000] 1,1% [0,9% – 1,3%]
Europe occidentale et centrale
et Amérique du Nord [1,5 million – 3,5 millions] 2,4 millions [48 000 – 130 000] 85 000 [0,2% – 0,5%] 0,3% [11 000 – 86 000] 26 000 A noter que ces chiffres ne sont que des estimations obtenues grâce à l’Epimodel utilisé par l’ONUSIDA et se heurtent à des estimations officielles parfois fausses de certains états qui n’ont pas les moyens d’étudier avec exactitude l’évolution des cas au sein de leur propre pays ou qui préfèrent sous-estimer les chiffres officiels à des fins politiques. Ce qui reste certain c’est que les chiffres de la pandémie restent très importants notamment en Afrique, que l’épidémie s’étend rapidement en Asie, et poursuit son expansion en Europe Orientale.
En Afrique sub-saharienne, on estime à 1,4 million le nombre de nouvelles personnes infectées par le VIH en 2014, ce taux étant de 340 000 en Asie et dans le pacifique, de 140 000 en Europe orientale et en Asie centrale, de 87 000 en Amérique latine, de 85 000 en Europe occidentale et en Amérique du Nord, de 22 000 au moyen Orient et en Afrique du nord et de 13 000 aux caraïbes. (Tableau 3).
ii. En France !
La France dispose d’un bon dispositif de collecte des données épidémiologiques concernant les PPVIH. Les données de surveillance, les différentes études transversales (ex : PREVACAR et VESPA2) et les cohortes ANRS permettent d’enrichir ces données épidémiologiques. (Rapport Morlat 2013)8.
. Plusieurs méthodes statistiques permettent une estimation de l’incidence. Celles-ci se rejoignent pour parler sur la période de 2004 à 2007 de 7000 à 8000 nouvelles contaminations par an en France (IC95% 5500-9300) soit un taux d’incidence de 17 à 19 pour 100 000 PA. 40 à 50% de ces nouvelles contaminations se produisent chez des hommes ayant des rapports homosexuels (taux d’incidence pour ce sous-groupe : 1000 pour 100 000 PA) suivi par l’incidence chez les personnes originaires d’Afriques sub saharienne et les usagers de drogue par voie intra veineuse. Le nombre de séropositivité, après avoir diminué significativement entre 2004 et 2007, se stabilise. Les découvertes de séropositivité pour le VIH étaient de 6600 en 2014 et touchaient majoritairement les personnes de 25 à 49 ans (INVS).
L’estimation du nombre de personnes étant dans la cascade de la prise en charge est encore plus difficile que celle de l’incidence de la maladie. En 2010, 149 900 personnes vivaient avec le VIH en France dont 81% diagnostiquées, 74% dans le système de soins, 60% sous ARV depuis au moins 6 mois et 52% avaient une charge virale contrôlée. Il semblerait toutefois que la prise en charge du VIH varie en fonction des groupes de transmissions. En France, la moitié des patients séropositifs reçoit des ARV et a une charge virale contrôlée soit deux fois plus qu’aux USA probablement à cause des différences de maintien des patients dans le système de soin.
Une des informations intéressantes que l’on peut tirer des statistiques sur les personnes prises en charge est celle concernant le vieillissement de la population. Ainsi seulement 25% des patients étaient âgés de plus de 50 ans en 2008 contre 35% en 2011. Le management des patients et de leurs complications semble donc s’être amélioré même si les prises en charges diagnostiques pourraient être encore plus précoces. En effet, encore 29% des patients sont diagnostiqués au stade SIDA ou avec moins de 200 CD4/mm3 et seulement 35% le sont au moment de la primo infection ou avec un taux de CD4 supérieur à 500/mm3 (InVS, FHDH ANRS CO4). Ces patients recevraient pour 88% à 93% d’entre eux un traitement anti rétroviral combiné avec un nombre médian de CD4 à la mise au traitement de 345/mm3 en 2011 vs 258/mm3 en 2007 (InVS, FHDH ANRS CO4), reflétant bien l’évolution des recommandations en faveur d’un traitement précoce, que nous développerons dans le paragraphe suivant.
!
c. Les traitements anti rétroviraux
!
Les traitements anti rétro viraux hautement actifs sont largement disponibles dans les pays industrialisés depuis 1996. Leur émergence a permis une nette diminution de la mortalité liée au stade SIDA grâce à la diminution des infections et des tumeurs classant en stade SIDA, transformant l’infection par le VIH en maladie chronique.
Dans la cohorte européenne COHERE4, la mortalité des hommes ayant un taux de CD4>500/mm3 depuis plus de 3 ans est comparable à celle des hommes de la population générale. Cependant, les patients VIH+ sous ARV sont exposés à d’autres risques comme le risque cardiovasculaire, celui de développer des désordres neurocomportementaux ou des cancers non classant au stade SIDA et à la morbi-mortalité qui découle de ces complications.
L’efficacité immuno-virologique restant l’objectif principal, l’amélioration de la tolérance clinico-biologique, la diminution du risque de transmission du virus et l’amélioration de la qualité de vie sont aujourd’hui également très importants.
i. Indications du traitement ARV !
Durant l’infection par le VIH, 109 cellules sont infectées chaque jour. Environ 99% de
ces nouvelles cellules infectées meurent dans les 24 à 48H et une grande proportion des cellules restantes dans les 2 à 4 semaines. Après la mise sous ARV, la virémie décroit de 4 à 5 logs mais certaines cellules infectées persistent. Ces cellules qui possèdent des provirus latents ou défectueux pourraient avoir un avantage cellulaire par rapport aux cellules produisant des virions. En effet, elles n’expriment pas de protéines virales ce qui les rend moins vulnérables aux T CD8 cytotoxiques spécifiques du VIH et les protègent de l’effet cytopathique des protéines virales. Ces cellules peuvent donc faire l’objet d’une expansion clonale. Pour minimiser les effets cytopathogènes du VIH et la morbidité qui en découle, le traitement ARV doit permettre une négativation de la charge virale plasmatique (<50/ml) permettant ainsi une meilleur restauration immunitaire et un moindre risque de sélection des virus résistants.
L’initiation précoce d’un traitement ARV permet une meilleur préservation du système immunitaire : restauration ou maintien des CD4>500/mm3, CD4/CD8>1, préservation des T CD4+ mémoire, de la diversité du répertoire T et notamment de la réponse T spécifique anti VIH ainsi que la réduction de l’inflammation systémique chronique. Un traitement ARV débuté précocement permettrait également d’éviter l’apparition de mutants échappant aux lymphocytes T cytotoxiques dans le réservoir du VIH à l’état latent9.
L’éducation thérapeutique du patient est bien sûr primordiale avant l’initiation du traitement afin de limiter les risques de défaut d’observance, à savoir l’émergence de virus résistants.
Il est recommandé d’instaurer un traitement ARV chez toute personne vivant avec le VIH quel que soit le nombre de CD4 y compris si il est >500/mm3. Ce traitement est cependant différé si une infection opportuniste est concomitante du diagnostic de VIH afin de réduire le risque d’IRIS (syndrome inflammatoire de restauration immunitaire) et la surmortalité immédiate. (Tableau 4).
Le traitement ARV est également indiqué sans délai chez les patients VIH+ ayant une néoplasie.
Il est recommandé d’instaurer un traitement ARV chez toutes personnes vivant avec le VIH, quelque soit son nombre de CD4 (AII).
Le niveau de preuve de cette recommandation dépend de la situation du patient à l’initiation du traitement :
. CD4< 350/mm3 : AI
. CD4 entre 350 et 500/mm3 : AII . CD4>500/mm3 : BIII
. Primo infection : BII
Un traitement ARV efficace permet de prévenir la transmission du VIH d’une personne vivant avec le VIH à son partenaire sexuel. Cette information doit être portée à la connaissance des patients et un traitement ARV peut être entrepris dans le but de prévenir la transmission sexuelle du VIH. (AI pour la transmission au sein d’un couple hétérosexuel, BIII pour les autres situations.)
ii. Les classes thérapeutiques !
Il existe 6 différentes classes de traitements anti rétroviraux ayant des mécanismes d’action différents sur le cycle viral : les inhibiteurs nucléosidiques ou nucléotidiques de la transcriptase inverse (INTI), les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), les inhibiteurs de protéases (IP) les inhibiteurs de l’intégrase (INI), les inhibiteurs de la fusion (IF) et les antagonistes du CCR5. (anti-CCR5). Figure 3.
Tableau 4. Initiation d’un traitement ARV chez un adulte symptomatique, Rapport Morlat 2013.
Tableau 5. Recommandations de trithérapies antirétrovirales, Rapport Morlat 2013
!
2"INTI" INNTI" " Commentaires"
TenofovirDF/emtricitabine!1!cp/j! Efavirenz!600mgx1! AI!
Disponible!en!1cp/j! Surveillance!rénale!
Précautions!si!clairance<80ml/min!
Efavirenz!à!ne!pas!prescrire!à!des!femmes!enceintes!ou! susceptibles!de!le!devenir!
TenofovirDF/emtricitabine!1!cp/j! Ripivirine!25mgx1! A!I!
Disponible!en!1cp/j! Surveillance!rénale! Précautions!si!clairance<80ml/min! Uniquement!si!CV<5!log!copies!/ml! Précautions!si!CD4!<200/m3! Prise!au!cours!d’un!repas!
Abacavir!/!lamivudine!1!cp/j! Efavirenz!600mgx1! AI!
Efavirenz!à!ne!pas!prescrire!à!des!femmes!enceintes!ou! susceptibles!de!le!devenir!
Uniquement!si!CV<5!log!copies!/ml! Uniquement!si!HLA!B5701!négatif!
2"INTI" IP/r" " "
TenofovirDF/emtricitabine!1!cp/j! 300/100mg!x1!Atazanavie/r! AI! Surveillance!rénale!rapprochée!Précautions!si!clairance<80ml/min! TenofovirDF/emtricitabine!1!cp/j! 800/100!mg!x1!Darunavir/r! AI! Surveillance!rénale!rapprochée!Précautions!si!clairance<80ml/min! Abacavir!/!lamivudine!1!cp/j! 300/100mg!x1!Atazanavir/r! AI! Uniquement!si!CV<5!log!copies!/ml!Uniquement!si!HLA!B5701!négatif!
La tolérance attendue du traitement et son efficacité, la facilité de prise, les interactions médicamenteuses éventuelles, les comorbidités du patient, les résultats du test de résistance génotypique, les résultats de la recherche de l’allèle HLA B5701 et le coût du traitement sont autant de données à prendre en compte lors de son choix.
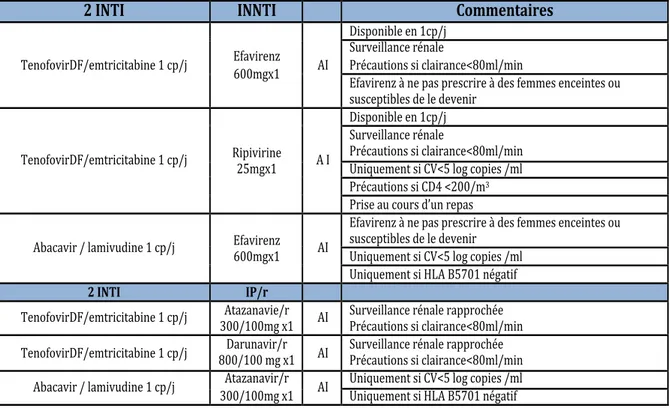
Il est recommandé en traitement de première ligne d’initier une trithérapie associant 2 INTI et un 3ème agent au choix. (Tableau 5).
L’association du TénofovirDF et de l’Emtricitabine ou de l’Abacavir et de la Lamivudine doit être utilisée préférentiellement lors de l’initiation d’une première trithérapie. L’association Abacavir/Lamivudine ne doit cependant être utilisée que chez les patients non porteurs de l’HLA B5701.
Un IP peut être utilisé comme 3ème agent, il est alors potentialisé par l’addition d’une faible dose de Ritonavir. Les associations Atazanavir/r ou Darunavir/r seront alors préférentiellement choisis.
Le choix d’une trithérapie avec un INNTI se heurte à 2 inconvénients : la connaissance des résultats du test génotypique devant le taux de résistance au INNTI (7,1% en 2012 dans la cohorte PRIMO) et la faible barrière génétique du VIH vis à vis des INNTI qui expose au risque de sélection rapide des virus résistants ; l’Efavirenz ou la Nevirapine seront alors préférentiellement choisis (si CV<5log copies/ml pour cette dernière).
Les INI peuvent également être choisis comme 3ème agent avec une bonne efficacité et une bonne tolérance.
En attendant l’arrivée de nouvelles stratégies thérapeutiques, l’accès aux trithérapies, en augmentation de 84% dans le monde depuis 2010, a déjà permis une réduction significative des décès des PVVIH. Le patient VIH sous trithérapie reste toutefois un patient fragile auquel il faut être attentif.
d. La fragilité du patient VIH+
!
Les PVVIH ont des facteurs de co morbidités plus fréquents que ceux de la population générale, parmi lesquelles un certain nombre de comorbidités classiquement associées au vieillissement comme les troubles métaboliques, les facteurs de risque cardiovasculaire, les troubles cognitifs, les atteintes rénales ou hépatiques ou encore le développement de cancers (classant mais aussi non classant SIDA). La notion de vieillissement prématuré ou accentué chez les patients PPVIH est donc discutée.
!
i. Les comorbidités !
Une des comorbidités fréquente des patients VIH+, souvent présente à la découverte de la séropositivité est la présence d’une co infection par le VHB ou le VHC. La prévalence de cette co infection était respectivement de 16,2% en 2011 pour le VHC (FHDH ANRS CO4) et de 7% pour le VHB en 2004.
Les comorbidités des patients séropositifs pour le VIH se diversifient avec le temps. Le nombre d’hospitalisation pour un événement classant SIDA, une infection bactérienne ou un événement psychiatrique a diminué alors que celui-ci a doublé pour les évènements cardiovasculaires. En 2012 sur 2784 patients suivis dans la cohorte Aquitaine ANRS CO3, 41% des patients présentaient une lipodystrophie, 66% une dyslipidémie, 9% un diabète et 26% une HTA. L’obésité (IMC≥30Kg/m2) toucherait 9% des personnes suivies avec une prédominance chez les femmes originaires d’Afrique subsaharienne et la maigreur (IMC<18,5Kg/m2) toucherait 6 % de la population (VESPA 2 Métropole).
ii. Le syndrome de fragilité
Le PVVIH vieillissant présente des caractéristiques particulières. Cette population présente en effet par rapport à la population générale du même âge une incidence accrue d’un syndrome dit de fragilité « frailty » défini par une diminution des réserves fonctionnelles, une augmentation de la vulnérabilité au stress et aux agressions et un risque accru de morbi-mortalité.
Ceci est en partie dû au rôle du virus VIH lui-même ou à ses protéines : par la persistance d’un état inflammatoire, par l’activation immune induisant à long terme une immunosénescence, par un contrôle immunologique généralement moins bon même si il est satisfaisant, par des co infections (CMV ou VHC) mais également par la surreprésentation de facteurs de risque cardiovasculaires ou de cancers.
Les traitements anti rétroviraux sont également capables pour certains d’induire un stress oxydant ou de permettre l’accumulation de protéines de sénescence comme la prélamine A qui pourrait contribuer à cet état de sénescence cellulaire.
Une surveillance accrue est actuellement recommandée chez les PPVIH après 50 ans et en particulier chez ceux infectés depuis longtemps, ayant reçu des ARV de 1ère génération plus toxiques, ayant un nadir de CD4 bas, gardant un taux de CD4 sub-optimal et un taux de CD8 élevé.
Ces idées de vieillissement prématuré et de syndrome de fragilité doivent être prises en compte dans la prise en charge des patients VIH+ pour d’autres pathologies. Leur évaluation et la discussion des stratégies thérapeutiques dans un cadre multidisciplinaire semblant primordiale.
iii. Les cancers non classant au stade SIDA
L’augmentation de l’espérance de vie des PVVIH grâce aux ARV ces dernières années a entraîné chez eux l’émergence de tumeurs considérées comme des tumeurs non classant au stade SIDA. L’émergence de ces tumeurs peut s’expliquer par l’augmentation de leur durée d’exposition à des oncogènes (environnement, mode de vie, co infections virales), leur vieillissement prématuré et leur fragilité. Ces tumeurs sont responsables d’une importante part de la morbi-mortalité qui touche actuellement les patient VIH+ sous ARV. Le rôle de l’immunosuppression dans la pathogénèse des NADCs (non AIDS defining cancers ; cancers non classant au stade SIDA) n’est pas bien défini alors que le degré d’immunodépression est au contraire un facteur de risque connu des cancers classant au stade SIDA. Ces tumeurs s’opposent donc aux tumeurs suivantes, définies comme classant au stade SIDA par le CDC (Center for Disease Control and Prevention) depuis 1993 : le sarcome de Kaposi, le lymphome non hodgkinien et le cancer invasif du col de l’utérus.
L’incidence des cancers chez les patients VIH par rapport à la population générale est significativement plus élevée. Elle est estimée être 3,5 IC95% [3,3-3,8] fois plus importante chez les hommes, en particulier chez les hommes de moins de 50 ans et 3,6 IC95% [3,2-4] fois plus importante chez les femmes, en particulier chez les femmes de moins de 40 ans, par rapport à la population générale.
L’incidence globale des cancers chez les PVVIH est de 14 pour 1000 patients dont 61% de cancers non classant SIDA. Les NADCs les plus fréquents sont : le cancer du poumon, le carcinome hépatocellulaire, le cancer colorectal, le cancer du canal anal, le lymphome de Hodgkin et les tumeurs cutanées10.
Nous allons nous intéresser à deux autres cancers non classant : les leucémies aiguës myéloïdes et les leucémies aiguës lymphoïdes non Burkitt dans la suite de ce mémoire.
e. Exploration d’une cytopénie chez le patient VIH+
La présence d’anomalies hématologique est fréquente chez les patients VIH+ et touche 11 à 75% des patients au stade SIDA. L’incidence des cytopénies est corrélée au degré d’immunosuppression induit par le VIH11. Les traitements anti rétroviraux permettent d’améliorer généralement ces cytopénies mais certains ARV comme la Zidovudine (AZT) sont eux-mêmes la cause de ces cytopénies au même titre que le VIH lui-même, que les infections opportunistes ou que certaines hémopathies (Ex : SMD, syndromes myélodysplasiques).
i. Cytopénie isolée
La physiopathologie de la survenue d’une anémie, d’une neutropénie et/ou d’une thrombopénie chez les patients VIH+ n’est donc pas totalement comprise mais est souvent d’origine multifactorielle, nécessitant dans la plupart des cas un examen médullaire pour faire le diagnostic et ne pas retarder la découverte d’une éventuelle hémopathie.
Le VIH peut avoir une action directe en infectant les cellules souches hématopoïétiques (CSH). Peu d’études sont cependant arrivées à démontrer la capacité du VIH à infecter les CSH CD34+12, 13 et à ainsi y établir un réservoir cellulaire latent. Ce
réservoir perturberait le microenvironnement médullaire entrainant une dérégulation de l’immunité, une rupture de la balance cytokinique et une diminution des facteurs requis pour une hématopoïèse normale14.
Même si ils sont moins toxiques que ceux de la 1ère génération, l’usage prolongé des ARV de seconde génération associé aux autres traitements (notamment les prophylaxies anti-infectieuses) prescrits aux PVVIH peuvent altérer le microenvironnement et ainsi la différenciation des CSH. Ils peuvent également entrainer des hémolyses intravasculaires (Ex : dapsone, ciprofloxacine) ou avoir une action myélosuppressive (trimethoprime-sulfamethoxazole).
La dénutrition chez les patients ayant une immunodépression avancée et les carences en vitamines (B12, folates) et en fer qui en découle peut avoir également un impact sur l’hématopoïèse.
De plus, certaines infections peuvent être associées à une hématopoïèse anormale (Ex : mycobactéries, histoplasme, leishmanies, CMV, EBV, ParvoB19).
Les tumeurs développées par les patients VIH+ peuvent également avoir un impact direct sur l’hématopoïèse. Les atteintes médullaires au diagnostic des hémopathies sont fréquentes et sont présentes chez la majorité des patients présentant une maladie de Hodgkin ou un lymphome non Hodgkinien6.
! L’anémie
L’anémie, qui est classiquement normocytaire, normochrome et arégénérative, est la plus fréquente des anomalies hématologiques observées chez les patients infectés par le virus du SIDA, qu’ils soient ou non sous trithérapie anti rétrovirale. L’incidence de l’anémie augmente avec la maladie VIH. Environ 35% des PVVIH sous ARV développeront une anémie à un moment donné15. Celle-ci a été décrite dans la littérature16 comme associée à une moins bonne qualité de vie, une progression accélérée de la maladie et une augmentation du taux de mortalité. Les causes de cette anémie peuvent être multiples et sont parfois intriquées. 3 mécanismes peuvent entrer en jeu :
. Un défaut de production secondaire à une infection opportuniste, au VIH lui-même, à des médicaments myélosuppresseurs, à un défaut de production d’érythropoïétine ou à un hypogonadisme.
. Une production inefficace des globules rouges secondaire à une carence en B12, en folates ou à une carence mixte.
. Une destruction accrue des globules rouges périphérique liée à une anémie hémolytique auto immune, une micro-angiopathie thrombotique ou à une coagulation intravasculaire disséminée.
! La neutropénie
Une neutropénie est décrite chez 70% des patients VIH+ à un stade avancé. Celle-ci peut également être due à la maladie elle-même, à une infection opportuniste, à une origine tumorale ou liée à une toxicité médicamenteuse. L’aggravation de la maladie VIH reflétée par la baisse des CD4+ et l’augmentation du taux d’ARN VIH-1 a été associée au développement de neutropénies.
! La thrombopénie
Une thrombopénie est visible chez 40% des patients infectés par le VIH durant l’histoire de leur maladie et peut être l’unique anomalie hématologique au diagnostic. Celle-ci peut être d’origine centrale ou périphérique. L’auto-immunité peut être à l’origine d’une thrombopoïèse inefficace causée par l’analogie entre les glycoprotéines d’enveloppe gp160/120 du VIH et le GpIIb/IIIa des plaquettes17. La thrombopénie, lorsqu’elle est isolée, n’affecte pas le pronostic.
!
ii. Bicytopénie ou pancytopénie !
Les causes des bicytopénies et des pancytopénies chez les patients VIH+ sont les mêmes que celles des cytopénies isolées (notamment les toxicités médicamenteuses) mais il faut évoquer également les hémopathies : infiltration médullaire d’un lymphome ou syndrome myélodysplasique.
Le traitement ARV le plus connu pour être hématotoxique est la zidovudine (AZT). C’est un analogue nucléosidique qui peut donc induire une terminaison de chaine durant la reverse transcription par le VIH. Ce médicament est également un inhibiteur de certaines ADN polymérases et donc un anti métabolite. Plusieurs études ont montré in vitro18 une réduction du potentiel prolifératif des progéniteurs myéloïdes de 50 à 70% à des concentrations proches de celles utilisées in vivo en clinique. Sur 145 patients étudiés, 65 (45%) développaient une toxicité hématologique de grade 3 (Hb<7,5g/dl ; PNN<750/mm3,
GB<150/mm3).
Concernant les hémopathies, le nombre de cas de SMD rapporté chez les patients VIH+ est restreint. Ces patients, en comparaison à la population de SMD non VIH+ sont relativement plus jeunes (médiane d’âge de 55 ans dans la série) et présentent plus de cytogénétique complexe. Ils ont un plus mauvais pronostic (incluant des del7q et des monosomies 7) ainsi qu’un taux de transformation en LAM plus important (63 vs 26% ; p=0,035) entrainant une moins bonne survie globale19.
Les cytopénies ne sont donc pas des évènements rares chez les patients VIH+. Nous avons vu que les causes pouvant expliquer ces cytopénies peuvent être multiples, parfois intriquées. Les explorations nécessaires doivent être mises en œuvre au cas par cas afin de ne pas méconnaître une hémopathie sous jacente comme un syndrome myélodysplasique ou une leucémie aiguë.
!
3. Les leucémies aiguës !
La leucémie (du grec leukos blanc et haima sang) est une prolifération clonale, maligne, de cellules immatures. Ces hémopathies aiguës peuvent toucher la lignée myéloïde (leucémie aiguë myéloïde, LAM) ou lymphoïde (leucémie aiguë lymphoïde, LAL).
La fréquence des leucémies aiguës dans les pays occidentaux est de 3 pour 100 000 habitants par an, les LAL étant plus fréquentes chez les enfants avec un pic d’incidence entre 2 et 5 ans et les LAM chez l’adulte avec une incidence augmentant avec l’âge et un âge médian de 65 ans.
Sur le plan clinique, on peut distinguer à différents degrés au diagnostic :
. des signes liés à l’insuffisance médullaire : pâleur, asthénie, dyspnée, syndrome hémorragique et signes éventuels en faveurs d’une infection ;
. un syndrome tumoral éventuel pouvant toucher les organes hématopoïétiques (adénopathies, hépatomégalie, splénomégalie) ou extra hématopoïétiques (atteinte du système nerveux central, cutanée, gingivale), le syndrome tumoral étant plus rare dans les LAM.
La biologie oriente le diagnostic en montrant souvent à l’hémogramme une pancytopénie associant une anémie normochrome, normocytaire arégénérative, une neutropénie et une thrombopénie avec parfois la présence de blastes circulants. C’est le myélogramme qui permet de confirmer le diagnostic lorsque le pourcentage de blaste est supérieur à 20% après coloration des lames au May-Grünwald-Giemsa (MGG). Il permet également d’affiner les caractéristiques de la maladie grâce à l’immuno-phénotypage, la cytogénétique et à la biologie moléculaire.
!
a. Les leucémies aiguës myéloïdes
!
Les leucémies aiguës myéloïdes (LAM) sont donc issues de la prolifération clonale d’une cellule de la lignée myéloïde qui a subi un blocage dans sa différenciation.
i. Diagnostic !
! Cytologie
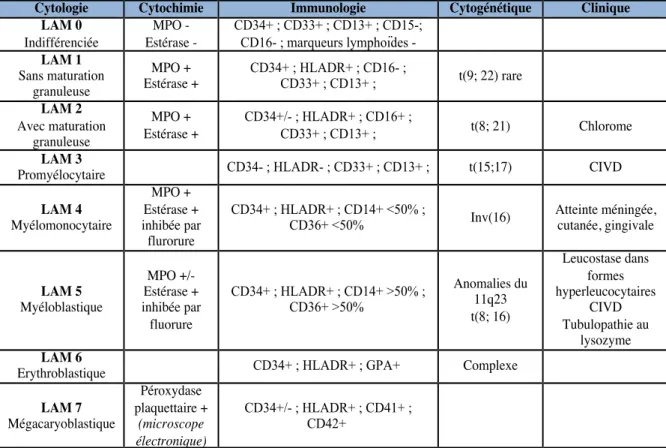
Les LAM peuvent être classées cytologiquement en fonction du stade où se trouve le blocage dans la différenciation myéloïde. La classification cytologique qui reste la plus
Cytologie Cytochimie Immunologie Cytogénétique Clinique LAM 0 Indifférenciée MPO - Estérase - CD34+ ; CD33+ ; CD13+ ; CD15-; CD16- ; marqueurs lymphoïdes - LAM 1 Sans maturation granuleuse MPO + Estérase + CD34+ ; HLADR+ ; CD16- ; CD33+ ; CD13+ ; t(9; 22) rare LAM 2 Avec maturation granuleuse MPO + Estérase + CD34+/- ; HLADR+ ; CD16+ ; CD33+ ; CD13+ ; t(8; 21) Chlorome LAM 3
Promyélocytaire CD34- ; HLADR- ; CD33+ ; CD13+ ; t(15;17) CIVD
LAM 4 Myélomonocytaire MPO + Estérase + inhibée par flurorure CD34+ ; HLADR+ ; CD14+ <50% ;
CD36+ <50% Inv(16) Atteinte méningée, cutanée, gingivale
LAM 5 Myéloblastique MPO +/- Estérase + inhibée par fluorure CD34+ ; HLADR+ ; CD14+ >50% ; CD36+ >50% Anomalies du 11q23 t(8; 16) Leucostase dans formes hyperleucocytaires CIVD Tubulopathie au lysozyme LAM 6
Erythroblastique CD34+ ; HLADR+ ; GPA+ Complexe
LAM 7 Mégacaryoblastique Péroxydase plaquettaire + (microscope électronique) CD34+/- ; HLADR+ ; CD41+ ; CD42+ !
employée de nos jours est la classification FAB (French American British) parue en 1976. Elle distingue 8 types de LAM20 (LAM 0 à LAM 7).
! Cytochimie
La cytochimie permet de compléter la cytologie. Le diagnostic de LAM est affirmé lorsque plus de 5% des blastes ont une activité myéloperoxydase positive. La réaction des estérases permet quant à elle de distinguer des myéloblastes « granuleux » des myéloblastes monocytaires dont la réaction aux estérases est diminuée par le fluorure de sodium.
! Immuno-phénotypage
La morphologie cellulaire et la cytochimie doivent être complétées au diagnostic et lors des éventuelles rechutes, d’une étude par cytométrie en flux (CMF) des blastes sur les prélèvements sanguins et médullaires. Auparavant les blastes leucémiques étaient considérés comme étant équivalents à des cellules hématopoïétiques normales, bloquées à un stade de leur différenciation. La CMF a permis de montrer que le profil de ces cellules diffère de la cellule normale en cours de maturation. L’étude des différents marqueurs permet en plus de la distinction des LAM et des LAL, d’aider à préciser le type de LAM (classification FAB), en particulier en cas de LAM 0 ou LAM 7. (Tableau 6).
LAM avec anomalies génétiques récurrentes :
LAM avec t(8; 21)(q22; q22); RUNX1-RUNX1T1
LAM avec inv(16)(p13.1q22) ou t(16; 16)(p13.1; q22) ; CBFB-MYH11 LAP avec t(15; 17)(q22; q12) ; PML-RARA
LAM avec t(9; 11)(p22; q23) ; MLLT3-MLL LAM avec t(6; 9)(p23; q34) ; DEK-NUP214
LAM avec inv(3)(q21q26.2) ou t(3; 3) (q21; q26.2) ; RPN1-EVI1 LAM (mégacaryoblastique) avec t(1; 22)(p13; q13) ; RBM15-MKL1 Entité provisoire : LAM avec mutation de NPM1
Entité provisoire : LAM avec mutation de CEBPa LAM avec changements liés à une myélodysplasie Hémopathie myéloïde secondaire à un traitement LAM sans autre spécificité
LAM avec différenciation minime LAM sans maturation
LAM avec maturation
Leucémie aiguë myélomonocytaire
Leucémie aiguë monoblastique / monocytaire Leucémie aiguë érythroïde
Leucémie aiguë érythroïde pure Erythroleucémie érythroïde/myéloïde Leucémie aiguë mégacaryoblastique
Leucémie aiguë basophilique
Panmyélose aiguë avec myélofibrose Sarcome myéloïde
Prolifération myéloïde associée au syndrome de Down Anomalie transitoire de la myélopoïèse
Leucémie myéloïde associée au syndrome de Down Tumeur dendritique blastique plasmacytoïde
!
! Cytogénétique
L’étude du caryotype des blastes médullaire est indispensable au diagnostic et au suivi des LAM. L’étude des translocations récurrentes a permis d’isoler de réelles entités oncogéniques qui possèdent une valeur pronostique.
La classification OMS de 1999 puis de 2008 révisée en 2016 complète la classification FAB21 (Tableau 7.). Elle distingue les LAM à anomalies cytogénétiques
récurrentes, les LAM avec signes de myélodysplasie, les LAM secondaires à des traitements et les LAM sans autres spécificités.
La sensibilité de détection des anomalies génétiques s’est améliorée ces dernières années avec les techniques d’hybridation in situ et de SNP microarrays. Plus de 55% des patients ayant une LAM présentent ainsi une ou plusieurs anomalies cytogénétiques.
La classification OMS est sur le point d’évoluer grâce à l’apport de la biologie moléculaire qui a permis de préciser notamment le pronostic des différentes LAM et une de ses sections sera sûrement dédiée aux hémopathies myéloïdes familiales de caractérisation récente.