1
Développement et application de nano-architectures
cœur-coquille fluorescentes pour la mesure du pH
Thèse
Jérémie Asselin
Doctorat en chimie
Philosophiæ doctor (Ph. D.) Québec, Canada © Jérémie Asselin, 20182
Développement et application de nano-architectures
cœur-coquille fluorescentes pour la mesure du pH
Thèse
Jérémie Asselin
Sous la supervision de :
iii
Résumé
Les variations ioniques entrent en jeu dans presque tous les processus métaboliques cellulaires et bactériens. Par le fait même, leur dysfonctionnement induit une modification des concentrations attendues et provoque des maladies graves à même la solution physiologique ou le tissu biologique affecté. Parmi ces différents facteurs, le pH est un paramètre-clé régissant plusieurs activités comme la capacité enzymatique, la conformation tridimensionnelle des protéines et l’activation de certains transporteurs membranaires. Lors de ces travaux de doctorat, des nanoparticules fluorescentes sensibles au pH ont été développées et appliquées sous la forme d’un substrat lamellaire implantable directement dans l’environnement de culture de cellules. Ce nouvel outil analytique adapté pour la recherche biomédicale in vitro offre donc la possibilité de visualiser le pH en microscopie de façon quantitative avec une résolution spatiale (~1 μm) et temporelle (<300 ms).
Pour ce faire, les nano-capteurs ont été optimisés dans le cadre d’une étude paramétrique structurale. Ces nanoparticules comportent un cœur métallique offrant une activité plasmonique qui permet d’exalter la fluorescence de chromophores incorporés dans une coquille de silice. La taille, la distance d’espacement, et le degré de recouvrement entre la bande plasmonique et le spectre d’excitation/émission de différents fluorophores ont donc été ajustés afin de rentabiliser la portée de l’effet amplificateur de ces architectures concentriques. Comme la chimie d’encapsulation des molécules sensibles est généralisable pour un grand nombre de précurseurs silanes, une démonstration a été faite pour un concept de nanoparticules multicouches permettant simultanément la détection multiélémentaire de la concentration en protons et en ions halogénure (Cl-, Br-, I-), et aussi
la correction de ces signaux par rapport à une référence interne. La normalisation ratiométrique permet de compenser pour les fluctuations et erreurs expérimentales issues notamment de la concentration des capteurs, du photoblanchiment et de l’intensité de la source en fonction du temps. Finalement, cette stratégie a été appliquée dans une étude spectroscopique utilisant la fluorescéine dans des nanoparticules cœur-coquille en tant que rapporteur ratiométrique pour la mesure quantitative du pH dans des cultures cellulaires. Pour ce faire, les nano-architectures ont été fonctionnalisées, puis confinées en surface d’un substrat de silice par voie de couplage clic complémentaire. Ces lamelles de microscopie à valeur ajoutée offrent donc une surface adaptée pour la culture de cellules excitables comme les fibroblastes cardiaques et les neurones, mais aussi pour la croissance bactérienne de biofilms et l’analyse multiphase en microfluidique.
iv
Abstract
Ionic gradient changes are essential in almost every cellular and bacterial metabolic processes. Therefore, any malfunction that perturbs these ion concentrations can induce major illnesses in the affected physiological solution or biological tissue. Amongst all the chemical species influenced by cell metabolism, protons are key to many events; enzyme activity, protein structural changes, and activation of membrane transporters. In this doctoral thesis, pH-sensitive fluorescent nanoparticles were developed and grafted on planar substrates in order to probe the culture medium of different cells in
vitro. These innovative analytical tools for biomedical research offer the possibility to image quantitative
pH values in microscopy with both spatial (~1 μm) and temporal resolutions (<300 ms).
As such, the sensors were optimized in a structural parametric study with regards to the nanoarchitecture design. These particles comprise a metallic core with plasmonic properties to enhance the fluorescence of molecules incorporated into a porous silica shell. The core size, the spacing layer thickness, the spectral overlap between the plasmon and the fluorescence excitation/emission bands, and the sensitive moieties were carefully chosen to take advantage of the plasmonic range of enhancement in concentric architectures. Since the covalent encapsulation of molecules is highly adaptable for many silanized fluorophores, core-multishell architectures were synthesized as a proof of concept which allows simultaneous measurements of pH and halides (Cl-,
Br-, I-), and signal normalization with an internal reference onto the same nanoparticle. The ratiometric
correction compensates for fluctuations in light intensity and experimental errors with sensor concentration, photobleaching and environmental effects as a function of time. Finally, this analytical strategy was applied in a spectroscopic study of fluorescein-doped nanoparticles as quantitative pH-sensitive markers implemented in biological cell cultures. Particularly, the core-shell nanoarchitectures were functionalized with a silane component and immobilized at the surface of a silica substrate by way of complementary click coupling. These improved microscope coverslips were evaluated as a fluorescent sensing surface for the culture of adhesive excitable cells – e.g. cardiac fibroblasts and neurons, but also for the growth of bacterial biofilms and the study of multiphase interfaces in microfluidic devices.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... x
Liste des tableaux ... xxi
Liste des abréviations ... xxii
Dédicaces ... xxiv Épigraphes ... xxv Remerciements ... xxvi Avant-propos ...xxviii 1 Introduction ... 1 1.1 Contexte de recherche ... 1 1.2 Objectifs du projet ... 3 1.3 Concept proposé ... 3 1.4 Références... 4
2 Théorie et état de l’art ... 6
2.1 Principes fondamentaux de fluorescence ... 6
2.1.1 Diagramme énergétique des phénomènes de luminescence ... 6
2.1.2 Mécanismes d’extinction de la fluorescence ... 8
2.1.3 Intérêt analytique de la fluorescence... 9
2.2 Plasmonique des nanomatériaux ... 11
2.2.1 Résonance plasmon localisée en surface (LSPR) ... 11
2.2.2 Modulation des propriétés plasmoniques ... 12
2.2.3 Exaltation de la fluorescence par un métal (MEF) ... 17
2.3 Littérature et état de l’art sur les indicateurs de pH ... 21
2.3.1 Mesures de pH par fluorescence moléculaire ... 22
2.3.2 Incorporation d’espèces sensibles dans des nano-architectures ... 27
2.3.3 Effet du MEF sur les propriétés analytiques ... 33
2.4 Application sur des substrats de détection extracellulaire ... 37
2.4.1 Incorporation à des substrats de papier ... 37
vi
2.4.3 Démonstration de capteurs planaires ... 39
2.5 Références... 41
3 Synthèses, méthodologies et techniques de caractérisation ... 47
3.1 Préparation de nanoparticules métalliques ... 47
3.1.1 Synthèse de cœurs métalliques par croissance de germes ... 48
3.1.2 Synthèse de cœurs métalliques par réduction polyol ... 52
3.2 Stabilisation et fonctionnalisation de colloïdes ... 54
3.2.1 Condensation alcaline de la coquille de silice ... 54
3.2.2 Incorporation de fluorophores dans des architectures concentriques ... 55
3.3 Application de nanoparticules sur des substrats de silice ... 57
3.3.1 Condensation de molécules silane sur des surface d’oxydes ... 57
3.3.2 Cycloaddition de Huisgen pour des fonctions azoture-alcyne ... 60
3.4 Techniques de caractérisation de nanomatériaux à l’état colloïdal ... 61
3.4.1 Spectroscopie d’extinction UV-VIS ... 61
3.4.2 Spectrofluorimétrie ... 62
3.4.3 Comptabilisation de photons uniques corrélés en temps (TCSPC)... 63
3.4.4 Analyse en suivi de nanoparticules uniques (NTA) ... 65
3.5 Techniques de caractérisation de substrats solides ... 66
3.5.1 Microscopie en champ sombre ... 66
3.5.2 Microscopie d’épifluorescence ... 67
3.5.3 Microscopie électronique en transmission ... 68
3.5.4 Microscopie électronique à balayage ... 70
3.6 Références... 71
4 Corrélation de l’exaltation de la fluorescence par un métal avec les propriétés structurales de nanoparticules cœur-coquille Ag@SiO2 ... 76
Résumé ... 76
Abstract ... 76
4.1 Introduction ... 77
4.2 Experimental details ... 79
4.2.1 Chemical and reagents ... 79
4.2.2 Preparation of Ag nanoparticles by seed-growth ... 79
4.2.3 Preparation of Ag@SiO2 core-shell nanoparticles ... 80
vii
4.2.5 Characterization ... 82
4.3 Results and discussion ... 82
4.3.1 Absorption spectra of Ag@SiO2 nanoarchitectures... 82
4.3.2 Influence of metal core size and spacer shell thickness ... 83
4.3.3 Quantification of enhancement factor (EF) ... 86
4.4 Summary and conclusion ... 88
4.5 Supplementary material ... 88
4.5.1 Control of spacer shell thickness for different Ag@SiO2 NPs ... 88
4.5.2 Determination of Ag@SiO2 concentrations by ICP-AES ... 89
4.5.3 Preparation of fluorescence lifetime references ... 89
4.5.4 Quantification of fluorophore incorporation yield ... 90
4.6 References... 97
4.7 Acknowledgements ... 101
5 Nanoarchitecture ratiométrique pour la détection simultanée du pH et d’ions halogénure utilisant la fluorescence exaltée par un plasmon dans l’UV ... 102
Résumé ... 102
Abstract ... 102
5.1 Introduction ... 102
5.2 Results and discussion ... 104
5.2.1 Synthesis of multishell sensor architectures ... 104
5.2.2 Demonstration of bimodal sensing with In@(RB)@(FL)@MQ ... 105
5.3 Summary and conclusions ... 108
5.4 Supplementary material ... 109
5.4.1 Chemical and reagents ... 109
5.4.2 Synthesis of In plasmonic cores ... 109
5.4.3 Preparation of fluorescent isothiocyanates ... 109
5.4.4 Preparation of silanized methoxyquinolinium ... 110
5.4.5 Preparation of multishell nanoarchitectures ... 110
5.4.6 Preparation of pH buffers and halide solutions ... 110
5.4.7 Characterization ... 111
5.5 Methodologies ... 111
5.5.1 Measurement of silica shells ... 111
viii
5.5.3 Application of ratiometry in In@(RB)@(FL)@MQ ... 111
5.6 References... 117
5.7 Acknowledgements ... 120
6 Nanobiocapteurs cœur-coquille sur substrat pour l’imagerie quantitative du pH extracellulaire par fluorescence ... 121
Résumé ... 121
Abstract ... 121
6.1 Introduction ... 121
6.2 Characterization of NP-functionalized substrates ... 123
6.3 Imaging of pH in cardiac fibroblast cultures ... 127
6.4 Conclusions ... 129
6.5 Materials and methods ... 130
6.5.1 Chemical and reagents ... 130
6.5.2 Synthesis of silver nanoparticles ... 130
6.5.3 Preparation of fluorescent silica shell (Ag@SiO2-fluorophore) ... 130
6.5.4 “Click” grafting of metal@SiO2 NPs on silica surfaces ... 131
6.5.5 Cardiac fibroblast culture ... 131
6.5.6 Characterization methods ... 132
6.6 Supporting material ... 132
6.7 References... 135
6.8 Acknowledgements ... 137
7 Études exploratoires ... 138
7.1 Modulation de la ratiométrie des NPs Ag@SiO2+FL ... 138
7.1.1 Influence du taux d’incorporation ... 140
7.1.2 Influence de l’architecture cœur-coquille ... 142
7.1.3 Caractérisations supplémentaires des NPs Ag@SiO2+FL ... 144
7.1.4 Incorporation de molécules SNARF ... 147
7.2 Démonstrations d’applications ... 149
7.2.1 Cartographie du pH en conditions microfluidiques ... 149
7.2.2 Suivi de l’activité thérapeutique du 2-thioUTP contre la calcification aortique ... 155
7.3 Références... 158
8 Conclusion et perspectives ... 160
ix
8.1.1 Développement de nano-architectures MEF ... 160
8.1.2 Démonstration d’applications analytiques ... 161
8.2 Perspectives des nano-outils et des surfaces analytiques ... 162
8.2.1 Exaltation de la fluorescence dans des nano-architectures sensibles ... 162
8.2.2 Architectures concentriques pour la détection multiélémentaire ... 163
8.2.3 Généralisation et fonctionnalisation de nouveaux substrats de silice... 164
8.3 Ouverture ... 166
8.4 Références... 166
Annexe A. Plate-forme microfluidique permettant l’imagerie du pH durant la stimulation chimique et hydrodynamique de biofilms oraux ... 167
Résumé ... 167
Abstract ... 167
Introduction ... 168
Experimental section ... 170
Preparation of pH-sensitive glass substrates ... 170
Fabrication of microfluidic devices for pH imaging ... 170
Biofilm culture in microchannels ... 172
Instrumentation ... 172
Fluid delivery ... 172
Experimental results ... 173
Analytical performance of pH sensing surfaces ... 173
Imaging of oral biofilms ... 176
Role of the chemical environment on biofilm pH ... 178
Hydrodynamic role in biofilm pH regulation ... 179
Discussion ... 181
Conclusions ... 182
Supplementary material ... 182
Chemical and reagents ... 182
Nanoparticle synthesis and surface attachment ... 183
Native pH responsivity of as-prepared nanoparticles. ... 184
Resistance to photobleaching ... 185
Biofilm formation in microchannels ... 186
x
Acknowledgements ... 191
Annexe B. Plate-forme microfluidique avec des nanoparticules exaltant la fluorescence pour la cartographie de pH en solutions acidifiées par des microbulles de CO2 ... 192
Résumé ... 192
Abstract ... 192
Introduction ... 192
Experimental details ... 194
Results and discussion ... 194
CO2 dissolution in water ... 196
Formation of CO2 bubbles ... 198
Imaging CO2(g)/water multiphase systems ... 199
Conclusion ... 200
References ... 200
Annexe C. Protocoles de synthèse ... 202
Préparation de nanoparticules d’argent ... 202
Réduction simple par la méthode de Turkevich ... 202
Synthèse contrôlée par croissance de germes ... 203
Préparation de nanoparticules d’indium ... 205
Synthèse de silanes fluorescents ... 206
Isothiocyanate de dérivés du xanthène ... 206
Fonctionnalisation du SNARF-NHS par un aminosilane ... 206
Condensation de coquilles de silice ... 207
Condensation contrôlée d’espaceurs de silice ... 207
Condensation de coquilles fluorescentes (pleine épaisseur) ... 208
Condensation de coquilles fluorescentes (couche mince) ... 208
Greffage de nanoparticules cœur-coquille sur substrats de silice ... 209
xi
Liste des figures
Figure 1.1 : Illustration de la gamme d'émission pour différentes protéines fluorescentes disponibles, tirée de la présentation de Roger Y. Tsien pour le prix Nobel de chimie en 2008.11 ... 2
Figure 1.2 : Schéma des composantes et de leur rôle dans le substrat sensible au pH incorporant des nanoparticules fluorescentes ... 4 Figure 2.1 : Diagramme de Jablonski représentant les échanges énergétiques présents dans un système moléculaire luminescent ... 6 Figure 2.2 : Graphe de Stern-Volmer de la fluorescence ou du temps de vie éteints (F, τ) normalisés par la luminescence sans cette influence (F0, τ0) par processus dynamique avec deux anions
halogénure en solution aqueuse.5 ... 9
Figure 2.3 : Illustration du photoblanchiment de cellules végétales BY-2 marquées avec une protéine verte fluorescente (GFP)7 ... 10
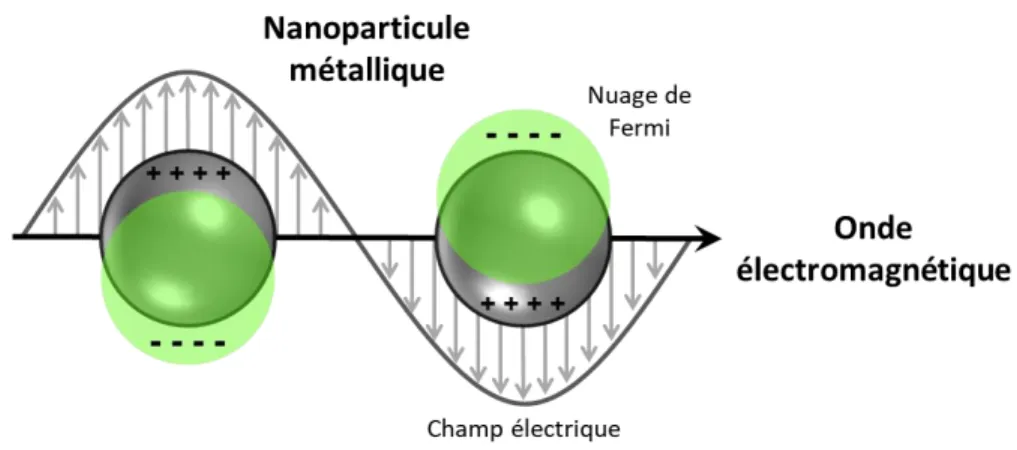
Figure 2.4 : Illustration de l'interaction d'une nanostructure métallique en résonance avec une onde électromagnétique incidente ... 11 Figure 2.5 : Tableau périodique des éléments classés par valeur d’efficacité plasmonique théorique pour des films minces ou des nanoparticules (QLSP, en gras) et selon la fréquence où le facteur de
qualité est maximal, en eV (caractère maigre); figure adaptée de Blaber et al.19 ... 13
Figure 2.6 : Illustration de l’influence de la forme et la taille d’une nanoparticule sur l’efficacité d’extinction de la lumière incidente ainsi que les longueurs d’onde affectées par le plasmon de surface pour (a) des sphères, (b) des cubes, (c) des tétraèdres, (d) des octaèdres, (e) des triangles plats et (f) des bâtonnets prismatiques.20 ... 15
Figure 2.7 : Simulation FDTD de nanocubes Ag exposés à de la lumière polarisée par rapport aux facettes (a) (110) et (b) (100) pour favoriser l’intensité du champ électrique aux points chauds (sommets). La déposition de particules sur un substrat provoque un changement d’indice de réfraction local, donc la discrimination des modes plasmoniques confinés (c) à l’extérieur ou (d) à l’intérieur de la surface d’indice de réfraction plus élevée.30 ... 16
Figure 2.8 : Diagramme de Jablonski modifié pour un système fluorescent avec l'effet plasmonique d'un métal16 ... 17
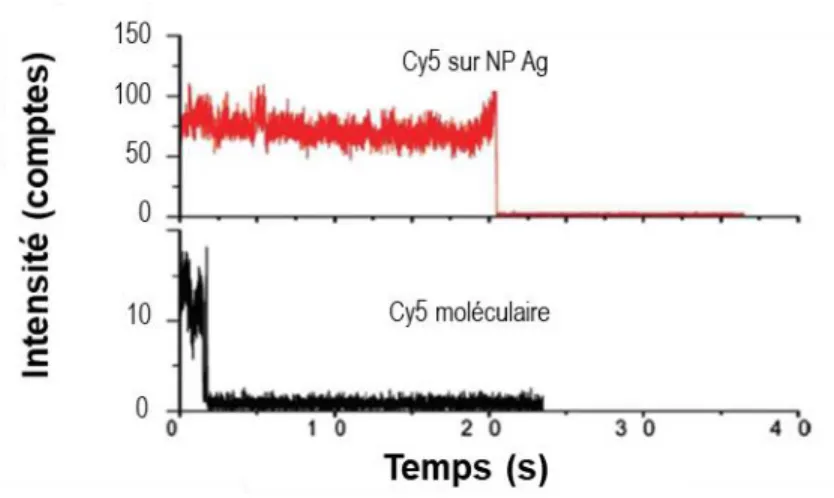
Figure 2.9 : Trace du signal de fluorescence en fonction du temps pour une molécule fluorescente (Cy5) libre et à proximité d’une nanoparticule d’argent.33 ... 18
Figure 2.10 : Démonstration expérimentale du MEF par (A) l'exaltation de signal perçu pour une surface supportant des îlots d’argent (SIF) et une monocouche de CdTe fluorescente, et (B) la diminution du temps de vie de fluorescence comparativement à un substrat de silice à titre de référence34 ... 19
Figure 2.11 : Superposition PAINT (points accumulation for imaging in nanoscale topography) de l’émission de fluorophores uniques sur une image de diffusion d’un nano-bâtonnet d’or, limitée par la diffraction. Les espèces moléculaires sont choisies selon leur recouvrement spectral avec le plasmon : A) mCherry favorise le MEF alors que B) mCitrine est déplacée de façon ipsochrome. La barre d’échelle représente 300 nm.45 ... 20
xii
Figure 2.12 : Illustration de l’interaction entre une lumière incidente (580 nm) avec une nanoparticule de 80 nm en argent (A) en absence et (B) en présence d’un dipôle fluorescent à 620 nm.16 ... 21
Figure 2.13 : Présentation des formes prototropiques de la fluorescéine, leurs propriétés de fluorescence et la constante d’équilibre de protonation52 ... 23
Figure 2.14 : Haut - Équilibre de protonation du SNARF-1 mis en jeu pour les mesures de pH biologiques. Bas – Spectres d’excitation (λem = 600 nm) et d’émission (λexc = 485 nm) pour une
variation de pH allant de 5,0 à 9,0. ... 24 Figure 2.15 : A) Représentation schématique du changement conformationnel entre une espèce triplex ADN éteint et un duplex ouvert fluorescent en fonction du nombre de triplets de bases azotés Thymine-Adénine-Thymine (TAT). B) Effet de la combinaison en solution de différents conformères ADN sensibles au pH dans des gammes complémentaires.61 ... 26
Figure 2.16 : A) Représentation schématique de la préparation des architectures MOFs incorporant l’isothiocyanate de fluorescéine. B) Calibration en intensité ratiométrique de fluorescence pour les MOFs en fonction du pH. C) Illustration par superposition des canaux provenant de l’excitation des MOFs avec FiTC à 488 nm (vert) et à 435 nm (rouge).62 ... 28
Figure 2.17 : A) Représentation schématique de l’assemblage FRET dans des polymères fluorescents (donneur) permettant l’incorporation d’isothiocyanate de fluorescéine (accepteur). B) Dépendance ratiométrique de l’intensité de luminescence en fonction du pH d’une solution. Illustration du marquage cellulaire et de la récolte du signal des bandes de l’architecture FRET avec deux filtres de microscopie appropriés (λexc = 405 nm; C) λem = 433-444 nm et D) λem = 507-518 nm).63 ... 29
Figure 2.18 : A) Illustration schématique d’une particule cœur-coquille SiO2@SiO2 incorporant une
molécule sensible et une autre à titre de référence dans la même architecture. B) Graphe de photoluminescence d’une espèce sensible au pH (fluorescéine, FITC) et d’une référence (tétraméthylrhodamine, TRITC) incorporées dans une particule concentrique. C) Données ratiométriques de luminescence en fonction du pH pour une correction FITC/TRITC. D) Application en imagerie des valeurs quantitative de pH dans une cellule leucocyte basophile de rat (RBL-2H3).64 . 30
Figure 2.19 : Schéma de préparation de nano-assemblages de systèmes cœur-coquille de silice incorporant une espèce sensible au pH (HPTS) et une référence interne (RBiTC) de façon à minimiser les échanges FRET dans le spectre récolté.65 ... 31
Figure 2.20 : A) Structure de l’assemblage NanoChlor incorporant la fluorescéine comme référence interne et un dérivé quinolinium pour la détection des ions halogénure. B) Spectres d’absorption et d’émission en fonction de la concentration d’ions extincteurs en solution aqueuse. C) Réponse ratiométrique en fluorescence par normalisation du signal du quinolinium par celui de la fluorescéine dans l’architecture.66 ... 32
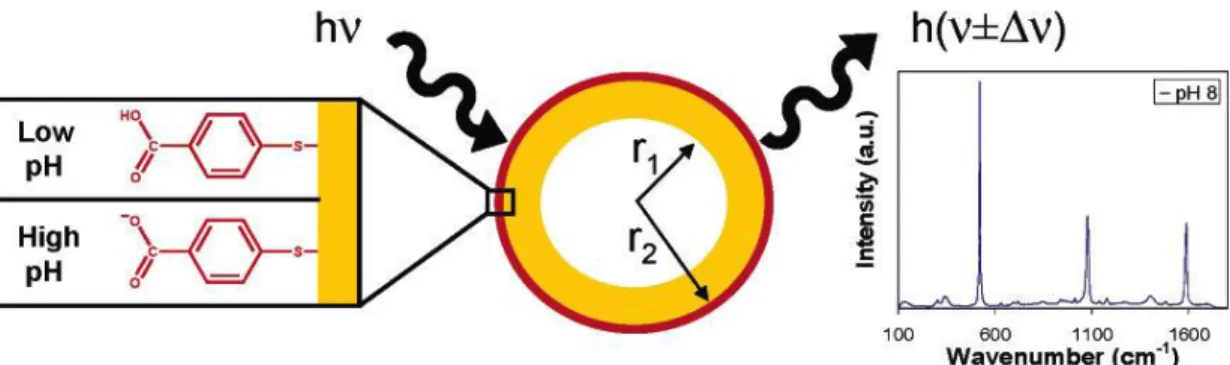
Figure 2.21 : Représentation schématique du principe derrière l’architecture sensibles au pH en SERS sur une nano-coquille plasmonique en or ... 33 Figure 2.22 : Illustration schématique de la méthode de synthèse par condensation d’une architecture cœur-coquille fonctionnalisée électrostatiquement avec le HPTS et représentation de la sensibilité ratiométrique de l’architecture dans la gamme de pH 6,0 à 9,037 ... 34
Figure 2.23 : A) Illustration d’une nanoparticule cœur-coquille utilisant la transition de phase d’un polymère pour traduire une variation de pH. B) Variation de la taille colloïdale en suspension et (C) de l’intensité de fluorescence des particules en fonction du pH.70 ... 35
xiii
Figure 2.24 : Représentation schématique d’une nanoparticule d’or luminescente dans le proche-infrarouge et supportant des ligands fonctionnalisés avec le fluorophore TAMRA avec un signal sensible au pH dans l’architecture finale.71 ... 36
Figure 2.25 : Représentation de la structure moléculaire des chromophores utilisés dans l’indicateur universel de Yamada et le changement colorimétrique qui leur est associé. ... 38 Figure 2.26 : Transition de phase d'un polymère dont la conformation tridimensionnelle est dépendante d’un stimulus externe agissant sur un paramètre thermodynamique comme la température ou l’ajout de diverses molécules.77 ... 38
Figure 2.27 : A) Illustration du concept de bicouches interférentielles répondant à un stimulus externe comme l’acidification. B) Spectres de réflectance en fonction du pH d’une solution tamponnée mise en contact avec le microgel sensible. C) Image de la réponse colorimétrique du capteur avec des solutions de pH 7 (à gauche) et 3 (à droite).82 ... 40
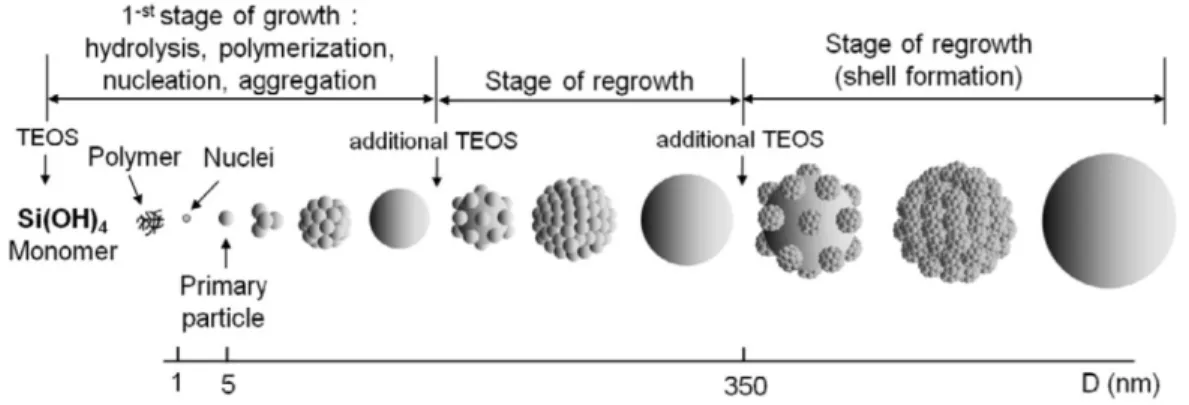
Figure 3.1 : Schéma des principales étapes de synthèse et de préparation des surfaces sensibles au pH dans ce projet ... 47 Figure 3.2 : Schéma de réaction des structures possibles durant la réduction de sels d’argent et de leur croissance subséquente13 ... 48
Figure 3.3 : A) Schématisation de l’évolution de la concentration en monomères métalliques et représentation des étapes générales de la formation de nanoparticules colloïdales. B) Illustration de l’évolution de la taille des colloïdes durant la synthèse. ... 49 Figure 3.4 : Illustration du contrôle de la réactivité des arêtes en fonction du pH de nanocristaux bimétalliques Au-Pd caractérisés en microscopie électronique à balayage et avec un modèle tridimensionnel. Les régions en jaune représentent une portion de la particule riche en Au, et en rouge le Pd.20 ... 51
Figure 3.5 : Schéma de préparation multiétape de monocristaux sphériques par itération successives de dissolution oxydative et de croissance par réduction à partir de nano-bâtonnets d’or.19 ... 52
Figure 3.6 : Voltamogrammes correspondant au potentiel d’oxydation de différents solvants polyols à (A) 22°C et (B) 60°C. Les solvants représentés correspondent à l’éthylène glycol (EG), au diéthylène glycol (DEG), au triéthylène glycol (TREG) et au tétraéthylène glycol (TEG).16 ... 53
Figure 3.7 : Illustration du mécanisme de polymérisation et de condensation de nanoparticules de silice par la méthode de Stöber. ... 55 Figure 3.8 : Réaction de couplage entre l'isothiocyanate de fluorescéine et l’aminopropyltriéthoxysilane pour former une molécule fluorescente fonctionnalisée par un groupement silane ... 56 Figure 3.9 : Schéma présentant la relation entre les identités synthétique et biologique de nanoparticules destinées à une application biomédicale, et la réponse physiologique d’un organisme par reconnaissance de ces éléments. ... 59 Figure 3.10 : Cycle catalytique proposé en 2010 par Hein et Fokin pour le cuivre(I) dans la cycloaddition [3+2] de Huisgen54,55 ... 61
Figure 3.11 : Illustration schématique du principe de compte de photons uniques en TCSPC et leur combinaison dans un histogramme de décroissance monoexponentielle59 ... 64
xiv
Figure 3.12 : Schéma des composantes présentes dans le parcours optique de l’appareil FluoTime (PicoQuant) utilisé pour les expériences de temps de vie de fluorescence par TCSPC60 ... 64
Figure 3.13 : Schéma de l’excitation et la récolte de la diffusion d’un colloïde en solution dans la chambre d’élution d’un appareil NTA ... 66 Figure 3.14 : A) Schéma du parcours optique pour un condenseur à champ sombre de type cardioïde avant et après l’ajout d’un échantillon diffusif. B) Image de la diffusion plasmonique tirée d’un montage de microscopie en champ sombre.65 ... 66
Figure 3.15 : Schéma représentant les composantes d’un cube de filtres dans un parcours optique de microscopie d’épifluorescence adapté pour les échantillons utilisant la fluorescéine ... 68 Figure 3.16 : Micrographes en transmission obtenus pour des échantillons représentatifs de nanoparticules (A) Ag et (B) Ag@SiO2 présentant des cœurs moyens de 75±12 nm et des coquilles
de 10,2±0,5 nm... 69 Figure 3.17 : Représentation schématique des composantes dans un montage de microscopie électronique à transmission (TEM) et à balayage (SEM)66 ... 70
Figure 4.1 : A) Representative transmission electron micrographs; B) UV-VIS extinction spectra in H2O;
C) Size distribution histograms (N>150, 3-nm bins) of Ag cores after seed-growth synthesis. ... 82 Figure 4.2 : A) Transmission electronic micrographs of (27 ± 4) nm Ag cores coated with silica shells (2.7 ± 0.3), (7.1 ± 0.4), (13.1 ± 0.9), and (17.6 ± 0.6) nm in thickness, respectively; B) Comparison of extinction spectra for 27-nm Ag cores and Ag@SiO2 NPs with 15-nm thick coating dispersed in ethanol;
C) Plasmonic shift as a function of shell thickness for different core sizes. ... 83 Figure 4.3 : Fluorescence intensity for Ag@SiO2@SiO2+FiTC (λexc=485 nm, λem=520 nm) with varying
core sizes and silica spacer thickness (N=3). ... 84 Figure 4.4 : Average fluorescence lifetimes for Ag@SiO2@SiO2+FiTC with varying core sizes and silica
spacer thickness (two-exponential model with IRF deconvolution using non-fluorescent Ag@SiO2 NPs
suspended in ethanol; N=3). ... 85 Figure 4.5 : A) Fluorescence enhancement factors (EF) for Ag@SiO2@SiO2+FiTC (λexc=485 nm,
λem=520 nm) with varying core sizes and silica spacer thickness (N=3); B) Enhancement factors for
74-nm cores with different xanthene fluorophores and silica spacer thickness. ... 87 Figure 4.6 : Top: Transmission electronic micrographs of (60±8) nm Ag cores with different silica spacer shells (scale bar: 100 nm). Bottom: Graph of SiO2 shell thickness in relation vs. volume of 9 mM
TEOS solution used during synthesis. ... 93 Figure 4.7 : Transmission electronic micrographs of Ag@SiO2 (left) and Ag@SiO2@SiO2+FiTC (right)
colloids prepared with 74-nm Ag cores. ... 93 Figure 4.8 : Colloidal sample concentrations determined by ICP-AES and TEM measurements. ... 94 Figure 4.9 : Calculated incorporation yields of the APS-functionalized fluorophores in the outer silica shell of Ag@SiO2@SiO2+x nanoparticles (where x: FiTC, EiTC or RBiTC). ... 94
Figure 4.10 : Spectral overlap between plasmons of Ag@SiO2 NPs (27-nm (black), 74-nm (grey)) and
xv
Figure 4.11 : Enhancement factors determined for Ag@SiO2@SiO2+x nanoparticles with different core
sizes (A: 27-nm, B: 40-nm, C: 60-nm, D: 75-nm) and different fluorophores as a function of spacer shell thickness (N=3). ... 96 Figure 5.1 : Schematic representation of the synthesis of pH- and halide ion-sensitive In@SiO2+rhodamine B@SiO2+fluorescein@6-methoxyquinolinium NPs, abbreviated as
In@(RB)@(FL)@MQ. ... 103 Figure 5.2 : Top: Spectral overlap of the plasmon of indium nanoparticles with the fluorophores studied in this work (6-methoxyquinolinium (MQ), fluorescein (FL) and rhodamine B (RB)). Bottom: Transmission electronic micrographs of In@(RB)@SiO2 with spacers of varying thickness: (A)
10.8±0.9, (B) 27±1, and (C) 43±1 nm. Scale bar is 100 nm. ... 105 Figure 5.3 : A) Fluorescence lifetime values (τ0) for molecular MQ and for In@(RB)@(FL)@MQ with
different silica thicknesses. B) Relative fluorescence intensities (F/F0) of MQ and different architectures
for a 50-mM KCl solution in water (pH 6.4; N = 3)... 106 Figure 5.4 : A) Fluorescence intensities of In@(RB)@(FL)@MQ (20-nm) with pH at different excitation wavelengths of 490 (green) and 440 nm (white). B) Corresponding ratiometric pH calibration curve in different phosphate buffers (0.1 M). ... 107 Figure 5.5 : Calibration curves of In@(RB)@(FL)@MQ (spacer thickness = 20 nm) with different halides in aqueous solution (0.1 M phosphate buffer, pH 7.2). ... 108 Figure 5.6 : Transmission electronic micrograph of In@(RB) NPs (indium cores: 70±20 nm, silica shell: 5.1±0.3 nm) and corresponding size distribution histogram for the In cores. ... 112 Figure 5.7 : Transmission electronic micrograph of In@(RB)@(FL)@MQ with different silica spacer thickness (A: 10.8±0.9 nm, B: 20±1 nm, C: 41±1 nm). ... 113 Figure 5.8 : Modulation of the second silica shell through variation in TEOS concentration during the Stöber reaction... 113 Figure 5.9 : Values of fluorescence intensity enhancement (λex = 340 nm, λem = 440 nm) and lifetime
(λex = 308 nm) for MQ in In@(RB)@SiO2@MQ architectures as a function of spacer thickness. .... 114
Figure 5.10 : Zeta potential values for In@(RB)@SiO2 architectures in nanopure water before and after
the binding reaction of silanized MQ. ... 114 Figure 5.11 : Stern-Volmer constant values for molecular MQ (A) and RB (B) in the presence of chloride (blue), bromide (red) and iodide (yellow). The concentration was 1×10-6 M for MQ and RB. ... 115
Figure 5.12 : Excited state lifetime values measured for rhodamine B (RB) and fluorescein (FL) in In@(RB)@(FL) and in solution (λex = 488 nm). The concentration was 1 × 10-6 M for RB and FL.
Fluorophores were excited at 488 nm and fluorescence emission was measured at 580 nm (RB) and 520 nm (FL). ... 115 Figure 5.13 : A) Stability range for pH-sensitive ratiometry of In@(RB)@(FL)@MQ (20-nm) in three buffer compositions with regards to chloride concentration. B) Halide ion-sensitive fluorescence ratiometry (MQ/RB) with regards to pH. ... 116 Figure 5.14 : Stern-Volmer constants for Cl-, Br- and I- with different In@(RB)@SiO2@MQ colloidal
xvi
Figure 6.1 : “Click” coupling scheme used to graft fluorescent silver core-silica shell nanoparticles (Ag@SiO2-FiTC NPs) onto a SiO2 substrate. The complementary silane moieties are permutable
between both components. ... 122 Figure 6.2 : Up: Fluorescence image (λexc = 489 ± 6 nm, λem = 536 ± 20 nm) of a 1-mm2 area on a
substrate grafted with Ag@SiO2-FiTC (inset: SEM image of a representative region of the substrate
(scale bar = 1 μm). Down: Fluorescence signal homogeneity across substrate measured with 4× and 20× microscope objectives (S/N: signal-to-noise ratio). ... 124 Figure 6.3 : A) Fluorescence emission of Ag@SiO2-FiTC and Ag@SiO2-EiTC grafted on the same
coverslip in controlled proportions. Spectra from each color-coded group were measured at pH 6.2, 6.8 and 7.4 (e.g., from bottom to top). Spectra are normalized at EiTC maximum (543 nm); B) Linearity of the FiTC/EiTC ratiometric signal with pH. ... 125 Figure 6.4 : A) Excitation spectra of Ag@SiO2-FiTC nanoprobes recorded at various pH values; the
fluorescence signal was collected on the low-energy wing of the emission band of FiTC at 576 nm. B) Sensitivity to pH measured at different excitation wavelengths; the fluorescence signal was collected at the maximum emission wavelength (512 nm). C) Emission intensity with excitation at 490 nm (blue) and 440 nm (red), and calculated ratiometric values (green) (λem = 512 nm). ... 126
Figure 6.5 : Left: Fluorescence images (λexc = 489 ± 6 nm, λem = 536 ± 20 nm) and ratiometric pH
images (λexc: 489 ± 6 nm / 436 ± 5 nm, λem: 536 ± 20 nm) of transfected fibroblasts grown on
pH-sensitive substrate. Right: Ratiometric fluorescence values were measured in the regions identified by the yellow circles and converted to pH values. The error bars show standard error (N=15). Control: unaltered cardiac fibroblasts. GFP: cells transfected with over-expressed intracellular GFP; GFP+CA12: cells transfected with over-expressed GFP and CA12 enzymes. ... 128 Figure 6.6 : Left: Ratiometric pH image (λexc: 489 ± 6 nm / 436 ± 5 nm, λem: 536 ± 20 nm) of a
GFP+CA12 transfected cell on a pH-sensitive substrate. Right: pH values measured along 5-µm wide tracks leading away from the cell membrane (shown by the arrows) are compared for unaltered (control) and GFP+CA12 transfected fibroblast cells. Thick lines show averaged pH values. The blue and yellow boxes designate regions inside and outside the cell, respectively. ... 129 Figure 6.7 : Fluorescence signal from FiTC from core-shell Ag@SiO2-FiTC NPs suspended in
phosphate buffer (pH = 6.8) and from the supernatant after 16 h (centrifugation: 15 min at 18 000 RCF). ... 132 Figure 6.8 : A) Optical density of Ag@SiO2-grafted surfaces with permutation of coupling agents,
B) Grafting efficiency for different reaction times, C) Reproducibility of extinction spectrum from 3 coverslips grafted with Ag@SiO2 NPs from distinct synthesis batches. Error bars show standard
deviation (N=3). ... 133 Figure 6.9 : Extinction spectra of different types of plasmonic core-shell nanoparticles on silica coverslips. ... 133 Figure 6.10 : A) Illustration of the excitation bandwidths (exc = 436 ± 5 nm and 489 ± 6 nm) selected
by two filter cubes used on a fluorescence microscope for ratiometric measurements with the Ag@SiO2-FiTC surfaces. B) Calibration curve obtained with fluorescence imaging of pH sensing
substrate (em = 536±20 nm) in cell culture media (pH adjusted with addition of dilute nitric acid). 134
Figure 6.11 :Epifluorescence microphotograph of the fluorescent surface (FiTC, green) and cell nuclei (DAPI, blue) taken with a 40× objective. ... 134
xvii
Figure 6.12 : Fluorescence intensity from Ag@SiO2-FiTC core-shell particles grafted on surfaces
before (blue) and after (red) etching of the metal cores. The enhancement factor was calculated as the ratio of intensities at both maxima. ... 135 Figure 7.1 : Spectres d'excitation pour des nanoparticules SiO2+FL (A : NPs de 60 nm) et Ag@SiO2+FL
(B : cœurs de 60 nm avec coquille de 12 nm) pour une gamme de pH passant de 5,9 à 7,6 (rouge vers bleu) pour λem = 540 nm. ... 139
Figure 7.2 : Sensibilité au pH dans la gamme de 5,9 à 7,6 pour des architectures incorporant la fluorescéine (FL) avec et sans l’influence plasmonique. ... 140 Figure 7.3 : A) Intensité de fluorescence et B) épaisseur de la coquille de nanoparticules Ag@SiO2+FL
préparées à partir de différentes concentrations de précurseur FL-APS dans le milieu réactionnel de la condensation de Stöber ... 141 Figure 7.4 : Spectres d’excitation en fonction du pH de 6,0 (rouge) jusqu’à 8,0 (bleu) pour des architectures Ag@SiO2+FL sur un cœur de 80 nm dans une coquille de 15 nm avec différentes
concentrations de FL-APS en milieu réactionnel de la condensation de coquille (CFL). ... 142
Figure 7.5 : Effet de la distance entre la couche SiO2+FL sur A) l’intensité ratiométrique et B) la
sensibilité au pH à partir d’un cœur de 80 nm. La référence correspond à des particules SiO2+FiTC de
60 nm. ... 143 Figure 7.6 : Anisotropie de fluorescence mesurée à 20°C pour la fluorescéine moléculaire (FiTC) et encapsulée dans un colloïde de silice (SiO2+FL), puis dans une architecture MEF à différentes
concentrations d’incorporation (Ag@(molarité réactionnelle))... 145 Figure 7.7 : Mesure de la photostabilité de différentes nanoparticules incorporant la fluorescéine en fonction de la taille du cœur plasmonique avec 6 μM de fluorophore pour la coquille (A) ou de la concentration en fluorophore utilisée (B) dans une architecture de 80 nm de cœur et une coquille de 15 nm. Les échantillons ont été caractérisés en contact avec une solution de tampon phosphate 0,010 M (pH 7,3) avec une excitation à 488 nm et une récolte avec un filtre passe-haut à 506 nm. Tous les résultats considèrent N > 100 et les barres d’erreur correspondent à l’erreur standard à la moyenne. ... 146 Figure 7.8 : Réaction de couplage entre un ester succinimidique du SNARF et de l’APTES afin de préparer un précurseur silane fluorescent pour immobilisation dans une coquille de silice ... 147 Figure 7.9 : Fluorescence d’architectures (A) Ag@SiO2+SNARF et (B) Ag@SiO2@SiO2+SNARF en
fonction du pH pour une excitation à 550 nm dans des solutions tampon phosphate (0,01 M). ... 148 Figure 7.10 : Valeurs de fluorescence ratiométrique de différentes architectures MEF incorporant le SNARF par rapport au SNARF-1 moléculaire dans des solutions tampon phosphate (0,01 M) ... 148 Figure 7.11 : Présentation schématique des étapes de fabrication d'un canal microfluidique sensible au pH avec une jonction « Y ». ... 150 Figure 7.12 : Images de microscopie d'épifluorescence comparant l’uniformité de canaux microfluidiques préparés par lithographie (i) et par réaction de couplage in situ (ii). ... 150 Figure 7.13 : A) Droite de calibration de l'intensité ratiométrique en fluorescence de NPs Ag@SiO2+FL
confinées dans un canal microfluidique et exposées à différentes solutions tamponnées (PB, 0,100 M) dans une gamme de 5,8 à 7,5. B) Comparaison du signal brut d’une région de greffage hétérogène de capteurs et les valeurs de pH converties par ratiométrie de fluorescence. ... 151
xviii
Figure 7.14 : A) Intensité ratiométrique de la fluorescence récoltée avec différents objectifs de 2× (N.A.=0,06) et 10× (N.A.=0,4) en fonction du temps d’exposition à une source filtrée à (427±5) nm. B) Valeurs de pH mesuré ... 151 Figure 7.15 : Images ratiométriques en microscopie d’épifluorescence pour des canaux microfluidiques avec deux entrées (forme en « Y ») à différents débits d’entrée de deux solutions tampon phosphate (0,100 M) à pH de 7,0 et 5,0 respectivement. La fluorescence moyenne de la région à pH 5,0 a été soustraite à toutes les images afin d’améliorer la perception du contraste à l’interface. ... 153 Figure 7.16 : A) Intensité relative de fluorescence (λexc = 485 nm, temps d’intégration de 10 ms) pour
plusieurs changements de pH 5,0 à 7,0 dans un écoulement durant 60 secondes. B) Clichés consécutifs tirés d’un vidéo à une fréquence de 4 images par seconde permettant d’observer une perturbation locale par surpression rapide de l’écoulement à pH 7,0. ... 154 Figure 7.17 : Images ratiométriques de bulles de CO2 A) de diamètre supérieur à 1 mm et B) plus
petites que 1 mm et leur signature d’acidification lorsqu’il y a contact avec la surface sensible au pH en-dessous. Les images ratiométriques sont superposées sur le même emplacement en transmission afin de mettre en évidence la position réelle des interfaces; la barre d’échelle correspond à 1 mm. 155 Figure 7.18 : Gauche – Imagerie ratiométrique de coupes histologiques de valves aortiques murines d’un contrôle calcifié sans traitement (CTL), un échantillon mis en contact avec le 2-thioUTP (2tUTP), et un échantillon mis en contact avec le 2-thioUTP et l’acétazolamide, un inhibiteur de CAXII (2tUPT+ACTZ). La barre d’échelle représente 50 μm. Droite – Valeurs de pH sous la coupe mesurées pour les échantillons précédents. ... 156 Figure 7.19 : A) Valeurs de pH extracellulaire (pHe) mesurées en microscopie d’épifluorescence à 10 μm de cellules fibroblastes cardiaques contrôles (CTL), mises en contact avec l’agent thérapeutique (2tUTP), ou avec le 2-thioUTP et le SITS, un inhibiteur des transporteurs de bicarbonate (2tUTP+SITS, 50 μM). B) Valeurs de pH intracellulaire (pHi) mesurées par cytométrie en flux pour des cellules marquées avec BCECF-AM (2 μM), un fluorophore pH sensible. ... 157 Figure 8.1 : A) Graphique obtenu en EELS de l’énergie des modes plasmoniques de structures octopodes Au/Pd. B) Structure des particules Ag/Pd dans différentes orientations en STEM (scanning
transmission electron microscopy). Schématisation et cartographie énergétique de différents modes
plasmoniques des octopodes dans le plan d’un substrat (C) ou éloigné d’une surface (D).1 ... 163
Figure 8.2 : A) Observation en microscopie d’épifluorescence de la couverture de NPs Ag@SiO2+FL
sur une fibre optique de 300 microns de diamètre. B) Signature spectrale de l’émission de fluorescence de l’extrémité du segment par retour couplé dans le cœur optique. ... 165 Figure A.1 : A) Presentation of the main steps for the fabrication of pH-sensitive microfluidic Y-channels. B) Fluorescence images from pH-sensitive channels resulting from i) the stamping process described in (A), and ii) grafting under low flow conditions. ... 171 Figure A.2 : Left: Relative standard deviation values measured in 10 different regions (diameter ~300 µm) from uncorrected fluorescence signal excited at 490 nm (green bars) and 440 nm (blue bars) and after ratiometric normalization (clear bars). Right: Effect of ratiometric signal normalization on the spatial uniformity of pH sensor response. Top trace (red, left axis): uncorrected raw fluorescence signal measured across sensor surface. Bottom trace (black, right axis): pH values calculated from raw fluorescence data and ratiometric calibration curve. ... 173
xix
Figure A.3 : A) Ratiometric pH images of the interface between pH 5 and pH 7 buffer solutions in the lower and upper channels. Flow rates were (i) QpH5= 1.5 mL/h, QpH7= 0.5 mL/h, (ii) QpH5= 1.0 mL/h,
QpH7= 1.0 mL/h, and (iii) QpH5= 0.5 mL/h, QpH7= 1.5 mL/h. B) pH cross-sections along the x-direction at
y = 0.5 mm (dark red) and y = 3.5 mm (blue) as highlighted by boxes around regions of interest in panel A ii). ... 175 Figure A.4 : Four consecutive frames from a movie showing the downstream propagation of a flow instability at the interface between pH 5.0 and pH 7.0 liquids with flow rates QpH5=3 mL/h, QpH7=1.6
mL/h. To improve image quality, a post-acquisition background subtraction was calculated using an image of the channel subjected to a solution of pH 5 only. A frame rate of 4 fps was achieved by reducing image acquisition time to 250 ms, with no binning and no delay between acquisitions. Scale bars are 1 mm. Dotted lines show the channel walls. ... 176 Figure A.5 : A) A Y-channel with acidic biofilm growth confined to upper portion of the image by bright-field transmission microscopy (i) and ratiometric pH imaging (ii). Global contrast enhancement was applied to optimize visualization, which were not otherwise readily visible for (i). Scale bar is 1 mm. (B) Pixel intensity values of the raw images as a function of distance from the microchannel wall for bright-field microscopy (orange) and ratiometric pH imaging (blue). The position and direction of the arrows in (A) indicate the path of the line profiles in (B). (C) An optically-dense biofilm segment near the microchannel wall with overlay from ratiometric pH imaging in the same location. Green color indicates acidic portions. Scale bar represents 100μm. (D) Pixel intensities of the individual raw images in (C) with distance from the microchannel wall for bright-field microscopy (orange) and ratiometric pH imaging (blue). The arrow in (C) indicates the path of the line profile in (D). ... 178 Figure A.6 : (A) Biofilm pH response to application to modified LB growth medium with and without glucose. At t=0 min the glucose concentration in the nutrient solution changed from 0.1wt% to 0wt%. At t=30 min (arrow) the glucose was re-introduced. All flow rates were kept constant at 0.3 mL/h. Measurements and error bars were generated from four specific fields of view, within the yellow square in Figure A.5(Aii). A two-data point moving average was applied to smooth results, for eye guidance. (B) Representative image from one of the four fields of view showing localized acidification (red) under regions of biofilm accumulation (green). The image was the result of overlaying of a pH image on a regular bright field image, using look up tables to transform grey-scale pixel intensity to red and green pixel intensity, respectively. Scale bar is 100µm. ... 179 Figure A.7 : (A) time-varying pH under flow conditions Q1=0.1 mL/h 0<t<20 min; Q2=0 mL/h 20<t<60
min; Q3=0.3 mL/h 60<t<130 min; Q4=0 mL/h 130<t<185 min. Black arrows show the time when flow
conditions were changed. Error bars were generated from 4 separate measurement zones. (B) Changes in calculated proton concentration with time. ... 181 Figure A.8 : A) Transmission electronic micrograph of Ag@SiO2+FiTC NPs with dimensions of (80±10)
nm for the core and (15±1) nm for the silica shell. B) Scanning electron micrograph of Ag@SiO2+FiTC
NPs grafted on a glass coverslip. ... 184 Figure A.9 : Ratiometric calibration curve measured for Ag@SiO2+FiTC-NPs surface and filter
combinations FC1/FC3. ... 185
Figure A.10 : Reduction in fluorescence emission intensity ratios of the nanoparticle sensing layer (FC1/FC3) at intervals between continuous exposure using filter combination FC2 and 2x and 10x
xx
Figure A.11 : Calibration curve of Ag@SiO2+FiTC surfaces before (solid circles, left axis,
y=0.0089x+0.3275) and after (open circles, right axis, y=0.0015x+0.1773) photobleaching with 10x
objective and FC2. ... 186
Figure A.12 : A) False coloured representation of a ratiometric pH image of a locally dense portion of
Streptococcus salivarius bacterial biofilm. B) Transmission image of the same region in A). Both A and
B were acquired using a 10x objective. Scale bars in A and B are 100 µm. ... 186 Figure B.1 : TEM (A) and SEM (B) of (110±10)-nm Ag@SiO2+FiTC NPs before and after grafting on a
glass coverslip. C) Steps in the fabrication of pH-sensitive coating inside a microchannel used in this work include (i) soft-stamp contacting (i) and removal (ii) steps. Irreversible bonding (iii) and inlet/outlet interfacing (iv) steps finalised the device. ... 195 Figure B.2 : Ratiometric calibration curve measured for Ag@SiO2+FiTC-NPs surface and filter
combinations FC1/FC3 (R2=0.9904). ... 196
Figure B.3 : A) View of the inlet of a Y-junction channel which contained pure water (top channel) and CO2 saturated water (lower channel). The box indicates the location which was used to make the line
profile. Darkened spots show photobleached segments, where previous measurements were taken with higher magnification. Contrast enhancement was applied for presentation purposes. B) Results of a line profile shown in (A). ... 196 Figure B.4 : Consecutive frames from a video showing the flow-stream response to a temporary misbalancing of pressure from inlets carrying neutral and acidified water streams. The flow rate ratio before the disturbance to flow was QpH7.0/QpH5.5=1 (A). Image acquisition time was 50 ms, and frame
interval was 680 ms. All video images were background subtracted using an image from the same field of view during the flow of acidified liquid only. Scale bar is 1 mm. Contrast enhancement and smoothing algorithm were applied for presentation purposes. ... 197 Figure B.5 : Fluorescence signal in spectrofluorimetry of the embedded pH-sensitive glass substrate under alternate pH 5.0 and 8.0 flows (λex=490 nm and λem=520 nm). Time increments of 50 ms were
used and the t90 parameter was averaged at 500 ± 200 ms, N=20. ... 198
Figure B.6 : A) Top-view of the microfluidic device used for generation of CO2 bubbles. The white
horizontal rectangle represents the microfluidic channel and the grey ellipses represent penetration points in the channel for inlets and outlets. B) Microfluidic side-view. Inlets are shown with downward pointing arrows and outlet with an upward pointing arrow. The microfluidic channel for gas bubble generation had dimensions of width, height and length equal to w=800 µm, h=200 µm, and L=20 mm, respectively. ... 198 Figure B.7 : Large (A) and small (B) CO2 bubbles trapped in a microchannel under static flow
conditions. The image is a combination of a color ratiometric image with a superimposed black and white transmission image show the bubble edge. False color images show red and green pixels of 5.3 and 7.1, respectively, which can be transformed into chemical maps with continuous pH variations via a mean filter. Scale bar is 1 mm. ... 199 Figure C.1 : A) Bande d'extinction plasmonique de nanoparticules d’argent préparées par réduction simple à ébullition avec le citrate de sodium. B) Image représentative en microscopie électronique par transmission des particules de (50±15) nm. ... 202
xxi
Liste des tableaux
Tableau 2.1 : Propriétés générales de luminescence des principaux indicateurs fluorescents présentés dans la littérature8 ... 25
Tableau C.1 : Volumes de solution TEOS 34 mM à ajouter pour une condensation de Stöber d’épaisseur contrôlée ... 207 Tableau C.2 : Paramètres de centrifugation pour la purification de NPs cœur-coquille de différentes tailles dans un milieu réactionnel d’éthanol ... 207 Tableau C.3 : Paramètres de centrifugation pour la purification de NPs cœur-coquille fluorescentes dans un milieu réactionnel d’éthanol ... 208
xxii
Liste des abréviations
APTES Aminopropyltriéthoxysilane DMA Diméthylamine
ε Section efficace d’absorption molaire E.F. Facteur d’exaltation de la fluorescence EiTC Isothiocyanate d’éosine Y
FiTC Isothiocyanate de fluorescéine FL Fluorescéine
FRET Transfert d’énergie résonant entre molécules fluorescentes (Förster resonant
energy transfer)
IRF Fonction de réponse instrumentale (Instrumental response function) λexc Longueur d’onde d’excitation de la fluorescence
λem Longueur d’onde d’émission de la fluorescence
LSPR Résonance plasmon localisée en surface (Localized surface plasmon resonance) M@SiO2 Architecture composée d’un cœur métallique (M) et d’une coquille de silice
(@SiO2)
MEF Fluorescence exaltée par un métal (Metal-enhanced fluorescence) MQ Méthoxyquinolinium
NP Nanoparticule
NTA Analyse par suivi de nanoparticules (Nanoparticle Tracking Analysis) pH Potentiel hydrogène
RiTC Isothiocyanate de rhodamine B
RB Rhodamine B
SAM Monocouche auto-assemblée (Self-assembled monolayer)
SEM Microscopie électronique à balayage (Scanning electron microscopy) SNARF Seminaphtarhodafluor
τ Temps de vie de fluorescence
TCSPC Comptabilisation de photons uniques corrélés en temps (Time-correlated single
photon counting)
TEA Triéthylamine
xxiii TEOS Tétraéthyl orthosilicate
u.arb. Unités arbitraires UV-VIS Ultraviolet-visible
xxiv
Dédicaces
À mes constantes :
xxv
Épigraphes
The real value of a real education, has almost nothing to do with knowledge, [but] everything to do with simple awareness.
- David Foster Wallace
What could I say to you that would be of value, except that perhaps you seek too much, That as a result of your seeking you cannot find.
- Hermann Hesse
A learning experience is one of those things that says: “You know that thing you just did? Don’t do that.”
xxvi
Remerciements
C’est au courant du 18e siècle qu’est introduite la définition d’une « personne expérimentée dans un
domaine qui accompagne une autre personne souvent plus jeune et moins expérimentée (mais non moins motivée) en réfléchissant, conseillant, et donnant du soutien moral pour l’aider à se développer dans sa fonction » du grec Mentor, qui enseigna au fils d’Ulysses (Bloch et von Wartburg, 1968). C’est donc dans de grands souliers que marchait Denis Boudreau, au 21e siècle, lorsque j’entrai dans son
bureau à titre de stagiaire… Mais Ô combien il aura su répondre à ces attentes! Après maintes conversations et discussions, je me dois de souligner comme il se doit mon mentor des dernières années. Les suggestions musicales, les blagues plus ou moins appropriées et les apports personnels ne font que pâle figure devant les leçons que j’ai apprises sous votre tutelle. Merci Denis d’avoir permis libre cours à mon imagination dans différentes idées de projets, d’avoir ouvert mes horizons et, parfois, d’avoir offert des conseils pertinents (avec du recul). Je blague bien, mais votre support et votre soutient m’ont forcé à aller plus loin, à me remettre en question et à courir chercher la pépite d’or derrière mes particules d’argent. Mille mercis à qui vous êtes, à votre intuition et à votre façon de gérer (notre) un groupe de recherche. Ça permet à des personnes comme moi de prendre leur essor et d’atteindre des objectifs qu’on aurait cru hors de portée.
J’aimerais souligner les conseils professionnels et l’appui constant des professeurs Jesse Greener et Younès Messaddeq, qui m’ont fait office de mentors à temps partiel depuis maintenant plusieurs années. Plus récemment, un gros merci à la générosité de Russ Algar de m’avoir accueilli (et à Ghinwa de m’avoir enduré) dans son groupe de recherche pour une opportunité de stage particulièrement constructive. Finalement, je me dois aussi d’offrir des remerciements en bonne et due forme au jury évaluateur de cet ouvrage : mesdames Anna Ritcey et Émilie Ringe, et messieurs Dominic Larivière et Jean-François Masson. Avec votre curiosité et votre enthousiasme envers la recherche scientifique, c’est un honneur pour moi que vous ayez accepté d’être les premiers lecteurs de cette thèse doctorale. À tous mes mini-mentors personnels, merci de m’avoir permis de me voir sous un autre jour, de dévoiler des facettes de ma personnalité que je croyais impossibles. Marie-Christine, Joanie, Félix-Antoine, Cyril, Alexandre, Samuel, David, Josée, Mélina, Marie-Pier, Audrey : votre patience et votre sagesse n’ont d’égales que votre bonté, votre sourire au quotidien. Vous ensoleillez un bureau ou un laboratoire à vous seul(e)s : ne vous éteignez jamais!
xxvii
Cette section serait bien incomplète sans des remerciements particuliers envers les stagiaires ayant participés à ce projet de doctorat, ces trois fougueux mousquetaires scientifiques qui ont tous apporté un gros quelque chose à mon passage gradué. Carl Roy (Porthos), le bon buveur, pour sa dextérité légendaire sur les lames-tunnels et ses inépuisables péripéties rocambolesques. Philippe Legros (Aramis), le charmeur en série, pour sa précision en synthèse, sa fougue sportive et son support incommensurable, voire meme essentiel dans les dernières années. Nicolas Fontaine (Athos), le modeste rationnel, pour son travail sans relâche (littéralement), ses rapports bimensuels de ouf et, ma foi, son innocence attachante. Et finalement, Megan Bouchard (D’Artagnan), la quatrième du trio, pour sa maturité, sa rigueur scientifique et son étincelle perpétuelle pour rallumer mon cœur d’enfant. Vous êtes tous et toute des personnes exceptionnelles et je ne pourrais vous remercier suffisamment de m’avoir autant appris.
Et finalement, à Toi : chère Lectrice, cher Lecteur. (Je me permets de te majusculifier)
Cet exercice de rédaction et de réflexion aura été un effort personnel et c’est un plaisir de partager cette ultime étape d’un projet qui aura été ma passion durant près de 4 ans. C’est grâce à Toi que cet ouvrage a maintenant une portée au-delà du temps et de l’espace, puisque Tu permets à ma voix d’exister. La portée réelle d’une thèse ou d’un mémoire est probablement difficile à évaluer. Après tout, le bassin des Lecteurs potentiels est limité et l’intérêt de certains est déjà biaisé : venir s’enquérir des remerciements de l’auteur, mettre en contexte une référence, imprimer un protocole détaillé. Bref, ça ne sera jamais un Coup de Cœur chez Archambault et ça n’attirera pas un « J’aime » sur Facebook. C’est donc particulièrement apprécié que Tu me rejoignes dans cette aventure le temps de quelques pages et j’espère sincèrement que Tu pourras en tirer quelque chose d’intéressant.
Tu n’as peut-être jamais entendu le rire de Félix-Antoine, l’éternuement de Mélina ou l’écureuil d’Audrey. Jamais vécu une anecdote interminable à la Samuel, un sourire à la Joanie, un débat à la Alexandre. Jamais assisté à un squash avec Maxime, à une expédition avec Frédérique, à un concert avec (l’une des) Stéphanie. Ça n’est pas le sujet des prochaines pages, mais ça aura été mon adjectif et mon adverbe pour parvenir à achever cette thèse de doctorat.
Merci. Merci mille fois. Pour tout.
xxviii
Avant-propos
Cette thèse de doctorat comporte une section de résultats composée de trois articles publiés dans des journaux scientifiques à visibilité internationale. Les présents travaux ont été entamés lors d’une maîtrise en chimie et se sont poursuivis après un passage direct vers le doctorat sous la direction du professeur Denis Boudreau. Alors que la rédaction des manuscrits s’est aussi déroulée sous sa supervision, cet avant-propos permettra de clarifier l’apport des différents co-auteurs aux expériences et de positionner le contenu scientifique des articles dans la suite logique du projet.
Tout d’abord, le premier article présenté dans cette thèse (chapitre 4) est paru dans la revue
Plasmonics en 2016 (doi: 10.1007/s11468-016-0186-5). Cet ouvrage détaille la méthodologie de
synthèse contrôlée des nanoparticules cœur-coquille et présente une étude spectroscopique de leurs propriétés d’exaltation de la fluorescence, fondamentale pour la suite du projet. Les étapes d’optimisation de la préparation des particules d’argent et de mesure des temps de vie de fluorescence ont été assistées par Philippe Legros et Alexandre Grégoire, respectivement.
Le chapitre 5 expose une nouvelle architecture multicouche permettant la mesure simultanée d’anions halogénure et du pH, travaux présentés dans un article du journal Chemical Communications en 2017 (doi: 10.1039/C6CC08693D). La synthèse des cœurs plasmonique d’indium a été entièrement effectuée sous la supervision de Marie-Pier Lambert et les calibrations en fluorimétrie ont été assistées par Nicolas Fontaine. Ces résultats bâtissent sur les connaissances fondamentales acquises dans le chapitre précédent afin d’exploiter l’influence d’un cœur plasmonique comme amplificateur d’un signal analytique.
L’article constituant le chapitre 6 a été publié dans le journal Chemical Communications en 2014 (doi: 10.1039/C4CC06075J) et présente l’étude spectroscopique et l’application de nano-capteurs de pH sur des substrats lamellaires. Les conditions de greffage des particules ont été optimisées avec l’aide de Carl Roy, à titre de stagiaire, et la démonstration des mesures extracellulaires est le fruit d’une collaboration étroite avec Rihab Bouchareb et Dr. Patrick Mathieu à l’Institut universitaire en cardiologie et en pneumologie de Québec. De plus, la technique de couplage des nanoparticules cœur-coquille sur des surfaces de silice et les lamelles de microscopie fonctionnalisées avec cette méthode ont pu être protégées par un brevet d’invention de l’Université Laval (document US 615/312,886 daté du 23 mai 2014).
xxix
De plus, les résultats et expériences de ce doctorat ont pu être évalués par des experts du domaine lors de séminaires internationaux :
• La conférence et le séminaire Gordon sur les métaux nobles à South Hadley (Massachussetts, USA) pour la partie des synthèses de nanoparticules plasmoniques cœur-coquille multicouches basées sur l’argent et l’indium;
• La rencontre de l’American Chemical Society à Philadelphie (Pennsylvanie, USA) pour l’étude spectroscopique des propriétés d’exaltation d’architectures multicouches fluorescentes;
• Les conférences SCIX de 2014 et 2017 à Reno (Nevada, USA) pour la présentation des résultats analytiques en microscopie dans des environnements cellulaires;
• Les conférences des sociétés canadiennes de chimie (2015 à 2017) et de génie chimique (2016) pour les preuves de concept d’applications en conditions in vitro et microfluidique, ainsi que pour le design d’architectures concentriques multifonctionnelles.
Finalement, l’annexe de cette thèse ajoute deux publications (Annexe A et Annexe B) résultant d’une collaboration avec le groupe du professeur Jesse Greener, qui ont permis de démontrer l’applicabilité des lamelles fonctionnalisées lors d’expériences en microfluidique. Ces documents complémentaires, parus dans les journaux Lab on a Chip et MRS Advances en 2016, sont joints à titre de suppléments puisqu’ils ont été rédigés avec l’aide de nos collaborateurs et se situent dans leur domaine d’expertise. Toutefois, l’analyse des résultats importants pour l’optimisation des substrats lamellaires a été jointe dans une section de démonstration d’applications au chapitre 7.
1
1 Introduction
1.1 Contexte de recherche
L’étude mécanistique de différents dysfonctionnements biologiques est une étape cruciale dans le développement de traitements ciblés pour un mécanisme cellulaire spécifique. Notamment, l’activation anormale des transporteurs membranaires pour le passage d’ions est reconnue comme caractéristique de plusieurs pathologies répandues dans la population. Par exemple, la division des cellules cancéreuses est promue par une acidification notable à proximité des tissus tumoraux afin d’activer certaines enzymes initiant la mitose. D’autres troubles comme la maladie d’Alzheimer et la fibrose kystique entraînent plutôt un déséquilibre ionique par l’inhibition ou l’absence de certaines protéines perméables aux cations (Na+, K+,
Ca2+) et aux chlorures (Cl-), respectivement. Plusieurs laboratoires biomédicaux cherchent donc à
développer des agents thérapeutiques antagonistes ou agonistes, selon le cas, en ciblant spécifiquement les récepteurs membranaires de l’activité métabolique affectée. Toutefois, la plupart des appareils de quantification ionique sont d’échelle macroscopique (électrodes, papiers colorimétriques, ICP) et souvent invasifs, voire même destructifs. Il existe alors un besoin important de développer des capteurs adaptés à la mesure de variations locales à proximité des membranes biologiques pour les cultures cellulaires. Ainsi, ces outils permettraient d’aider grandement à l’identification du rôle de différentes composantes biologiques et de faire le suivi de l’activité et de l’efficacité de nouveaux médicaments ciblés pour ces maladies.
Depuis maintenant plusieurs décennies, l’arrivée des nanotechnologies a permis aux chercheurs d’interagir avec le mode biologique à une échelle auparavant inatteignable grâce à des découvertes pionnières comme la manipulation de liposomes (1964)1,2 et de virus (1976)3, la préparation de nanoparticules plasmoniques
(1951)4,5 et de points quantiques luminescents (1981)6,7, et le contrôle des dendrimères (1990)8,9. Ces
avancées ont ouvert la porte à des explorations biomédicales poussées et ont mené à une compréhension plus avancée en permettant le suivi d’événements métaboliques intracellulaires. Notamment, la transfection du gène de protéines fluorescentes comme GFP (green fluorescent protein) sert à rapporter efficacement l’expression de protéines métaboliques modifiées, mais aussi à ajouter certaines fonctionnalités comme une sensibilité au pH, aux ions et à certaines biomolécules dans toute la gamme du visible (Figure 1.1).10–12
L’ajout de ce signal permet de différencier aisément en microscopie les cellules présentant, par exemple, un nouveau gène de transporteur membranaire par rapport à leurs homologues non-transfectés.
2
Figure 1.1 : Illustration de la gamme d'émission pour différentes protéines fluorescentes disponibles, tirée de la présentation de Roger Y. Tsien pour le prix Nobel de chimie en 2008.11
Alors que l’étude de la variation de paramètres généraux comme le pH ou les ions polarisants (Na+, K+, Ca2+,
Cl-) demeure intéressante pour sonder l’activité métabolique des cellules eucaryotes, la complexité de
l’environnement intracellulaire vient ajouter un bémol aux valeurs brutes mesurées. En effet, la composition chimique du cytosol varie drastiquement selon l’organelle à proximité et les données recueillies demeurent qualitatives dans la plupart des expériences réalisées sans normalisation du signal. Même dans ce cas, le développement de la sonde peut difficilement être fait dans un environnement calquant les conditions expérimentales, justement à cause du contexte cytoplasmique et des actions métabolismes interreliées s’y déroulant. Ainsi, les expériences quantitatives permettant le suivi cellulaire vont plutôt utiliser des techniques destructives impliquant leur lyse avant la mise en contact avec un marqueur sensible ou encore la mise en place de systèmes complexes à faible invasivité comme la méthode électrique du « patch-clamp ».13–15 De
cette manière, une micropipette est utilisée pour percer la membrane cellulaire et mesurer des variations du potentiel électrochimique dans certaines cellules excitables.
Toutefois, puisque le suivi non-destructif s’est fait historiquement par le marquage colorimétrique des compartiments cellulaires puis par l’expression de protéines fluorescentes, seulement un faible nombre d’études se sont penchées à sonder l’activité in vitro à même l’environnement extracellulaire. Pourtant, ces conditions de culture ont l’avantage d’être réplicables et de permettre le suivi temporel de l’activité métabolique d’ensemble de la cellule de façon non-invasive. De plus, l’application de nanotechnologies dans ce genre de capteurs externes offrirait potentiellement plusieurs informations sur les transporteurs membranaires avec une bonne résolution spatiale et temporelle par rapport aux dimensions cellulaires eucaryotes.
3 1.2 Objectifs du projet
Les outils de détection cellulaire peuvent se retrouver dans deux gammes bien distinctes. Tout d’abord, un capteur macroscopique (électrode, papier colorimétrique) offrira des informations temporellement résolues, mais dont l’invasivité et la précision spatiale le limitent aux mesures générales d’ensemble. Ensuite, une sonde moléculaire ou nanoscopique se heurte aux interactions cellulaires en tant que corps étranger : la phagocytose, l’internalisation active par endocytose et leur destruction subséquente par acidification.16 Ces
travaux de doctorat visent donc à développer et à appliquer un outil de détection polyvalent implantable directement dans l’environnement extracellulaire. Par le fait même, le capteur tentera de répondre à ces problématiques particulières :
• La mesure d’informations exclusivement extracellulaires à proximité de la membrane biologique; • Le suivi d’un paramètre d’intérêt en fonction de l’activité métabolique de cellules ou de bactéries; • L’utilisation d’une méthode de normalisation permettant la quantification de ce paramètre; • La récolte d’un signal analytique résolu spatialement et temporellement.
Comme les techniques par fluorescence dépendent d’une interaction lumière-matière très peu invasive dans la gamme du visible, ce phénomène est mis de l’avant dans le projet. En effet, la fluorescence permet d’étudier fondamentalement les capteurs en spectrofluorimétrie résolue en longueurs d’onde ou en temps, mais aussi de les appliquer en microscopie d’épifluorescence dans des conditions réelles de culture cellulaire.
1.3 Concept proposé
Dans le cadre de cette thèse doctorale, un capteur de détection extracellulaire par fluorescence a été optimisé et appliqué pour visualiser quantitativement des variations de pH (Figure 1.2). Le choix du pH comme paramètre d’intérêt est motivé par la sélectivité intrinsèque au mécanisme de protonation des molécules, qui vient simplifier l’étude des interférents en solution. Afin d’obtenir une sensibilité suffisante et un signal de luminescence intense, ce système sensible utilise des nanoparticules exhibant une fluorescence exaltée par un métal. Pour ce faire, la caractérisation physico-chimique de ce phénomène a été effectuée dans des architectures concentriques et ces résultats sont détaillés dans le chapitre 4. Ce genre de nanostructures dites « cœur-coquille » peuvent être adaptées afin d’introduire plusieurs fonctions analytiques pour la détection multiélémentaire à partir de la même particule : une démonstration en est présentée dans le chapitre 5 de cet ouvrage. Finalement, ces nano-capteurs ont été immobilisés à la surface