HAL Id: hal-02792456
https://hal.inrae.fr/hal-02792456
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Identification d’un récepteur à l’odeur d’oestrus chez le
rat
Louis Richevaux
To cite this version:
Louis Richevaux. Identification d’un récepteur à l’odeur d’oestrus chez le rat. [Stage] 2016, pp.23. �hal-02792456�
Rapport de stage du 18 avril au 16 juin 2016
Identification d’un récepteur à l’odeur d’œstrus chez le rat
Louis Richevaux
Université Paris-Saclay / Université de Versailles St-Quentin-en-Yvelines Master 1 Biologie Santé – Année 2015-2016
Etablissement d’accueil : Institut National de la Recherche Agronomique (INRA) – Domaine de Vilvert, Jouy-en-Josas, France
Unité de recherche : UR1197 Neurobiologie de l’Olfaction (NBO) – Bâtiment 230 Site internet : www.jouy.inra.fr/nbo/
Stage encadré par : Mr. Patrice CONGAR, chargé de recherche.
Rendu le 9 juin 2016 Soutenance le 20/21 juin 2016
L’INRA est un organisme français de recherche publique qui s’intéresse à l’agronomie, à l’alimentation, et à l’étude des plantes et des animaux. Son but est d’apporter des solutions à des enjeux actuels tels que les changements climatiques, l’alimentation humaine, l’épuisement des ressources non renouvelables (fossiles) en intégrant économie, société et environnement.
Dans le cadre de mon stage, j’ai intégré l’unité de Neurobiologie de l’olfaction (UR 1197) dont un des objectifs est de comprendre le sens qu’est l’olfaction à travers des modèles murins comme la souris ou le rat. L’olfaction est un sens très important chez la plupart des animaux, et l’unité cherche à comprendre ses bases neurobiologiques qui permettent la détection et la discrimination des odeurs ainsi que la plasticité et l’adaptation du système olfactif. Mais leur intérêt se porte également sur son impact sur la physiologie de l’animal et son comportement, et inversement l’impact de l’état physiologique d’un individu, comme son état nutritionnel ou son stress, sur sa capacité à percevoir les odeurs.
Remerciements :
Mr Patrice CONGAR, Mr Adrien ACQUISTAPACE et Mme Guenhaël SANZ pour leur disponibilité et leur confiance, Mr Nicolas MEUNIER pour son aide lors de la recherche de ce stage, l’ensemble des personnels, chercheurs, techniciens de l’unité NBO et de l’INRA de nous avoir accueilli, moi et mes camarades stagiaires.
Identification d’un récepteur à l’odeur d’œstrus chez le rat
Louis Richevaux Sommaire Résumé & Abréviations………...1 Introduction………2 1. Contexte de la recherche……….2 2. Le système olfactif………....23. Quantification de l’activité neuronale et identification d’un récepteur……….... 3
4. Etudes précédentes………...4 a) Etude chez la souris……… 4
b) Electro-olfactogramme………. 5 5. Objectif………...5
Matériels et
méthodes………...6
1. Préparation des cellules dissociées ………. 6
a) Dissection……….... 6 b) Dissociation des cellules……… 6
2. Fluorescence et observation au microscope inversé………. 7
a) Marqueur fluorescent………. 7
b) Microscopie inversée………. 7 3. Prélèvement des cellules……….
7
4. RT-PCR sur cellule unique ……… 8
a) Reverse Transcription RT……….. 8
b) Nested PCR……….. 9 c) Migration sur gel……… 9
Résultats………
10
1) Identification des cellules
d’intérêt………10 2) Prélèvement des cellules………..11 3) Résultats de la RT-PCR………12 Discussion et perspectives……….14 Bibliographie………18
1
Résumé
L’olfaction est un sens primordial dans la majorité des espèces animales. En effet nombre de signaux sociaux sont véhiculés par ce sens, par exemple lors des phases de reproduction. Lors de ce stage, nous avons cherché à identifier et prélever les neurones olfactifs de rat répondant à une odeur spécifique de la période d’ovulation des femelles, dite œstrus : la 6-méthyl-5-hepten-2-one (ou méthylheptenone MH). Pour détecter les neurones répondant à la MH, nous avons utilisé une approche d’imagerie calcique sur des cellules dissociées de muqueuse olfactive de raton. Les neurones isolés sensibles à la MH ont été prélevés et nous avons ensuite essayé d’extraire de ces neurones le récepteur olfactif spécifique à cette odeur d’œstrus par une technique de RT-PCR « Nested » sur cellule unique. Le but serait de permettre, à terme, la conception de biosenseurs à base de récepteurs olfactifs pouvant détecter les périodes de fécondité des femelles dans les élevages, via la détection d’odorants, et de ce fait améliorer la gestion et l’efficacité de la reproduction au sein des élevages de rente.
Abréviations : ADNc : ADN complémentaire, BET : bromure d’éthidium, BO : bulbe
olfactif, EO : épithélium olfactif, KCl : solution saline enrichie en chlorure de potassium, MH : 6-méthyl-5-hepten-2-one (méthylheptenone), MO : muqueuse olfactive, MOP : mélange de 12 odorants, NO : Neurone olfactif, RCPG : récepteur couplé aux protéines G, RT : reverse transcription, RO : Récepteur olfactif, PCR : polymerase chain reaction, SN : salin normal, TAE : Tris Acetate EDTA.
2
Introduction
1. Contexte de la recherche
La vie animale est régie de manière prépondérante par l’interaction entre les individus, en effet, ces interactions sont les fondements de la société et jouent un rôle important dans la survie de chaque espèce, notamment lors des périodes de reproduction. Dans beaucoup d’espèces l’odorat est un des sens les plus développés et cette interaction entre les individus repose en grande partie sur ce sens (partie 2).
Dans les espèces mammifères, la femelle suit un cycle précis de production de gamètes qui délimite des périodes pendant lesquelles elle est fécondable et donc où la conception est possible, notamment la période d’ovulation, dite œstrus. Il a été montré que lors de cette période d’œstrus, la femelle émettait certaines odeurs en plus grande quantité, et qui serait donc spécifique de cette période. Parmi ces molécules odorantes la 6-méthyl-5-hepten-2-one (méthylheptenone MH) (Nielsen et al. 2013) est retrouvée chez le rat, le renard et le cheval, et la trans-5-heptèn-2-one chez la souris (Schwende et al. 1984). Ces odorants, quand ils sont perçus par les rats mâles, déclenchent alors des comportements sexuels incluant érections (Nielsen et al. 2013), comportements de type parade nuptiale destinés à préparer l’accouplement et la reproduction.
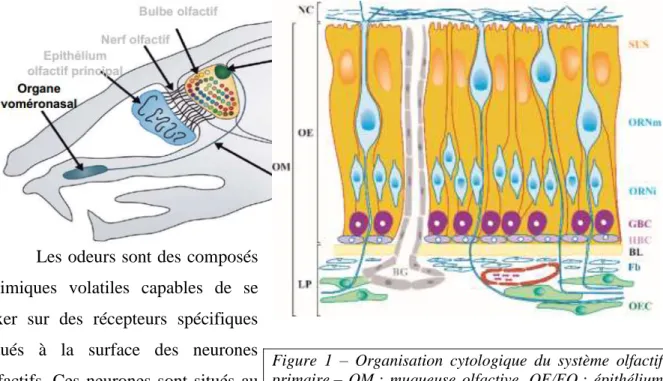
3 Les odeurs sont des composés
chimiques volatiles capables de se fixer sur des récepteurs spécifiques situés à la surface des neurones olfactifs. Ces neurones sont situés au niveau de l’épithélium olfactif (EO,
schéma figure 1) entre d’autres types cellulaires comme des cellules de soutien ou des cellules progénitrices destinées au renouvellement des neurones. L’EO recouvre le cartilage des cornets nasaux de la cavité nasale des mammifères. Les neurones olfactifs se projettent au niveau des glomérules du bulbe olfactif (BO) après avoir traversé la lame criblée, c’est le premier relais de l’information olfactive dans le système nerveux périphérique (figures 1 et 2). Le BO se projette ensuite à son tour dans le système nerveux central au niveau des régions sensorielles associées à l’olfaction comme le tubercule olfactif ou le cortex pyriforme.
Les molécules odorantes se fixent à des récepteurs couplés à des protéines G (RCPG) spécifiques : Golf, exprimés à la surface des neurones olfactifs (NO). Chaque neurone exprime
un seul type de RCPG olfactif (RO) parmi plusieurs centaines, voire plus de 1000 chez la souris ou le rat. La reconnaissance d’un odorant par un neurone olfactif déclenche principalement une cascade de transduction dépendante de la protéine Golf. Celle-ci induit
l’activation de l’adénylate cyclase 3 qui transforme l’ATP en AMPc. Cet AMPc va ensuite déclencher l’activation de canaux CNG (cyclic nucleotide gated channel) qui permettent
l’entrée d’ions Na+
et Ca2+ dans la cellule et également l’activation de la PKA qui permet l’inactivation du Figure 2 – Schéma du système olfactif chez le rat
Figure 1 – Organisation cytologique du système olfactif primaire – OM : muqueuse olfactive, OE/EO : épithélium olfactif, SES : cellules de soutient, ORNm : neurones olfactifs matures, ORNi : neurones olfactifs immatures
Figure 3 – Schéma de la transduction olfactive
4 récepteur. L’accumulation de Ca2+ dans la cellule active des canaux chlore Cl- (figure 3), l’ion va alors sortir de la cellule en fonction de son gradient transmembranaire. L’entrée de cations Na+ et Ca2+ et la sortie de l’anion Cl- entraine une dépolarisation de la membrane du neurone et la genèse un potentiel récepteur, qui pourra, si l’intensité de stimulation est suffisante, conduire à l’émission d’un potentiel d’action.
3. Quantification de l’activité neuronale et identification du récepteur.
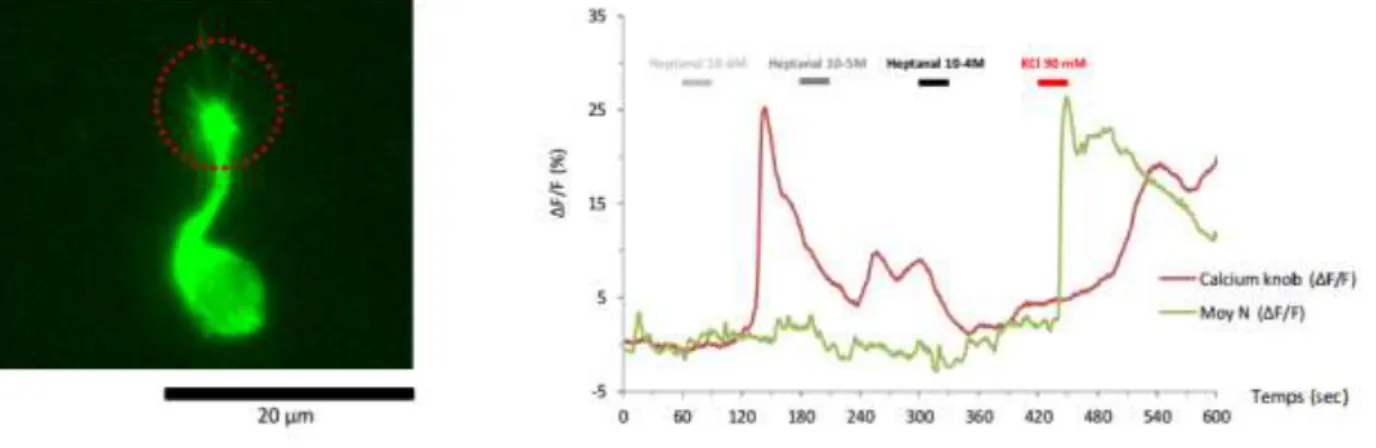
Afin de quantifier et d’observer l’activité neuronale déclenchée par un stimulus olfactif et d’identifier les cellules répondantes, sur tissu dissocié, la quantité de messagers intracellulaires impliqués dans cette activité est évaluée. Le Ca2+ est un des messagers qui s’accumulent dans la cellule lors de cette activation neuronale, il peut être quantifié et visualisé grâce à certains marqueurs fluorescents comme le Fura2-AM (Touhara et al. 1999) ou le fluo 4 (voir Matériel et méthodes) par des approches d’imagerie cellulaire.
Une fois un neurone répondant à une odeur identifié grâce aux marqueurs, celui-ci est prélevé et une RT-PCR sur cellule unique (voir Matériel et méthodes) est pratiquée pour identifier l’ARNm et ainsi le récepteur spécifique à l’odeur d’intérêt.
4. Etudes précédentes
a) Etude chez la souris
En travail préliminaire, le laboratoire a utilisé des approches similaires à celles qui seront développées dans ce rapport pour la recherche de RO connus et exprimés chez la souris. Les récepteurs i7 de souris sont sensibles à l’heptanal et ont été exprimés en association avec la GFP dans l’objectif de mettre au point un protocole permettant l’identification d’un RO répondant à une molécule odorante d’intérêt. Les chercheurs ont donc trouvé au sein de tissus dissociés des NO GFP positifs qui présentaient des réponses
Figure 4 – Neurone GFP positif de souris à gauche et réponses à différentes stimulations au cours du temps (en niveaux de fluorescence)
5 calciques à l’heptanal.
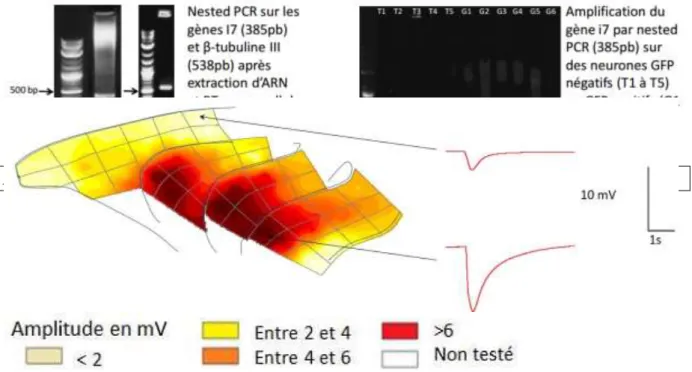
Sur les quelques neurones GFP positifs qui ont pu être prélevés, des RT-PCR de type Nested mono-cellule (développé en Matériel et Méthodes) ont été effectuées en ciblant le récepteur connu i7 ainsi que la β-tubuline III (une protéine spécifique des neurones) (Figure 5).
Cependant, ce modèle de souris présentait une fiabilité relative puisque les résultats étaient peu reproductibles et les préparations de cellules ne permettaient qu’un rendement faible. Il s’est alors imposé qu’un autre modèle devait être développé et le modèle rat a été choisi puisqu’en étant relativement proche de la souris il permettrait d’utiliser des protocoles relativement similaires.
b) Electro-olfactogramme
Une étude précédente effectuée par un stagiaire du laboratoire a montré des réponses
de certaines zones spécifiques de la muqueuse olfactive à des stimulations par la méthylheptenone dans des expériences d’électro-olfactogramme, une technique permettant la détection de champs électriques locaux au niveau de la muqueuse olfactive et traduisant une activité neuronale en réponse à des odorants.
Figure 5 – Nested PCR sur les ADNc i7 et β-tubuline III
Figure 6 – Résultats d'un EOG après stimulation par la MH : l’intensité de couleur représente l’intensité de réponse (en mV) à la stimulation (partie droite et basse de la figure)
6 Cette expérience a permis de montrer que la zone antéro-ventrale des cornets olfactifs IIb et III présentait une augmentation d’activité en réponse à une stimulation à la MH, il convient donc d’utiliser ces zones pour des expériences de cellules dissociées.
5. Objectif du stage
L’objectif de ce stage fut donc d’identifier des neurones répondant à l’odeur d’œstrus MH dans un modèle de rat grâce à la technique d’imagerie calcique sur des cellules dissociées d’épithélium olfactif de ratons et immobilisées sur lamelles. Les NO répondants sont prélevés et les ARNm extraits pour identifier le RO sensible à la méthylheptenone par une technique de RT-PCR sur cellule unique.
Matériels et méthodes
1. Préparation des cellules dissociées a) Dissection
Des ratons Wistar de 7 à 15 jours sont euthanasiés par décapitation. La boite crânienne est ouverte en deux avec un scalpel selon l’axe sagittal et les cavités nasales dégagées (septum et membranes) pour laisser apparaitre les cornets olfactifs (figure 7 ci-contre). Les parties ventrale et médiane des cornets IIb et III sont prélevés et disséquées dans une solution saline normale (SN – composition détaillée en annexe : tableau S1) froide (4°C) afin de séparer la muqueuse olfactive du cartilage sous-jacent en maintenant les cellules en vie. Ces deux cornets ont été montrés comme particulièrement répondants à la MH dans des expériences d’électro-olfactogramme (figure en 6 introduction).
b) Dissociation des cellules
Une fois la muqueuse isolée, elle est plongée d’une solution de dissociation (Hank’s Dissociation Buffer, papaïne 20U/mL, L-cystéine 500mM, 400µL, activée au bain-marie 15 Figure 7 – a) Coupe sagittale d'une tête de raton, b) Schéma des cornets olfactifs chez le rat, cornets d’intérêt encadrés en rouge
a IIa IIb III IV I b
7 minutes avant ajout des tissus) au bain-marie pendant 15 minutes. La dissociation à l’aide de la papaïne est arrêtée par l’ajout de sérum de veau fœtal (protéines en large excès) puis une fois les tissus retombés au fond du tube
après homogénéisation, le surnageant est remplacé par une solution de rinçage
(Hank’s Dissociation Buffer,
DNase1 100U/Ml, 800µL) homogénéisée par quelques reversements de tube. Le surnageant est à nouveau éliminé et remplacé par 800µL de SN. 400µL de solution contenant les tissus dissociés par
trituration à la pipette de verre rodée sont déposés à travers un tamis de 40µm (Falcon) sur des lamelles en poly-L-lysine
(protocole de préparation en annexe) montées dans des chambres d’enregistrement en microscope inversé et laissés à sédimenter 1h à l’obscurité et à température ambiante.
2. Fluorescence et observation au microscope inversé a) Chargement et marqueur fluorescent
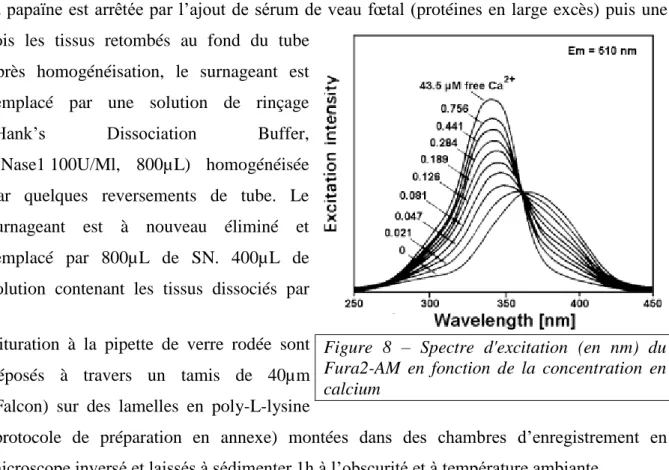
Les 400µL de solution de fixation sont alors remplacés par 400µL de solution de chargement de marqueur fluorescent Fura2-AM : SN, Powerload 100X – perméabilisation de la membrane, probenicid 250mM – séquestration du marqueur (Molinas et al. 2012), Fura2-AM ; la lamelle est mise à charger 1h à température ambiante et à l’obscurité. Le Fura2-Fura2-AM est un fluorophore sensible au calcium : en l’absence de calcium, il est excité par une lumière à 380nm, mais en présence de Ca2+ son spectre est décalé et atteint un maximum à 340nm (figure 8). Sa longueur d’onde d’émission est de 510nm indépendamment de la présence ou non de Ca2+. En cas d’activation neuronale, il y une entrée de calcium dans le neurone, si celui-ci est chargé en Fura-2, il y aura plus d’émission lorsque la longueur d’onde d’excitation sera de 340nm que 380nm.
b) Microscopie inversée
Figure 8 – Spectre d'excitation (en nm) du Fura2-AM en fonction de la concentration en calcium
8 Les lamelles sur lesquelles sont fixées les cellules de la MO, montées en chambre d’enregistrement pour le microscope inversé muni d’un objectif 10X à immersion, sont soumises à deux excitations successives à 380 et 340nm (200ms chacune) grâce à un boitier Olympus MT-20. L’émission est filtrée par un filtre d’émission spécifique au Fura2-AM (510nm) et captée par une caméra Hammamatsu ORCA-ER. Un ratio de l’émission en fonction de l’une ou l’autre des longueurs d’onde d’excitation (340-380nm) est calculé en fonction des différents traitements présentées au cours du temps et les résultats sont enregistrés sous forme de film à 1 image par seconde (correspondant au ratio), le tout grâce au logiciel excellenceRT.
3. Prélèvement des cellules
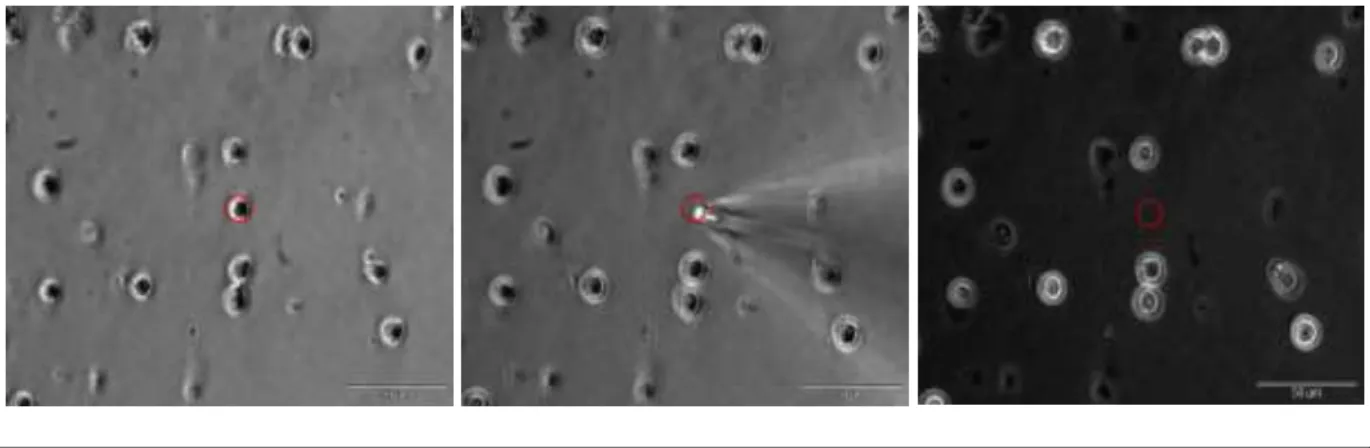
Les cellules d’intérêt sont prélevées grâce à des micropipettes de verre étirées à partir de capillaires de verre d’1,5mm de diamètre (diamètre à l’extrémité : ½ cellule), telles que les pipettes utilisées en technique de patch clamp (électrophysiologie), fixées sur micromanipulateurs manuels (axes x, y, z) et aspirées par pistons (5mL).
La pipette est descendue vers la lamelle dans la solution SN avec une légère surpression pour éviter l’entrée de liquide, puis approchée de la cellule. L’extrémité de la pipette est ensuite amenée au contact de la membrane en prenant soin d’éviter, lorsque cela est possible, le contact avec les cellules environnantes qui pourraient s’y accrocher et contaminer l’échantillon. Une première dépression est alors lancée pour faire adhérer la cellule à la pipette, de façon similaire à un patch-clamp, puis le tout est déplacé dans une zone
vide (si la zone est trop dense) où la dépression est augmentée pour aspirer la cellule.
4. RT-PCR sur cellule unique
9 Une fois la cellule unique prélevée, la pointe de la pipette est cassée au fond d’un microtube contenant un mélange de tampon de resuspension (2µL) et de RNase out (inhibiteur de RNase, 1µL) (kit SuperScript III, ThermoFisher) et l’air contenu dans la pipette est expulsé pour s’assurer de bien récupérer la cellule. Le microtube est ensuite congelé instantanément dans de l’azote liquide puis conservé dans un congélateur à -80°C.
a) Reverse transcription RT
Les microtubes sont d’abord décongelés dans de la glace puis chauffés 1’ à 75°C et centrifugés pour culoter toutes les gouttes qui restent sur les parois. 7µL de mélange DNase (DNase 1µL, tampon de suspension 10X 1µL, H2O 5µL) sont ensuite ajoutés dans chaque
tube. Ils sont ensuite incubés 5’ à température ambiante puis mis dans la glace, et enfin incubés 5’ à 70°C. Cette première étape permet d’éliminer l’ADN cellulaire afin de n’amplifier que les ARN. Suite à ceci, 9µL de mélange de RT sont ajoutés (4µL de tampon 10X, 0,7µL de DTT, 0,7µL de mix de dNTP, 1,3µL d’oligo dT, 0,7µL de RNase out, 0,7µL de SuperScriptIII – transcriptase – et 1,9µL d’H2O) dans chacun des tubes laissés 2’ à
température ambiante puis incubés 1h à 37°C et 10’ à 65°C. Ils sont ensuite conservés à -20°C. Cette étape permet la réverse transcription des ARN en séquences d’ADN complémentaire (ADNc).
b) Nested PCR
La Nested PCR (Polymerase Chain Reaction) ou réaction en chaîne par polymérases emboitée est effectuée sur l’ADNc obtenu après la RT. Cette technique particulière de PCR utilise deux paires d’amorces nucléotidiques. Un premier fragment est tout d’abord amplifié par les amorces extérieures (first outer primer set dans la figure 10 ci-contre), qui engendre un premier amplicon. Sur ce premier amplicon, une deuxième PCR est appliquée à l’aide d’amorces plus rapprochées et délimitant exactement la séquence d’intérêt (second inner primer set dans la figure). Cette technique de PCR permet de réduire la quantité de produit non spécifique et ainsi, dans le Figure 10 – Schéma d'une PCR de
type Nested, en vert : séquence d'intérêt, en bleu : brins d'ADNc, flèches orange : amorces
10 cas d’une PCR sur cellule unique, d’amplifier deux fois la séquence d’intérêt qui se trouve en très faible quantité dans l’échantillon, puisqu’il ne s’agit que du cytoplasme d’une cellule unique.
Dans chaque tube est ajouté un mélange réactionnel de PCR contenant : 6,3 µL d’eau stérile, 4µL de tampon 5X, 1,2µL de MgCl2, 1µL de dNTP à 5Mm, 1µL de chaque amorce
externe (sens ‘fwd’ et antisens ‘rev’) ainsi que 0,5µL de Taq polymérase. De même pour la seconde PCR en utilisant les amorces internes. A ce mélange sont ajoutés 5µL de produit de RT pour la première PCR ou de produit de première PCR pour la seconde. Les séquences des amorces pour l’amplification de la β-tubuline III sont détaillées avec les températures
d’hybridation à l’ADN (Tm) dans le tableau suivant :
Tableau 1 – Détail des amorces et Tm associés utilisées pour la PCR sur la β-tubuline III c) Migration sur gel
Les produits de PCR sont déposés sur gel d’agarose 1,2% contenant une goutte de bromure d’éthidium BET, un intercalant de l’ADN permettant de marquer les produits de PCR. L’électrophorèse est réalisée dans du tampon TAE (Tris, Acetate, EDTA) 1X à 100 puis 50 mV. Un marqueur du nombre de paires de bases, le 2-log DNA Ladder, est également placé à migrer pour évaluer la taille des produits de PCR. Une photographie est prise sous UV.
Résultats
1. Identification des cellules d’intérêt
Les neurones d’intérêt sont des cellules présentant une activité en réponse à une stimulation par une solution contenant un odorant (MH) et par une solution saline enrichie en KCl à 40mM. Le KCl induit une dépolarisation des cellules excitables (i.e. neurones), ainsi, une cellule répondant à une stimulation par une solution enrichie KCl sera identifiée comme étant un neurone. L’un des protocoles de stimulation établis pour identifier ces neurones est présenté dans la figure suivante :
Nom de l’amorce Séquence (nombre de nucléotides) Tm TmPCR Couple
Fwd1_b_tub3_m CAGTGCGGCAACCAGATAG (19) 58,8°C
56°C 1 – externe Rev1_b_tubIII_rat CTGTTAGTGGGGCAAAGC (18) 56°C 1 – externe Fwd2_b_tubIII_rat CTGGAAGCGATCAGTGTCTAG (21) 59,8°C
59°C 2 – interne Rev2_b_tubIII_rat CGTAGGTGGGTGTAGCCAG (19) 61°C 2 – interne
Figure 11 – Protocole de stimulation sur une durée totale de 10 minutes (600s) ; entre chaque stimulation, un flux continu de SN est diffusé, de même qu’entre chaque protocole.
MH [10-6 M] 1'-1'30"
MH [10-5 M] 4'-4'30"
KCl [40mM] 7'-7'30"
11 L’odorant utilisé est la 6-méthyl-5-heptane-2-one (MH) qui, comme expliqué précédemment, signerait l’œstrus, et dont
on cherche à identifier le récepteur. Il est d’abord dilué à 10-2M dans de l’huile
minérale puis en série à 10-5M et 10-6M dans du SN. Les cellules répondant uniquement au KCl à 40Mm ou répondant au KCl et à un mélange de 12 odorants (MOP à 10-5M, tableau S2 en annexe) sont considérées comme contrôles.
a
b c
12 2,50 3,50 4,50 5,50 6,50 0 60 120 180 240 300 360 420 480 540 600 In ten sité d e rép o n se (n iv ea u x d e g ris ) Temps (s)
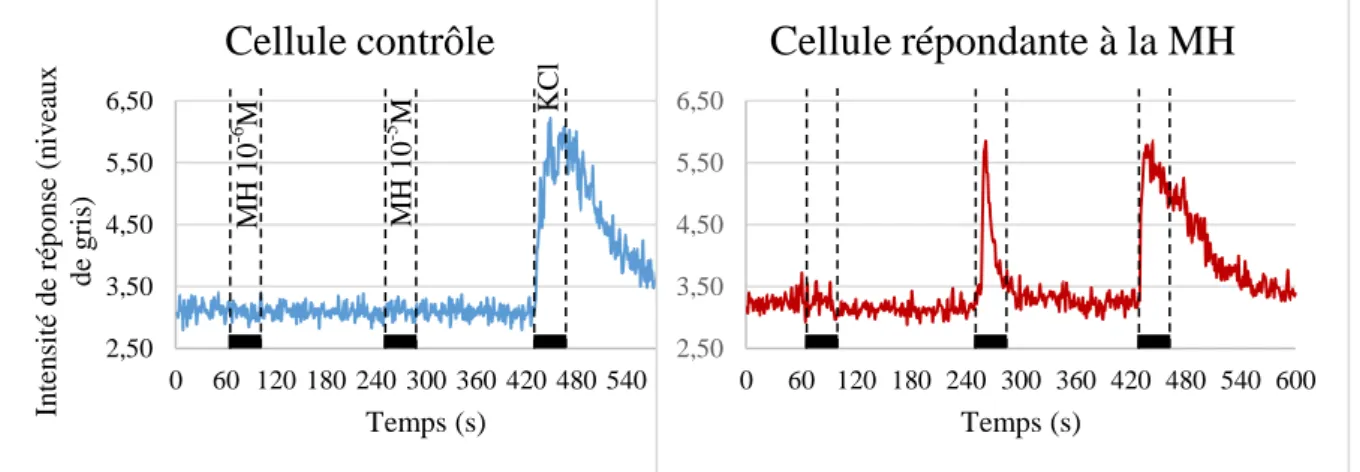
Cellule contrôle
Pour chaque lamelle (2 par rat et par jour de manipulation), le protocole est répété sur plusieurs champs. Chaque champ est analysé directement près l’enregistrement afin de déterminer les cellules dont l’activité est modifiée. Dans un premier temps l’enregistrement est visualisé en accéléré et la variation d’intensité de fluorescence des cellules due au marqueur Fura2-AM en réponse à une accumulation de Ca2+ intracellulaire est recherchée. Chaque cellule que l’on suppose avoir une réponse suffisamment importante aux stimulations est analysée individuellement par traçage d’une région d’intérêt (ROI : Region Of Interest)
(figure 12) et mesure de la variation d’intensité de gris (figure 13). Les cellules d’intérêt réagissent à l’odorant (à 10-5
M ou 10-6M) ainsi qu’au KCl à 40mM et présentent une variation d’intensité similaire à celle présentée dans la figure dessous. De même, la figure 13 ci-dessous montre la variation d’intensité d’une ROI d’une cellule considérée contrôle, ne réagissant donc qu’au KCl.
Une analyse du nombre de cellules par champ a été réalisée. Celle-ci nous a permis de déterminer le nombre moyen de cellules par champ qui répondent à une stimulation par le Figure 13 – Exemple de graphiques obtenus pour une ROI délimitant une cellule contrôle répondant uniquement au KCl à 40mM (contrôle) et une cellule répondante à une stimulation à 10-5 de MH et à 40mM de KCl. Les rectangles noirs indiquent les périodes de stimulation d’après le protocole présenté en figure 11
Figure 12 – Champ cellulaire enregistré a) Exemple d’un champ de lamelle observé au microscope à contraste de phase – barre d’échelle : 200µm, b) Gros plan sur l’encadré de la partie a, c) Traçage d’une ROI sur une cellule. b et c – barre d’échelle : 50µm 2,50 3,50 4,50 5,50 6,50 0 60 120 180 240 300 360 420 480 540 600 Temps (s)
Cellule répondante à la MH
0 250 500 750 1000 1250 1500 1750 1 2 3 4 No m b re d e ce llu les ChampNombre de cellules totales et de cellules
répondantes par champ sur 4 champs
Cellules répondantes au KCl à 40mM Cellules non répondantes
[VAL EUR] 0,0 10,0 20,0 30,0 40,0 50,0 Moyenne P o u rce n tag e
Moyenne du
pourcentage de
cellules répondanes
+ SEM
Figure 14 – Nombre de cellules répondantes au KCl 40mM par rapport au nombre total de cellules dans 4 champs et moyenne du pourcentage de cellules répondantes par rapport au nombre total de cellules + SEM (±5,19%), n=4
MH 1 0 -6 M KC l MH 1 0 -5 M
13 KCl à 40mM. Cette quantification est présentée dans la figure 14 ci-dessous.
En moyenne, un champ enregistré au microscope inversé présente 38,9%±5,19% (SEM, n=4) de cellules répondantes à une stimulation par le KCl à 40mM. Ainsi, environ 40% des cellules observées sur un champ sont des neurones.
2. Prélèvement des cellules
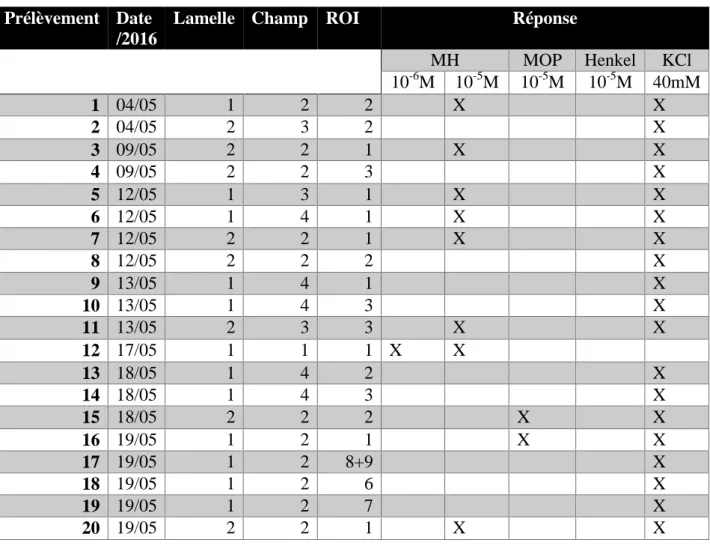
Chaque cellule est prélevée selon le point 3 du Matériel et méthodes. Un récapitulatif des cellules prélevées et de leurs réponses est présenté dans le tableau 2 ci-dessous.
Prélèvement Date /2016
Lamelle Champ ROI Réponse
MH MOP Henkel KCl 10-6M 10-5M 10-5M 10-5M 40mM 1 04/05 1 2 2 X X 2 04/05 2 3 2 X 3 09/05 2 2 1 X X 4 09/05 2 2 3 X 5 12/05 1 3 1 X X 6 12/05 1 4 1 X X 7 12/05 2 2 1 X X 8 12/05 2 2 2 X 9 13/05 1 4 1 X 10 13/05 1 4 3 X 11 13/05 2 3 3 X X 12 17/05 1 1 1 X X 13 18/05 1 4 2 X 14 18/05 1 4 3 X 15 18/05 2 2 2 X X 16 19/05 1 2 1 X X 17 19/05 1 2 8+9 X 18 19/05 1 2 6 X 19 19/05 1 2 7 X 20 19/05 2 2 1 X X
Tableau 2 – Récapitulatif des prélèvements de 20 cellules
3. Résultats de la RT-PCR
Dans un premier temps une PCR est réalisée pour cibler la β-tubuline III de manière à confirmer que les cellules prélevées et dont les ARN ont été convertis en ADNc sont bien des neurones. En effet, cette protéine est spécifique des cellules neuronales et peut être amplifiée par des amorces présentées dans le tableau 1 (matériel et méthodes). L’amplification de cette protéine donne un fragment de 538pb d’après les amorces utilisées. La PCR est tout d’abord
14 réalisée sur quelques cellules
contrôles (répondant au KCl mais pas à la MH) parmi les 20 prélevées afin de vérifier que le bon fonctionnement du
protocole. Le gel
d’électrophorèse obtenu avec les produits de PCR est présenté dans la figure 14. On observe dans cette figure une bande à environ 0,5kb pour le
prélèvement 19, qui correspondrait aux 538pb de la β-tubuline recherchée. Ceci indique donc que la cellule prélevée dans le tube 19 est bien un neurone. Toutefois, parmi les 6 prélèvements utilisés ici, un seul produit un résultat positif (19) alors que les autres produisent des résultats négatifs sous forme de trainées (smears). Ceci indique qu’aucun fragment n’a pu être spécifiquement amplifié en PCR pour ces prélèvements.
Afin de vérifier si l’absence de signal observé précédemment pouvait être due à des conditions de réverse transcription ou de PCR non optimales, une deuxième série de cellules contrôles (10 cellules de 21 à 30) prélevées a été analysée. Ces prélèvements ont été réalisés en faisant attention de bien vortexer et culoter les échantillons avant de pratiquer la RT. L’actine, protéine présente dans toutes les cellules en quantité abondante, est également
recherchée par RT-PCR en plus de la β-tubuline III afin de vérifier la présence de matériel cellulaire dans le prélèvement. Elle a été amplifiée en utilisant un protocole déjà mis au point au laboratoire et les amorces utilisées sont présentées dans le tableau S3 en annexe.
La figure 15a montre les résultats de l’amplification de la β-tubuline et la figure 15b ceux de l’amplification de l’actine.
Figure 15 – Gels d’électrophorèse des produits de PCR des prélèvements 21 à 30, pour une amplification de la β-tubuline (a) et de l'actine (b), le marqueur (M) est le même que dans la figure 14
Figure 14 – Gel de migration des produits de PCR de 6 prélèvements précisés en haut, l'échelle du marqueur M est jointe à gauche
a
15 Le gel d’électrophorèse en figure 15a ne présente pas de bandes d’amplification de la β-tubuline. Cette absence d’amplification peut être due soit à un défaut de PCR, soit à l’absence de matériel cellulaire. Au niveau du gel présenté en figure 15b une amplification de matériel est présente dans 6 prélèvements. En effet, des bandes sont observées dans les puits 22, 27 et 30 malgré une absence de migration. Quant aux bandes à environ 0,6kb présentes dans les puits 21, 23 et 30, elles correspondent au fragment amplifié de l’ADNc d’actine (607pb). Ces résultats montrent qu’il y a présence de matériel cellulaire dans 6 cas sur 10 et que l’étape de RT est efficace dans ces cas-là.
Discussion et perspectives
Lors de ce stage, nous avons cherché à identifier les RO répondant à la méthylheptenone, qui a été montrée comme signant l’œstrus dans différentes espèces (Nielsen et al. 2013). Nous nous sommes basés sur un protocole de 1999 (Touhara et al.) qui a défini les bases de l’utilisation d’approches d’imagerie calcique et de RT-PCR pour l’identification fonctionnelle de récepteurs répondant à des odorants spécifiques.
Identification et prélèvement des cellules :
Pour ce faire, nous avons prélevé des cellules dissociées d’épithélium olfactif de ratons qui présentaient en imagerie calcique une réponse à une stimulation par la MH. Une stimulation par du KCl à 40mM nous permettait ensuite de vérifier la viabilité des cellules et d’identifier les cellules excitables (neurones) qui répondent par une augmentation rapide du calcium intracellulaire. Les cellules répondant uniquement au KCl ont été considérées comme des NO viables mais ne répondant pas à l’odorant d’intérêt, et un certain nombre d’entre elles ont été prélevées comme cellules contrôles. L’utilisation de jeunes rats pour cette expérience s’explique par le fait qu’à cet âge (7 à 15 jours), les épithéliums olfactifs de l’animal sont plus faciles à prélever et à dissocier en comparaison d’un épithélium mature prélevé chez un adulte. A ce stade, il y a plus de plasticité tissulaire et développement et maturation sont encore très présents. De plus la viabilité cellulaire est également plus importante sur des prélèvements issus de ratons, ce qui a pu être vérifié expérimentalement. Cette étape de prélèvement de cellules a représenté la majeure partie du stage puisque le rendement d’obtention de cellules répondantes et d’intérêt est très faible. Ceci s’explique par le fait que sur un champ pouvant compter de 300 à 1500 cellules, donc un nombre très variable selon la qualité de la préparation (dissection et dissociation), la probabilité qu’une cellule soit répondante à notre odorant est faible. En effet, nous avons vu que la proportion de cellules
16 répondantes à une stimulation par le KCl dans un champ environnait les 40%. De plus, chez le rat, 800 à 1000 récepteurs olfactifs différents sont exprimés dans l’EO, ainsi, parmi les 40% de cellules répondantes au KCl 40mM, des neurones, nous avons une faible chance de trouver une cellule d’intérêt répondant à la MH, même si le fait de prélever des zones qui ont été particulièrement répondantes en EOG nous permet d’augmenter ces chances car nous avons pu repérer au final une dizaine de cellules répondantes. De tels résultats avaient été observés par l’équipe de Touhara en 1999. En effet, parmi les 3500 neurones répondant au KCl que cette équipe a pu mettre en évidence, 226 répondaient à au moins un des 11 odorants utilisés, 2 à 45 cellules répondant par odorant. La dissociation du tissu est également un facteur important puisque s’il n’est pas correctement effectué, il peut subsister des blocs de cellules non dissociées qui se trouvent alors moins fixées et perturbent l’enregistrement en étant ballotées par le flux constant de solution. L’ensemble de ces données nous a poussé à réaliser le protocole de nombreuses fois pour obtenir un nombre correct de cellules correctement dissociées à prélever et à analyser en biologie moléculaire, soit trois à quatre champs par lamelle, pour deux lamelles par raton et jour de manipulation, sur 2 semaines.
Les premiers jours ont été utilisés à la mise au point des différentes étapes de cette manipulation. En effet, nous avons testé plusieurs concentrations d’enzyme de dissociation (papaïne) en fonction de l’âge des rats pour s’assurer de l’efficacité de chacune, et il s’est avéré que les épithéliums des ratons les plus âgés se dissociaient mieux avec une concentration de papaïne doublée. De plus, les premières triturations de cellules, avant la filtration et le dépôt sur lamelles, ont été effectués avec des micropipettes et cônes de plastique classiques (à la P1000), ce qui ne nous permettait pas d’observer une bonne dissociation, beaucoup de paquets de cellules subsistant à cette trituration. Nous avons alors opté pour l’utilisation de pipettes de verre rodées pour la réalisation de cette étape, qui nous permettait une meilleure dissociation et donc un plus grand nombre de cellules fixées malgré un nombre plus important de cellules mortes.
Le protocole de prélèvement des cellules reste encore à optimiser. En effet le prélèvement n’est peut-être pas optimal du fait qu’il est réalisé à sec. Un article dans la revue Single-channel recording de 1995 (par Hannah Monyer et Peter Jonas), utilise un dispositif différent de prélèvement. Dans ce dispositif, du liquide de prélèvement est présent dans la pipette, ce qui permet un enregistrement en patch-clamp d’une cellule unique, puis un prélèvement de la cellule. Le contenu de la pipette après prélèvement est expulsé par un système d’air comprimé dans le tube de PCR. Cette technique pourrait être adaptée à notre
17 protocole bien qu’elle soit réalisée sur des tranches d’encéphale, mais ceci nécessiterait une évaluation du ratio difficulté/bénéfice puisque cela rajouterait une complication.
Recherche du récepteur olfactif :
Les cellules prélevées ont été analysées grâce à une reverse transcription suivie d’une PCR de type Nested. Dans un premier temps, la nature neuronale des cellules a été testée grâce à une amplification de la β-tubuline III, une protéine spécifique des neurones. Cela n’a donné que peu de résultats car les produits d’amplification correspondant à la β-tubuline III (bande à environ 0,5kb) n’ont été observés quepour une cellule sur 16 analysées. Néanmoins, puisque la β-tubuline a quand même été détectée une fois, cela signifie que les conditions de PCR utilisées permettent d’amplifier la β-tubuline III lorsque son ADNc est suffisamment représenté dans l’échantillon. Cependant, le très faible rendement de cette PCR pourrait suggérer d’améliorer les amorces utilisées pour cibler plus facilement la β-tubuline III. Le choix d’amorces plus longues par exemple pourrait permettre une meilleure reconnaissance de la β-tubuline lors de la PCR, malgré des risques d’amplification de matériel cellulaire de façon non-spécifique. Le niveau d’expression des gènes étudiées est un autre paramètre qui pourrait avoir son importance au vu de nos résultats, à savoir. En effet, la présence d’actine dans les prélèvements a été évaluée afin de s’assurer de la présence de contenu cellulaire dans ceux-ci puisqu’il s’agit d’une protéine fortement exprimée. Cette analyse nous a permis de montrer que dans 60% des cas, la RT semble être efficace, car une bande d’amplification est observé dans le gel (Figure 15b). Dans ce même graphique, 3 échantillons ne migrent pas. Des données similaires avaient été observées dans l’étude sur la souris et ce point reste à sujet à interrogation. En comparaison de l’actine, la β-tubuline III est une protéine moins exprimée, et on peut donc se demander si son niveau d’expression est suffisant pour permettre une détection efficace dans le cadre d’une PCR sur cellule unique. Un moyen de répondre à cette question serait d’augmenter la quantité de matériel en regroupant plusieurs cellules prélevées. Cette question demande d’être résolue car les niveaux d’expression des RO sont du même ordre de grandeur que celui de la β-tubuline, voir plus faibles. La phase de mise en évidence du RO sensible à la méthylheptenone ne sera donc envisageable que lorsqu’il sera possible de détecter efficacement la β-tubuline.
L’étape de DNase-RT, qui semble ne pas être majoritairement en cause dans l’absence d’amplification de la β-tubuline, pourrait cependant être également optimisée. En effet, l’élimination de l’ADN génomique à l’aide de la DNase préalablement à la RT pourrait jouer un rôle dans les résultats que nous obtenons. Le premier protocole de RT pratiqué incluait un ajout d’EDTA entre l’étape de DNase et la RT. L’EDTA (Éthylène Diamine Tétra-Acétique)
18 est généralement utilisé comme inhibiteur de nucléases comme la DNase, du fait qu’il séquestre les ions Mg2+ qui sont nécessaires à l’activité de nombreuses de ces enzymes. Cependant il se peut que des traces d’EDTA puisse également altérer, par le même mécanisme, les enzymes de RT comme la SuperScript III. L’EDTA a donc été retiré du protocole et la DNase est simplement inactivée par la chaleur. Mais, de ce fait, des traces de DNase pourraient subsister et altérer les ADNc produits lors de la RT dans certains échantillons. La réalisation de RT-PCR en absence d’étape de DNase devrait permettre de répondre à cette question.
Poursuite de l’étude :
L’étape suivante de cette étude, après les différentes mises au point suggérées précédemment, sera de rechercher un RO sensible à la méthylheptenone au moyen des approches de biologie moléculaire présentées ci-dessus en utilisant des amorces dégénérées. Ces amorces dégénérées permettent de cibler une large proportion des RO exprimés chez le rat et consistent en des séquences conservées parmi ces récepteurs séquencés dont quelques bases ont été modifiées. Les neurones olfactifs n’exprimant qu’un seul type de RO, l’utilisation des amorces dégénérées devrait permettre d’amplifier l’unique récepteur olfactif exprimé dans ces cellules, dans notre cas les NO et les RO répondant à la MH.
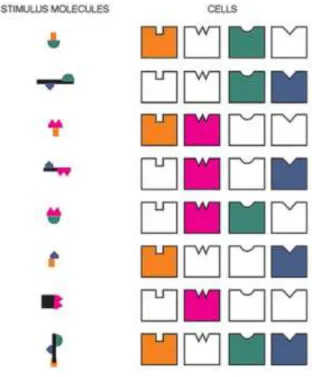
Le système olfactif est conçu de telle sorte que les récepteurs ne sont capables de reconnaître que quelques groupements des molécules odorantes et rarement leur totalité, c’est le code combinatoire, présenté en figure 16 ci-contre, tirée de Ache et Young (Neuron, 2005). Ainsi, une molécule odorante peut être détectée, dans différentes mesures, par chaque récepteur sensible aux différents groupements qui la composent. Dans le cas de notre étude, en cherchant à isoler le récepteur à la méthylheptenone, il serait en réalité possible d’isoler plusieurs récepteurs, sensibles aux différents groupements de la molécule. Les neurones exprimant ces récepteurs
Figure 16 – Schéma du code combinatoire du système olfactif. A gauche, les différents odorants et leurs différents groupements fonctionnels en couleur, et à droite les récepteurs spécifiques à ces groupements
19 présenteraient donc des réponses variables en fonction du groupement qui se fixe au récepteur.
Dans l’optique de la conception de biosenseurs associant récepteurs olfactifs et capteurs en diamant (CEA List), le récepteur à la MH permettrait la détection des femelles en œstrus dans les élevages. Toutefois, pour s’assurer de la spécificité de cette détection, d’autres odorants spécifiques de cet état physiologique devraient être recherchés, et leurs récepteurs potentiels identifiés. Ainsi, les senseurs envisagés pourraient être porteurs des récepteurs sensibles aux différents odorants signant l’œstrus mais également des récepteurs sensibles à des odorants neutres et ne présentant aucune surproduction pendant la période d’œstrus.
Bibliographie
Adrien Molinas, Gilles Sicard, Ingrid Jakob (2012) Functional Evidence of Multidrug Resistance Transporters (MDR) in Rodent Olfactory Epithelium
Barry W. Ache, Janet M. Young (2005) Olfaction: Diverse Species, Conserved Principles
Birte L. Nielsen, Nathalie Jerôme, Audrey Saint-Albin, Olivier Rampin, Yves Maurin (2013) Behavioural response of sexually naïve and experienced male rats to the smell
of 6-methyl-5-hepten-2-one and female rat faeces
Birte L. Nielsen, Nathalie Jerôme, Audrey Saint-Albin, Christian Ouali, Sophie Rochut, Emilie-Laure Zins, Christine Briant, Elodie Guettier, Fabrice Reigner, Isabelle Couty, Michèle Magistrini, Olivier Rampin (2016) Oestrus odours from rats
and mares : Behavioural responses of sexually naive and experienced rats to natural odours and odorants
Hannah Monyer, Peter Jonas (1995) Polymerase Chain Reaction analysis of ion
channel expression in single neurons of brain slice
Kazushige Touhara, Shintaro Sengoku, Koichiro Inaki, Akio Tsuboi, Junzo Hirono, Takaaki Sato, Hitoshi Sakano, And Tatsuya Haga (1999) Functional identification and
Annexe
Produit MW Concentration Poids Poids Poids
(g/mol) (mmol/l) (g / 1 l) (g / 2 l) (g / 5 l) NaCl 58,44 140 8,180 16,360 40,900 KCl 74,55 5 0,373 0,746 1,865 MgCl2 203,31 2 0,407 0,814 2,035 CaCl2 147,02 2 0,294 0,588 1,470 Hepes 238,3 10 2,383 4,766 11,915 Sucrose 342,3 6 2,054 4,108 10,269 Glucose 180,16 10 1,802 3,604 9,010
Tableau S3 - Composition de la solution de Salin Normal (SN)
Protocole de préparation des lamelles coatées à la poly-L-lysine :
Des lamelles rondes de diamètre 15mm stérilisées à l’autoclave sont rincées à l’alcool à 70% puis séchées. 150 µL de solution de coating (0,01% de Poly-L-lysine dans de l’eau stérilisée et filtrés à 0,22µm) sont déposés sur chaque lamelle et laissés à polymériser 1h à température ambiante. Les lamelles sont ensuite rincées 3 fois à l’eau stérilisée puis laissées à sécher et enfin disposées dans des plaques B12 (1 par puit) conservé au réfrigérateur.
Note : On observe une meilleure fixation des cellules sur lamelles fraiches
Odorants Densité Pureté Poids
moléculaire Solvant Concentration d'odorant Volume (µl) / 1ml final
(g/ml) (%) (g/mol) Stock (mol/l) pour 10
-1 M Anisole 0,992 99 108,14 9,08 11,01 Citral 0,888 96 152,24 5,60 17,86 Heptanal 0,818 95 114,19 DMSO 6,81 14,69 Isoamyl acetate 0,873 70 130,19 DMSO 4,69 21,30 Lyral 0,989 99 210,32 EtOH 4,66 21,48 Lilial 0,944 204,34 EtOH 0,00 34,50 Octanol 0,827 98 130,23 6,22 16,07 1-4-cinéole 0,89 75 154,25 4,33 23,11 Isomenthone 0,9 99 154,25 5,78 17,31 Limonène 0,843 99 136,24 6,13 16,32 L-carvone 0,959 97 150,22 MetOH 6,19 16,15 Pyridine 0,818 95 114,19 H2O 6,81 14,69
Ajouter le volume de DMSO (µl) pour compléter à 1 ml : 775,49
Nom de l’amorce Séquence (nombre de nucléotides) TmPCR Couple
Act305 TTGTCACCAACTGGGACGATATGG (24)
57°C 1 – externe Act1068 GATCTTGATCTTCATGGTGCTAGG (24) 1 – externe Act331 AAGATTTGGCACCACACTTTCTAC (24)
57°C 2 – interne Act938 CACTTCATGATGGAATTGAATGTA (24) 2 – interne
Identification of an œstrus-specific sensitive olfactory receptor in the rat
Louis Richevaux
Smell is one of the most important senses within the animal kingdom; it elicits lots of behaviours and governs most of the social interactions between individuals, including reproduction. In mammals, reproduction strongly depends on the female reproductive/hormonal cycle. During this cycle, oestrus is a period during which the female is particularly receptive to male sexual behaviours and willing to mate. Within this period, the production of specific odorants by the female is increased, including the 6-methyl-5-hepten-2-one (methylhepten6-methyl-5-hepten-2-one) identified in rats (Nielsen et al. 2013). This odorant has been shown to elicit behavioural responses on sexually experienced or naive rat males (Nielsen et al. 2013 and 2016), strongly suggesting the existence of an olfactory receptor specific for this innately responsive odor. The purpose of this study was : firstly to identify methylheptenone-responding olfactory neurons in the olfactory epithelium of young rats using calcium imaging technique; secondly to extract the olfactory receptor(s) expressed in these responding-neurons by a monocellular reverse transcription-coupled nested PCR. The first aim of my work was thus to optimize the different protocols on control neurons, from the dissection of animals’ olfactory mucosa and cellular dissociation to calcium imaging, cell harvesting and the different single-cell RT-PCR steps. The next step was to apply this multistep optimized-approach to isolated methylheptenone-responding neurons. The ultimate goal of this study is to design biosensors to detect the periods of fertility of females in livestock.