Effet d’une surexpression d’érythropoïétine cérébrale sur la régulation et la mise en place post-natales du système nerveux de contrôle respiratoire chez la souris
Thèse
Céline Michelle Caravagna
Doctorat en neurobiologie Philosophiæ doctor (Ph. D.)
Québec, Canada
III Résumé
L’érythropoïétine (Epo) est une cytokine exprimée dans le système nerveux central (CNS). A l’âge adulte, elle agit comme modulateur respiratoire dans le tronc cérébral en augmentant la réponse ventilatoire à l’hypoxie (RVH) chez l’homme et la souris. Les troubles respiratoires chez les nouveau-nés étant répandus, trouver un traitement adapté est d’un intérêt primordial. J’ai émis l’hypothèse qu’une stimulation chronique à l’Epo du CNS des nouveau-nés aiderait le développement de la commande centrale respiratoire et sa réponse à l’hypoxie. Afin de tester cette hypothèse, j’ai enregistré la respiration de souris transgéniques surexprimant l’Epo spécifiquement dans le CNS (Tg21). La RVH, qui se met normalement en place au cours du développement post-natal, apparaît légèrement plus tôt chez les souris Tg21, mais n’est pas accentuée avant le sevrage, comme elle l’est à l’âge adulte. Nous avons quantifié l’expression d’Epo et de son récepteur (EpoR) dans le tronc cérébral des souris Tg21. L’expression d’EpoR diminue au cours du développement post-natal, mais la surexpression d’Epo augmente. Ceci pourrait expliquer cette apparition tardive de l’augmentation de la RVH. J’ai par la suite étudié les mécanismes impliqués. J’ai montré par enregistrements électrophysiologiques que la dépression du rythme due à l’hypoxie n’est pas présente dans les troncs cérébraux provenant de souris Tg21. In vitro, le tronc cérébral Tg21 est capable de maintenir le rythme respiratoire en hypoxie. De plus, le patron de décharge des troncs cérébraux Tg21 le jour de la naissance ressemble à celui à trois jours de vie, ce qui laisse penser à une maturation accélérée de la commande centrale respiratoire. Cette dernière observation reste cependant à confirmer. Dans ses autres rôles (e.g. érythropoïétique et neuroprotecteur), l’Epo met en jeu différentes voies de signalisation, dont les voies de signalisation MEK-ERK et PI3K-Akt. J’ai émis l’hypothèse que ces voies de signalisation étaient également mises en jeu dans l’effet que l’Epo a sur la commande centrale respiratoire, et grâce à l’utilisation d’inihibiteurs, mis en évidence que l’une ou l’autre de ces voies de signalisation n’est pas suffisante pour expliquer l’effet bénéfique de l’Epo sur le rythme respiratoire, ce qui laisse penser à un mécanisme compensatoire.
V Abstract
Erythropoietin (Epo) is a cytokin expressed in the central nervous system (CNS). At adulthood, Epo acts as a respiratory modulator which enhances hypoxia ventilatory response (HVR) in both human and mouse. Respiratory disorders in newborns are common, as such finding an adapted treatment is of first interest. I hypothesized that chronic Epo stimulation on the CNS of newborns is helpfull to the central respiratory command to develop and respond to hypoxia. To test this hypothesis, I recorded breathing of transgenic mice overexpressing Epo in the CNS only (Tg21). HVR, which normally sets up during post-natal development, appears earlier in Tg21 mice, but is not higher as observed at adulthood in Tg21 mice. We quantified Epo and EpoR expression in Tg21 brainstems. EpoR expression decreases during post-natal development, while Epo overexpression is enhanced. These results could explain the late apparition of HVR enhancement. Then, I studied the underlying mecanisms. By electrophysiological recordings, I showed that usual rhythm depression due to hypoxia is not present in Tg21 brainstems-spinal cord preparations. In vitro, Tg21 brainstem is able to maintain the respiratory rhythm during hypoxia. Moreover, burst pattern from Tg21 mice on the first day of post-natal life looks like the burst pattern at three living days, which suggests an earlier maturation of the central respiratory system. However, this observation needs to be confirmed. In other roles (e.g. erythropoietic and neuroprotector) Epo recruits different pathways, mostly MEK-ERK and PI3K-Akt pathways. I hypothesized that these pathways are also involved in Epo effect on the central respiratory command. Thank to specific inhibitors, I highlighted that one of these pathways is not sufficient to support Epo role on newborn breathing, suggestiong a compensatory mechanism.
VII Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... XIII Liste des figures ... XV Liste des abréviations et des sigles ... XIX Remerciements ... XXIII Avant propos ... XXVII
Introduction ... 1
Introduction générale ... 3
1. Le contrôle nerveux de la respiration ... 7
1.1. La commande centrale respiratoire ... 8
1.2. Description anatomique et fonctionnelle des groupes respiratoires neuronaux ... 8
1.2.1. La colonne respiratoire ventrale ... 8
1.2.1.1. Le complexe pré-Bötzinger ... 8
1.2.1.2. Le complexe Bötzinger... 11
1.2.1.3. Les groupes respiratoires ventraux ... 11
1.2.1.4. Le noyau rétrotrapézoïde associé au groupe respiratoire parafacial ... 12
1.2.2. Le noyau du tractus solitaire ... 13
1.2.3. Les noyaux du raphé ... 13
1.2.4. Les noyaux parabrachial et Kölliker-Fuse ... 14
1.3. Les mécanismes cellulaires de la commande centrale respiratoire et hypothèses expliquant la genèse du rythme respiratoire ... 15
1.3.1. Les neurones rythmiques ... 16
1.3.2. Hypothèses expliquant la genèse du rythme respiratoire ... 17
1.3.2.1. Le réseau inhibiteur ... 17
1.3.2.2. Les neurones autorythmiques ... 18
1.3.2.3. Un modèle hybride ? ... 19
1.4. La maturation du réseau respiratoire chez le nouveau-né ... 22
1.4.1. La maturation moléculaire du réseau respiratoire neuronal durant le développement ... 22
1.4.2. La maturation cellulaire du réseau neuronal respiratoire durant le développement ... 23
1.4.3. La maturation physiologique du réseau neuronal respiratoire durant le développement ... 23
VIII
1.5.1. Les organes chémosenseurs centraux et périphériques ... 26
1.5.1.1. Les cellules pulmonaires neuroendocrines ... 26
1.5.1.2. Les corps aortiques ... 27
1.5.1.3. Les corps carotidiens ... 27
1.5.1.4. Les groupes chémosenseurs du tronc cérébral ... 29
1.5.2. La chémosensibilité à l’O2 du tronc cérébral ... 29
1.5.2.1. Les neurotransmetteurs mis en jeu dans la réponse à l’hypoxie du tronc cérébral ... 29
1.5.2.1.1. Les catécholamines ... 29
1.5.2.1.2. Les neurotransmetteurs inhibiteurs : le GABA et la glycine ... 30
1.5.2.1.3. La sérotonine ... 31
1.5.2.1.4. L’adénosine ... 31
1.5.2.2. La réponse à l’hypoxie du tronc cérébral isolé ... 32
1.5.2.2.1. La mise en évidence de la réponse à l’hypoxie du tronc cérébral ... 32
1.5.2.2.2. Les caractéristiques de la réponse à l’hypoxie du tronc cérébral ... 33
1.5.3. Les caractéristiques de la réponse ventilatoire à l’hypoxie ... 35
2. L’érythropoïétine ... 38
2.1. La protéine ... 38
2.2. Les dérivés de l’Epo ... 39
2.3. Le récepteur à l’Epo ... 40
2.3.1. Le récepteur à l’Epo et sa forme soluble ... 40
2.3.2. Le récepteur commun β ... 41
2.4. L’érythropoïétine dans le système nerveux central chez la souris ... 43
2.4.1 La localisation de l’Epo dans le système nerveux central ... 43
2.4.2. Les rôles de l’Epo dans le système nerveux central ... 44
2.4.3. Les mécanismes d’action ... 47
3. L’érythropoïétine et la commande centrale de la respiration ... 50
3.1. L’effet de l’Epo sur la respiration à l’âge adulte ... 50
3.2. L’effet de l’Epo sur la commande centrale respiratoire du nouveau-né ... 52
Problématique ... 54
Hypothèse de travail ... 54
Objectifs spécifiques ... 54
Chapitre 1 - Précisions méthodologiques ... 57
La lignée de souris Tg21 ... 58
Electrophysiologie sur préparations de tronc cérébral et moelle épinière isolés ... 60
IX Chapitre 2 ... 65 Précisions introductives ... 67 Résumé en français ... 69 Abstract ... 72 1. Introduction ... 73
2. Materiel and methods ... 74
2.1. Animals ... 74
2.2. Electrophysiological recordings ... 75
2.3. Statistical analysis... 75
3. Results ... 76
3.1. The pons displays inhibitory activity in Tg21 brainstem-spinal cord preparations ... 76
3.2. Compared with the controls, the Tg21 brainstem-spinal cord preparations at P0 displayed lower basal frequency ... 78
3.3. Compared with the controls, the Tg21 brainstem-spinal cord preparations at P3 displayed a shorter basal burst duration ... 78
3.4. Compared with the controls, the Tg21 brainstem-spinal cord preparations at P0 were less strongly affected by hypoxia ... 78
3.5. The hypoxic response at P3 is higher in the Tg21 brainstem-spinal cord preparations than in the control preparations ... 81
4. Discussion ... 81
4.1. Corresponding wild type mice are the appropriate control for Tg21 Epo-overexpressing mice ... 83
4.2. The pons remains inhibitory despite chronic Epo stimulation ... 83
4.3. Does the effect of Epo overexpression on central respiratory command begin at a post-natal age? ... 84
4.4. Acute versus chronic Epo stimulation of the hypoxic fictive response ... 84
4.5. Chronic Epo stimulation affects central respiratory command differentially according to age ... 85
4.6. Does Epo accelerate the maturation of the central network that controls respiration? ... 86
5. Conclusions ... 86
Aknowledgements ... 87
Chapitre 3 ... 89
X
Résumé en français ... 93
Abstract ... 96
1. Introduction ... 97
2. Material and methods ... 98
2.1. Animals ... 98 2.2. Plethysmography recordings ... 98 2.3. Radioimmunoassay ... 99 2.4. mRNA quantification ... 99 2.5. Statistical analysis ... 100 3. Results ... 101 3.1. Plethysmography results ... 101
3.1.1. Minute ventilation and HVR are similar in control and Tg21 mice at P7 ... 101
3.1.2. HVR and post-hypoxic recovery are lower in P15 Tg21 mice compared to control ... 101
3.1.3. HVR is higher in P21 Tg21 mice during exposure to 6% O2 ... 104
3.1.4. The alteration of respiratory parameters was not due to changes of metabolism ... 106
3.2. Relative Epo overexpression is enhanced in Tg21 brainstems after P7 ... 107
3.3. EpoR mRNA expression is decreased in Tg21 brainstems until P21... 107
4. Discussion ... 109
4.1. Tg21 mice allow analysis of Epo effects on post-natal development of HVR ... 109
4.2. HVR is present in both control and Tg21 mice as early as P7 ... 109
4.3. HVR differences due to genotype appears at P15 ... 110
4.4. The HVR pattern observed at P21 approximates the adult pattern ... 111
4.5. Are the carotid bodies implicated in the effect of Epo on the ventilatory response to hypoxia? ... 111 5. Conclusion ... 112 Acknowledgements ... 112 Chapitre 4 ... 113 Précisions introductives ... 115 Résumé en français ... 117 Abstract ... 120 1. Introduction ... 121
XI
2.1. Animals ... 122
2.2. Electrophysiological recordings ... 122
2.3. Statistical analysis... 122
3. Results ... 123
3.1. U0126 and LY294002 in “en bloc” preparations is effective at 1 µM ... 123
3.2. Normoxic burst frequency is not modified in control but is enhanced in Tg21 brainstem-spinal cord preparations by U0126 and LY294002 ... 125
3.3. U0126 or LY294002 abolish hypoxic-induced frequency depression in control preparations ... 125
4. Discussion ... 126
4.1. Tg21 preparations display lower frequency than C57BL/6 preparations ... 127
4.2. MEK1/2and PI3K are implicated in basal activity of Tg21medulla oblongata and in the response to hypoxia of controlmedulla oblongata ... 127
4.3. Potential compensation of PI3K–Akt and MEK–ERK pathways... 128
4.4. Potential drugs effect on the phrenic motor neurons ... 129
5. Conclusion ... 129
Aknowledgements ... 129
Chapitre 5 - Discussion ... 131
1. Introduction ... 133
2. L’Epo stimule la réponse à l’hypoxie du tronc cérébral isolé in vitro... 135
2.1. Les principaux résultats ... 135
2.2. Les limites du modèle expérimental d’enregistrements électrophysiologiques sur préparations de tronc cérébral-moelle épinière isolés. ... 136
2.3. L’effet chronique de l’Epo sur les préparations de tronc cérébral-moelle épinière isolés est plus important que l’effet d’une application d’Epo aiguë ... 137
2.4. La surexpression d’Epo dans le tronc cérébral des souris Tg21 semble accélérer la maturation du réseau neuronal respiratoire à P0 ... 138
2.5. Différents types de cellules peuvent être mis en jeu dans la réponse à l’hypoxie des préparations de tronc cérébral-moelle épinière isolés ... 140
2.6. Les mécanismes moléculaires de la réponse à l’hypoxie du tronc cérébral isolé mettent en jeu l’Epo parmi d’autres molécules ... 141
2.6.1. Les mécanismes moléculaires de la réponse à l’hypoxie du tronc cérébral isolé restent mal connus ... 141
XII
2.6.3. Les voies de signalisation mises en jeu par l’Epo dans la commande centrale
respiratoire en normoxie et hypoxie ... 143
2.7. L’expression d’EpoR serait modulée par l’Epo ... 144
3. La surexpression chronique d’Epo stimule la RVH in vivo uniquement aux âges post-nataux tardifs ... 147
3.1. Les principaux résultats ... 147
3.2. Les avantages et limites de la technique de pléthymographie ... 147
3.3. La surexpression d’Epo et son effet dans le tronc cérébral des souris Tg21 varie en fonction de l’âge ... 148
3.3.1. L’apparition tardive de la RVH accentuée chez les souris Tg21 post-natales 148 3.3.2. Le niveau de surexpression d’Epo dans le tronc cérébral des souris post-natal est différent de celui mesuré à l’âge adulte... 149
3.4. L’effet stimulateur de l’Epo n’est visible que lors d’une hypoxie sévère ... 150
3.5. La période critique pourrait en partie expliquer l’effet délétère de l’Epo en hypoxie sévère à P15 ... 151
3.6. Epo est-elle surexprimée dans les corps carotidiens ? ... 152
4. L’Epo comme molécule thérapeutique ? ... 154
5. Conclusion de la discussion ... 155
Chapitre 6 - Conclusion ... 157
1. Vérification des hypothèses de travail et atteinte des objectifs ... 159
2. Apport de l’étude à l’état des connaissances ... 159
2.1. Dans le domaine de la respiration ... 159
2.2. Dans le domaine des neurosciences ... 160
2.3. Dans le domaine du développement ... 161
3. Conclusions générales ... 161
Références ... 163
Annexes ... 201
Erythropoietin and the Sex-Dimorphic Chemoreflex Pathway ... 203
Gestational stress promotes pathological apneas and sex-specific disruption of respiratory control development in newborn rat. ... 211
XIII Liste des tableaux
Tableau 1 Solutions nécessaires à la réaction de PCR pour chaque échantillon d’ADN à analyser. ... 58 Tableau 2 Comparison of body weights and selected physiological variables between pups born dams subjected to gestational stress versus pups born from undisturbed mothers (control) ... 218 Tableau 3 Syndromes associated with a respiratory control disturbance in which glia and/or brain-derived neurotrophic factor (BDNF) are involved. ... 241
XV Liste des figures
Figure 1 Le système respiratoire ... 4
Figure 2 Les structures nerveuses impliquées dans le contrôle respiratoire ... 7
Figure 3 Noyaux et groupes neuronaux du tronc cérébral impliqués dans la genèse et le contrôle du rythme respiratoire ... 10
Figure 4 Les différents types de neurones respiratoires rythmiques ... 17
Figure 5 Le réseau inhibiteur proposé comme générateur du rythme respiratoire ... 18
Figure 6 Vue d’ensemble du générateur central de patron respiratoire ... 21
Figure 7 Paramètres respiratoires chez la souris en cours de développement ... 24
Figure 8 Localisation des chémosenseurs à l’O2 ... 26
Figure 9. Cascade de transduction du signal par les cellules de type I des corps carotidiens durant l’hypoxie ... 28
Figure 10 Effet de l’hypoxie centrale sur la fréquence de décharge d’une préparation de bulbe rachidien-moelle épinière isolés ... 33
Figure 11 La réponse ventilatoire à l’hypoxie chez la souris ... 37
Figure 12 Structure primaire de l’Epo humaine ... 39
Figure 13 Les récepteurs à l’Epo ... 43
Figure 14 Les voies de signalisation intracellulaires induites par l’activation du récepteur à l’Epo (EpoR) ... 49
Figure 15. La réponse ventilatoire à l’hypoxie aigüe chez les souris contrôles et Tg21 adultes. ... 51
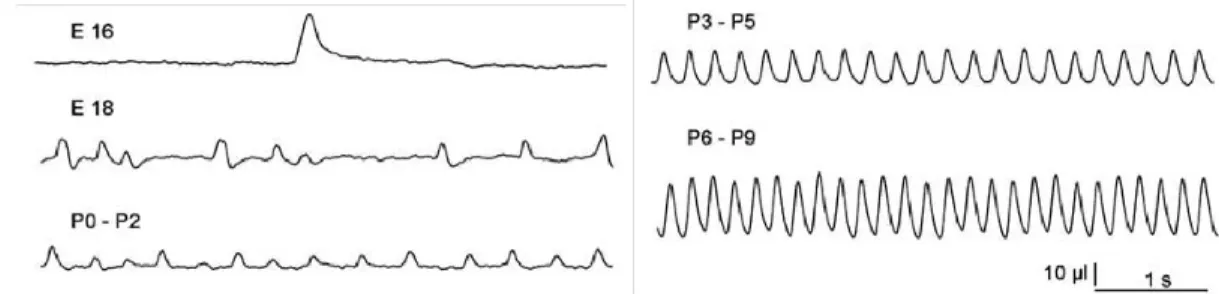
Figure 16. Enregistrements originaux obtenus à partir de préparations de tronc cérébral-moelle épinière isolés ... 53
Figure 17 Gel obtenu après la migration des produits de PCR pour génotypage des souris Tg21 ... 59
Figure 18 Dispositif expérimental d'enregistrements électrophysiologiques sur tronc cérébral-moelle épininère isolés. ... 61
XVI
Figure 19 Exemple de tracé enregistré par électrophysiologie sur tronc cérébral-moelle
épinière isolés ... 61
Figure 20 Système utilisé pour les enregistrements de pléthysmographie corps entier sur animal non restreint. ... 63
Figure 21 Exemple de tracé enregistré par pléthysmograhie en corps entier ... 63
Figure 22 The pons displays inhibitory activity in Tg21 brainstem-spinal cord preparations ... 77
Figure 23 The baseline parameters of P0 Tg21 preparations are similar to those of P3 preparations. ... 79
Figure 24 P0 Tg21 brainstem-spinal cord preparations do not display hypoxia-induced frequency depression. ... 80
Figure 25 P3 Tg21 brainstem-spinal cord preparations display hypoxia-induced amplitude enhancement but no hypoxia-induced frequency depression. ... 82
Figure 26 Respiratory parameters of P7 Tg21 and control mice ... 102
Figure 27 Respiratory parameters of P15 Tg21 and control mice ... 103
Figure 28 Respiratory parameters of P21 Tg21 and control mice ... 105
Figure 29 Metabolism parameters of P7 and P21 Tg21 and control mice ... 106
Figure 30 Epo protein and EpoR mRNA quantification in Tg21 and control brainstems .. 108
Figure 31 1µM is the right dose to apply of U0126 and LY294002 on brainstem-spinal cord preparations ... 124
Figure 32 Antagonization of PI3K-Ak and MEK–ERK pathways in preparations of Tg21 and control animals stimulates bursts frequency. ... 126
Figure 33 Epo and EpoR in carotid bodies. ... 206
Figure 34 Modulation of hypoxic ventilatory response (HVR) by systemic Epo ... 207
Figure 35 Sex-dependent effect of Epo in carotid bodies of mice and humans ... 209
Figure 36 Box plot of the plasma corticosterone levels measured in gestating dams maintained under standard animal care conditions and females subjected to gestational stress ... 217
XVII Figure 37 A) Effects of gestational stress on apnea frequency during neonatal
development B) Relationships between maternal corticosterone measured on the 12th day of gestation (G12) and mean apnea frequency measured at postnatal day 4 (P4) for each litter ... 219 Figure 38 Neonatal development of the ventilatory response to hypoxia in pups born to control dams versus pups born to dams subjected to gestational stress. ... 220 Figure 39 Effects of gestational stress on medullary levels of serotonin (5-HT) and
noradrenaline (NA) in developing newborn rat pups ... 221 Figure 40 Effects of gestational stress on age-dependent changes in basal phrenic burst frequency produced by in vitro medullary preparations. ... 222 Figure 41 Effects of gestational stress on circulating levels of corticosterone and
testosterone in 4 days old male and female pups. ... 224 Figure 42 A) Comparison of the minute ventilation response to moderate hypercapnia (FICO2 = 0.05; 20 min) between pups born to control dams versus pups born to dams
subjected to gestational stress. B) Breathing frequency and C) tidal volume components of the response. ... 225 Figure 43 Gestational stress augments the physiological consequences of an apneic event in 4 days old pups. ... 226 Figure 44 Effects of serotonin (5-HT; 5 µM) bath application on inspiratory (phrenic) motor output produced by medullary preparation during the neonatal period ... 227 Figure 45 A) Effects of acute administration of the selective 5-HT1A agonist 8-OH-DPAT (0.05 mg/kg; i.p.) on apnea frequency in developing newborn pups ... 228 Figure 46 Schematic representation of brainstem respiratory centers in which glia and/or brain-derived neurotrophic factor (BDNF) are involved in breathing control. ... 232 Figure 47 Link between neurons and astrocytes in respiratory control and rhythmogenesis ... 234 Figure 48 Proposed model for astrocytic BDNF action on breathing control ... 238
XIX Liste des abréviations et des sigles
ACh acétylcholine transférase
ADNc acide désoxyribonucléique complémentaire Akt anti-apoptotic kinase
ARNm acide ribonucléique messager ATP adénosine triphosphate
BC complexe de Bötzinger (Bötzinger complex)
BDNF facteur neurotrophique dérivé du cerveau (brain-derived neurotrophic factor) CNS sytème nerveux central (central nervous system)
CO2 dioxyde de carbone
CRV colonne respiratoire ventrale
e-pF parafacial embroynnaire (embryonic parafacial) Epo érythropoïétine
EpoR récepteur à l’érythropoïétine
ERK protéine kinase régulée par un signal extracellulaire (extracellular
signal-regulated protein kinase)
EX jour gestationnel X (embryonic day X)
GABA acide γ-aminobutyrique (γ-aminobutyric acid) GABAA récepteur canaux au GABA
GM-CSF facteur stimulant les colonnies de granulocytes et macrophages (granulocyte-macrophage colony-stimulating factor)
HIF facteur inductible par l’hypoxie (hypoxia inducible factor) icv injection cérébro-ventriculaire
IL-3 interleukin-3
KO knock out
(a)LCR liquide céphalorachidien (artificiel)
XX
MeCP2 protéine 2 liant methyl-CpG (Methyl-CpG binding protein 2) NK1 neurokinine 1 NK1R récepteur à la neurokinie NKF noyau Kölliker-Fuse NMDA N-méthyl-D-aspartate NO monoxyde d’azote NPB noyau parabrachial NTS noyau du tractus solitaire
O2 dioxygène
P75NTR récepteur p75 à la neurotrophine (p75 neurotrophin receptor) PBC complexe de préBötzinger (preBötzinger complex)
PCR réaction en chaine par la polymérase (polymerase chain reaction)
PDGF facteur de croissance dérivé des plaquettes (platelet-derived growth factor) pFRG groupe respiratoire parafacial (parafacial respiratory group)
PI3K phosphoinositide 3-kinase PLCg phospholipase Cg
PX jour post-natal X (post-natal day X) RCβ récepteur commun β
RTN noyau retrotrapézoïde (retrotrapezoid nucleus) sEpoR récepteur soluble à l’érythropoïétine
SST somatostatine TrkB récepteur au BDNF
XXI
XXIII Remerciements
(C’est l’histoire d’une fée qui s’appelle érythropoïétine …)
Je remercie mon directeur Jorge Soliz, qui m’a permis de faire mon doctorat dans son laboratoire et a financé ma participation à de nombreux congrès. J’ai ainsi pu apprendre à développer mon autonomie, mon sens des responsabilités, ainsi que mon amour du travail bien fait. Ces trois années ont été une expérience très enrichissante.
Je remercie le Dr Tommy Seaborn, qui m’a encouragée et soutenue tout au long de mon doctorat, tant d’un point de vue professionnel que personnel. Tommy m’a servi de modèle de rigueur, de persévérance et d’humilité. Il a toujours répondu présent, et m’a aidée à de nombreuses reprises à gérer les paramètres impromptus.
Je remercie le Dr Richard Kinkead pour m’avoir offert à plusieurs reprises l’opportunité de collaborer avec lui, et pour avoir si volontiers relu tout ce que je pouvais écrire de travers. Merci également de m’avoir permis de travailler sur les postes d’en bloc et le cryostat, entre autres.
Je remercie le Dr Vincent Joseph pour l’aide prodiguée durant mon doctorat, aussi bien matérielle qu’intellectuelle. Merci également à la Dre Aida Bairam pour les relectures et les intéressantes discussions scientifiques sur le développement des nouveau-nés.
Je remercie les membres de mon jury d’avoir accepté d’en faire partie, et de s’être déplacés parfois de loin pour venir m’entendre dire ce qu’ils savaient déjà.
D’un point de vue plus personnel maintenant, je remercie Nicolas, pour son soutien sans faille dans cette situation pas toujours évidente. Je lui dois le courage d’être partie, et par la même occasion mon titre de Docteure. Merci de m’avoir poussée à m’affirmer et à aller de l’avant. Merci d’avoir supporté cette épreuve pour moi. Je t’aime. Pommade fleurs flatteries etc.
Je remercie Rebec, ma coloc parfaite durant la quasi-totalité de ces trois années. Ca a été un véritable bonheur d’avoir quelqu’un comme elle au quotidien, avec une écoute, une compréhension et un sens de l’humour incroyables. Que de bons souvenirs de cette co-habitation ! Sauf en ce qui concerne Henri …
XXIV
Je remercie François, farouche gardien du tiroir de bonbons, pour avoir été un si bon voisin de bureau, avoir surveillé mon expansion et avoir flatté mon ordi aussi souvent que nécessaire.
Je remercie Orlane pour sa bonne humeur, ses éternuements et ses « groupons », et Elisa pour avoir activement participé à l’écriture de ma thèse.
Je remercie JP de m’avoir si bien tenu compagnie dans le sous-sol durant les longues journées de désespérantes manip, et de m’avoir amenée à toutes les soirées lointaines avec sa bonne humeur et sa djipimobile.
Je remercie la petite Orlane pour la compagnie, les exemples de tracés de pléthysmo et les expériences supplémentaires de mon article. Je remercie Mélanie qui a si bien su gérer mes colonies de souris dégénérées. Et pour les cabanes à sucre !
Je remercie toutes les épaules, québécoises ou assimilées, sur lesquelles j’ai pu
m’appuyer quand j’en ai eu besoin. Merci à tous mes amis du quotidien, qui ont rendu ma vie agréable malgré tout à grands coups de bouffe (au pesto !), de fous rires et de danses. Une pensée particulière à Raph, à Flavien, à Hanan, à Emilie, à Sophie, à Guillaume, à Caro, à Nic, à Cécile, à Milie... et à ma bande de badminton / squash / cartes, tant de Services Canada que de St François : Orlane, JP, François, Benja, Minou, Ben, Audrey. Je vais m’entrainer au squash jusqu’à arrêter d’être ridicule ! (Non, je n’aime pas perdre). Je remercie mon frère Léo pour ses messages humoristiques toujours bienvenus, qui ont su me divertir agréablement quand je surchauffais, ainsi que pour l’accueil à Montréal et le mémorable road-trip dans la cambrousse québécoise.
Enfin, je remercie mes parents d’avoir toujours cru en moi, et d’avoir supporté cette douloureuse distance sans (trop) ronchonner. Je suis heureuse de les avoir rendus fiers, bien que depuis longtemps chroniquement aveuglés par leur amour parental. Merci également de m’avoir permis de réaliser ces longues études dans des conditions confortables.
Je remercie tous mes amis des deux côtés de l’Atlantique (surtout ceux qui sont venus me rendre de très agréables visites) et ma famille qu’il serait trop long de nommer ici mais que je n’oublie pas pour autant et dont la présence est toujours réconfortante.
XXV Et pour pour la toute fin, merci à Papa, Maman, Belle-Maman et Nico d’être venus braver le grand froid pour me voir soutenir ma thèse, ainsi qu’à mes amis qui ont dépensé un si précieux jour de congé pour être présents cet après-midi-là.
XXVII Avant propos
L’article intitulé Post-natal hypoxic activity of the central respiratory command is improved
in transgenic mice overexpressing erythropoietine (Epo) in the brain a été publié en ligne
le 7 juin 2014 par le journal Respiratory Physiology & Neurobiology, et constitue le premier chapitre de cette thèse. J’ai participé à chacune des étapes ayant mené à la réalisation de ce travail. Plus précisément, j’ai mis au point le protocole expérimental et planifié les reproductions d’animaux nécessaires avec l’aide de la technicienne animalière Mélanie Pelletier. J’ai intégralement réalisé les enregistrements électrophysiologiques et leur analyse, ainsi que la compilation des résultats et l’analyse statistique. J’ai mené la discussion scientifique qui en a résulté, ainsi que l’écriture de l’article scientifique. Enfin, j’ai moi-même assuré la soumission et la correspondance avec le journal. Les co-auteurs Richard Kinkead et Jorge Soliz ont participé à la rédaction de l’article et à l’interprétation des résultats.
L’article intitulé Hypoxic ventilatory response is improved at late post-natal ages in mice
overexpressing erythropoietin in the brain a été soumis pour publication le 19 septembre
2014 (N° de soumission : DN-D-14-00152) au journal International Journal of
Developmental Neuroscience. Il constitue le chapitre 2. Dans cette étude, j’ai entièrement
réalisé les enregistrements de pléthysmographie, ainsi que l’analyse et la compilation des données récoltées. Les quantifications par RIA et dosage de l’acide ribonucléique messager (ARNm) ont été réalisées par la co-auteure Edith M. Schneider Gasser, ainsi que la rédaction de la partie correspondante du Matériel et Méthodes. J’ai interprété les résultats avec Vincent Joseph, et mené l’écriture de l’article avec Jorge Soliz et Vincent Joseph.
L’article intitulé PI3K and MEK1/2 molecular pathways are involved in the
erythropoietin-mediated regulation of the central respiratory command a été publié en ligne le 21
novembre 2014 par le journal Respiratory Physiology & Neurobiology en tant que Short
Communication, et constitue le troisième chapitre de cette thèse. De la même manière
que pour l’article constituant le chapitre 1, j’ai intégralement réalisé les enregistrements électrophysiologiques et leur analyse, ainsi que la compilation des résultats et l’analyse statistique. J’ai mené la discussion scientifique qui en a résulté, ainsi que l’écriture de l’article scientifique. Le co-auteur Jorge Soliz a participé à la rédaction de l’article et à l’interprétation des résultats.
1 Introduction
3 Introduction générale
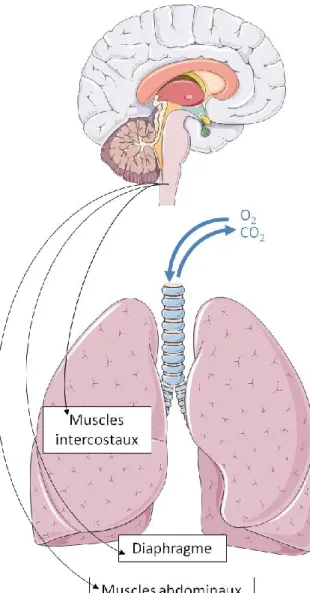
La respiration est définie comme l’ensemble des phénomènes permettant l'absorption du dioxygène (O2) et le rejet du dioxyde de carbone (CO2) par les êtres vivants. Ce processus implique des mouvements pulmonaires rythmiques, obtenus grâce à différents muscles de l’abdomen, notamment le diaphragme, les muscles instercostaux et les muscles abdominaux. Ainsi, au niveau physiologique, la respiration est décrite en trois phases : l’inspiration, la post-inspiration ou expiration passive, et l’expiration (Richter, 1982). Au repos, l’inspiration est la phase nécessitant une mise en jeu du diaphragme. Sa contraction provoque un étirement des poumons grâce à la pression négative ainsi créée dans la cage thoracique. La post-inspiration est la phase durant laquelle d’autres processus liés à la respiration sont mis en jeu, comme la déglutition ou la phonation. Elle correspond à un arrêt temporaire des mouvements respiratoires. Enfin, l’expiration au repos ne requiert pas de forces musculaires, mais celles-ci peuvent être mises en jeu lorsque la respiration doit être forcée, comme lors d’un effort physique ou de paroles (Iscoe, 1998). D’autres muscles, tels que les muscles intercostaux et abdominaux, sont alors mis en jeu. Dans tous les cas, l’air pénètre d’abord dans les voies aériennes supérieures (cavité nasale, cavité buccale, pharynx et larynx) puis dans les voies aériennes inférieures (trachée, bronches et poumons) jusqu’aux alvéoles pulmonaires dans lesquelles les échanges gazeux avec le sang ont lieu (Fig. 1).
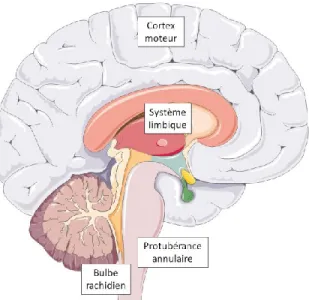
Toutes ces étapes nécessitent une grande coordination de mouvement, qui est contrôlée par le sytème nerveux central (central nervous system ; CNS) (Fig. 2). Le principal paramètre selon lequel la respiration est adaptée est le métabolisme de l’organisme. En fonction de la consommation en O2, et donc de la production de CO2, la respiration est rapidement modulée pour rester adéquate aux besoins métaboliques du corps. Ces besoins sont reflétés par les niveaux de gaz sanguins, qui sont principalement détectés par les chémosenseurs sanguins (les corps carotidiens) et les chémosenseurs centraux : une grande consommation d’O2 et production de CO2 sont caractéristiques d’un métabolisme élevé, et nécessitent donc une ventilation pulmonaire plus importante.
4
Figure 1 Le système respiratoire. Certains groupes neuronaux du tronc cérébral, qui fait partie du cerveau, sont chargés de stimuler et coordonner les mouvements respiratoires. Ils stimulent les muscles (intercostaux, abdominaux et diaphragme) qui sont les effecteurs des mouvements respiratoires. Les poumons sont le siège des échanges gazeux avec le milieu extérieur. Le dioxygène (O2) nécessaire à l’organisme est ainsi récupéré dans l’air au niveau des alvéoles pulmonaires, tandis que le dioxyde de cardone (CO2) est rejeté. Céline Caravagna®
Les centres nerveux du contrôle de la respiration, qui reçoivent et intègrent cette information, sont situés dans le tronc cérébral. Ils modulent dès la naissance les muscles effecteurs via les nerfs phréniques, vagues et hypoglosses, assurant ainsi les échanges gazeux nécessaires au nouveau-né dès son passage à l’air libre. Par ailleurs, il peut y avoir un contrôle volontaire de la respiration via le cortex moteur, et une modulation de la respiration liée aux émotions par le système limbique.
5 Le réseau neuronal contrôlant la respiratoire doit donc dès la naissance être fonctionnel, car l’oxygénation de tout l’organisme en dépend. Ainsi, le processus de maturation de la commande respiratoire commence in utero. Il met en jeu des mouvements respiratoires fœtaux, qui sont non seulement un indice que le cerveau commence à envoyer des signaux inspiratoires aux muscles abdominaux et thoraciques, mais sont également nécessaires au bon développement des poumons eux-mêmes (Greer, 2012). A la naissance, l’apport en O2 du nouveau-né n’étant plus assuré par la mère, il doit être effectué par le nouveau-né lui-même. Il est donc primordial pour le nouveau-né d’assurer son autonomie respiratoire. De plus, il doit être capable d’adapter sa respiration pour maintenir des concentrations viables de gaz sanguins malgré les possibles variations en besoin énergétique de l’organisme (par exemple en cas de diminution de la température) et en disponibilité d’O2 (par exemple à haute altitude).
La majorité des nouveau-nés ayant vu le jour prématurément (c’est-à-dire avant la 35ème semaine de gestation, d’après l’Organisation Mondiale pour la Santé) présentent des troubles de la respiration, à cause de leur immaturité (Mahoney and Jain, 2013). Ceci se reflète par des irrégularités respiratoires, pouvant causer des apnées et qui ont pour conséquence une respiration inadéquate aux besoins du nouveau-né, et donc une mauvaise oxygénation de son organisme. Une apnée est définie cliniquement comme un arrêt de la respiration durant 15 à 20 secondes. Elle peut être centrale, obstructive ou mixte. Une apnée centrale est définie comme un arrêt total des efforts inspiratoires sans mise en évidence d’une obstruction des voies aériennes. Une apnée obstructive est définie comme une absence de flu d’air dans les voies aériennes couplée à des mouvements respiratoires forçant (Milner et al., 1980). Une apnée mixte comprend des efforts respiratoires contre une obstruction, suivis d’un arrêt des mouvements respiratoires (Gauda et al., 1987). Chez les enfants prématurés, l’apnée mixte est la plus fréquente (50% des cas) suivie de l’apnée centrale (Barrington and Finer, 1990). La respiration périodique est une autre dysfonction respiratoire, commune chez les nouveau-nés prématurés. Il s’agit d’une respiration au patron oscillatoire bien connu. La respiration périodique est caractérisée par des cycles ventilatoires de 10 à 15 secondes avec des pauses de 5 à 10 secondes. Ces dysfonctionnements sont associés à des désaturations et hypoxémies (Adams et al., 1997; Miller et al., 1988) qui sont dangereux pour le nouveau-né.
6
Différents traitements sont aujourd’hui appliqués pour aider à l’oxygénation de ces nouveau-nés : il peut y avoir un support ventilatoire mécanique, total ou partiel, une supplémentation de l’air inhalé en O2, ou encore une pression positive d’air continue (Tempera et al., 2011). Seulement, des effets secondaires sont souvent présents. Le support mécanique et la pression positive d’air continue affectent le bon développement des muscles respiratoires et des poumons en remplaçant, voire contrant, les mouvements musculaires, tandis que la supplémentation de l’air inhalé en O2 perturbe la mise en place des chémosenseurs des voies aériennes. Ainsi, si ces solutions permettent de pallier rapidement et sûrement au manque d’O2 chez les nouveau-nés, elles ne sont pas pour autant envisageables à long terme. De nouvelles pistes thérapeutiques sont donc explorées. Parmi celles-ci, l’administration de monoxyde d’azote (NO) par inhalation commence à être répandue en clinique, bien que son efficacité à long terme sur le développement du nouveau-né reste à confirmer (Barrington and Finer, 2010). L’administration de caféine pour lutter contre l’apnée du prématuré est une pratique efficace de plus en plus courante en clinique (Kreutzer and Bassler, 2014). La xanthine est depuis longtemps utilisée pour stimuler la respiration chez les nouveau-nés prématurés (Herlenius et al., 2002). La progestérone est également proposée depuis peu comme un stimulant respiratoire chez le nouveau-né (Bairam et al., 2013; Lefter et al., 2007). Enfin, l’Epo a été observée comme un stimulant respiratoire chez le nouveau-né humain prématuré : des injections chroniques d’Epo, afin de lutter contre l’anémie du prématuré, a par ailleurs permis à ces enfants une meilleure autonomie respiratoire vis-à-vis des supports habituellement nécessaires aux nouveau-nés prématurés (Tempera et al., 2011). Or, il est connu que l’Epo est un stimulant respiratoire chez l’humain et la souris adultes (Soliz et al., 2009). Cependant, les implications exactes de l’Epo sur le système respiratoire du nouveau-né restent à déterminer.
Cette thèse porte sur les effets de l’Epo sur la commande centrale respiratoire du nouveau-né, et son implication dans le mécanisme de réponse à l’hypoxie, dans un modèle murin surexprimant l’Epo dans le CNS sans montrer d’érythropoïèse accentuée, qui permet une stimulation chronique du CNS par l’Epo sans intervention sur l’animal.
7 1. Le contrôle nerveux de la respiration
Les centres nerveux impliqués dans le contrôle de la respiration au sens large comprennent le cortex moteur, le système limbique, et certaines parties du tronc cérébral, à la fois dans le bulbe rachidien et la protubérance annulaire (Richter, 1982) (Fig. 2). Le rythme respiratoire lui-même, qu’il soit inspiratoire ou expiratoire, est généré et adapté aux besoins métaboliques de l’organisme dans le tronc cérébral. Plus précisément, le bulbe rachidien est le siège de la rythmogenèse respiratoire. Les groupes respiratoires de la protubérance annulaire, ainsi que certains du bulbe rachidien, exercent le contrôle « involontaire » de la respiration, c’est-à-dire sa régulation en fonction des besoins de l’organisme.
Les études qui constituent cette thèse se penchent spécifiquement sur les groupes respiratoires du tronc cérébral, et plus particulièrement sur leur capacité à moduler la respiration en cas de manque d’O2 (hypoxie) chez la souris nouveau-née, sous l’influence de l’Epo. Ces groupes neuronaux sont donc détaillés dans un premier temps, afin de situer précisément le système considéré.
Figure 2 Les structures nerveuses impliquées dans le contrôle respiratoire. L’acte respiratoire met en jeu différentes parties du système nerveux central selon qu’il soit volontaire ou spontané. Le cortex moteur permet le contrôle volontaire des muscles effecteurs des mouvements respiratoires. Le système limbique est impliqué dans les processus émotionnels mettant en jeu la respiration. Enfin, la protubérance annulaire et le bulbe rachidien assurent la respiration involontaire et l’adaptent aux besoins de l’organisme. Céline Caravagna®
8
1.1. La commande centrale respiratoire
L’identification et la localisation dans le tronc cérébral des groupes neuronaux respiratoires ont été caractérisées au XIXe siècle, grâce à des expériences de sections étagées du tronc cérébral chez l’animal vivant. Ainsi, une régionalisation des centres respiratoires a été suggérée par LeGallois en 1812, puis confirmée par Flourens en 1842. Ces expériences ont par la suite été précisées (Lumsden, 1923) de plus en plus finement, jusqu’à en arriver aux connaissances actuelles. Les groupes neuronaux respiratoires ont chacun une fonction propre, décrite dans cette partie en même temps que leur localisation au sein du tronc cérébral.
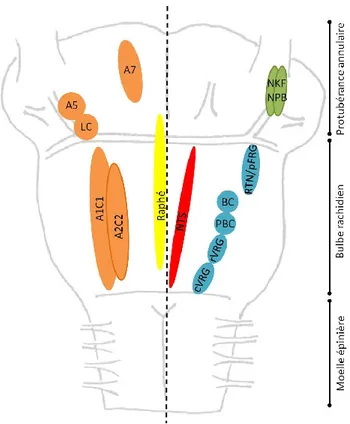
1.2. Description anatomique et fonctionnelle des groupes respiratoires neuronaux La commande centrale respiratoire est formée de différents groupes et noyaux neuronaux, définis par leur localisation et leur(s) fonction(s). Ceux-ci sont regroupés selon leur position dans le bulbe rachidien et la protubérance annulaire (Fig. 3).
1.2.1. La colonne respiratoire ventrale
La colonne respiratoire ventrale comprend les groupes neuronaux respiratoires localisés rostro-caudalement dans la partie ventrale du bulbe rachidien, sans tenir compte de leur localisation latérale (Fig. 3) : le complexe de préBötzinger (preBötzinger complex ; PBC), le complexe de Bötzinger (Bötzinger complex ; BC), les groupes respiratoires ventraux et le noyau rétro trapézoïde/groupe respiratoire parafacial (retrotrapezoid nucleus/parafacial
respiratory group ; RTN/pFRG).
1.2.1.1. Le complexe pré-Bötzinger
Le PBC est localisé dans la partie ventro-latérale du bulbe rachidien (Fig. 3) (Arata et al., 1990; Gray et al., 2001; McKay et al., 2005; Smith et al., 1991), ventralement au noyau ambigüe qu’il côtoit. Il existe deux marqueurs des neurones respiratoires du PBC, qui permettent de le localiser. La somatostatine (SST) est l’un d’eux (Gray et al., 2010). L’autre est le récepteur à la neurokinine 1 (NK1R). L’expression de NK1R dans les neurones du PBC est moins spécifique à la naissance et augmente avec l’âge (Gray et al., 2010), rendant la SST un marqueur du PBC plus fiable aux premiers âges développementaux.
9 Le PBC est le principal générateur du rythme respiratoire. Chez le rat adulte, l’ablation de 80% des neurones exprimant NK1R cause des apnées répétées, durant le sommeil dans un premier temps, puis durant la veille également (Gray et al., 2001). Parce que la technique d’enregistrements électrophysiologiques sur tronc cérébral isolé n’est applicable qu’aux premiers âges post-nataux, le PBC a d’abord été mis en évidence chez le nouveau-né (Arata et al., 1990; Smith et al., 1991).
Il est intéressant de mentionner que la SST est présente dans le corps cellulaire et les fibres des cellules de nombreux neurones du tronc cérébral impliqués dans le contrôle respiratoire d’enfants mort-nés humains (Lavezzi et al., 2004). La SST est un inhibiteur de la respiration fœtale, mais devient nécessaire pour le contrôle physiologique de la respiration immédiatement après la naissance (Lavezzi et al., 2004). Un défaut de mise en place du PBC serait donc inévitablement fatal à la naissance.
Le rythme généré par le PBC est envoyé aux muscles effecteurs de la respiration par différentes voies : les neurones inspiratoires du PBC projettent de manière très importante sur les neurones prémoteurs bulbospinaux (Dobbins and Feldman, 1994) et parahypoglossaux (Dobbins and Feldman, 1995), qui relayent l’information jusqu’aux neurones moteurs spinaux et hypoglossaux. Le PBC est donc un élément majeur de la commande centrale respiratoire, en tant que générateur du rythme respiratoire.
Par ailleurs, ce rythme respiratoire est soumis à différentes modulations, afin de transformer le signal rythmique brut en signal approprié à la contraction des muscles respiratoires. La genèse du rythme respiratoire et les modifications apportées à son patron sont en effet deux phénomènes distincts. In vitro, le rythme inspiratoire « brut » peut être modulé sans modification du patron des décharges (Del Negro et al., 2009). C’est alors la fréquence qui est modifiée. Le PBC joue non seulement un rôle majeur dans la genèse du rythme respiratoire, mais aussi dans sa mise en forme. Selon une hypothèse récemment proposée, l’activité du PBC comprendrait deux étapes, une activité pré-inspiratoire de faible amplitude qui déterminerait le patron des bouffées inspiratoires, et une activité inspiratoire d’amplitude plus élevée, qui cacherait l’activité pré-inspiratoire (Kam et al., 2013). Il y aurait donc dans le PBC des mécanismes différents soutendant la genèse de l’activité inspiratoire rythmique et la mise en forme de son patron. Cette mise en forme des signaux rythmiques respiratoires est également modulée par d’autres groupes neuronaux : les pré-motoneurones et motoneurones du tronc cérébral et de la moelle épinière y ont
10
certainement un rôle prédominant, ce qui n’exclue bien sûr pas l’action d’autres groupes neuronaux influençant le PBC en amont. Ces groupes neuronaux seront détaillés par la suite.
Enfin, le PBC est également capable d’une sensibilité intrinsèque à l’O2. Ce point sera développé plus en détail dans la partie 1.5. La réponse à l’hypoxie chez le nouveau-né. Ainsi, le PBC est indispensable à rythme respiratoire normal, in vitro (Arata et al., 1990; Smith et al., 1991) comme in vivo (Gray et al., 2001; Tan et al., 2008), chez l’adulte comme chez le nouveau-né, et ce via 3 actions complémentaires : genèse du rythme, mise en forme du patron de décharge et chémosensibilité centrale à l’O2.
Figure 3 Noyaux et groupes neuronaux du tronc cérébral impliqués dans la genèse et le contrôle du rythme respiratoire. Les différents groupes et noyaux neuronaux sont représentés selon leur disposition latérale et rostro-caudale chez la souris nouveau-née, sans tenir compte de la répartition ventro-dorsale. Tous les noyaux et groupes neuronaux sont présents bilatéralement dans le tronc cérébral mais, pour des raisons de clarté, ils ne sont représentés que d’un côté du schéma. Complexe pré-Bötzinger (PBC) ; noyau rétro-trapézoïde associé au groupe respiratoire parafacial (RTN/pFRG) ; groupes respiratoires ventraux rostral (rVRG) et caudal (cVRG) ; colonne respiratoire ventrale (en bleu) ; noyau du tractus solitaire (NTS), qui est colocalisé avec le groupe respiratoire dorsal ; noyau Kölliker-Fuse associé au noyau prabrachial (NKF/NPB) ; noyaux catécholaminergiques (Locus coeruleus (LC) A1C1, A2C2, A5, A7); noyaux du Raphé (raphé). D’après l’Atlas stéréotaxique the Developping Mouse Brain, Paxinos et al., 2007. Céline Caravagna®
11 1.2.1.2. Le complexe Bötzinger
Beaucoup de groupes neuronaux du tronc cérébral viennent moduler le rythme respiratoire dans le but de l’adapter aux besoins de l’organisme dans différentes situations, sans qu’une activité autorythmique propre ait été démontrée. Parmi ceux-ci, le complexe Bötzinger est localisé dans la partie ventrale du bulbe rachidien, rostralement au PBC (Fig. 3).
Le complexe Bötzinger a un rôle inhibiteur sur le rythme respiratoire (Tian et al., 1998), ses neurones projettant sur de nombreux autres groupes respiratoires (Ezure et al., 2003b) étant principalement glycinergiques (Ezure et al., 2003a; Schreihofer et al., 1999), mais aussi acide γ-aminobutyriquergiques (γ-aminobutyric acidergic ;GABAergiques) (Livingston and Berger, 1989). Cette inhibition est mise en jeu lors du passage de l’activité inspiratoire à l’activité expiratoire du réseau, grâce aux neurones rythmiques inhibiteurs présents dans le BC et étroitement interconnectés au reste du réseau respiratoire (Smith et al., 2007).
1.2.1.3. Les groupes respiratoires ventraux
Caudalement au PBC, les groupes respiratoires ventraux constituent les voies de sortie de la commande centrale respiratoire. Ils sont situés dans le prolongement de l’axe formé par le BC et le PBC (Fig. 3).
Les groupes respiratoires ventraux sont constitués des groupes rostraux et caudaux, qui comprennent des motoneurones et prémotoneurones innervant les muscles respiratoires. Plus précisément, les neurones rostraux projettent sur les motoneurones spinaux phréniques, innervant le diaphragme, et les motoneurones inspiratoires, innervant les muscles intercostaux (Bianchi et al., 1995). Les neurones respiratoires caudaux, qui sont excitateurs de l’expiration, projettent vers les motoneurones spinaux thoraciques et lombaires (Ezure, 1990). Ainsi, les groupes respiratoires ventraux ont une grande importance dans la mise en place du signal approprié à la contraction des muscles respiratoires (Feldman and Ellenberger, 1988). Ils transforment le signal rythmique généré par les groupes neuronaux en amont en signal contractile relayé jusqu’aux muscles effecteurs. A cause de leur disposition anatomique (Fig. 3), l’ensemble constitué par les groupes respiratoires ventraux, le PBC et le BC est appelé la colonne respiratoire ventrale.
12
1.2.1.4. Le noyau rétrotrapézoïde associé au groupe respiratoire parafacial
Le RTN et le pFRG ayant des caractéristiques communes (chémosensibilité à l’hypercapnie (Guyenet et al., 2005) et neurones glutamatergiques (Weston et al., 2004)) en plus d’une proximité de localisation qui permet un recouvrement de ces deux structures (Onimaru and Homma, 2003), ils sont communément considérés comme une même population neuronale dans l’étude du réseau contrôlant la respiration (Feldman and Del Negro, 2006; Janczewski and Feldman, 2006). Ils seront dans cette thèse considérés ensemble sous l’appellation de RTN/pFRG.
Le RTN/pFRG est localisé sur la face ventrale du bulbe rachidien, et disposé latéralement au PBC. Il est situé dans la partie rostrale de la face ventrale par rapport au BC (Fig. 3). Le RTN/pFRG présente une activité rythmique sur des préparations réduites comprenant la partie rostrale du bulbe rachidien sans le PBC (Onimaru and Homma, 2003). Ceci a confirmé la capacité d’un autre groupe neuronal que le PBC à générer un rythme associé au rythme respiratoire (Onimaru and Homma, 2008), cassant un dogme jusqu’ici bien établi. Plus précisément, cette rythmogenèse est associée à une activité expiratoire, car une transection du tronc cérébral à peine caudale au RTN/pFRG abolit l’expiration active chez le jeune rat anesthésié sans effet sur l’activité inspiratoire (Janczewski and Feldman, 2006). Cette activité rythmique ne serait activée que lorsque c’est nécessaire, par exemple lors d’une réponse émotionnelle forte ou d’une activité physique (Feldman et al., 2013). Ainsi, on peut supposer que le RTN/pFRG puisse servir de générateur de “secours” dans certaines conditions, telle qu’une défaillance PBC à la naissance ou au contraire tel qu’un besoin d’augmenter l’activité expiratoire (Janczewski and Feldman, 2006). Il est important que préciser que le RTN/pFRG et le PBC sont interconnectés (Bochorishvili et al., 2012; Tan et al., 2010). Le RTN/pFRG a été donc reconnu récemment comme un autre groupe neuronal impliqué dans la rythmogenèse respiratoire.
Le rythme respiratoire généré par le PBC et/ou le RTN/pFRG n’est pas transmis tel quel aux muscles effecteurs, même après les modulations par les groupes neuronaux qui le génèrent. Il est modulé et adapté en fonction des besoins de l’organisme. Ces informations provenant de la périphérie du corps sont intégrées dans le tronc cérébral par différents groupes neuronaux (Fig. 3), et servent à moduler le rythme respiratoire pour qu’il soit le mieux adapté à la situation actuelle. Ces groupes neuronaux sont décrits dans la suite de cette section.
13 Enfin, le RTN/pFRG a également une importante fonction de chémosensibilité centrale, qui sera détaillée dans la partie 1.5. La réponse à l’hypoxie.
1.2.2. Le noyau du tractus solitaire
Par opposition au groupe respiratoire ventral, le bulbe rachidien comprend aussi un groupe respiratoire dorsal. Celui-ci est colocalisé avec une partie du NTS, ce qui peut rendre difficile leur différenciation.
Le NTS est un noyau allongé rostro-caudalement, localisé dans la partie dorsale du bulbe rachidien (Fig. 3).
Le NTS est le principal noyau intégrant les afférences périphériques (Jean, 1991) et à ce titre, il renseigne les noyaux respiratoires sur différents points (e.g. distention pulmonaire (Bonham and McCrimmon, 1990; Kubin et al., 2006; Sapru, 1996), qui induit le réflexe de Hering-Breuer, c’est-à-dire l’arrêt de l’inspiration lorsque les poumons sont étirés au maximum physiologique). Il est également le premier relais central des informations issues des chémorécepteurs périphériques (McCrimmon et al., 1987), étant la zone principale de projection des fibres sensorielles du nerf sinusal, lequel innerve les corps carotidiens (Claps and Torrealba, 1988; Finley and Katz, 1992). Le role du NTS se situe donc en aval de la modulation du rythme respiratoire, au niveau de la réception des informations nécessaires à une modulation adaptée aux besoins de l’organisme.
Les neurotransmetteurs produits par les neurones du NTS sont nombreux et varient selon les zones de projection. Chez le pigeon, les projections du NTS sur le NPB expriment majoritairement la SP, la CCK, la NT et la TH (Berk et al., 1993). Chez le rat, une grande partie des neurones du NTS expriment le glutamate et le NO (Lin, 2009).
Certains auteurs placent également une partie du noyau moteur du nerf crânien XII dans le groupe respiratoire dorsal, car il est situé à proximité du NTS, et est impliqué dans l’adaptation de certains muscles des voies aériennes supérieures (e.g. la langue) à la ventilation (Smith et al., 2013).
1.2.3. Les noyaux du raphé
Les noyaux du raphé sont un ensemble de noyaux sérotoninergiques complexe localisé depuis le bulbe rachidien jusqu’à la protubérance annulaire (Fig. 3).
14
Les noyaux sérotoninergiques du raphé (pallidus, obscurus et magnus) stimulent la commande respiratoire par la sérotonine (Al-Zubaidy et al., 1996) et la substance P (Ptak et al., 2009), dès la gestation. En effet, l’antagonisation du courant INaP dans les noyaux du raphé arrête le rythme respiratoire, montrant l’importance de ces noyaux dans le processus respiratoire (Pace et al., 2007). Les neurones sérotoninergiques du raphé seraient donc stimulateurs de la sortie respiratoire motrice, bien que leur effet ait été longtemps pensé inhibiteur (Teran et al., 2014). Il faut dire que le noyau pallidus du raphé module l’inhibition de l’activité du nerf phrénique induite par le BC chez le rat (Yu et al., 2011), et qu’une partie distincte du bulbe rachidien rostral, en l’absence d’influence de la protubérance annulaire, médie l’effet inhibiteur de la sérotonine sur le rythme respiratoire (Makino et al., 2014). L’action des neurones des noyaux du raphé sur la respiration est donc encore à explorer, mais la communauté scientifique s’accorde sur leur importance. Par ailleurs, au moins une partie des neurones des noyaux du raphé sont des chémorécepteurs centraux (Hodges and Richerson, 2010). Ils seraient donc impliqués dans la RVH, tout comme les neurones du RTN/pFRG. Les neurones sérotoninergiques du raphé ont donc un rôle modulateur du rythme respiratoire, en fonction des niveaux de gaz dans le LCR et de l’activité des autres groupes neuronaux respiratoires.
1.2.4. Les noyaux parabrachial et Kölliker-Fuse
Au niveau de la protubérance annulaire, les noyaux impliqués dans le contrôle respiratoire sont principalement les NPB et NKF (Bertrand and Hugelin, 1971; Bertrand and Vibert, 1973), A5, A7 (Alheid and McCrimmon, 2008; Roux et al., 2008) et le LC (Doi and Ramirez, 2010) (Fig. 3). Ils sont situés latéralement, NPB et NKF au niveau dorsal, A5 et A7 à un niveau plus ventral. Les noyaux A5, A7 et LC sont des noyaux catécholaminergiques (plus précisément, noradrénergiques), dont l’implication dans la modulation du rythme en réponse à l’hypoxie sera décrite dans la partie traitant de la réponse à l’hypoxie.
La lésion des NPB et NKF provoque un allongement de la phase inspiratoire chez l’animal anesthésié (Dutschmann and Herbert, 2006), ce qui démontre une influence inhibitrice sur les groupes respiratoires médiant l’inspiration. En effet, les NPB et NKF projettent massivement vers la colonne respiratoire ventrale et leur activité est coordonnée avec l’activité inspiratoire du PBC (Riche et al., 1979).
15 Il existe un consensus sur un rôle des noyaux pontiques dans l’intégration sensorimotrice (Song and Poon, 2004). En effet, les mécanorécepteurs pulmonaires, activés par l’inflation des poumons lors de l’inspiration, projettent, via le nerf vague, sur le NTS, qui lui-même projette largement sur le NKF et le NPB (Kubin et al., 2006; Loewy and Burton, 1978; Ricardo and Koh, 1978). Les NKF et NPB sont donc impliqués dans le réflexe de Hering-Breuer (Ezure et al., 1991; Shaw et al., 1989). De plus, la stimulation électrique du NKF déclenche l’arrêt de l’inspiration (Chamberlin and Saper, 1994; Dutschmann and Herbert, 2006) et entraîne une activité motrice post-inspiratoire prolongée (Dutschmann and Herbert, 2006), deux caractéristiques du réflexe de Hering-Breuer. Cependant, ce rôle intégrateur du NKF serait plus important en période post-natale, durant laquelle la distention pulmonaire joue une part plus importante dans le processus d’arrêt de l’inspiration. Après P15 chez le rat, une modification progressive des paramètres ventilatoires apparait avant même la stimulation de ces récepteurs (Dutschmann et al., 2009). Cette modification est également attribuable au NKF, car son blocage abolit cette activité anticipatoire. Les NPB et NKF sont donc des noyaux inhibiteurs dont l’influence sur le rythme respiratoire intervient en fin d’inspiration.
Enfin, les NKF et NPB sont également recrutés lors des modifications de l’activité respiratoire liées à la nociception (Jiang et al., 2004) et aux réflexes respiratoires suite à la stimulation nasopharyngée (Dutschmann and Herbert, 1998).
Tous ces noyaux respiratoires du tronc cérébral forment un réseau complexe afin de maintenir la respiration de manière adéquate. Par exemple, le noyau du raphe, le NKF et A5 projettent sur A6 (Luppi et al., 1995). Le NTS, le NPB et le NKF projettent sur A5 (Maiorov et al., 2000). Cependant, les mécanismes exacts permettant l’émergence d’un rythme dans le bulbe rachidien sont toujours sujets à débats. Les trois principales hypothèses, chaque ayant ses forces et ses faiblesses, sont présentées dans la section suivante.
1.3. Les mécanismes cellulaires de la commande centrale respiratoire et hypothèses expliquant la genèse du rythme respiratoire
La commande centrale respiratoire comprend les neurones nécessaires à l’émergence d’un rythme respiratoire. Certains neurones présentent des propriétés autorythmiques, d’autres une activité rythmique acquise grâce au réseau neuronal respiratoire. Les
16
neurones (auto)rythmiques ne déchargeant pas tous en phase, ils ont été étudiés séparément dans le but de définir le rôle de chaque patron de décharge.
1.3.1. Les neurones rythmiques
Les neurones de la commande centrale respiratoire sont classés selon leur synchronisation de décharge avec les différentes phases du cycle respiratoire, et selon leur patron de décharge, qui peut être croissant, décroissant ou constant (Smith et al., 2013) (Fig. 4). Certains neurones sont actifs pendant l’inspiration, d’autres pendant l’expiration, d’autres encore pendant la post-inspiration. Les neurones inspiratoires sont
- les neurones pré-inspiratoires (actifs pendant la fin de l’expiration et le début de l’inspiration),
- les neurones inspiratoires précoces (actifs de manière décroissante durant l’inspiration),
- les neurones inspiratoires tardifs (actifs de manière croissante durant l’inspiration). Les neurones inspiratoires déchargent de façon décroissante durant la phase post-inspiratoire. Enfin, les neurones expiratoires déchargent de manière croissante depuis la fin de la phase post-inspiratoire jusqu’à la fin de l’expiration.
La classification de ces populations neuronales ne définit cependant pas leur fonction. En effet, chaque groupe peut comprendre des interneurones excitateurs comme inhibiteurs, répartis dans les différents groupes neuronaux et noyaux respiratoires du tronc cérébral. Le fonctionnement des neurones respiratoires, ou du moins ce que l’on en connait, est détaillé dans les paragraphes suivant.
17 Figure 4 Les différents types de neurones respiratoires rythmiques. Les patrons de décharge neuronaux dans différents groupes du tronc cérébral, illustrés schématiquement, sont typiques de ceux enregistrés sur des préparations de mammifères anesthésiés. Les neurones respiratoires sont classés selon leur profil de décharge et la phase d’activité prédominante. Post-I : neurones inspiratoires; aug-E : neurones expiratoires; pre-I/I : neurones pré-inspiratoires; early-I : neurones inspiratoires précoces; aug-I :neurones inspiratoires; I :inspiration; post-I : post-inspiration; E2 : expiration. Adapté de (Smith et al., 2013).
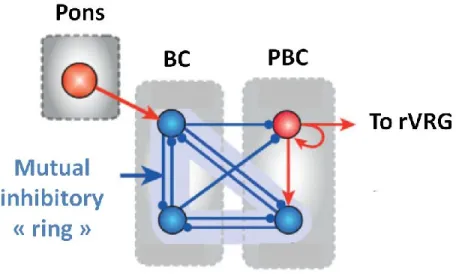
1.3.2. Hypothèses expliquant la genèse du rythme respiratoire 1.3.2.1. Le réseau inhibiteur
La première hypothèse proposée pour expliquer la genèse du rythme respiratoire est celle mettant en jeu des connexions inhibitrices réciproques. Une partie des neurones respiratoires du tronc cérébral sont inhibiteurs (Richter, 1982), et plus précisément environ 50% des neurones du PBC le sont (Winter et al., 2009). Ils s’agenceraient en une « boucle d’inhibition », comprenant trois populations neuronales distinctes du PBC et du BC (Burns and Smith, 1962) (Fig. 5). Ces populations s’inhiberaient mutuellement, alternant ainsi les phases d’activité et les phases d’hyperpolarisation (Molkov et al., 2010; Smith et al., 2007). En effet, le blocage des transmissions synaptiques inhibitrices dans une préparation in vitro provoque des apnées et des décharges toniques des neurones du PBC et du BC (Smith et al., 2007), montrant l’importance des connexions inhibitrices dans
18
la genèse du rythme respiratoire. Cependant, non seulement ce blocage n’abolit pas totalement le rythme inspiratoire, mais chez le rat adulte anesthésié, l’antagonisation des récepteurs aux neurotransmetteurs inhibiteurs (les récepteurs canaux au GABA (GABAA) et glycinergiques) dans le PBC et le BC ralentit le rythme respiratoire sans provoquer d’apnée (Janczewski et al., 2013). Ces derniers résultats remettent en question la nécessité des connexions inhibitrices dans la genèse du rythme respiratoire in vivo, et ont mené à l’élaboration d’une autre hypothèse de la rythmogenèse respiratoire, mettant en jeu des neurones aux propriétés autorythmiques intrinsèques.
Figure 5 Le réseau inhibiteur proposé comme générateur du rythme respiratoire. Il est postulé que le patron normal de respiration en 3 phases soit généré par des populations neuronales inhibitrices interconnectées (en bleu) qui forment une structure en boucle d’inhibition mutuelle qui intéragit avec la population neuronale excitatrice glutamatergique du PBC (Adapté de (Smith et al., 2013))
1.3.2.2. Les neurones autorythmiques
Un point important dans la rythmogenèse respiratoire est la présence de neurones générant individuellement un rythme. Certains neurones du PBC et RTN/pFRG montrent en effet des propriétés intrinsèques autorythmiques, dues aux différents canaux ioniques exprimés (Feldman and Del Negro, 2006). Les courants ICAN et INaP seraient particulièrement importants dans ce contexte (Feldman et al., 2013). INaP est un courant persistant dépendant du voltage et des concentrations en ions Na+, qui est présent dans le PBC dès la naissance mais n’est pas spécifique aux neurones du PBC (Feldman et al., 2013). ICAN est un courant dépendant des concentrations en ions Ca2+, qui n’est que faiblement dépendant du voltage et apparait après P4. Il ne serait donc pas impliqué dans