EFFET DES VERS DE TERRE EXOTIQUES SUR LES COMMUNAUTÉS DES 2
PLANTES DE SOUS-BOIS DE FORÊT DU SUD DU QUÉBEC 3 4 5 par 6 7 8 Claude Ndabarushimana 9 10 11
mémoire présenté au Département de biologie en vue 12
de l’obtention de grade de maître ès sciences (M.Sc.) 13
14 15 16
FACULTÉ DES SCIENCES 17 UNIVERSITÉ DE SHERBROOKE 18 19 20 21
Sherbrooke, Québec, Canada, juin 2019 22
23 24
25
Le 18 juin 2019 26
27
le jury a accepté le mémoire de M. Claude Ndabarushimana dans sa version finale. 28 29 Membres du jury 30 Pr Bill Shipley 31 Directeur de recherche 32 Département de Biologie 33 34
Pre Sophie Calmé 35 Évaluatrice interne 36 Département de Biologie 37 38 39 40 41 Pr Mark Vellend 42 Président-rapporteur 43 Département de Biologie 44
iv 45
SOMMAIRE 46
47
Le présent mémoire traite de deux approches permettant d’aborder les effets de l’invasion de vers 48
de terre exotiques dans les forêts du sud du Québec : il s’agit d’un échantillonnage des vers de 49
terre et des espèces herbacées de sous-bois de forêt, et d’une étude expérimentale faite en 50
mésocosmes. 51
52
En premier lieu nous avons réalisé un échantillonnage des vers de terre et des espèces herbacées 53
de sous-bois de forêt du parc écoforestier de Johnville. On est parti de l’hypothèse de travail 54
selon laquelle la structure de communautés des espèces herbacées du sous-bois de forêt est 55
déterminée par les abondances des vers de terre et en essayant de répondre à la question de savoir 56
s’il existe une corrélation entre la structure et la composition des communautés des espèces de 57
plantes de sous-bois et l’abondance des vers de terre du parc écoforestier de Johnville, 58
indépendamment des variables abiotiques et historiques. Ici, nous donnerons les détails sur des 59
résultats issus de l’analyse des données d’un échantillonnage de vers de terre et d’espèces 60
herbacées du sous-bois de forêt réalisé sur 87 placettes dans trois zones du parc, tout au long de 61
18 transects perpendiculaires aux chemins se trouvant dans notre zone d’étude. On a trouvé que 62
les vers de terre sont présents en grande quantité dans les zones Récréation et Plantation tandis 63
qu’ils sont quasiment absents dans la zone Conservation et que les espèces herbacées du boisé de 64
Johnville sont structurées en trois communautés réparties respectivement sur les 3 secteurs de ce 65
territoire. Les résultats tirés des analyses statistiques montrent comme plusieurs autres études 66
qu’il y a une association entre l’abondance des vers de terre et la structure de la végétation du 67
sous-bois au parc écoforestier de Johnville. Contrairement à nos attentes, nous n’avons pas 68
détecté un lien entre les perturbations anthropiques actuelles (distance des routes et sentiers) et 69
l’abondance de vers de terre. Après avoir analysé les données de l’échantillonnage, il se trouve 70
que l’abondance des vers de terre est différente d’une zone à l’autre. Comme la répartition des 71
abondances des vers de terre, les espèces herbacées du parc sont structurées en respectant la 72
zonalité de ce site, ce qui nous amène à croire que c’est l’historique de chaque zone qui est 73
déterminant et non les abondances de vers de terre en place. 74
v 75
En deuxième lieu, j’ai réalisé une étude expérimentale faite en mésocosmes dans des conditions 76
contrôlées. Les forêts du Canada et du nord des États-Unis connaissent des changements des 77
communautés des espèces herbacées du sous-bois reliée à une invasion des vers de terre 78
exotiques introduits à l’époque coloniale dans ces forêts qui se sont régénérées, en absence de 79
vers de terre, au lendemain de la glaciation du Wisconsin il y a plus de 10000 ans. Dans cette 80
étude nous essayons de comprendre si ces vers invasifs affectent les plantes herbacées de ces 81
forêts et si oui, par quels mécanismes? 82
83
Pour comprendre ces mécanismes, nous avons privilégié l’approche par analyse des traits 84
fonctionnels en choisissant des espèces végétales qui possèdent des traits fonctionnels qui 85
peuvent accentuer ou diminuer les effets négatifs hypothétiques créés par des changements 86
environnementaux provoqués par les vers de terre. Ainsi nous avons mis en place un dispositif 87
expérimental fait de 96 mésocosmes dans lesquels nous avons transplanté 12 espèces herbacées 88
représentatives d’une communauté de sous-bois sélectionnées selon leurs abondances pour 89
s’assurer d’avoir suffisamment d’individus, en utilisant deux traits: (i) la position d’enracinement 90
des plantes (2 niveaux, soit dans la matière organique, soit dans le sol minéral) et (ii) le taux de 91
mycorhization des racines (2 niveaux, fortement mycorhizées ou faiblement mycorhizées). 92
93
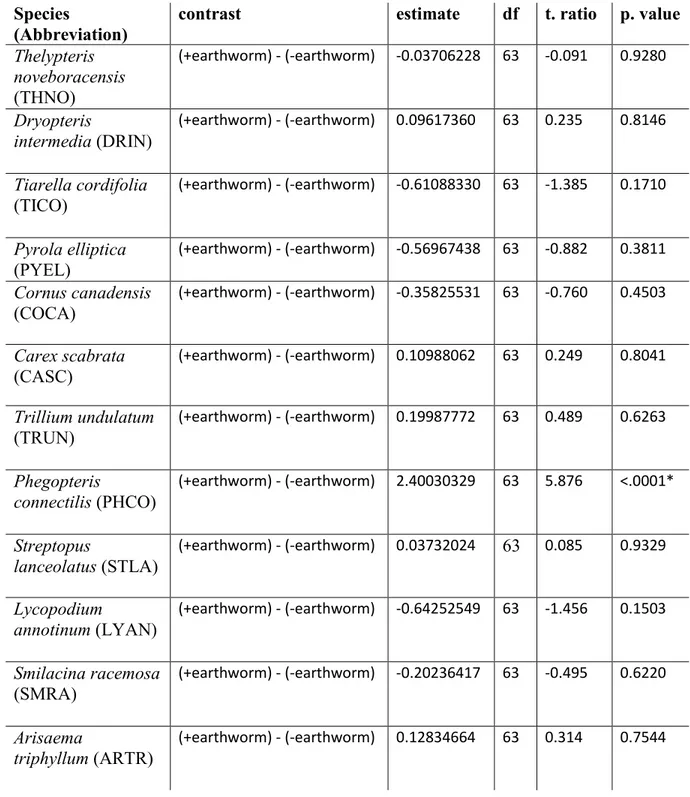
Après deux saisons de croissance, seule l’espèce Phegopteris connectilis a répondu de façon 94
significative à l’effet des vers de terre et sa biomasse a augmenté en présence de ceux-ci. Si 95
l’effet des vers de terre sur les sols dans nos mésocosmes est semblable aux effets sur les sols 96
agricoles, il est possible que l’effet positif sur cette espèce soit dû à l’augmentation de fertilité 97
causée par l’augmentation de décomposition de la matière organique du sol. Si cela est le cas, 98
nous ne pouvons cependant pas expliquer pourquoi les autres espèces n’ont pas répondu de la 99
même façon. 100
Mots clés : Invasion de vers de terre, espèces herbacées, plantes de sous-bois, forêt. 101
vi
REMERCIEMENTS 102
103
Je te remercie Éternel Dieu pour ton amour, pour ta miséricorde et pour m’avoir assisté tout au 104
long de mes études. Grâce à toi, j’ai l’espérance d’un avenir meilleur! 105
106
Je tiens à remercier du fond du cœur mon directeur de recherche Dr. John William Shipley. Avoir 107
placé sa confiance en moi durant tout le cheminement de ce programme m’a permis d’avoir 108
motivation et persévérance du début jusqu’à la fin de mes études graduées. Avec monsieur Bill 109
Shipley, j’ai non seulement appris l’écologie fonctionnelle mais aussi comment un scientifique 110
doit avoir un esprit critique avec une rigueur scientifique inébranlable. J’apprécie aussi le côté 111
humain de ce grand professeur, je n’oublierai pas les soirées auxquelles j’ai été convié à son 112
domicile en compagnie des étudiants gradués de son laboratoire. L’ambiance y était chaleureuse, 113
le tout dans une atmosphère agréablement détendue. 114
115
Par cette occasion, je tiens également à remercier les professeurs Mark Vellend et Robert 116
Bradley, tous deux membres de mon comité de conseillers, pour leurs conseils et leur aide. Je 117
remercie du fond du cœur les étudiants Michael, Françoise, Laurent et Lee pour leur aide 118
également. 119
120
Pour terminer, je remercie Micheline, Jean Pierre, ma famille, mes amis et toutes les personnes 121
qui de près ou de loin ont contribué au bon déroulement de mes études à la maîtrise en Biologie. 122
vii
TABLE DES MATIÈRES 123 124 125 SOMMAIRE ... iv 126 REMERCIEMENTS ... vi 127
TABLE DES MATIÈRES ... vii 128
LISTE DES TABLEAUX ... ix 129
LISTE DES FIGURES ... x 130 CHAPITRE 1 ... 1 131 INTRODUCTION GÉNÉRALE ... 1 132 CHAPITRE 2 ... 7 133
La structure d'une communauté végétale herbacée de sous-bois de forêt et sa relation avec 134
l'abondance des vers de terre invasifs. ... 7 135
Abstract ... 9 136
1. Introduction ... 10 137
2. Materials and Methods ... 13 138
Presentation of the study area ... 13 139 Sampling ... 13 140 3. Statistical analyses ... 16 141 4. Results ... 17 142 Earthworm community ... 17 143
Influence of earthworm abundance on the structure of forest understory plant 144 communities ... 18 145 5. Discussion ... 20 146 6. Acknowledgements ... 23 147 7. References ... 24 148 CHAPITRE 3 ... 27 149
Effet des vers de terre exotiques sur les plantes de sous-bois de forêt. ... 27 150 Abstract ... 28 151 1. Introduction ... 30 152 2. Methods ... 34 153 Experimental design ... 34 154 Experimental treatments ... 35 155
viii
Application of treatments ... 38 156
Initial and final above-ground biomass measurement ... 39 157 3. Statistical analyses ... 41 158 4. Results ... 41 159 Survival: ... 41 160 Growth: ... 43 161 5. Discussion ... 46 162 6. Acknowledgements ... 48 163 7. References ... 49 164 CHAPITRE 4 ... 53 165
DISCUSSION ET CONCLUSION GÉNÉRALE ... 53 166 ANNEXES ... 56 167 BIBLIOGRAPHIE ... 60 168 169 170
ix
LISTE DES TABLEAUX 171
172
CHAPITRE 2 173
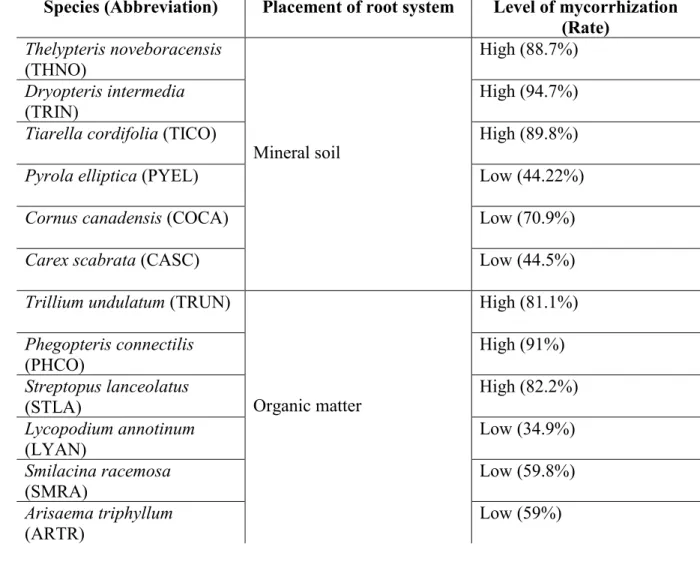
Table 1. Species according to root placement and mycorrhization rate………..…...37 174
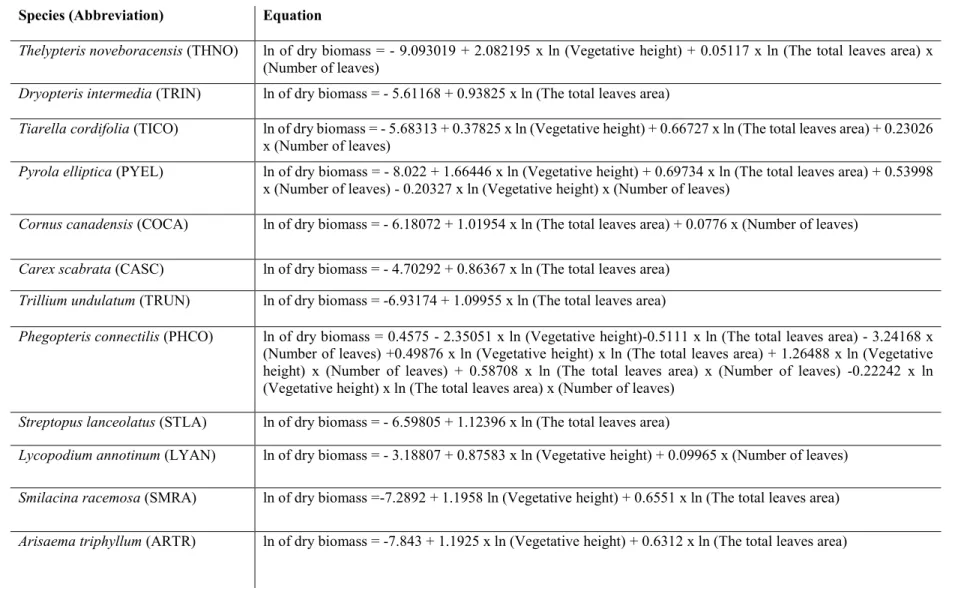
Table 2. Prediction equation of the initial biomass of twelve species used in the 175
experiment.……….……….…….……….40 176
Table 3. Statistical results of multiple ANOVAs to determine the effect of earthworms 177
depending on the plant species. ……….………...45 178
x
LISTE DES FIGURES 180
181
CHAPITRE 2 182
Figure 1. 1945 aerial photo of Johnville ecoforest park………....………..…….14 183
Figure 2. Sampling plan and illustration of earthworm abundances per plot. ………..……18 184
Figure 3. Ordination of understory plant community……….…...….20 185
186
CHAPITRE 3 187
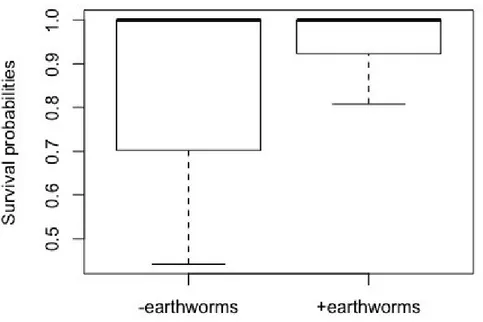
Figure 4. Probabilities of survival of species with or without earthworms……….……...….42 188
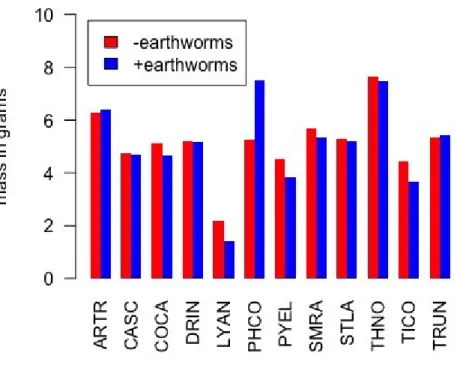
Figure 5. Species growth by treatment type. ……….…….……….….…….43 189
190 191
1 CHAPITRE 1 192 INTRODUCTION GÉNÉRALE 193 194 195
Au Canada et dans la partie septentrionale des États-Unis, il est généralement admis que la 196
plupart des vers de terre indigènes n’ont pas survécu aux glaciations du Wisconsin. La glaciation 197
du Wisconsin a décimé la quasi-totalité des vers de terre indigènes de cette partie du continent. 198
La très grande majorité des espèces de vers de terre qui vivent maintenant dans le sol au Canada 199
et les régions nordiques des États-Unis résultent des récentes introductions faites par les colons 200
européens (Reynolds 1994). Ainsi, la majorité des espèces de vers de terre dans les parties 201
nordiques de l’Amérique de Nord font partie de ces espèces exotiques envahissantes. La 202
dispersion des vers de terre par les humains est la plus importante puisque la dispersion naturelle 203
des vers de terre est très lente, avec une vitesse de propagation allant de 5 à 10 mètres par an 204
selon la région (Addison 2009, Cameron et Bayne 2009). Les sols contenant les vers de terre, 205
même aujourd’hui, sont surtout associés aux activités humaines (agriculture, horticulture, etc). 206
Leur abondance relative et composition spécifique sont fortement liées au type de sol, climat, 207
végétation, topographie, historique de l’utilisation des sols et surtout à son historique 208
d’envahissement par des espèces exotiques (Hendrix et Bohlen, 2002). 209
210
Même si les vers de terre se trouvent de plus en plus en milieu forestier, il y a encore plusieurs 211
forêts sans vers de terre (Hedrix et Bohelen, 2002). C’est le cas notamment des endroits qui 212
n’ont pas été soumis à une influence humaine après la glaciation. L’intérieur des forêts semble 213
relativement peu affecté par l'invasion des vers de terre: la probabilité d'apparition de vers de 214
terre et l'étendue de la propagation augmentent en fonction de la proximité des routes et des 215
aménagements (Cameron et Bayne 2009, Sackett et al, 2011; Shartelletal, 2013). On les trouve 216
généralement sous une forte densité dans des terres agricoles, à proximité des routes et autour des 217
lacs utilisés pour la pêche, ce qui laisse penser que leur introduction a été facilitée par les 218
activités humaines telles que le transport par le biais des pneus ou tout simplement apportés pour 219
être utilisés comme des appâts de pêche (Hendrix et Bohelen, 2002). 220
2 221
Les vers de terre sont souvent appelés des « ingénieurs écosystémiques » puisqu’ils modifient 222
beaucoup les attributs physiques et biolniques du sol. Vu que différentes espèces végétales sont 223
adaptées différemment à ces attributs du sol, il est possible que l’envahissement des sols 224
forestiers par les vers de terre exotiques puisse modifier également la structure des communautés 225
végétales. En particulier, les vers de terre modifient directement le taux de décomposition de la 226
litière, la structure physique du sol et les communautés microbiennes du sol. L'ampleur de la 227
perte de l’horizon organique du sol de forêt et les conséquences pour les communautés végétales 228
de la forêt indigène dépendent de l'espèce de vers de terre (Hale et al., 2005). Cela étant, il est 229
raisonnable de croire que l’introduction des vers dans les écosystèmes qui se sont développés 230
sans ces espèces au lendemain de la dernière glaciation auront des répercussions importantes. 231
L’activité des vers de terre n’est pas toujours bénéfique aux plantes. Après l'envahissement, les 232
vers de terre modifient la structure de horizons du sol, la disponibilité des éléments nutritifs, et le 233
biote du sol. Parmi les conséquences attribuables aux vers de terre exotiques envahissants, on 234
trouve notamment la modification de la structure du sol forestier (McLean et Parkinson 1997a) et 235
la réduction ou l’éradication de la couche de litière (Edwards et Bohlen, 1996). Ceci peut 236
affecter les espèces de différentes façons; les espèces herbacées du sous-bois varient en fonction 237
de leur placement du système racinaire dans le sol et les espèces dont les racines sont limitées à la 238
couche organique peuvent être affectées de façon négative alors que celles dont les racines sont 239
limitées au sol minéral peuvent être affectées de façon positive. Ensuite, d’après Wardle (2002), 240
quand les vers de terre transforment la structure d'un sol dominé par les champignons en un sol 241
dominé par les bactéries, les relations cruciales entre les racines et la plante sont affectées. La 242
perte de mycorhizes peut entraîner des effets négatifs sur la fonction racinaire des plantes 243
(Lawrence et al., 2003), la croissance des plantes (Gundale, 2002) et des assemblages de 244
communautés végétales (Holdsworth et al., 2007). Donc, les espèces peuvent être affectées 245
différemment selon leurs taux de mycorhization. 246
247
En connaissance de ce qui précède, nous avons voulu dans le premier chapitre de ce mémoire 248
vérifier l’hypothèse selon laquelle l’abondance des vers de terre influence la structure des 249
3
communautés de plantes de sous-bois de forêts indépendamment des autres facteurs abiotiques et 250
biotiques, incluant l’historique du site. 251
Pour ce faire, nous avons posé deux questions : 252
1) Existe-t-il une corrélation entre la structure et la composition des communautés des 253
espèces de plantes de sous-bois et l’abondance des vers de terre? 254
2) Si oui, cette corrélation existe-elle indépendamment des variables abiotiques et 255
historiques? Autrement dit, est-ce que cette corrélation disparait en contrôlant pour des 256
variables abiotique et historiques? 257
258
Quand l’abondance des espèces introduites devient importante, et quand l’impact de ces espèces 259
introduites sur ces écosystèmes devient majeur, on parle d’espèces exotiques invasives. 260
Cependant, l'histoire de l'utilisation des terres et d'autres facteurs spécifiques du site peuvent 261
confondre les études comparant les sites sans vers avec les sites envahis par les vers (Callaham et 262
Blair 1999 ; Jordan et al. 1999 ; Cortez et al. 2000 ; Bohlen et al. 2004a; Hale et al, 2005). 263
Les vers de terre affectent directement la structure et la fonction de l'écosystème en ingérant, 264
modifiant et mélangeant la matière organique et le sol minéral (Lavelle et al. 1998), modifiant 265
ainsi la structure, la chimie et la biologie du sol (Devliegher et Verstraete 1997; Hale et al, 2005). 266
Les espèces végétales du sous-bois varient dans le placement de leurs systèmes racinaires. 267
Certaines espèces placent leurs racines uniquement dans la couche superficielle de litière, 268
certaines uniquement dans le sol minéral, et certaines dans les deux. Donc, il est raisonnable de 269
croire que l’abondance des espèces végétales du sous-bois ayant ces différences dans le 270
placement de leurs systèmes racinaires seront affectées différemment par l’invasion des vers de 271
terre. Ensuite, nous savons que ces vers de terre modifient la structure des horizons du sol, la 272
disponibilité des éléments nutritifs, et la faune du sol. 273
Les vers de terre font partie de la communauté détritivore, consommant la litière de feuilles et 274
augmentant les taux de décomposition. L'ampleur des impacts des envahissements de vers de 275
terre sur les sols forestiers dépend de l'assemblage des espèces de vers de terre qui envahissent le 276
sol ainsi que de l'historique de leur utilisation (Frelich et al, 2006). 277
Finalement, la perte de la couche superficielle des sols forestiers cause des changements dans la 278
communauté mycorhizienne. Les changements dans la structure et la chimie du sol et le pâturage 279
4
par les vers de terre conduisent aux changements dans l'abondance et de la structure des 280
communautés fongiques du sol (Johnson et al 1992; McLean and Parkinson, 1998b, 2000). 281
La perte de mycorhizes peut avoir des effets négatifs sur la fonction racinaire des plantes 282
(Lawrence et al., 2002), la croissance des plantes (Gundale, 2002) et les assemblages de 283
communautés végétales (Holdsworth et al., 2007). De plus, une augmentation de la diversité des 284
vers de terre peut entraîner une diminution de la diversité des espèces végétales en raison du fait 285
que différentes espèces de vers de terre occupent plusieurs niches dans le sol. Hale et ses 286
collaborateurs, en 2005, ont constaté une diversité végétale plus faible dans les régions où l'on 287
trouve à la fois des espèces de vers épigéiques (vivant dans la couche organique supérieure du 288
sol) et endogéniques (dans des couches organiques et minérales du sol) que dans les régions où 289
l'on ne trouve que des vers endogéniques (Hopfensperger et al., 2011). Le déclin des taux des 290
champignons en abondance ou en colonisation ou des changements dans la composition de la 291
communauté fongique mycorhizienne pourrait conduire à des changements dans les 292
communautés végétales des forêts feuillus et boréales, incluant les communautés du sous-bois 293
(Frelich et al, 2006), qui sont la cible de cette étude. Bien qu'il y ait peu d’espèces végétales 294
mycorhiziennes, comme Arisaema triphyllum et Circaea lutetiana, qui ont une relation positive 295
avec la biomasse lombricienne, un beaucoup plus grand nombre d'espèces végétales est 296
négativement corrélé avec la biomasse lombricienne (Hale 2004). Donc, nous savons que les 297
structures physique, chimique et microbiolnique des sols forestiers sont changées suite à 298
l’invasion des vers de terre. Plusieurs auteurs ont affirmé que les vers de terre influencent 299
fortement la composition de la communauté végétale herbacée (Drouin et al, 2014, Frelich et al, 300
2006). Typiquement, ces études démontrent une association entre l’occurrence ou abondances 301
des vers de terre et un changement dans la structure de la communauté végétale. 302
303
Cependant, une association entre la distribution des vers de terre et la structure de la végétation 304
de sous-bois n’est pas nécessairement une relation causale puisque la corrélation entre les deux 305
peut être une réponse commune aux perturbations humaines, même pour des perturbations qui 306
datent de plusieurs décennies. Par exemple Beauséjour et al (2015) ont conclu que certaines 307
espèces étaient distribuées en tenant compte non seulement de la distribution spatiale des 308
perturbations humaines, mais aussi du délai après lequel la perturbation s’est répandue. Notre 309
5
premier chapitre nous a permis de conclure que la distribution des vers de terre et la structure des 310
communautés d’espèces de sous-bois de forêt du parc écoforestier de Johnville suivent 311
l’historique de l’utilisation de ce site. Pourtant, il existe de bonnes raisons pour supposer que 312
l’invasion des vers de terres des sols forestiers provoque un changement de la structure et la 313
composition des communautés végétales du sous-bois. 314
315
Il y a deux faiblesses importantes dans toutes ces études. D’abord, ces études se basent sur des 316
corrélations entre la présence/absence (ou abondance) des vers de terre et des changements de 317
composition des espèces végétales. Par contre, nos forêts sont bousculées simultanément par 318
plusieurs changements : l’aménagement forestier, les changements dans les populations 319
d’herbivores (surtout les cerfs de Virginie), les dépositions azotées et les changements 320
climatiques. Il est très difficile de séparer les effets des invasions des sols forestiers par les vers 321
de terre de ces autres changements en utilisant les études observationnelles. Ensuite, même si 322
nous pouvions attribuer un effet causal aux vers de terre, il est probable que cet effet sera 323
différent sur différentes espèces végétales. Certaines espèces végétales peuvent être favorisées, 324
et d’autres affectées négativement. Comment prévoir ces effets? Pour démontrer une relation 325
causale entre l’introduction des vers de terre et des changements dans la composition de la 326
communauté des plantes de sous-bois, il faudrait faire une expérience sur le terrain en 327
introduisant des vers de terre dans un sol qui n’a jamais eu des vers de terres, avec un contrôle 328
statistique approprié, et ensuite suivre les changements dans la végétation. Une telle expérience 329
n’a pas été faite et ne se fera probablement jamais à cause des contraintes d’éthique 330
environnementale. 331
332
Dans notre chapitre 2, nous proposons un compromis entre une telle expérience idéale et des 333
études purement observationnelles : une expérience dont on manipule la présence/absence des 334
vers de terres mais dans des conditions plus contrôlées qui ne mettent pas en danger les sols 335
forestiers. En plus, nous avons privilégié l’approche par analyse des traits fonctionnels en 336
choisissant des espèces végétales qui possèdent des traits fonctionnels qui peuvent accentuer ou 337
diminuer les effets négatifs hypothétiques créés par des changements environnementaux 338
provoqués par les vers de terre. L’arrivée des vers de terre dans un sol forestier cause la réduction 339
6
de la couche de feuilles mortes (litière) sur la surface du sol, la couche de la matière organique 340
décomposée des sols forestiers. Puisque plusieurs espèces de sous-bois gardent leur système 341
racinaire dans cette couche, on peut supposer que ces espèces seront négativement affectées par 342
les vers de terre. Les espèces dont les racines se trouvent dans le sol minéral ne devraient pas 343
être affectées autant. 344
345
Ensuite, nous savons que les vers de terre détruisent des hyphes fongiques, incluant des hyphes 346
mycorhiziennes (Pelosi et al, 2014) présumément en les mangeant. Si c’est bien le cas, les 347
espèces de sous-bois qui sont plus fortement mycorhizées devraient être plus affectées 348
négativement par les vers de terre. Existe-t-il des attributs morpholniques, physiolniques ou 349
phrénolniques (« traits fonctionnels ») des espèces végétales qui peuvent prédire leurs réponses 350
face aux vers de terre ? Pour approcher cette problématique, nous avons fait une expérience dans 351
des mésocosmes. Nous y avons transplanté des espèces de sous-bois ayant des trais fonctionnels 352
variés. Certaines espèces ont uniquement des racines dans la litière et d’autre dans le sol minéral. 353
Dans chacune de ces deux catégories, la moitié des espèces sont fortement mycorhizées les autres 354
faiblement. La moitié des mésocosmes a fait l’objet d’un ajout des vers des terres tandis que 355
l’autre moitié des mésocosmes a fait l’objet d’une exclusion des vers de terres. 356
357
Ainsi dans ce deuxième chapitre nous avions deux hypothèses de travail: (1) les espèces ayant 358
leurs racines uniquement dans la couche de litière seront affectées négativement par les vers de 359
terre exotiques; (2) les espèces qui sont fortement mycorhizées seront aussi affectées 360
négativement. 361
7
CHAPITRE 2 362
La structure d'une communauté végétale herbacée de sous-bois de forêt et sa relation avec 363
l'abondance des vers de terre invasifs. 364
365 366
Titre original: The structure of a herbaceous understory plant community and its relationship to 367
invasive earthworm abundance. (sera soumis à Botany) 368
369
Le présent chapitre présente les résultats issus de l’analyse des données d’un échantillonnage de 370
vers de terre et d’espèces herbacées du sous-bois de forêt réalisé sur 87 placettes dans trois zones 371
du parc écoforestier de Johnville au long de 18 transects perpendiculaires aux chemins. 372
373
On a trouvé que les vers de terre sont présents en grande quantité dans les zones Récréation et 374
Plantation tandis qu’ils sont quasiment absents dans la zone Conservation et que les espèces 375
herbacées du boisé de Johnville sont structurées en trois communautés réparties respectivement 376
sur les 3 secteurs de ce territoire. 377
378
Les résultats montrent comme plusieurs autres études qu’il y a une association entre l’abondance 379
des vers de terre et la structure de la végétation du sous-bois au parc écoforestier de Johnville. 380
Comme la répartition des abondances des vers de terre, les espèces herbacées du parc sont 381
structurées en respectant la zonalité de ce site. On est amené à penser que c’est l’historique de 382
chaque zone qui est déterminant, en contraste avec l’affirmation selon laquelle la réponse de la 383
forêt est fortement corrélée au type d’espèce de vers de terre présents. 384
8
The structure of a herbaceous understory plant community and its relationship to invasive 385
earthworm abundance 386
Claude Ndabarushimana, Bill Shipley* 387
Laboratoire d’Écologie Fonctionnelle 388
Département de biologie, Université de Sherbrooke, Sherbrooke (QC) Canada J1K 2R1 389
9 Abstract
390 391
We asked if the community structure of forest understory herbaceous species is determined by 392
earthworm abundances independently of abiotic and historical variables. To answer this question, 393
we studied the structure and community composition of understory plant species and the earthworm 394
abundance of Johnville Ecoforest Park (Quebec). Here we report results from a sampling of 395
earthworms and herbaceous forest understory species on 87 plots in three zones of the park that 396
differ in historical land use, along 18 transects perpendicular to the roads. Earthworms are present 397
in large quantities in the Recreation and Plantation zones, while they are nearly absent in the 398
Conservation zone. The herbaceous species are also structured into three communities distributed 399
respectively over the three zones of this territory and there is an association between the abundance 400
of earthworms and the structure of herbaceous understory vegetation. The statistical significance 401
of this association disappears once we take into consideration the differences between land use 402
zones. There is no link between current anthropogenic disturbances and the abundance of 403
earthworms. The observed association between the abundance of earthworms and the structure of 404
herbaceous understory vegetation is not causal but generated by the common response of each to 405
land use history. 406
407
Keywords: Invasive earthworms, forest understory plant communities. 408
10 1. Introduction
410 411
In Canada and the northern United States, it is generally accepted that most native earthworms did 412
not survive the Wisconsin glaciations. Rather, the vast majority of earthworm species now 413
occurring in Canada and the northern United States are the result of recent introductions by 414
European settlers (Reynolds 1994). In Quebec (Canada), 17 of 19 known earthworm species have 415
been introduced by European settlers (Reynolds and Reynolds 1992; Addison 2009, Drouin et al. 416
2014). Among the exotic earthworm species, the most abundant are those of the genus Lumbricus 417
(Reynolds 1977; Addison 2009). These exotic species are found mainly in agricultural land or 418
other places disturbed by humans but are also found in some forest soils in this region (Hale et al. 419
2005, Bohlen et al. 2004a, Burtelow et al. 1998). 420
421
In historically worm-free soils in North America, the invasion of European earthworms is strongly 422
linked to human activities, leading to their introduction into new areas where their establishment 423
and spread will depend on their habitat (Kalisz and Dotson 1989, Suarez et al. 2006, Tiunov et al. 424
2006, Cameron et al. 2007). This human dispersal is important because the natural dispersion of 425
earthworms is very slow, with a propagation rate ranging only up to 5 to 10 meters per year 426
depending on the region (Addison 2009, Cameron and Bayne 2009). Soils containing earthworms, 427
even today, are mainly associated with human activities (agriculture, horticulture, etc.). Their 428
relative abundance and species composition are strongly related to soil type, climate, vegetation, 429
topography, land use history and especially its history of invasions by exotic species (Hendrix and 430
Bohlen 2002). Although earthworms are increasingly found in forest environments in these areas, 431
there are still many forested areas without earthworms (Hendrix and Bohlen 2002). Forest interiors 432
are often relatively unaffected by earthworm invasion; the probability of earthworm establishment 433
and the extent of spread increases with proximity to roads and other human developments 434
(Cameron and Bayne 2009, Sackett et al. 2011; Shartelletal 2013). In forests, they are generally 435
found in high density near roads and around lakes used for fishing, suggesting that their 436
introductions have been facilitated by human activities such as transport by vehicles or simply 437
brought in to be used as fishing bait (Hendrix and Bohlen 2002). Drouin et al. (2016) confirmed 438
that the distribution and abundance of exotic earthworms observed in forests reflect human 439
11
accessibility to these environments and that their dispersal is facilitated by humans because 440
earthworms have been found in unprotected sites and crossed by trails and no worms have been 441
found on protected sites or sites remote from trails and dwellings. The authors of this study also 442
suggested that the consequences of the growing spread of earthworms in temperate forests could 443
compromise the integrity of biodiversity and the recruitment of shrub species. The authors of the 444
study found a negative correlation between earthworm abundance and the abundance of some plant 445
species. However, it is also known that the history of site use can explain the distribution and 446
dispersal rate of earthworms. Beauséjour et al. (2015) concluded that earthworm distributions are 447
determined by not only the current spatial distribution of human disturbances, but also the history 448
of such human disturbances. Some of the oldest human disturbances on their study site (Mont Saint 449
Hilaire, Quebec) that are up to one hundred and fifty years old, are now barely evident in the 450
vegetation structure, but their influence on earthworm distributions persists to this day. Therefore, 451
the history of forest sites (former agricultural and non-agricultural land) must be taken into account 452
to understand the current distribution of earthworms in these forest soils. 453
454
Earthworms are often referred to as "ecosystem engineers" because they significantly alter the 455
physical and biolnical attributes of the soil. Since different plant species are adapted differently to 456
these soil attributes, and since these North American plant communities have developed since the 457
end of the Wisconsin glaciations in the absence of earthworms, it is possible that the invasion of 458
forest soils by exotic earthworms may also alter the structure of these forested plant communities. 459
In particular, earthworms directly modify the rate of litter decomposition, the physical structure of 460
the soil and the microbial communities of the soil. The extent of loss of the organic horizon of 461
forest soil and the consequences for plant communities of native forest depends on the invasive 462
earthworm species (Hale et al. 2005). However, it is reasonable to believe that the introduction of 463
worms into ecosystems that developed without these invasive species in the aftermath of the last 464
glaciation more than 10,000 years ago will have significant impacts. The invasion of exotic 465
earthworms into temperate and boreal forests in North America, long ignored, has become a 466
growing concern in the scientific community (Hale et al. 2005; Suarez et al. 2006; Addison 2009). 467
12
The activity of earthworms is not always beneficial to plants. After invasion, earthworms modify 469
the structure of soil horizons, nutrient availability, and soil biota. The type and magnitude of these 470
impacts vary with lumbricid species and soil characteristics (Frelich et al. 2006). Earthworms are 471
key members of the soil macrofauna and they can affect the composition of primary producers and 472
ecosystem productivity by changing seedbed conditions, soil characteristics, water flow, nutrients 473
and carbon, and plant relationships. There is indirect evidence that they strongly influence the 474
composition of the herbaceous plant community. Changes in the tree seedling community 475
attributed to exotic earthworms suggest that the composition of the tree layer will eventually change 476
(Drouin et al. 2014, Frelich et al. 2006). However, an association between earthworm distribution 477
and understory vegetation structure in the field is not necessarily a causal relationship since the 478
correlation between the two can be a common response to human disturbances, even for 479
disturbances that date back several decades. However, there are good reasons to assume that the 480
invasion by earthworms of forest soils causes a change in the structure and composition of 481
understory plant communities. Consequences attributable to invasive exotic earthworms include 482
changes in forest soil structure (McLean and Parkinson 1997) and reduction or eradication of the 483
bedding layer (Edwards and Bohlen 1996). This can affect species in different ways; herbaceous 484
species in the understory vary according to their placement of the root system in the soil and species 485
whose roots are limited to the organic layer might be negatively affected while those whose roots 486
penetrate into the mineral soil might be positively affected. Furthermore, according to Wardle 487
(2002), when earthworms transform the structure of a fungus-dominated soil into a bacteria-488
dominated soil, the relationships between the roots and the plant are affected. The loss of 489
mycorrhizae can have negative effects on the root function of plants (Lawrence et al. 2003), plant 490
growth (Gundale, 2002) and plant community assemblages (Holdsworth et al. 2007). Therefore, 491
species may be affected differently depending on their mycorrhization rates. 492
In this respect, we wanted to test the hypothesis that the abundance of earthworms influences the 493
structure of forest understory plant communities independently of other abiotic and biotic factors, 494
including the history of the site. To do this, we asked two questions: 495
1) Is there a correlation between the structure and community composition of understory plant 496
species and the abundance of earthworms? 497
13
2) If so, does this correlation exist independently of abiotic and historical variables? In other words, 498
does this correlation disappear by controlling for abiotic and historical variables? 499
500
2. Materials and Methods 501
502
Presentation of the study area 503
504
The sampling campaign was conducted in the summer of 2017 at Johnville Ecoforest Park (45.345° 505
N, 71.755° W) in the Estrie region of south-central Quebec, Canada. This park covers 224 ha, 85 506
of which is a peat bog (Grégoire et al. 2010), the rest being a mixed forest located about 300 km 507
south of the boreal forest. The dominant tree species are Acer rubrum Linnaeus, Betula papyrifera 508
Marshall, Abies balsamea Linnaeus, Betula alleghaniensis Britton. The park prohibits activities 509
that could have a negative impact on wetlands and forests, such as drainage, road construction, 510
motorized traffic, among others except for some recreational and educational activities intended 511
for the general public (L. DeSerres, personal communication). This study site is located in an area 512
that receives up to 1209 mm of precipitation per year and average temperatures range from -10.2°C 513
in January to 19.0° in July (Environment Canada 2018). 514
515
Sampling 516
517
Sampling was carried out at three sectors of the park that we will call "zones": the Plantation zone 518
(P) in the northeast, the Conservation zone (C) in the southeast and the Recreation zone (R) in the 519
southwest,which shelters the Lavigne spring that has supplied water to the villages surrounding the 520
site since 1919. The "P" zone was planted before the 1900s, mainly with forest species such as 521
white pine, red pine and maple. The "R" zone is a secondary forest that has developed on former 522
agricultural fields (Figure 1). 523
14 524
525
Figure 1. 1945 aerial photo of Johnville Ecoforest Park. 526
(source: Department of Energy, Mines and Resources, Canada). Flight line: A9429, Photo no. 56, 527
Latitude: 45°20'14'', Scale: 1/20 000. The red outline determines the approximate location of the 528
park. 529
530
Zone "C", which is located around the lakes, one of which has historically provided drinking water 531
for the village of Lennoxville, does not appear to have ever experienced significant anthropogenic 532
15
pressure. Indeed, the road leading into this part of the park was built with local materials around 533
1969. 534
535
We collected our samples from 87 plots of 50 cm X 50 cm each, along 18 transects perpendicular 536
to the roads or trails of the park. On the same path, in the same sector, the transects were parallel 537
to each other and equidistant by 50 m. For a given transect, the plots were placed 1m, 6m, 16m, 538
66m, and 116m from the road or path. We used this sampling design since many studies have 539
shown that earthworm density often decreases as one moves away from a road (Cameron and Bayne 540
2009; Hale et al 2008). In each plot, herbaceous species were identified and the abundance of each 541
was estimated by counting the number of stems. The number of earthworms per plot was quantified 542
using Lawrence and Bowers' (2002) mustard solution extraction method, in which a mustard 543
solution (10g/l) is poured on the soil previously cleared of litter and vegetation after counting the 544
number of herbaceous plant individuals. This solution causes earthworms to return to the surface. 545
All individuals observed for 15 to 20 minutes after application of the mustard solution were 546
counted. Lawrence and Bowers (2002) showed that this method is as effective as other methods 547
while being much faster. Since we could not identify juvenile individuals to species, we worked 548
only with the total abundance of earthworms. Environmental data were collected on the following 549
variables: (1) the thickness of the litter layer (in cm) was measured using a ruler; (2) soil drainage 550
was estimated from the absorption rate of the mustard solution by the soil and classified into three 551
categories. After pouring 5 liters of mustard solution onto the quadrat, drainage was deemed rapid 552
if it disappears within 5 min, moderate for 5-10 min and slow for 10 and more; (3) soil texture was 553
classified into the four categories (sand, silt, clay and organic matter) assessed taking into account 554
the most dominant constituent element. These elements have been classified according to a rapid 555
test as described by Saucier (1994, pp. 32-35); (4) Percent canopy cover was estimated using a 556
digital photo taken by a camera equipped with a hemispherical lens and the free LGA (Gap Light 557
Analyzer) software from the Cary Institute of Ecosystem Studies (www.caryinstitute.org). The 558
DBH (diameter at breast height) was measured with a tape on tree stems larger than 2cm to deduce 559
basal area. The DBH was been estimated in a circle of 2m radius with the center of the plot. 560
16 3. Statistical analyses
562 563
All statistical analyses were performed with R software (version 3.4.3). The relationship between 564
earthworm density and environmental conditions was determined using generalized mixed linear 565
models using the lmer function (lme4 library) with transect as a random variable and using the 566
quasi-Poisson distribution in our model to manage cases of overdispersion (Crawley 2012). We 567
tested the statistical significance of the relationships in these generalized linear models between 568
earthworm abundance and environmental variables such as distance from plots to roads, zone 569
(zoning in park sectors), percent canopy, basal area, bedding thickness, soil drainage, number of 570
stems and soil texture with ANOVAs by using the chi-square distribution and comparing nested 571
models (with/without the explanatory variable). 572
The relationships between the structure of understory vegetation and environmental variables were 573
determined using redundancy analysis (Legendre and Legendre 2012) using the vegan package 574
(version 2.4.6). We constructed a matrix of the relative abundances of each herbaceous species 575
(response variable) found in each quadrat. To do this, we used a Hellinger transformation from 576
abundances per plot to relative abundances (Legendre and Gallagher 2001). A Hellinger 577
transformation is available in the vegan library of R under the decostand function (). This 578
transformation is appropriate for our species abundance data because the proportion of zeros in the 579
matrix is high (92%), and this avoids double zeros being considered in the calculation of similarity 580
between plots (Legendre and Gallagher 2001). This produces a matrix (V) that describes the 581
relative abundance of each plant species in each quadrat. Next, we constructed a matrix of 582
explanatory variables (E). This matrix describes the values of each environmental variable, 583
including the zone in which the plot is found, plus the abundance of earthworms found in each 584
quadrat. Having different units, the environmental variables in matrix E were standardized before 585
calculating the distance measurements used to perform the ordination analyses (Borcard et al. 586
2011). Some variables were ln-transformed before analysis as ln(x) or ln(x+1) on a case-by-case 587
basis to ensure that their residuals were distributed according to a normal distribution. The 588
abundance of earthworms was also included in matrix E; these abundances were transformed into 589
ln(x+1), where x is the number of individuals recorded. We related the vegetation (V) and 590
environmental E matrices using redundancy analysis (RDA) via the RDA function of the vegan 591
17
library. Null probabilities, associated with these models, were determined by permutation tests, 592
using 1000 permutations. The analysis was done in three steps: 593
Step 1: We tested the null hypothesis that there is no association between earthworm abundance 594
and vegetation structure, without reference to other environmental variables, using an RDA that 595
relates the matrix V to only the transformed abundance of earthworms. The rejection of this null 596
hypothesis demonstrates that there is an association between the abundance of earthworms and the 597
structure of vegetation. 598
Step 2: An RDA was then performed using all environmental variables without the abundance of 599
earthworms. We retained the significant explanatory variables by progressive selection using the 600
vegan ordiR2step function. A significant relationship shows that there is an association between 601
some of these environmental variables and vegetation structure. 602
Step 3: Then the RDA was redone using the environmental variables selected in Step 2 plus the 603
transformed abundances of earthworms. If the structure and composition of vegetation is affected 604
by earthworm abundance independently, or in addition to other environmental variables, then this 605
variable will have a significant association in the model. If, on the other hand, the association 606
between the structure and composition of vegetation and earthworms is caused only by a common 607
response to other environmental variables, then the abundance of earthworms will lose its 608
significance in this model. 609 610 4. Results 611 612 Earthworm community 613 614
A model linking the abundance of earthworms according to the three zones shows that the 615
abundance of earthworms differs from one zone to another (p<0.001). Earthworms are present in 616
large quantities in the Recreation and Plantation zones while they are almost absent in the 617
Conservation zone. We observed only one earthworm in the Conservation zone while we observed 618
637 and 583 earthworms in the Recreation and Plantation Zones, respectively (Figure 2). 619
18 620
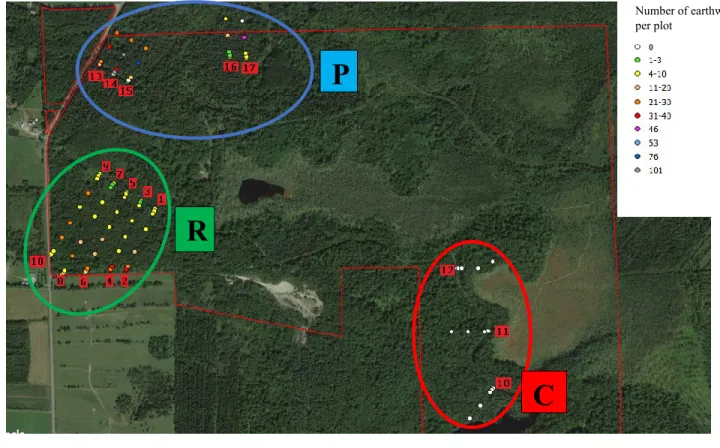
Figure 2. Sampling plan and illustration of earthworm abundances per plot. 621
Google aerial image/ unknown year (Municipalité régionale de comté du Haut St-François), P = 622
Plantation, R = Recreation, C = Conservation, the numbers 1 to 18 represent the number of each 623
transect. 624
Contrary to our hypotheses, earthworms, in the two zones (R and P) where they are abundant, are 625
not distributed according to any environmental variable. Their abundance is not significantly 626
correlated to any of the response variables (bedding thickness, soil texture, drainage, moisture, 627
DBH, canopy opening, basal area), including distance from a source of human disturbance, whether 628
a road or a walking trail. 629
630
Influence of earthworm abundance on the structure of forest understory plant communities 631
632
A redundancy analysis (RDA) of the structure (V) of the herbaceous community as a function of 633
earthworm abundance shows that the two are significantly associated (F1,85 = 3.1352, p = 0.001).
634
However, in the stepwise selection of variables, the only environmental variables selected that had 635
P
R
C
Number of earthworms per plot19
a significant association with the structure of the understory herbaceous communities were the zone 636
in which the plot was found. In particular, the redundancy analysis of the structure (V) of the 637
herbaceous community according to zone (Z) shows that the latter has a significant response (F1,85
638
= 4.6439, p = 0.001). Thus, the vegetation structure of the understory is associated with both the 639
zone and the abundance of earthworms. On the other hand, there is also a strong association 640
between the zone and the abundance of earthworms. A third redundancy analysis (RDA) of the 641
structure (V) of the herbaceous community as a function both of the abundance of earthworms and 642
the zone together shows that earthworms do not have a significant response (F1,84 = 0.9439, p =
643
0.5246) by controlling for the zone but the zone remains significant (F1,84 = 2.3979, p = 0.0013)
644
when controlling for earthworm abundance. Figure 3 summarizes the RDA and shows that the 645
herbaceous species of the Johnville woodland are structured into 3 communities spread over the 3 646
sectors of this territory. 647
20 648
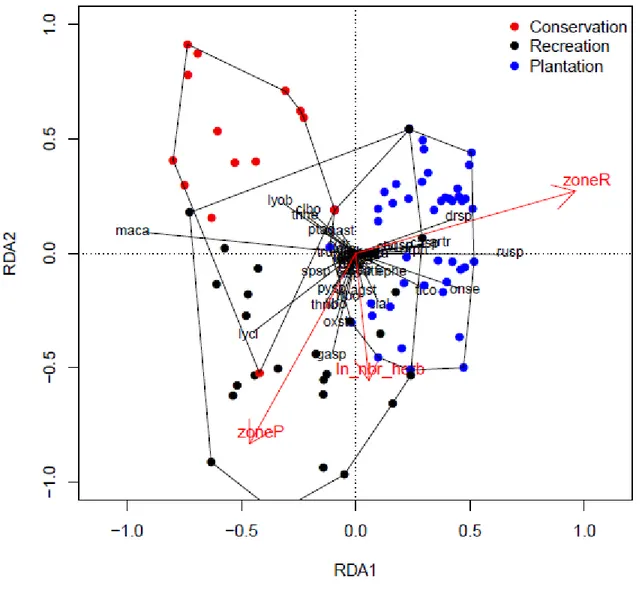
Figure 3. Ordination of understory plant community from Johnville ecoforest park. 649
The output of an RDA shows 3 distinct zones (Conservation zone in red, Recreation zone (R) in 650
black and Plantation zone (P) in blue. The meaning of the plant species codes is given in the 651 appendix. 652 653 5. Discussion 654 655
In our study, as in several other studies (for example, Frelich et al. 2006; Drouin et al, 2016), there 656
is an association between the abundance of earthworms and the structure of understory vegetation. 657
Contrary to our expectations, we did not detect an association between current anthropogenic 658
21
disturbances (distance from roads and trails) and the abundance of earthworms. However, there is 659
a very clear association between the historical use of the site and the abundance of earthworms. At 660
Johnville Park, the three sectors (zones) have experienced different human activities in the past. 661
The Plantation zone is currently occupied by conifers originally planted on an old farm. The 662
Recreation zone, dominated by yellow birch, is a younger secondary forest that has also developed 663
on former agricultural land. These two zones have experienced agricultural activities in the past 664
and anthropogenic pressure has been further encouraged by the alignment of access roads for water 665
intake work from the site's source to supply water to surrounding villages, including the current 666
town of Lennoxville. This activity dates back to 1919 (History of the Johnville Woodlands, 2002), 667
i.e. nearly 100 years ago, before which there were agricultural activities. Agricultural activities are 668
pointed out because they have a great potential to be associated with the spread of earthworms, 669
which could partly explain the presence and high density of earthworms in these zones. The 670
Conservation zone remained isolated until 1979 when a road was built to access it. This may partly 671
explain the very low density of earthworms (1 worm sampled throughout the area) compared to the 672
other two zones. It is also important to note that the only earthworm in this zone was sampled close 673
to the road, at 1 meter. This indicates that this zone remains well preserved and that the introduction 674
of worms into this part of the park is probably recent. 675
676
There is an additional reason that could explain this uneven distribution of earthworm densities at 677
the study site. According to information gathered from current park managers, roads and hiking 678
trails in the Recreation and Plantation sectors have been developed with materials collected 679
elsewhere, potentially containing earthworms, while for roads in the Conservation Zone, the 680
materials used have been dug on site in the zone itself. The Conservation Zone has been lnged in 681
the past but does not have an agricultural past. Since the natural dispersion of earthworms is very 682
slow, at most 10 meters per year (Addison 2009), the most likely explanation is that earthworms 683
were introduced into the Recreation and Plantation zones by agricultural activities prior to 1919, 684
the year the site was acquired by the Town of Lennoxville, and that earthworms have not yet 685
invaded the Conservation Zone. 686
22
Although the current distribution of earthworms and understory vegetation structure appears to 688
follow the history of the site, does this necessarily mean that earthworms do not have an effect on 689
vegetation structure? Indeed, there is a considerable spatial variation in the abundance of 690
earthworms within the Recreation and Plantation sites, ranging from 0 to 404 individuals per m2
691
(101 worms being the largest count on a 0.25 m2 plot). On the other hand, by including the zone
692
and abundance of earthworms in the RDA, the abundance of earthworms lost its statistical 693
significance, but the zone continued to be significant. This suggests that the association between 694
earthworm abundance and vegetation structure was due to the fact that both respond simultaneously 695
to differences in historical use of the site (zoning). Within each zone, the variation in earthworm 696
abundance is not correlated with differences in understory vegetation structure. Like the 697
distribution of earthworm abundances, the herbaceous species in this park are structured according 698
to the land use history of the park, contrary to our working hypothesis that this structure would be 699
determined by the abundances of earthworms. Here too, we are led to believe that it is the past of 700
each zone that is decisive in the assertion that the forest response is strongly correlated to the type 701
of earthworm species in place (Bohlen et al. 2004). Our results and conclusions are based on 702
observational data. There is a need for experimental studies to try to approach the impact of exotic 703
earthworms on forest understory species. 704
23 6. Acknowledgements
705 706
We thank David R. Sanchez for his participation in the sampling campaign, and Mathieu Dufresne 707
of the Johnville Park for his help. This research was supported by an NSERC Individual Discovery 708
Grant to BS. 709
710 711
24 7. References
712 713
Addison, J.A. 2009. Distribution and impacts of invasive earthworms in Canadian forests 714
ecosystems. Biol. Invest. 11, 59–79. 715
Beauséjour, R., Handa, I. T., Lechowicz, M. J., Gilbert, B., & Vellend, M. 2015. Historical 716
anthropogenic disturbances influence patterns of non-native earthworm and plant invasions 717
in a temperate primary forest. Biolnical Invasions, 17(4), 1267-1281. 718
Bohlen, P.J., Pelletier. D., Groffman, P.M., Fahey, T.J., Fisk, M.C. 2004a. Ecosystem 719
consequences of exotic earthworm invasion of north temperate forests. Ecosystems 7:1–12. 720
Bohlen, P.M. Groffman, T.J. Fahey, M. Fisk, E. Suarez, D.M. Pelletier and R.T. Fahey. 2004C. 721
Ecosystem consequences of exotic earthworms invasion of north temperate forests. 722
Ecosystems, 7: 1-12. 723
Borcard, Gillet & Legendre. 2011. Numerical Ecolny with R. Springer New York. 724
Cameron, E.K., Bayne, E.M. 2009. Road age and its importance in earthworm invasion of 725
northern boreal forests. J Appl Ecol 46:28–36. 726
Cameron, E.K., Bayne, E.M, Clapperton, M.J. 2007. Human-facilitated invasion of exotic 727
earthworms into northern boreal forests. Ecoscience 14:482–490. 728
Crawley, M.J. 2012. The R book. John Wiley and Sons. 729
Drouin, M., Bradley, R., Lapointe, L., 2016. Linkage between exotic earthworms, understory 730
vegetation and soil properties in sugar maple forests. Forest Ecolny and Management. 364, 731
113-121, Mar. 15, 2016. ISSN: 0378-1127. 732
Drouin, M., Bradley, R., Lapointe, L., Whalen, J. 2014. Non-native anecic earthworms 733
(Lumbricus terrestris L.) reduce seed germination and seedling survival of temperate and 734
boreal trees species. Applied Soil Ecolny, ISSN: 0929-1393, Vol: 75, Page: 145-149. 735
Edwards, C.A., Bohlen PJ. 1996. Mycorrhizal symbiosis. In: Edwards, C.A., Bohlen PJ, eds. 736
Biolny and ecolny of earthworms. London, UK: Chapman & Hall, 64–80. 737
25
Environnement Canada. 2018. 1981 to 2010 Canadian Climate Normals station data. 738
«http://climate.weather.gc.ca/climate_normals/» (Accessed 09 April 2018). 739
Frelich, L.E., Hale, C.M., Scheu S, Holdsworth, A.R., Heneghan, L., Bohlen, P.J., Reich, P.B. 740
2006. Earthworm invasion into previously earthworm-free temperate and boreal forests. 741
Biol Invasions 8:1235–1245. 742
Grégoire Taillefer, A., & Wheeler, T. 2010, Effect of Drainage Ditches on Brachycera (Diptera) 743
Diversity in a Southern Quebec Peatland, The Canadian Entomolnist, 2, p. 160, BioOne 744
Complete, EBSCOhost, viewed 9 April 2018. 745
Gundale, J. M. 2002. Influence of exotic earthworms on the soil organic horizon and the rare fern 746
Botrychium mormo. Conserv. Biol., 16:1555–1561. 747
Hale, C.M., Frelich L.E., Reich ,P.B. 2005. Exotic European earthworm invasion dynamics in 748
northern hardwood forests of Minnesota, USA Ecol Appl. 15(3):848–860. 749
Hale, C. M., Frelich L, Reich P., Pastor J. 2008. Exotic earthworm effects on hardwood forest 750
floor, nutrient availability and native plants: a mesocosm study. – Oecolnia 155: 509–518. 751
Hendrix, P., Bohlen, P. 2018. Exotic Earthworm Invasions in North America: Ecolnical and 752
Policy Implications. Bioscience [serial online]. September 2002;52(9):801. Available from: 753
Academic Search Complete, Ipswich, MA. Accessed August 1. 754
Holdsworth, A. R., L. E. Frelich and Reich, P. B. 2007. Effects of earthworm invasion on plant 755
species richness in northern hardwood forests. Conserv. Biol., 21:997–1008. 756
Kalisz, P.J., Dotson, D.B. 1989. Land-use history and the occurrence of exotic earthworms in the 757
mountains of eastern Kentucky. Am Midl Nat 122:288–297 758
Lawrence, A. P., & Bowers, M. A. 2002. Short communication: A test of the ‘hot’ mustard 759
extraction method of sampling earthworms. Soil Biolny And Biochemistry, 34: 549-552. 760
doi:10.1016/S0038-0717(01)00211-5. 761
Legendre, P., Gallagher, E.D., 2001. Ecolnically meaningful transformations for ordination of 762
species data. Oecolnia 129, 271-280. 763
26
Legendre, P., Legendre, L., 2012. Numerical Ecolny, third ed. Elsevier, Amsterdam, The 764
Netherlands. 765
Reynolds, J.W. 1977. The Earthworms (Lumbricidae and Sparganophilidae) of Ontario. Toronto 766
(ON): Royal Ontario Museum Miscellaneous Publication. 767
Reynolds, J.W., 1994. The distribution of the earthworms (Oligochaeta) of Indiana: a case for the 768
post quaternary introduction theory for megadrile migration in North America. 769
Megadrilnica 5:28–32 770
Sackett T.E., Smith SM, Basiliko, N. 2012. Exotic earthworm distribution in a mixed-use 771
northern temperate forest region: influence of disturbance type, development age, and soils. 772
Can J Forest Res 42:375–381. 773
Saucier, J.P., 1994. Le point d’observation écolnique : normes techniques : [Charlesbourg] : 774
Gouvernement du Québec, Ministère des ressources naturelles, 1994. 775
Shartell, L.M., Lilleskov, E.A., Storer, A.J. 2013. Predicting exotic earthworm distribution in the 776
northern Great Lakes region. Biol Invasions 15:1665–1675. 777
Suarez, E.R., Tierney, G.L., Fahey TJ, Fahey, R. 2006 Exploring patterns of exotic earthworm 778
distribution in a temperate hardwood forest in south-central New York, USA. Landsc Ecol 779
21:297–306. 780
Tiunov, A.V., Hale, C.M. Holdsworth, A.R., Vsevolodova-Perel, T.S. 2006. Invasion patterns of 781
Lumbricidae into the previously earthworm-free zones of northeastern Europe and the 782
western Great Lakes region of North America. Biol Invasions 8:1223–1234. 783
Wardle, D., 2002. Communities and ecosystems: linking the aboveground and belowground 784
components. Princeton University Press, Princeton, New Jersey. 785
27 CHAPITRE 3 786
Effet des vers de terre exotiques sur les plantes de sous-bois de forêt. 787
788 789
Titre original: Effect of exotic earthworms on forest understory plants (sera soumis à Botany) 790
791
Le présent chapitre présente une étude expérimentale qui a été réalisée en mettant en place un 792
dispositif expérimental fait de 96 mésocosmes dans lesquels nous avons transplanté 12 espèces 793
herbacées représentatives d’une communauté de sous-bois afin de mesurer l’effet d’un ver de 794
terre introduit sur ces dernières. 795
796
Les résultats de cette étude montrent qu’après deux saisons de croissance, seule l’espèce 797
Phegopteris connectilis a répondu de façon significative à l’effet des vers de terre et sa 798
biomasse a augmenté en présence de ceux-ci. 799
800
De cette étude, on a conclu que si l’effet des vers de terre L. terrestris sur les sols dans nos 801
mésocosmes est semblable aux effets observables sur les sols agricoles, il est possible que 802
l’effet positif de cette espèce soit dû à l’augmentation de fertilité causée par l’augmentation de 803
décomposition de la matière organique du sol. Si c'est bien le cas, nous ne pouvons pas 804
expliquer pourquoi les autres espèces n’ont pas répondu de la même façon. 805
806 807
28
Effect of exotic earthworms on forest understory plants 808
Claude Ndabarushimana, Bill Shipley* 809
Laboratoire d’Écologie Fonctionnelle 810
Département de biologie, Université de Sherbrooke, Sherbrooke (QC) Canada J1K 2R1 811
812
Abstract 813
814
It has been hypothesized that forests in Canada and the northern United States are experiencing 815
changes in communities of herbaceous forest understory species following an invasion of exotic 816
earthworms. These earthworms were introduced during colonial times into these forests that 817
have existed in the absence of earthworms since the end of the Wisconsin glaciation over 10,000 818
years ago. In this study we experimentally test if the addition of Lumbricus terrestris changes 819
the probability of survival and growth of understory plants and, if so, the mechanisms by which 820
these invasive worms affect the herbaceous plants in these forests. To understand these 821
mechanisms, we chose plant species that have functional traits that can enhance or reduce the 822
hypothetical negative effects created by two environmental changes caused by earthworms. 823
Thus we set up an experimental system made of 96 mesocosms in which we transplanted 12 824
herbaceous species representative of a community of forest understory selected according to 825
their abundance to ensure that we had enough individuals. The species were chosen according 826
to two traits: (i) the rooting position of the plants (2 levels, either in organic matter or in mineral 827
soil) and (ii) the rate of root mycorrhization (2 levels, strongly mycorrhized or weakly 828
mycorrhized). After two growing seasons, only Phegopteris connectilis responded significantly 829
to the effect of earthworms and its biomass increased in their presence. If the effect of 830
earthworms on soils in our mesocosms is similar to the effects on agricultural soils, it is possible 831
that the positive effect of this species is due to increased fertility caused by the increased 832
decomposition of soil organic matter. 833
Keywords: Earthworms, forest understory plant communities 834
29 835
30 836 1. Introduction 837 838 839
Human impacts on global ecosystems are now so pervasive that many speak of the 840
Anthropocene era (Sprankling, 2017). One of these impacts is the introduction of exotic species. 841
When the abundance of introduced species becomes significant, and when the impact of these 842
introduced species on these ecosystems becomes major, we speak of invasive alien species. The 843
majority of earthworm species in northern North America are among these invasive alien 844
species. The Wisconsin glaciation decimated almost all of the native earthworms in Canada and 845
the northern United States. The forests of this part of the American continent have evolved in 846
the absence of these worms (Portes 1977, James 1998). Soils containing earthworms in this 847
region, even today, are mainly associated with human activities (agriculture, horticulture, etc.) 848
and their relative abundance and specific composition are strongly linked to soil type, climate, 849
vegetation, topography, land use history and especially its history of exotic species evasions 850
(Hendrix and Bohlen, 2002). Although earthworms are increasingly found in forest 851
environments, there are still several forest areas without earthworms (Hedrix and Bohelen, 852
2002). This is particularly the case for areas that were not subject to human influence after the 853
glaciation. This is because, in the absence of human introductions, their propagation is only 854
about 5-10 meters per year depending on the region (Addison 2009, Cameron et Bayne 2009). 855
856
Earthworms are often referred to as "ecosystem engineers" because they significantly alter the 857
structure of the soil. In particular, they directly modify decomposition rates, the physical 858
structure of the soil and the microbial communities of the soil. Therefore, it is reasonable to 859
believe that the introduction of these species into ecosystems that have developed without these 860
species for more than 10 000 years will have significant impacts. One of the first consequences 861
of introducing earthworms into a forest ecosystem is the reduction of the dead leaf layer (litter). 862
Exotic earthworm invasions have been associated with decreased forest soil thickness and the 863