Sélection de l’habitat, dynamique de population et
utilisation de l’espace du caribou des monts Torngat
Mémoire
Édouard Bélanger
Maîtrise en biologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Édouard Bélanger, 2017
Sélection de l’habitat, dynamique de population et
utilisation de l’espace du caribou des monts Torngat
Mémoire
Édouard Bélanger
Sous la direction de :
iii RÉSUMÉ
Le caribou montagnard des monts Torngat situé dans le nord du Québec et du Labrador connait présentement un déclin rapide. Cependant, la démographie, l’utilisation de l’espace et la sélection de l’habitat en relation avec le déclin de cette population sont méconnues. À l’aide de 35 caribous adultes munis de colliers satellites, nous avons évalué la sélection des habitats à deux échelles spatiales, la survie, et l’effet de la chasse ainsi que du chevauchement avec la population voisine de caribous migrateurs de la Rivière-George. Nous avons démontré que la sélection de l’habitat est similaire entre les deux échelles spatiales étudiées, mais variable selon les saisons. Nos résultats suggèrent que la sélection est déterminée par l’accessibilité et la disponibilité des ressources alimentaires en hiver et durant la pré mise-bas, l’évitement des insectes en été, et par la présence de plantes graminoïdes lors du rut. Bien que la prédation soit connue pour être le principal facteur limitant les populations et la sélection chez le caribou lors de la mise-bas, aucun comportement anti-prédateur n’a été détecté chez les femelles lors de cette saison. Nos résultats démontrent que le déclin est principalement attribuable à une faible survie des femelles adultes due à la chasse et à la prédation. Nous avons observé que l’utilisation de l’aire de distribution du caribou des monts Torngat par le troupeau Rivière-George a grandement diminué durant les 25 dernières années en raison de leur déclin. Ceci pourrait causer une diminution du flux génique et des possibilités d’immigration entre les deux troupeaux. Nos modèles démographiques suggèrent que le caribou des monts Torngat continuerait de décliner rapidement si aucune mesure de gestion n’était prise de façon à augmenter la survie des adultes.
iv ABSTRACT
The Torngat Mountains caribou herd in northeastern Québec-Labrador is rapidly declining. Few studies have examined the causes of this decline and little is known about the habitat selection, survival and space use of this herd. Using 35 caribou equipped with satellite collars between 2011 and 2015, we evaluated the Torngat Mountains caribou habitat selection at two different spatial and temporal scales, survival, and effect of harvest on future population trends. We also evaluated the Torngat Mountains caribou space use in relationship with its neighbor, the Rivière-George migratory caribou. We found little variation in habitat selection between the two spatial scales studied. However, there was variation in factors limiting habitat selection among different seasons. Habitat selection was primarily driven by resource availability and abundance during winter and pre-calving, by insect avoidance in summer and by the presence of graminoids during the rut. Although predation is known to be the main limiting factor of caribou populations and habitat selection by female caribou during calving, we found no evidence of predator avoidance behavior during this season. Moreover, we showed that the population decline was primarily attributed to low survival of adult females due to subsistence hunting and predation. We also found that the overlap between the two populations has decreased in the last 25 years due to a decline in Rivière-George herd abundance. This could result in decreased genetic exchanges and immigration between herds. Using demographic models, we showed that the Torngat Mountains caribou would rapidly decline if no management actions were taken to increase adult survival.
v TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ...iv
TABLE DES MATIÈRES ... v
LISTE DES TABLEAUX ... vii
LISTE DES FIGURES ... viii
LISTES DES ANNEXES ... ix
REMERCIEMENTS ... xi
AVANT-PROPOS ... xvi
INTRODUCTION GÉNÉRALE ... 1
Contexte théorique ... 1
Interactions entre la sélection de l’habitat et la dynamique de population ... 1
Sélection de l’habitat ... 1
Facteurs qui affectent la sélection de l’habitat ... 3
Les fonctions de sélection des ressources ... 3
Dynamique des populations et paramètres démographiques... 4
Modèles démographiques ... 5
Le caribou ... 6
L’importance du caribou ... 7
La sélection de l’habitat du caribou ... 7
Les caribous des monts Torngat et de la rivière George ... 7
Objectifs ... 9 CHAPITRE PRINCIPAL... 10 RÉSUMÉ... 11 ABSTRACT ... 12 KEYWORDS ... 13 STUDY AREA ... 16 METHODOLOGY ... 18 Habitat selection ... 18
Survival and demography ... 20
Space use ... 22
RESULTS ... 23
Habitat selection ... 23
Survival and demography ... 32
vi
DISCUSSION ... 34
Habitat selection by Torngat Mountains caribou ... 34
Survival and demography of the Torngat Mountains caribou ... 36
Space use ... 37 MANAGEMENT IMPLICATIONS ... 37 ACKNOWLEDGMENTS ... 38 LITERATURE CITED ... 39 CONCLUSION GÉNÉRALE ... 45 Sélection de l’habitat ... 45 Tendances démographiques ... 47
Le déclin du caribou des monts Torngat et sa relation spatiale avec le troupeau Rivière-George ... 48
Limites de l’étude ... 51
Perspectives futures ... 52
BIBLIOGRAPHIE GÉNÉRALE ... 55
vii LISTE DES TABLEAUX
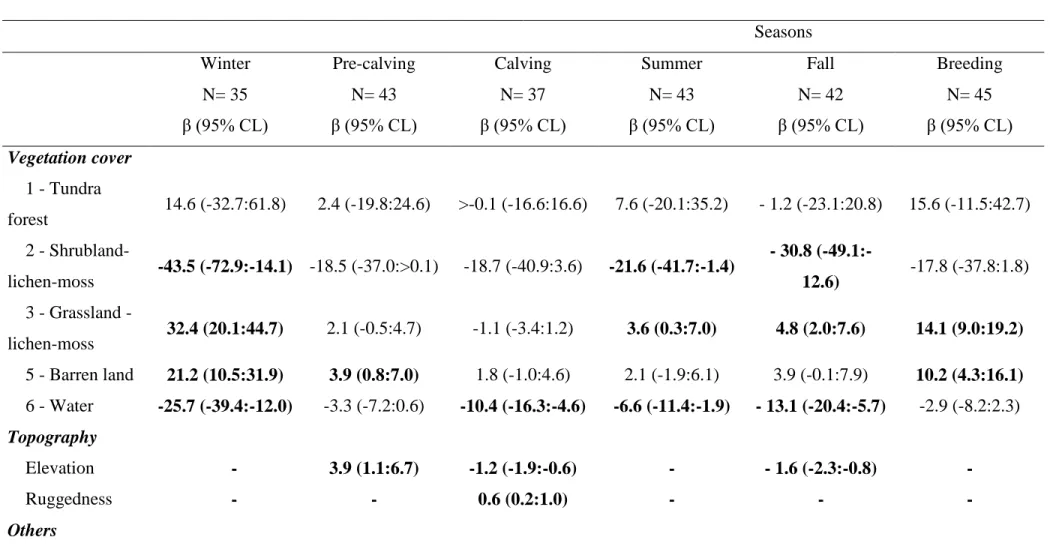
Tableau 1. Contribution des auteurs de l’article scientifique. ... xvii Table 2. Parameter estimates (β) and 95% confidence limit (CL) of the most parsimonious seasonal models (see appendix 3) of home-range resource selection by Torngat Mountains caribou in the Northern Quebec-Labrador peninsula, from 2011 to 2015. Random effect coefficients and their standard error (SE) as well as K-fold cross validation using Spearman correlation (Spearman rs) and their standard deviation (SD) are presented. Bold β and 95% CL represent 95% confidence
intervals that excluded 0. N represent the number of caribou-seasons. ... 24 Table 3. Parameter estimates (β) and 95% CL of the most parsimonious seasonal models (see appendix 5) of within home-range resource selection by Torngat Mountains caribou in the Northern Quebec-Labrador peninsula, from 2011 to 2015. Random effect coefficients and their standard error (SE) as well as K-fold cross validation using Spearman correlation (Spearman rs) and their standard deviation (SD) are presented. Bold β and 95% CL represent 95% confidence intervals that
excluded 0. ... 29 Table 4. Annual survival with 95 % confidence intervals (CI) and population growth rate (λ) with standard deviation (SD) of the Torngat Mountains caribou herd under various hunting scenarios. Annual survival is from a sample of 35 adult caribou marked with satellite collars between 2011 and 2016 in the Torngat region, Quebec and Labrador, Canada. Growth rates (λ ± SD) and time to reach critical population threshold in years (CPt ± SD; pop. size ≤ 50) are estimated from stochastic models. ... 32
viii LISTE DES FIGURES
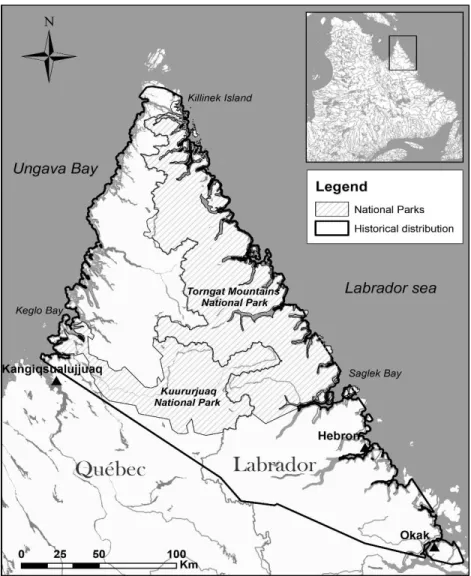
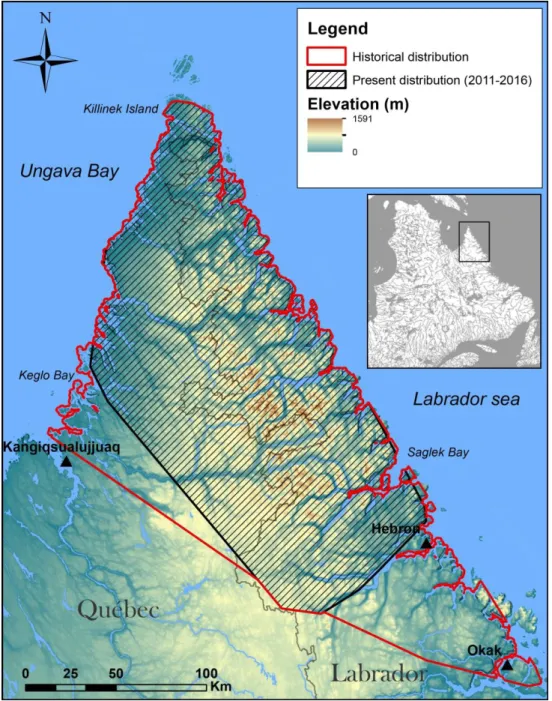
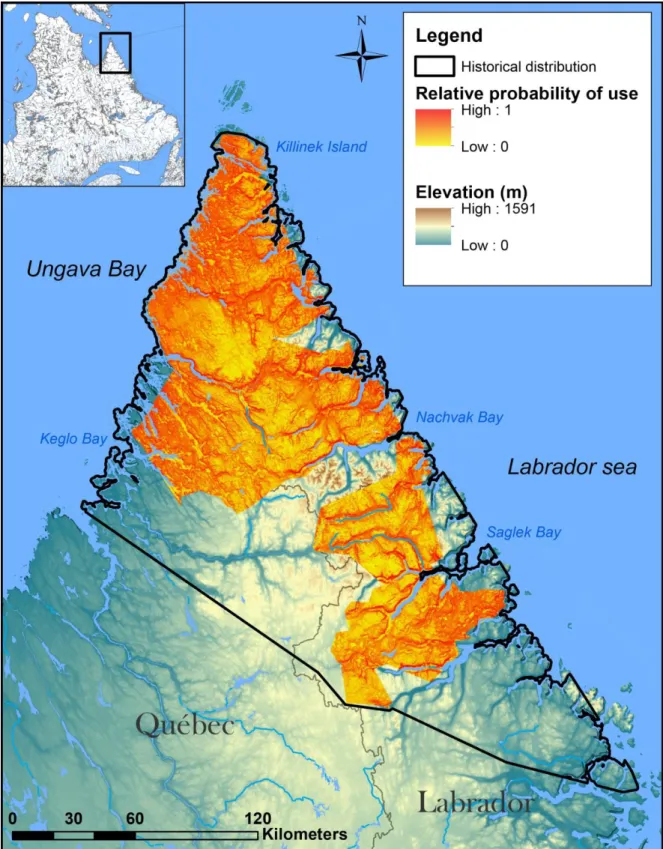
Figure 1. Historical distribution of the Torngat Mountains caribou herd based on a 100% minimum convex polygon (MCP) of the locations of 10 adult caribou monitored from 1988 to 1999 (data from Schaefer and Luttich 1998) coupled with the 100% MCP of 35 adult caribou monitored between 2011 and 2016 in northern Québec and Labrador, Canada. A buffer of 1,042 m was created around the continent representing the longest trip undertaken by a caribou on ice. The 100% MCP was then clip using this buffer to eliminate sea segments considered unavailable for caribou. The total area is 33 843 km2. ... 17
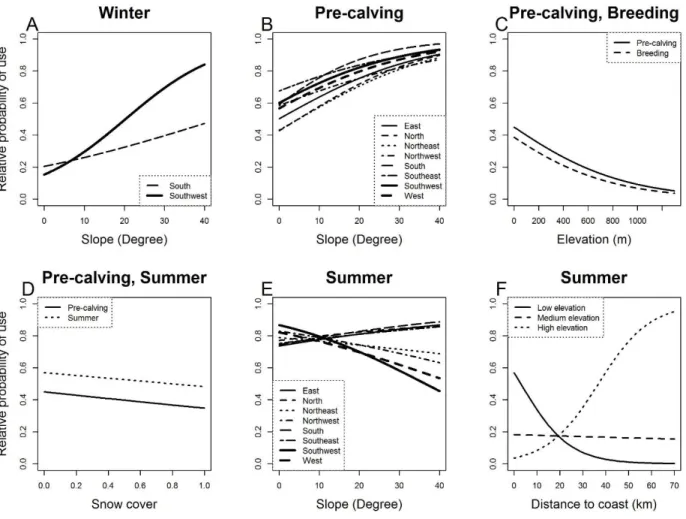
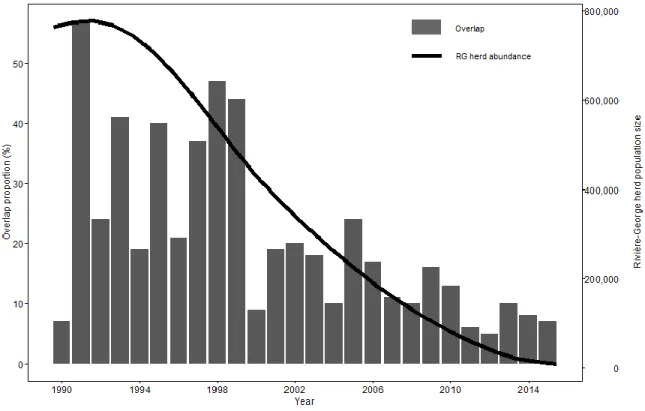
Figure 2. Relative probability of use as a function of (A) snow cover during pre-calving for different elevations, (B) elevation during calving for different terrain ruggedness, (C) distance to coast during summer and (D) elevation during fall at the home-range scale by Torngat Mountains caribou from 2011 to 2015 in the Torngat region, Quebec-Labrador peninsula, Canada. ... 26 Figure 3. Relative probability of use as a function of aspect for different slopes during (A) winter, (B) pre-calving, and (E) summer, and as a function of (C) elevation during the pre-calving and breeding, (D) snow cover during pre-calving, and summer and (G) elevation according to distance to coast during summer for within home-range resource selection of Torngat Mountains caribou from 2011 to 2015 in the Torngat region, Quebec-Labrador peninsula, Canada. ... 27 Figure 4. Overlap between the distribution of the Rivière-George caribou herd and the distribution of the Torngat Mountains caribou herd between 1990 and 2015 in Quebec and Labrador, Canada. The black line represents variations in the population size of the Rivière-George herd. An average of 31 RG caribou per year (min. 19, max. 84) were marked with satellite collars during the study period... 34 Figure 5. Distribution historique (1988-2016) et distribution récente (2011-2016) du caribou des monts Torngat basées sur la méthode des polygones convexes minimums à 100%. La distribution historique est basée sur les localisations de 10 caribous adultes suivis de 1988 à 1999 (données provenant de Schaefer and Luttich 1998) et sur les localisations de 35 caribous adultes suivis de 2011 à 2016. La distribution présente est basée sur les mêmes 35 caribous adultes suivis de 2011 à 2016 ainsi que sur l’inventaire aérien fait en 2014 (Couturier et al. 2015). Les aires de distribution sont respectivement de 33 843 km2 et 26 310 km2 pour la distribution historique et récente. ... 50
ix LISTES DES ANNEXES
Appendix 1: Vegetation classes used to assess resource selection by Torngat Mountains caribou (2011-2015). The vegetation classes are from the database of 2010 of the North American Land Cover at 250 m spatial resolution. Produced by Natural Resources Canada/ The Canada Centre for Mapping and Earth Observation (NRCan/CCMEO); United States Geological Survey (USGS);
Insituto Nacional de Estadística y Geografía (INEGI); Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO) and Comisión Nacional Forestal (CONAFOR). Eleven
classes were present in the study area and were pooled into 6 classes based on land cover, food resources for caribou and availability of the classes in the area... 65 Appendix 2. Covariates used in the mixed-models to assess resource selection by Torngat
Mountains caribou, Québec and Labrador, Canada from 2011 to 2015. ... 67 Appendix 3. Candidate mixed-effects models describing home-range seasonal resource selection by Torngat mountains caribou in Northern Quebec- Labrador peninsula, Canada. The log-likelihood (LL), number of parameters (K), the Akaike Information Criterion (AIC), the delta AIC and Akaike Weight are presented. Bold model represent the selected model. ... 68 Appendix 4. Candidate mixed-effects models describing within home-range seasonal resource selection by Torngat Mountains caribou in Northern Quebec- Labrador peninsula. The log-likelihood (LL), number of parameters (K), the Akaike Information Criterion (AICc), the delta AICc and the Akaike Weight are presented. Bold model indicate the most parsimonious models. . 70 Appendix 5. Parameter estimates (β) and P values at α = 0.05 of equivalent seasonal models within 2 delta AICc (see Table 1) for resource selection by Torngat mountains caribou in the Northern Quebec-Labrador peninsula. Bold β and P values represent significant results with 95% CL. Italic β and P values represent variables not selected by the model selection. ... 72 Appendix 6. Candidate models describing Torngat mountains caribou adult survival in Northern Quebec-Labrador peninsula. The log-likelihood, number of parameters (K), the Akaike Information Criterion (AIC), the delta AIC and the Akaike weight are presented. Bold model represent the selected model. ... 74 Appendix 7. Parameter estimates (β), standard error (SE) and 95% confidence intervals (CI) of none-selected models but within 2 AIC explaining adult survival of Torngat Mountains caribou. Adult survival was estimated from a sample of 35 adult caribou marked with satellite collars
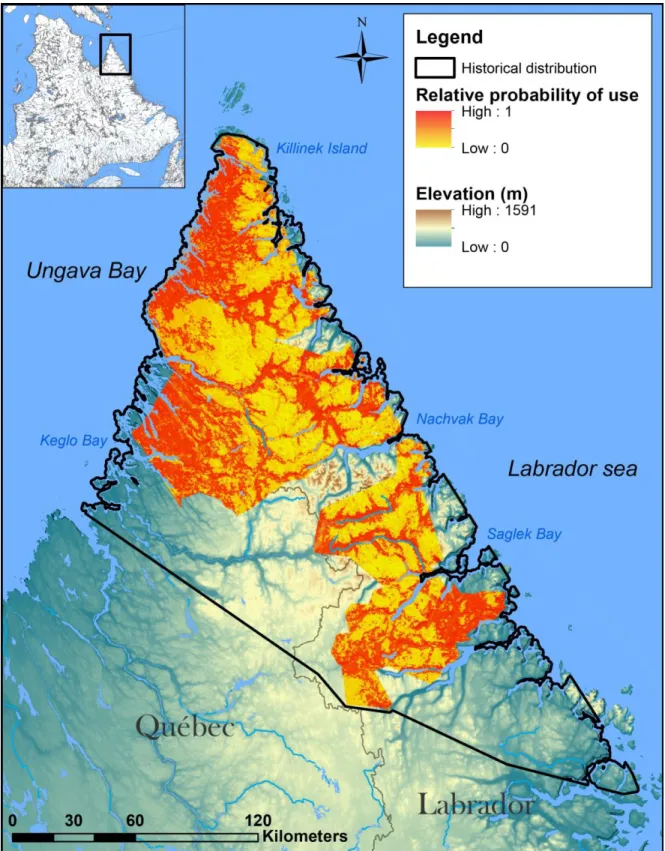
between 2011 and 2016. ... 75 Appendix 8. Annual survival with 95 % confidence intervals (CI) and population growth rate (λ) with standard deviation (SD) of the Torngat Mountains caribou herd under various hunting scenarios and initial population sizes. Initial population sizes represent respectively the lowest and highest values of the 2014 aerial survey’s confidence interval. Annual survival is from a sample of 35 adult caribou marked with satellite collars between 2011 and 2016 in the Torngat region, Quebec and Labrador, Canada. Growth rates (λ ± SD) and time to reach critical population threshold in years (CPt ± SD; pop. size ≤ 50) are estimated from stochastic models. ... 76 Appendix 9. Maps of relative probability of use (RPoU) at a 250 m2 scale per season for the period
2011-2015 using coefficient estimates for each variable of within home-range RSF for caribou of the Torngat Mountains. The RPoU ranges from 0 to 1 with 0 meaning avoided habitat and 1 selected habitat. The relative probability of use is restricted to the area used during the analysis, hereby the seasonal home-ranges of the marked caribou. For pre-calving and calving seasons, only
x
females were used for the RSF and for the RPoU. The distribution presented in the maps is the current range (2011-2016) defined by a 100% MCP. ... 77
xi REMERCIEMENTS
Les paragraphes qui suivent furent très difficiles à écrire. La raison est simple, je n’ai jamais été très bon rédacteur en français. Il m’est impossible de décrire à quel point je suis reconnaissant de l’aide que j’ai reçu tout au long de mes études, principalement lors de cette maitrise. Ce qui suit est un essai pour remercier toutes ces personnes qui m’ont aidé de proche ou de loin.
Je tiens à souligner que ma maîtrise a commencé bien avant mon inscription à l’Université Laval aux études supérieures. Elle a commencé au début de mon baccalauréat lorsque je réfléchissais à faire une maîtrise. Dès lors, de nombreuses personnes m’ont encouragé dans mes études et lors de mes emplois, et ont stimulé mon intérêt en sciences biologiques. Ces personnes ont participé, à leur manière, à ce projet, car elles m’ont permis d’obtenir cette maîtrise, mais aussi m’ont donné la confiance et les outils pour la réaliser. Je pense ici à mes amis au baccalauréat à Sherbrooke, principalement Véronique Demers, à Murray M. Humphries et Manuelle Landry Cuerrier de l’Université McGill, la team Red Squirrel Camp hiver’12, la team Anticosti automne’12 et la team Caw 2013 et 2014.
En premier lieu, je tiens à remercier mon directeur de recherche Steeve D. Côté. D’abord, pour l’aide et la confiance que tu m’as donnée tout au long de ce projet. Aussi, tu as su être présent lors de mes nombreuses demandes de rencontre rapide et « questions de couloir ». Merci pour les nombreuses occasions que tu m’as données d’aller présenter mes résultats un peu partout au Canada. Ces expériences m’ont beaucoup amené tant au niveau scientifique que professionnel. Je n’aurai pas eu l’occasion de me rendre dans les Torngats lors de ce projet, mais ce n’est pas faute de support de ta part. Si nous remontons un peu dans le temps : tu m’as fait confiance pour la 1re fois en m’engageant comme technicien à l’Île d’Anticosti. Cette expérience m’a permis de rencontrer d’autres membres de ton laboratoire. C’est à partir de ce moment que l’idée de faire une maîtrise dans Caribou Ungava s’est implantée. À noter aussi que cette opportunité a renforci ma curiosité scientifique et mes aptitudes à la cueillette de données scientifiques, entre autres l’abattage de cerf pour des « raisons scientifiques »… Aussi, merci pour l’initiation à la recherche qui en découla. Par la suite, tu m’as fait confiance une 2e fois, puis une 3e avec ton projet sur les chèvres de montagne à Caw Ridge. J’y ai en effet passé 2 étés et un peu d’un 3e. Je pourrais faire une thèse sur le temps que j’y ai passé
xii
et les choses que j’y ai apprises. Cependant, je tiens à souligner que cette expérience a été celle qui a le plus stimulé mon intérêt pour le comportement animal. Mon esprit a été bombardé de questions et réflexions sur le monde animal qui m’ont permis de grandement évoluer, et le font toujours aujourd’hui. À cette occasion, je tiens à remercier toutes les chèvres de montagne et marmottes de Caw Ridge, principalement 305.
Secondly, I wish to thank the Torngat wildlife, plants and fisheries secretariat for having intrusted me with the project. Thanks to Jamie Snook, Jennifer Mitchell, Bryan Wood, Beverly White and other members of the Secretariat for their support and help. I hope my thesis and article will help the management of the Torngat Mountains caribou and will meet your expectation.
Mathieu Leblond, postdoc, merci 1000 fois de m’avoir toujours bien accueilli lorsque je venais cogner à ton bureau sans préavis. J’ai toujours apprécié la façon dont tu m’amenais à réfléchir sur les problèmes écologiques et statistiques ou sur la rédaction.
Merci aux techniciens et biologistes du MFFP, Charles Jutras, Stéphane Rivard, Vincent Brodeur et Christian Dussault pour ce qui a trait aux données, mais aussi aux échanges concernant le projet. J’en profite aussi pour remercier Daniel Fortin, Jean-Pierre Tremblay et Gilles Gauthier pour leurs commentaires lors du proposé de recherche ou du présent mémoire. Merci à Gaétan Daigle et Aurélien Nicosia pour leur aide avec les statistiques. Je remercie aussi Frédéric Lesmerises pour son script R sur les domaines vitaux.
Maintenant, ceux à qui je dois énormément pour toutes sortes de raisons et toutes à leurs manières : le labo Côté-Tremblay! Sans vous, ce projet ne serait pas ce qu’il est. Sonia de Bellefeuille, pour ta charmante présence et ton dévouement aux étudiants. Caroline Hins, tu es celle qui m’a encouragé à tenter ma chance avec Caribou Ungava, celle qui a planté l’idée, et qui a toujours su me répondre avec un sourire malgré les températures parfois frigorifiantes du Vachon. Michael B. pour tes conseils, bien avant le présent projet, qui m’ont motivé à faire une maîtrise et ceux lors de celle-ci, merci. Sabrina P. pour les discussions de sélection de ressources, les scripts R et l’aide ArcGIS, je t’en dois une! Mael L., sans toi, je crois que j’en serais encore à mes analyses de RSF et spatiales. Merci pour ta patience et ton entrain à aider, ce fut grandement apprécié. Patrick M., maître chevrier et fidèle confident, tu as su
xiii
amener mes réflexions scientifiques à un autre niveau tant lors de ma maîtrise que lors de nos étés à Caw. Ton encouragement à faire une maîtrise fut très apprécié. J’en profite pour remercier ma psychologue de service, Alexandra B. Je remercie aussi ma première correctrice de proposé de recherche et de courriels en anglais, Amélie D., gracias! Brett C., merci pour tes conseils en analyses spatiales et tes corrections en anglais. Andréa P., tu as su survivre à mes sauts d’humeurs sur le terrain et tu as fait preuve de patience. Tu m’auras beaucoup appris sur moi-même! Clara B.-M., Dalie C.-V. et Marianne G., je me félicite de vous avoir survécu à BD… Trêve de plaisanteries, votre bonne humeur est contagieuse tout comme celle de Émilie C., Pascale A., Maxime B., Nicolas H., Jérémie F., Frédéric D., Mylène C. et Myriam C. Je vous remercie très, très fort de toujours m’avoir accueilli avec un grand sourire, ça fait chaud au cœur! Barbara V., tu m’as aidé avec mes analyses de survie et RMark. Sans tes scripts, ma maîtrise prendrait au moins une session de plus! Bob R. merci a lot pour your help avec mes courriels in anglais! Antoine B.-L., merci pour tes réflexions philosophiques sur de nombreux sujets. Laurent D., merci pour les parties de chasse et pour les nombreux articles journalistiques traitant de gestion de la faune! Julien H.-R., merci pour ton aide pour toutes sortes de raisons de professionnel de recherche! Béatrice C. et Florent D., merci pour les étés à Caw et votre support, de proche ou de loin, lors de ma maîtrise. Je tiens aussi à remercier Olivier C.-V., fidèle ami/bro qui m’a grandement encouragé lors de ce projet.
En dernier lieu, je tiens à remercier mes parents, Roger Bélanger et Lynda Rodrigue, sans qui je n’aurais pas eu l’opportunité de continuer mes études au niveau universitaire. Merci de m’avoir encouragé durant ce long chemin qu’ont été mes études. Merci d’avoir cru en moi malgré les hauts et les bas de mes études!
xiv
“I read somewhere... how important it is in life not necessarily to be strong... but to feel strong, to measure yourself at least once. If you want something in life, reach out and grab it.” Christopher McCandless a.k.a Alexandre Supertramp
xv
“The “pebble” is that students I help today now often mark large mammals with satellite-connected collars and monitor nearly real-time hourly movements at their desk, then make
inferences about locations of kill sites and test new ideas about travel paths and habitat use. But I think they are losing even more of the connection with the real environment than I did, and so I scoff and shake my head in sorrow. “Go to the Yukon,” I should tell them, “and experience what the natural world is really like… and if not, then read this book and you’ll yearn to go.”” Todd Fuller, Professor of Wildlife Conservation, University of Massachusetts Foreword to the book “Wolves of the Yukon” by Bob Hayes
xvi AVANT-PROPOS
Ce mémoire de maîtrise a comme objectif de produire des connaissances applicables à la gestion et la conservation du troupeau présentement en déclin de caribous montagnards des monts Torngat, Québec et Labrador, Canada. Il comporte 4 parties principales: une introduction générale, un chapitre principal sous forme d’article scientifique rédigé en anglais, une conclusion générale et les annexes. La bibliographie générale du document, excluant celle du chapitre principal, est aussi présentée. Cette étude est la première à présenter des analyses quantitatives et exhaustives sur le comportement et la démographie du troupeau de caribous des monts Torngat.
La date de soumission pour l’article scientifique inséré dans ce mémoire est prévue pour novembre 2017. Le journal scientifique visé est The Journal of Wildlife Management. L’étudiant de ce présent mémoire est l’auteur principal de l’article scientifique. Les coauteurs sont Mathieu Leblond et Steeve D. Côté. Voici les différentes parties auxquelles les auteurs ont participé ainsi que leur statut:
Édouard Bélanger, étudiant à la maîtrise, membre du Centre d’études nordiques, Université Laval
Mathieu Leblond, chercheur postdoctoral, membre du Centre d’études nordiques, Université Laval
Steeve D. Côté, directeur de maîtrise, professeur titulaire au département de biologie de l’Université Laval, directeur de Caribou Ungava et titulaire de la Chaire de recherche industrielle CRSNG en aménagement intégré des ressources de l'île d'Anticosti, chercheur régulier du Centre d’études nordiques
xvii
Tableau 1. Contribution des auteurs de l’article scientifique.
E. Bélanger M. Leblond S. D. Côté
Conception du projet X
Financement X
Formulation des hypothèses X X
Analyses statistiques X X
Interprétation des résultats X X X
Rédaction X
Révision X X X
1 INTRODUCTION GÉNÉRALE
Contexte théorique
Interactions entre la sélection de l’habitat et la dynamique de population
L’étude de la sélection de l’habitat et de la dynamique de population fournit plusieurs outils nécessaires à la gestion et à la conservation des espèces (Haines et al. 2006, Morellet et al. 2007, Croak et al. 2013). En effet, la compréhension de la sélection de l’habitat permet d’identifier les aires nécessaires à la pérennité des différentes populations animales telles que les corridors de migration (Chetkiewicz et al. 2006), les sites de reproduction (Dzialak et al. 2011), les habitats présentant une protection face aux prédateurs (Bjørneraas et al. 2012) ou les sites où il est facile d’accéder aux proies (Balme et al. 2007). Parallèlement, la dynamique de population est influencée par les paramètres démographiques tels que la survie, la reproduction, l’immigration et l’émigration. À leur tour, ces paramètres sont influencés par la génétique, la prédation, la chasse, le climat et par les caractéristiques de l’habitat. Par exemple, chez plusieurs ongulés, la disponibilité des habitats de bonne qualité affecte positivement la reproduction (Sæther and Heim 1993, Nilsen et al. 2004) et la survie (Pettorelli et al. 2003, Pettorelli et al. 2005, Gese and Thompson 2014). Ainsi, les individus tendent à utiliser différents habitats de façon à maximiser leur survie et leur reproduction (Rettie and Messier 2000). Les connaissances acquises sur les caractéristiques des habitats sélectionnés ainsi que sur les paramètres démographiques d’une espèce en déclin sont essentielles à l’élaboration de plans de gestion pour cette espèce. Elles permettent de planifier adéquatement les efforts de conservation.
Sélection de l’habitat
La compréhension du comportement et de la répartition des individus d’une espèce permet de déterminer quels habitats sont nécessaires à sa survie et à sa reproduction (Fedy et al. 2014). Un habitat peut se définir comme n'importe quelle aire géographique comprenant des ressources (p. ex. nourriture et abris) ainsi que des conditions environnementales (biotiques et abiotiques) qui déterminent la présence, la survie et la reproduction d’une espèce ou d’une population (Gaillard et al. 2010). Au niveau individuel, la sélection de l’habitat représente un processus où l’individu sélectionne différents habitats de façon à minimiser son exposition
2
aux facteurs limitants et à maximiser sa valeur adaptative (Rettie and Messier 2000, Gaillard et al. 2010). En ce sens, l’utilisation d’une composante d’habitat, telle qu’une ressource alimentaire, est dite sélective lorsque cette composante est utilisée de façon disproportionnée par rapport à sa disponibilité (Johnson 1980, Manly et al. 2002).
La sélection de l’habitat peut être considérée comme un processus hiérarchique où un individu sélectionne une aire telle que son domaine vital puis sélectionne différentes composantes à l’intérieur de celle-ci (Johnson 1980, Orians and Wittenberger 1991). Ce processus de sélection se fait à plusieurs échelles spatiales et temporelles et les critères de sélection sont différents selon le niveau étudié (Johnson 1980, Orians and Wittenberger 1991, Hall et al. 1997). Par exemple, à large échelle, le caribou forestier (Rangifer tarandus) sélectionne une aire en fonction du facteur limitant le plus sa valeur adaptative, comme la prédation, alors qu’à fine échelle, la sélection de l’habitat est expliquée par la qualité des ressources alimentaires (Rettie and Messier 2000). Il est donc important de considérer différentes échelles lors de l’étude de la sélection de l’habitat puisque celui-ci répond à différents besoins selon l’échelle (Boyce 2006, DeCesare et al. 2012b). Johnson (1980) propose une approche largement acceptée dans la littérature comportant quatre ordres de sélection : sélection d’une aire de répartition par une espèce ou une population (1er ordre de sélection), sélection d’un domaine vital par un individu ou un groupe d’individus (2e ordre de sélection), utilisation des différentes composantes d’habitats à l’intérieur du domaine vital (3e ordre de sélection) et approvisionnement en ressources alimentaires parmi celles disponibles dans les sites d’alimentation (4e ordre de sélection).
De plus, la sélection de l’habitat se fait à différentes échelles temporelles (Rettie and Messier 2000). Un individu peut utiliser différentes composantes de l’habitat selon les années, les saisons et, à plus fine échelle, selon le moment de la journée. Parallèlement, la sélection à large échelle temporelle se fait aussi à large échelle spatiale (ex. les saisons influencent l’aire de répartition; Sharma et al. 2009) alors qu’une échelle temporelle plus fine (ex. le moment de la journée) influence la sélection à une échelle spatiale plus fine. Cette variation temporelle dans l’utilisation de l’habitat a d’ailleurs été démontrée chez plusieurs taxons (mammifères; Rettie and Messier 2000, poissons; Blanchfield et al. 2009, reptiles; Croak et al. 2013, oiseaux; Fedy et al. 2014). Fedy et al. (2014) fournissent un exemple de l’utilisation de
3
plusieurs échelles spatiales et temporelles appliqué à la conservation: ils ont déterminé les habitats préférentiels du Tétras des armoises (Centrocercus urophasianus), une espèce à situation préoccupante due à des pertes d’habitats, selon les saisons ainsi qu’à plusieurs échelles spatiales de façon à obtenir de meilleurs outils de gestion. Il est donc important de considérer les aspects spatiaux et temporels lors des études de la sélection de l’habitat de façon à augmenter les capacités de prédiction et les conclusions biologiques possibles d’inférer aux populations (Fedy et al. 2014).
Facteurs qui affectent la sélection de l’habitat
Plusieurs facteurs peuvent agir de façon positive ou négative sur la sélection des différentes composantes d’habitats disponibles pour un individu (Manly et al. 2002). En effet, la densité de population, la compétition avec d’autres espèces, la prédation et les perturbations anthropiques peuvent affecter la qualité de l’habitat et ultimement, influencer quels habitats les individus sélectionnent (Manly et al. 2002). Ainsi, chez les orignaux (Alces alces), les habitats comprenant une meilleure protection contre les prédateurs et de la nourriture de qualité déterminent la sélection des habitats et l’utilisation de l’espace (Bjørneraas et al. 2012). Parallèlement, il existe un compromis entre la quantité et la qualité de la nourriture chez l’argali (Ovis ammon hodgsoni) : celui-ci sélectionne des sites procurant une alimentation de meilleure qualité plutôt que des sites caractérisés par une grande abondance de nourriture (Singh et al. 2010). De façon générale et à plus fine échelle, la taille des parcelles d’alimentation, la distance entre les parcelles d’alimentation, la qualité et la quantité des ressources alimentaires affectent la sélection (Manly et al. 2002).
Les fonctions de sélection des ressources
L’utilisation des habitats peut se caractériser par des fonctions de sélection des ressources (FSR) définies comme des fonctions proportionnelles à la probabilité d’utilisation d’une unité de ressource (Boyce and McDonald 1999, Manly et al. 2002). Les analyses de sélection de l’habitat, comme les FSR, permettent de quantifier les ressources qu’un individu sélectionnera par rapport à leur disponibilité et de déterminer s’il y a une sélection ou un évitement d’une ressource quelconque. Il est ensuite possible d’évaluer les aires géographiques, habitats ou ressources alimentaires essentiels à la reproduction et la survie des individus d’une espèce (Manly et al. 2002, Fedy et al. 2014). De même, les analyses de
4
sélection de l’habitat permettent de déterminer les effets des perturbations anthropiques sur l’utilisation de l’espace (Cameron et al. 2005) et à quel ordre de sélection ceux-ci jouent un rôle (DeCesare et al. 2012b).
Dynamique des populations et paramètres démographiques
L’étude de la dynamique de population est nécessaire pour comprendre comment les paramètres démographiques influencent la taille d’une population (Beissinger 2002). En effet, en estimant la contribution relative des paramètres démographiques, il est possible de prédire la taille future, les risques d’extinctions et quels paramètres ont la plus grande influence sur le taux d’accroissement d’une population (Crouse et al. 1987, Pfister 1998, Beissinger 2002, Naujokaitis-Lewis et al. 2009). Ces connaissances permettent la gestion d’une espèce surabondante ou en déclin, à l’aide de prises de décisions informées.
Il existe un grand nombre de facteurs qui influencent les paramètres démographiques d’une espèce (Oli 2003, Zabel et al. 2006). Parmi ces facteurs, on compte les facteurs environnementaux (Zabel et al. 2006), les habitats disponibles (Lindenmayer 2000, Larson et al. 2004, Bulman et al. 2007) ainsi que les effets anthropiques (McCann et al. 2012). Les facteurs environnementaux et anthropiques sont nombreux: la densité, le climat, la prédation, la chasse et le parasitisme (Sæther 1997, Gaillard et al. 2000b). De façon générale, le climat, la densité et le parasitisme ont des effets indirects sur les taux de survie et de recrutement, notamment via un effet sur la condition corporelle des individus (Skogland 1990, Albon et al. 2002, Simard et al. 2010, Koons et al. 2012). Par exemple, la condition corporelle des femelles chez certains grands mammifères est négativement affectée par la densité (Clutton-Brock et al. 1983, Kie and White 1985, Sæther 1997, Gaillard et al. 2000a). Une mauvaise condition corporelle se traduit alors en une diminution de la survie et de la reproduction (Thomas 1982, Testa and Adams 1998). De plus, la qualité et la disponibilité des habitats jouent un rôle essentiel dans la démographie d’une espèce: une diminution de la qualité et disponibilité de l’habitat peut mener à une diminution du succès reproducteur et de la survie (Larson et al. 2004). De surcroît, les facteurs tels que la prédation et la chasse affectent directement les changements de taille de population puisqu’ils prélèvent des individus dans la population (Gaillard et al. 2000b, McCann et al. 2012).
5
Différentes études de la dynamique de population d’espèces longévives ont déterminé que la survie des femelles adultes est le paramètre démographique qui influence le plus la taille d’une population (Lande 1988, Pfister 1998, Gaillard et al. 2000b, Hamel et al. 2006). Une baisse de la survie des femelles peut mener à une diminution rapide de la taille de la population. Chez certaines populations de grands herbivores, la chasse peut être une cause importante de mortalité chez les adultes. Par exemple, dans une étude sur le tapir de Baird (Tapirus bairdii), McCann et al. (2012) ont démontré que la survie des adultes dépendait principalement du taux de récolte par la chasse et de la taille de la population. De plus, sans intervention limitant le braconnage, la population s’éteindrait rapidement. Dans un même ordre d’idées, Hamel et al. (2006) ont montré que les populations de chèvres de montagne (Oreamnos americanus) sont très sensibles à la mortalité des femelles adultes et que cette espèce ne peut pas soutenir une chasse sportive sur ce segment de la population. Dans un contexte où une population fait face à une grande pression de chasse, quantifier la mortalité des adultes, que ce soit par la chasse ou par la prédation, permet d’identifier leurs effets sur les changements en nombre de la population.
L’effet de la récolte d’individus par la chasse sur le taux de survie d’une population peut-être compensatoire ou additif (Sandercock et al. 2011). L’hypothèse de la mortalité additive prédit que la baisse du taux de survie est directement liée à l’augmentation de la mortalité par la chasse, c’est-à-dire que la population ne compense pas pour cette mortalité (Burham and Anderson 1984, Sandercock et al. 2011). D’une autre part, l’hypothèse de la mortalité compensatoire suppose que la baisse de survie occasionnée par la chasse est compensée par une augmentation de la survie des autres individus de la population (Burham and Anderson 1984). De façon générale, la récolte par la chasse est additive chez les animaux longévifs avec un faible taux de reproduction (Hamel et al. 2006, Sedinger et al. 2007, McCann et al. 2012).
Modèles démographiques
Les modèles démographiques peuvent être utilisés pour prédire les changements en nombre d’une population selon différentes perturbations et mesures de gestion (Crouse et al. 1987, Nichols 2001, Hamel et al. 2006). De façon générale, les modèles démographiques prennent en compte différents paramètres démographiques tels que le taux de naissance, de survie, de
6
recrutement, d’émigration et d’immigration ainsi que la densité-dépendance (Beissinger and Westphal 1998, Zabel et al. 2006). En couplant les modèles démographiques avec des analyses de sensibilité, il est possible de déterminer l’effet des paramètres démographiques et d’identifier l’élément qui a le plus grand effet sur la dynamique de population (Crouse et al. 1987, Pfister 1998, Naujokaitis-Lewis et al. 2009). D’ailleurs, les analyses de sensibilité sont fortement recommandées lors de l’utilisation de modèles de prédiction (Naujokaitis-Lewis et al. 2009).
Le caribou
Les différentes populations de caribous et de rennes connaissent un déclin global dans pratiquement toute leur distribution circumpolaire (Vors and Boyce 2009). Bien que certaines de ces populations connaissent naturellement de grandes fluctuations d’abondance (Gunn 2003, Payette et al. 2004, Festa-Bianchet et al. 2011), ce déclin global pourrait être attribué aux activités humaines en expansion (Nellemann et al. 2001) et aux changements climatiques entraînant de nombreuses perturbations environnementales, particulièrement en milieux nordiques (ACIA 2004).
Les raisons du déclin des populations de caribous sont multiples et complexes. Ainsi, les changements climatiques affectent notamment la disponibilité et la productivité des plantes (Post and Forchhammer 2008), augmentent l’abondance des insectes et des parasites (Weladji et al. 2003, Witter et al. 2012a, Witter et al. 2012b), modifient les écosystèmes et leur paysage (p. ex. changements dans les espèces; Thompson et al. 1998) et augmentent les risques d'occurrence de phénomènes météorologiques extrêmes (Forchhammer et al. 2002). Les développements anthropiques peuvent aussi affecter les populations de caribous via la fragmentation de l’habitat par les routes et les industries (Cameron et al. 2005). Parallèlement, les facteurs tels que la prédation et la compétition apparente (McLoughlin et al. 2003, Vors and Boyce 2009, Wittmer et al. 2013) jouent un rôle respectivement direct et indirect sur la survie des caribous et ultimement dans le déclin des populations. De plus, la chasse peut accélérer le déclin des populations (Boulanger et al. 2011, Festa-Bianchet et al. 2011) puisque la mortalité due à la chasse est souvent considérée additive chez les espèces longévives (Festa-Bianchet et al. 2011, Péron 2013). Ultimement, ces différents facteurs sont reliés et peuvent mener à des effets cumulés augmentant leurs impacts (Sorensen et al. 2008).
7 L’importance du caribou
Le caribou et le renne jouent des rôles essentiels aux niveaux écologique, social et culturel. Ils affectent la structure végétale et le cycle de l’azote de leur aire de répartition et ils supportent des populations de prédateurs (Vors and Boyce 2009, Festa-Bianchet et al. 2011). D'un point de vue culturel et économique, ils fournissent des bénéfices pour de nombreuses communautés autochtones via la chasse et sont d’une importance capitale au niveau spirituel. Ils soutiennent aussi une industrie de la chasse sportive en plus d’une industrie d’élevage en Europe (Crête 1999, Suominen and Olofsson 2000, Côté et al. 2012).
La sélection de l’habitat du caribou
Les caribous utilisent une grande diversité d’environnements à l’intérieur de leur distribution circumpolaire. Il existe plusieurs écotypes de caribous qui présentent différents comportements adaptés à leur environnement et à leurs habitats respectifs. Toutefois, les facteurs qui limitent la sélection de l’habitat (c.-à-d. prédation, harcèlement des insectes, disponibilité et qualité des ressources alimentaires) sont semblables d’un écotype à l’autre et varient selon les saisons. Par exemple, durant l’hiver, les caribous sont limités en partie par la disponibilité des ressources. En effet, les caribous forestiers sélectionnent les forêts matures où la neige s’accumule afin d’accéder aux lichens arboricoles alors que les caribous montagnards et migrateurs sélectionnent les habitats dans lesquels il y a une plus faible accumulation de neige pour accéder aux lichens terrestres (Seip and Cichowski 1996, Terry et al. 2000, Ihl and Klein 2001). Pareillement, lors de la mise-bas, les caribous montagnards sélectionnent les sommets des montagnes de façon à se séparer spatialement des prédateurs alors que les caribous migrateurs se regroupent et utilisent des aires de mise-bas nordiques pour éviter la prédation (Bergerud and Page 1987, Bergerud et al. 2008). Durant l’été, les caribous montagnards et migrateurs sélectionnent des habitats plus venteux, c.-à-d. sommet de montagnes, collines et habitats côtiers, de façon à éviter le harcèlement des insectes (Skogland 1980, Downes et al. 1986, Ion and Kershaw 1989, Quayle and Kershaw 1994, Witter et al. 2012a).
Les caribous des monts Torngat et de la rivière George
Présentement, deux populations de caribous occupent le nord-est du Québec et du Labrador : le troupeau migrateur de la Rivière-George (TRG) et le troupeau montagnard des monts
8
Torngat (TMT). Bien que génétiquement identiques (Boulet et al. 2007), les deux troupeaux présentent des différences dans leur écologie. Le TMT fait partie de l’écotype montagnard et entreprend des mouvements saisonniers et des migrations altitudinales dans les monts Torngat (Schaefer and Luttich 1998, COSEWIC 2011). L’effectif de ce troupeau a été estimé à environ 5000 individus en 1980 (Bélanger and Le Hénaff 1985) puis à 930 (intervalle de confiance: 616-1453) individus à l’aide d’un inventaire aérien exhaustif (Couturier et al. 2015) en 2014. Ces estimations couplées aux connaissances traditionnelles des communautés inuites de la région (Wilson et al. 2014) révèlent que le troupeau est en déclin. De plus, depuis 2016, ce troupeau est considéré comme en danger d’extinction (COSEPAC, rapport non-publié).
Par ailleurs, Schaefer and Luttich (1998) démontrent que le patron de l’utilisation de l’habitat des TMT est distinct de celui du TRG malgré un chevauchement des aires de répartition des deux troupeaux, particulièrement en été. Les caribous du TRG font partie de l’écotype migrateur. Ils entreprennent de longues migrations saisonnières de plusieurs centaines de kilomètres et se regroupent lors de la mise bas (Bergerud 1996, Taillon et al. 2012). Le TRG a subi de grandes fluctuations d’abondance dans les deux derniers siècles (Payette et al. 2004) et subit un déclin depuis le début des années 1990. Son effectif a été estimé par inventaires aériens à environ 60 000 caribous en 1963 (Des Meules and Brassard 1964), puis à 776 000 en 1993 (Couturier et al. 2004), et 8 900 en 2016 (MFFP 2016). En plus de se différencier par leur démographie et leur comportement, les individus de ces deux troupeaux se distinguent par le volume et la taille corporelle et, également, par leur taux de mouvement (Couturier et al. 2010). En effet, les individus des monts Torngat sont généralement moins hauts sur pattes et plus volumineux et ont un taux de mouvement journalier plus bas (Couturier et al. 2010).
En observant les aires de mise bas du TRG (Taillon et al. 2012) lors des années à forte abondance de population, on remarque un chevauchement avec la distribution du TMT (Schaefer and Luttich 1998). Ce phénomène pourrait s’expliquer par le fait que la superficie des aires occupées par les caribous migrateurs augmente généralement avec leur abondance (Schaefer and Mahoney 2003) pouvant ainsi chevaucher les aires d’autres troupeaux. Ce chevauchement pourrait avoir des conséquences négatives pour le caribou du TMT tel que la
9
compétition pour les ressources alimentaires et l’augmentation du nombre de prédateurs qui suivent les grandes populations de caribous migrateurs.
Alors que la démographie, la répartition et la dynamique de population du TRG sont bien documentées (Couturier et al. 2004, Couturier et al. 2010, Côté et al. 2012, Taillon et al. 2012), peu de connaissances sont disponibles sur ses mêmes sujets pour le TMT rendant sa gestion peu informée et difficile. Dans le contexte actuel de déclin du TMT et en raison de la sensibilité des caribous face à l’accroissement des perturbations et des pressions anthropiques dans le nord, il est nécessaire de comprendre la répartition et la dynamique de ces caribous montagnards en relation avec ceux du TRG.
Objectifs
Le TMT a connu un déclin rapide dans les dernières années menaçant son maintien à long terme. Il est essentiel de documenter la sélection de l’habitat, la démographie et l’utilisation de l’espace du TMT pour comprendre les processus qui ont pu mener à son déclin et ultimement, aider à sa gestion et sa conservation. Les objectifs spécifiques du projet sont : • évaluer la sélection de l'habitat saisonnière des caribous des monts Torngat à 2 échelles spatiales, soit la sélection du domaine vital (2e ordre de sélection) et la sélection des habitats à l’intérieur du domaine vital (3e ordre de sélection) de façon à déterminer les habitats préférentiels ;
• déterminer l’effet de la chasse sur la survie des individus des monts Torngat et réaliser différents scénarios de survie à l’aide de modèles démographiques de façon à fournir un outil de gestion ;
• déterminer le moment et l’envergure du chevauchement entre les caribous des monts Torngat et ceux du troupeau Rivière-George et estimer l’effet de l’abondance de la population des caribous de la rivière George sur l’utilisation de l’espace des caribous des monts Torngat. Ces connaissances permettront une meilleure planification des efforts de conservation, de l’emplacement des aires protégées ainsi que de la gestion de la récolte dans la région des monts Torngat.
10 CHAPITRE PRINCIPAL
October 2017 Steeve D. Côté Département de biologie, Pavillon Alexandre-Vachon 1045, av. de la Médecine Quebec, QC, Canada, G1V 0A6 Phone: (418) 656-2131 # 3490
Bélanger et al. • Behavior and Survival of Torngat Mountains Caribou
Habitat Selection and Population Trends of the Declining Torngat Mountains Caribou
ÉDOUARD BÉLANGER (1) MATHIEU LEBLOND (1) STEEVE D. CÔTÉ (1) (1) Caribou Ungava, Université Laval Département de biologie, Pavillon Alexandre-Vachon 1045, av. de la Médecine Quebec, QC, Canada, G1V 0A6 Phone: (418) 656-2131 # 8152
11 RÉSUMÉ
Comprendre pourquoi une espèce à risque sélectionne certains habitats et quelles composantes de ses traits biodémographiques entrainent des changements en nombre peut aider à quantifier les causes d’un déclin et permettre une meilleure gestion. Le troupeau de caribou montagnard des monts Torngat situé dans le nord du Québec et du Labrador connait présentement un déclin rapide et peu d’études ont examiné les raisons de ce déclin. La démographie, l’utilisation de l’espace et la sélection de l’habitat en relation avec le déclin de cette population sont méconnues. À l’aide du suivi de 35 caribous adultes munis de colliers satellites, nous avons étudié la sélection de l’habitat à deux échelles spatiales, la survie, l’effet de la chasse sur la survie ainsi que du chevauchement avec les caribous migrateurs du troupeau Rivière-George. Les caribous sélectionnaient des habitats comportant une grande abondance de ressources en hiver et des habitats favorisants l’évitement des insectes en été. La sélection de l’habitat du caribou des monts Torngat est similaire aux autres populations de caribous migrateurs et montagnards à l’exception de la saison de mise-bas où nous n’avons pas détecté de comportement anti-prédateur. Le chevauchement avec le troupeau Rivière-George a grandement diminué durant les 25 dernières années et est corrélé au déclin majeur du troupeau Rivière-George. Le déclin du troupeau des monts Torngats est principalement attribuable à une faible survie des femelles adultes (70% annuellement) due à la chasse (38% de la mortalité) et à la prédation (27%). Nos modèles démographiques suggèrent que le taux de croissance de la population augmenterait de 0.83 à 0.94 avec une augmentation de la survie, c.-à-d. une diminution de la pression de chasse. En comparant plusieurs scénarios, nous avons déterminé que le caribou des monts Torngat continuerait de décliner rapidement si aucune action de gestion n’était prise pour augmenter la survie des femelles adultes.
12 ABSTRACT
Understanding why a species at risk select certain habitats and what components of its life history drive changes in numbers can help mitigate the causes of a decline and how to manage it. The Torngat Mountains caribou herd in northern Quebec-Labrador is rapidly declining and few studies have examined the causes of this decline. Using 35 Argos and GPS collars fitted on Torngat Mountains caribou between 2011 and 2015, we assessed seasonal habitat selection at two spatial scales, future population trends, and its space use relationships with the neighbouring Rivière-George migratory caribou herd. Caribou selected habitat with abundant food resources in winter and habitat favouring the avoidance of insects in summer. Habitat selection by the Torngat Mountains caribou was consistent with other barren-ground and montane caribou with the exception of calving, where we did not detect predator avoidance behavior. The spatial overlap with the Rivière-George herd declined substantially during the past 25 years and was correlated with the Rivière-George herd extended decline. The decline of the Torngat Mountains caribou was principally attributed to the low survival of adult females (70% annually), originating from subsistence harvest (38% of mortality) and predation (27%). Demographic models revealed that the population growth rate would increase from 0.83 to 0.94 with an increase in adult survival, i.e. a decrease in harvest pressure. Using different demographic scenarios, we showed that the Torngat Mountain caribou could continue to decrease rapidly if no management actions were taken to increase adult female survival.
13 KEYWORDS
Wildlife conservation, harvest, population dynamics, population trends, Rangifer tarandus, space use, survival.
14
Habitat selection and population dynamic analyses are often used as management tools for the conservation of species at risk (Haines et al. 2006, Croak et al. 2013). Knowledge of the distribution and behavior of a species helps to determine critical areas for survival and reproduction (Fedy et al. 2014). In addition, assessing parameters such as survival and reproduction may help to predict future population trends, and identify extinction risks and potential causes of decline (Beissinger 2002). When little is known about a species of concern, a combination of habitat selection and population dynamics analyses should improve management and policy decisions and identify priority actions.
Individuals in natural environments use beneficial components of their habitat (e.g. food) while avoiding deleterious components (e.g. exposure to predators) to maximize their fitness (Rettie and Messier 2000, Gaillard et al. 2010). This selection is often viewed as a multi-scale hierarchical process, where individuals first select habitat at a broad scale (e.g., regional) and then choose specific components within this area (Johnson 1980, Orians and Wittenberger 1991). Habitat selection is also influenced by the temporal scale because life history (e.g. calving: Bergerud and Page 1987, nesting: Orians and Wittenberger 1991) and environmental constraints (e.g. food availability: McLoughlin et al. 2002, temperature: Croak et al. 2013) vary over time. For instance, Fedy et al. (2014) showed that the preferential habitat of the Greater sage grouse (Centrocercus
urophasianus), a species of conservation concern, differed at different spatial and temporal scales.
They concluded that large-scale resource management was preferable to ensure protection of its habitat and long-term sustainability of the species. It is thus necessary to consider both spatial and temporal resolutions to better plan habitat management for species of concern.
Caribou (Rangifer tarandus) use a broad range of environments throughout their circumpolar distribution. Though the factors influencing their selection are usually similar (e.g. predation, food availability, insect harassment), different caribou ecotypes exhibit great variability in their habitat selection behavior (COSEWIC 2011). For instance, the montane ecotype in western Canada selects mountain tops and disperse along an altitudinal gradient to limit predation on calves and reduce insect harassment during calving and summer (Bergerud and Page 1987). Conversely, the migratory ecotype in northern Quebec and Labrador undertake long migrations and aggregate during calving (Taillon et al. 2012) in response to resource availability (Teitelbaum et al. 2015) and to reduce predation risk (Bergerud 1996). They also select cool habitats to decrease insect
15
harassment during summer (Sharma et al. 2009). However, one aspect that is common to the different caribou ecotypes is a decline across most of their circumpolar range, probably related to many factors including habitat change, predation, hunting, and climate change (Festa-Bianchet et al. 2011).
In ungulate populations, the survival of adult females is the demographic parameter that has the strongest effect on population growth rate (Gaillard et al. 1998). Several studies have shown that the proximate causes of decline in caribou populations were the low survival rate of adult females, typically followed by low recruitment (Fancy et al. 1994, Seip and Cichowski 1996, Wittmer et al. 2005). Low survival of adult females is often associated with predation (Seip and Cichowski 1996, Wittmer et al. 2005), sometimes in relation with habitat deterioration (Boisjoly et al. 2010) and hunting pressure (Fancy et al. 1994, Schmelzer et al. 2004). Hunting is a direct cause of mortality and may have strong impacts on population growth rate, especially in long-lived species (e.g. snow geese Anser caerulescens atlanticus: Menu et al. 2002, bluefin tuna Thunnus thynnus: MacKenzie et al. 2009, caribou: Festa-Bianchet et al. 2011). For instance, the Bathurst barren-ground caribou herd underwent one of the largest declines observed in caribou, from 203,800 breeding females in 1986 to 8,075 in 2015 partly due to hunting (Boulanger et al. 2011, Boulanger et al. 2016). A constant harvest rate was one of the potential factors of the acceleration of the decline in recent years (Boulanger et al. 2011) and the same tendency was observed in other caribou populations (Seip and Cichowski 1996, COSEWIC 2004). This process can be even more dramatic in small populations because harvest has a stronger impact on survival rates and because long-term viability is generally lower (caribou: Schmelzer et al. 2004, mountain goat Oreamnos americanus: Hamel et al. 2006, Baird's tapir Tapirus bairdii: McCann et al. 2012). Assessing harvest impacts can promote the use of efficient management tools such as decreasing hunting quotas, and has been used by several organizations and communities (e.g. Inuit and Inuvialuit) concerned by caribou populations at risk (COSEWIC 2004, Festa-Bianchet et al. 2011).
The Torngat Mountains (TM) montane caribou herd underwent a rapid decline from approximately 5,000 individuals in 1980 (Bélanger and Le Hénaff 1985) to 930 (CI: 616-1453) in 2014 (Couturier et al. 2015), threatening its long-term viability. This decline was also observed by the Inuit communities of the region (Wilson et al. 2014). This population is the only montane caribou population in the Arctic, and has been identified as a distinct designatable unit by the committee
16
on the status of endangered wildlife in Canada in 2011 (COSEWIC 2011). In December 2016, it was assessed as threatened by the COSEWIC (COSEWIC, unpublished report). While the demography and distribution of migratory caribou herds in Northern Quebec and Labrador are relatively well studied (Rivière-George and Rivière-aux-Feuilles migratory caribou; Couturier et al. 2004, Couturier et al. 2010, Côté et al. 2012, Taillon et al. 2012), little is known about the space use, habitat selection, and demography of the TM herd. Susceptibility of caribou to harvest, potential increases in human development, and the growing concerns of Inuit communities in the area (Wilson et al. 2014) underline the importance of studying this population. Moreover, the neighbouring Rivière-George (RG) migratory caribou herd is known to overlap with the TM herd, particularly during calving and summer. The presence of the RG herd may impact the survival and behaviour of TM caribou through competition for critical habitat or increase in predation due to the higher abundance of RG caribou and predators following this herd. Our objectives were to assess habitat selection, survival, and space use of the TM herd to provide knowledge helpful for management. More precisely, we aimed to a) assess the habitat selection of the TM herd at different spatio-temporal scales, b) estimate adult survival and model the impact of hunting on future population trends of the TM herd, and c) determine the degree of spatial overlap between the TM and RG herds.
STUDY AREA
The montane ecotype of the TM caribou and the migratory ecotype of the RG herds are located in northeastern Quebec and Labrador. The TM caribou are distributed north of Okak Bay and Kangiqsualujjuaq in the Quebec-Labrador peninsula (Schaefer and Luttich 1998, Boulet et al. 2007) (Figure 1). In fall and winter, they use the coastal plains of Ungava Bay, and progressively move to the high plateaus during the pre-calving and calving seasons (Schaefer and Luttich 1998). In summer, they move along the eastern Torngat Mountains basin and the high plateaus. This area is also used by the RG herd in summer, where the two herds may co-occur (Schaefer and Luttich 1998, Taillon et al. 2012). The RG caribou population declined from around 776 000 individuals in 1993 to 8,900 in 2016 (MFFP 2016).
The topography of the eastern Torngat Mountains region consists of high tundra plateaus and mountains (up to 1400 m) and the vegetation cover is dominated by grasslands mixed with barren land, lichens and mosses. Numerous fjords and broad valleys extend to the Atlantic Ocean. Part of
17
the study area (29%) is protected by the Torngat Mountains National Park in Nunatsiavut (Schaefer and Luttich 1998, Parks Canada 2010). In the north and west, the landscape is dominated by rugged foothills which gradually transform into low coastal plains towards Ungava Bay (Schaefer and Luttich 1998). Plant communities consist primarily of grasslands mixed with lichens and mosses (NALCMS 2010). South of this area, in Nunavik (Quebec), the Kuururjuaq National Park includes the watershed of the Koroc River and covers 13% of the range of the TM herd (Parks Canada 2010).
Figure 1. Historical distribution of the Torngat Mountains caribou herd based on a 100% minimum convex polygon (MCP) of the locations of 10 adult caribou monitored from 1988 to 1999 (data from Schaefer and Luttich 1998) coupled with the 100% MCP of 35 adult caribou monitored between 2011 and 2016 in northern Québec and Labrador, Canada. A buffer of 1,042 m was created around the continent representing the longest trip undertaken by a caribou on ice. The 100% MCP
18
was then clip using this buffer to eliminate sea segments considered unavailable for caribou. The total area is 33 843 km2.
METHODOLOGY
Between 1988 and 1999, 10 adult females from the TM herd were equipped with Argos satellite-tracking collars (emitting every 3 – 4 days). These caribou were captured using chemical restraint agents fired using a dart-gun from a helicopter (see Schaefer and Luttich 1998). Between 2011 and 2013, 25 adult females and 10 adult males were captured with a net-gun fired from a helicopter and equipped with Argos (n=9, locations every 2 days) or GPS (n=26, locations each 5 or 11 hours) satellite-tracking collars. Causes of death (e.g., predation, hunting) were assessed directly in the field when collars were recovered 1 to 6 months after death. Caribou from the RG herd have been monitored by telemetry (Argos and GPS) since 1986 (n = >400 individuals). Locations were obtained every 3 hours (GPS) to 5 days (Argos) and were filtered to eliminate erroneous locations (see Boulet et al. 2007). The animal care committee of Laval University approved all handling procedures (certificate # 2014011, renewed each year).
Habitat selection
We defined the distribution of the TM herd by merging the late (1988-1999) and present (2011-2016) ranges (see Figure 1). Both ranges were created using a 100% minimum convex polygon (Mohr 1947) in R (R Core Team 2015).
We divided the year into 6 periods based on Schaefer and Luttich (1998) and movement rates of the 35 marked caribou from 2011 to 2016: pre-calving (3 May to 4 June), calving (5 June to 25 June), summer (26 June to 25 September), fall (26 September to 14 October), breeding (15 October to 15 November), and winter (16 November to 2 May). We established the annual and seasonal home ranges of TM individuals using 100% MCPs. We did not consider seasonal home ranges when <50% of possible locations were collected during a period because of collar malfunction or death of the animal. Using this criterion, the minimum number of caribou locations used was 6 during the calving season (20 days length) up to a minimum of 64 during winter (169 days). We assessed habitat selection of TM caribou using resource selection functions (RSF) under a used vs. available design (Manly et al. 2002). The RSF used was a generalized linear mixed model with a binomial distribution and a logit function. We added year and individual as random effects in the
19
models to account for the unbalanced sample size (locations) and the annual and inter-individual variations in selection. We performed RSFs on the 2011-2015 data because some map layers were unavailable for the 1988-1999 period.
To estimate selection at the scale of the study area (2nd order of selection sensu Johnson 1980), we compared habitat composition of home ranges with 10 paired random home ranges in a matched case-control design (Fortin et al. 2009, Massé and Côté 2009). We associated each seasonal home range with 10 random home ranges of the same shape, randomly translated and rotated in the population range. To estimate habitat selection at the scale of the home range (3rd order of selection), we generated random locations within the seasonal home ranges at a ratio of 1:1 with real locations. We characterized the landscape surrounding caribou and random locations using a circular buffer of 1-km radius. This 1-km radius was used to reduce the difference in precision between Argos and GPS collars, as well as to consider the precision of habitat maps (Rettie and McLoughlin 1999). Habitat maps had a resolution of 250 m2 and were segregated into 19 land cover classes (NALCMS 2010). We collapsed the 11 out of 19 classes occurring in the Torngat Mountains region into 6 vegetation classes based on similarities in land cover and food resources for caribou (see Appendix 1 for a description of these classes). We used the vegetation cover including barren land, lichen, and moss as the reference category for the RSFs because it was the category closest to a null selection ratio. In addition, we evaluated the effect of topography, including elevation, aspect, slope, and terrain ruggedness (pixel resolution at 18.54 m2; NALCMS 2010) on TM caribou habitat selection. We used ‘flat’ as the reference category for aspect in the RSF. We used the Vector Ruggedness Measure (VRM) to determine terrain ruggedness because it is more independent of the slope than other ruggedness indices (Sappington et al. 2007). This index varies between 0 and 1, where 0 is a perfectly flat terrain and 1 is an extremely rugged terrain.We obtainedsnow cover from satellite MODIS/Terra (using maximum snow cover) on an 8-days temporal resolution and 500 m2 spatial resolution (Hall et al. 2006). See appendix 2 for a complete list of covariate used in the mixed-models.
We estimated the percentage of vegetation classes, mean elevation, mean slope (using the mean of all 18.54 m2 pixels) and snow cover within each home range (2nd order) and each buffer around locations (3rd order). In addition, we estimated the mean ruggedness for each home range and the most common aspect for each buffer. We also calculated the distance to the coast (Atlantic Ocean
20
or Ungava Bay) from the middle of each buffer and the mean distance to the coast of home ranges. We limited our analysis of RSF on adult females only during pre-calving and calving seasons because the presence of a calf can affect selection. For the other seasons, we used both sexes because preliminary results showed no significant difference in habitat selection between sexes. We tested for multi-collinearity among variables with the variation inflation factor (VIF; Zuur et al. 2010); we dropped variables with VIF >4.
We created candidate models a priori in order to represent different scenarios of selection based on the ecology of caribou (see appendices 3 and 4 for the list of models). We then used Akaike’s Information Criterion (AIC) to determine the most parsimonious model for each season (Burnham and Anderson 2002). If two models yielded results within AIC≤ 2, we assessed whether the additional parameters were significant at the 95% confidence interval. If the additional parameters were not significant, we considered them as uninformative and rejected that model (Arnold 2010). We used k-fold cross validation to verify the validity of models, and we report the average of 10 iterations (Boyce et al. 2002).
Survival and demography
We used the RMark package in R v.3.2.3 (R Core Team 2015) to estimate the survival of adult (>2 years old) TM caribou between 2011 and 2016. This package models survival parameter estimators using the known fate (i.e. alive or dead) from each location of marked individuals (see White and Burnham 1999). Individuals with collar malfunctions were considered as ‘unknown fate’ the date their collar started to malfunction (i.e. censor from that date on). We created daily, seasonally, and annual models, to which we added sex. We used the same annual periods as for the resource selection analyses, but we merged pre-calving and calving as well as fall and breeding to obtain 4 seasons. We did so because our sample size was low and to limit the difference in length among seasons. We used the AICc to determine the most parsimonious model (Burnham and Anderson 2002). We used the recruitment and sex ratio estimated during an aerial survey in March 2014 by Couturier et al. (2015). Recruitment was defined as the late winter (> 10 months of age) calf:cow ratio and was estimated at 28.4 calves: 100 females. The sex ratio of adults (>2 years old) was estimated at 37 males: 63 females, which is similar to other ratios reported in the literature for caribou (Bergerud 1971, Bergerud 1980, Fancy et al. 1994). Our models assumed a sex ratio of
21
50:50 up to 2 years old (Boulanger et al. 2011) and yearling survival equal to the same-sex adult survival.
We used the following equation to calculate population growth rate:
λ = N1 / N0
where λ is the finite rate of increase, N1 is the population size at t1, and N0 is the population size at t0. We used the following equation to calculate N1:
N1 =NM0 × SM + NF0 × SF + r
where NM0 is the number of adult males at t0, SM is male survival, NF0 is the number of adult females at t0, SF is female survival, r is the number of juveniles that survived to become adult. The relation between hunting mortality and natural mortality can be described as follows:
S = S0× Sh
Sh = 1 – bH
where S0 is the natural survival rate, Sh is the hunting survival rate, b is the degree by which hunting is additive, and H is the hunting mortality rate (Lebreton 2005). We assumed that hunting was completely additive (b = 1)because the population was low and declining and because long-lived species generally do not compensate hunting mortality(Festa-Bianchet et al. 2011, Péron 2013). Subsequent to the last equations, it follows that:
1 – Sh = p / (1 – p) × (1 – S0)
where p is the proportion (i.e. 1/3) of individuals that died from hunting (Lebreton 2005). It is then possible to determine the effect of different hunting scenarios on the survival of adults by changing the value of p. We only used known causes of mortality (i.e. hunting and predation) to generate p. To generate demographic models, we used the 2014 population estimate of 930 individuals as the starting population size (930 individuals, Couturier et al. 2015). We created 3 scenarios by varying the survival rates of adults base on different harvest, I) survival estimated using the 35 marked individuals (the “Business-as-usual” scenario, where nothing changes in the future), II) survival corrected by removing all hunted individuals (the “Increased adult survival” scenario), and III)