MELISSA GlRARD
DIVERSITE FLORALE DE DEUX CULTURES DE
VACCINIUM ET L'ABEILLE DOMESTIQUE
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval dans le cadre du programme de maîtrise en biologie végétale
pour l'obtention du grade de maître es science (M. Sc.)
DEPARTEMENT DE PHYTOLOGIE
FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2010
Résumé
Les colonies d'abeilles domestiques, Apis mellifera L., sont affectées négativement par plusieurs facteurs. Le manque de diversité florale, dû à l'intensification de l'agriculture, est un des facteurs impliqué dans le dépérissement récent du cheptel d'abeilles domestiques nord américain. Au Québec, les colonies d'abeilles sont de plus en plus sollicitées pour assurer le bon rendement des cultures qui requièrent le service de pollinisateurs telles le bleuet nain et la canneberge. Ces deux cultures, souvent intensives, offrent une flore environnante de faible diversité aux abeilles. Ce projet de recherche visait à évaluer l'importance de la diversité florale sur le développement des colonies d'abeilles introduites de façon consécutive dans les bleuetières et les cannebergières, i.e. pendant la même saison apicole. Les résultats démontrent que les monocultures de bleuets nains ne semblent pas offrir une diversité florale adéquate pour le développement normal du couvain d'abeilles. Cette étude aura aussi permis d'acquérir des techniques d'identification de grains de pollen frais, une expertise rare.
Abstract
Honeybee colonies, Apis mellifera L., are negatively affected by many biotic and abiotic factors, often causing their decline. It is now recognized that the lack of floral diversity due to the intensification of agriculture is one of the factors that could possibly be involved in this decline. In Quebec, growers are seeking pollination services from honeybees to ensure higher yields in crops such as lowbush blueberries and cranberries. This research project aimed to assess the importance and impacts of floral diversity found in the surroundings of blueberry and cranberry crops on the development of the honeybee colonies introduced for pollination. Results suggest that intensively grown blueberry crops may not provide sufficiently diverse flora for bee colonies to develop normally. This study also allowed the acquiring of techniques to identify fresh grains of pollen, a rare expertise that will prove useful for the development of bee research in Quebec.
Avant-Propos
Le chapitre II de ce mémoire est un manuscrit qui sera soumis au journal scientifique Apidologie. L'article, intitulé Species diversity of pollen harvested by honeybees in the Vaccinium spp. crop environment in Quebec, Canada and its importance for honeybee colonies development, fut rédigé par Mélissa Girard, auteure principale. Les co-auteures sont Valérie Fournier, Ph.D. professeure d'entomologie à l'Université Laval et Madeleine Chagnon, Ph.D. professeure associée à l'Université Laval et à l'Université du Québec à Montréal.
Remerciements
Je désire débuter par la source et remercier mon père Marc-André Girard et ma mère Francine Godin de m'avoir fait goûter aux beautés de la nature dès mon tout jeune âge. Mes parents m'ont toujours encouragée dans mes études, mes voyages, mes passions. De plus, je me plais à croire que le prénom qu'ils m'ont donné a influencé mon choix de carrière puisqu'il veut dire « L'abeille » en grec (ixéXiooa).
Je remercie ma directrice Valérie Fournier et ma co-directrice Madeleine Chagnon, qui m'ont permis de faire un aussi passionnant projet de maîtrise. Merci énormément pour votre aide, vos conseils, votre expérience et vos encouragements.
Mon projet a demandé plusieurs heures de collecte de données et de laboratoire. Sans Jeanne Camirand et Martine Bernier, je serais probablement encore en train de monter des lames de pollen. Un autre collègue, Joseph Moisan De Serre, m'a aidé à faire la longue, mais très goûteuse, récolte de bleuet à l'été 2009. Marine Marel et Emilie Lemaire, deux autres amies et collègues, m'ont soutenue pendant ces deux années de travail.
Je dois aussi souligner l'aide d'Emile Houle, de Georges Martin, de Michael Benoît et de Sylvain Gingras, tous employés au Centre de Recherche en Sciences Animales de Deschambault (CRSAD). Nous avons passé quelques nuits à transhumer des colonies d'abeilles jusque sur la Côte-Nord, au Lac St-Jean et dans les Bois-Francs. Nous garderons en tête plusieurs péripéties. J'ai aussi adoré les journées pendant lesquelles nous avons analysé le couvain des ruches de ce projet. Assise sur un toit de ruche à noter les chiffres qu'ils me donnaient, je finissais toujours la journée à moitié endormie. Un remerciement spécial à Emile que je considère comme une encyclopédie apicole vivante et qui est très généreux de son temps, de ses nombreuses expériences et de ses connaissances.
Je remercie Pierre Giovenazzo pour ses conseils et son positivisme qui m'ont aidé à avancer et à connaître mon potentiel.
La palynologie est un domaine peu en demande, mais Johanne Parent m'a permis d'apprendre et de développer cette expertise qui semble abandonnée au Québec. Tu es mon mentor, Johanne.
Je souligne aussi l'aide de Gaétan Daigle, un statisticien qui m'a énormément aidé pour l'analyse statistique de mes données.
Merci à tous ceux qui m'ont aidé à trouver des sites où introduire les colonies d'abeilles pour mes deux étés de terrain et aussi pour vos conseils : Ève-Catherine Desjardins, Marius Biais, Daniel Harvey, Gérald Savard, Daniel Simard, André Gagnon, Andrée Tremblay, Marie-Eve Moreau, Véronique Moreau et Jean-Pierre Deland. Merci aux producteurs qui ont accepté que je travaille, sur la pointe des pieds, dans leurs champs.
Je suis très contente d'avoir rencontré Yves Loublier et Jean-François Odoux, palynologues Français, qui étaient présents à Montpellier pour le congrès Apimondia en septembre 2009. Vous m'avez fourni des références très pertinentes et vous m'avez aussi fait sentir moins seule dans ce domaine, relativement peu étudié, qu'est la palynologie.
Toutes les personnes énumérées plus haut m'ont aidée de près ou de loin, activement ou indirectement dans mon projet de recherche. Par contre, la personne qui m'a soutenue au quotidien est mon copain Jonathan Lafond. Ma passion pour les abeilles est profondément ancrée dans tout ce que j'entreprends et Jo a su l'accepter et la partager avec moi.
Pour terminer, je remercie Ingemar Fries, professeur d'apiculture en Suède (2007), qui a contribué à me donner la piqûre, au sens propre et au sens figuré!
A tous ceux qui m'ont fait découvrir ma passion pour les abeilles
Table des matières
Résumé i
Abstract ii Avant-Propos iii Remerciements iv Table des matières vii Liste des tableaux ix Liste des figures x
Introduction générale 1
Chapitre I : Revue de littérature 2
1.1 Apis mellifera L 3 1.1.1 Causes de dépérissement d'Apis mellifera 4
1.1.1.1 Syndrome d'effondrement des colonies 4
1.1.1.2 Parasites et maladies 5
1.1.1.3 Pesticides 8
1.1.1.5 Stress nutritionnels lors des services de pollinisation 10
1.1.2 Besoins nutritionnels d'Apis mellifera 11 1.2 Services de pollinisation au Québec 14
1.2.1 Le bleuet 15 1.2.1.1 La plante 15 1.2.1.2 La régie des plantes nuisibles dans les bleuetières 16
1.2.1.3 Les besoins en pollinisation du bleuet 16
1.2.2 Lacanneberge 17 1.2.2.1 La plante 17 1.2.2.2 La régie de culture 18
1.2.2.3 Les besoins en pollinisation de la canneberge 18
1.3 Recherche proposée 20 1.4 Objectifs du projet 21 1.4.1 Objectif général 21 1.4.2 Objectifs spécifiques 21 1.5 Hypothèses du projet 22 1.5.1 Hypothèse générale 22 1.5.2 Hypothèses spécifiques 22
Chapitre II : Article scientifique 23
Abstract 26 2.1 Introduction 27
2.2 Materials and Methods 29 2.2.1 Honeybees supplies 29 2.2.2 Study regions 29 2.2.3 Study sites and treatments 29
2.2.4 Pollen sampling 30 2.2.6 Colony weight variations 31
2.2.7 Brood surface evaluation 32
2.2.8 Fruit yields 32 2.2.9 Statistical analyses 32
2.2.9.1 Weight and brood surface 32
2.2.9.2 Pollen analyses 33 2.2.9.3 Fruit yields 33
2.3 Results 34 2.3.1 Pollen taxa abundance and richness 34
2.3.2 Colony weight variations 36
2.3.3 Brood surface 37 2.3.4 Fruit yields 37 2.4 Discussion 38
2.4.1 Pollen taxa abundance and richness 38
2.4.3 Brood surface 40 2.4.4 Fruit yields 42 2.5 Conclusion 42 Acknowledgements 43 Chapitre III : Conclusion générale 44
Tableaux et figures 49
Bibliographie 67 Annexe I : Liste complète des taxons de pollen récoltés par les abeilles 78
Taxons de pollen récoltés par les abeilles en 2008 et leur abondance relative (%) selon
les cultures et les traitements 79 Taxons de pollen récoltés par les abeilles en 2009 et leur abondance relative (%) selon
les cultures et les traitements 80
Liste des tableaux
Tableau 1.1 Besoins minimums requis pour les dix acides aminés essentiels à l'abeille
domestique (en g/100 g protéines) 12 Tableau 1.2 Nombre de butineuses dans une colonie en fonction du nombre total
d'abeilles 13 Table 2.1 Ten most dominant pollen taxa* (%) during A) blueberry pollination period
(June) and B) cranberry pollination period (July). Average ofthe three treatments
combined 50 Table 2.2 Jaccard's similarity indexes for each treatment during blueberry pollination
period (June) and cranberry pollination period (July) in A) 2008 and B) 2009 51 Table 2.3 Simpson's diversity indexes for the treatments V, VF and F during blueberry and
cranberry pollination periods both in A) 2008 and B) 2009 52 Table 2.4 Average fruit yields and standard deviation for treatment V and VF for
Liste des figures
Figure 1.1 Schéma d'une coupe transversale d'une fleur de V. angustifolium 54 Figure 1.2 Fleurs blanches de V. angustifolium butinées par une abeille domestique 55
Figure 1.3 Schéma d'une coupe transversale d'une fleur de V. macrocarpon 56 Figure 1.4 Fleur ouverte (blanche) et fleur fermée (rose) de V. macrocarpon 57
Figure 2.1 Capturing foragers loaded with pollen and nectar 58 Figure 2.2 One gram of pollen pellets sorted by color in a Petri dish 59
Figure 2.4 Brood comb covered with sealed brood 61 Figure 2.5 Species rank abundance curves for blueberry and cranberry for 2008 and 2009.
The y-axis represents the number of pollen pellets (abundance) from a plant species in
relation to its rank (x-axis) 62 Figure 2.6 Species accumulation curves for blueberry and cranberry crops in A) 2008 and
B)2009 63 Figure 2.7 Weight variations in kg and standard error in A) Lowbush blueberry (June) and
B) Cranberry (July). Comparison ofthe three treatments; V, VF and F 64 Figure 2.8 Evolution ofthe brood surface (# cells) before (1 June) and after (25 June)
blueberry pollination, after cranberry pollination (22 July) and before overwintering
Introduction générale
L'agriculture moderne tend à maximiser les profits et les rendements, mais à quel prix? Alors que les superficies mises en culture ne cessent d'augmenter, les habitats naturels, tels les fossés et les boisés, sont détruits et l'application de pesticides rend les monocultures exemptes de ravageurs et de plantes nuisibles (Krebs et al, 1999; Macdonald & Johnson, 2000). Le manque d'abris et de sources de nourriture alternatives fait disparaître plusieurs organismes bénéfiques. La diversité en pollinisateurs indigènes est alors très faible dans ces environnements (Eckert & Shaw, 1960; Free, 1970; Steffan-Dewenter & Tscharntke, 1999).
Les pollinisateurs sont nécessaires pour la mise à fruits de la grande majorité des cultures vivrières (Aizen et al, 2008). Dans un contexte de déclin des populations de pollinisateurs sauvages en milieu agricole (Biesmeijer et a l , 2006; Klein et al, 2007), l'abeille domestique {Apis mellifera L., Hymenoptera : Apidae) est chaque année davantage sollicitée pour les services de pollinisation (Aizen & Harder, 2009). Au Québec, les colonies d'abeilles domestiques sont principalement louées pour la pollinisation des cultures de petits fruits tels le bleuet nain et la canneberge. Les mêmes colonies sont souvent utilisées pour polliniser successivement plusieurs cultures pendant la même saison estivale, ce qui peut causer un stress non négligeable aux abeilles (Kevan et a l , 2007).
La problématique entourant ce dernier point sera documentée dans le chapitre qui suit. Dans un premier temps, les principaux facteurs de stress affectant l'abeille domestique seront exposés. Les besoins nutritionnels de l'abeille seront ensuite détaillés. De plus, le contexte québécois des services de pollinisation et l'importance de ces services, pour les cultures du bleuet nain et de la canneberge seront discutés. Finalement, les résultats de cette étude seront présentés sous forme d'article scientifique.
1.1 Apis mellifera L.
L'abeille domestique, Apis mellifera L., est native d'Europe et d'Afrique (Free, 1970; Dietz, 2005). Sa distribution géographique d'origine s'étend du sud de l'Afrique à la Scandinavie. Cette espèce, aussi appelée abeille européenne ou abeille mellifère, a été domestiquée pour la production de miel et pour ses colonies nombreuses. Les premières A. mellifera ont été importées en Amérique par les colons européens pratiquant l'apiculture. Une caractéristique importante qui distingue A. mellifera des autres espèces d'Apis spp. est que la longueur de sa langue a suivi l'évolution des fleurs complexes des angiospermes. Cette caractéristique physionomique lui permet de récolter beaucoup plus de nectar que d'autres Apidae (Winston, 1991). L'abeille domestique est donc très importante pour la pollinisation de plusieurs espèces de plantes. Au Canada, la valeur des services de pollinisation réalisés par A. mellifera représente de 1,3 à 1,7 milliards de dollars annuellement (Conseil canadien du miel, 2010).
L'introduction en Amérique du Nord de races d'A. mellifera provenant de différents pays a eu comme conséquence la propagation de plusieurs pathogènes et maladies (Dietemann et al, 2006; De la Rua et al, 2009). De plus, une partie de la production de miel est délaissée par plusieurs apiculteurs au profit des services de pollinisation. Ce service est plus rentable pendant les périodes moins mellifères de l'été. Comme il sera élaboré plus loin, ces deux éléments jouent un rôle important dans les pertes et l'affaiblissement des colonies d'abeilles domestiques.
Les principaux facteurs nuisant à la santé et à la performance de l'abeille domestique sont les parasites et les maladies, les pesticides, la transhumance pour les services de pollinisation et les stress nutritionnels. Plus récemment, on observe, principalement aux États-Unis, un nouveau type de problème qu'on nomme « le syndrome d'effondrement des colonies » (Colony collapse disorder, CCD)(Stokstad, 2007). Ce
problème a été très médiatisé, ce qui a eu pour effet bénéfique de faire tourner l'attention sur les causes du dépérissement des pollinisateurs.
1.1.1 Causes de dépérissement d'Apis mellifera
1.1.1.1 Syndrome d'effondrement des colonies
Le syndrome d'effondrement des colonies cause la mort rapide des colonies d'abeilles dû à la perte au champ des butineuses désorientées. Aucun symptôme n'est perçu avant que les abeilles ne désertent la ruche, laissant le couvain et quelques jeunes ouvrières derrière. La colonie étant trop affaiblie, elle s'effondre. De plus, aucune abeille n'est retrouvée morte près de la ruche. Étrangement, les colonies adjacentes ne pillent pas les ressources des ruches désertées. Les pertes, en nombre de colonies, engendrées par ce phénomène encore mystérieux sont très importantes (Kevan et al, 2007).
Au Canada, l'augmentation des pertes et de l'affaiblissement des colonies a commencé au milieu des années 1990. Le pourcentage moyen de pertes a été de 33 % pour le Canada en 2009 (Pernal, 2009). Par contre, le CCD ne semble pas en être la cause (Currie et al, 2010). Aux États-Unis, le déclin est davantage marqué depuis 2006, année où le syndrome d'effondrement des colonies a été reconnu (Stokstad, 2007). La mortalité des colonies se situe entre 30 et 90 % annuellement (Pemal, 2007). En Europe, un phénomène similaire semble responsable de la mort de milliers de colonies, mais l'acronyme CCD n'est pas utilisé pour le décrire (van Engelsdorp et a l , 2008). Des pertes de l'ordre de 1,8 à 53 % y sont répertoriées (Neumann & Carreck, 2010). Selon Ratnieks et Carreck (2010), le CCD n'est pas causé par un nouveau pathogène, mais plutôt par une combinaison de pathogènes et de parasites déjà connus et présents dans les colonies d'A. mellifera.
Plusieurs facteurs peuvent donc causer l'affaiblissement des colonies d'abeilles domestiques. Par contre, aucun de ces facteurs ne semblent expliquer à lui seul cet 4
affaiblissement. Les facteurs biotiques reconnus sont : l'acarien V. destructor (=jacobsoni) Anderson & Trueman (Acari: Varroidae), les protozoaires Nosema ceranae et N. apis (Microsporidia), les bactéries Paenibacillus larvae et Melissococcus plutonius, l'insecte Aethina tumida Murray (Coleoptera : Nitidulidae) et l'acarien Acarapis woodi (Rennie) (Acari: Tarsonemidae) (Shimanuki et al, 2005). Les agents abiotiques probables sont: les pesticides, la transhumance des colonies pour les services de pollinisation et les stress nutritionnels (Kevan et a l , 2007; Johnson, 2010)
1.1.1.2 Parasites et maladies
Varroa destructor
Le parasite V. destructor est pointé du doigt par plusieurs comme étant l'un des principaux acteurs dans le syndrome d'effondrement des colonies. D'ailleurs, les régions touchées par le CCD sont celles ayant la plus grande pression exercée par cet acarien (Neumann & Carreck, 2010). En Amérique du Sud, où les abeilles africanisées sont résistantes à ce parasite, aucune perte anormale n'a été répertoriée. Cela suggère que le varroa n'est pas le seul responsable des pertes mondiales associées au CCD (Martin & Medina, 2004).
À l'origine, le Varroa était un parasite de l'abeille asiatique (A. cerena). Ayant évolué avec ce parasite, A. cerena nettoie sa ruche à un niveau tolerable d'infestation. Suite à l'introduction d'A. mellifera ligustica (abeilles italiennes) en Indonésie, V. destructor s'est propagé vers l'ouest (Hanley & Duval, 1995). Au Canada, il est présent depuis le début des années 1990 (Simoneau, 2004). Maintenant, il peuple presque toutes les régions du globe où il y a de l'apiculture, à l'exception de l'Australie (Ratnieks & Carreck, 2010).
V. destructor se nourrit de l'hémolymphe des abeilles. Certaines abeilles en meurent et d'autres naissent beaucoup plus petites avec les ailes déformées (Hanley &
Duval, 1995). Cet acarien est aussi porteur de certains virus; le virus israélien de la paralysie aiguë, le virus des ailes déformées et le virus du Cachemire. Ces virus peuvent persister dans une colonie exempte de Varroa, ce qui laisse croire que la transmission de virus se fait aussi entre abeilles (Ratnieks & Carreck, 2010). Au Canada, un autre pathogène a été associé au CCD : Nosema ceranae (Currie et al., 2010).
Nosema apis et iv*. ceranae
Nosema spp. sont des champignons microscopiques unicellulaires qui affectent uniquement les abeilles adultes en infectant les cellules épithéliales de leurs ventricules (Bailey, 1955). Suite à l'infection, les spores produites dans le tractus digestif de l'abeille peuvent être transmises aux autres ouvrières par contact avec les fèces (Fries, 1988). Cette maladie du système digestif (dysenterie) cause une réduction de la production de miel et des mortalités hivernales plus importantes (Higes et al, 2008). Jusqu'à tout récemment, N. apis était principalement connu pour infester A. mellifera, alors que N. ceranae était reconnu pour attaquer l'abeille asiatique. Cette dernière souche a été transmise à l'abeille européenne dans les dernières décennies (Williams et a l , 2008). Au Canada, les premiers spécimens d'abeilles infestées avec N. ceranae ont été observés dans les Maritimes en 2006 et 2007.
Paenibacillus larvae et Melissococcus plutonius
Une maladie bactérienne causant d'importantes pertes économiques est la loque américaine {Paenibacillus larvae) (Kevan, 1999; Forsgren, 2009). Le chercheur américain G.F. White a découvert cette bactérie pathogène associée au couvain en 1906. Cette maladie s'attaque aux très jeunes larves (1 jour) et cause leur mort. Les spores sont transmises par la nourriture infectée offerte aux larves par les nourricières. En très peu de temps, tout le couvain peut être affecté et la colonie, affaiblie, meurt. Les spores peuvent survivre jusqu'à 35 ans dans la ruche (Simoneau, 2002), ce qui rend son contrôle difficile.
La loque européenne, causée par la bactérie Melissococcus plutonius, est moins persistante que la loque américaine puisqu'aucune spore n'est produite (Glare & O' Callaghan, 2008). Les premiers symptômes sont visibles à un stade avancé de la maladie. Les colonies voisines peuvent donc être infectées très rapidement (Charrière et al, 2008). Cette bactérie s'attaque au couvain non operculé, causant la mort des larves (Glare & O' Callaghan, 2008).
Acarapis woodi
L'acarien Acarapis woodi cause l'acariose chez les abeilles adultes. Cette infestation de la trachée cause des dommages mécaniques et physiologiques. L'acarien se nourrit de l'hémolymphe de l'abeille et le nombre élevé de parasites dans la trachée obstrue l'entrée d'air. La trophallaxie est le moyen direct de contamination des abeilles entre elles (Ritter, 2008). Ce parasite a été découvert aux États-Unis en 1984 et malgré des efforts pour le détruire, il s'est propagé (Caron, 2000). Il a été identifié quelques années plus tard au Canada et il s'étend maintenant dans toutes les régions apicoles, sans toutefois être une réelle menace (Ministry of Agriculture and Lands, 2003).
Aethina tumida
Le petit coléoptère des ruches, A. tumida est une nouvelle menace pour l'apiculture canadienne. Il a été répertorié pour la première fois en 2002 au Manitoba et en 2008 au Québec. Aux États-Unis, l'invasion a été très rapide, passant d'un seul état infecté à 29 états en moins de sept ans entre 1996 et 2003 (Neumann & Elzen, 2004). Cet insecte originaire d'Afrique du Sud est très difficile à contrôler. De plus, l'utilisation d'insecticides pour le contrer nuit à l'abeille et augmente les risques de contamination du miel (Hauser, 2004). Les excréments laissés par les larves d'A. tumida dans les rayons font fermenter le miel (Elzen et al, 1999). Selon Eyer et al. (2009), le coléoptère consommant de la cire ou du pollen contaminé peut être infecté par certains virus affectant les abeilles. A. tumida est donc un autre vecteur potentiel de virus pour A. mellifera.
Certains de ces parasites ou pathogènes ne causent pas la mort des colonies lorsqu'ils agissent seuls. Par contre, en combinaison avec d'autres facteurs de stress, ces maladies peuvent nuire au développement et à la santé des abeilles (Glare & O' Callaghan, 2008). Les pesticides, la transhumance des colonies et les stress nutritionnels en sont des exemples.
1.1.1.3 Pesticides
Les pesticides causent des pertes importantes au cheptel apicole (McGregor, 1976; Johnson et al, 2010). Auparavant, l'empoisonnement des abeilles par ces produits phytosanitaires était associé à leur mort subite, donc à des doses létales d'insecticides. Grâce à une meilleure gestion des épandages, l'exposition létale ne représente aujourd'hui qu'une faible partie des effets néfastes causés à A. mellifera (Desneux et al, 2007). D'autre part, le développement de technologies récentes {e.g. OGM, semences enrobées) et de nouvelles molécules chimiques, se voulant moins toxiques, crée une nouvelle problématique pour l'industrie apicole. Les conséquences sub-létales provenant d'intoxications chroniques aux insecticides sont plus subtiles et peuvent être confondues avec des pathologies (Charrière et al., 2006). Les abeilles ingèrent les pesticides présents dans le pollen et le nectar des plantes qui ont été traitées. Ces substances toxiques peuvent y persister plusieurs jours (Barker et a l , 1980). Des dérèglements comportementaux, neurologiques, de mobilité, d'alimentation, de fécondité de la reine et d'orientation sont notés dans les cas d'intoxications à doses réduites (Desneux et al., 2007).
Les insecticides sont les pesticides causant le plus de dommages aux abeilles. Une étude de Frazier et al. (2008) a permis de découvrir 46 pesticides et six de leurs metabolites dans du pollen récolté par des abeilles. De cela, les insecticides étaient présents dans 50 % des échantillons analysés dont des pyréthroïdes, des organophosphorés, des carbamates et des néonicotinoïdes étaient en tête de liste. Notamment, ces quatre familles sont considérées comme étant les plus toxiques pour A. mellifera. Les insecticides sont très
perturbateurs pour l'abeille domestique et cette dernière ne bénéficie d'aucune protection légale malgré son rôle d'auxiliaire indispensable en agriculture (Haubruge et al, 2006).
Contrairement aux insecticides, les herbicides sont indirectement impliqués dans la santé des abeilles. Leur application joue un rôle important dans la diminution de la diversité et de l'abondance des plantes pollinifères et nectarifères dans la mosaïque agricole. Au Danemark, Andreasen et al. (1996) ont démontré que la fréquence des plantes adventices présentes autour des cultures a diminué d'environ 60 % entre 1970 et 1990. Cette flore est indispensable aux colonies d'abeilles introduites pour la pollinisation. Elle offre des ressources complémentaires en pollen et en nectar nécessaires au bon développement des colonies (Haubruge et a l , 2006).
Les fongicides affectent également l'abeille domestique. Selon Thompson et Wilkins (2003), ces derniers peuvent causer une mort anormale des larves et une malformation des abeilles adultes ayant été exposées lors de leur développement. Certains fongicides ont un effet répulsif pour A. mellifera lorsque mélangés à du sirop de sucre (Ladurner et a l , 2005). Une autre étude évalua la synergie entre les fongicides et les insecticides pyréthroïdes et détermina que les doses létales (DL50) d'insecticides administrées à l'abeille diminuèrent entre deux à six fois lorsque les fongicides y étaient ajoutés (Thompson & Wilkins, 2003).
Finalement, Alaux et al, (2010a) ont démontré pour la première fois qu'une interaction entre un organisme infectieux, Nosema sp. et un produit phytosanitaire, l'insecticide imidaclopride pouvait menacer les pollinisateurs.
1.1.1.4 Transhumance pour les services de pollinisation
Les services de pollinisation entraînent nécessairement la transhumance des colonies de leur rucher respectif aux cultures à polliniser. Ce transport sur de longues distances peut être une autre source de stress important pour les abeilles. Le confinement dans les camions, la chaleur, les vibrations, le manque d'eau et l'air vicié sont des paramètres altérant la santé et la résistance dM. mellifera. Lorsque les colonies sont transportées inadéquatement, la vulnérabilité aux autres stress abiotiques et biotiques auxquels les abeilles sont déjà confrontées s'accentue (Kevan et a l , 2007; Oldroyd, 2007).
1.1.1.5 Stress nutritionnels lors des services de pollinisation
Le but premier de l'abeille lors de la pollinisation d'une culture est la quête de nourriture (Severson & Parry, 1981). Le nectar étant la principale source de glucides, le pollen fournit les minéraux, les vitamines, les lipides et les acides aminés (de Groot, 1953). Eckert (1942) a affirmé que le miel est essentiel pour la vie des abeilles adultes, mais que le pollen est un facteur vital pour prolonger la vie d'une colonie. De plus, les stress nutritionnels aggravent la santé des abeilles déjà affectées par des pathogènes (Glare & O' Callaghan, 2008). La pollinisation de monocultures peut donc créer un déséquilibre alimentaire chez les abeilles (Westerkamp & Gottsberger, 2002; Kevan & Ebert, 2005; Oldroyd, 2007).
Les monocultures dans lesquelles les colonies sont introduites pour les services de pollinisation arborent une flore souvent très pauvre en diversité (Brodschneider & Crailsheim, 2010). Les butineuses sont, de toutes évidences, contraintes à visiter presqu'exclusivement une seule espèce de fleur. Johnson (2010) affirme que les colonies utilisées pour les services de pollinisation subissent un stress nutritionnel important. Pour optimiser la pollinisation, un nombre plus élevé que nécessaire de ruches sont introduites
dans les champs. Ces champs sont saturés en butineuses, mais la culture ne peut pas fournir assez de ressources pour nourrir cette population disproportionnée. De plus, le pollen de certaines cultures ne rencontrent pas les besoins nutritionnels des abeilles et les butineuses volent à l'extérieur des champs pour trouver une flore plus diversifiée (Westerkamp & Gottsberger, 2002; Johnson, 2010).
1.1.2 Besoins nutritionnels d'Apis mellifera
Différentes sources de pollen doivent être disponibles aux butineuses pour la survie à long-terme et le maintien des performances optimales de l'ensemble de la ruche (Keller et a l , 2005). Schmidt et al, (1987) ont affirmé que les abeilles nourries avec un mélange de grains de pollen provenant de sources diversifiées vivent plus longtemps que celles ayant accès à une source de pollen peu diversifiée. De leur côté, Pernal et Currie (2000) ont démontré que le développement des glandes hypopharyngiales et des ovaires est influencé par la consommation de pollen. Alaux et al. (2010b), appuient ces auteurs en affirmant qu'une diversité en pollen confère aux abeilles une meilleure protection antiseptique dans la ruche. Ces quelques études confirment donc l'importance d'une diète diversifiée en pollen.
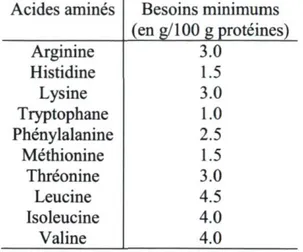
En apiculture, un des plus importants facteurs limitatifs est l'apport en pollen. La qualité de celui-ci est aussi cruciale. La consommation d'une source de protéine déficiente en un seul acide aminé essentiel affecte l'équilibre physiologique et la croissance de l'abeille, peu importe la quantité consommée de cette source de protéines. De tous les acides aminés présents dans les protéines, dix sont essentiels pour les abeilles puisqu'ils ne peuvent pas être synthétisés par leur métabolisme. Ce sont l'arginine, l'histidine, la lysine, le tryptophane, la phenylalanine, la methionine, la threonine, la leucine, l'isoleucine et la valine (Tableau 1.1) (de Groot, 1953).
Tableau 1.1 Besoins minimums requis pour les dix acides aminés essentiels à l'abeille domestique (en g/100 g protéines)
Acides aminés Besoins minimums (en g/100 g protéines) Arginine 3.0 Histidine 1.5 Lysine 3.0 Tryptophane 1.0 Phenylalanine 2.5 Methionine 1.5 Threonine 3.0 Leucine 4.5 Isoleucine 4.0 Valine 4.0 (Source : de Groot, 1953)
Comme mentionné précédemment, le pollen représente la seule source de protéines pour A. mellifera. Plus précisément, le pain d'abeille (pollen traité avec des enzymes pour la conservation dans les alvéoles) est utilisé par les abeilles nourricières pour nourrir les larves tout au long de leur développement. Lorsque les larves sont sous-alimentées, il en résulte des abeilles naines. Ces carences peuvent survenir lorsque les colonies sont malades, sous-peuplées, que le couvain est élevé très tôt au printemps ou dans des environnements comme les monocultures, où l'abondance et la richesse en pollen est faible (Winston, 1991; Brodschneider & Crailsheim, 2010).
Pour transporter le pollen d'une fleur à l'autre et ainsi assurer le développement d'un fruit, l'abeille doit fréquenter de façon intensive les organes reproducteurs de la fleur. Il est connu que la présence de couvain stimule le nombre total de butineuses de pollen comparativement aux butineuses de nectar (Free, 1970; Herbert Jr., 2005). Ainsi, pour offrir de bonnes performances lorsqu'elles sont utilisées pour les services de pollinisation, les colonies introduites doivent avoir une grande quantité de couvain à élever. De plus, il
est important que la colonie demeure forte en quantité totale d'abeilles car le nombre de butineuses est fonction du nombre total d'individus dans la ruche (Tableau 1.2).
Tableau 1.2 Nombre de butineuses dans une colonie en fonction du nombre total d'abeilles. Abeilles Butineuses 10 000 Peu nombreuses 15 000 2 000 20 000 3 000 30 000 7 000 45 000 18 000 60 000 30 000 (Source: Boucher, 2008)
Un apport adéquat en pollen est donc très important, et ce, particulièrement au printemps. Les colonies commenceront à élever du couvain beaucoup plus tôt si elles ont accès à du pollen en quantité suffisante. Lorsque le climat printanier n'est pas clément, les suppléments de pollen peuvent aider au développement de la ruche, si l'obtention rapide d'une colonie forte est nécessaire. Par contre, les abeilles peuvent continuer à avoir des carences alimentaires, même en été, dues aux pratiques commerciales. La pollinisation de plusieurs cultures consécutives dans la même saison apicole en est un exemple. Des problèmes plus graves peuvent donc survenir si les colonies subissent des carences nutritionnelles tout au long de la saison estivale parce qu'elles entreront en hivernation avec des capacités affaiblies (Mattila & Otis, 2006).
1.2 Services de pollinisation au Québec
Au Québec, les colonies d'abeilles sont surtout sollicitées pour la pollinisation des cultures de petits fruits. Les deux cultures en importance sont le bleuet nain {Vaccinium angustifolium Aiton, Ericaceae) et la canneberge {V. macrocarpon Aiton, Ericaceae). Les superficies des bleuetières et des cannebergières ont connu un essor important ces dernières années. En effet, la superficie totale des bleuetières cultivées au Québec a augmenté de 21 % depuis 2006, atteignant 28 231 ha en 2008. Pour ce qui est de la canneberge, les superficies sont un tiers plus grandes qu'en 2006, grimpant à 1 843 ha en 2009 (Association des Producteurs de Canneberges du Québec, 2009; Lavaute, 2009).
À l'opposé, le cheptel québécois d'A. mellifera ne connaît pas une hausse proportionnelle à l'accroissement récent des superficies des cultures de bleuets nains et de canneberges. En 1998, il y avait 29 797 ruches dans la province (calcul incluant seulement les apiculteurs ayant plus de 6 colonies) et en 2006 on en dénombrait 35 545 (Institut de la statistique du Québec, 2009). Au cours de ces neuf années, il y a eu beaucoup de fluctuations dues, entre autres, à l'acarien V. destructor. Ce parasite a causé beaucoup de pertes en 2003, diminuant le nombre de ruches à 22 806 (Institut de la statistique du Québec, 2009). Dû à la grande demande, les mêmes colonies sont transhumées dans les bleuetières et les cannebergières successivement dans la saison apicole. Dans le jargon apicole, ce phénomène est appelé «double transhumance».
Les cultures du bleuet nain et de la canneberge demandent une régie intensive des plantes nuisibles. L'environnement dans lequel les colonies sont introduites pour la pollinisation est donc plutôt pauvre en diversité florale. De ce fait, la faune pollinisatrice indigène y est aussi très réduite (Evans & Spivak, 2006). Avec l'augmentation des superficies et la destruction des habitats des pollinisateurs indigènes, l'introduction d'A.
mellifera devient essentielle pour assurer des rendements acceptables. Plusieurs études ont été conduites depuis et toutes ont démontré que sans pollinisateur domestique, la mise à fruit du bleuet et de la canneberge serait pratiquement inexistante (Aras et a l , 1996; Usui et a l , 2005; Evans & Spivak, 2006).
1.2.1 Le bleuet
1.2.1.1 La plante
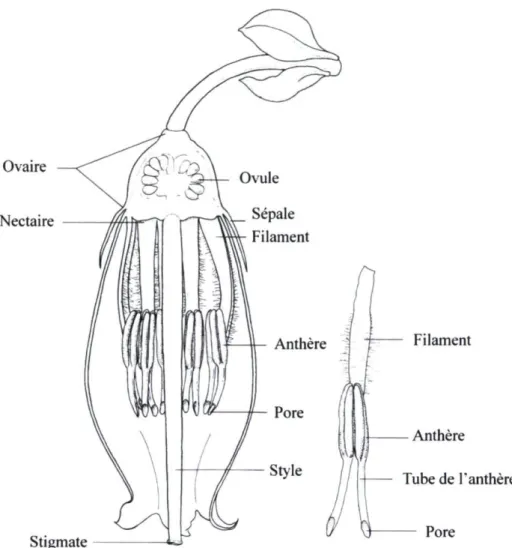
Le bleuet nain est une plante indigène qui peuple une grande partie de la forêt boréale de l'Amérique du Nord. Il préfère les sols acides et bien drainés dans des environnements clairsemés. Par contre, les bleuetiers peuvent aussi être rencontrés dans les ouvertures des forêts très denses (Usui et al, 2005). D'importantes cultures commerciales de bleuets ont été développées en défrichant des parcelles naturellement peuplées par le bleuet (Javorek et al, 2002). Le bleuetier est une plante pouvant atteindre 30 cm de hauteur. Il se développe à partir d'une graine et se propage en un seul clone par rhizomes pouvant former une colonie de près de 12 m de diamètre (McGregor, 1976). Les fleurs ont une corolle de cinq pétales blancs-rosés fusionnés formant une cloche de cinq à sept millimètres de profondeur (Figures 1.1 et 1.2). Deux anneaux de cinq étamines sont placés autour d'un long style (Figure 1.1). Le stigmate n'ayant pas reçu de pollen reste réceptif entre cinq à huit jours. Le style continue à s'allonger jusqu'à dépasser la corolle pour augmenter les chances de contact avec des grains de pollen compatibles. Deux jours suivants la pollinisation, le stigmate devient non-réceptif et la corolle tombe (McGregor, 1976). Pour atteindre le nectar, les abeilles doivent insérer leur proboscis entre les filaments des anthères (Javorek et al, 2002).
1.2.1.2 La régie des plantes nuisibles dans les bleuetières
La régie des plantes nuisibles est très intensive dans les bleuetières. À tous les deux ans, les plants de bleuets sont fauchés au ras du sol. Cette fauche permet aux plants de faire des réserves dans leurs rhizomes. La première année de floraison est celle donnant les meilleurs rendements, ce qui explique que les plants soient fauchés après deux ans maximum (Trehane, 2004). Avant la repousse, tous les champs sont traités avec des herbicides. La matière active la plus utilisée est l'hexazinone (Gagnon, 2005). Il cible les dicotylédones et les graminées herbacées (SAgEPesticides). La flore présente dans et autour des champs de bleuets est donc réduite au minimum. Tel que mentionné précédemment, ce manque de diversité florale affecte très négativement la survie et l'établissement des pollinisateurs sauvages. Finalement, la culture du bleuet nain au Québec est peu touchée par les insectes ravageurs et les maladies fongiques. Il n'y a donc pas d'utilisation d'insecticides ou de fongicides.
1.2.1.3 Les besoins en pollinisation du bleuet
La fleur du bleuetier ne peut être autofécondée (Westerkamp & Gottsberger, 2000). De ce fait, la pollinisation croisée est requise pour l'obtention de bons rendements dans les bleuetières (McGregor, 1976). L'intérêt d'introduire des pollinisateurs pendant la floraison est donc très justifié. Toutefois, contrairement aux pollinisateurs indigènes naturellement présents dans les bleuetières, l'abeille domestique n'est pas en mesure de faire de la pollinisation vibratile (« buzz pollination »). Cette vibration permet de faire sortir le pollen des anthères poricides (Karmo, 1974). A. mellifera est donc beaucoup moins efficace dans le transport du pollen d'une fleur à l'autre. Selon Javorek et al. (2002), elle doit visiter la même fleur 4,3 fois plus que le bourdon {Bombus sp.) pour y apposer la même quantité de pollen. Par contre, Cane et Schifferhauer (2003) spécifient qu'un pollinisateur apposant le double du pollen nécessaire pour la mise à fruit n'est pas plus efficace qu'un insecte
apportant le nombre minimal de grains de pollen requis. Il est vrai que les abeilles sauvages sont très importantes étant donnée leur grande efficacité, mais la plupart ne volent pas à plus de 200 mètres de leur nid. Il y a donc trop de fleurs dans les bleuetières commerciales pour qu'elles puissent toutes être pollinisées par les abeilles sauvages (Javorek et al, 2002). L'introduction d'abeilles domestiques permet donc une mise à fruits plus uniforme (Evans & Spivak, 2006).
Selon Javorek et al. (2002), les abeilles ne butinent pas le pollen, mais bien le nectar dans les fleurs de bleuetiers. Lors d'une étude, seulement deux à 10 % des abeilles domestiques furent trouvées portant du pollen de V. angustifolium dans les bleuetières (Mackenzie et a l , 1996). C'est donc grâce à l'action pollinisatrice d'un grand nombre d'individus que les colonies d'abeilles domestiques améliorent les rendements des bleuetiers et non par l'efficacité individuelle des butineuses.
1.2.2 La canneberge
1.2.2.1 La plante
La canneberge pousse naturellement dans les milieux tourbeux et acide (Centre d'interprétation de la canneberge, 2010) entre les 40°N et le 50°N parallèles de l'ouest ontarien jusqu'à la côte est canadienne (Trehane, 2004). Les plants peuvent être productifs pendant plusieurs dizaines d'années (McGregor, 1976). En culture commerciale, plusieurs bonnes plantations ont été réalisées sur des argiles bleues ou des sables, malgré la préférence des plants pour les tourbières et les terres noires (Pickett et al, 1949).
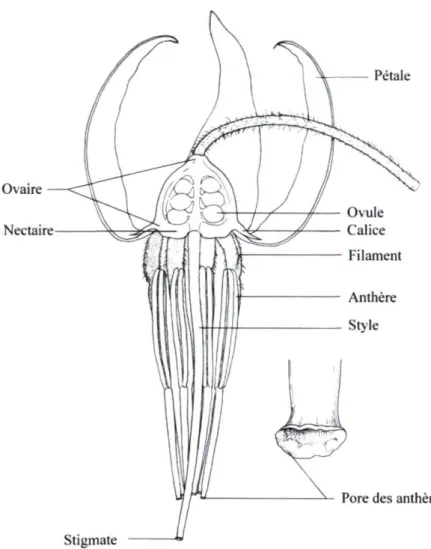
Les branches atteignent de 15 à 45 cm de hauteur et portent des feuilles oblongues et semi-persistantes d'environ 1,25 cm de longueur. Des racines se forment le long des tiges horizontales pour former un tapis très fourni. Les fleurs sont produites sur les courtes
tiges dressées pouvant en porter entre deux à sept. Elles sont formées de quatre sépales et de quatre pétales rosés (Figures 1.3 et 1.4). Lors de l'ouverture de la fleur, les pétales se courbent pour exposer un stigmate entouré de huit étamines.
1.2.2.2 La régie de culture
L'utilisation de pesticides est inévitable dans les cultures intensives de canneberges. Les insecticides demeurent l'outil le plus efficace contre plusieurs ravageurs du feuillage, des fruits et des racines. Les abeilles domestiques et les autres pollinisateurs indigènes subissent les effets de ces applications (Loose et a l , 2005). Certains insecticides sont répulsifs pour les pollinisateurs. Les dernières fleurs ne sont pas pollinisées puisque les pollinisateurs ne retournent pas au champ (Strik et a l , 2002).
Pour contrer les plantes nuisibles, le sarclage manuel est efficace dans les premières années d'implantation de la canneberge. Si l'infestation prend trop d'ampleur, des herbicides sont appliqués (Thomas, 2003). Les sites de nidification et les sources de nourriture pour les pollinisateurs sont donc perturbés.
1.2.2.3 Les besoins en pollinisation de la canneberge
Les fleurs de la canneberge sont auto-fertiles, mais la pollinisation croisée permet une meilleure mise à fruits, des fruits plus gros donc des rendements supérieurs (Thomas, 2003). Le pollen est relâché par les tubes des anthères lorsque la fleur est secouée (Trehane, 2004). Pour empêcher l'autopollinisation d'un plant, le pollen des fleurs est relâché avant que le stigmate soit réceptif (McGregor, 1976; Marucci & Moulter, 1997; Trehane, 2004). La fenêtre idéale pour la mise à fruit est entre le troisième et le dixième jour de l'ouverture
de la fleur. Si la fleur n'est pas fécondée, elle reste réceptive entre deux à trois semaines (McGregor, 1976).
Quelques chercheurs ont affirmé que l'action du vent permet une partie de la pollinisation des fleurs de la canneberge (Brown & Mc Neil, 2006). Par contre, la plupart des auteurs confirment que les pollinisateurs sont essentiels pour une mise à fruits optimale dans les cannebergières (Hall & Murray, 1968; Free, 1970; McGregor, 1976; Trehane, 2004; Usui et al, 2005), le pollen des fleurs de la canneberge étant trop lourd et collant pour être efficacement transporté par le vent.
Cette plante sécrète très peu de nectar et, dans quelques régions, elle n'en produit pas du tout (Kevan et a l , 1983; Ramsay, 1987; Cane & Schiffhauer, 1997). De plus, ce nectar n'est pas attractif pour les abeilles. Par contre, quelques études évoquent le fait que les butineuses visitent la canneberge plus souvent pour son nectar que pour son pollen (Mackenzie, 1994; Trehane, 2004). En dépit de ces études contradictoires, la présence des abeilles sur les fleurs permet une maturation plus uniforme des fruits, car l'action pollinisatrice de ces dernières enclenche aussitôt une mise à fruits (McGregor, 1976; Evans & Spivak, 2006).
1.3 Recherche proposée
La présente recherche vise à déterminer si, et dans quelle mesure, les monocultures de Vaccinium (bleuets nains et canneberges) nuisent à la santé des colonies d'abeilles dû à une diversité appauvrie des sources de pollen environnantes. A notre connaissance, aucune étude n'a encore ciblé l'importance de l'environnement floral dans lequel les colonies d'abeilles domestiques sont introduites pour offrir des services de pollinisation au Québec. Dans cette étude, la diversité florale a été déterminée via l'identification des grains de pollen rapportés aux ruches par les abeilles elles-mêmes et non par l'inventaire des plantes présentes dans les environnements étudiés. Les résultats de ce projet pourront permettre une gestion plus éclairée de l'amélioration de l'environnement pollinifère et nectarifère de cultures de Vaccinium, tributaires des pollinisateurs.
1.4 Objectifs du projet
1.4.1 Objectif général
L'objectif général de mon projet de maîtrise est d'examiner l'importance et l'influence de la diversité florale dans la mosaïque des cultures de Vaccinium (bleuets nains et canneberges) sur la performance des colonies d'abeilles domestiques introduites pour la pollinisation.
1.4.2 Objectifs spécifiques
Les objectifs spécifiques sont :
• Évaluer la diversité en taxons végétaux (familles, genres ou espèces) disponibles pour les abeilles dans les cultures du bleuet nain et de la canneberge via l'identification des grains de pollen (palynologie) récoltés par les abeilles.
• Déterminer si les colonies ont accès à une plus grande diversité florale dans les cultures de Vaccinium vs. les champs témoins.
• Déterminer si l'accessibilité à une grande vs faible diversité florale a un effet sur le développement des colonies en termes de surface du couvain et poids de la ruche.
• Déterminer si la diversité florale nuit ou contribue à l'augmentation des rendements en fruits des cultures de Vaccinium.
1.5 Hypothèses du projet
1.5.1 Hypothèse générale
L'hypothèse générale qui fur testée est la suivante : la performance des colonies d'abeilles domestiques est négativement affectée lors de leur présence dans les cultures de
Vaccinium offrant une faible diversité florale, nuisant ainsi aux services de pollinisation.
1.5.2 Hypothèses spécifiques
Les hypothèses spécifiques sont :
• Les colonies d'abeilles subissant une double transhumance dans des cultures de Vaccinium sont exposées à une plus faible diversité florale comparativement aux colonies témoins.
• Le développement des colonies subissant un manque de pollen diversifié est affecté négativement.
• Les rendements en fruits dans les cultures offrant une grande diversité florale sont plus élevés.
Diversity of pollen harvested by honeybees in the surrounding of Vaccinium spp. crops and its importance for the development of honeybee colonies*
*Ce manuscrit sera soumis au journal Apidologie pour révision par les pairs et publication. Les auteurs sont Mélissa Girard, Valérie Fournier (Centre de recherche en horticulture, Université Laval) et Madeleine Chagnon (Département des sciences biologiques, Université du Québec à Montréal).
Résumé
L'accessibilité à une flore diversifiée est très importante pour le développement des colonies d'abeilles domestiques introduites dans une culture pour offrir un service de pollinisation. Notre étude visait à déterminer l'impact de la diversité florale environnante sur la santé des colonies d'abeilles introduites dans les cultures de bleuet nain {Vaccinium augustifolium) et de canneberge (V. macrocarpon) au Québec (Canada). Les résultats suggèrent que les monocultures de bleuets nains n'offrent pas une flore adéquate pour l'élevage optimal du couvain. Les plantes qui furent le plus butinées dans cet environnement, Alnus spp. et Taraxacum officinale, sont déficientes en certains acides animés essentiels à l'abeille. La diminution significative {P = 0.0067) de la surface de couvain dans les monocultures de bleuets en juin pourrait donc être expliquée par des carences alimentaires. En juillet, la flore pollinifère fut moins riche qu'en juin, mais avait de meilleures qualités nutritionnelles. Les taxons dominants furent les Brassicaceae, Trifolium spp. et V. macrocarpon. Malgré la diminution de la surface du couvain dans les monocultures de bleuets, l'état de santé des colonies s'améliora lors de leur séjour dans les cannebergières du même traitement, sans toutefois atteindre le même niveau de santé que les colonies qui eurent accès à une flore davantage diversifiée pendant la même période.
Abstract
Access to a rich diversity of flora is very important for the development of honeybee colonies introduced in crops for pollination services. The aim of this study was to determine the impact of surrounding floral diversity on the health of honeybee colonies introduced in crops of lowbush blueberries ( Vaccinium angustifolium) and cranberries ( V. macrocarpon). The results suggest that monocultures of lowbush blueberries are not suitable for optimal brood rearing. In this environment, the dominant pollen sources were Alnus spp. and Taraxacum officinale. These plants are deficient in certain amino acids essential for the honeybees. Significant reduction of brood rearing during their stay in blueberry monocultures in June could therefore be explained by nutritional deficiencies. In July, the polliniferous flora was poorer than in June, but offers a better nutritional quality. Pollen analysis allowed the identification of Brassicaceae, Trifolium spp. and V. macrocarpon as the three dominant taxa foraged in the monocultures of cranberries. Despite a decrease in their brood surface, the colonies introduced in the blueberry monocultures regained strength during their stay in the cranberry fields. However, they did not reach the same force as the colonies which had access to a richer flora during the same period.
2.1 Introduction
A combination of many factors has been causing a decline in the world honeybee's livestock. Although the Varroa mite is pointed out as being the main parasite responsible for the losses of colonies (Neumann & Carreck, 2010), many other pathogens, such as Nosema ceranae (Currie et al., 2010) as well as a few viruses (Bromenshenk et al, 2010; Ratnieks & Carreck, 2010) are known to affect the honeybee's health. Pesticides (Charrière et al, 2006; Desneux et al, 2007) and commercial beekeeping practices (e.g. migration to crops (Kevan et al, 2007)) are also important factors known to be causing lethal and sub lethal stresses to honeybee colonies.
Over the last decades, the intensification of agriculture, combined with the use of herbicides on immense areas, have profoundly changed the agricultural landscape via the depletion of natural floral diversity (Brodschneider & Crailsheim, 2010). Simultaneously to this phenomenon, pollinator-dependant crops have expanded tremendously, increasing the demand for commercial pollination services (Klein et al. 2007; Aizen and Harder 2009). Thus, the crops in which honeybee colonies are introduced for pollination tend to offer low floral diversity, forcing the foraging bees to extensively visit a single plant species (Brodschneider & Crailsheim, 2010). Furthermore, in order to optimize pollination, the fields are often over-crowed with honeybees (Johnson, 2010). The nectar and pollen resources thus become too scarce to feed the disproportionately high number of honeybees sheltered in the hives brought in for pollination. Also, the pollen of some cultivated plants cannot satisfy the nutritional needs ofthe developing honeybee colonies (de Groot, 1953; Westerkamp & Gottsberger, 2000). Therefore, indigenous flora established in the areas surrounding the crops is still essential for pollinators because it serves as a complementary source of pollen and nectar (Haubruge et a l , 2006). As a result of this loss in floral diversity, colonies used for crop pollination are subjected to an additional stress factor: nutritional deficiencies (Westerkamp & Gottsberger, 2002; Kevan & Ebert, 2005; Oldroyd, 2007; Glare & O' Callaghan, 2008).
In the province of Quebec, Canada, pollination services by honeybees are requested mainly for two small fruit crops: lowbush blueberries {Vaccinium angustifolium Ait., Ericaceae) and cranberries {Vaccinium macrocarpon Ait., Ericaceae). In the last five years, the surface area of these two crops increased respectively by 24 and 35 percent (Association des Producteurs de Canneberges du Québec, 2009; Lavaute, 2009). Consequently, the demand for honeybee hives for pollination rose proportionately to this increase in acreage of Vaccinium crop lands. Unfortunately, Vaccinium crops often offer environments showing a poor floral diversity. To further compound this problem, the same honeybee colonies are regularly used to pollinate the two crops consecutively in the same season. Little information is available on several key questions regarding this subject, for instance: 1) To what extent are honeybees restricted to lower floral diversity when hives are placed successively in two Vaccinium crops in the same season? 2) How is the colonies' development (e.g. hive weight variations and brood surface evolution) affected by this potential lack of pollen diversity?
In an attempt to answer these important questions, our main objectives were to 1) assess the importance of floral diversity in the surrounding landscapes of lowbush blueberry and cranberry crops via the sampling to the pollen brought in to the hives by the bees, and 2) examine the development of honeybee colonies therein introduced for pollination. No study, to our knowledge, has yet investigated the effects of floral diversity of crop surroundings on the health of honeybee colonies introduced for commercial pollination services. The results of our study will provide a better understanding of the natural floral diversity found in the vicinity of blueberry and cranberry fields, consequently enabling the further improvement of the adjacent landscapes of these crops that are very dependent of honeybees and other pollinators for optimal fruit set.
2.2 Materials and Methods
2.2.1 Honeybees supplies
The colonies of honeybees were Apis mellifera ligustica mixed with primovski and came from the Centre de Recherche en Sciences Animales de Deschambault (CRSAD), Quebec, Canada. Thirty-six hives were used. Their brood frame surfaces were evened in late spring. There was an average of 30 400 cells of brood per hive.
2.2.2 Study regions
The study took place in 2008 and 2009 in different regions within the province of Quebec in Canada. The experimental blueberry fields were located in the Côte-Nord area in 2008 (48° 44' 00" North; 69° 06' 00" West) and in the Lac St-Jean area in 2009 (48° 53' 00" North; 72° 14' 00" West). The cranberry fields were in the Bois-Francs region for both years (46° 30' 00" North; 75° 59' 00" West). These three regions are the most important production areas for their respective crops in the province of Quebec.
2.2.3 Study sites and treatments
Three different treatments were compared; 1) Vaccinium farms offering low floral diversity in their surroundings, also called monocultures (commercial farms) (V); 2)
Vaccinium farms offering high floral diversity (none commercial farms) (VF); and 3) fields offering high floral diversity from a minimum of 5 km away from any Vaccinium production (F) = control plots. Treatments were repeated four times, for a total of 12 study sites, and three experimental hives were placed at each site (= 36 hives). Study sites were
selected with the help of a GPS and the software ArcGIS. All study sites were at least five kilometres apart to avoid overlapping in the honeybees foraging areas.
In early June, the hives were transported from Deschambault to the blueberry fields and control plots for a three-week stay. At the end of June, the hives were brought back to the Deschambeault for brood evaluation prior to being transported in the cranberry fields and control plots at the beginning of July. After spending two to three weeks for cranberry pollination, the hives were finally brought back to Deschambault for the remaining of the beekeepeing season. For the second year of the study (2009), new experimental colonies were used.
Pollen sampling and its identification took place on both years of the study (2008 and 2009), while data on colony weight, brood surface and fruit yields were collected for 2009 only.
2.2.4 Pollen sampling
Floral diversity was indirectly sampled through the sampling, both quantitatively and qualitatively, of the pollen taxa foraged by the honeybees themselves. Thus, no surveying of the entire melliferous flora found in the surroundings of the sites took place. The collection of the pollen pellets harvested by honeybee foragers was done using two methods. First, a pollen trap (Shaparew's model) was installed randomly on one of the three hives at each one ofthe 12 sites. Drawers were emptied at each visit, i.e. every other day, and the pollen pellets were frozen until analysis. Second, foragers coming back to the hives were captured (N= approx. 40) using an insect net (Figure 2.1). Captures were done at each visit ofthe sites. Captured bees were put on dry ice and frozen until analysis. Pellets were removed from the pollen baskets using forceps.
2.2.5 Pollen identification
From each bag of pollen harvested in pollen traps, two sub-samples of one gram were removed after mixing the whole sample (Louveaux, 1958). The sub-samples were sorted into lots according to the different colors of the pellets under normal and UV light (Figure 2.2). For each color lot, a quantity equivalent to a tip of a needle of pollen was mounted on a microscope slide with glycerine-gelatine dyed with fuchsine (Louveaux et a l , 1970). The pollen grains were identified under the microscope (xlOOO) either to the plant family, the genus or the species-level when possible using a collection of reference and a taxonomie key (Moore & Webb, 1983).
Pollen pellets on the hind legs of the foragers were removed and mixed together with distilled water (2ml) to form a homogeneous mixture. A small drop of this mixture together with the glycerine-gelatine was placed on two different glass slides and covered with a glass cover. One hundred grains were identified randomly on both slides.
2.2.6 Colony weight variations
The weight gain (production of honey and brood) of each colony was taken prior to its introduction in the blueberry fields and every other day during the pollination period of blueberries and cranberries. After the second pollination, the weight was thereafter taken once a week (Figure 2.3).
2.2.7 Brood surface evaluation
For each hive, the brood surface (Figure 2.4) was evaluated to the square inch and converted to a number of cells. Brood surface evaluation was performed five times during the study: 1) prior to the introduction in the blueberry fields (late May), 2) between stays in the blueberry and cranberry fields (late June/early July), 3) after their stay in cranberry fields for pollination (late July), 4) before wintering (October) and 5) after wintering (April ofthe following year).
2.2.8 Fruit yields
At each Vaccinium site (V and VF), three pollination exclusion cages (0.5 m2 in blueberry fields and 0.25 m2 in cranberry fields) were installed randomly in the fields before flower bloom. When fruits were ripped, the fruits from these caged plots as well as those from the three open field pollinated plots were harvested. Yields were compared between the treatments to determine is the floral diversity facilitates or makes competition to the fruit set.
2.2.9 Statistical analyses
2.2.9.1 Weight and brood surface
The comparison of weight gain for hives of different treatments (V, VF, F) was done by means of an ANCOVA model using the initial hive weight as a covariate. A repeated measure ANOVA was done to compare the evolution of those treatments through time. The dependency between observations from the same hive at different times was taken into account by adjusting a heterogeneous autoregressive covariance structure to the
data. This dependency structure was the one that best described the data as showed by Akaike information criteria (AIC). Finally, another repeated measure ANOVA was done to compare the brood surface variations throughout time. This variable was transformed ( [brood/1 OOO]2) to satisfy the assumptions ofthe model and the dependency structure that best described the data was the autoregressive covariance structure. All statistical analyses were performed with SAS-STAT proc MIXED (SAS institute inc., 2008) at the a - 0.05 level of significance. For all models, the assumption of normality was verified with the Shapiro-Wilk's test, while the homogeneity of variances was verified with the traditional residual plots.
2.2.9.2 Pollen analyses
Jaccard's indexes were used to study the similarity of species richness between each treatment. The diversity at each site was calculated with Simpson's index (Peet, 1974). The analyses were done with MVSP 3.1 (Kovach Computing Services, Wales, U.K.). A Wilcoxon test for paired samples was used to find significant differences between the treatments (SIMSTAT, 1996). Finally, the rarefaction curves were done using R software (The R Foundation for Statistical Computing, 2009).
2.2.9.3 Fruit yields
A Student t-test was done to compare the two fruit yield averages of the treatments V and VF. The statistical analyse was performed with the SAS/STAT proc GLM (SAS institute inc., 2008) at the a = 0.05 level of significance.
2.3 Results
2.3.1 Pollen taxa abundance and richness
A total of 2257 microscope slides of pollen were examined in order to identify plant taxon and their relative abundance. Overall, 61,720 taxon occurrences were registered for both years combined. Dominance of plant taxa was determined by counting relative occurrence of pollen pellets (traps) and grains (hind legs) of each of these taxa. In 2008, pollen grains from 916 microscope slides included 43 and 32 different taxa from the blueberry and cranberry crop environments, respectively. In 2009, pollen grains from 1341 observed slides included 54 and 34 different taxa for the same crops (Annex 1). During these two crop's pollination periods, the co-flowering plants in the study sites contained trees, shrubs, herbaceous plants and grasses (Table 2.1 and Annex 1). Jaccard's community indexes revealed that the plant taxa identified by pollen analysis differed greatly for these two crops and their flowering periods in both 2008 (0.154) and 2009 (0.110). In addition, Jaccard's index for the flora in the two blueberry production regions, i.e. Lac Saint-Jean (2009) and Côte-Nord region (2008) was 0.431.
In 2008, the dominant taxa recorded in June in the blueberry environment were Acer spicatum (Aceraceae) and Nemopanthus sp. (Aquifoliaceae) while in the cranberry field, in July, the dominant taxa were Trifolium sp. (Fabaceae) followed by V. macrocarpon. Overall, the ten most dominant taxa counted for up to 89.9 and 90.8 % ofthe total number of identified pollen pellets for June and July, respectively (Table 3 A).
Data analysis of the pollen harvested during the 2008 blueberry pollination period shows that the Jaccard's similarity indexes calculated for the V {Vaccinium farms offering low floral diversity) and VF {Vaccinium farms offering high floral diversity) sites were more identical between each other regarding their taxon listings than to that of samples from the F sites (control). The V and F sites are the furthest apart (Table 2.2 A). However,
when taking into account the abundance of each of these taxon (number of pellets and grains), the Simpson's diversity indices were comparable for all V (0.925), F (0.942) and VF (0.934) sites (Table 2.3 A) and no significant differences were found between sites, using a Wilcoxon matched-pairs sign rank test.
Still in 2008, but for the cranberry field, Jaccard's similarity indexes showed that it was treatment F and VF that were more similar, the V and VF sites this time being the furthest apart (Table 2.2 A). As in the blueberry environment, the Simpson's diversity indexes were comparable for all sites. However, the VF (0.874) sites had a slightly lower diversity index than the F (0.906) and V (0.905) sites (Table 2.3 A). Again, no significant difference can be found between sites using a Wilcoxon matched-pairs sign rank test.
In 2009, the most abundant pollen taxa recorded were Taraxacum officinalis (Asteraceae) and Salix sp. (Salicacea) in June (Blueberry) and plants from the Brassicaceae family followed by V. macrocarpon in July (Cranberry). The ten most dominant taxa counted up for 74.9 % ofthe total taxa occurrences in June and 96.3 % in July (Table 2.1 B).
Jaccard's similarity indexes show that during both the blueberry (June) and cranberry (July) flowering periods, the pollen samples from the VF and F sites were more identical between each other regarding their taxa listings than to that of samples from the V sites. However these indexes did not differ greatly. The lowest indexes were found between the V and F sites in the blueberry environment and between the VF and the F sites in the cranberry environment (Table 2.2 B).
For the blueberry environment, the Simpson's diversity indexes were comparable in the V (0.968), VF (0.972) and F (0.966) sites. These indexes were higher than those found during the cranberry pollination period. Here, the V sites had a lower Simpson's diversity index (0.845) compared to the F (0.912) sites, these latter being more comparable to the VF
(0.896) sites (Table 2.3 B). In the blueberry environment, floral diversity had a tendency to be poorer in the V sites than in the F sites, but these differences were not statistically different. However, in July (cranberry) a significant difference in floral diversity between the V and F sites was confirmed by the Wilcoxon rank test (z = -2.82; P = 0.0047). The F site also differed significantly from the VF site (z = -1.97; P = 0.0048).
Species rank abundance curves comparing the blueberry and cranberry pollination environments and periods (2008 and 2009) show that the abundance of dominant species deleted much faster in the cranberry crop than in the blueberry crop for both years (Figure 2.5). This graph also illustrates the high number of taxa with very few occurrences.
Species accumulation curves, excluding rare species, showed that the expected number of pollen taxa from the blueberry and cranberry environments were 19 and 10 in 2008 (Figure 2.6 A) and 25 and 9 in 2009 (Figure 2.6 B). Both curves quickly reached a threshold, that of the combined samples from the cranberry crop sites laid below that of combined samples from the blueberry crop sites, both in 2008 and 2009.
2.3.2 Colony weight variations
During the blueberry pollination period (June 6th to 21st 2009), the 12 hives introduced in each treatment (V, VF and F) gained in average respectively 16.8, 13.6 and
15.9 kg (Figure 2.7 A). There was no significant difference in the weight gain between the treatments during this period (F (2,29) = 0.19; P = 0.8274). During the cranberry pollination period (July 1st to 20th 2009) the hives from the V, VF and F treatments gained an average of 3.0, 6.1 and 7.7 kg, respectively. As for the previous period there were no significant differences in the weight gain between each treatment (F(2,30) = 0.80; P = 0.4592) (Figure 2.7 B). The hives sited in the V cranberry treatment had a tendency to gain less weight than those ofthe two other treatments. They also had a tendency to lose weight at the end ofthe 36
journey in the cranberry fields. In the F treatment, the colonies seemed to accumulate more weight than those of the V and VF treatments, but the differences were not statistically significant.
2.3.3 Brood surface
The 36 hives had a similar brood surface at the beginning of the experimentation (u = 30 441 ± 3 485 cells; t = 1.31; df = 82; P = 0.7587). After the blueberry pollination period (June 25th 2009), the hives introduced in the V treatment had a significantly lower brood surface than the hives in F treatment (t = -2.78; df = 82; P = 0.0067). After the cranberry pollination period, the colonies that had showed losses in brood surfaces during the blueberry pollination period (V) recovered as fast as those from the VF treatment or even faster (Figure 2.8).
2.3.4 Fruit yields
The fruit yields from sites V and VF were compared in order to evaluate if the existence of a higher regional floral diversity could cause a plant competition effect on pollinators (Table 2.4). In the blueberry fields, the average yields were higher in plots from the V treatment (411 g) than in those from the VF treatment (149 g) (F= 43.86; df= 7; P= 0.0006). In the cranberry fields, the difference was not significant (F= 0.03; df= 7; P= 0.8597).