Une isoforme de Allograft Inflammatory Factor-1 (AIF1)
impliquée dans le cancer du sein
Mémoire
Ferial Amira Slim
Maîtrise en médecine moléculaire
Maître ès sciences (M.Sc)
Québec, Canada
Une isoforme de Allograft Inflammatory Factor-1 (AIF1)
impliquée dans le cancer du sein
Mémoire
Ferial Amira Slim
Sous la direction de :
Francine Durocher, directrice de recherche
Caroline Diorio, codirectrice de recherche
iii RÉSUMÉ
Le cancer du sein (BC) représente l’un des cancers les plus communs et les plus dangereux sur le plan de la mortalité et de l’incidence chez les femmes dans le monde. Celui-ci est d’autant plus récurrent dans les pays développés, notamment le Canada [2]. Il s’agit d’une maladie complexe et multifactorielle dont la sévérité et la réponse au traitement varient selon les cas et dont le diagnostic peut parfois s’avérer délicat dû à l’hétérogénéité de la pathologie. Ce projet a ainsi pour objectif d’étudier un facteur de risque potentiel du BC pouvant servir au diagnostic et au traitement des patientes atteintes.
Allograft Inflammatory Factor-1 (AIF1) est une protéine impliquée dans de nombreuses maladies inflammatoires et a été également associée au cancer, cependant, dans la majorité des études, une seule des isoformes a été analysée. Nos analyses de la signature transcriptionnelle d’individus provenant de familles à risque élevé de BC (BRCA1/BRCA2 ou non-BRCA1/2 (BRCAX)) ont permis d’identifier des transcrits significativement et différentiellement exprimés entre ces différents groupes. Parmi ceux-ci, deux variants d’épissage du gène AIF1, appelés AIF1v3 et AIF1v1, étaient significativement surexprimés chez les lignées cellulaires lymphoblastoides (LCLs) des sœurs BRCAX atteintes comparativement à leurs sœurs non-atteintes. Nos études d’expression génique ont par la suite révélé que ces deux isoformes étaient majoritairement exprimées dans les tumeurs mammaires les moins sévères et que cette expression provenait du microenvironnement tumoral, AIF1v1 étant majoritairement exprimé par les lymphocytes et AIF1v3 par les macrophages. Nous avons également démontré l’effet d’un traitement à l’acide gras oméga-3 docosahexaénoïque (DHA) sur la réduction de l’expression des deux isoformes dans des LCLs d’individus BRCAX. Pour finir, nos données montrent que l’expression des isoformes de AIF1 dans les tumeurs et le tissu adipeux mammaires corrélait avec les paramètres cliniques et métaboliques des patientes.
Ainsi, les données et connaissances obtenues à travers cette étude représentent une avancée considérable pour la communauté scientifique et la recherche sur le cancer puisqu’il s’agit de la première étude portant sur AIF1v1 et son implication dans le BC, le microenvironnement tumoral et la réaction inflammatoire.
iv ABSTRACT
Breast cancer (BC) represents one of the most common and dangerous cancers in terms of mortality and incidence among women worldwide. It is even more recurrent in developed countries including Canada [2]. BC is a complex and multifactorial disorder, its severity and response to treatment differs from case to case and its diagnosis can be tricky due to the heterogeneity of the pathology. Thus, this project aims to study a potential BC risk factor that can be used for diagnosis and treatment of BC patients.
Allograft Inflammatory Factor-1 (AIF1) is a protein involved in many inflammatory diseases that has also been associated with cancer, however, in most studies, only one isoform has been analyzed.
Our analyses of the transcriptional profile of individuals from French Canadian families with high risk of BC (BRCA1/BRCA2 or not-BRCA1/2 (BRCAX)) identified significantly and differentially expressed transcripts between the different groups. Among them, two AIF1 splice variants were highly overexpressed in the BRCAX lymphoblastoid cell lines (LCLs) of the affected sister comparatively with her non-affected sister.
Our gene expression analysis revealed that both isoforms were mostly expressed in the least aggressive BC and this expression resulted from the tumor microenvironment, AIF1v1 being mostly expressed by lymphocytes and AIF1v3 by activated macrophages. We also demonstrated the effect of docosahexaenoic omega-3 fatty acids (DHA) on the downregulation of AIF1 isoforms expression in BRCAX LCLs. Lastly, our data showed that AIF1 isoforms expression in breast tumors and breast adipose tissue correlated with metabolic and clinical parameters of BC patients.
Ultimately, all data and information resulting from this study represent a major breakthrough for the scientific community and the cancer research field since it is the first study on AIF1v1 and its involvement in BC, breast tumor microenvironment and inflammatory reaction.
v
TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... iv
TABLE DES MATIÈRES ... v
LISTE DES TABLEAUX ... vii
LISTE DES FIGURES ... viii
LISTE DES ABRÉVIATIONS ... ix
REMERCIEMENTS ... xiv
AVANT-PROPOS ... xv
CHAPITRE 1 : INTRODUCTION ... 1
1. Le cancer du sein ... 1
1.1. L’épidémiologie ... 1
1.2. L’immunologie du cancer du sein ... 2
1.2.1. Les caractéristiques et classifications du cancer du sein ... 2
1.2.2. Inflammation & immunologie tumorale ... 7
1.2.3. Le microenvironnement tumoral mammaire ... 9
1.3. Les facteurs de risque ... 13
1.4. Les gènes de susceptibilité au cancer du sein ... 15
1.4.1. BRCA1 & BRCA2 ... 15
1.4.2. BRCAX ... 16
2. Identification du gène AIF1... 18
2.1. AIF1 et ses variants... 18
2.2. Structure et expression... 20
vi
2.3.1. AIF1 et les maladies inflammatoires ... 22
2.3.2. AIF1 et le cancer ... 22
2.3.3. AIF1 et le cancer du sein ... 23
3. Problématique... 25
3.1. Mise en perspective ... 25
3.2. Hypothèse et objectifs de l’étude ... 25
CHAPITRE 2: AN ISOFORM OF AIF1 INVOLVED IN BREAST CANCER ... 27
Résumé ... 28 Abstract ... 29 Introduction ... 30 Results ... 32 Discussion ... 37 Methods ... 41 References ... 47 Acknowledgments ... 53
DISCUSSION & LIMITES DE L’ÉTUDE ... 66
CONCLUSION & PERSPECTIVES ... 69
vii
LISTE DES TABLEAUX
Table 1. Description of the cohorts ... 61 Table 2. Distribution of the infiltrating immune cells, KM scores, TSP and TCP between the different AIF1v1 expression groups in breast tumors ... 62
Table 3. Spearman’s correlation between AIF1v1/v3 expression in breast tumors and variables breast adipose tissue ... 62
viii
LISTE DES FIGURES CHAPITRE 1 : INTRODUCTION
Figure 1. Les différentes catégories du cancer du sein ... 3
Figure 2. Les sous-types moléculaires du cancer du sein. ... 4
Figure 3. Les différentes méthodes de classification du cancer du sein. ... 6
Figure 4. Les différentes étapes de l’immunoediting dans le cancer. ... 7
Figure 5. Le microenvironnement tumoral mammaire (MET). ... 12
Figure 6. Alignement des séquences en acides aminés de AIF1 chez différentes espèces. 19 Figure 7. Alignement des séquences en acides aminés de variants de AIF1. ... 19
Figure 8. Représentation schématique des isoformes de AIF1... 20
Figure 9. Représentation chronologique des découvertes scientifiques majeures sur AIF1. ... 21
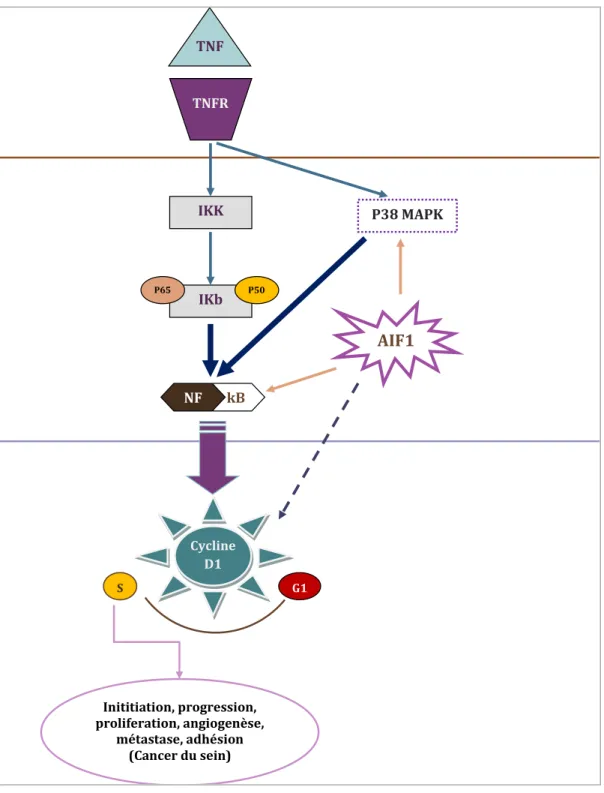
Figure 10. Représentation schématique du mécanisme d’activation de la voie de signalisation de NF-κB/cyclin D1 par AIF1. ... 24
CHAPITRE 2 : AN ISOFORM OF AIF1 INVOLVED IN BREAST CANCER Figure 1. AIF1 gene expression analysis by RNA-sequencing in 16 pairs of BRCAX sisters (affected and unaffected) from French Canadian families with high-risk of breast cancer. 56 Figure 2. Predictive structure of AIF1 isoforms. ... 57
Figure 3. Characterization of AIF1 isoforms in breast tumors and tumor microenvironment ... 58
Figure 4. Assessment of tumor inflammatory infiltrate in breast tumors ... 59
Figure 5. Effect of long-chain omega-3 fatty acid docosahexaenoic acid (DHA) on the expression of (A) AIF1v1 and (B) AIF1v3 ... 60
Figure S1. Estimation of inflammation reaction methods ... 63
ix
LISTE DES ABRÉVIATIONS ADH = Atypical Ductal Hyperplasia
ADNg = ADN génomique
ADSC = Adipose Derived Stromal Cell AIF1 = Allograft Inflammatory Factor-1
AIF1v1 = Allograft Inflammatory Factor-1 variant 1 AIF1v2 = Allograft Inflammatory Factor-1 variant 2 AIF1v3 = Allograft Inflammatory Factor-1 variant 3 AKT = Protein kinase B
ANOVA = one-factor analysis of variance ATM = Ataxia Telangiectasia Mutated ATP50 = ATP synthase O subunit
BART1 = Balloon Angioplasty-Responsive Transcript 1 BC = Cancer du sein
BMI = Body Mass Index BRCA1 = BReast Cancer 1 BRCA2 = BReast Cancer 2
BRCAX = individu à risque élevé étant non BRCA1/2 BT20 = Breast cancer cell line
CAA = Cancer Associated Adipocyte CAF = Cancer Associated Fibroblast CCL-5 = Chemokine (C-C motif) Ligand 5 CD = Cluster de Différenciation
cDNA = ADN complémentaire CHEK2 = Checkpoint kinase 2 CI = Carcinome Invasif
CIS = Carcinome In Situ COX2 = Cyclooxygenase-2
CSF1 = Colony Stimulating Factor 1 CXCL12 = C-X-C Motif Chemokine 12
x
CYP19A1 = Cytochrome P450 Family 19 Subfamily A Member 1 DCIS = Ductal Carcinoma In Situ
DHA = Acide docosahexaénoïque DMSO = Dimethyl sulfoxide DNA = Acide désoxyribonucléique E1 = Estrone
E2 = Estradiol
EPA = Acide eicosapentaénoïque ER = Récepteur d’estrogène
ERK1/2 = Extracellular signal–Regulated Kinases 1/2 FA = Fatty Acid
FBS = Fetal Bovine Serum
FFPE = formalin-fixed, paraffin-embedded FGFR2 = Fibroblast Growth Factor Receptor 2 FOXP3 = Forkhead box P3
G6PD = glucose-6-phosphate dehydrogenase
GAPDH = glyceraldehyde-3-phosphate dehydrogenase GO = Gene Ontology
H = Helix
H&E =Hématoxyline et Éosine
HEK293 = Human embryonic kidney cells 293 HepG2 = human liver cancer cell line
HER2 = Récepteur-2 pour les facteurs de croissance épidermiques humains HGF = Hepatocyte Growth Factor
HPRT1 = hypoxanthine guanine phosphoribosyl transferase 1 Iba-1 = Ionized calcium-binding adapter molecule 1
IDC = Invasive Ductal Carcinoma IFN-γ = Interferon gamma
IGF/IGF-1R = Insulin-like Growth Factor/ Insulin-like Growth Factor-1 Receptor IL = Interleukine
xi KM = Klintrup & Mäkinen criteria
LCL = Lymphoblastoid Cell Line
LNCaP = Epithelial cell line derived from a human prostate carcinoma LPS = Lipopolysaccharide
LSP1 = Lymphocyte-Specific Protein 1 Lum = Luminal
MCF10A = Non-tumorigenic human mammary epithelial cell line MCF7 = Breast cancer cell line
MDA-MB-231 = Triple-negative breast cancer cell line MEC = Matrice ExtraCellulaire
MET = MicroEnvironnement Tumoral MRF1 = Microglia Response Factor-1 mRNA = ARN messager
MS/MS = Tandem mass spectrometry
MTT = méthode rapide de numération des cellules vivantes. NF-κB = Nuclear Factor-kappa B
OV90 = Human ovarian adenocarcinoma cell line OVCAR-3 = Epithelial ovarian cancer cell line P = p-value
P38-MAPK = P38 Mitogen-Activated Protein Kinase PALB2 = Partner and localizer of BRCA2
PCR = Polymerase Chain Reaction PGE2 = Prostaglandine E2
PMA = Phorbol 12-myristate 13-acetate PR = Récepteur de la progestérone PTEN = Phosphatase and tensin homolog PUFA = PolyUnsaturated Fatty Acid
qRT-PCR = Quantitative Reverse Transcription PCR RAW 264.7 = murine macrophage cell line
RNA = Acide ribonucléique
xii RPPA =Reverse Phase Protein Array RS = Spearman correlation coefficient SAS = Statistical Analysis System SD = Standard Deviation
SDF-1 = Stromal cell-Derived Factor 1 SKBR3 = Human breast cancer cell line STK11 = Serine/Threonine Kinase 11 TAM = Tumor Associated Macrophage TCP = Tumor Cell Percentage
TGF-β = Transforming Growth Factor-β Th = T helper cells
THP-1 = human monocytic cell line derived from an acute monocytic leukemia TIL = Tumor Infiltrating Lymphocyte
TNFα = Tumor Necrosis Factor-α
TNM = Tumeur, Nodes (terme anglais pour les ganglions lymphatiques) et Métastases TNRC9 = TriNucleotide Repeat Containing 9
TP53 = Tumor Protein 53
TSP = Tumor Stroma Percentage
VEGF = Vascular Endothelial Growth Factor WHR = Waist-Hip Ratio
xiii
Я посвящаю эту работу своей любви Thank you for being an incredible rock of support
xiv
REMERCIEMENTS
Il m’est bien difficile de savoir trouver les mots justes à poser pour décrire la gratitude envers toutes les personnes ayant contribué à l’aboutissement de ce projet. Cette maîtrise représente bien plus que mes premiers pas en recherche biomédicale, il s’agit également de ma première fois loin des personnes chères à mon cœur dans un territoire étranger, une réorientation de carrière et de ce fait, un choix décisif dans ma vie.
À cet effet, j’aimerais en premier lieu remercier ma directrice de recherche, Dre Francine Durocher, qui m’a accueillie dans son laboratoire et par ce fait m’a accordé toute sa confiance pour mener à bien ce projet. Je la remercie de m’avoir offert cette opportunité, d’avoir fait preuve de patience et d’avoir su m’encourager tout au long de ma maîtrise. Je tiens par la même occasion à remercier ma co-directrice de recherche, Dre Caroline Diorio, qui, au même titre que Dre Francine Durocher, m’a enrichie de beaucoup de valeurs tant sur le plan humain que professionnel. Merci pour votre disponibilité, votre écoute et vos conseils. Je remercie notamment tous les membres de leurs équipes respectives, qui ont cru en moi et m’ont supportée et encouragée jusqu’à la toute fin. Je ne pourrai tous vous nommer en quelques lignes mais sachez que de par vos paroles, conseils et critiques vous avez fortement contribué à alimenter mes réflexions et m’avez toujours poussée à m’améliorer et ne jamais me laisser abattre. J’adresse mes sincères remerciements à toutes les personnes que j’ai rencontrées dans le cadre de ma maîtrise, étudiants et professeurs, qui ont su se démarquer à mes yeux et devenir, pour certains, des amis et confidents précieux.
Pour finir, j’adresse toute ma gratitude et mon amour à mes parents et ma sœur adorés. Vous avez été et serez toujours mon plus grand support dans la vie.
Je vous suis éternellement redevable.
Et à toi ma Pitch. Où que je sois dans la vie, tu y seras toujours avec moi.
xv
AVANT-PROPOS
L’étude présentée dans ce mémoire a vu le jour à la suite d’un projet réalisé auparavant dans notre laboratoire par Marie-Christine Pouliot, à partir duquel nous avons sélectionné le gène AIF1 en particulier dans l’objectif de le caractériser et de déterminer son implication dans le cancer du sein.
L’article présenté dans le chapitre 2 a été soumis à la revue Scientific Reports. En tant que première auteure de cet article, j’ai procédé à sa rédaction, à toute la recherche de la littérature, aux analyses statistiques et bioinformatiques ainsi qu’à l’interprétation et la discussion des résultats. Toutes ces étapes ont été vérifiées et validées par mes deux directrices de recherche et la version finale de l’article a été approuvée par tous les co-auteurs.
Tout au long de ma maîtrise, le protocole, la méthodologie et les analyses effectuées au courant du projet ont été mis en place par moi-même conformément aux objectifs de mon projet et sous la supervision continuelle de mes directrices de recherche.
J’ai également eu l’aide précieuse de Kaoutar Ennour-Idrissi, étudiante au doctorat en épidémiologie, pour les mesures de l’inflammation sur lames de tumeurs mammaires ainsi que son expertise en programmation informatique sur SAS. Pour la partie de la culture cellulaire et analyses de l’expression génique par qRT-PCR, j’ai bénéficié de l’aide de Geneviève Ouellette, professionnelle de recherche du laboratoire. Je remercie également Mélissa Pelletier pour son aide avec l’extraction des stéroïdes et la technique de chromatographie sur couche mince, Mélanie Verreault pour sa contribution avec les traitements oméga-3 et le Dr Simon Jacob qui nous a gracieusement fourni les échantillons utilisés dans la présente étude.
Toutes les participantes au projet ont donné leur consentement éclairé écrit pour l’utilisation de leurs échantillons. Ce projet a été approuvé par le comité d’éthique du Centre de Recherche du CHU de Québec – Université Laval.
xvi
Les résultats de mes travaux ont été présentés à de nombreux congrès, conférences et journées scientifiques, entre autres la Journée Scientifique des Étudiants (JSE 2016 et JSE 2017), le congrès du Club de Recherches Cliniques du Québec (CRCQ 2016 et CRCQ 2017), le congrès de l’American Institute for Cancer Research (AICR 2016) à North Bethesda, USA, le congrès de l’International Chair of Cardiometabolic Risk (ICCR 2017) et les journées de la recherche du CHU de Québec-Université Laval en 2017.
Ce projet a été réalisé grâce à des subventions de l’Institut de recherche de la Société Canadienne du Cancer, L'Alliance Canadienne pour la Recherche sur le Cancer du Sein (grant #20462), le Réseau de recherche en santé cardiométabolique, diabète et obésité (grant #314074) du “Fond de recherche du Québec – Santé (FRQS)” et la “Banque de tissus et données du Réseau de recherche sur le cancer” de la “Fondation du cancer du sein du Québec” et FRQS associé avec le Réseau canadien de banques de tumeurs (CTRNet).
1
CHAPITRE 1 : INTRODUCTION 1. Le cancer du sein
1.1. L’épidémiologie
Le cancer du sein (BC) est considéré comme la forme de cancer la plus répandue au monde chez les femmes [7]. Au Canada, la Société canadienne du cancer estime qu’une femme sur 8 serait à risque de développer un BC au cours de sa vie. En effet, 26 300 nouveaux cas de cancers du sein ont été diagnostiqués au Canada pour l’année 2017, dont 6 500 nouveaux cas au Québec, soit 25,5 % de tous les nouveaux cas de cancers attendus cette même année chez les canadiennes.Le pourcentage de cancers du sein chez l’homme au Canada est quant à lui inférieur à 1 % [2].
Le BC se place au deuxième rang sur le plan de la mortalité, représentant 13 % de tous les décès par cancer chez les canadiennes, la plus grande proportion de décès se manifestant majoritairement chez les plus jeunes (le BC représente 21 % des décès par cancer chez les femmes de 30 à 59 ans par rapport à 12 % chez les femmes de 60 ans et plus) [2]. Différents facteurs ont été suggérés pour expliquer ce phénomène, notamment l’association d’un jeune âge lors du diagnostic à l’agressivité des tumeurs mammaires [2]. Une diminution graduelle du taux de mortalité par BC a été cependant observée au Canada depuis 1987 et on estime que plus de 32 000 décès par BC ont été évités entre 1987 et 2012 [2]. Ceci découle vraisemblablement des avancées réalisées en matière de dépistage mammographique et de détection précoce ainsi qu’à l’amélioration des traitements. D’ailleurs, on estime chez les canadiennes un taux de survie à cinq ans de 87% pour le BC entre 2006 et 2008 [2]. Ceci a été également observé dans divers autres pays développés ayant adopté les meilleures stratégies de traitement du BC tels que les États-Unis, le Royaume-Uni, l’Allemagne et la France [7].
Deux formes de BC peuvent être observées : la forme familiale et la forme sporadique. En effet, 5 à 10% des cancers du sein sont dits héréditaires, le reste des cas survenant de manière spontanée serait attribuable à d’autres facteurs, appelés facteurs de risque, dont il sera question dans la section 1.3 Les facteurs de risque.
2 1.2. L’immunologie du cancer du sein
1.2.1. Les caractéristiques et classifications du cancer du sein
Le BC est une maladie complexe avec une variabilité phénotypique remarquable. La structure d’un sein normal est constituée d’une couche de cellules épithéliales luminales aux fonctions sécrétrices et de cellules myoépithéliales aux fonctions contractiles reposant sur une membrane basale les séparant du tissu conjonctif sous-jacent [8-10]. Le microenvironnement mammaire est quant à lui composé d’une matrice extra-cellulaire (MEC) et de différents types de cellules stromales, telles que les cellules endothéliales, les adipocytes, les fibroblastes et les cellules immunitaires.
Le processus de tumorigénèse repose sur l’acquisition progressive d’anomalies génétiques et épigénétiques qui conféreraient un avantage sélectif de prolifération et de survie des cellules tumorales. Des études histopathologiques ont ainsi permis de classer le BC en des catégories distinctes allant des conditions ou lésions précancéreuses à l’invasion tumorale (Figure 1).
On distingue ainsi :
− les dysplasies, souvent appelées tumeurs bénignes (Figure 1A),
− les hyperplasies atypiques, se distinguant des dysplasies par des changements cytologiques et un accroissement marqué du nombre des cellules,
− les carcinomes in situ (CIS), décrivant une prolifération de cellules épithéliales cancéreuses sans franchissement de la membrane basale de l’épithélium (Figure 1B), − et enfin les carcinomes invasifs (CI), lorsque les cellules tumorales envahissent le tissu
conjonctif en franchissant la membrane basale (Figure 1C).
Suite à l’invasion en phase locale, les cellules cancéreuses sont capables d’aller se disséminer à distance du foyer tumoral initial pour aller former des foyers secondaires. C’est ce qu’on appelle les métastases (Figure 1D).
3 A) B) B) B) A) B) B) B) A) B) B) B)
Figure 1. Les différentes catégories du cancer du sein
Schéma de la progression tumorale. La transformation des cellules épithéliales mammaires jusqu’au processus de métastase se fait suite à de nombreux changements génétiques et épigénétiques. Figure adaptée de Vargo-Gogola & Rosen [3] et images libres de droit prises de The Internet Pathology Laboratory for Medical Education.
B) B) B) B) C) C) C) C) D) D) D) D) A) B) B) B)
4
D’autres études moléculaires ont montré que les cancers du sein pouvaient être classés en sous-types moléculaires particuliers. En effet, parmi les premières études sur le sujet, celles de Pérou et Sörlie démontrèrent que les cancers du sein récepteur-positifs d’estrogène (ER+) et récepteur-négatifs d’estrogène (ER-) étaient des conditions pathologiques biologiquement distinctes de par leurs analyses moléculaires [8, 11, 12]. Trois principaux biomarqueurs sont utilisés en clinique : le récepteur d’estrogène (ER), le récepteur de la progestérone (PR) et le récepteur 2 du facteur de croissance épidermique humain (HER2) [13]. En se basant sur l’expression de ces récepteurs-ci, les tumeurs mammaires ont donc été classées en quatre sous-types moléculaires intrinsèques: luminal A, luminal B, HER2 et triple-négatif (Figure 2). Ces sous-types moléculaires ont été caractérisés depuis plus de 15 ans maintenant [8, 14, 15]. Des études subséquentes portant sur des analyses de regroupement des tumeurs mammaires en fonction de leurs profils d’expression génique ont par la suite mené à de nouvelles classifications moléculaires du BC [16-20].
Figure 2. Les sous-types moléculaires du cancer du sein.
Les 4 sous-types moléculaires du cancer du sein. LumA = Luminal A; LumB = Luminal B; ER = Récepteur d’estrogène; PR = Récepteur de la progestérone; HER2 = Récepteur 2 du facteur de croissance épidermique humain; Degré de sévérité de BC croissant.
5
Ces 4 sous-types moléculaires montrent à quel point le BC est hétérogène. Ils évoluent différemment, ont des pronostics différents et réagissent donc différemment aux traitements [11, 21, 22]. Les luminaux A sont considérés comme les cancers du sein avec le meilleur pronostic et avec des taux de survie relativement élevés. Les luminaux B sont généralement diagnostiqués à un jeune âge et leur croissance tumorale est plus rapide par rapport aux luminaux A. Les cancers HER2+ représentent 5 à 15% des cas de cancers du sein, ils ont un mauvais pronostic et sont également diagnostiqués à un jeune âge. Les cancers du sein triple-négatif représentent 15 à 20% des cas de cancers du sein et ont les moins bons pronostics et taux de survie comparativement aux autres sous-types moléculaires [23-27]. Les taux de survie à cinq ans pour chacun de ces sous-types moléculaires sont de 65 à 94% pour les luminal A, 83 à 92% pour les luminal B, 39 à 71% pour les tumeurs HER2 et 51 à 93% pour les tumeurs triple-négatives [28].
Il existe notamment d’autres classifications qui ont été proposées au fur et à mesure des études et des avancements technologiques. On parle d’ailleurs des grades histologiques de Nottingham [29, 30] et du stade TNM [31, 32] qui sont des systèmes internationaux se basant surtout sur des critères histologiques et qui sont maintenant adoptés en clinique pour le pronostic et le traitement du BC, les regroupements selon les profils d’expression géniques et les classifications selon les profils mutationnels des génomes des tumeurs ou encore les méthodes se basant sur les réseaux et interactions moléculaires [5]. On reconnaît par exemple le test Mammaprint (test de diagnostic in vitro approuvé par la Food and Drug Administration (Agence américaine des produits alimentaires et médicamenteux) qui permet d'évaluer le risque de métastases à distance à 5 ans) ou encore le test Oncotype DX (test diagnostique de 21 gènes permettant d'estimer la probabilité de l’avantage de la chimiothérapie et le risque de récidive à distance à 10 ans).
Chacune de ces méthodes apporte des informations supplémentaires et spécifiques, cependant certaines se basent sur des outils bioinformatiques sophistiqués et parfois très coûteux. Ainsi les classifications histopathologiques et moléculaires sont souvent celles qui sont les plus utilisées dans les études et en clinique (Figure 3).
6
Figure 3. Les différentes méthodes de classification du cancer du sein.
Les méthodes de classification du cancer du sein peuvent être basées sur des critères histopathologiques, anatomiques, génomiques ou encore des critères d’expression génique. Figure adaptée de Taherian-Fard, Srihari et Ragan [5]. Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Voie intrinsèque de Perou Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Mammaprint Wang-76 Oncotype DX Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Oncotype DX Métagène Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Méthodes de classification du cancer du sein Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Grade Histologique Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Stade TNM Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Signatures d’expression génique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Profil génomique Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Réseaux d’interaction (intégratif) Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Sous-type moléculaire Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Prédictif Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Pronostic Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
Index Pronostic de Nottingham
7
1.2.2. Inflammation & immunologie tumorale
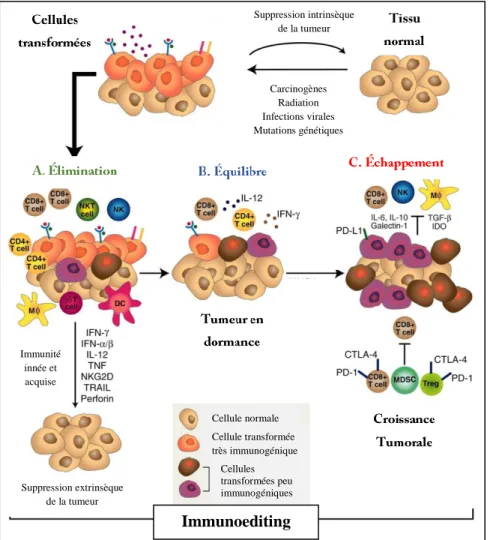
La théorie d’immunosurveillance a d’abord été proposée par Paul Ehrlich en 1909 puis reprise en 1967 par Macfarlane Burnet et Lewis Thomas [33]. Celle-ci énonce que notre système immunitaire reconnaît et élimine les cellules anormales et/ou tumorales pour maintenir l’homéostasie cellulaire tout au long de notre vie. D’autres études subséquentes ont cependant réfuté cette théorie en montrant que même en présence d’un système immunitaire fonctionnel les tumeurs avaient le pouvoir de croître et de se propager. C’est ainsi qu’est né le concept de « l’immunoediting » [34]. En effet, durant les différentes étapes du développement tumoral, le système immunitaire a autant la capacité de reconnaître les cellules tumorales et de les détruire que de promouvoir la progression tumorale, ce qui pourrait parfois conduire à une résistance au traitement. Le procédé d’immunoediting se déroule en trois phases : l’élimination, l’équilibre et l’échappement (Figure 4). Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur Suppression intrinsèque de la tumeur
Figure 4. Les différentes étapes de l’immunoediting dans le cancer.
L’immunoediting comprend trois phases séquentielles: A. La phase d’élimination dans laquelle l’immunité innée et acquise détruisent les tumeurs se développant avant l’apparition de signes cliniques, B. La phase de l’équilibre dans laquelle les cellules cancéreuses sont en dormance fonctionnelle grâce à des mécanismes immunologiques et C. La phase d’échappement dans laquelle les cellules tumorales continuent à croitre en échappant au système immunitaire menant à l’apparition de signes cliniques. Figure adaptée de Schreiber et al [6]. Carcinogènes Radiation Infections virales Mutations génétiques Carcinogènes Radiation Infections virales Mutations génétiques Carcinogènes Radiation Infections virales Mutations génétiques Carcinogènes Radiation Infections virales Mutations génétiques Carcinogènes Radiation Infections virales Mutations génétiques Cellule normale Cellule normale Cellule normale Cellule normale Cellule normale Cellule normale Cellule transformée très immunogénique Cellule transformée très immunogénique Cellule transformée très immunogénique Cellule transformée très immunogénique Cellules transformées peu immunogéniques Cellules transformées peu immunogéniques Cellules transformées peu Immunoediting Immunoediting Suppression extrinsèque de la tumeur Suppression extrinsèque de la tumeur Suppression extrinsèque Immunité innée et acquise Immunité innée et acquise Immunité innée et acquise Immunité innée et acquise
8
La phase d’élimination est la phase décrite par la théorie de l’immunosurveillance, au cours de laquelle les cellules transformées sont reconnues et éliminées par le système immunitaire. Dans la phase d’équilibre, le système immunitaire de l’hôte et les cellules tumorales entrent dans un équilibre dynamique et restent ainsi en dormance. Quant à la phase d’échappement, elle se caractérise essentiellement par la capacité des cellules cancéreuses à développer des moyens de circonvenir et de contrôler la réponse immunitaire antitumorale par différents mécanismes [6].
L’inflammation est un procédé physiologique complexe qui a souvent été associé à la tumorigénèse, et qui serait un phénomène indépendant de l’immunoediting [35]. Les principaux types d’inflammation liés au cancer sont : l’inflammation chronique précédant le développement tumoral et l’inflammation associée à la tumeur et l’inflammation due au traitement [36]. L’inflammation chronique contribuerait à l’initiation tumorale en générant un stress génotoxique ainsi qu’à la promotion tumorale par l’induction de la prolifération cellulaire et la progression tumorale en favorisant l’angiogenèse et l’invasion du tissu [37]. L’inflammation se produisant durant la progression tumorale normale explique raisonnablement pourquoi le système immunitaire n’arrive plus à restreindre l’expansion du cancer. Quant à l’inflammation induite durant le traitement anti-tumoral, celle-ci est souvent protumorigénique et serait responsable de la résistance au traitement, et serait aussi impliquée dans les phénomènes de métastases et rechutes post-traitement [36].
Par conséquent, l’inflammation et l’immunité pro-tumorales fonctionneraient séparément tout en restant interconnectées par différentes voies afin de permettre aux cellules tumorales de se développer et croître tout en échappant au phénomène de l’immunosurveillance [6, 33, 37, 38]. Plusieurs études ont ainsi montré que le système immunitaire jouait un rôle majeur dans le dialogue entre les cellules tumorales et les cellules du microenvironnement.
9
1.2.3. Le microenvironnement tumoral mammaire
Le développement d’une pathologie cancéreuse ne se limite pas à l’accumulation d’anomalies intrinsèques puisque les cellules cancéreuses peuvent communiquer et interagir avec le microenvironnement tumoral (MET) durant les différentes étapes de l’évolution de la maladie. Le MET prend donc en considération les différents éléments entourant la cellule tumorale et les interactions structurales et fonctionnelles entre ces partenaires, que ce soit de manière directe par le biais de complexes jonctionnels ou bien par des facteurs sécrétés.
Comme précédemment décrit, le MET mammaire est constitué de différents types de cellules (Figure 5):
− les adipocytes : le tissu adipeux mammaire comprend majoritairement des adipocytes matures et des progéniteurs (préadipocytes et les cellules souches dérivant du tissu adipeux, ADSCs). Il existe plusieurs études portant sur le rôle des adipocytes dans la progression tumorale et le terme ‘adipocytes associés au cancer’ (CAAs) leur a d’ailleurs été attribué [39-42]. Il a été démontré in vitro et in vivo que les ADSCs favorisaient la croissance et la survie des cellules tumorales dans le BC ainsi que leur pouvoir de migration et d’invasion en sécrétant différentes cytokines (IL-6, IL8, CCL-5, and CXCL12/SDF-1) et induisaient la transition épithélio-mésenchymateuse. Les CAAs contribueraient également à la radiorésistance dans le BC [43-46].
− les fibroblastes : ce sont des cellules du tissu conjonctif qui sécréteraient des composants de la MEC. Des études ont montré que les fibroblastes pouvaient être activés dans le cancer et leur ont donné la terminologie de fibroblastes associés au cancer (CAFs) [47-52]. Ils auraient notamment différentes fonctions dans le BC. Ils favorisent la progression tumorale par différents mécanismes, entre autres par la sécrétion de différents facteurs comme HGF, TGF-β, SDF-1, VEGF et IL-6 et les métalloprotéinases matricielles [53-55]. Ils participeraient aussi au processus de métastase et d’invasion dans le BC [56, 57].
10
− les cellules endothéliales : en temps normal, celles-ci ont une fonction dans le développement et le maintien des fonctions vasculaires. Elles jouent un rôle important dans la croissance tumorale, l’invasion et peuvent aussi participer à l’initiation du BC. Des études ont rapporté des interactions entre les cellules endothéliales, les cellules tumorales et les cellules myéloïdes pouvant expliquer certains mécanismes reliant la chimiorésistance et la métastase [58, 59].
− les cellules immunitaires : tel que précédemment évoqué, les cellules immunitaires participent activement au développement du BC et de son évolution. Ces cellules peuvent infiltrer les tumeurs mammaires et parmi celles-ci on reconnaît les macrophages, les leucocytes, les cellules myéloïdes suppressives et les cellules dendritiques. Les cellules infiltrant les tumeurs sont souvent observées et associées avec un mauvais pronostic de la maladie [60-64]. Celles que l’on retrouve majoritairement dans le BC sont les lymphocytes infiltrant les tumeurs (TILs) et les macrophages associés aux tumeurs (TAMs) [62, 64-66].
• TILs : ils auraient différentes fonctions selon le type de lymphocytes infiltrant la tumeur et leur localisation. Il a été démontré que les lymphocytes T prédominent dans le tissu tumoral tandis que les cellules de la lignée myéloïde prédominent dans le tissu mammaire normal [67]. Les TILs jouent un rôle important pour diriger la réponse à la chimiothérapie. En effet, les lymphocytes T de type-1 sont associés à un pronostic favorable, les lymphocytes T CD4+ (Th1) facilitent la présentation antigénique via la sécrétion et l’activation des cellules présentatrices d’antigènes, tandis que les lymphocytes T cytotoxiques CD8+ sont importants pour la destruction des cellules tumorales. Alors que les lymphocytes T de type-2 sont plutôt de mauvais pronostic, les lymphocytes T CD4+ (Th2) et lymphocytes T CD4+ Forkhead box P3 vont par exemple favoriser la prolifération des lymphocytes-B et la réponse immune anti-inflammatoire pour permettre la croissance tumorale. Ainsi, les TILs ont une place de plus en plus importante dans le pronostic et la prise de décision dans le traitement des cancers du sein [68-72].
11
• TAMs : ils sécrètent des facteurs de croissance qui peuvent promouvoir l’angiogenèse en sécrétant des facteurs pro-angiogéniques tel que VEGF, ils favorisent la croissance tumorale, la migration et produisent des facteurs qui diminuent la réponse anti-tumorale locale permettant aux cellules tumorales d’échapper au système immunitaire. Leur présence est souvent associée à un mauvais pronostic, un grade élevé, une nécrose élevée et un moins bon taux de survie [64, 73-78]. Cependant cela dépend souvent de quel type de macrophages et du degré de sévérité de la maladie. En effet, on ne retrouvera pas les mêmes types de macrophages ni le même nombre dans un CIS comparativement à un CI ou encore un luminal ou un triple-négatif. Leur fonction peut donc différer selon l’environnement les entourant [74].
En résumé, le microenvironnement mammaire peut fortement diriger la progression tumorale à travers les différentes cellules le composant qui communiquent constamment entre elles et avec les cellules tumorales mais aussi grâce à des facteurs sécrétés tels que les cytokines et les adipokines.
12 Figure 5. Le microenvironnement tumoral mammaire (MET).
Le MET comprend différents types de cellules pouvant soit former une barrière à la formation du cancer du sein soit au contraire aider à la tumorigénèse. Parmi les principales cellules intervenant dans la progression tumorale, on retrouve 1) les lymphocytes infiltrant les tumeurs (TILs), 2) les fibroblastes associés au cancer (CAFs), 3) les macrophages associés aux tumeurs (TAMs), et 4) les adipocytes associés au cancer (CAAs). Figure adaptée de Balkwill et al [4].
Bar rière à la f or mat ion d e can cer Tumorigénèse
13 1.3. Les facteurs de risque
Le BC est une maladie complexe et multifactorielle associée à différents facteurs de risque pouvant être modifiables (tels que la consommation d’alcool ou la sédentarité) ou non-modifiables (tels que l’âge ou l’origine ethnique) et dont la susceptibilité d’augmenter le risque de développer la maladie varierait selon les cas [79-81].
L’un des principaux facteurs de risque est assurément le sexe de l’individu. En effet, tel que mentionné précédemment, peu d’hommes sont à risque de développer un BC au cours de leur vie [2]. L’âge est considéré, quant à lui, comme le facteur de risque le plus important chez la femme puisque l’incidence de la maladie augmenterait de manière exponentielle avec l’âge jusqu’à la ménopause et ralentirait par la suite [82-84]. L’ethnicité et la région géographique sont également à prendre en considération car tous deux influencent le risque de développer un BC. Les taux d’incidence les plus élevés sont observés dans les régions les plus développées, mais la mortalité est beaucoup plus élevée relativement dans les pays pauvres, faute de détection précoce et d'accès aux traitements [7]. Ces variations géographiques des taux d’incidence peuvent être dues à des différences dans la fréquence des facteurs de risque modifiables, comme une alimentation malsaine, le tabagisme et l’obésité ou encore aux procédures mises en place dans les pays pour le diagnostic du BC [2, 7, 85, 86]. Certaines femmes appartenant à des groupes ethniques spécifiques semblent être plus à risque de développer un BC au cours de leur vie. C’est le cas des femmes d’ascendance juive Ashkénaze qui posséderaient une forte prévalence de trois mutations fondatrices dans les gènes BRCA1 (pour BReast Cancer 1) et BRCA2 (pour BReast Cancer 2) [84, 87, 88].
L’histoire familiale est par ailleurs souvent suspectée et considérée parmi les facteurs de risque les plus importants. En effet, une femme ayant des apparentés de premier degré atteints de BC aurait un risque deux à quatre fois plus élevé de développer la maladie et ce risque augmenterait en fonction du nombre d’apparentés atteints [89-91]. Outre les antécédents familiaux, les antécédents personnels de BC ou de certaines maladies bénignes du sein telles que les hyperplasies représentent aussi un facteur de risque bien établi [92, 93].
14
Des facteurs hormonaux tels que l’âge précoce aux premières menstruations, la ménopause tardive, l’utilisation à long terme (5 ans ou plus) d’une hormonothérapie de remplacement après la ménopause ou encore l’utilisation pendant dix ans ou plus de contraceptifs oraux combinés sont également considérés comme d’importants facteurs de risque au BC. Enfin, il existe également des facteurs environnementaux pouvant jouer un rôle dans le risque de développer un BC, parmi ceux-ci l’exposition à de fortes radiations ionisantes et à certains produits chimiques ou encore les facteurs liés aux habitudes de vie comme la consommation d’alcool, le tabagisme, l’inactivité physique et l’alimentation riche en gras. [94-103]. La densité mammaire est aussi un facteur de risque reconnu influençant la susceptibilité de développer un BC. En effet, quelle que soit la méthodologie utilisée pour évaluer la densité mammaire, toutes les études publiées concernant la population générale ont retrouvé un risque plus élevé de BC chez les femmes ayant des seins denses [104, 105]. D’autres pathologies non mammaires ont été également proposées comme étant un facteur de risque incontestable au BC. C’est notamment le cas du diabète [106, 107] et de l’obésité [108, 109].
Cependant, certains de ces facteurs de risque sont difficilement identifiables chez la majorité des femmes atteintes de BC. Toutefois, il existe certains gènes appelés gènes de susceptibilité au BC, qui ont été identifiés et pour lesquels des dépistages génétiques ont été développés permettant aux individus d’évaluer leur risque de développer la maladie.
15
1.4. Les gènes de susceptibilité au cancer du sein
Tel que mentionné précédemment, les cancers du sein héréditaires représentent 5 à 10% de tous les cas de cancers du sein et seraient en majorité attribuables à des mutations génétiques particulières transmises par l’un des parents. Celles-ci sont donc portées par des gènes dits de susceptibilité (ou de prédisposition) au BC dont les principaux gènes responsables sont BRCA1 et BRCA2.
1.4.1. BRCA1 & BRCA2
Le gène BRCA1 a été identifié pour la première fois en 1994 [110]. Il est situé sur le bras long du chromosome 17 tandis que le gène BRCA2, découvert en 1995, est situé sur le bras long du chromosome 13 [111]. Tous deux sont des gènes suppresseurs de tumeur qui maintiennent l'intégrité génomique afin de prévenir la prolifération incontrôlée de cellules mammaires. Ils jouent également un rôle important dans la réponse au stress cellulaire via l’activation de mécanismes de réparation de l’ADN [112-116]. Il a été démontré que des mutations germinales des gènes BRCA prédisposeraient les individus au développement de cancers du sein [117-119]. Ces mutations ont une transmission autosomique dominante, ainsi la présence d’un seul gène muté pourrait être transmise par l’un des parents et suffirait pour augmenter le risque de développer un cancer.
Une étude récente estime qu’environ 72% des femmes portant une mutation délétère sur le gène BRCA1 et environ 69% des femmes portant une mutation délétère sur le gène BRCA2 développeront un BC avant l’âge de 80 ans [120]. En effet, plus de 500 mutations ou variations de séquence des gènes BRCA1/2 ont été identifiées et associées à un risque élevé de BC ainsi que d’autres types de cancers (cancer de l’ovaire, cancer de la prostate ou encore celui du pancréas). Ce risque varie significativement selon le type de mutation (non-sens, faux-sens, changement du cadre de lecture) [121, 122], sa position (par exemple, la présence de mutations dans la région centrale du gène serait associée à un risque plus élevé de cancers de l'ovaire que de cancers du sein, contrairement aux mutations retrouvées dans les régions 5' et 3' du gène) [123-125] et probablement d’autres facteurs indépendants tels que l’âge, le poids et l’activité physique [126-130].
16
Il a été démontré que les femmes atteintes de cancers du sein associés à ces deux gènes auraient tendance à développer des cancers du sein à un âge précoce qui seraient en majorité agressifs et degrade histologique élevé [131, 132].
Cependant, les altérations des gènes BRCA1/2 ne représentent qu’une partie des cancers du sein familiaux, le reste des cas serait attribuable à d’autres gènes ou allèles de prédisposition qui ont été classés en trois catégories : les allèles rares de forte pénétrance (tels que TP53, PTEN et STK11), les allèles rares de pénétrance modérée (tels que PALB2, CHEK2 et ATM) et enfin les allèles fréquents de faible pénétrance (tels que FGFR2, TNRC9, et LSP1) [133].
Toutefois, certains cas de cancers du sein héréditaires chez des familles présentant de nombreux cas de cancers du sein restent inexpliqués [134]. En effet, seulement 20% des cancers du sein familiaux seraient attribués aux mutations dans les gènes BRCA1 et BRCA2, tandis qu’approximativement 5 à 10% seraient attribués aux mutations dans les gènes de susceptibilité précédemment évoqués [135]. Ces familles dites à haut-risque de BC non-BRCA1/2 (ie chez lesquelles une mutation délétère non-BRCA1/2 n’a pas été identifiée) ont donc été rassemblées en un groupe appelé les familles BRCAX.
1.4.2. BRCAX
En effet, une étude menée par Kainu et al parue en 2000 regroupant des familles avec plusieurs cas de cancers du sein chez lesquelles toute mutation délétère dans les gènes BRCA1 et BRCA2 a été exclue, a émis l’hypothèse que d’autres gènes associés à un haut risque de BC doivent exister. Ils ont ainsi choisi de les nommer les BRCAX [136]. Les familles BRCAX sont donc par définition des familles à risque élevé de développer un BC qui sont non-BRCA1/2, c’est-à-dire, n’ayant pas de mutations délétères dans les gènes BRCA1/2.
17
Alors que les phénotypes des tumeurs BRCA1/2 sont assez bien décrites dans la littérature [135, 137-145], les études portant sur les tumeurs BRCAX sont quant à elles limitées. Certaines études comparant des cas de cancers du sein sporadiques, BRCA1, BRCA2 et BRCAX ont montré que les cancers du sein non-BRCA1/2 étaient de grade plus faible, avaient tendance à être des cancers positifs aux récepteurs d’œstrogène (ER+) et avaient un meilleur taux de survie à long terme [146-150]. Dix études ayant étudié l’histologie mammaire dans des familles BRCAX ont montré que 56 à 86% des cas étaient des carcinomes canalaires, 2 à 15% étaient des carcinomes lobulaires et 0 à 17% des carcinomes médullaires [150]. En comparaison, les BRCA1 sont plutôt de type triple négatif et « basal-like » (ER-/PR-/HER2-), tandis que les BRCA2 sont majoritairement de type luminal B (ER+ et/ou PR+ et HER2+) (voir Figure 2) [151, 152].
En outre, malgré qu’on lui ait attribué un nom défini, le groupe des BRCAX est un groupe hétérogène rassemblant différents types de tumeurs. Ainsi, différentes techniques ont donc été utilisées pour essayer de distinguer le groupe BRCAX des groupes BRCA1/2. Une classification moléculaire a notamment été proposée permettant de distinguer chacun des groupes selon leur profil d’expression génique [153]. Plus récemment, une étude dans notre laboratoire de Pouliot et al a mis en évidence dans des lignées lymphoblastoides provenant de femmes de familles BRCAX, BRCA1 et BRCA2 des transcrits différentiellement exprimés entre les différents groupes de BC pouvant ainsi discriminer les individus BRCAX des individus BRCA1/2 [154].
De ce fait, le BC est une maladie hétérogène regroupant différents cas dont le degré de sévérité peut varier selon l’individu (âge, ethnicité, habitudes de vie, etc.), les facteurs génétiques (prédisposition génétique, mutations de gènes), l’environnement, mais aussi le type de la tumeur ainsi que son immunologie et microenvrionnement.
18
2. Identification du gène AIF1 2.1. AIF1 et ses variants
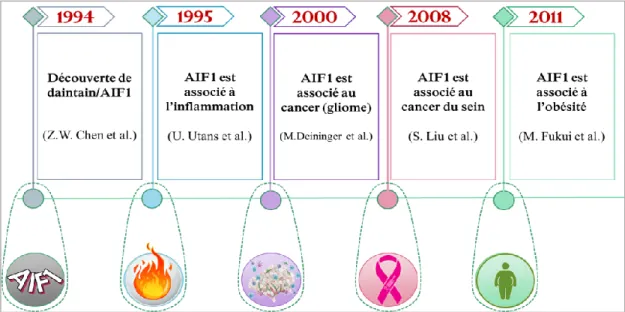
Allograft inflammatory factor-1 (AIF1) a été identifié pour la première fois en 1994 dans des intestins de porc par Chen et al qui ont choisi de le nommer « daintain » [155]. En 1995, Utans et al ont identifié un polypeptide dans des allogreffes cardiaques chez le rat et l’ont ainsi appelé « AIF1 » [156]. AIF1 et daintain se sont avérés avoir des séquences identiques et le terme AIF1 a été adopté dans les études subséquentes. L’analyse des séquences protéiques de AIF1 provenant de différentes espèces a révélé une forte similarité suggérant que AIF1 est hautement conservé entre les espèces (Figure 6). D’autres protéines ont été identifiées par la suite comme des homologues à AIF1, possédant des séquences en acides aminés hautement similaires, tels que ionized calcium-binding adapter (Iba1), interferon-gamma-responsive transcript-1 (IRT1), protéine G1, balloon angioplasty-responsive transcript 1 (BART1) et microglia response factor-1 (MRF1) [157-159]. AIF1 splice variant-3 (AIF1v3), considéré comme le type sauvage découvert en 1994, est le variant le plus long et encode un polypeptide de 17KDa.
Une étude publiée en 1999 a permis de cloner par RT-PCR deux variants d’épissage de AIF1 provenant de leucocytes et macrophages du sang périphérique [159]. Des analyses de séquences utilisant des banques de données biologiques ont permis de déterminer que ces deux autres variants d’épissage de AIF1, appelés AIF1 splice variant-1 (AIF1v1) et AIF1 splice variant-2 (AIF1v2) correspondaient aux homologues G1 et IRT1 respectivement (Figure 7). Il a été démontré que l’expression de AIF1 différait selon les tissus et selon l’isoforme étudiée [1] et que la structure de AIF1 et ses variants ainsi que leur niveau d’expression déterminaient leurs fonctions et interactions.
Ainsi, dans l’objectif d’étudier le rôle de AIF1 dans une pathologie donnée, il est important de comprendre comment et par quoi celui-ci est sécrété et également les différences structurales et fonctionnelles de ses transcrits.
19
Homo sapiens MSQTRDLQGGKAFGLLKAQQEERLDEINKQFLDDPKYSSDEDLPSKLEGF Pan troglodytes MSQTRDLQGGKAFRLLKAQQEERLDEINKQFLDDPKYSSDEDLPSKLEGF Macaca mulatta MSQTRDLQGGKAFGLLKAQQEERLDEINKQFLDDPKYSSDEDLLSKLEGF Canis lupus familiaris MSQSRDLQGGKAFGLLKAQQEERLEGINKQFLDDPKYSNDEDLPSKLEAF Bos taurus MSQSKDLQGGKAFGLLKAQQEERLDGINKHFLDDPKYSSDEDLQSKLEAF Mus musculus MSQTRDLQGGKAFGLLKAQQEDRLDEINKQFLDDPKYSSDEDLPSKLEAF Rattus norvegicus MSETRDLQGGKAFGLRKAQQEERINEINQQFLDDPKYSSDEDLPSKLEAF
**:::******** * *****:*:: **::********.**** ****.*
Homo sapiens KEKYMEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGET Pan troglodytes KEKYMEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGET Macaca mulatta KEKYMEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGET Canis lupus familiaris KVKYMEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKRLIREVSSGSEET Bos taurus KTKYMEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIREVSSGSEET Mus musculus KKKYMEFDLNGDGDIDIMALKRMLEKLGVPKTHLELKKLIREVSSSSGET Rattus norvegicus KKKYMEFDLNEDGGIDIMSLKRMMEKLGVPKTHLELKKLIMEVSSGPGET
* ******** :*.****:****:*************:** ****.. **
Homo sapiens FSYPDFLRMMLGKRSAILKMILMYEEKAREKEKPTGPPAKKAISELP Pan troglodytes FSYPDFLRMMLGKRSAILKMILMYEEKAREKEKPTGPPAKKAISELP Macaca mulatta FSYPDFLRMMLGKRSAILKMILMYEEKAREKEKPTGPPAKKAISELP Canis lupus familiaris FSYSDFLRMMLGKRSAILRMILMYEEKNKEHKRPTGPPAKKAISELP Bos taurus FSYSDFLRMMLGKRSAILRMILMYEEKNKEHQKPTGPPAKKAISELP Mus musculus FSYSDFLKMMLGKKSAILKIILMYEEKAREQEKPAGPPAKKDISELP Rattus norvegicus FSYSDFLKMMLGKRSAILKMILMYEEKAREQEKPTGLPAKKAISELP
***.***:*****:****::******* :*:::*:* **** *****
gi|NM_001623| v3 MSQTRDLQGGKAFGLLKAQQEERLDEINKQFLDDPKYSSDEDLPS---K gi|AF299327| G1 --- gi|NM_032955.2|v1 --- gi|NM_004847| v2 --MEFDLNGNGDIGEKRVICGGRVVCRPKKTEVSPTCSIPHDLGGGPPTTVGGRRMGMRK gi|U95213| IRT-1 --MEFDLNGNGDIGEKRVICGGRVVCRPKKTEVSPTCSIPHDLGGGPPTTVGGRRMGMRK gi|NM_001623| v3 LEGFKEKYMEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGETFSYPDF gi|AF299327| G1 ---MEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGETFSYPDF gi|NM_032955.2|v1 ---MEFDLNGNGDIDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGETFSYPDF gi|NM_004847| v2 WERRERVSPPSPHPHPLPPDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGETFSYPDF gi|U95213| IRT-1 WERRERVSPPSPHPHPLPPDIMSLKRMLEKLGVPKTHLELKKLIGEVSSGSGETFSYPDF ***************************************** gi|NM_001623| v3 LRMMLGKRSAILKMILMYEEKAREKEKPTGPPAKKAISELP
gi|AF299327| G1 LRMMLGKRSAILKMILMYEEKAREKEKPTGPPAKKAISELP gi|NM_032955.2|v1 LRMMLGKRSAILKMILMYEEKAREKEKPTGPPAKKAISELP gi|NM_004847| v2 LRMMLGKRSAILKM--- gi|U95213| IRT-1 LRMMLGKRSAILKM--- **************
Figure 6. Alignement des séquences en acides aminés de AIF1 chez différentes espèces.
Les séquences protéiques de AIF1 révèlent une haute similarité entre les espèces suggérant un fort degré de conservation.
(*) représente des acides aminés conservés.
(:) représente des acides aminés conservés avec de fortes similarités. (.) représente des acides aminés conservés avec de faibles similarités.
Figure 7. Alignement des séquences en acides aminés de variants de AIF1.
Les séquences en acides aminés de v1 et g1 sont identiques de même que les séquences de v2 et IRT-1.
v3= AIF1 variant 3, G1= protéine G1, v1= AIF1 variant 1, v2= AIF1 variant 2, IRT-1= interferon-gamma responsive transcript-1.
EF hand site
-KR-KK-GKR- pattern QXXER motif
20 2.2. Structure et expression
Chez l’humain, le gène AIF1 se trouve dans la région du complexe d’histocompatibilité de classe III sur le chromosome 6p21.3, connu pour regrouper des gènes impliqués dans les réponses inflammatoires tels que tumor necrosis factor-α (TNFα) et nuclear factor-kappa B (NF-κB) [158]. L’épissage alternatif de AIF1 peut résulter en de multiples variants transcrits, cependant la longueur et la nature codante de ces variants ne sont pas certaines. Tel que mentionné dans la section précédente, à ce jour trois variants de AIF1 ont été décrits : AIF1v3 (accession number : NM_001623), qui est le type sauvage, AIF1v1 (accession number : NM_032955) qui diffère de AIF1v3 dans la région 5' UTR et qui aurait une portion de la région codante 5' qui lui fait défaut et AIF1v2 (accesion number : NM_ 004847) différant du type sauvage dans les régions 5' UTR et 3' UTR (Figure 8).
Figure 8. Représentation schématique des isoformes de AIF1.
Les lignes horizontales représentent les introns. Les rectangles représentent les exons. Les flèches indiquent les sites d’initiation de la transciption. Les triangles sur l’isoforme 2 représentent des éléments riches en AU dans la région 3’. Les régions communes aux trois isoformes sont représentées par les lignes pointillées. Figure de Del Galdo et al [1].
Isoforme 3
Isoforme 2
21
AIF1v3 encode une protéine de 147 acides aminés (aa) (initialement décrite par Utans et al comme précédemment mentionné [156]), AIF1v2 encode une protéine de 132aa (correspondant à IRT1 décrite par Auteri et al) [160] et AIF1v1 encode une protéine de 93aa (aussi appelée G1) décrite pour la première fois par Olavsen et al [161].
Cependant, les études concernant AIF1v1 et AIF1v2 sont très limitées et peu d’informations existent quant à leur fonction et expression. On sait néanmoins que les trois isoformes seraient exprimées différentiellement et par diverses sources [1, 158].
2.3. Les fonctions et mécanismes de AIF1
Les fonctions de AIF1 semblent nombreuses et ne sont pas entièrement connues. Cependant, plusieurs études ont rapporté qu’il serait majoritairement exprimé par les immunocytes et qu’il serait associé à différentes maladies inflammatoires [162], à l’obésité [163, 164], au diabète [165-167] et aux cancers, notamment le BC [168, 169] (Figure 9).
22 2.3.1. AIF1 et les maladies inflammatoires
AIF1 a largement été étudié dans les maladies inflammatoires puisqu’il a été décrit comme un médiateur-clé de l’inflammation par la régulation de l’expression de certains médiateurs inflammatoires tels que les cytokines, les chimiokines et l’oxyde nitrique synthase [170, 171]. En effet, il serait impliqué dans des maladies auto-immunes telles que l’arthrite rhumatoïde [172] ou encore l’encéphalomyélite auto-immune expérimentale [173], dans l’immunité reproductive [162], dans le rejet de greffe [174, 175], dans les vasculopathies [176, 177], mais aussi dans les lésions du système nerveux central [178, 179].
AIF1 augmenterait la production de certaines interleukines telles que IL-6, IL-10 et IL-12 dans des lignées de macrophages RAW 264.7 stimulées avec des lipopolysaccharides [171]. L’expression de AIF1 dans des lymphocytes T régulerait la production de 4 et IL-17 [180]. Une autre étude a également montré que AIF1 aurait la capacité de réguler de nombreuses molécules d’adhésion cellulaires importantes [181].
Le fait que AIF1 soit exprimé dans différents tissus et qu’il soit impliqué dans différentes maladies inflammatoires suggère qu’il pourrait également avoir un rôle dans les cancers. En effet et comme précédemment évoqué dans la section 1.2. L’immunologie du cancer du sein, l’inflammation, le système immunitaire et le microenvironnement tumoral participent fortement au développement de tumeurs et leur progression.
2.3.2. AIF1 et le cancer
Plusieurs études ont révélé que AIF1 serait surexprimé dans certains cancers et qu’il jouerait un rôle considérable dans la progression tumorale [169, 182], même si ce rôle reste controversé. En effet, il existe une étude qui a démontré que les niveaux protéiques de AIF1 étaient significativement réduits dans 67,9% des tumeurs gastriques comparativement aux tissus normaux correspondants et qu’il aurait une fonction de suppresseur de tumeurs potentiellement par la régulation de la β-catenine [183]. Dans d’autres études, AIF1 favoriserait la prolifération des cellules HepG2 en activant IGF/IGF-1R et sa voie de signalisation AKT [184], il contribuerait également à la pathophysiologie et la progression des hémangiomes [169, 182] ainsi qu’à l’activation de certains macrophages et cellules