Université de Sherbrooke
Mesure de sections efficaces absolues vibrationnelles et électroniques pour la collision d’électrons de basse énergie avec des constituants de l’ADN en phase condensée
Par Vincent Lemelin
Programme de sciences des radiations et imagerie biomédicale
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en sciences des radiations et imagerie biomédicale
Sherbrooke, Québec, Canada Septembre, 2019
Membres du jury d’évaluation
Pr. Léon Sanche, Département de médecine nucléaire et radiobiologie, Université de Sherbrooke
Pr. Kevin Whittingstall, Département de médecine nucléaire et radiobiologie, Université de Sherbrooke
Pr. Patrick Ayotte, Département de Chimie, Université de Sherbrooke Pr. Peter McBreen, Département de Chimie, Université Laval
“One day, in retrospect, the years of struggle will strike you as the most beautiful.” -Sigmund Freud
R
ÉSUMÉMesure de sections efficaces absolues vibrationnelles et électroniques pour la collision d’électrons de basse énergie avec des constituants de l’ADN en phase condensée
Par Vincent Lemelin
Programme de sciences des radiations et imagerie biomédicale
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en sciences des radiations et imagerie biomédicale, Faculté de médecine et des sciences de la santé, Université de Sherbrooke,
Sherbrooke, Québec, Canada, J1H 5N4
Cette thèse de doctorat présente la mesure de probabilités d’interactions (sections efficaces) pour les électrons de basse énergie en collision avec des constituants de l’ADN condensés. Produits en abondance lors du passage des rayonnements ionisants à travers la matière biologique, les électrons de basse énergie sont considérés comme une des espèces secondaires des plus importantes en radiobiologie. Connus pour être les principaux responsables du transfert d’énergie des rayonnements ionisants au milieu biologique via les collisions inélastiques, l’étude des interactions des électrons de basse énergie avec des molécules d’intérêts biologiques (constituants de l’ADN) devient rapidement importante. Dans cette thèse de doctorat, les excitations vibrationnelles et électroniques sont étudiées pour trois biomolécules : le tétrahydrofurane (THF), le phosphate de diméthyle (DMP) et la thymidine (dT). Les molécules de THF et DMP représentent le désoxyribose et le groupement phosphate respectivement, les deux composants de la colonne vertébrale de l'ADN. La dT est un nucléoside constitué de deux unités fondamentales de l’ADN : le désoxyribose et la base thymine. Les sections efficaces absolues vibrationnelles et électroniques de ces molécules sont mesurées en phase condensée à l’aide d’un spectromètre de pertes d’énergie de l’électron à haute résolution. Les valeurs de sections efficaces sont extraites à partir des spectres de pertes d’énergie de l’électron à plusieurs énergies incidentes entre 0 et 20 eV. La dépendance en énergie incidente des valeurs de sections efficaces permet l’observation de plusieurs résonances. Cette thèse présente cinq articles décrivant en détails la méthode expérimentale ainsi que les mesures de sections efficaces vibrationnelles et électroniques pour les trois biomolécules. Un sixième article présente une comparaison quantitative des valeurs de sections efficaces de la dT et celles de ses constituants : le THF et la thymine. Cette thèse de doctorat permet de raffiner notre compréhension fondamentale des processus résonants entre les électrons de basse énergie et ces biomolécules. Aussi, elle rend disponibles les valeurs de sections efficaces qui sont nécessaires aux simulations radiobiologiques et à la nanodosimétrie. Finalement, ce projet de doctorat permet d’élucider si les sections efficaces d’une molécule complexe, comme la dT, peuvent être approximées par la somme des sections efficaces de ses constituants.
Mots clés : Sections efficaces, Électron de basse énergie, Résonance, Anion transitoire, Excitation vibrationnelle et électronique, HREELS, Radiobiologie
S
UMMARYMeasurement of absolute vibrational and electronic cross sections for low-energy electron scattering from condensed DNA constituents
By Vincent Lemelin
Program of Radiation Sciences and Biomedical Imaging
Thesis presented at the Faculty of Medicine and Health Sciences for the obtention of Doctor degree diploma philosophiae doctor (Ph.D.) in radiation sciences and biomedical imagery, Faculty of medicine and health sciences, Université de Sherbrooke, Sherbrooke,
Québec, Canada, J1H 5N4
This Ph.D. thesis presents the measurement of interactions probabilities (cross sections) for low-energy electrons with condensed DNA constituents. Produced abundantly by the passage of ionizing radiations through biological medium, low-energy electrons are considered one of the most important secondary species in radiobiology. They are responsible for transferring most of the energy of secondary electrons to biological media, via inelastic collisions. For this reason, studies of low-energy electrons interactions with biologically relevant molecules (such as DNA constituents) are becoming increasingly important. In this thesis, vibrational and electronic excitations are studied for three biomolecules: tetrahydrofuran (THF), dimethyl phosphate (DMP) and thymidine (dT). The THF and DMP molecules represent the deoxyribose and the phosphate group respectively; the two constituents of the DNA backbone. dT is a nucleoside composed of two fundamental units of DNA: the deoxyribose and the thymine base. Absolute vibrational and electronic cross sections are measured for these biomolecules in condensed phase using a high-resolution electron energy loss spectrometer. The cross section values are calculated from the electron energy loss spectra for various incident energies between 0 and 20 eV. The incident energy dependence of the cross sections shows multiple resonances. This thesis presents five articles which describe in detail the experimental method as well as the results of the measurements of the vibrational and electronic cross sections for the biomolecules studied. The sixth article consists of a quantitative comparison between the cross section values of dT and those of its constituents: THF and thymine. This Ph.D. thesis allows the refinement of our understanding of the resonant processes between low-energy electrons and biomolecules. Furthermore, this thesis produces cross section values that are crucial and necessary for radiobiological simulations and nanodosimetry. Finally, this Ph.D. thesis elucidates if the cross section values of a complex molecule, such as dT, can be approximated by the sum of the cross sections of its constituent subunits.
Keywords: Cross sections, Low-energy electron, Resonance, Tranisent anion, Vibrational and electronic excitation, HREELS, Radiobiology
T
ABLE DES MATIÈRESRésumé... iii
Summary ... iv
Table des matières ... v
Liste des figures ... vii
Liste des figures des articles ... vii
Liste des tableaux des articles ... x
Liste des abréviations ... xii
Introduction ... 1
Mise en contexte ... 1
Rayonnements ionisants ... 1
Radiobiologie ... 2
Thérapies ciblées et radiochimiothérapie concomitante ... 5
Simulations Monte Carlo ... 7
Spectroscopie de pertes d’énergie de l’électron à haute résolution (HREELS) ... 9
Diffusion de l’électron ... 11
Processus non-résonants ... 12
Processus résonants ... 12
Section efficace ... 16
Théorie de la diffusion simple de l’électron ... 18
Objectifs ... 22
Tétrahydrofurane (THF) ... 22
Phosphate de diméthyle (DMP) ... 22
Thymidine (dT) ... 23
Recension des écrits ... 24
Tétrahydrofurane (THF) ... 25 Phosphate de diméthyle (DMP) ... 26 Thymidine (dT) ... 28 Problématique et hypothèses ... 30 Hypothèses ... 31 Articles ... 34
Article 1 ... 35
Article 2 ... 47
Article 3 ... 68
Article 4 ... 94
Discussion ... 115
Sections efficaces électroniques du THF et du DMP (Articles 1 et 5) ... 115
Sections efficaces vibrationnelles du DMP (Article 2) ... 116
Sections efficaces vibrationnelles et électroniques de la dT (Articles 3 et 6) ... 117
Comparaison quantitative des valeurs de sections efficaces de la dT, thymine et THF (Articles 4 et 6) ... 119
Corrections des valeurs de sections efficaces vibrationnelles de la thymine (Article 4) ... 119
Comparaison quantitative des valeurs de sections efficaces ... 120
Limites générales ... 123
Limites de la spectroscopie HREEL ... 125
Perspectives futures ... 127
Conditions plus complexes ... 127
Implications pour les calculs nanodosimétriques ... 128
Futures études - molécules complexes ... 130
Désorption acoustique induite par laser (LIAD) ... 132
Conclusion ... 136
Liste des références ... 139
Remerciements ... 154
Annexes ... 155
Articles supplémentaires ... 155
Article 5 ... 155
Article 6 ... 163
Développement mathématique du modèle de simple diffusion ... 198
Chapitre du livre Radiation in Bioanalysis - Spectroscopic Techniques and Theoretical Methods ... 205
Liste des publications et des communications produites pour ce projet ... 206
Publications ... 206
Présentations orales ... 207
L
ISTE DES FIGURESFigure 1 [Structure chimique d’un brin d’ADN et de ses constituants] 3 Figure 2 [Importance des électrons de basse énergie et des sections efficaces en radiothérapies ciblées et radiochimiothérapie concomitante] 7 Figure 3 [Spectromètre de pertes d’énergie de l’électron à haute résolution] 10 Figure 4 [Courbes de potentiel pour une molécule diatomique] 15 Figure 5 [Molécules utilisées pour modéliser différents constituants de l’ADN] 24 Figure 6 [Principe de désorption acoustique induite par laser] 134 Figure 7 [Concept d’un HREELS augmenté de la technique de LIAD] 135
L
ISTE DES FIGURES DES ARTICLESARTICLE 1
Figure 1.1 [Spectre de pertes d’énergie de l’électron en collision avec le tétrahydrofurane
condensé] 40
Figure 1.2 [Dépendance en énergie incidente de l’électron des valeurs de sections efficaces
électroniques du tétrahydrofurane] 41
ARTICLE 2
Figure 2.1 [Structure chimique d’un brin d’ADN ainsi que le phosphate de diméthyle
modélisant le groupement phosphate de l’ADN] 50
Figure 2.2 [Spectre représentatif de pertes d’énergie de l’électron en collision avec le
phosphate de diméthyle condensé] 54
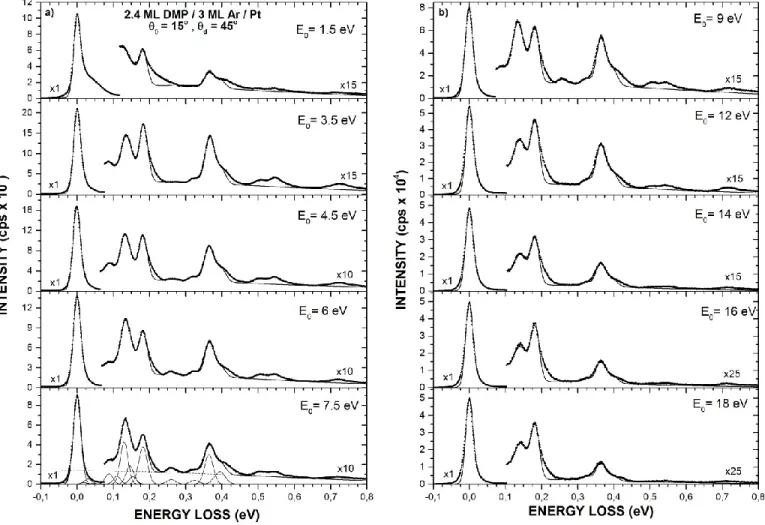
Figure 2.3 [Spectres de pertes d’énergie de l’électron à plusieurs énergies incidentes en
collision avec le phosphate de diméthyle] 57
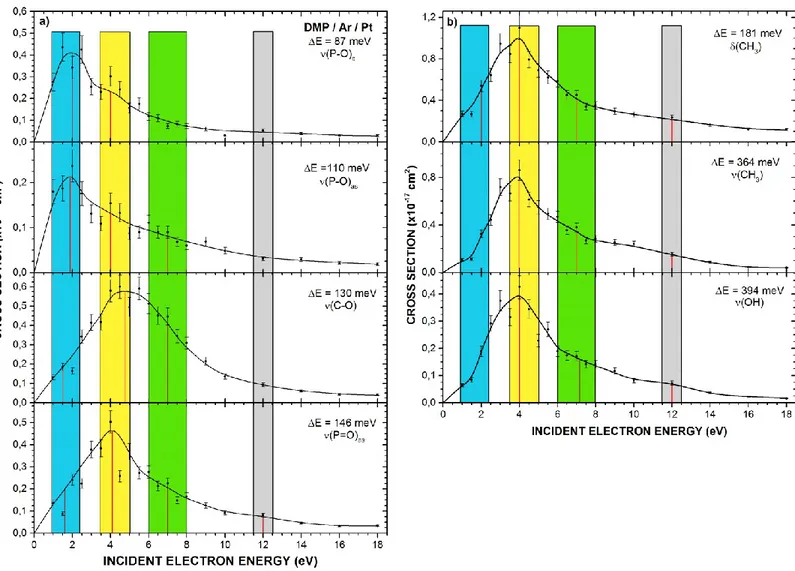
Figure 2.4 [Dépendance en énergie incidente de l’électron des valeurs de sections efficaces
vibrationnelles du phosphate de diméthyle] 59
ARTICLE 3
Figure 3.2 [Spectre représentatif de pertes d’énergie de l’électron en collision avec la
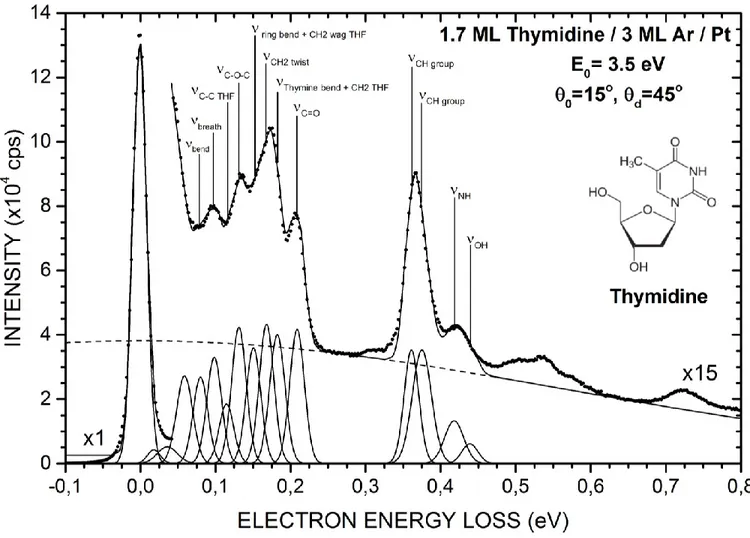
thymidine condensée] 78
Figure 3.3 [Dépendance en énergie incidente de l’électron des valeurs de sections efficaces
vibrationnelles de la thymidine] 82
ARTICLE 4
Figure 4.1 [Structure chimique du tétrahydrofurane, de la thymine et de la thymidine] 98 Figure 4.2 [Spectres vibrationnelles de la thymine (2003) et de la thymidine] 100 Figure 4.3 [Sections efficaces absolues vibrationnelles totales de la thymine (2003), de la
thymine corrigées et de la thymidine] 101
Figure 4.4 [Spectres de pertes d’énergie de l’électron avec la thymine, le tétrahydrofurane et la thymidine avec une énergie incidente de 4 eV] 102 Figure 4.5 [Sections efficaces pour chaque vibration retrouvée dans la thymidine, la thymine et le tétrahydrofurane en fonction de l’énergie incidente de l’électron] 105 Figure 4.6 [Sections efficaces absolues vibrationnelles totales pour la thymidine, la thymine et le tétrahydrofurane en fonction de l’énergie incidente de l’électron] 109
ARTICLE 5
Figure 5.1 [Spectre électronique pour la collision d’électrons avec le phosphate de diméthyle
condensé] 158
Figure 5.2 [Dépendance en énergie incidente de l’électron des valeurs de sections efficaces
électroniques du phosphate de diméthyle] 160
ARTICLE 6
Figure 6.1 [Structure chimique d'un simple brin d'ADN ainsi que la thymidine, le
tétrahydrofurane et la thymine] 168
Figure 6.2 [Spectre électronique représentatif de la thymidine] 171 Figure 6.3 [Spectres électroniques de la thymidine pour diverses énergies incidentes de
l'électron] 172
Figure 6.4 [Sections efficaces pour chaque excitation électronique de la dT en fonction de
Figure 6.5 [Valeurs de sections efficaces totales électroniques pour la dT et la thymine en fonction de l'énergie incidente de l'électron.] 180
L
ISTE DES TABLEAUX DES ARTICLESARTICLE 1
Tableau 1.I [Valeurs numériques de sections efficaces électroniques pour des électrons de
11-16 eV incidents sur le tétrahydrofurane condensé] 42
ARTICLE 2
Tableau 2.I [Énergies des modes vibrationnels du phosphate de diméthyle mesurées par
différentes spectroscopies] 56
Tableau 2.II [Valeurs numériques de sections efficaces vibrationnelles pour des électrons (1-18 eV) en collision avec le phosphate de diméthyle condensé] 58 Tableau 2.III [Énergies des résonances observées dans les différents modes vibrationnels du
phosphate de diméthyle] 61
Tableau 2.IV [Énergies et nature des résonances mesurées expérimentalement ou prédites théoriquement pour le phosphate de diméthyle et les molécules similaires au groupement
phosphate] 63
ARTICLE 3
Tableau 3.I [Énergies des modes vibrationnels de la thymidine mesurées par différentes
spectroscopies] 80
Tableau 3.II [Valeurs numériques de sections efficaces vibrationnelles pour des électrons (1-19 eV) en collision avec la thymidine condensée] 84 Tableau 3.III [Énergies et nature des résonances mesurées expérimentalement ou prédites théoriquement pour la thymidine et les molécules similaires] 87
ARTICLE 6
Tableau 6.I [Énergies des excitations électroniques de la thymidine provenant de diverses
études expérimentales et théoriques] 174
Tableau 6.III [Énergies et type des résonances observées dans diverses études sur les interactions électrons-thymidine et molécules similaires] 179
L
ISTE DES ABRÉVIATIONSAED Attachement électronique dissociatif AT Anion transitoire (Transient anion (TA)) AuNP Nanoparticule d’or (Au) (Gold nanoparticle)
Ar Argon
CS Section efficace (Cross section)
DEA Attachement électronique dissociatif (Dissociative electron attachment) DMP Phosphate de diméthyle (Dimethyl phosphate)
dT Thymidine
EBE Électron de basse énergie (Low-energy electron (LEE)) EEL Perte d’énergie de l’électron (Electron energy loss)
ETS Spectroscopie par transmission d’électrons (Electron transmission
spectroscopy)
ESD Désorption stimulée par électrons (Electron stimulated desorption) eV Électron-volt (=1.6 x 10-19 joule) (Electron-volt)
FWHM Largeur à mi-hauteur (Full width at half maximum) GNP Nanoparticule d’or (Gold Nanoparticle)
HREELS Spectromètre de pertes d’énergie de l’électron à haute résolution (High
resolution electron energy loss spectrometer)
LIAD Désorption acoustique induite par laser (Laser-Induced Acoustic Desorption) LEE Électron de basse énergie (Low-energy electron)
MC Monte Carlo
ML Monocouche (Monolayer)
MNP Nanoparticule de métal (Metal nanoparticle) Pt Platine (Platinum)
SAM Monocouche auto-assemblée (Self-Assembled Monolayer) SE Section efficace (Cross section (CS))
SPUL Probabilité de diffusion par unité de longueur (Scattering probability per unit
length)
TA Anion transitoire (Transient anion) THF Tétrahydrofurane (Tetrahydrofuran)
TRT Thérapie ciblée par radionucléide (Targeted radionuclide therapy) UHV Ultravide (Ultra high vacuum)
UPLC Chromatographie en phase liquide ultraperformante (Ultra-performance
liquid chromatography)
I
NTRODUCTIONMise en contexte
Rayonnements ionisants
En moyenne, 565 canadiens recoivent un diagnostic de cancer et 221 en meurrent chaque jour (Société canadienne du cancer, 2018). Le cancer représente environ 30% des causes de décès et est donc la principale cause de mortalité au Canada (Société canadienne du cancer, 2018). Par contre, le taux de survie suite au diagnostic a augmenté de 53 à 60 % entre 1994 et 2008 (Société canadienne du cancer, 2018). Cette augmentation peut être expliquée, en partie, par la constante amélioration des techniques de détections des tumeurs et des cellules cancéreuses comme l’imagerie biomédicale (par ex. l’imagerie par Rayons-X, Tomographie par Émission de Positrons (TEP) et l’Imagerie par Résonance Magnétique (IRM)) et par l’augmentation de l’efficacité des différents traitements de cancers comme la chirurgie, la chimiothérapie, l’immunothérapie et la radiothérapie. Cette dernière, qui est une des principales modalités de traitement du cancer, utilise les rayonnements ionisants pour traiter plusieurs types de cancer autant en surface (par ex. mélanomes) qu’en profondeur (par ex. gliomes) (Thariat et al., 2013). Les rayonnements ionisants, découverts au 19e siècle par
Wilhelm Röntgen (Rontgen, 1896), comportent les ondes électromagnétiques ayant une longueur d’onde plus petite que 10-7 m (Ultraviolet (UV), Rayons-X et Gamma) ainsi que
toutes particules chargées (par ex. proton, électron, ion) ou neutres provoquant l’ionisation et l’excitation des molécules et atomes du milieu qu’ils traversent. Ces rayonnements ont longuement été étudiés durant le 20e siècle et plusieurs innovations ont été développées à
partir de ceux-ci comme les centrales nucléaires, la radiothérapie et l’imagerie biomédicale. L’utilisation de l’arme nucléaire durant la deuxième guerre mondiale ainsi que les tragédies causées par le dysfonctionnement de réacteurs nucléaires (Tchernobyl (1986) et Fukushima (2011)) ont démontré les dangers d’une forte exposition aux rayonnements ionisants pour toute forme de vie. La radiothérapie utilise à son avantage ce caractère destructeur pour éliminer le plus précisément possible les tumeurs et les cellules cancéreuses avec ce type de rayonnement. Évidemment, pour développer des techniques radiothérapeutiques toujours plus efficaces et précises, il devient important de comprendre fondamentalement les
2 nombreux processus qui s’enclenchent aux niveaux physique, chimique et biologique pendant et suite au passage des rayonnements ionisants à travers le milieu biologique. Le domaine d’étude de ces processus se nomme la radiobiologie.
Radiobiologie
L’ADN des cellules cancéreuses est considéré la cible principale en radiothérapie (McNamara et al., 2017; Rezaee et al., 2017). Les rayonnements ionisants sont donc utilisés pour endommager l’ADN des cellules cancéreuses. Lorsque l’ADN subit des dommages difficilement réparables (par ex. bris double-brin) ou en grande quantité, les mécanismes de réparations de l’ADN sont insuffisants et la mort cellulaire est enclenchée. Par conséquent, les cellules cancéreuses sont éliminées et le volume tumoral diminue. Lors du passage des rayonnements ionisants à travers la matière biologique, ceux-ci provoquent l’excitation et l’ionisation des molécules qu’ils rencontrent (Pimblott and LaVerne, 2007). Donc, les rayonnements ionisants peuvent directement et indirectement endommager l’ADN (Desouky et al., 2015). L’endommagement indirect s’effectue via les espèces secondaires qui interagissent avec les molécules de l’ADN. Les espèces secondaires sont produits par les rayonnements primaires de haute énergie et les électrons secondaires qui interagissent avec les constituants du milieu cellulaire avoisinant l’ADN (Alizadeh et al., 2013). Parmi les espèces secondaires on compte les ions, les espèces réactives de l’oxygène (par ex. H2O2)
(Desouky et al., 2015), les radicaux libres comme l’hydroxyle (HO•) (Desouky et al., 2015) et beaucoup d’autres. L’endommagement direct se produit lorsque l’énergie est déposée directement à un ou plusieurs constituants de l’ADN (bases, désoxyribose ou groupement phosphate (voir Figure 1)) par les radiations, les particules primaires de hautes énergies (Desouky et al., 2015) ainsi que les électrons secondaires. Ces derniers sont reconnus pour être une des espèces des plus importantes en radiobiologie, car ils sont produits abondamment par le passage des rayonnements ionisants dans la matière biologique (Pimblott and LaVerne, 2007). En effet, environ ~5×104 électrons sont produits par MeV
d’énergie déposée (Uehara et al., 1999) dans la matière par la simple et multiple ionisations des molécules. La grande majorité de ces électrons ont une énergie en dessous de 30 eV (Pimblott et al., 1996) et leur énergie la plus probable est de 9-10 eV (Pimblott and LaVerne, 2007). Ces électrons sont nommés électrons de basse énergie (EBEs). Après plusieurs
décennies d’études, il s’est avéré que les EBEs sont les principaux responsables de l’énergie déposée à la matière, et donc aux cellules, suite au passage des radiations (Bouchiha et al., 2006; Duque et al., 2015; Inokuti, 1983; Pimblott et al., 1996). En 2000, Boudaiffa et al. (Boudaı̈ffa et al., 2000) ont démontré que les EBEs peuvent endommager l’ADN en produisant des bris simples et doubles brins, et ce, même avec des énergies incidentes sous le seuil d’ionisation des biomolécules dû au phénomène de résonance. Ainsi, l’étude fondamentale des interactions des EBEs avec des biomolécules comme l’ADN et ses constituants est d’une grande importance pour la radiobiologie. Ce type d’études est aussi pertinent pour plusieurs autres domaines connexes aux rayonnements ionisants comme l’astrochimie dans laquelle les EBEs ont probablement un rôle important à jouer dans la synthèse de molécules organiques à partir de constituants simples (Esmaili et al., 2018, 2017), le domaine de la nanolithographie par rayonnement UV extrême et faisceaux d’électrons (Wu et al., 2010), les sciences des plasmas (Lozano et al., 2017) et atmosphériques (Lu and Sanche, 2001) et la dosimétrie pour les voyages interplanétaires (Sridharan et al., 2015).
Figure 1 - Exemple d’un simple brin d’ADN (à la gauche) ainsi que les bases isolées et les constituants de la colonne vertébrales de l’ADN (en encadré).
4 La radiothérapie conventionnelle est basée sur deux techniques : la radiothérapie externe et la curiethérapie (aussi nommée brachythérapie). La première est une technique utilisant des faisceaux de rayonnements ionisants directement focalisés sur la tumeur à traiter chez le patient. Les rayonnements ionisants peuvent êtres produits par un accélérateur linéaire et peuvent être composées de photons, protons, neutrons, etc. Pour sa part, la curiethérapie utilise de petites sources radioactives qui sont insérées à l’intérieur du patient à proximité de la tumeur. Parmi la grande quantité de radioisotopes utilisés, on retrouve l’125I,
le 192Ir et le 103Pd (Thariat et al., 2013). En radiothérapie conventionnelle, un des paramètres
des plus important à contrôler est la dose déposée par les rayonnements ionisants par unité de masse (J/kg ou Gy); définie comme étant la dose absorbée. Le physicien médical planifiant le traitement radiothérapeutique doit optimiser cette dose : maximiser la dose au niveau des tissus cancéreux et minimiser celle-ci pour les tissus sains (Thariat et al., 2013). Étant donné le caractère destructeur des rayonnements ionisants, il est impératif d’épargner les organes et les tissus sains afin d’éviter l’endommagement de ceux-ci. Or, la radiothérapie conventionnelle est imparfaite et plusieurs problèmes persistent toujours de nos jours. Par exemple, en radiothérapie externe, les faisceaux de rayonnements ionisants traversent inévitablement des tissus et des organes sains occasionnant certains effets secondaires néfastes à court et à long termes (fibrose de tissus, dysfonctionnement de glandes, irritations cutanées, etc.) (Dearnaley et al., 1999). Pour sa part, la curiethérapie est une thérapie invasive et entraîne aussi divers effets secondaires indésirables. En outre, la radiothérapie conventionnelle peut causer l’augmentation des risques de seconds cancers (Clarke et al., 2005; Gao et al., 2003; Huang and Mackillop, 2001) et dans le cas du cancer du sein, il a été démontré que cette modalité peut augmenter l’incidence de métastases (Bouchard et al., 2017).
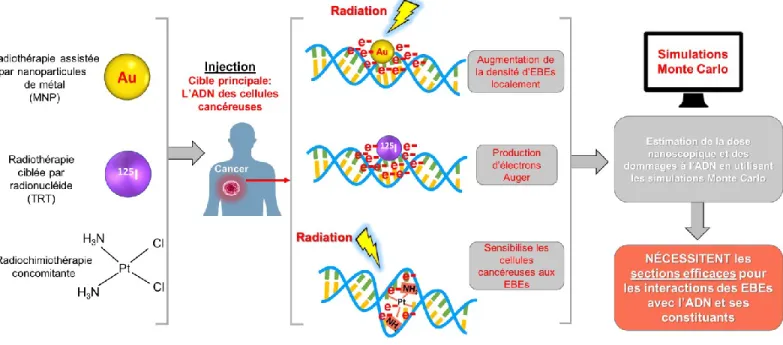
De nouvelles techniques, basées en partie sur les rayonnements ionisants, sont en cours d’étude et de développement pour améliorer l’efficacité des traitements radiothérapeutiques et surpasser les limites de la radiothérapie conventionnelle. Les techniques les plus prometteuses ciblent précisément les cellules cancéreuses et déposent une dose toxique aux niveaux subcellulaire, moléculaire et nanoscopique épargnant ainsi les cellules saines (Chattopadhyay et al., 2010; Gaze, 1996; Hainfeld et al., 2008; Hayes, 2017; Reilly, 2008; Rezaee et al., 2017; Sanche, 2015; Seiwert et al., 2007; Zalustky, 2013). Certaines de ces
nouvelles techniques utilisent à leur avantage la grande réactivité des EBEs produits dans le milieu biologique par les rayonnements ionisants pour augmenter la dose locale (au niveau des cellules cancéreuses). C’est le cas pour la thérapie ciblée par radionucléide (TRT pour
targeted radionucleide therapy), la radiothérapie assistée par nanoparticules de métal (MNPs
pour metal nanoparticles) et la radiochimiothérapie concomitante.
Thérapies ciblées et radiochimiothérapie concomitante
Contrairement à la radiothérapie conventionnelle qui délivre des doses macroscopiques (i.e., de l’ordre de grandeur des tissus et des organes (>mm3)), les thérapies
ciblées et la radiochimiothérapie concomitante permettent de cibler nanoscopiquement les cellules cancéreuses en évitant l’endommagement des cellules saines. Par exemple, des MNPs comme les nanoparticules d’or (AuNPs) sont utilisées afin d’augmenter la dose locale des rayonnements ionisants (voir Figure 2) (Her et al., 2017; Ngwa et al., 2014). Ces nanoparticules se localisent préférentiellement dans les cellules cancéreuses, notamment dû à l’augmentation de l’effet de rétention-perméabilité des cellules et tissus cancéreux (Her et al., 2017; Ngwa et al., 2014). Lorsqu’elles sont amassées dans les cellules cancéreuses, les MNPs sont soumises aux rayonnements ionisants de haute énergie utilisés en radiothérapie conventionnelle (énergie primaire entre 10 à 80 keV). Les rayonnements interagissent fortement avec les métaux ayant un grand numéro atomique (Z) et à ces énergies, le coefficient d’absorption des MNPs est environ 100 fois celui de la matière biologique (Berger et al., 2010; Butterworth et al., 2010; Hubbell and Seltzer, 2004). L’interaction des rayonnements primaires avec les MNPs provoque la libération d’un important nombre d’électrons Auger et de photoélectrons due à l’effet Compton et photoélectrique (Her et al., 2017; Ngwa et al., 2014). Ces derniers provoquent la production d’une grande densité d’EBEs autour des MNPs amassées dans les cellules cancéreuses (Sakata et al., 2018). Étant donné leur basse énergie, les EBEs ont un petit parcours dans la matière (environ 10-12 nm dans l’eau) (McMahon et al., 2011; Meesungnoen et al., 2002) et déposent alors localement leur énergie aux molécules du milieu biologique à une distance submillimétrique de la MNP. Lorsque la MNP est située à proximité ou à l’intérieur du noyau de la cellule, l’ADN peut alors être affecté. Depuis les travaux fondateurs de Hainfield et al. (Hainfeld et al., 2004),
6 celles-ci a été démontrée maintes fois in vivo et in vitro (Butterworth et al., 2010; Chang et al., 2008; Chattopadhyay et al., 2013; Hainfeld et al., 2013). Ainsi, avec leur effet de radiosensibilisation causé par la production d’une grande densité d’électrons secondaires, les MNPs et les radionucléides sont des outils prometteurs pour le futur de la radiothérapie ciblée.
La radiochimiothérapie concomitante, quant à elle, combine les deux modalités : la chimio- et la radiothérapie. Dans cette technique, les agents chimiothérapeutiques injectés dans le patient sensibilisent les cellules cancéreuses aux radiations et aux EBEs (voir Figure 2) (Aupérin et al., 2010; Seiwert et al., 2007; Zheng and Sanche, 2013). Les dommages à l’ADN sont augmentés en raison de l’attachement de l’agent chimiothérapeutique à l’ADN des cellules cancéreuses. Par conséquent, l’effet synergétique entre la chimio- et la radiothérapie produit une augmentation de l’efficacité des traitements radiothérapeutiques.
Évidemment, il est impératif d’estimer les doses aux niveaux sub-cellulaire et nanoscopique pour prédire les dommages et les risques radiobiologiques reliés à ces types de traitements. Les modèles macrodosimétriques (calcul de dose pour des volumes >mm3)
utilisés en radiothérapie conventionnelle ne sont pas adaptés à ces nouvelles techniques afin de calculer les nanodoses induites par les diverses espèces secondaires comme les EBEs. Au contraire, la macrodosimétrie tient compte seulement des interactions des particules primaires (photons et particules de haute énergie) avec les molécules du milieu biologique (majoritairement la molécule d’eau) (Emfietzoglou et al., 2005; Francis et al., 2011; Meesungnoen et al., 2002; Plante and Cucinotta, 2009). Ainsi, de nouveaux modèles, dits nanodosimétriques, doivent être développés pour estimer les différents dépôts d’énergie effectués par les espèces secondaires réactives dont les EBEs et leurs interactions avec des molécules biologiquements pertinentes comme les unités fondamentales de l’ADN. Les modèles nanodosimétriques reposent généralement sur des simulations par ordinateur appelées simulations Monte Carlo.
Simulations Monte Carlo
Les simulations Monte Carlo (MC) sont des méthodes numériques basées sur des échantillonnages aléatoires (Fippel, 2013). Étant donné que les radiations ionisantes
Figure 2 – Illustration des principes de base de trois modalités radiothérapeutiques de type ciblé : la radiothérapie assistée par nanoparticules de métal (MNP) utilisant ici les nanoparticules d’or (Au), la thérapie ciblée par radionucléide (TRT) utilisant ici l’iode 125 et la radiochimiothérapie concomitante utilisant dans cette exemple le cisplatine. Les trois techniques sont basées sur le même principe : suite à l’injection de l’agent (MNP, radionucléide ou agent chimiothérapeutique), celui-ci se concentre préférentiellement dans le noyau des cellules cancéreuses puisque la cible principale est l’ADN de ces cellules. Dans le cas des MNPs, les radiations administrées provoquent une augmentation de la densité d’EBEs localement ce qui augmente la dose au niveau nanoscopique. De la même manière en TRT, les électrons Auger produits par le radionuléide augmente la dose déposée au niveau nanoscopique. Pour la radiochimiothérapie concomitante, l’agent chimiothérapeutique sensibilise l’ADN aux EBEs produits suite au passage des radiations dans la matière biologique. Pour estimer cette dose nanoscopique ainsi que les dommages à l’ADN, les simulations radiobiologiques et Monte Carlo sont utilisées et celles-ci nécessitent des paramètres tels que les sections efficaces des EBEs avec l’ADN et ses constituants.
8 modéliser le passage de ces rayonnements à travers le milieu biologique. Les simulations MC permettent d’obtenir des informations d’un système via la simulation des interactions microscopiques de ce système (Fippel, 2013). Ces simulations peuvent prédire la transformation du milieu, la dose déposée au niveau nanoscopique, la production ainsi que la trajectoire des diverses particules primaires ainsi que les espèces secondaires produites (Nikjoo et al., 2016; Rogers, 2006). Les techniques de thérapies ciblées discutées dans la section précédente utilisant la production d’EBEs pour augmenter la dose locale ont recours aux simulations MC pour effectuer les calculs nanodosimétriques. Les méthodes MC nécessitent une grande quantité de paramètres qui permettent de modéliser les différentes interactions et processus lors du passage des interactions des rayonnements ionisants dans la matière (Dingfelder, 2006; Liu et al., 2017; Uehara et al., 1999). En effet, les particules et espèces secondaires créées par les rayonnements ionisants ont une certaine énergie dans le milieu, elles ont une certaine probabilité de parcourir le milieu sans faire de collision et lors d’une collision, une section efficace (SE) de diffusion spécifie les probabilités pour que cette collision soit élastique ou inélastique (excitation vibrationnelle et électronique, ionisation, etc.). Le transfert d’énergie de ces particules et espèces peut alors être suivi point par point ainsi que l’énergie déposée à l’échelle moléculaire et nanoscopique, permettant ainsi la nanodosimétrie. Cette dose pourra être ensuite reliée à un effet radiobiologique (Torfeh et al., 2019). Ainsi, un paramètre essentiel aux simulations sont les SEs ou probabilités d’interactions pour toutes les espèces réactives, incluant les EBEs, avec les molécules présentent dans le milieu biologique. Pour modéliser les dommages et la dose déposée, il est donc impératif de connaître les SEs pour toutes les biomolécules présentes dans les cellules et son noyau comme les constituants de l’ADN, l’eau, les acides aminés et beaucoup d’autres. Ainsi, pour avoir des simulations qui représentent le mieux possible la réalité, elles doivent prendre en compte toutes les interactions possibles des particules produites par les rayonnements ionisants et donc incorporer les SEs pour (Uehara et al., 1999) : les interactions élastiques, inélastiques, l’ionisation, les excitations vibrationnelles et électroniques, les phonons, etc. Étant donné l’abondance des EBEs, leurs SEs pour la collision avec des biomolécules sont importantes et il est donc nécessaire de les mesurer expérimentalement. Plusieurs modèles et codes utilisant des valeurs de SEs et permettant la nanodosimétrie et/ou la simulation des processus enclenchés au niveau nanoscopique et
moléculaire suite à l’irradiation sont développés et toujours en constante amélioration comme Geant4-DNA simulation tool-kit (Kyriakou et al., 2017), PENELOPE (Kyriakou et al., 2017), TOPAS-nBio (McNamara et al., 2017) et d’autres.
Plusieurs techniques expérimentales permettent la mesure de SEs de divers processus d’interactions des EBEs avec des molécules d’intérêts biologiques comme la spectrométrie photoélectronique X (XPS) (Klyachko et al., 1999), la spectroscopie par transmission d’électrons (ETS) (Burrow et al., 2008) et la désorption stimulée par électrons (ESD) (Hervé Du Penhoat et al., 2001). Cette thèse de doctorat consiste en la mesure expérimentale de SEs absolues à l’aide de la technique de spectroscopie de pertes d’énergie de l’électron à haute résolution (nommée HREELS de l’anglais High-Resolution Electron Energy Loss
Spectroscopy).
Spectroscopie de pertes d’énergie de l’électron à haute résolution (HREELS)
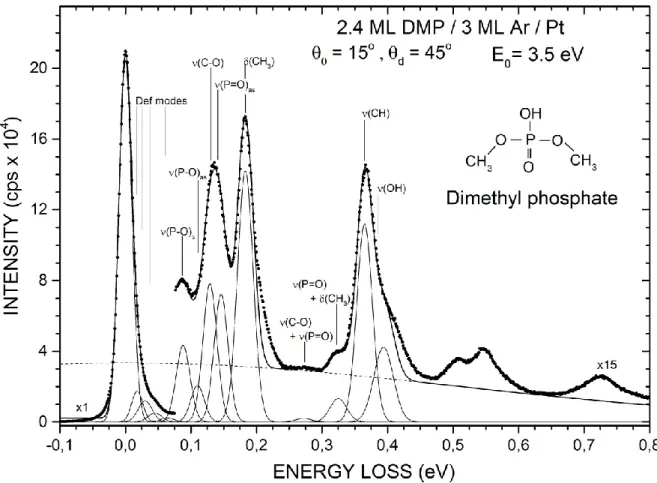
Le HREELS est une technique qui a été grandement utilisée durant les dernières décennies pour divers champs d’études: la caractérisation et l’analyse de surface (Ibach and Mills, 1982), l’analyse des structures et des liens moléculaires (Conrad and Kordesch, 2017; Yates and Madey, 1987) et récemment, l’étude de plasmons de surface (Colliex et al., 2016; Koh et al., 2009). Dans le cadre de ce projet, cette technique utilise des électrons monocinétiques incidents sur une cible comportant à sa surface un solide moléculaire. Le petit parcours moyen des électrons (énergie inférieure à 100 eV) dans un solide procure à la technique de HREELS une très haute sensibilité de la surface de la cible (Ibach and Mills, 1982). L’électron incident subit une collision avec la cible, interagit avec les molécules de la surface et peut transférer une partie de son énergie avant d’être rétrodiffusé dans le vide. De cette manière, il est possible de mesurer une quantité d’électrons ayant subi une perte d’énergie suite à leur interaction avec les molécules de la surface. Les pertes d’énergies sont alors associées à des excitations vibrationnelles ou électroniques des molécules étudiées. La Figure 3 présente un schéma du spectromètre HREEL utilisé dans cette thèse qui permet la mesure de SEs vibrationnelles et électroniques pour la collision d’EBEs avec des biomolécules condensées. Le spectromètre est composé d’une chambre principale sous ultravide (~2×10-11 Torr) contenant deux hémisphères électrostatiques : le monochromateur
10 projetés sur la cible contenant le solide moléculaire à étudier. Suite à la rétrodiffusion, l’analyseur récupère une quantité d’électrons ayant subi certaines pertes d’énergie.
Les interactions des EBEs avec les molécules sont extrêmement sensibles à l’énergie impliquée et à la phase des molécules. À haute énergie (au-dessus de 100 eV) et pour des molécules désordonnées, on peut approximer la diffusion de l’électron à une collision avec une molécule individuelle (Sanche, 1990). Ceci est dût à la longueur d’onde de l’électron à
Figure 3 - Schéma représentatif d'un spectromètre de pertes d’énergie de l’électron à haute résolution (HREELS) utilisé durant ce projet. Le spectromètre est composé de deux hémisphères électrostatiques (i.e., déflecteurs électrostatiques) : un monochromateur placé à 15o et un analyseur fixé à 45o dans l’azimut opposé. Les électrons monoénergétiques produits
par le monochromateur sont incidents sur un substrat de platine (Pt) refroidit à 19 Kelvin sur lequel 3 monocouches d’un gaz rare (ici l’argon) et une monocouche de biomolécules ont été condensées. L’analyseur mesure dans sa direction une quantité d’électrons ayant subi des collisions élastiques ou inélastiques avec la cible. Le courant transmis à travers ces couches peut aussi être mesuré.
ces énergies qui est petite comparativement à la distance intermoléculaire dans les milieux biologiques condensées (Sanche, 1990). En-dessous de 100 eV, cette longueur d’onde devient comparable à la distance intermoléculaire (par exemple, à 1 eV, 𝜆B ≈ 12Å) et les
EBEs peuvent interagir avec plusieurs molécules simultanément (Sanche, 1990). Par exemple, en phase condensée, des effets quantique peuvent se produire comme la diffraction de l’électron par le solide moléculaire (Zheng et al., 2006) et les phénomènes causés par la structure de bandes (Nagesha and Sanche, 1998). Il est aussi possible de mesurer les excitations vibrationnelles intermoléculaires (i.e., phonons) (Michaud et al., 2003) qui sont absents dans la phase gazeuse. Ainsi, étant donné que la matière biologique se retrouve naturellement en phase condensée, il devient crucial de mesurer les SEs des molécules individuelles dans cette phase pour incorporer tous ces effets et représenter le mieux possible le milieu biologique.
Plusieurs types d’interactions sont possibles entre les EBEs et les molécules. Premièrement, ils peuvent interagir sans transfert ou perte d’énergie. On appelle alors ce processus : collision élastique. Deuxièmement, les EBEs peuvent interagir inélastiquement, signifiant alors une perte ou un transfert d’énergie de l’électron à la molécule. Parmi les collisions inélastiques, on retrouve les excitations vibrationnelles et électroniques des molécules provoquées par la collision de l’électron. L’excitation vibrationnelle consiste en l’activation de différents modes vibratoires de la molécule. La perte d’énergie subie par l’électron correspond précisément à l’énergie d’activation de ces modes vibrationnelles. De même, pour les excitations électroniques, la perte d’énergie subie par l’électron incident correspond à l’excitation électronique de la molécule. Dans ce projet, il sera question des excitations vibrationnelles et électroniques pour plusieurs molécules d’intérêts biologiques.
Diffusion de l’électron
Le HREELS permet de mesurer les deux principaux processus d’interactions entre les électrons et les molécules: non-résonants et résonants. La probabilité d’interaction des processus non-résonants est plus importante à plus hautes énergies que les processus résonants (Arumainayagam et al., 2010). Par contre, il y a une variation monotone des probabilités d'interaction des processus non-résonants en fonction de l’énergie incidente de
12 SEs, et ce, à des énergies spécifiques de l’électron. Les processus inélastiques peuvent tous procéder par des processus résonants ou non-résonants, à l’exception de l’AED qui ne peut se produire qu’avec une résonance.
Processus non-résonants
Les processus non-résonants sont majoritairement contrôlés par la force d’échange ainsi que le potentiel électrostatique permanent et induit (Lafosse and Azria, 2011). Les termes dipolaires induits ou permanents sont habituellement les contributions principales dans l’expansion du potentiel (Lafosse and Azria, 2011). Ces termes résultent de la longue portée du potentiel Coulombien (~10 à 100 Å) et les interactions des électrons avec le substrat peuvent être approximés par un potentiel global de diffusion (Lafosse and Azria, 2011). Étant des interactions de longue portée, la diffusion direct favorise de petits transferts de quantité de mouvement (Δk<<k) et les électrons sont diffusés majoritairement dans le direction spéculaire (Lafosse and Azria, 2011). Puisque la probabilité d’interaction varie peu en fonction de l’énergie et un faible changement de quantité de mouvement est impliqué, les processus non résonants ne sont pas étudiés dans cette thèse de doctorat. Par contre, les processus résonants, qui peuvent montrer une grande variation de leur probabilité d’interaction à basse énergie, sont beaucoup plus pertinents à étudier pour le domaine de la radiobiologie.
Processus résonants
Comme mentionné précédemment, les processus résonants se produisent à faible énergie incidente de l’électron (<20 eV). Ces processus se produisent à une courte distance (environ 1 Å) contrairement aux processus non résonants (Lafosse and Azria, 2011). L’électron est diffusé par le potentiel atomique de la molécule cible. Avec ce type de processus, les électrons peuvent subir une importante variation de quantité de mouvement et de vecteur k et aucune direction de diffusion n’est favorisée (Lafosse and Azria, 2011). L’importance des interactions des EBEs en radiobiologie réside en grande partie dans les phénomènes résonants. Effectivement, l’évolution ou la décroissance d’une résonance peut mener à la fragmentation de molécules et éventuellement mener à des bris de l’ADN lorsque la molécule affectée fait partie de celui-ci. Les résonances peuvent être observées dans plusieurs types d’interactions EBE-molécule comme les interactions élastiques,
vibrationnelles, électroniques, l’ionisation et l’attachement électronique dissociatif (AED). Les processus résonants sont caractérisés par une forte augmentation des probabilités d’interactions à certaines énergies incidentes de l’électron (Schulz, 1973). Des maxima sont donc observés dans la dépendance en énergie incidente des SEs. La résonance, aussi appelée « anion transitoire » (AT), correspond à l’attachement temporaire de l’électron à la molécule. La probabilité d’interaction augmente, car l’EBE est présent autour de la molécule pendant un temps long relativement au temps habituel de collision (Sanche, 1990; Schulz, 1973). Ceci signifie que l’électron occupe temporairement une orbitale précédemment vide de la molécule (Sanche, 1990; Schulz, 1973).
Il existe deux principaux types de résonances: les résonances de forme et les résonances à cœur excité. Le premier type correspond à la capture temporaire de l’électron dans un orbital précédemment vide de la molécule dans son état fondamental (Sanche, 1990; Schulz, 1973). Pour ce type de résonance, l’électron incident est capturé par le potentiel effectif produit par la molécule et l’électron. L’électron est capturé, dans un orbital quasi-lié, par un potentiel attractif entouré d’une barrière centrifuge répulsive. Cette barrière retient l’électron pendant un certain moment puisqu’elle peut être traverser par effet tunnel (Sanche, 1990; Schulz, 1973). La résonance à cœur excité correspond, quant à elle, à la capture temporaire de l’électron dans une orbitale de la molécule dans un état électronique excité. Simultanément à la capture de l’électron, un électron de la molécule passe d’une orbitale de faible énergie vers une de plus haute énergie. Ainsi, l’AT est constitué d’une molécule ayant deux électrons dans des orbitales de haute énergie et un trou dans une orbitale habituellement occupée (Schulz, 1973). Les deux types de résonances sont différenciables par leurs temps de vie ainsi que l’énergie impliquée. Pour les résonances de forme, leur temps de vie typiques (𝛥t) est de 10-13 à 10-15 secondes tandis que les résonances à cœur excité ont un temps de vie
plus long de l’ordre de 10-12 à 10-13 secondes (Schulz, 1973). La différence de ces temps de
vie permet alors de distinguer ces résonances dans la dépendance en énergie des SEs. En effet, selon le principe d’incertitude, la largeur en énergie de la résonance est liée à son temps de vie (𝛤𝛥t≃ħ) (Sanche, 1990). Les structures ayant une largeur d’environ 1 à 2 eV sont produites par des résonances de forme, car le temps de vie plus court provoque des structures très larges dans la dépendance en énergie des SEs. Les structures plus étroites, dues au temps de vie très long, correspondent donc aux résonances à cœur excité.
14 L’évolution d’une résonance peut mener à plusieurs processus, appelés canaux de décroissance, ayant tous une probabilité de se produire. La Figure 4 présente un schéma des courbes de potentiel hypothétiques pour l’attachement de l’électron à une molécule diatomique quelconque AB. Les canaux de décroissance pertinents à ce présent projet peuvent être brièvement décris par ce schéma. La courbe noire représente l’état fondamental de la molécule neutre AB. Les courbes verte et bleue représentent l’état dissociatif et excité de l’AT (AB-) respectivement. La molécule AB est initialement dans son état fondamental à
une distance internucléaire d’équilibre Re. À cette distance, l’énergie verticale d’attachement
(EVA) est l’énergie nécessaire pour l’attachement de l’électron à la molécule générant ainsi l’AT. Cette transition s’effectue verticalement dans la région de Franck-Condon (représentée en rouge), puisque selon le principe de Franck-Condon, découlant de l’approximation de Born-Oppenheimer, la distance internucléaire reste inchangée durant cette transition (Arumainayagam et al., 2010). Lorsque l’état de l’AT est dissociatif dans la région de Franck-Condon (courbe verte dans la Figure 4), deux canaux de décroissances sont en compétition : l’autodétachement et l’AED. Ce dernier processus se produit lorsque trois conditions sont respectées : (1) l’état de l’AT est dissociatif dans la région de Franck-Condon, (2) le temps de vie de l’AT est plus long que la période de vibration et (3) l’affinité électronique est positive pour l’un des fragments de la molécule (dans ce cas-ci, le fragment B capte l’électron) (Arumainayagam et al., 2010; Sanche, 1990). Lorsque le temps de vie de la résonance n’est pas suffisamment long, l’état de l’AT ne peut atteindre la distance critique Rc provoquant la dissociation de la molécule et l’autodétachement de l’électron se produit.
Il y a alors transition (représentée par t dans la Figure 4) de l’état de l’AT vers un état vibrationnel excité de la molécule neutre AB.
L’AED de l’électron est extrêmement important en radiobiologie puisqu’il provoque la dissociation de la molécule en un ou plusieurs fragments neutres et un fragment négatif. Ainsi, lorsqu’une biomolécule de l’ADN subit l’AED, ceci provoque un dommage à l’ADN. Intuitivement, l’activation des vibrations par l’autoionisation de l’AT peut être compris par le fait que l’électron supplémentaire dans une orbitale liante ou antiliante de la molécule provoque un déplacement des noyaux de la molécule durant le temps de vie de la résonance. Ceci induit une compression ou une élongation des liens moléculaires et suite à l’autodétachement de l’électron, les noyaux reviennent à leur position d’équilibre produisant
la vibration du lien moléculaire (Sanche, 1990). L’excitation vibrationnelle de la molécule peut aussi être décrite de façon quantique. Les noyaux moléculaires peuvent être décrits par une fonction d’onde nucléaire ou paquet d’onde nucléaire. Lors de la transition dans la région de Franck-Condon, le paquet d’onde nucléaire est excité vers la courbe de potentiel dissociative. Ce paquet d’onde nucléaire est alors perturbé et hors de la position d’équilibre de la nouvelle courbe de potentiel qui est dans ce cas-ci dissociative (Allan, 2012). Par conséquent, durant le temps vie de l’anion transitoire, le paquet d’onde nucléaire relaxe
Figure 4 - Schéma représentant l’énergie potentielle V(R) en fonction de la distance internucléaire pour une molécule diatomique AB. La courbe noire représente l’état fondamental de la molécule neutre (AB), la courbe verte correspond à l’état dissociatif de l’anion transitoire (AB-) et l’état excité de cet anion est représenté par la courbe bleue. La
région de Franck-Condon est représentée en rouge et l’énergie verticale d’attachement est représentée par EVA. La transition correspondant à l’autodétachement est représentée par t. La distance nucléaire à l’équilibre est représentée par Re et la distance nucléaire critique
16 (Garraway and Suominen, 1995) et se propage vers un état de plus basse énergie en suivant la courbe de potentiel, causant un déplacement des noyaux moléculaires. Lors de l’autodétachement de l’électron, les intensités (ou les probabilités) de transition vers un état vibrationnel excité sont dictées par le chevauchement des deux fonctions d’onde nucléaires de l’état dissociatif et neutre (états initial et final), déterminant ainsi les facteurs de Franck-Condon (Garraway and Suominen, 1995). Dans cette thèse de doctorat, le canal de décroissance pour lequel les molécules sont laissées dans un état vibrationnel ou électronique excité est étudié à l’aide du HREELS.
Comme mentionnée précédemment, chaque canal de décroissance a une probabilité de se produire et on peut y associer une SE. Il est donc important de mesurer celle-ci pour chaque processus. Même si les excitations vibrationnelles ou électroniques ne produisent aucun dommage ou n’induisent pas la dissociation des molécules, ces interactions restes néanmoins importantes. En effet, pour représenter et simuler le plus fidèlement possible la séquence complexe d’évènements aux niveaux physique, chimique et biologique suite au passage des rayonnements ionisants dans la matière biologique, tous les processus d’interactions et leurs SEs sont importants et nécessaires. Par exemple, si les SEs vibrationnelles sont plus grandes relativement à celles de l’AED pour une biomolécule donnée, les excitations vibrationnelles deviennent importantes par rapport à l’autre processus. C’est donc la relation entre les SEs des divers processus qui est pertinente et c’est pour ces raisons qu’il est important d’en mesurer le plus possible.
Ainsi, le sujet de cette thèse de doctorat est la mesure expérimentale de SEs, avec le HREELS, pour les excitations vibrationnelles et électroniques provoquées par la collision d’EBEs avec des molécules d’intérêts biologiques en phase condensées. Ces mesures sont effectuées dans la direction hors-spéculaire pour étudier les processus résonants, les plus pertinents en radiobiologie. Le choix des molécules étudiées sera discuté dans la section
Objectifs.
Section efficace
La SE est définie comme étant la probabilité d’interaction en unité de surface par particule cible pour une particule incidente d’interagir avec la particule cible. Dans le cadre de cette thèse de doctorat, les particules incidentes sont les EBEs, dans la gamme d’énergie
entre 0 et 20 eV, et les particules cibles sont des constituants de l’ADN. Ainsi, la particule incidente aura une probabilité σr d’interagir dans un processus r avec la molécule cible. Les processus r peuvent être des excitations vibrationnelles, électroniques, des ionisations, des phonons; ce sont des mécanismes d’interactions entre l’électron et la molécule cible. Il est possible d’attribuer et de mesurer une probabilité d’interaction pour chaque processus d’interaction.
Il existe plusieurs types de SEs. Le premier type et le plus intuitif est la SE totale. Elle représente la probabilité pour l’électron d’interagir avec tous les processus confondus. La SE totale est donc la somme des SEs de tous les processus d’interactions possibles (σr = ∑ 𝜎𝑟 𝑟). Le deuxième type est la SE différentielle correspondant à la probabilité d’interaction
par unité d’angle solide à un angle donné. En outre, la SE différentielle peut aussi représenter la probabilité d’interaction par unité d’énergie. À l’opposé, la SE intégrale est la probabilité d’interaction différentielle (SE différentielle) intégrée sur tout l’espace (ou sur l’énergie). Le dernier type se nomme la SE absolue et elle correspond à la probabilité d’interaction pour une seule collision (ou une interaction) entre l’électron et la molécule.
Il est possible de mesurer ou d’obtenir différentes combinaisons de types de SEs. Par exemple, il est possible de mesurer des SEs différentielles et totales. Ces SEs représentent donc la probabilité d’interaction de l’électron avec la molécule à un angle solide donné pour tous processus confondus. De plus, il est possible de mesurer des SEs absolues et intégrales qui correspondent à la probabilité d’interaction entre l’électron et la molécule pour un seul processus d’interaction pour tous les angles. Les SEs mesurées expérimentalement dans cette thèse de doctorat sont des SEs absolues et intégrales pour les excitations vibrationnelles et électroniques de biomolécules provoquées par la collision d’électrons lents. Il est à noter que ce type de SEs est l’un des plus facilement exportable pour les simulations radiobiologiques permettant de connaître l’évolution du milieu et le dépôt d’énergie suite au passage de rayonnements ionisants. Effectivement, étant donné que les valeurs absolues et intégrales de SEs ne dépendent pas de l’angle ni des paramètres expérimentaux utilisés durant les mesures, elles ne nécessitent aucun traitement avant leur implémentation.
18
Théorie de la diffusion simple de l’électron
Comme mentionné dans les sections précédentes, la technique de HREELS est souvent utilisée pour étudier les interactions dipolaires et celles-ci sont décrites par des théories dipolaires semi-classiques et quantiques (Michaud and Sanche, 1984a). Par contre, lorsque les excitations vibrationnelles et électroniques sont étudiées dans la direction hors spéculaire, comme dans le cas de cette thèse, les interactions dipolaires deviennent faibles en intensité et les processus à courtes distances deviennent importants (Lafosse and Azria, 2011). Il est donc nécessaire de développer une théorie qui décrit la diffusion des électrons et qui permet le calcul de SEs vibrationnelles et électroniques à partir de mesures expérimentales. Un tel modèle a été développé par Michaud et Sanche (Michaud and Sanche, 1984a): la théorie de diffusions multiples. Cette théorie décrit la diffusion d’un EBE dans les régimes de sous monocouches et/ou de multicouches de molécules (simple ou multiples diffusions de l’électron). Dans ce modèle, pour un faisceau d’électrons uniforme incident sur un matériel désordonné d’une certaine épaisseur, il est possible de décrire la densité de courant (ayant une certaine distribution angulaire et énergétique dans le milieu) par une équation analogue à celle du transfert radiatif pour un plan parallèle (Chandrasekhar, 1950; Michaud and Sanche, 1984a). Dans ce modèle, la diffusion de l’électron est liée au terme de probabilité de diffusion par unité de longueur Q (ou SPUL pour scattering probability per
unit lenght). Ce terme est relié à la SE. Dans cette thèse de doctorat, seulement des couches
minces de molécules condensées sont utilisées. Lorsque le film de molécules est constitué d’une ou quelques monocouches (faible épaisseur de couche), il a été démontré que les effets de collisions multiples peuvent être négligés dû au libre parcours moyen de l’EBE qui est grand devant l’épaisseur de ces couches (Lévesque et al. 2005, Michaud et al 2012). Ainsi, à partir de la théorie de diffusion multiples de Michaud et Sanche (Michaud and Sanche, 1984a), il est possible d’isoler seulement le terme de simple diffusion pour décrire le courant d’électrons diffusés par le film mince par unité d’angle solide et par unité d’énergie 𝐽(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) (Levesque et al., 2003):
𝐽(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) ≅
𝐼0
Où I0 est le courant incident d’électrons avec une énergie incidente E0, 𝑄(𝜃0, 𝜙0, 𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) est le SPUL par unité d’angle solide et par unité d’énergie pour qu’un électron d’énergie E0 transfert une énergie E-E0 dans le film et soit dévié de la trajectoire initiale 𝜃0, 𝜙0 vers la direction finale 𝜃, 𝜙. Le facteur 1/cos 𝜃0 tient compte de la projection du faisceau d’électrons incident sur le substrat et le terme L est le nombre de couches de molécules constituant le film.
Étant donné que l’analyseur mesure ce courant dans un angle solide ∆ΩA et qu’on peut associer un coefficient quelconque de transfert TA relié à l’efficacité des différents éléments de l’analyseur (par ex. lentilles électrostatiques), on peut aussi écrire le courant par unité d’angle solide et par unité d’énergie 𝐽(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) mesuré à l’analyseur comme:
𝐽(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) ≅
𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0)
∆Ω𝐴T𝐴 (2)
Où 𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) est le courant mesuré à l’analyseur par unité d’énergie. On peut alors
remplacer cette dernière équation dans (1) et on obtient :
𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) ≅𝐼0cos 𝜃∆Ω𝐴T𝐴
0 𝑄(𝜃0, 𝜙0, 𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0)𝐿 (3)
Le courant incident total 𝐼0 ne peut être mesuré dans nos expériences et pour permettre le
calcul de valeurs de SEs absolues à partir de spectres de pertes d’énergie, il est nécessaire d’exprimer ce courant par un autre terme dont la mesure expérimentale est possible (Levesque et al., 2005b, 2003). Avec la relation de conservation des courants (expliquée en détail en annexe), il est possible de définir un courant incident effectif 𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0) qui dépend du courant total incident 𝐼0 comme suit (Levesque et al., 2005b):
𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0) ≡
𝐼0∆Ω𝐴T𝐴
20 Le courant incident effectif 𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0) est défini comme le courant total d’électrons rétrodiffusé dans la direction de l’analyseur 𝜃𝑝, 𝜙𝑝 mesuré à l’analyseur dans l’angle solide
∆ΩA. Il est possible de déterminer expérimentalement ce courant et celui-ci peut être vu comme la fraction du courant incident total 𝐼0 qui serait rétrodiffusée dans la direction de
l’analyseur par un film ayant un coefficient de réflexion parfait de 1. Le terme [2𝜋 + 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0)] provient de l’intégration du courant dans l’équation de la conservation des courants du système (voir les équations (5) à (13) en annexe). Le coefficient 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0) indique l’écart entre l’intégrale sur le demi-espace d’une distribution de
courant purement isotrope avec l’amplitude 𝐽(𝜃𝑝, 𝜙𝑝, 𝐸0) et la valeur réelle, étant
𝐽(𝜃,𝜙, 𝐸0). Les détails concernant ces termes sont donnés en annexe.
On peut alors remplacer (4) dans (3) et on obtient :
𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) ≅
𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)[2𝜋 + 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0)]
cos 𝜃0 𝑄(𝜃0, 𝜙0, 𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0)𝐿 (5)
On isole le terme qui est lié à la SEs de diffusion - le SPUL différentiel (𝑄(𝜃0, 𝜙0, 𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0)) :
𝑄(𝜃0, 𝜙0, 𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) ≅ 𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) cos 𝜃0
𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)[2𝜋 + 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0)]𝐿 (6)
On peut alors intégrer le SPUL différentiel :
𝑄𝑟(𝐸0, 𝐸 − 𝐸0) ≡ ∫ ∫ 𝑄(𝜃0, 𝜙0, 𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) sin 𝜃 𝑑𝜃 𝑑𝜙 𝜋 𝜋/2 2𝜋 0 (7) 𝑄𝑟(𝐸0, 𝐸 − 𝐸0) ≡ cos 𝜃0 𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)[2𝜋 + 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0)]𝐿 ∫ ∫ 𝐼(𝜃, 𝜙, 𝐸𝜋 0, 𝐸 − 𝐸0) sin 𝜃 𝑑𝜃 𝑑𝜙 𝜋/2 2𝜋 0 (8)
Suite à plusieurs opérations mathématiques (voir équations (18) à (22) en annexe), le résultat de cette intégration est :
𝑄𝑟(𝐸0, 𝐸 − 𝐸0) ≡
𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) cos 𝜃0
𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)𝐿
[2𝜋 + 𝑏(𝐸0, 𝐸 − 𝐸0)]
[2𝜋 + 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0)] (9)
Le terme [2𝜋 + 𝑏(𝐸0, 𝐸 − 𝐸0)] (expliqué en détail en annexe) est similaire au terme
[2𝜋 + 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0)]. Il représente la différence entre l’intégrale sur le demi-espace de la vraie distribution de courant 𝐽(𝜃,𝜙, 𝐸0, 𝐸 − 𝐸0) et celle d’une distribution de courant
𝐼(𝜃𝑝, 𝜙𝑝, 𝐸0, 𝐸 − 𝐸0). Pour le système utilisé dans ce projet de doctorat, il a été montré que le courant peut être considéré isotrope (Lepage et al., 2000; Michaud and Sanche, 1987, 1984a). Dans ce cas, les coefficients 𝑎(𝜃𝑝, 𝜙𝑝, 𝐸0) et 𝑏(𝐸0, 𝐸 − 𝐸0) sont très petit
comparativement à 2 et le quotient de droite de l’équation (9) tend vers 1. Ainsi, l’équation (9) devient :
𝑄𝑟(𝐸0, 𝐸 − 𝐸0) ≡𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) cos 𝜃0
𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)𝐿 (10)
Finalement, on peut exprimer le SPUL en fonction de la SE σr (E0, E-E0) et le nombre de densité de surface nS qui correspond au nombre de molécules par unité de surface (Levesque et al., 2005b): 𝑄𝑟(𝐸0, 𝐸 − 𝐸0)𝐿 ≡ 𝜎𝑟(𝐸0, 𝐸 − 𝐸0)𝑛𝑆 (11) On remplace (11) dans (10) : 𝜎𝑟(𝐸0, 𝐸 − 𝐸0) ≡ 𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0) cos 𝜃0 𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)𝑛𝑆 (12)
Cette équation est celle utilisée pour obtenir les valeurs de SEs dans ce projet pour chaque molécule étudiée. De cette manière, en mesurant seulement les spectres de pertes d’énergie
22 de l’électron (spectres vibrationnelles et électroniques) à un angle donné [𝐼(𝜃, 𝜙, 𝐸0, 𝐸 − 𝐸0)] et en normalisant par le courant incident effectif [𝐼0(𝜃𝑝, 𝜙𝑝, 𝐸0)] ainsi que les autres paramètres expérimentaux (𝑛𝑆 et cos 𝜃0), il est possible d’extraire les valeurs absolues de SEs vibrationnelles et électroniques.
Objectifs
Cette thèse de doctorat comporte plusieurs objectifs. En effet, trois molécules d’intérêts biologiques sont étudiées à l’aide de la spectroscopie HREEL et les SEs vibrationnelles et électroniques absolues sont mesurées pour celles-ci. Plus précisément, les trois biomolécules étudiées dans cette thèse de doctorat sont : le tétrahydrofurane (THF), le phosphate de diméthyle (DMP pour dimethyl phosphate) et la thymidine (dT).
Tétrahydrofurane (THF)
Dans la Figure 5, il est possible de remarquer que le THF (C4H8O) est une molécule
servant de modèle pour le désoxyribose qui compose la colonne vertébrale de l’ADN. Cette molécule est d’une grande importance, car elle est une partie intégrante de l’ADN et la fragmentation de cette dernière provoque un bris simple brin à l’ADN. Des contraintes expérimentales obligent l’utilisation du THF à défaut du désoxyribose, car il est impossible d’injecter le désoxyribose dans le système HREELS sans éviter sa fragmentation lors de la sublimation. Dans la Figure 5, il est possible de voir que le THF est l’anneau central du désoxyribose et qu’il est donc un excellent modèle pour ce groupement de l’ADN. Ainsi, il est important pour le domaine de la radiobiologie de connaître les probabilités d’interactions des EBEs avec cette molécule pour améliorer les modèles radiobiologiques et les calculs de doses au niveau nanoscopique. Dans cette thèse de doctorat, seulement les SEs électroniques absolues sont mesurées pour cette molécule, car les SEs des excitations vibrationnelles ont déjà été mesurées (V Lemelin et al., 2016).
Phosphate de diméthyle (DMP)
Le deuxième objectif est la mesure des SEs absolues des excitations vibrationnelles et électroniques du DMP provoquées par la collision d’EBEs. Le DMP (C2H7PO4) (voir Figure