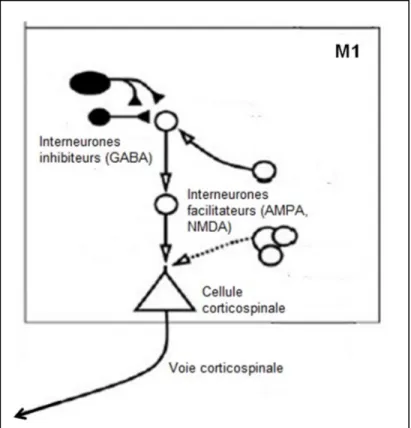
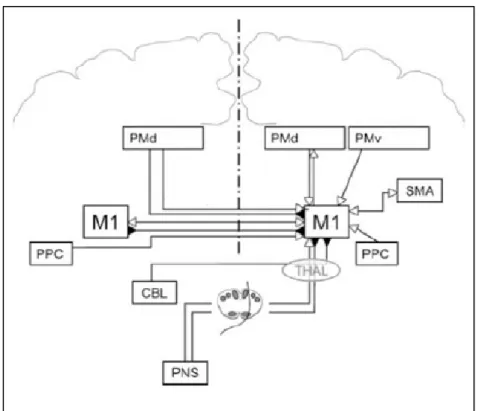
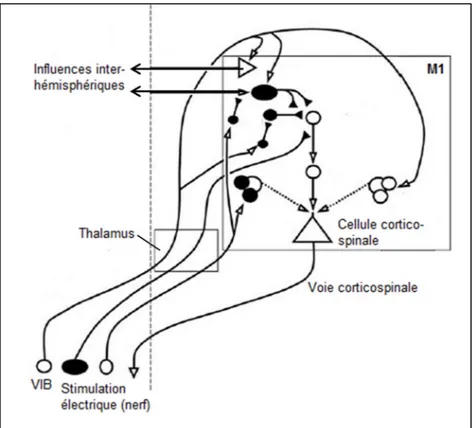
Interventions non invasives en phase chronique post-AVC
Rôle des afférences proprioceptives sur la plasticité cérébrale et le
contrôle sensorimoteur
Thèse
Louis-David Beaulieu
Doctorat en médecine expérimentale
Philosophiæ Doctor (Ph.D.)
Québec, Canada
Interventions non invasives en phase chronique post-AVC
Rôle des afférences proprioceptives sur la plasticité cérébrale et le
contrôle sensorimoteur
Thèse
Louis-David Beaulieu
Sous la direction de :
Cyril Schneider, directeur de recherche
Édith Ribot-Ciscar, codirectrice de recherche
Résumé
L’accident vasculaire cérébral (AVC), est un problème de santé majeur au niveau mondial. Les traitements de réadaptation visent à réduire le fardeau individuel et sociétal engendrés par l’AVC, via l’amélioration de l’indépendance fonctionnelle et des déficiences sensoriels et moteurs. Par contre, la plupart des survivants conservent des séquelles chroniques et ce, malgré l’accès à des soins de réadaptation intensifs et spécialisés. La recherche se penche donc sur l’utilisation de technologies novatrices et sécuritaires pour notamment tenter de dépasser les gains obtenus en clinique. Parmi les différentes approches actuellement évaluées en recherche, les appareils de neurostimulation périphérique semblent favoriser la récupération des fonctions sensorimotrices, via la production massive d’informations somatosensorielles (cutanées et proprioceptives). Ces afférences forceraient le système nerveux central lésé à s’adapter, offrant une fenêtre temporelle pendant laquelle le cerveau serait dans un meilleur état pour recevoir une thérapie. Malgré ces données intéressantes, le manque de connaissances limite le transfert clinique de ces approches. En particulier, le rôle des afférences proprioceptives vs. cutanées sur les effets de la neurostimulation périphérique demeurent à ce jour mal compris. L’objectif principal de la thèse était de déterminer si la nature des afférences sensorielles recrutées par neurostimulation périphérique a un impact sur la plasticité cérébrale et les déficiences sensorimotrices chez une clientèle AVC au stade chronique. Les cinq études du doctorat visaient plus précisément à : (i) évaluer les propriétés métrologiques (fidélité et changement minimal détectable) d’un outil de mesure neurophysiologique (stimulation magnétique transcrânienne – TMS) utilisé dans la thèse pour tester la plasticité cérébrale (études 1 et 2); (ii) approfondir les connaissances reliées aux paramètres d’application et afférences produites par deux approches de neurostimulation périphérique, soit la rPMS (stimulation magnétique périphérique répétitive) et la NMES (stimulation électrique neuromusculaire) (étude 3); (iii) développer et valider une approche standardisée permettant d’induire des illusions de mouvement par vibration musculo-tendineuse (VIB), puis débuter son processus de validation (étude 4); (iv) déterminer l’influence
sensorimotrice chez des personnes au stade chronique post-AVC en comparant les effets aigus de trois interventions de neurostimulation périphérique (NMES, rPMS, VIB) avec une séance d’exercices (étude 5).
Dans l’ensemble, les résultats des études supportent : (i) que les évidences actuelles ne permettent pas de conclure sur la fidélité des mesures TMS, mais que les erreurs de mesure observées encouragent l’utilisation de ces mesures pour suivre des changements de groupe plutôt qu’individuels; (ii) que notre procédure standardisée utilisant les illusions de mouvement induites par la VIB est valide chez des individus au stade chronique post-AVC et (iii) que le recrutement préférentiel des afférences proprioceptives semble plus efficace pour favoriser la plasticité cérébrale et l’amélioration des déficiences sensorimotrices chez des individus vivant avec les séquelles chroniques d’un AVC. Toutefois, avant de considérer un potentiel transfert clinique des approches étudiées dans la thèse, des études supplémentaires devront évidemment reproduire nos résultats et approfondir les diverses réflexions soulevées.
Table des matières
Résumé ... iii
Table des matières ... v
Liste des tableaux ... xi
Liste des figures ... xii
Liste des abréviations et des sigles ... xiv
Remerciements ... xviii
Avant-propos ... xx
Chapitre 1 : Introduction ... 1
1.1 Épidémiologie de l’AVC ... 2
1.1.1 Prévalence, incidence et mortalité ... 2
1.1.2 Fardeau individuel et sociétal ... 3
1.2 Physiopathologie de l’AVC et récupération ... 5
1.2.1 Causes principales d’AVC ... 5
1.2.2 Réactions physiologiques suivant l’ischémie cérébrale ... 6
1.2.3 Pronostic de récupération ... 8
1.3 Neurophysiologie de la perception sensorielle et du contrôle moteur ... 9
1.3.1 Vue d’ensemble : continuum perception-cognition-action ... 10
1.3.2 Voies sensorielles et cibles cérébrales principales ... 11
1.3.3 Traitement des informations sensorielles ... 18
1.3.4 Planification et programmation motrices : boucles cortico-corticales ... 21
1.3.5 Programmation et exécution motrices : boucles cortico-sous-corticales et cortico-cérébelleuses ... 22
1.3.6 Programmation et exécution motrices : cortex moteur primaire (M1) ... 25
1.3.7 Exécution motrice : voies descendantes ... 31
1.3.8 Exécution motrice : motoneurones alpha ... 34
1.4 Altération du contrôle sensorimoteur après un AVC ... 35
1.4.1 Classifications des déficiences sensorimotrices ... 36
1.4.2 Principales déficiences sensorimotrices post-AVC et outils de mesure ... 37
1.5 Plasticité cérébrale post-lésionnelle ... 45
1.5.3 Réorganisation des cartes sensorielles et motrices ... 47
1.5.4 Implication de l’hémisphère contralésionel ... 48
1.6 Investigation neurophysiologique du M1 par stimulation magnétique transcrânienne ... 50
1.6.1 Historique et principes physiques ... 50
1.6.2 Principes neurophysiologiques ... 51
1.6.3 Mesures obtenues par la TMS au dessus du M1 ... 53
1.6.4 Considérations méthodologiques ... 60
1.7 Neurostimulation périphérique comme approche émergente en réadaptation neurologique ... 62
1.7.1 NMES : Évidences, avantages et inconvénients ... 63
1.7.2 RPMS : Évidences, avantages et inconvénients ... 65
1.7.3 NMES versus RPMS ? ... 67
1.7.4 VIB : Évidences, avantages et inconvénients ... 68
1.7.5 Illusions de mouvement comme méthode d’évaluation de la proprioception ... 70
1.8 Rationnel de la thèse, objectifs et hypothèses de recherche ... 71
1.8.1 Rationnel de la thèse ... 71
1.8.1 Objectif et hypothèse de l’étude 1 (article 1, Chapitre 3) : « Tester la fidélité des mesures TMS chez des personnes sans problème neurologique » ... 72
1.8.2 Objectif et hypothèse de l’étude 2 (article 2, Chapitre 4) : « Tester la fidélité des mesures TMS chez des personnes au stade chronique après un AVC » ... 73
1.8.3 Objectif et hypothèse de l’étude 3 (article 3, Chapitre 5) : « Approfondir les connaissances reliées aux paramètres d’application de la rPMS et comparer la nature des afférences produites par la NMES et la rPMS » ... 73
1.8.4 Objectif et hypothèse de l’étude 4 (article 4, Chapitre 6) : « Développer une approche standardisée et faisable cliniquement permettant de tester l’intégrité du traitement des afférences proprioceptives en utilisant les illusions de mouvement induites par la VIB » ... 74
1.8.5 Objectif et hypothèse de l’étude 5 (article 5, Chapitre 7) : « Déterminer l’influence des afférences sensorielles sur la plasticité cérébrale et la récupération sensorimotrice en comparant les effets aigus de trois méthodes de neurostimulation périphérique (NMES, rPMS, VIB) avec une séance d’exercices » ... 74
Chapitre 2 : Méthodologie générale ... 76
2.1 Organisation générale des études de la thèse ... 76
2.2 Principaux éléments méthodologiques des revues de littérature ... 77
2.2.2 Revue permettant la détermination des paramètres rPMS et afférences rPMS
vs. NMES (étude 3) ... 79
2.3 Principaux éléments méthodologiques des études originales ... 80
2.3.1 Participants recrutés ... 81
2.3.2 Mesures TMS (études 2 et 5) ... 84
2.3.3 Illusions de mouvement par vibration musculo-tendineuse (études 4-5) ... 88
2.3.4 Fidélité des mesures TMS en AVC chronique (étude 2) ... 89
2.3.5 Effets rPMS vs. NMES vs. VIB vs. Exercices (étude 5) ... 90
2.4 Extraction des données et plan d’analyse statistique ... 94
Chapitre 3 (étude 1) ... 96
3.1 Résumé ... 97
3.2 Abstract ... 98
3.3 INTRODUCTION ... 99
3.4 MATERIALS AND METHODS ... 101
3.4.1 Literature search ... 101
3.4.2 Selection of the studies ... 102
3.4.3 Critical appraisal of studies ... 102
3.4.4 Critical appraisal of statistical concepts relative to reliability ... 104
3.4.5 Data extraction ... 106
3.5 RESULTS ... 106
3.5.1 Critical appraisal of the studies ... 107
3.5.2 Minimal detectable change (MDC) ... 109
3.6 DISCUSSION ... 111
3.6.1 Quality of methodology ... 111
3.6.2 Minimal detectable change (MDC) ... 115
3.6.3 ICC results ... 117 3.6.4 Study limitations ... 118 3.7 CONCLUSIONS ... 119 Chapitre 4 (étude 2) ... 145 4.1 Résumé ... 146 4.2 Abstract ... 147 4.3 INTRODUCTION ... 148 4.4 METHODS ... 149
4.4.1 Participants and Study design ... 149
4.4.2 Electromyographic (EMG) recordings ... 150
4.4.3 TMS testing ... 150
4.4.4 TMS data reduction ... 152
4.4.5 Statistical analysis for TMS outcomes reliability ... 153
4.5 RESULTS ... 156 4.5.1 TMS outcomes ... 156 4.5.2 Reliability results ... 157 4.6 DISCUSSION ... 158 4.6.1 Reliability results ... 158 4.6.2 Methodological considerations ... 163 4.6.3. Conclusions ... 164 Chapitre 5 (étude 3) ... 168 5.1 Résumé ... 169 5.2 Abstract ... 170 5.3 INTRODUCTION ... 171 5.4 RPMS PARAMETERS ... 172 5.4.1 Methods ... 172 5.4.2 Results ... 172
5.5 PREFERENTIAL AFFERENTS RECRUITMENT ... 186
5.5.1 Preferential recruitment over a nerve trunk ... 186
5.5.2 Preferential recruitment over a muscle ... 187
5.5.3 Recommendations for rPMS application based on preferential recruitment of afferents ... 189 5.6 CONCLUSIONS ... 190 5.7 ACKNOWLEDGMENTS ... 190 Chapitre 6 (étude 4) ... 198 6.1 Résumé ... 199 6.2 Abstract ... 200 6.3 INTRODUCTION ... 201 6.4 METHODS ... 204
6.4.1 PART A: Development of the SKIP ... 204
6.5 RESULTS ... 209 6.5.1 Discriminant validity ... 210 6.5.2 Feasibility ... 210 6.5.3 Floor/Ceiling effects ... 211 6.6 DISCUSSION ... 211 6.6.1 Discriminant validity ... 212
6.6.2 Feasibility in clinical practice and research projects ... 213
6.6.3 Floor/ceiling effects ... 214 6.6.4 Conclusions ... 214 Chapitre 7 (étude 5) ... 228 7.1 Résumé ... 229 7.2 Abstract ... 230 7.3 INTRODUCTION ... 231
7.4 MATERIAL AND METHODS ... 233
7.4.1 Participants and study design ... 233
7.4.2 Surface EMG recordings ... 235
7.4.3 Clinical testing and associated EMG measures ... 235
7.4.4 TMS testing of tibialis anterior M1 area ... 237
7.4.5 Interventions ... 238
7.4.6 Data reduction ... 240
7.4.7 Statistical analysis ... 242
7.5 RESULTS ... 243
7.5.1 Baseline differences between the paretic and non paretic sides ... 243
7.5.2 Ankle movement, pain and fatigue ... 243
7.5.3 Acute after-effects in each intervention ... 244
7.5.4 Cumulative effects ... 245
7.5.5 Correlations ... 246
7.6 DISCUSSION ... 246
7.6.1 The role of recruited afferents in NIPS after-effects ... 247
7.6.2 Are NMES and exercises inefficient? ... 249
7.6.3 Cumulative after-effects between sessions ... 250
7.6.4 Methodological considerations ... 250
7.6.6 Acknowledgement ... 251
7.6.7 Conflict of interest ... 251
7.6.8 Ethical approval ... 252
Chapitre 8 : Discussion générale ... 261
8.1 Survol des principaux résultats des études du doctorat ... 262
8.1.1 Fidélité des mesures TMS (études 1 et 2) ... 262
8.1.2 Paramètres rPMS et afférences rPMS vs. NMES (étude 3) ... 263
8.1.3 Développement et validation du SKIP (étude 4) ... 263
8.1.4 Effets rPMS vs. NMES vs. VIB vs. Exercices (étude 5) ... 264
8.2 Neurostimulation périphérique : rôle des afférences ... 264
8.2.1 Comparaison des paramètres et afférences induites entre les interventions ... 264
8.2.2 Comparaison des effets aigus entre les interventions ... 271
8.2.3 Changements TMS post-rPMS : mécanismes neurophysiologiques potentiels ... 276
8.3 Considérations méthodologiques ... 277
8.3.1 Considérations méthodologiques propres aux revues de littérature ... 278
8.3.2 Considérations méthodologiques propres aux études originales ... 279
8.4 Perspectives de recherche et retombées cliniques de la thèse ... 282
8.4.1 Perspectives de recherche ... 282
8.4.2 Retombées cliniques ... 284
Références ... 286
Annexe 1 : Feuillet d’information et formulaire de consentement pour le recrutement des personnes au stade chronique post-AVC ... 330
Annexe 2 : Questionnaire utilisée pour le suivi téléphonique 2, 10 et 30 jours après le projet ... 345
Liste des tableaux
Chapitre 2
Tableau 2.1. Paramètres des interventions de l’étude 5 ... 93
Chapitre 3 Table 3.1. Summary of studies of the systematic review ... 122
Table 3.2. TMS outcomes discussed in the systematic review ... 124
Table 3.3. Critical appraisal of studies of the systematic review ... 126
Table 3.4. Minimal detectable change of TMS outcomes ... 130
Chapitre 3 - Annexes Table 3.A.1. Quality of studies rated with the critical appraisal scale for psychometric articles ... 136
Table 3.A.2. Interrater agreement for Law and MacDermid critical appraisal tool ... 138
Table 3.A.3. Frequency distribution of the TMS checklist ratings ... 139
Table 3.A.4. Interrater agreement for the TMS checklist appraisal tool ... 141
Chapitre 4 Table 4.1. Characteristics of participants with chronic stroke ... 165
Table 4.2. TMS measures ... 166
Table 4.3. ICC, SEMeas and MDC results ... 167
Chapitre 5 Table 5.1. Parameters of rPMS application ... 192
Table 5.2. Pros and cons of magnetic stimulation applied at the periphery ... 195
Table 5.3. Side effects of magnetic stimulation applied at the periphery ... 196
Chapitre 6 Table 6.1. General characteristics of participants ... 219
Table 6.2. Mean, standard deviation and coefficient of variation for the SKIP rating sheet scores. ... 220
Chapitre 7 Table 7.1. General characteristics of participants with chronic stroke ... 258
Table 7.2. TMS and clinical outcomes at baseline ... 259
Table 7.3. EMG measures at baseline ... 260
Chapitre 8 Tableau 8.1. Conséquences physiologiques des interventions ... 265
Liste des figures
Chapitre 1
Figure 1.1. Boucle temporelle illustrant les structures et processus cérébraux impliqués dans le contrôle moteur. ... 11 Figure 1.2. Voies sensorielles. ... 15 Figure 1.3. Organisation somatotopique (homonculus) des cortex sensoriel et moteur
primaires (S1 et M1) ... 18 Figure 1.4. Principales cibles supraspinales impliquées dans le traitement des informations sensorielles. ... 19 Figure 1.5. Boucles cortico-sous-corticales et cortico-cérébelleuses impliquées dans le
contrôle moteur ... 23 Figure 1.6. Connexions intrinsèques dans le cortex moteur primaire (M1) ... 27 Figure 1.7. Projections intra- et inter-hémisphérique vers le cortex moteur primaire (M1) . 28 Figure 1.8. Influences des afférences sur les connexions intrinsèques du cortex moteur
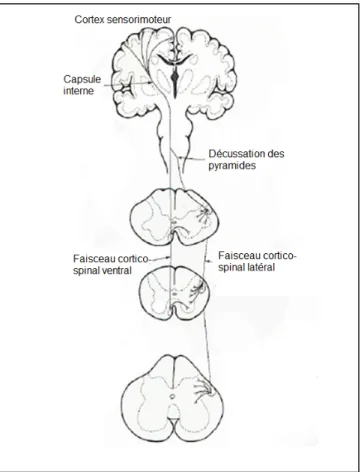
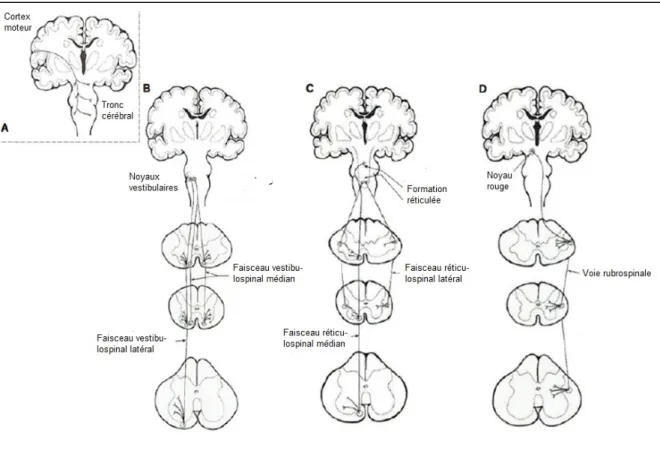
primaire (M1) contralatéral et sur l’hémisphère ipsilatéral ... 30 Figure 1.9. Voie corticospinale ... 33 Figure 1.10. Voies extrapyramidales ... 34 Figure 1.11. Ondes induites par la stimulation transcrânienne du cortex moteur primaire
(M1) et interneurones recrutés par les paradigmes TMS de double stimulation ... 53
Chapitre 2
Figure 2.1. Organisation générale des études de la thèse ... 76 Figure 2.2. Représentation schématique de l’amplitude, la latence et la période de silence
... 86 Figure 2.3. Représentation schématique des mesures SICI et SICF ... 87
Chapitre 3
Figure 3.1. Flowchart of the research strategy and systematic review evidence ... 121
Chapitre 5
Figure 5.1. Flow chart of the review’s research strategy. ... 191
Chapitre 6
Figure 6.1. Diagram of SKIP montage. ... 216 Figure 6.2. Optimal starting angles in SKIP for evoking illusory movements at the ankle
joint in patients with chronic stroke (paretic & non paretic sides) and in healthy
individuals. ... 217 Figure 6.3. SKIP scores obtained from the rating sheet in patients with chronic stroke
(paretic & non paretic sides) and in healthy individuals. ... 218
Chapitre 7
Figure 7.1. Acute pre/post changes of TMS outcomes after the interventions ... 253 Figure 7.2. Acute pre/post changes of isometric eversion strength after the interventions
... 254 Figure 7.3. Cumulative clinical improvements across sessions ... 255
Figure 7.4. Cumulative decrease of clonus detected by EMG of the soleus muscle across sessions ... 256 Figure 7.5. Correlations between improvements of ankle muscles isometric strength and
Liste des abréviations et des sigles
AA Amplitude articulaire
aDF Flexion dorsale active (de l’anglais active dorsiflexion) AMPA Récepteurs glutamatergiques
α-amino-3-hydroxy-5-méthylisoazol-4- propionate
AMS & SMA Aire motrice supplémentaire & supplementary motor area (en anglais)
AMT Seuil moteur actif (de l’anglais active motor threshold) AVC Accident vasculaire cérébral
BDNF Facteur neurotrophique (de l’anglais brain-derived neurotrophic factor)
BL Ligne de base (de l’anglais baseline) CB Cervelet (de l’anglais cerebellum)
CI Intervalle de confiance (de l’anglais confidence interval) CHU Centre hospitalier universitaire
CMD & MDC Changement minimal détectable & minimal detectable change (en anglais)
CMSA Chedoke-McMaster Stroke Assessment
CMV & MVC Contraction maximale volontaire & maximal voluntary contraction (en anglais)
CS Cellule corticospinale
CUT Afférences cutanées
CV Coefficient de variation
DF Flexion dorsale (de l’anglais dorsiflexion) DMC Déficience motrice cérébrale
EEG Électroencéphalographie EMG Électromyographie
É.T. & SD Écart-type & standard deviation (en anglais)
EVA & VAS Échelle visuelle analogue & visual analog scale (en anglais)
EV Éversion
FL Muscle long fibulaire (du latin fibularis longus)
FNM Fuseau neuromusculaire
Fof8 Bobine de stimulation en forme de 8 (de l’anglais figure of 8)
GABA, GABAA
& GABAB
Acide γ-aminobutyrique (GABA), liée au récepteur de type A & B
GBD Fardeau global des maladies (de l’anglais Global burden of disease)
GB Ganglions de la base
ICC Coefficient de corrélation intra-classe (de l’anglais intraclass correlation coeffcient)
IFCN Fédération Internationale de Neurophysiologie Clinique (de l’anglais International Federation of Clinical
Neurophysiology)
IRM & MRI Imagerie par résonnance magnétique & magnetic resonance imaging (en anglais)
LICF Facilitation intracorticale à long intervalle (de l’anglais long interval intracortical facilitation)
LOA Limites de l’accord (de l’anglais limits of agreement) LogN & LN Logarithme naturel
LTD Dépression à long terme (de l’anglais long term depression)
LTP Potentialisation à long terme (de l’anglais long term potentiation)
MEP & uMEP Potentiel évoqué moteur (MEP) et MEP non conditionné (de l’anglais unconditioned motor evoked potential) MN & MN Motoneurones alpha () & gamma ()
Moy Moyenne
MSO Intensité maximale du stimulateur (de l’anglais maximal stimulator output)
MSE Erreur carré moyenne (de l’anglais mean square error) MT & AMT Seuil moteur & seuil moteur actif (de l’anglais active motor
threshold)
Mvt Mouvement
M1 Cortex moteur primaire
NIPS Stimulation périphérique invasive (de l’anglais non-invasive peripheral stimulation)
NMDA Récepteurs glutamatergiques N-methyl-D-aspartate NMES Stimulation électrique neuromusculaire (de l’anglais
neuromuscular electrical stimulation) OTG Organe tendineux de Golgi
PFC Cortex préfrontal (de l’anglais prefrontal cortex) PMd & PMv Aire prémotrice dorsale & ventrale
PNS Stimulation nerveuse périphérique (de l’anglais peripheral nerve stimulation)
PP & PPC Cortex pariétal postérieur (de l’anglais parietal posterior cortex)
PRISMA Preferred Reporting Items for Systematic Reviews and Meta-Analyses
RC Bobine de stimulation ronde (de l’anglais round coil) ROM Amplitude de mouvement (de l’anglais range of motion) rPMS Stimulation magnétique périphérique répétitive (de
l’anglais repetitive peripheral magnetic stimulation) RVA Réponse vibratoire antagoniste
SEMeas Erreur standard de la mesure (de l’anglais standard error
of the measurement)
SENIAM Surface ElectroMyoGraphy for the Non-Invasive Assessment of Muscles
SEP Potentiel évoqué sensoriel (de l’anglais sensory evoked potential)
SKIP Standardized Kinesthetic Illusion Procedure
SICF Facilitation intracorticale à court intervalle (de l’anglais short-interval intracortical facilitation)
SICI Inhibition intracorticale à court intervalle (de l’anglais short-interval intracortical inhibition)
SNC & CNS Système nerveux central & central nervous system (en anglais)
SOL Muscle soléaire (du latin soleus)
SP Période de silence (de l’anglais silent period) S1 & S2 Cortex sensoriel primaire & secondaire TA Muscle tibial antérieur
TCC Traumatisme cranio-cérébral
THAL Thalamus
TES Stimulation électrique transcutanée (de l’anglais transcutaneous electrical stimulation)
TMS & rTMS Stimulation magnétique transcrânienne (TMS) et TMS répétitive (de l’anglais repetitive transcranial magnetic stimulation)
TVR Réflexe tonique vibratoire (de l’anglais tonic vibratory reflex)
À mes collègues et mentors, pour m’avoir mené jusqu’ici À ma famille et amis, pour tout le bonheur que vous m’apportez À Jessie et Victor (et futurs petits frères/sœurs), pour tout l’amour que vous m’apportez
Remerciements
Cette partie de la thèse étant moins « scientifique », je me permets de baser mes remerciements en respectant les priorités émises par l’aventurier Bear Grylls dans son guide de suivie :
Protection, Rescue, Water & Food
Protection. Mes mentors prennent évidemment la première place au palmarès des personnes importantes dans la réalisation de mon doctorat. Cyril, tu m’as fourni un « toit » et tu as allumé en moi le « feu » nécessaire à cette carrière de professeur-chercheur qui s’ouvre maintenant à moi. Si je n’avais pas été ton « protégé », je doute sincèrement que serais là où je suis présentement. Merci de tout cœur pour les belles années qui sont derrière nous, et pour celles qui nous restent à vivre ensembles dans le futur. Édith, tu m’as offert une « résidence secondaire » dans ton magnifique coin de pays, et m’as fait découvrir de nouvelles idées et approches qui seront extrêmement utiles pour ma survie dans la jungle académique. Tu es une co-directrice extra, nickel tu vois, et je me considère très chanceux de t’avoir à mes côtés.
Rescue. Afin de survivre aux études supérieures, il faut parfois compter sur le « sauvetage » par des tierces personnes. J’ai eu la chance d’avoir des collègues en or depuis les 8 dernières années qui m’ont fourni leur aide précieuse à de multiples reprises, en plus d’apporter plaisir, motivation (a.k.a café), sueur (je réfère ici aux entrainements du club « The Cave ») et rigolades. Bref, merci Annabelle, Fannie, Samuel, Lysanne, Monica, Audrey, Alexandre et autres membres de l’équipe ! Je souhaite également remercier les participants de mes projets car sans eux, aucun « sauvetage » ne m’aurait aidé à réaliser les travaux du doctorat.
La contribution de deux personnes doit être particulièrement soulignée. Vay, de collègue « sénior » tu es devenue une amie sincère. Merci pour ton aide, ton écoute et ton exemple, mais surtout pour les nombreux bons moments que nous avons eu ensembles. Hugo, je n’aurais pas pu espérer trouver un meilleur collègue, partenaire d’entrainement et surtout un aussi bon ami. Je suis reconnaissant que la vie t’a
placé, toi et ta famille, sur ma route. J’espère que nous pourrons continuer ce chemin ensemble longtemps encore.
Water and Food. Tout bon aventurier des cycles supérieurs ne peut survivre bien longtemps en se restaurant uniquement d’articles scientifiques, d’expérimentations et d’analyses. Sa survie dépend de certaines substances offrant un apport énergétique sain et équilibré. Voici pourquoi je clos cette section en offrant mes plus sincères et chaleureux remerciements à ma famille et mes amis. Sans vous, les dernières années auraient manquées de saveur, car vous assurez un apport constant de bonheur dans ma vie.
J’aimerais plus particulièrement remercier mes parents pour leur amour, leur exemple et leurs apprentissages qui me servent quotidiennement. Vous êtes une base solide sur laquelle notre famille peut s’appuyer. Bref, merci d’être là.
Pour terminer, merci à toi Jessie pour ton support indéfectible, ton aide précieuse (même pour la rédaction de cette thèse !), ton amour inconditionnel, et surtout, pour toutes les belles choses que tu me fais vivre depuis déjà plus de 10 ans ! Tu es un ange dans ma vie, et un tel amour ne peut qu’apporter plus de petits anges en ce monde.
Vic, tu fais de moi un papa fier et comblé. Je suis à chaque jour impressionné par tes prouesses et ta personnalité qui se développe petit à petit. Merci de m’apporter autant de joie et d’amour, et saches que je serai toujours là pour toi.
Avant-propos
La thèse présente les travaux de recherche réalisés à l’intérieur du doctorat (Automne 2012 à Automne 2016) sous la supervision du Dr Cyril Schneider (directeur principal) et du Dr Édith Ribot-Ciscar (codirectrice). Cette thèse par insertion d’articles contient 8 chapitres : l’introduction générale (Chapitre 1), l’approche méthodologique générale (Chapitre 2), les 5 articles scientifiques rédigés en anglais issus des travaux de recherche du doctorat (Chapitres 3-7) et la discussion générale (Chapitre 8), ainsi que deux Annexes. Parmi les articles insérés, un est publié et quatre ont été soumis dans des revues scientifiques avec évaluation par les pairs.
Contribution de l’étudiant pour tous les articles insérés dans la thèse : En tant qu’auteur principal des articles insérés dans la thèse, j’ai contribué à toutes les phases de réalisation d’une étude : élaboration du protocole expérimental, recrutement des participants, collecte et analyses des données, rédaction de l’article et processus de révision/publication.
Étude 1 (manuscrit présenté au Chapitre 3)
Le premier article s’intitule : « Reliability and minimal detectable change of transcranial magnetic stimulation outcomes in healthy adults : a systematic review » (auteurs : Louis-David Beaulieu, Véronique Flamand, Hugo Massé-Alarie & Cyril Schneider). Il est actuellement sous révision dans la revue Brain Stimulation. Aucune modification n’a été apportée au manuscrit original, excepté pour la mise en forme de la thèse.
Étude 2 (manuscrit présenté au Chapitre 4)
Le deuxième article s’intitule : « Intrarater reliability of lower limb transcranial magnetic stimulation outcomes in the ipsi- and contralesional hemispheres of adults with chronic stroke » (auteurs : Louis-David Beaulieu, Hugo Massé-Alarie, Edith Ribot-Ciscar & Cyril Schneider). Il est actuellement sous révision dans la revue Clinical Neurophysiology. Aucune modification n’a été apportée au manuscrit original, excepté pour la mise en forme de la thèse.
Étude 3 (manuscrit présenté au Chapitre 5)
Le troisième article s’intitule : « Repetitive peripheral magnetic stimulation to reduce pain or improve sensorimotor impairments: A literature review on parameters of application and afferents recruitment » (auteurs : Louis-David Beaulieu & Cyril Schneider). Il a été publié en Septembre 2015 dans la revue Neurophysiologie Clinique / Clinical Neurophysiology. Aucune modification n’a été apportée au manuscrit original, excepté pour la mise en forme de la thèse.
Étude 4 (manuscrit présenté au Chapitre 6)
Le quatrième article s’intitule : « The Standardized Kinesthetic Illusion Procedure (SKIP) to assess proprioceptive integration with muscle tendon vibration : development and validation in chronic stroke and healthy people » (auteurs : Louis-David Beaulieu, Hugo Massé-Alarie, Edith Ribot-Ciscar & Cyril Schneider). Il a été soumis à la revue Physiotherapy Theory & Practice. Aucune modification n’a été apportée au manuscrit original, excepté pour la mise en forme de la thèse.
Étude 5 (manuscrit présenté au Chapitre 7)
Le cinquième article s’intitule : « After-effects of peripheral neurostimulation on brain plasticity and ankle function in chronic stroke : the role of afferents recruited » (auteurs: Louis-David Beaulieu, Hugo Massé-Alarie, Edith Ribot-Ciscar & Cyril Schneider). Il est actuellement sous révision dans la revue Neurophysiologie Clinique / Clinical Neurophysiology. Aucune modification n’a été apportée au manuscrit original, excepté pour la mise en forme de la thèse.
Chapitre 1 : Introduction
La présente thèse aborde différents domaines de recherche reliés à la plasticité cérébrale (capacité du cerveau à s’adapter, se réorganiser) et à l’amélioration de la fonction motrice (contrôle sensorimoteur) chez des personnes vivant avec les séquelles d’un accident vasculaire cérébral (AVC). Notamment, la thèse s’est penchée sur l’importance des informations proprioceptives après un AVC car elles informent le système nerveux central (SNC) sur la position et les mouvements du corps et elles pourraient largement contribuer à l’amélioration des fonctions. La thèse s’est d’abord intéressée, par le biais d’une revue systématique (personnes en santé) et d’une étude expérimentale (personnes avec AVC chronique), à la fidélité des mesures neurophysiologiques de la fonction motrice et de la plasticité cérébrale, obtenues par stimulation magnétique transcrânienne (TMS) du cortex moteur primaire. Une troisième étude a révisé la littérature pour approfondir les connaissances reliées à la nature des afférences produites par deux interventions novatrices de neurostimulation périphérique, de même que leurs paramètres d’application. Une quatrième étude a permis de développer et de tester un outil pour évaluer les problèmes proprioceptifs au stade chronique post-AVC. Finalement, la dernière étude a exploré les effets aigus cliniques (sur la fonction motrice ou le contrôle du mouvement) et neurophysiologiques (mesures TMS sur la fonction cérébrale ou la plasticité cérébrale) d’interventions de neurostimulation périphérique qui recrutent de manière différente les afférences proprioceptives.
La thèse s’organise en huit chapitres distincts. Le Chapitre 1 (introduction générale) présente les évidences nécessaires à la compréhension des concepts abordés : épidémiologie (section 1.1) et physiopathologie (section 1.2) de l’AVC; neurophysiologie de la perception sensorielle et du contrôle moteur (section 1.3); altération du contrôle sensorimoteur après un AVC (section 1.4); plasticité cérébrale post-lésionnelle (section 1.5); fonction motrice cérébrale testée par TMS (section 1.6); neurostimulation périphérique : une approche émergente en réadaptation neurologique (section 1.7); rationnel, objectifs et hypothèses des articles présentés dans la thèse (section 1.8). Le second Chapitre présente l’approche méthodologique
générale des cinq études de la thèse. Les Chapitres 3 à 7 présentent les résultats de ces études sous la forme d’articles scientifiques. Finalement, le Chapitre 8 (discussion générale de la thèse) présente une réflexion approfondie et intégrée des évidences mis en lumière par les études de la thèse, et élabore sur les retombées et perspectives à considérer pour les études futures dans ce domaine.
1.1 Épidémiologie de l’AVC
L’AVC se définit comme l’altération soudaine de la fonction cérébrale provoquée par la mort des cellules à l’intérieur du cerveau, résultant d’une interruption de la vascularisation du tissu cérébral (www.fmcoeur.qc.ca; 2016). Tel que décrit dans les prochaines sections, l’AVC représente l’une des principales causes de mortalité et d’incapacités physiques et ce, tant au niveau mondial qu’au Canada. Depuis les deux dernières décennies, l’incidence (i.e. nombre de nouveaux cas par an) et la prévalence (i.e. nombre de cas par rapport à la population à un moment donné) de l’AVC n’ont cessé de progresser, en grande partie par la faute de mauvaises habitudes de vie [1-3]. Ces données soulignent que l’AVC est un problème de santé majeur à l’échelle mondiale et nécessite l’attention urgente et soutenue de tous les acteurs ayant un impact direct ou indirect sur les soins de santé (prévention, réadaptation, etc.).
1.1.1 Prévalence, incidence et mortalité
De nombreuses études d’envergure internationale comptabilisent avec précision la prévalence, l’incidence et le taux de mortalité associés à l’AVC. Ces indices ont grandement augmenté depuis 20 ans, quoique légèrement moins rapidement depuis 2010 [1, 4]. En 2013, l’AVC a causé environ 6.5 millions de morts et 25 millions de survivants, et l’incidence était estimée à 10.3 millions de nouveaux cas par an [4]. Les pays développés détiennent les plus forts taux d’incidence et de prévalence, particulièrement les États-Unis avec plus de 1000 cas par 100 000 habitants [4]. Ces indices semblent reliés à de mauvaises habitudes de vie : mode de vie sédentaire, alimentation riche en sodium, en sucres raffinés et en gras trans et saturés, tabagisme, entre autres facteurs [4-7]. Inversement, les plus hauts taux de mortalité
causés par AVC mondialement [4]. Les personnes qui subissent un AVC dans les pays industrialisés bénéficient d’une plus grande accessibilité à des soins hospitaliers d’urgence, ainsi qu’à différentes technologies dans les domaines diagnostiques et thérapeutiques permettant une prise en charge rapide et individualisée [1, 4, 8, 9]. Malgré ces progrès technologiques et l’avancement des connaissances dans le domaine, l’AVC demeure au deuxième rang des causes de mortalité au niveau mondial, ainsi qu’au troisième rang des causes d’incapacités à long terme [1]. La prochaine section traite spécifiquement du fardeau individuel et sociétal résultant des incapacités observées chez les survivants d’un AVC.
1.1.2 Fardeau individuel et sociétal
Le fardeau global des maladies (global burden of diseases - GBD) est une méga-étude internationale incluant 188 pays et qui s’intéresse au fardeau individuel de centaines de maladies et conditions de santé sur l’espérance de vie et l’incapacité fonctionnelle. Le GBD utilise trois indicateurs : (i) les années de vie perdues à la suite d’une mort prématurée, (ii) les années vécues avec incapacités et (iii) la combinaison de ces deux facteurs permettant une vision globale de l’impact de la maladie sur la condition humaine. Particulièrement pour l’AVC, le troisième indicateur représente la meilleure estimation du fardeau individuel engendré, étant donné son haut taux de mortalité. Selon ce facteur combiné, l’AVC est classé au second rang des maladies ayant le plus d’impact au niveau mondial [1, 2, 4, 9]. Les déficiences (altération du fonctionnement d'un organe ou d'un système) et incapacités fonctionnelles (conséquences d’une déficience sur le fonctionnement d’un individu, par exemple dans ses activités quotidiennes, http://www.who.int/classifications/icf/en/, 2016) chez les survivants d’un AVC sont variées, affectant notamment une ou plusieurs des fonctions suivantes : mouvement, mobilité, sensation, langage, émotion, mémoire et autres fonctions cognitives [10]. Les déficiences et incapacités motrices et sensorielles seront d’ailleurs spécifiquement abordées dans la section 1.4. Plus du tiers des individus conservent des séquelles sévères au stade chronique (≥ 6 mois), dont 20% nécessitent une assistance pour réaliser les activités de la vie quotidienne [10, 11]. Dans une cohorte de 434 personnes questionnées six mois après avoir subi un AVC,
plus de la moitié ont rapporté de la difficulté à réaliser leurs tâches ménagères quotidiennes et 65% se sentaient incapables de réintégrer leurs activités communautaires [12]. D’autres études estiment que ces limitations fonctionnelles sont vécues par environ 55-75% des survivants d’un AVC [13], réduisant non seulement leur qualité de vie, mais aussi la qualité de vie de leurs proches aidants [14]. Une revue de littérature récente a d’ailleurs mis en lumière le rôle majeur de la récupération motrice et fonctionnelle sur la qualité de vie des personnes vivant avec les séquelles d’un AVC et de leurs proches [15].
Outre le fardeau individuel, l’AVC a des répercussions économiques et sociétales majeures [16-18]. Par exemple, il est estimé qu’aux États-Unis seulement, les coûts directs en soins hospitaliers et de réadaptation associés à l’AVC et autres maladies cardiovasculaires vont tripler d’ici les vingt prochaines années, en passant de 273 milliards en 2010 à 818 milliards en 2030 [19]. De plus, les coûts indirects reliés à la perte de salaire et de productivité devraient passer de 172 milliards en 2010 à 276 milliards en 2030 [19]. Selon les auteurs, le vieillissement de la population et la prévalence croissante des facteurs de risques de l’AVC ont un impact important sur ces estimations.
Ces données épidémiologiques soulignent l’impact considérable de l’AVC sur la santé et la qualité de vie, ainsi que les répercussions économiques engendrées. La prévention au niveau des facteurs de risque [5, 6, 20], ainsi que l’accès à des soins de qualité permettant d’optimiser la récupération [10, 15] sont des cibles prioritaires pour réduire le fardeau individuel et sociétal. La présente thèse aborde spécifiquement l’amélioration des soins prodigués post-AVC, et tout particulièrement concernant certaines mesures et thérapies du domaine de la réadaptation physique. Dans le but d’assurer une compréhension optimale des concepts spécifiques reliés aux études de la thèse, certaines notions fondamentales seront préalablement abordées dans les prochaines sections. Une attention particulière est portée sur les déficiences sensorielles et motrices, étant donné leur importance dans les études de la thèse de doctorat.
1.2 Physiopathologie de l’AVC et récupération
1.2.1 Causes principales d’AVC
Selon la Fondation des maladies du cœur (www.fmcoeur.qc.ca; 2016), environ 80% des AVC sont le résultat d’une ischémie induite par un caillot dans le réseau vasculaire. Dans la majorité des cas, le caillot bloquant la circulation sanguine est une conséquence de l’athérosclérose, c’est-à-dire d’une accumulation progressive de plaques (dépôts graisseux) dans les artères. Ces plaques peuvent directement obstruer le canal artériel, ou se détacher de la paroi et ensuite bloquer une artère plus petite en aval. Si le caillot provient d’une artère cérébrale, l’AVC est dit thrombotique, alors que s’il provient d’ailleurs (ex : du cœur) l’AVC est dit embolique. Une ischémie cérébrale transitoire est observée lorsque la privation d’oxygène est seulement de courte durée et ne mène pas à des dommages cérébraux permanents. Pour cela, le caillot peut s’être dissous soit de manière spontanée, soit en réponse à un agent pharmacologique anti-thrombotique, une intervention médicale nommée thrombolyse (www.fmcoeur.qc.ca; 2016). Dans les deux cas, la survie tissulaire dépend crucialement de la durée de l’ischémie. L’efficacité maximale de la thrombolyse se situe dans les premières 90 minutes suivant l’apparition des symptômes, et doit être typiquement administrée dans les 3 heures en Amérique du Nord [21, 22] et dans les 4,5 heures en Europe [22]. Au-delà de ce délai, les risques d’hémorragie et de décès secondaires deviennent trop grands par rapport aux bénéfices attendus [22]. Par contre, des études récentes utilisant différents dosages ou de nouveaux agents anti-thrombotiques ont montré des bénéfiques jusqu’à 9 heures après l’occlusion [22-24]. Si aucune intervention par thrombolyse n’est possible, la lésion cérébrale progresse rapidement en termes de volume dans les premières 24 heures, pour ensuite se stabiliser [10]. Le volume de tissu lésé dépend donc du temps de privation d’oxygène et des interventions administrées (ou non). De plus, la qualité du réseau vasculaire dans son ensemble revêt une importance majeure dans la taille de la lésion. En effet, le volume de tissu lésé pourrait être plus grand dans un réseau artériel affecté par des plaques athéromateuses et présentant peu de voies collatérales [10].
Les 20% des AVC non ischémiques sont causés par une lésion des vaisseaux sanguins qui crée une hémorragie cérébrale (www.fmcoeur.qc.ca; 2016). Les AVC hémorragiques sont dus à une faiblesse structurelle des vaisseaux sanguins, soit par malformation artérioveineuse congénitale, soit par un anévrisme (faiblesse dans la paroi qui se gonfle et ultimement se rupture). Les traitements médicaux d’urgence sont généralement de nature chirurgicale, et visent à évacuer l’œdème et diminuer la pression intracrânienne [25]. Certaines nouvelles approches thérapeutiques sont présentement sous évaluation, telle l’utilisation d’agents neuro-inflammatoires pour favoriser la réparation tissulaire [26]. Par contre, étant donné que la revascularisation par thrombolyse est contre-indiqué (elle empêcherait l’agrégation plaquettaire nécessaire au colmatage du vaisseau sanguin lésé), le pronostic de récupération est généralement moins bon que pour les AVC ischémiques [25]. Tel que mentionné précédemment, divers facteurs augmentent considérablement le risque de subir un AVC. Outre le sexe [27, 28], l’âge [2], la race et l’ethnicité [1, 4], la plupart des facteurs de risque de l’AVC sont considérés comme modifiables. Ces facteurs incluent une consommation faible de légumes et fruits (i.e. moins de cinq portions par jour), une alimentation riche en sucres raffinés, gras saturés et en sodium, le tabagisme, la sédentarité, l’embonpoint ou l’obésité, l’hypertension artérielle, le diabète et le stress (www.fmcoeur.qc.ca, 2016) [4-7]. Ces mauvaises habitudes de vie augmentent considérablement le risque de développer de l’athérosclérose ou d’affaiblir la paroi des artères. Le fait d’adopter au moins cinq comportements sains parmi ceux présentés serait associé à une baisse de 88 % du risque de décès attribuables à l’AVC et autres maladies cardiovasculaires, et permettrait de retarder l’apparition de ces maladies d’environ 14 ans (www.fmcoeur.qc.ca; 2016). Ces recommandations sont autant importantes pour les survivants d’un AVC, car ils présentent un risque accru de récidive [29, 30].
1.2.2 Réactions physiologiques suivant l’ischémie cérébrale
Les dommages cérébraux induits par l’AVC résultent d’une privation subite d’oxygène qui ultimement mène à la nécrose tissulaire, lorsque prolongée au-delà de quelques heures [31]. La privation subite d’oxygène entraine une cessation
brusque de l’activité électrique des cellules cérébrales affectées et par le fait même, des fonctions qui étaient assurées par ces cellules [10]. Diverses déficiences et incapacités sont alors observées, dépendamment des régions cérébrales touchées. Par exemple, le blocage de l’artère cérébrale moyenne, responsable de la vascularisation de la majorité du cortex, engendre très fréquemment des désordres sensoriels et moteurs (voir sections 1.3 et 1.4), alors que l’atteinte des artères cérébrales antérieure et postérieure occasionne entre autres des troubles cognitifs et visuels, respectivement (www.fmcoeur.qc.ca; 2016) [10]. Lorsque prolongée au-delà d’un certain délai, l’ischémie induit des dommages structurels permanents. Dans les premiers jours suivant la lésion, le volume de tissu cérébral affecté par l’ischémie excède la région complètement privée d’oxygène [32]. Cette zone hypoperfusée, mais ne présentant pas encore de changements irréversibles est nommée tissu péri-lésionnel (ou penumbra, en anglais) [32, 33], et représente la cible thérapeutique principale de la thrombolyse [21, 23, 34]. Les modèles animaux et humains ont démontré que le tissu péri-lésionnel subit des changements majeurs dans les premières 24 heures suivant l’ischémie. La baisse de circulation sanguine occasionne des perturbations ioniques qui résultent en une augmentation de la concentration extra-cellulaire de glutamate [32, 33]. Les récepteurs du glutamate, i.e. NMDA (N-Méthyl-D-Aspartate) et AMPA (α-amino-3-hydroxy-5-méthylisoazol-4-propionate), sont alors suractivés et causent une accumulation de calcium intra-cellulaire [33]. Le calcium induit une cascade signalétique activant divers facteurs géniques et la synthèse de protéines, résultant en une accumulation de radicaux libres qui créent des dommages irréversibles aux cellules [33]. Outre ce mécanisme lésionnel relié au glutamate (nommé excitotoxicité glutamatergique), d’autres processus délétères contribuent à l’accroissement du volume de tissu lésé, tel le relâchement de facteurs inflammatoires pro-apoptotiques [35]. Au-delà de 24 heures, la croissance de la lésion ralentie progressivement [33], et des changements secondaires sont observés, incluant la formation d’un œdème cérébral et l’infiltration de cellules immunitaires [36]. Quoique que ces réactions permettent d’activer les processus de réparation tissulaire, certaines données suggèrent que les réponses inflammatoires et immunitaires peuvent accroitre la lésion cérébrale [37].
Différents mécanismes favorisent la réparation tissulaire et la récupération des fonctions affectées dès les premières minutes suivant l’ischémie. Une cascade complexe de processus cellulaires et moléculaires se met en branle, non seulement dans les tissus lésés et péri-lésionnels, mais également dans des régions cérébrales éloignées [31, 38]. Ces processus incluent entre autres l’inflammation, des changements au niveau de la transcription et translation géniques, la sécrétion de facteurs de croissance, ainsi que des changements au niveau des récepteurs de certains neurotransmetteurs [39]. Ces divers processus permettent d’attirer des cellules immunitaires nécessaires à l’élimination des débris occasionnés par la mort neuronale [36], et favorisent la croissance axonale, l’angiogénèse et la création de nouvelles synapses [39]. Ultimement, ces réactions physiologiques causées par l’ischémie visent à faciliter la réorganisation des connexions entre les neurones (i.e. plasticité cérébrale) pour compenser la perte de cellules [40-42]. Les concepts reliés à la plasticité cérébrale sont traités plus spécifiquement dans la section 1.5.
1.2.3 Pronostic de récupération
Les déficits neurologiques peuvent régresser de façon substantielle dans les premières semaines, particulièrement lorsque le patient a bénéficié de la thrombolyse et de soins neurologiques spécialisés, dont la réadaptation physique détient une place importante [43-46]. Les processus de réorganisation cérébrale (voir section 1.5) qui sous-tendent la récupération sont relativement lents et nécessitent plusieurs mois, voire des années, pour atteindre leur potentiel maximal [10, 47]. Au stade aigu (i.e. premiers jours post-lésion), il est difficile de prédire avec précision le degré ultime de récupération, car l’évolution au stade subaigu (i.e. premiers mois post-AVC pendant lesquels les patients reçoivent habituellement de la réadaptation intensive) est extrêmement hétérogène [39, 48, 49]. Par la suite, les prédictions s’améliorent à mesure que le temps passe et que les déficiences neurologiques se précisent [50, 51], particulièrement avec l’utilisation de nouveaux outils d’investigation neurophysiologique [10]. La plupart des études épidémiologiques s’entendent pour dire que la majorité des améliorations au niveau des déficits neurologiques survient dans les 6 à 12 mois suivant la lésion [10,
52-à les réaliser sans aide externe, s’améliore usuellement dans les 20-30 semaines post-AVC, quoique fréquemment par le biais de stratégies motrices compensatoires (c’est-à-dire d’une manière différente que celle utilisée avant l’AVC) ou l’utilisation d’aides techniques [55, 56]. Au stade chronique, c’est-à-dire environ 6-12 mois après l’AVC lorsque les progrès cliniques ralentissent et se stabilisent, les traitements de réadaptation sont habituellement cessés, principalement par manque de ressources (humaines, financières, matérielles, etc.) [57, 58] et d’évidences sur le ratio coûts-bénéfices d’offrir des soins prolongés [59]. De plus, le manque de connaissances des administrateurs de soins en lien avec le potentiel de récupération au stade chronique, malgré la grande quantité d’évidences à ce sujet, est un facteur important à considérer [47].
Dans l’ensemble, la présente section a permis de détailler les causes et conséquences principales d’un AVC, particulièrement en ce qui concerne les déficiences sensorimotrices et leur pronostic de récupération. Étant l’importance de ces déficiences post-AVC dans les travaux du doctorat, la section suivante (1.3) propose une description détaillée des notions fondamentales reliées au contrôle sensorimoteur. Ces connaissances sont cruciales, car les sections subséquentes (1.4 à 1.7) prennent assise sur ces évidences neuro-anatomiques et physiologiques reliées à la perception sensorielle à l’action motrice.
1.3 Neurophysiologie de la perception sensorielle et du contrôle
moteur
Le contrôle du mouvement volontaire ou contrôle moteur se définit comme l’habileté du SNC à réguler ou diriger les mécanismes essentiels à la production de mouvements fonctionnels et coordonnés, ajustés aux demandes de l’environnement [60]. Pour ce faire, de nombreuses structures et processus cérébraux doivent étroitement collaborer. La présente section présente ces structures et processus et survole l’organisation neuro-anatomique et fonctionnelle reliée au contrôle du mouvement. Il est important de souligner que certaines des notions présentées seront développées plus en profondeur que d’autres, notamment le traitement supraspinal des informations sensorielles ainsi que les structures impliquées dans
la production de mouvements via le système corticospinal, étant donné leur place centrale dans les études de la thèse. En outre, il existe diverses théories du contrôle sensorimoteur, mais la présente thèse se base particulièrement sur la cadre théorique proposé par Shumway-Cook et Woollacott étant donné qu’il reconnait particulièrement l’importante de la perception sensorielle sur le contrôle du mouvement [60].
1.3.1 Vue d’ensemble : continuum perception-cognition-action
Les processus cérébraux impliqués dans le contrôle moteur et détaillés dans les sections suivantes peuvent être définis en trois grandes catégories, les processus perceptuels, les processus cognitifs et les processus moteurs qui s’inscrivent dans une boucle temporelle illustrée dans la Figure 1.1. D’abord, les processus de perception sensorielle sont fondamentaux pour le contrôle moteur : ils permettent un ajustement fin de la commande motrice selon les exigences propres à la tâche et au contexte environnemental [61] et ils fournissent les informations sensorielles nécessaires à l’apprentissage de nouvelles habiletés motrices, par exemple en détectant les conséquences et erreurs réalisées [10]. Au-delà du contrôle et de l’apprentissage moteur, la capacité à percevoir et interpréter les sensations en provenance du corps permet d’interagir avec autrui et avec l’environnement, ce qui influence ainsi l’indépendance fonctionnelle et la participation sociale [10]. Par la suite, la réalisation d’un mouvement repose sur des processus cognitifs de planification et de programmation motrice [60]. La planification motrice concerne l’intention derrière le geste moteur et l’élaboration d’une stratégie en vue de le réaliser. La programmation motrice (ou organisation de la commande motrice dans la Figure 1.1) concerne la détermination précise des paramètres spatio-temporels de la commande motrice, incluant le choix des muscles à activer, leur séquence et durée d’activation ainsi que la vitesse de contraction et la tension musculaire à développer. Finalement, les processus d’exécution de la commande motrice concernent la réalisation de l’acte moteur en soi. De plus, les rétroactions sensorielles pendant le mouvement permettent de vérifier la cohérence du mouvement avec celui planifié et de réajuster la commande au besoin [60]. Dans
mouvement, le SNC questionne d’abord les centres de traitement sensoriel pour baser la planification du mouvement selon l’état du corps dans son environnement, puis il organise avec précision les paramètres du mouvement, l’exécute et vérifie son adéquation par rapport à ce qui était planifié, en le corrigeant au besoin.
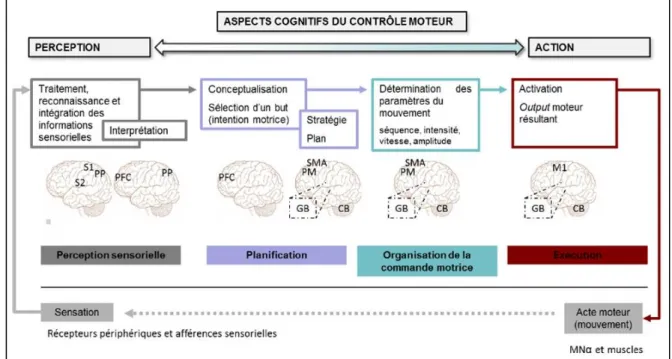
Figure 1.1. Boucle temporelle illustrant les structures et processus cérébraux impliqués dans le contrôle moteur.
La production d’un geste nécessite la contribution des processus de perception sensorielle, de planification et d’organisation motrice, d’exécution et d’analyse du mouvement via les réafférences induites. S1 & S2 = cortex sensoriel primaire & secondaire; PP = cortex pariétal postérieur; PFC = cortex préfrontal; SMA = aire motrice supplémentaire; PM = cortex prémoteur; GB = ganglions de la base; CB = cervelet; M1 = cortex moteur primaire; MNα = motoneurones alpha (Figure adaptée de [62]).
1.3.2 Voies sensorielles et cibles cérébrales principales
La thèse aborde préférentiellement le rôle des afférences somatosensorielles sur la plasticité cérébrale et la récupération sensorimotrice post-AVC. Les récepteurs de ce système, ainsi que les différentes voies transmettant au cerveau les signaux provenant de ces récepteurs, seront donc traités spécifiquement dans les prochaines sections. Les autres systèmes sensoriels (surtout visuel et vestibulaire) ne seront pas développés dans l’introduction de la thèse, bien qu’ils contribuent de manière importante au contrôle du mouvement [60].
1.3.2.1 Récepteurs du système somatosensoriel
Il existe quatre grandes catégories de récepteurs sensoriels au niveau périphérique, soient les récepteurs musculaires, tendineux, articulaires et cutanés. Étant donné que la présente thèse s’intéresse particulièrement à l’importance de la proprioception (sens de la position et du mouvement des membres et du corps) en réadaptation post-AVC, les récepteurs sensoriels contribuant de manière substantielle à la proprioception sont détaillés plus en profondeur.
Les récepteurs articulaires sont présents dans la capsule et les ligaments articulaires. Ils présentent les mêmes caractéristiques morphologiques que plusieurs autres récepteurs sensoriels, notamment des terminaisons ressemblant aux corpuscules de Ruffini et de Pacini (voir récepteurs cutanés plus bas) [60]. Historiquement, les récepteurs articulaires étaient considérés comme étant les afférences principales de la proprioception, contrairement aux évidences contemporaines qui soutiennent clairement l’implication majeure des récepteurs musculaires et cutanés [63-69]. Les experts s’entendent plutôt pour attribuer aux récepteurs articulaires une fonction de protection en présence d’angles articulaires extrêmes [60].
Les récepteurs musculaires sont les fuseaux neuromusculaires (FNM) [60]. Ces FNM sont constitués de petites fibres (fibres intrafusales regroupées dans une conjonctive) situées parallèlement aux fibres musculaires (fibres extrafusales ou musculosquelettiques) : les fibres des FNM sont donc étirées lorsque le muscle s’allonge. Un FNM comporte deux types de terminaisons sensorielles : les terminaisons primaires (dites afférences de type Ia) sont enroulées en spirale sur la partie équatoriale des fibres intrafusales (notamment les fibres à sac nucléaire); les terminaisons secondaires (dites afférences de type II) innervent les fibres intrafusales en para-équatorial [60]. Ces terminaisons sensorielles sont écrasées quand les fibres intrafusales sont étirées et cela provoque des changements de conductance ionique, la génération de potentiels récepteurs puis de potentiels d’action le long des fibres Ia et II qui acheminent ces signaux de la périphérie au SNC via la racine dorsale de la moelle épinière [60]. Par leur différence d’innervation
au sein du FNM, les fibres Ia et II transmettent des informations différentes au SNC. Les terminaisons Ia sont situées de manière optimale pour détecter immédiatement le plus petit étirement du FNM (informations sur l’accélération et la vitesse du mouvement, informations sur la longueur renseignant sur la position instantanée), alors que les terminaisons II sont aussi activées quand le muscle est maintenu dans une position statique (informations sur la longueur informant sur la position instantanée) [63-65, 69]. Les fibres intrafusales sont innervées par des terminaisons motrices de motoneurones gamma (MN) situés dans la corne ventrale de la moelle épinière [60]. Ces MN sont de format somatique et de diamètre axonal plus petits que les motoneurones alpha (MNα) qui innervent les fibres musculosquelettiques (contrôle volontaire du muscle) [60]. Les MN innervent les fibres intrafusales à leur partie polaire, là où elles ont la capacité de se contracter. Donc cette innervation gamma dite fusimotrice permet de raccourcir les parties polaires des fibres intrafusales et ainsi de maintenir tonique la partie équatoriale [60]. Cela permet au FNM de rester extrêmement sensible à tout étirement du muscle même si le muscle est en position raccourcie et donc assure constamment le codage sensoriel des mouvements [60]. L’étirement rapide des FNM active différentes boucles réflexes. Par exemple, le réflexe d’étirement musculaire représente l’activation des MNα par les fibres Ia issues du muscle étiré, provoquant ainsi sa contraction à moins d’influences inhibitrices locales (spinales) ou provenant de diverses structures cérébrales [60, 70] (section 1.3.8). Cet étirement musculaire provoque également l’inhibition des muscles antagonistes via une boucle réflexe d’inhibition [70]. L’importance des afférences musculaires dans la perception sensorielle, le contrôle moteur et les déficiences sensorimotrices post-AVC est abordée et détaillée dans la suite de l’introduction de la thèse. Toutes ces informations issues de l’étirement du FNM sont appelées informations proprioceptives.
Un autre type d’informations proprioceptives existe et ce sont celles issues des récepteurs tendineux. Récepteurs musculaires et récepteurs tendineux sont des mécanorécepteurs déclenchant des messages proprioceptifs acheminés au SNC par leurs fibres respectives. Les récepteurs tendineux sont constitués des organes tendineux de Golgi (OTG) : ce sont des terminaisons nerveuses situées dans
l’aponévrose musculo-tendineuse et dont l’écrasement dû à la contraction musculaire ou à l’étirement musculaire exagéré provoque un changement de conductance ionique et active les fibres Ib qui acheminent l’information au SNC via la corne dorsale de la moelle épinière [60]. Étant donné que chaque OTG innerve une fibre musculaire et que la zone tendineuse est rigide par rapport au muscle, l’OTG est sensible au moindre changement de tension dans le muscle (la plus petite variation de contraction musculaire) et les OTG sont activés par un étirement exagéré du muscle qui étirerait aussi la zone tendineuse [60]. Les OTG auraient différentes implications en contrôle moteur, notamment protéger le muscle en cas de tension excessive via un mécanisme réflexe di-synaptique inhibant la contraction du muscle et excitant son antagoniste ou permettre d’ajuster la contraction en présence de fatigue musculaire [60].
Les récepteurs cutanés comprennent trois sous-types : (i) les mécanorécepteurs (corpuscules de Pacini, de Ruffini et de Meissner, disques de Merkel) détectent les stimuli mécaniques reliés au toucher; (ii) les thermorécepteurs renseignent sur le froid/chaleur ressentis sur la peau; (iii) les nocicepteurs détectent de potentiels dommages à la peau et transmettent des signaux de douleur au SNC [60]. Ces divers récepteurs cutanés peuvent influencer le contrôle moteur de plusieurs façons : activer des réflexes stéréotypés, tel le réflexe de retrait lors d’une stimulation douloureuse, être sensibles à l’étirement de la peau et participer ainsi au codage proprioceptif du mouvement [66-68]. Notamment, les mécanorécepteurs cutanés de la plante du pied codent avec précision le déplacement du poids du corps en position debout, et peuvent contribuer aux ajustements posturaux pour maintenir la stabilité en position debout [71].
1.3.2.2 Voies sensorielles
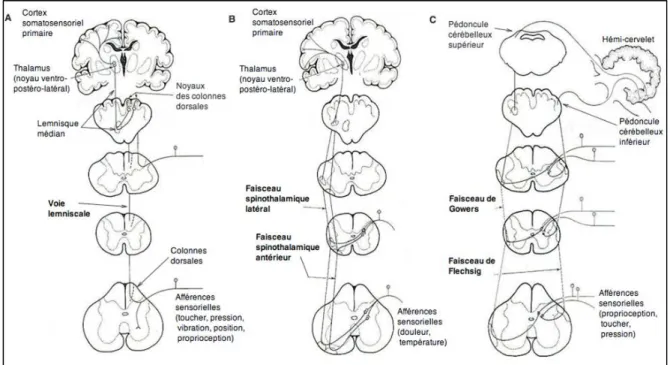
Les récepteurs sensoriels du système somatosensoriel acheminent au SNC les afférences nécessaires à la perception sensorielle via deux principaux systèmes ascendants : les voies lemniscale et extra-lemniscales [60] (Figure 1.2). À noter que les termes « information », « signal », et « message » sont utilisés fréquemment dans les prochaines sections de manière alternative au terme « afférence ». La voie
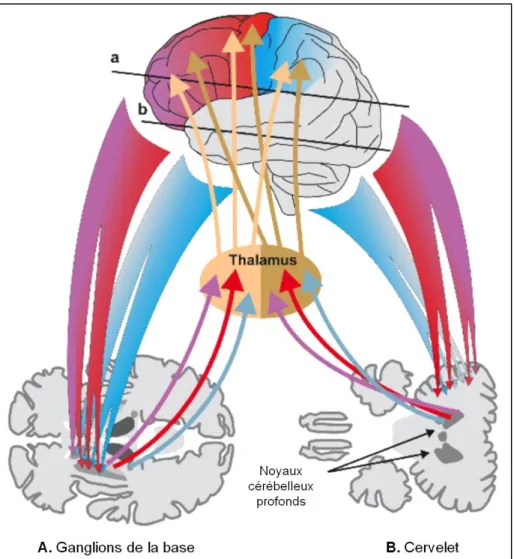
lemniscale (3 neurones, voir Figure 1.2a) véhicule entre autres les messages proprioceptifs issus des mécanorécepteurs et nécessaires à la perception consciente de la position et mouvement du corps et des membres (i.e. proprioception consciente). Les voies extra-lemniscales regroupent la voie spinothalamique (3 neurones, Figure 1.2b) véhiculant les messages de douleur et de température et la voie spinocérébelleuse (2 neurones, Figure 1.2c) dite voie de proprioception « inconsciente ». Plus spécifiquement, la voie spinocérébelleuse est constituée d’une voie postérieure directe (faisceau de Flechsig) et antérieure doublement croisée (faisceau de Gowers) dont l’ensemble achemine les messages proprioceptifs au même hémi-cervelet mais à deux intervalles de temps différents (Figure 1.2c).
Figure 1.2. Voies sensorielles.
Schéma représentant les trois voies ascendantes acheminant les informations sensorielles de la périphérie au système nerveux central, soit la voie lemniscale (A), spinothalamique (B) et spino-cérébelleuse (C) (Figure adaptée de [62]).
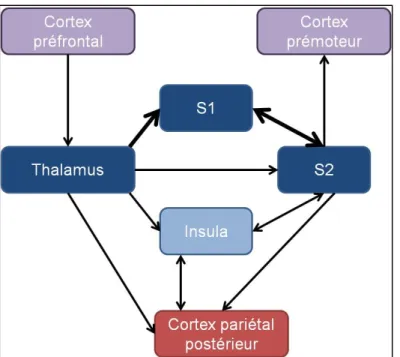
Les voies ascendantes transmettent les messages sensoriels à différences cibles du SNC. Le cortex somatosensoriel est la cible principale des voies lemniscale et spino-thalamique [60]. Plus spécifiquement, il est constitué des cortex somatosensoriels primaire (S1) et secondaire (S2). S1 est situé dans le cortex pariétal antérieur, tout juste en postérieur de la scissure de Rolando [72], et est impliqué dans le traitement des informations somatosensorielles. Il intègre principalement les afférences provenant de l’hémicorps contralatéral en suivant une organisation somatotopique, c’est-à-dire que toutes les parties du corps sont représentées dans S1 selon une cartographie précise (Figure 1.3). S1 est lui-même subdivisé en quatre aires distinctes (aires de Brodmann 1, 2, 3a et 3b) qui intègrent les informations sensorielles de nature différente [10] : les aires 1, 2 et 3b reçoivent des informations provenant des récepteurs cutanés, mais les champs récepteurs sont plus précis dans l’aire 3b [10, 72] et l’aire 2 est également activée pour le codage des informations proprioceptives [73]. L’aire 3a traite spécifiquement des informations proprioceptives [72] et présente une forte connectivité avec le cortex moteur primaire (M1) situé en avant de la scissure de Rolando dans l’aire frontale ascendante [10, 74, 75]. Le cortex somatosensoriel secondaire (S2) est quant à lui situé dans la région de l’opercule pariétal sous S1 [72]. Contrairement à S1, S2 reçoit des projections provenant des deux côté du corps et ne démontre pas la même spécificité modalitaire que les aires 1, 2, 3a et 3b de S1, ni de somatotopie précise [76]. De plus, S2 est fortement connecté avec de nombreuses structures avoisinantes, tels S1, le thalamus, l’insula, le cortex prémoteur et le cortex pariétal postérieur [10]. S2 jouerait un rôle plus complexe d’intégration multimodalitaire, par exemple dans des tâches de discrimination sensorielle, de reconnaissance d’objet, d’apprentissage [10, 72] et en réponse à de nouveaux stimuli sensoriels [77]. Outre S1 et S2, d’autres structures cérébrales jouent un rôle important dans le traitement des informations sensorielles. D’abord, la majorité des informations somatosensorielles passent par le thalamus avant d’être transmises à S1 et S2 [60]. Le thalamus présente une forte connectivité avec les deux hémisphères cérébraux, entre autres via le cortex cingulaire antérieur [10]. En fait, le thalamus fait partie du système inhibiteur préfronto-thalamique impliqué dans le « gating » des informations
sensorielles, c’est-à-dire qu’il permet d’optimiser le traitement de certaines informations aux dépens d’autres, et d’impliquer des processus cognitifs plus complexes, telle l’attention pour faciliter par exemple la détection de stimuli difficiles à ressentir [10, 78]. L’insula a quant à elle un rôle important dans la perception consciente d’une sensation, dans la mémorisation de celle-ci et dans l’apprentissage à long terme [79]. Le cortex pariétal postérieur intègre les informations sensorielles pertinentes pour le contrôle moteur [10], particulièrement les informations somatosensorielles (traitées dans l’aire de Brodmann 5) et visuelles sur le corps et son environnement (traitées dans l’aire de Brodmann 7) nécessaires à la réalisation de tâches visuo-motrices [79]. Le cortex pariétal postérieur a également d’importantes connexions avec le cortex prémoteur, une région fortement impliquée dans la planification/programmation motrice [79] (voir section 1.3.4 et Figure 1.1). Finalement, le cervelet est une autre cible d’importance, particulièrement pour les afférences de la voie spino-cérébelleuse. Chaque hémi-cervelet présente une connectivité avec le réseau somatosensoriel de l’hémisphère contralatéral, ce qui lui confère la capacité d’intervenir dans l’établissement de la commande motrice [60] (voir section 1.3.5). Le cervelet aurait entre autres une implication dans l’anticipation d’évènements sensoriels ainsi que dans la détection d’erreurs lors d’une tâche motrice en fonction des rétroactions proprioceptives produites par le mouvement [10].
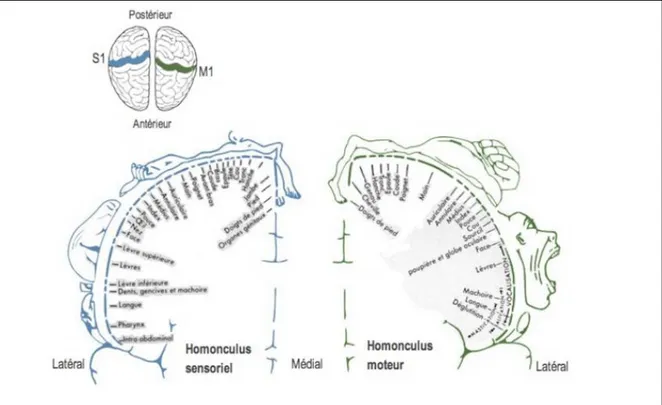
Figure 1.3. Organisation somatotopique (homonculus) des cortex sensoriel et moteur primaires (S1 et M1)
Le cortex sensoriel primaire (à gauche dans la figure) et moteur primaire (à droite) sont organisés de manière somatotopique. Les représentations sensorielles et motrices du visage et des mains sont disproportionnées, étant donné la plus grande quantité de neurones nécessaires au traitement sensoriel et contrôle moteur de ces parties du corps (Figure adaptée de [62]).
1.3.3 Traitement des informations sensorielles
Un modèle récent distingue deux grandes voies de traitement central des afférences sensorielles, soit une voie « ventrale » et une voie « dorsale » [79], chaque voie répondant à un objectif particulier. La voie ventrale achemine les informations sensorielles de S1 vers S2 puis vers l’insula, dans un objectif de perception consciente et de mémorisation d’une sensation [79]. D’un autre côté, la voie dorsale implique la collaboration de S1 et S2 et leurs projections vers le cortex pariétal postérieur dans un objectif de planification/programmation motrice [79]. La Figure 1.4 présente un résumé des structures et leurs interconnexions impliquées dans ces deux grandes voies. Les voies dorsales et ventrales partagent des mécanismes similaires de traitement des informations sensorielles (détaillés ci-dessous) : complexité en fonction de la nature de la tâche, traitement en parallèle et en série