Contribution de la kinase WNK1 à la guérison des plaies cornéennes
Texte intégral
Figure
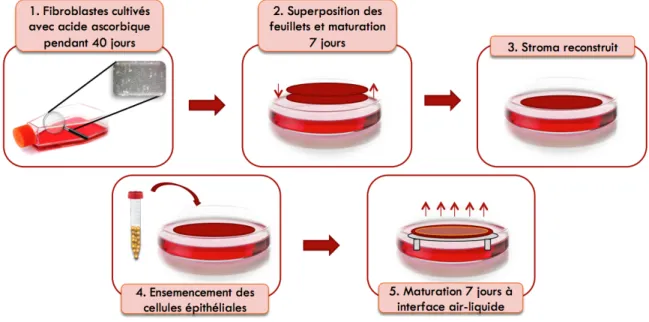
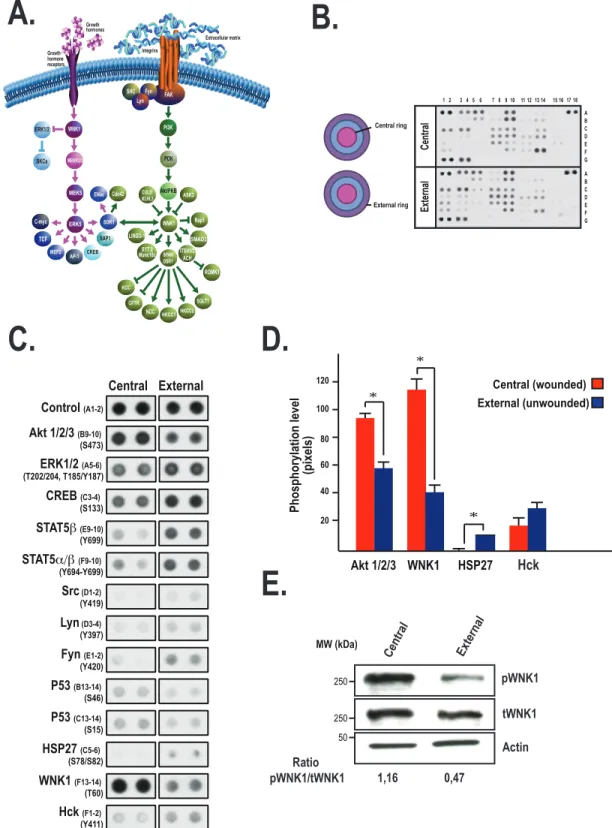
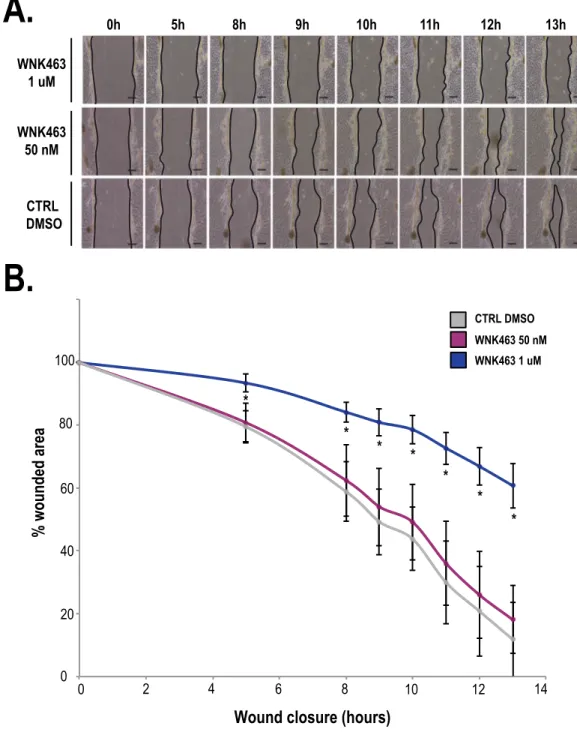
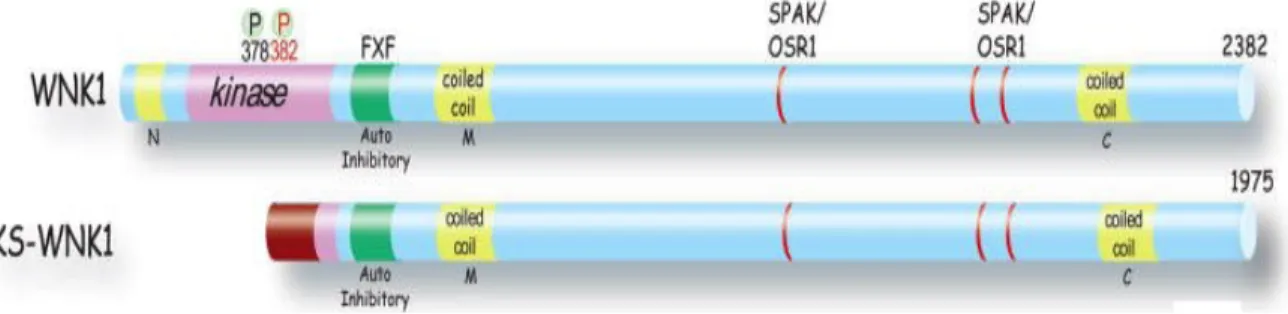
Documents relatifs
La façon dont des strates successives peuvent ainsi se cumuler sans s’annuler peut être illustrée a contrario et avec le même test de négation sur un type d’exemple qui
Nous pouvons donc recenser les segments (tweets) les plus caractéristiques de chaque classe, les termes en gras indiquant les formes caractéristiques de ces classes 10. 9 Ceci
نييصفحلا ةقلاع تناك ومح يبأب لبق نايز ينب ةكلمم يف مكُحلا هيلوت هتاقلاع نع ةفلتخم نويصفحلا ناك ذإ ،نيينيرملاب ،نيينيرملل هئادع يف نوكرتشي
L’accès à ce site Web et l’utilisation de son contenu sont assujettis aux conditions présentées dans le site LISEZ CES CONDITIONS ATTENTIVEMENT AVANT D’UTILISER CE SITE WEB.
[r]
L’analyse du sang (plasma et sérum) et de l’urine sont traditionnellement utilisés pour le diagnostic des plusieurs maladies métaboliques. Ils fournissent des informations
En tout état de cause, l’on peut parfaitement concevoir le recours successif à une personnalité qualifiée dans le cadre de l’enquête puis d’un expert dans
Les mesures de similarité que nous avons utilisées dans nos travaux sont dé- crites dans (Bernstein et al., 2005) : cosinus (formule 1) qui permet de calculer l’angle entre