De la naissance au sevrage : influence des conditions
environnementales et des caractéristiques individuelles chez
le phoque commun (Phoca vitulina) du Saint-Laurent
Mémoire
Joanie Van de Walle
Maîtrise en biologie
Maître ès sciences (M. Sc.)
Québec, Canada
Résumé
Chez les mammifères, la date de naissance et les soins maternels peuvent moduler les chances de survie de la progéniture. Cette étude visait à évaluer l’impact des facteurs environnementaux (e.g. climat, océanographie, disponibilité des ressources alimentaires) et individuels (e.g. sexe de la progéniture) sur la phénologie des naissances, la croissance pré-sevrage et l’apport alimentaire lacté des chiots phoque commun du Saint-Laurent. Une méta-analyse sur 7 cohortes a révélé un impact positif de la température de l’eau à l’hiver sur les dates de mise-bas et une corrélation positive entre le succès d’élevage et l’abondance de hareng. L’étude montre différents patrons d’utilisation de l’espace pour l’allaitement et des soins maternels biaisés en faveur des mâles que nous expliquons par leur dépense énergétique et leur sollicitation supérieures aux femelles. Ce mémoire montre la sensibilité du phoque commun aux changements environnementaux et l’importance des considérations comportementales dans l’établissement du bilan énergétique des chiots allaités.
Abstract
In mammals, birth date and maternal care can affect offspring survival probabilities. This project aimed to assess the impact of environmental (e.g. climate, oceanography and food availability) and individual (e.g. offspring sex) factors on birth phenology, pre-weaning growth and milk intake in the St. Lawrence harbour seal. A meta-analysis on 7 cohorts revealed a positive impact of water temperature during winter on birth dates and a positive correlation between rearing success and herring abundance. This study revealed different patterns of space utilisation for nursing and biased maternal cares towards males that we explain by their greater energy expenditure and solicitation compared to females. This study shows the harbour seal sensitivity to environmental change and the importance of behavioural considerations when assessing the energy budget of pups during lactation.
Avant-propos
Ce mémoire comporte deux articles scientifiques rédigés en anglais ainsi qu’une introduction et une conclusion rédigées en français. Le premier article traitant de l’effet des conditions environnementales et des caractéristiques individuelles sur la saison des naissances et sur la saison de croissance pré-sevrage chez le phoque commun (Chapitre 2) a été soumis au journal Marine Ecology Progress Series et se trouvait en révision lors du dépôt final du présent mémoire. Le second article traitant du comportement d’allaitement chez la même espèce (Chapitre 3), sera probablement soumis au journal Behavioural Ecology suite au dépôt final de ce mémoire. Je suis la principale auteure de ces deux articles. Également, à titre de co-auteurs figurent mon directeur de recherche, le Dr Gwénaël Beauplet, mon co-directeur de recherche, le Dr Mike O. Hammill ainsi qu’un collaborateur externe spécialiste du domaine de recherche dans lequel s’inscrit mon projet, le Dr John P. Y. Arnould. Leur contribution à chacun des deux articles est présentée aux tableaux 1 et 2. Au terme de ce projet de recherche, je serai également co-auteure d’un article méthodologique consacré à la discrimination des principaux types d’ingestion pouvant être détectés chez les chiots du phoque commun en allaitement par la méthode de télémétrie thermique stomacale, méthode utilisée dans le second article (Chapitre 3) de ce mémoire. Mon implication dans la conception et l’élaboration du projet, dans l’acquisition des données, dans l’interprétation des résultats ainsi que dans la révision du manuscrit valide ma contribution à titre de co-auteure.
Tableau 1: Contribution effective des co-auteurs au 1er article scientifique présenté dans ce mémoire.
Joanie
Van de Walle Gwénaël Beauplet Hammill Mike O.
Conception du projet X
Élaboration du projet X X
Financement X
Matériel X X
Acquisition des données X X X
Analyses statistiques X
Interprétation des résultats X X
Rédaction X
Tableau 2: Contribution effective des co-auteurs au 2e article scientifique présenté dans ce mémoire.
Au cours des dernières années, de nombreuses personnes ont été plus qu’utiles à la réalisation de ce projet. En premier lieu, j’aimerais remercier mon directeur de maîtrise qui a su m’accorder une complète confiance et qui affichait toujours une très grande disponibilité pour échanger nos idées sur mon projet. Sa passion pour les mammifères marins est contagieuse et j’ai énormément appris sur ce domaine qui m’était totalement étranger il y a de cela très peu longtemps. Je lui dois ma participation à de nombreux congrès tant nationaux qu’internationaux durant lesquels j’ai eu la chance de présenter mes résultats et de rencontrer des personnes influentes dans le domaine. Grâce à lui, j’ai aussi réussi à garder un bon moral jusqu’à la fin, que ce soit par ses encouragements, ou tout simplement par ses agissements sur le terrain qui nous ont bien fait se marrer!
Je tiens également à remercier mon co-directeur, Mike O. Hammill pour sa confiance et ses interventions pertinentes qui ont contribué à améliorer la qualité de mon travail.
Sur le terrain, j’ai eu la chance de passer 4 étés mémorables en compagnie de personnes formidables. Étant confinés dans un petit espace, une chaloupe ou un zodiac, pendant de longues heures et ayant à vivre sous le même toit pendant des mois, la compétence et l’attitude des coéquipiers est primordiale. À ce chapitre, j’ai été choyée. J’aimerais prendre le temps de remercier tous les membres des sessions de terrain. D’abord, la doyenne, Geneviève Lambert avec qui j’ai eu d’incroyables fous rires et qui était d’une efficacité remarquable. Ensuite, Pierre-Étienne Lessard, qui a été un partenaire digne de
Joanie
Van de Walle Gwénaël Beauplet Hammill Mike O. John P. Y. Arnould
Conception du projet X
Élaboration du projet X X
Financement X
Matériel X X X
Acquisition des données X X X
Analyses statistiques X Interprétation des
résultats X X
Rédaction X
confiance et avec qui j’ai passé d’agréables moments, notamment lors de nos sorties « tite molle a vanile ». Aussi, Solène-Tremblay Gendron, Simon Bélanger et François-Olivier Hébert ont été d’une aide importante sur le terrain. Finalement, j’aimerais remercier Caroline Sauvé pour son aide sur le terrain, mais surtout pour son aide durant les sessions de laboratoire.
De retour sur la terre ferme, les autres membres du LaBeauplet ont aussi apporté leur contribution. J’aimerais dire un immense merci à Katherine Gavrilchuk, pour ses corrections, son appui et son amitié. J’aimerais aussi remercier Rae Couture avec qui les discussions étaient toujours intéressantes, tellement qu’il était difficile de travailler les mercredis quand elle venait au bureau. En dehors de notre équipe, j’aimerais remercier Anne-Sophie Julien pour les consultations statistiques; Marie-Eve Gingras, Marilyne Marois et Yves Morin pour les emprunts de matériel de laboratoire; André Roy pour m’avoir généreusement fourni le matériel nécessaire à la fabrication du lait à 50 % de matières grasses; Yves Dubé, François Gingras, Laure Devine, Pierre Joly et Claude Leblanc pour m’avoir donné l’accès à leurs données; Pierre Carter, Jean-François Gosselin et Samuel Turgeon pour leur aide sur le terrain et à l’Institut Maurice-Lamontagne.
Je tiens aussi à remercier tous les organismes qui ont contribué à ce projet par le support financier ou par l’accès à leurs installations. Je remercie ainsi le Conseil de Recherches en Sciences Naturelles et en Génie (CRSNG), la compagnie Roche, Québec-Océan ainsi que Pêches et Océans Canada.
En débutant ce projet de maîtrise, j’étais loin de me douter de l’ampleur de la tâche à accomplir. Je me souviendrai toujours de paroles qui se voulaient réconfortantes de mon directeur de recherche : « Si je t’ai donné autant de travail, c’est que je savais que tu étais capable et assez motivée pour le faire! ». Je me rappelle donc par la même occasion cette motivation qui m’animait. On ne le dira jamais assez, la dure épreuve que constitue la passation d’une maîtrise demande certaines capacités intellectuelles, mais plus encore, de la passion. Ayant eu la chance de participer à la collecte de données sur le terrain l’été précédant le début de ce projet, j’ai bel et bien développé cette passion si importante pour mon futur projet d’étude. Comment n’aurais-je pu? Le décorum à couper le souffle que constitue le parc du Bic lorsque le jour se lève sur une mer miroitante au-dessus de laquelle
planent des nuées d’eiders, alors que le flanc de quelques rorquals en brise la surface se situe parmi les plus belles visions de ma vie. Donc, la passion était présente au rendez-vous. Par contre, au fil du temps et des épreuves chroniques, je me suis demandé à plusieurs reprises si j’étais réellement «capable et assez motivée pour le faire!» Heureusement, lors de ces épisodes de découragement inhérents au processus de raisonnement, de création et d’apprentissage par embûches, de nombreuses personnes ont su trouver les mots pour me rassurer et me réconforter. Je tiens donc, finalement, à remercier toutes les personnes qui m’ont encouragée et qui ont cru en moi. Je pense à mes amis et à ma famille et, surtout, à la personne avec qui j’ai partagé le plus clair de cette belle aventure, l’homme qui partage aussi ma vie, Rémi St-Arnaud. Un immense merci.
Table des matières
RÉSUMÉ ... III ABSTRACT ... IV AVANT-PROPOS ... V TABLE DES MATIÈRES ... IX LISTE DES FIGURES ... XI LISTE DES TABLEAUX ... XIII LISTE DES FIGURES EN ANNEXE... XIV LISTE DES TABLEAUX EN ANNEXE ... XV
CHAPITRE 1 : INTRODUCTION ... 1 SOINS PARENTAUX ... 1 ALLAITEMENT ... 3 FACTEURS INTRINSÈQUES ... 4 FACTEURS EXTRINSÈQUES ... 6 ÉNERGÉTIQUE DE LA LACTATION ... 7
LE CAS DES PINNIPÈDES ... 9
LE PHOQUE COMMUN ... 11
OBJECTIFS GÉNÉRAUX ET SPÉCIFIQUES ... 13
CHAPITRE 2 ENVIRONMENTALLY INDUCED CHANGES IN THE TIMING OF BIRTH AND THE REARING SUCCESS OF THE ST. LAWRENCE HARBOUR SEAL ... 15
RÉSUMÉ ... 16
ABSTRACT ... 17
INTRODUCTION ... 18
METHODS ... 19
Study site and species ... 19
Growth surveys ... 20
Age determination ... 21
Statistical analysis ... 23
RESULTS ... 24
Pupping season ... 24
Individual and environmental effects ... 27
Pre-weaning season ... 28 DISCUSSION ... 32 Pupping phenology ... 32 Pre-weaning growth ... 34 Unsuccessful rearing ... 35 ACKNOWLEDGEMENTS ... 37
CHAPITRE 3 NURSING PATTERNS AND LACTATION PERFORMANCE REVEALED BY STOMACH TEMPERATURE TELEMETRY IN HARBOUR SEALS (PHOCA VITULINA) ... 39
RÉSUMÉ ... 40
ABSTRACT ... 41
INTRODUCTION ... 42
METHODS ... 44
Study site and species ... 44
Laboratory calibrations ... 46
Data analysis ... 48
Statistical analysis... 49
RESULTS ... 50
Temporal and spatial nursing patterns ... 51
Inter-suckling intervals ... 53 Lactation performance ... 54 DISCUSSION ... 58 Lactation performance ... 63 Weaning process ... 64 ACKNOWLEDGEMENTS ... 65 CHAPITRE 4 : CONCLUSION ... 67 SAISON DE REPRODUCTION ... 67 CROISSANCE PRÉ-SEVRAGE ... 69 COMPORTEMENT D’ALLAITEMENT ... 71
Utilisation de la télémétrie thermique stomacale ... 71
Patrons d’allaitement ... 71
DES SOINS MATERNELS DIFFÉRENTIELS ENTRE LES SEXES? ... 72
UN SEVRAGE GRADUEL OU ABRUPT? ... 73
PERSPECTIVES ... 74
BIBLIOGRAPHIE... 79
Liste des figures
Chapitre 2
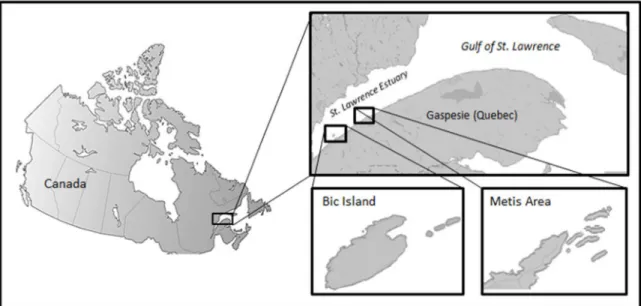
Figure 2.1. Location of the two harbour seal (Phoca vitulina) breeding sites under study in the St. Lawrence Estuary, Canada. Bic Island and Metis are 60 km apart and differ in harbour seal abundance. ... 20 Figure 2.2. Birth distributions of the 2008-2011 harbour seal cohorts in the St. Lawrence Estuary, Canada.
Black bars represent the daily proportion of the total number of pups born while the dotted lines show the cumulative proportion of pups born. ... 26 Figure 2.3. Harbour seal pups median birth date (Julian days) with error bars (95 % CI around the median
birth date) in parallel with the mean Sea Surface Temperature (SST) during the gestation period, the mean integrated Chlorophyll a index (Chla) during the primary production period preceding embryonic implantation and the ice cover (%) during the gestation period. ... 28 Figure 2.4. Mass, standard length, axial girth and BCI (axial girth/standard length) evolution over the
course of harbour seal pups lactation period (n = 143). The first series of 4 graphs (left) show differences between males and females and the second series (right) show differences between cohorts (2008 – 2011). The dotted lines represent the age at which axial girth and BCI started to decrease (age = 25 d). Regression lines for axial girth and BCI were therefore extrapolated from age 0-25 d. Enlarged versions of these graphs, including colony comparisons, are provided in the Appendix (Figure A.3 through Figure A.14). ... 30 Figure 2.5. Percentage of harbour seal pups (females, males and total) that died or did not sustain a
positive growth (deemed unsuccessful rearing) in parallel with the abundance of age 4 spring spawning herring abundance from 1998 to 2011 in the St. Lawrence Estuary, Canada... 32
Chapitre 3
Figure 3.1. A simulated PDER event (900 ml of 50 % fat milk) showing the three extracted points: A) time before PDER event; B) time where the minimum temperature is recorded and; C) time where temperature is recovered (details are provided in the text). In this example, the temperature at point A is equal to the temperature at point C. The polygon between these two points and the baseline (y=0) is thus TC(tC-tA). The dark shaded area represents the area under the curve (AUC). The light shaded area represents the area above the curve (AAC), which is obtained by subtracting the AUC to the polygon area. Steps in temperature profile are due to the STP resolution (±0.1oC). ... 48
Figure 3.2. Relationship between the volume of milk (35 % and 50 % fat milk at 37.1oC) introduced in
the simulated stomach (37.8oC) and the area above the curve (AAC) of the subsequent PDER event
simulated in laboratory. The regression formula was further used to estimate the volume of milk consumed during recorded PDER events deemed suckling in free-ranging harbour seal pups. Estimates of milk consumption were used to make comparisons between individuals and time periods. ... 51 Figure 3.3. Daily suckling pattern of harbour seal pups in the St. Lawrence Estuary, Canada determined
by stomach temperature telemetry. Bars represent the means ± standard errors of the individual proportions of total suckling events occurring at each hour of the day. Dark shaded bars represent
the overall daily pattern, while light shaded bars represent the daily pattern when the days where field sessions occurred were removed to control for manipulation induced behavioral alterations ... 52 Figure 3.4. Harbour seal spatial and temporal nursing patterns revealed by stomach temperature
telemetry. Suckling events deemed aquatic nursing occurred while pups were in the water while suckling events deemed nighttime nursing occurred between 6 pm and 6 am. Shaded bars represent the proportion of total suckling events deemed aquatic and nighttime nursing (mean ± standard errors) for male (dark shaded bars) and female (light shaded bars) pups. Sample sizes figure at the top of each shaded bar. ... 53 Figure 3.5. Mean (± SE) estimates of lactation features over the course of the 5 weeks lactation period in
harbour seal pups (empty squares = females; black squares = males). A) Daily number of suckling events detected by stomach temperature telemetry, B) estimated amount of milk ingested per suckling event and C) estimated total amount of milk ingested per day. ... 56 Figure 3.6. Daily frequency of nursing among harbour seal pups that had the longest stomach temperature
record durations and that were monitored at the end of the lactation period (n = 4). ... 57 Figure 3.7. Differences in estimated amount of milk ingested daily over the course of lactation between
harbour seal pups showing the two extreme nursing preferences (black circles = at-sea, empty circles = on-land). ... 57 Figure 3.8. Relationship between the estimated amount of milk ingested and mass gain (kg) among male
Liste des tableaux
Tableau 1: Contribution effective des co-auteurs au 1er article scientifique présenté dans ce mémoire. ... v
Tableau 2: Contribution effective des co-auteurs au 2e article scientifique présenté dans ce mémoire. ... vi
Chapitre 2
Table 2.1. Main parameters describing the birth seasons of the 1998-2000 (Dubé et al. 2003) and the 2008-2011 harbour seal cohorts in the St. Lawrence Estuary, Canada. The number of pups classified within the two groups: 1) pups that gained mass throughout lactation (successfully reared pups) and 2) pups that died or did not significantly gain mass during lactation (unsuccessfully reared pups) are also presented for each cohort. ... 25 Table 2.2. Model selection for the influence of individual and environmental factors on harbour seal pups
birthdates in the St. Lawrence Estuary, Canada. ... 27 Table 2.3. Estimations (± SE) of harbour seal pups mass, standard length, axial girth and Body Condition
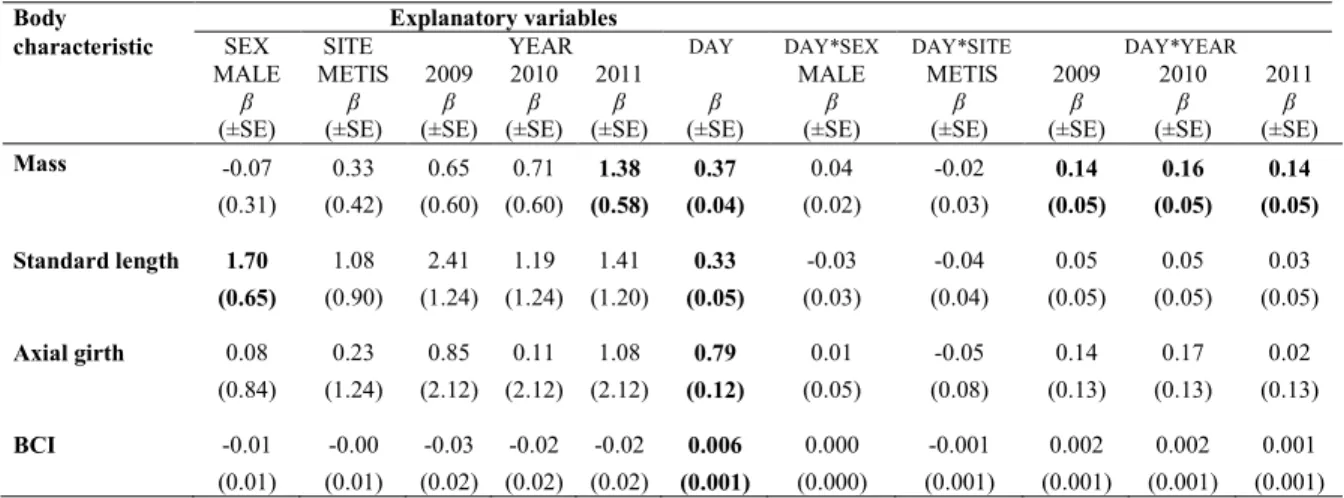
Index (BCI: axial girth/standard length) at different stages throughout lactation using linear mixed effects models (n = 143). No predictions were made after 25 d of age for axial girth and BCI because the relations were no longer linear beyond this point. ... 31 Table 2.4. Linear mixed effects models estimates (β) with the corresponding standard error (± SE) of
explanatory variables (sex, site and year) of harbour seal pups body characteristics during the lactation season. Baseline (intercept) represents Bic females of 2008. ... 31
Chapitre 3
Table 3.1. Results from the best resulting general linear mixed models (GLMM) after applying a stepwise function to the 3 global models assessing the effects of age, sex and their interactions on the number of suckling events per day as well as the estimated amount of milk consumed per suckling event and per day in the harbour seal pups at Bic, Canada. ... 55
Liste des figures en annexe
Figure A.1. Distribution and cumulative proportion of births of the 1998-2000 harbour seal cohorts in the St. Lawrence Estuary, Canada. The points at 0.8 on the graphs represent days that surveys were conducted (Dubé et al. 2003). ... 91 Figure A.2. Absence of correlation between pup birth mass (kg) deviance from cohort average and pup
birth date deviance from cohort median (d)... 92 Figure A.3. Evolution of body mass of female and male harbour seal pups during the rearing seasons of
2008 to 2011 in the St. Lawrence Estuary. ... 93 Figure A.4. Evolution of standard length of female and male harbour seal pups during the rearing seasons
of 2008 to 2011 in the St. Lawrence Estuary. ... 93 Figure A.5. Evolution of axial girth of female and male harbour seal pups during the rearing seasons of
2008 to 2011 in the St. Lawrence Estuary. ... 94 Figure A.6. Evolution of Body Condition Index (BCI = axial girth/standard length) of female and male
harbour seal pups during the rearing seasons of 2008 to 2011 in the St. Lawrence Estuary. ... 94 Figure A.7. Evolution of body mass of harbour seal pups from the two haul-out sites under study (Bic and
Metis) during the rearing seasons of 2008 to 2011 in the St. Lawrence Estuary. ... 95 Figure A.8. Evolution of standard length of harbour seal pups from the two haul-out sites under study
(Bic and Metis) during the rearing seasons of 2008 to 2011 in the St. Lawrence Estuary. ... 95 Figure A.9. Evolution of axial girth of harbour seal pups from the two haul-out sites under study (Bic and
Metis) during the rearing seasons of 2008 to 2011 in the St. Lawrence Estuary. ... 96 Figure A.10. Evolution of Body Condition Index (BCI = axial girth/standard length) of harbour seal pups
from the two haul-out sites under study (Bic and Metis) during the rearing seasons of 2008 to 2011 in the St. Lawrence Estuary. ... 96 Figure A.11. Evolution of body mass of harbour seal pups during the rearing seasons of 2008 to 2011 in
the St. Lawrence Estuary. ... 97 Figure A.12. Evolution of standard length of harbour seal pups during the rearing seasons of 2008 to 2011
in the St. Lawrence Estuary. ... 97 Figure A.13. Evolution of axial girth of harbour seal pups during the rearing seasons of 2008 to 2011 in
the St. Lawrence Estuary. ... 98 Figure A. 14. Evolution of Body Condition Index (BCI = axial girth/standard length) of harbour seal pups
Liste des tableaux en annexe
Table A.1. Individual characteristics of harbour seal pups instrumented with a stomach temperature pill (STP) from the 2010 to 2012 cohorts with their associated STP recordings results. ... 99
CHAPITRE 1 : INTRODUCTION
L’étude des composantes biodémographiques individuelles, aussi connues sous l’expression « traits d’histoire de vie », permet l’approfondissement des connaissances sur la biologie des espèces et nous renseigne sur les mécanismes par lesquels les espèces évoluent et s’adaptent face à un environnement en constant changement (Stearns 1992). La conception classique de la théorie des composantes biodémographiques est basée sur des modèles d’optimisation des coûts et bénéfices (Roff 1992; Stearns 1992). L’évolution des différentes stratégies de reproduction est donc modulée par certains compromis auxquels doivent faire face les organismes ainsi que par les pressions de sélection exercées par l’environnement (Stearns 2000).
Selon la théorie sur les composantes biodémographiques, le fait que l’énergie et le temps soient limités mène à l’existence d’un compromis entre la reproduction actuelle et la reproduction future (Stearns 1992). Plusieurs études témoignent de l’existence et de l’importance de ce compromis au sein des stratégies reproductrices chez différents taxons (Gustafsson & Sutherland 1988; Beauplet et al. 2006; Hamel & Côté 2009). Effectivement, l’allocation énergétique à la reproduction actuelle, bien que bénéfique pour la survie, la croissance et la reproduction future de la progéniture (Clutton-Brock 1991), peut engendrer des coûts pour les parents (Clutton-Brock 1991; Shine & Schwarzkopf 1992). Ces coûts sont une mesure de l’effort parental, c’est-à-dire de la quantité de temps et d’énergie qu’un parent alloue à sa descendance (Clutton-Brock 1991). Lorsqu’importants, ils peuvent affecter plusieurs composantes biodémographiques individuelles, telles que la croissance, la survie et la fécondité future des parents (Roff 1992). Ce faisant, l’effort parental peut se traduire en un investissement parental, c’est-à-dire en des soins apportés à la progéniture actuelle qui augmentent les chances de survie de la progéniture actuelle tout en réduisant l’aptitude des parents à investir dans leur reproduction future (Trivers 1972; Clutton-Brock 1991).
Soins parentaux
L’allocation énergétique à la reproduction actuelle peut se mesurer par l’étude des soins parentaux. Ces derniers représententtous les comportements des parents susceptibles
d’augmenter la valeur sélective (« fitness ») de leurs descendants (Clutton-Brock 1991) et se présentent sous une vaste gamme de patrons au sein du règne animal. Par exemple, les soins parentaux sont inexistants chez la plupart des invertébrés (Davies et al. 2012) alors qu’ils peuvent être multiples et variés au sein d’autres taxons (Clutton-Brock 1991). Il peut s’agir, par exemple, de la préparation d’un refuge (e.g. nid ou terrier), de la défense contre des prédateurs ou, de façon plus subtile, de l’apprentissage (Clutton-Brock 1991).
L’occurrence des soins parentaux ainsi que leur imputabilité parentale entre mâle et femelle varient d’un taxon à l’autre (Davies et al. 2012) en fonction de deux facteurs principaux. Premièrement, les différentes contraintes physiologiques et d’histoire de vie auxquelles doivent faire face les différents taxa peuvent mener à une prédisposition d’un sexe à fournir des soins (Davies et al. 2012). Deuxièmement, en fonction des conditions écologiques et des opportunités d’accouplement, les coûts et bénéfices associés aux soins seront très variables d’un sexe à l’autre (Davies et al. 2012). Chez les espèces polygynes (un mâle pouvant s’accoupler avec plusieurs femelles, Newton 1989), tel que fréquemment observé chez les mammifères, les femelles sont limitées par leur nombre d’ovules alors que les mâles le sont par le nombre de femelles qu’ils peuvent féconder (Clutton-Brock 1991; Møller 1998). Dans un tel système, les mâles fournissent peu ou pas de soins parentaux; leur contribution se limitant habituellement à la copulation (Clutton-Brock 1991) et à la compétition pour les partenaires sexuels (Trivers 1972). De plus, le succès reproducteur des mâles peut être jusqu’à 4 fois plus variable que celui des femelles (Le Boeuf & Reiter 1988). Évolutivement, plus le succès reproducteur varie entre les sexes, plus la sélection sexuelle est forte (Newton 1989). Ainsi, les mâles de grande qualité (disposant de plus de ressources au début de la période d’accouplement; e.g. masse) ont de plus grandes chances de se reproduire que les autres (Møller 1998; Pelletier et al. 2006). Donc, la voie empruntée afin de maximiser la valeur sélective diffère selon le sexe chez la majorité des mammifères; les mâles favorisant généralement leur effort (et leur succès) d’accouplement tandis que dans 95 % des cas, les femelles prodiguent seules les soins nécessaires aux jeunes (Trivers 1972; Clutton-Brock 1991; Davies et al. 2012).
Allaitement
Le soin maternel mammalien le plus caractéristique et le plus énergivore est sans conteste l’approvisionnement en nourriture sous forme de lait (Schulz & Bowen 2005). La lactation correspond à une période très exigeante du cycle vital puisque la femelle doit alimenter son jeune jusqu’à l’indépendance nutritionnelle complète (Gittleman & Thompson 1988; Clutton-Brock 1991). La dépense énergétique qui lui est incombée est alors très importante et peut atteindre, au pic de lactation (période où la production journalière de lait est maximale, Morag et al. 1973), généralement de 2,5 à 5 fois celle des femelles non gestantes (Randolph et al. 1977; Clutton-Brock 1991; Oftedal 2000).
Afin de composer avec cette grande demande énergétique imposée, deux stratégies générales peuvent être adoptées chez les mammifères: la reproduction sur capital (« capital breeding ») et la reproduction sur revenu (« income breeding », Jönsson 1997). Selon Jönsson (1997), la femelle reproductrice sur capital stricte acquiert et accumule les réserves nécessaires à l’élevage des jeunes avant la parturition. Ces réserves sont ensuite utilisées pour prodiguer les soins maternels, dont principalement l’allaitement. De son côté, la femelle reproductrice sur revenu stricte ajuste sa consommation alimentaire en fonction des besoins de la progéniture tout au long de la lactation préservant ainsi ses réserves corporelles (Stearns 1989; Jönsson 1997; Boyd 2000). Cependant, comme présenté dans la synthèse de Stephens et al. (2009), il n’existe pas de séparation nette entre ces deux stratégies; la reproduction sur capital et sur revenu représentent les pôles d’un continuum. Effectivement, il existe plusieurs exemples où l’énergie nécessaire à la production de lait provient de sources endogènes (i.e. réserves corporelles) et exogènes (i.e. alimentaires; Wheatley et al. 2008; Hamel & Côté 2009). Dans une telle situation, les soins maternels pouvant être prodigués seront dépendants à la fois des conditions environnementales pré- et post-partum.
En ce qui concerne la progéniture, sa survie est intimement liée au transfert d’énergie mère-petit, ce dernier se traduisant par la croissance pré-sevrage (Albon et al. 1987; Clutton-Brock 1991; Hall et al. 2001; Chambellant et al. 2003). Effectivement, la survie des nouveau-nés et des juvéniles est un des paramètres démographiques les plus variables, souvent influencé par les conditions corporelles pré-sevrage et/ou au sevrage
(Coulson et al. 1997; Wickens & York 1997; Gaillard et al. 2000). De plus, puisque la masse au sevrage dépend du taux de croissance pendant la lactation (Iverson et al. 1993), le rythme auquel la progéniture accumule des réserves corporelles pendant cette période semble crucial. Chez plusieurs espèces mammaliennes autant terrestres que marines, cette relation positive entre la masse et la survie juvénile a été clairement établie (McMahon et al. 2000; Côté & Festa-Bianchet 2001; Beauplet et al. 2005).
Facteurs intrinsèques
La quantité d’énergie allouée à la reproduction est tributaire de plusieurs facteurs tant intrinsèques qu’extrinsèques. L’importance de considérer l’hétérogénéité individuelle dans l’évaluation des coûts associés à la reproduction a été démontrée chez plusieurs espèces (Festa-Bianchet et al. 1998; Beauplet et al. 2006; Hamel et al. 2009). Ainsi, les femelles peuvent agir sur le phénotype de leur progéniture (e.g. masse à la naissance, taux de croissance pré-sevrage) à travers leur contribution génétique, mais aussi par les effets maternels, c’est-à-dire une contribution maternelle au phénotype de la progéniture indépendante du génotype de la progéniture et de l’environnement (Bernardo 1996). Cette contribution relève des caractéristiques individuelles telles que la condition corporelle (e.g. masse post-partum), l’âge ainsi que la parité (Reiter & Le Boeuf 1991; Bowen et al. 1994; Bowen et al. 2001a; Bowen et al. 2001b; Côté & Festa-Bianchet 2001).
Premièrement, une femelle en bonne condition physique dispose d’une plus grande aptitude à nourrir et à élever des jeunes de sorte que ces derniers seront, au terme de la période de soins, les plus en santé et les plus massifs (Trivers & Willard 1973). En effet, plusieurs études font état de la relation positive entre la masse maternelle et la condition corporelle de la progéniture (i.e. masse à la naissance, croissance pré-sevrage et masse au sevrage, Anderson & Fedak 1987; Bowen et al. 1994).
Deuxièmement, chez les espèces longévives, l’atteinte de la maturité sexuelle ne coïncide pas toujours avec l’arrêt de la croissance (Clutton-Brock 1991). De ce fait, les femelles doivent faire des compromis (« trade-off »; corrélation négative entre deux traits d’histoire de vie, Begon et al. 2006) entre investir dans leur reproduction ou dans leur propre croissance (Reiter & Le Boeuf 1991; Bowen et al. 1994; Hamel & Côté 2009), ce
phénomène étant accentué lorsque les ressources disponibles sont limitantes (Roff 1992). Ainsi, les jeunes femelles doivent partager l’énergie acquise entre maintenance, croissance et reproduction (Stearns 1992) alors que les femelles ayant cessé de croître peuvent allouer une portion plus importante de leurs ressources à la reproduction. Il a ainsi été démontré chez plusieurs espèces que l’effort reproducteur s’accroît avec l’âge (Pianka 1976; Clutton-Brock 1991). Finalement, la parité et donc l’expérience des femelles peut influencer la date de naissance, la masse à la naissance ainsi que la croissance des jeunes (Iverson et al. 1993; Côté & Festa-Bianchet 2001; Hinde 2009). Par exemple, dans le cas du phoque commun à l’Ile-de-Sable, le taux de croissance des chiots des femelles âgées (≥ 11 ans) était de 8,5 % supérieur à celui des jeunes femelles (4 - 6 ans; Bowen et al. 2001a).
En plus des considérations maternelles, il importe de considérer le fait que la progéniture n’agit pas en tant que récipient passif et peut aussi influencer les soins qui lui sont apportés en tant que participants actifs de la relation parent-enfant (Harper 1981; Stamps et al. 1985; Rosen & Renouf 1993). Peuvent alors surgir des conflits d’intérêt où les mères doivent conserver certaines ressources pour leur reproduction future alors que la progéniture actuelle aurait intérêt à s’en accaparer (Trivers 1974; Clutton-Brock 1991). L’obtention de beaucoup de soins entraîne l’augmentation de la valeur sélective de la progéniture (ainsi que de son succès reproducteur futur, donc de la proportion future de ses gènes dans la population), mais peut diminuer par le fait même celle de sa mère (Trivers 1974). Puisque la représentativité génétique dans la population est une mesure de la valeur sélective, la relation parent-enfant est d’autant plus conflictuelle considérant que les participants de la relation partagent 50 % de leurs gènes (Clutton-Brock 1991). Il se pourrait donc qu’en adoptant certains comportements, tels que la sollicitation, la progéniture agisse sur la quantité d’énergie qui lui est allouée et ainsi sur sa propre croissance (Hofer 1981; Clutton-Brock 1991).
De plus, chez les espèces polygynes où l’on retrouve un dimorphisme sexuel et où le succès reproducteur est nettement plus variable chez les mâles que chez les femelles, les mères de grande qualité (e.g. masse corporelle, âge, rang social) devraient biaiser leur allocation d’énergie et de soins en faveur des mâles (Trivers & Willard 1973; Clutton-Brock 1991). Ce phénomène où les soins maternels apportés peuvent effectivement être
plus importants chez les fils que chez les filles a été décrit en milieu naturel chez des espèces polygynes et sexuellement dimorphiques (Clutton-Brock et al. 1981; Trillmich 1986). Par contre, cette hypothèse ne se vérifie que lorsque certaines prémisses sont satisfaites: la condition des jeunes au sevrage doit être corrélée à celle de la mère pendant la lactation, les traits phénotypiques des jeunes au sevrage doivent être maintenus à l’âge adulte et, finalement, de petites différences dans les soins maternels prodigués (menant à de petites différences phénotypiques) doivent avoir une plus grande influence sur le succès reproducteur à vie des mâles que des femelles (Trivers & Willard 1973).
Facteurs extrinsèques
L’environnement dans lequel évoluent les dyades mère-petit peut influencer le transfert d’énergie pendant la lactation (Harper 1981). Ces facteurs environnementaux sont de deux ordres : abiotique (e.g. climat) et biotique (e.g. compétition, Krebs 2001). Sous de hautes latitudes, la saisonnalité marquée de l’environnement entraîne d’importantes contraintes chez les endothermes y vivant. Chez plusieurs espèces dont les grands herbivores, la mise-bas a lieu l’été, soit la saison chaude. Les nouveau-nés disposent ainsi d’une saison climatique favorable où les ressources alimentaires sont abondantes et de grande qualité pour parfaire leurs réserves corporelles avant l’hiver (Bunnell 1982; Rutberg 1984). Le regroupement des mises-bas autour de cette période pourrait contribuer à alléger le fardeau énergétique associé à la production de lait chez les femelles reproductrices (Rutberg 1984; Bronson 1985; Trites & Antonelis 1994; Côté & Festa-Bianchet 2001). Ce faisant, les femelles peuvent maximiser l’allocation énergétique à la croissance des jeunes pendant la lactation, favorisant ainsi leurs chances de survie pré- et post-sevrage (McMahon et al. 2000; Hall et al. 2001; Beauplet et al. 2005). Plusieurs études attestent de cette synchronisation de la saison des naissances en fonction des conditions environnementales chez les ongulés (Guinness et al. 1978; Rutberg 1984; Côté & Festa-Bianchet 2001) et les pinnipèdes (Trites 1992; Dubé et al. 2003; Gibbens & Arnould 2009). Plusieurs indices témoignent donc du lien entre l’environnement dans lequel les individus évoluent et la phénologie des naissances au sein des populations animales. À plus grande échelle, les fluctuations environnementales peuvent altérer le cycle reproducteur et parfois même causer d’importants déphasages temporels au sein du cycle (Lunn & Boyd 1993;
Bowen et al. 2003; Reijnders et al. 2010), spécialement dans un contexte de changements climatiques et de fluctuations dans l’abondance des ressources alimentaires.
Pour les jeunes, que ce soit directement via l’alimentation ou indirectement via la qualité et la quantité du lait produit par la mère, l’abondance et la qualité des ressources alimentaires peut affecter leur masse et leur survie (Doidge et al. 1984; Albon et al. 1987; Baker & Fowler 1992). Par exemple, lors des épisodes d’El Niño où la nourriture est rare, une grande mortalité de chiots de l’otarie de Galapagos (Arctocephalus galapagoensis) et du lion de mer d’Amérique du Sud (Otaria flavescens) a été notée, ce qui est attribuable à l’incapacité des mères de fournir l’énergie nécessaire à la croissance et conséquemment à la survie de leurs chiots (Trillmich 1986; Soto et al. 2004). La quantité d’énergie disponible pour les femelles reproductrices peut aussi être affectée par des effets dépendants de la densité. Ainsi, lorsque la densité d’une population s’accroît, la compétition pour les ressources augmente, limitant leur disponibilité per capita, ce qui peut avoir des répercussions sur la croissance et la survie des individus (Albon et al. 1987; Krebs 2001).
Énergétique de la lactation
La lactation représente la composante la plus énergivore du cycle reproducteur mammalien (Stearns 1992). Par contre, il est très difficile d’évaluer adéquatement le transfert de lait mère-petit en milieu naturel (Cameron 1998). Jusqu’à ce jour, les études en ce sens se basent principalement sur des observations visuelles (Cameron 1998), qui s’avèrent peu fiables puisque la durée des tétées ne constitue pas toujours un indicateur représentatif du volume transféré (Cameron 1998; Therrien et al. 2008). De plus, les observations comportementales directes ne sont pas toujours évidentes, voire possibles à réaliser comme dans le cas du phoque commun où les évènements d’allaitement ont surtout lieu dans l’eau (Venables & Venables 1955; Hedd et al. 1995; Schreer et al. 2010).
D’autres méthodes indirectes basées sur l’utilisation de dilutions isotopiques et d’eau doublement marquée ont été décrites et utilisées afin de déterminer la consommation de lait chez plusieurs espèces de pinnipèdes en lactation (Fedak & Anderson 1982; Costa et al. 1986; Oftedal et al. 1987; Tedman & Green 1987; Lydersen & Hammill 1993; Arnould et al. 1996; Arnould & Hindell 2002). Par contre, ces techniques ne permettent que de
quantifier le volume de lait consommé entre deux échantillonnages en plus d’occasionner un dérangement important (plusieurs heures) chez les animaux étudiés. Ces méthodes étant basées sur les flux hydriques pour évaluer la consommation de lait, leur utilisation nécessite une simplification importante, soit que l’apport d’eau dans l’organisme provient uniquement du lait maternel (Oftedal et al. 1987). Or, il s’avère que plusieurs études attestent de la consommation d’eau libre (mariposia; Bowen et al. 1994) chez des chiots pinnipèdes pendant la lactation, tel que le phoque commun (Hedd et al. 1995; Schreer et al. 2010). Ces méthodes comportent d’importantes limitations, d’où l’intérêt d’innover en matière de techniques indirectes pour décrire le comportement d’allaitement et évaluer adéquatement le transfert énergétique mère-petit.
Il est possible de détecter l’ingestion de matière solide ou liquide en étudiant les patrons de variations temporelles de la température stomacale. Puisque la température de la plupart des proies des endothermes marins est plus faible que celle de ces derniers, une baisse de température stomacale s’observe suite à l’ingestion de proies (Wilson et al. 1992). Wilson et al. (1992) furent les premiers à étudier cette relation chez les oiseaux marins à l’aide de prototypes de capteurs thermiques stomacaux. Depuis, plusieurs chercheurs ont utilisé la télémétrie thermique stomacale pour étudier l’écologie alimentaire chez un bon nombre d’espèces d’oiseaux et de pinnipèdes (Gales & Renouf 1993; Grémillet & Plös 1994; Hedd et al. 1996; Bekkby & BjØrge 1998; Lesage et al. 1999; Austin et al. 2006;
Kuhn & Costa 2006; Horsburgh et al. 2008; Kuhn et al. 2009).
L’amplitude de la diminution de température ainsi que le temps nécessaire au réchauffement de ce qui est ingéré sont assujettis à sa composition chimique et physique. Il en résulte ainsi des courbes de température caractéristiques propres à la consommation d’eau, de poissons et de lait (Hedd et al. 1996; Kuhn & Costa 2006; Schreer et al. 2010; Sauvé et al., en préparation). En effet, lorsqu’une substance riche et solide est ingérée, la température stomacale chute et le mélange gastrique ainsi que la vidange sont relativement lents. En présence d’eau, la température chute plus drastiquement, mais remonte plus rapidement (Wilson & Culik 1991). Hedd et al. (1995) ont examiné ce phénomène chez un chiot phoque commun en captivité: une prise de lait menait invariablement à une baisse de la température stomacale, caractérisée par une faible chute de température et un lent
réchauffement de ce qui est ingéré. L’ingestion de poisson, quant à elle, comprend des caractéristiques intermédiaires entre l’ingestion d’eau et de lait (Sauvé et al., en préparation). L’utilisation de la télémétrie thermique stomacale permet donc de détecter spécifiquement les prises de lait et de caractériser le comportement d’allaitement en milieu naturel. Chez un chiot phoque commun en captivité, Hedd et al. (1995) sont aussi parvenus à estimer des volumes de lait ingérés par tétée à l’aide de calibrations en laboratoire, permettant de faire un pas de plus vers la compréhension du comportement d’allaitement et de l’allocation énergétique à la reproduction chez les mammifères.
Le cas des pinnipèdes
Plusieurs aspects de la biologie des pinnipèdes en font un groupe intéressant pour étudier l’allocation énergétique à la reproduction. Les femelles reproductrices donnent généralement naissance à un seul jeune par année (Bowen 1991). Elles disposent donc d’une unique chance par année d’augmenter leur succès reproducteur. L’étude de l’allocation énergétique à la progéniture, et subséquemment, l’investissement maternel, est donc plus aisée dans un tel système.
Bien que dépendants du milieu marin pour s’alimenter, les Pinnipèdes (excluant les Odobénidés ou morses, Boness & Bowen 1996) ont recours à la terre ferme pour la mise-bas et l’allaitement. Prendre soin des jeunes et s’alimenter représentent donc des évènements séparés spatio-temporellement (Schulz & Bowen 2005). Pour pallier cette contrainte, Phocidés et Otariidés arborent deux stratégies aux antipodes du continuum des stratégies de reproduction maternelles, soient la reproduction sur capital et la reproduction sur revenu. La phylogénie dichotomique du sous-ordre des Pinnipèdes serait principalement basée sur ces deux stratégies reproductrices (Bonner 1984; Boness et al. 1994). Les Phocidés (phoques vrais) jeûnent pendant la courte période d’élevage des chiots (« fasting strategy » d’une durée de 4 à 50 d) alors que les Otariidés (otaries à fourrure et lions de mer) emploient une stratégie d’approvisionnement régulier en mer (« foraging cycle strategy » pendant une période de lactation s’étendant de 4 à 18 mois, Boness et al. 1994; Boness & Bowen 1996; Schulz & Bowen 2005). Les contraintes auxquelles font face les femelles reproductrices sont propres à la stratégie reproductrice déployée. Effectivement, chez les Otariidés, les conditions environnementales prévalant pendant l’allaitement auront
un impact sur la croissance de la progéniture (Ono et al. 1987; Beauplet et al. 2004; Soto et al. 2004; Lea et al. 2006) alors que ce sont principalement les conditions environnementales qui prévalent pendant la période de gestation ou d’accumulation des réserves corporelles qui auront des répercussions sur la quantité d’énergie pouvant être allouée à la progéniture chez les Phocidés (Le Boeuf & Crocker 2005).
Chez les Phocidés, les chiots disposent généralement d’une courte période de soins maternels (entre 4 et 50 d selon les espèces, Bowen 1991). Ils doivent donc accumuler rapidement suffisamment de réserves avant le sevrage pour supporter la période de jeûne post-sevrage où ils doivent apprendre à s’alimenter seuls (Bowen 1991). Le défi est d’autant plus imposant chez les individus de petite taille, pour lesquels plusieurs contraintes physiologiques importantes s’ajoutent. Les petits chiots ont des capacités de tétée moins importantes (Kovacs & Lavigne 1986) et leurs pertes de chaleur sont plus grandes puisqu’ils possèdent moins d’isolation, leur ratio surface/volume étant supérieur (Bowen et al. 1994). La demande énergétique relative qui leur est imposée est ainsi supérieure, retardant leur croissance et leur conférant une masse au sevrage plus faible (Bowen et al. 1994).
Lorsque sevrés, les mêmes défis de thermorégulation (avec la demande énergétique impliquée) se présentent alors à eux pendant la durée du jeûne post-sevrage. Conséquemment, les petits chiots sevrés doivent accroître leur effort de chasse afin de combler leurs besoins métaboliques, d’autant plus que la chasse est généralement moins fructueuse chez les jeunes en apprentissage (Muelbert et al. 2003; Noren et al. 2008). De plus, les chances de survie post-sevrage des jeunes dépendent principalement de deux facteurs intimement liés, soient de la quantité de réserves qu’ils auront accumulée pré-sevrage et de leur efficacité à s’alimenter seuls. Cette période d’apprentissage post-pré-sevrage où les chiots jeûnent est nécessaire au développement des capacités de nage et de plongée. En effet, les chiots des phocidés développent généralement leurs habiletés de chasse uniquement suite au sevrage. Dans le cas du phoque commun, par exemple, les nouveau-nés sont physiologiquement limités par une plus faible capacité de stockage de l’oxygène, mais cette capacité s’accroît rapidement au sevrage (Clark et al. 2007). Cependant, le temps dont ils disposent pour effectuer l’apprentissage de la chasse en solo
dépend de l’ampleur de leurs réserves corporelles. Lors du jeûne, les chiots utilisent principalement leurs réserves lipidiques, mais lorsque celles-ci sont insuffisantes, l’énergie peut être soutirée du catabolisme des protéines (Castellini & Rea 1992). Afin de minimiser les pertes protéiques, les petits chiots ont intérêt à écourter leur période d’apprentissage au maximum (Noren et al. 2008). Ce faisant, les habiletés physiologiques de plongée ne peuvent se développer de façon optimale (Burns 1999; Bowen et al. 2001b; Noren et al. 2005; Noren et al. 2008), occasionnant un impact potentiel sur la survie post-sevrage. Ainsi, les traits phénotypiques, dont la croissance et la masse au sevrage, chez les pinnipèdes ont une importance de taille dans l’évaluation des probabilités de survie juvénile et de la valeur sélective des femelles (Hall et al. 2001; Beauplet et al. 2005).
Le phoque commun
Au sein des Phocidés, le phoque commun (Phoca vitulina) est l’espèce la plus commune et la plus répandue le long des côtes du nord de l’Atlantique et du Pacifique (Thompson et al. 1997; Burns 2009). Cinq sous-espèces sont maintenant reconnues et Phoca vitulina concolor représente la sous-espèce du nord-est de l’Amérique du Nord (Boulva & McLaren 1979; Thompson & Wheeler 2008; Burns 2009).
Tout comme les autres espèces de Phocidés, le phoque commun est itéropare (une seule reproduction par année) et donne naissance à un seul chiot. Une grande proportion des femelles matures est gestante chaque année, pouvant atteindre 85 % dans certaines populations (Burns 2009). En général, les femelles atteignent la maturité sexuelle vers l’âge de 3-4 ans et sont primipares l’année suivante (Boulva & McLaren 1979). Elles continuent cependant de croître vers une masse asymptotique jusqu’à l'âge de 6 ans (Hauksson 2006). Ainsi, il peut exister un conflit entre la croissance et la reproduction chez les jeunes femelles où les coûts reliés à la reproduction semblent plus élevés chez les jeunes femelles comparativement aux femelles qui ont atteint la masse asymptotique (Bowen et al. 2001b). Les mâles, quant à eux, sont matures sexuellement vers l’âge de 5-6 ans (Boulva & McLaren 1979). Ils semblent établir des territoires sous-marins de type lek (Boness et al. 2006), et les comportements sexuels se déroulent habituellement dans l’eau (Boulva & McLaren 1979).
Le phoque commun du Saint-Laurent, contrairement aux autres espèces de Phocidés retrouvés dans les eaux canadiennes, a une période de mise-bas estivale (Boulva & McLaren 1979). Ainsi, dans l’Estuaire du Saint-Laurent, la période des naissances s’étend sur 33 à 42 d, de la mi-mai jusqu’au début juillet avec un pic maximal survenant à la fin mai (Dubé et al. 2003). La période de lactation, quant à elle, dure approximativement 33 d (Dubé et al. 2003). La période d’accouplement se déroule suite au sevrage du jeune de l’année (Burns 2009), mais l’implantation de l’embryon dans la paroi utérine est différée (diapause embryonnaire) de trois mois (Boulva & McLaren 1979; Burns 2009). La gestation active s’étend donc sur 9 mois (Burns 2009) et se situe en majeure partie pendant l’hiver. Le mécanisme de réactivation du blastocyste n’est pas bien connu, mais selon certains auteurs, certaines indications environnementales (e.g. photopériode) pourraient être en cause. La diapause embryonnaire serait alors un stade pouvant présenter une certaine flexibilité (Boyd 1991; Temte 1994).
Bien que polygyne, le phoque commun ne présente pas un dimorphisme sexuel aussi contrasté que celui des autres espèces de Phocidés (Boulva & McLaren 1979). Le phoque commun se distingue aussi des autres espèces de sa famille qui sont majoritairement des reproducteurs sur capital stricts, puisqu’il semble faire usage d’une stratégie reproductrice intermédiaire, voire même similaire à la stratégie de reproduction sur revenu observée chez les Otariidés (Boness et al. 1994; Schulz & Bowen 2005). En effet, puisque les femelles phoques commun ont des réserves corporelles relativement limitées et que leurs dépenses énergétiques sont relativement importantes, elles doivent effectuer de nombreux voyages d’alimentation en mer pendant la lactation pour subvenir aux besoins de leur chiot (Boness et al. 1994). Les chiots, quant à eux, sont des nageurs précoces; leur première entrée dans l’eau se fait généralement durant les premières heures de vie (Lawson & Renouf 1985), et ils accompagneraient leur mère durant la plupart des épisodes d’alimentation en mer (Bowen et al. 1999; Lesage et al. 1999). Ce comportement peut avoir plusieurs conséquences physiologiques pour les chiots allaités. En effet, les activités de nage et de plongée entraînent une dépense énergétique importante pour les chiots occasionnant une augmentation de leurs besoins en énergie (Boyd et al. 1997) et pourraient conséquemment provoquer une diminution de leur croissance pré-sevrage. Par contre, l’augmentation des capacités aérobies associées à la pratique de ces activités
pourrait procurer des avantages nets lors de l’apprentissage de la chasse et donc à l’alimentation en solo post-sevrage, comme suggéré par les résultats de Eisert & Oftedal (2009) dans le cas des chiots du phoque de Weddell (Leptonychotes weddellii).
Dans l’estuaire du St-Laurent, on retrouve les phoques communs en petites colonies isolées (Boulva & McLaren 1979; Lesage et al. 1995), dans les anses, sur les îles et sur les rochers où ils s’échouent dans des endroits peu perturbés et à proximité des eaux profondes (Boulva & McLaren 1979; Lesage et al. 1995; Burns 2009). Considérant son présumé rôle dans la consommation de poissons à vocation commerciale, dans la destruction d’équipement de pêche et dans la transmission de nématodes parasitaires, le phoque commun a été chassé avec primes jusqu’en 1979 dans le St-Laurent (Boulva & McLaren 1979). Depuis l’arrêt de la chasse, l’abondance de la population n’est pas précisément connue, de sorte qu’il est impossible d’établir un statut de conservation à l’heure actuelle. Par contre, n’étant plus soumis à des pressions de chasse depuis 30 ans, il est probable que la densité des populations du St-Laurent ait augmenté et que la compétition pour les ressources alimentaires se soit accrue. Une telle situation pourrait avoir des répercussions sur l’allocation énergétique des femelles à la reproduction (Albon et al. 1987).
Objectifs généraux et spécifiques
L’objectif général de la présente étude était d’approfondir nos connaissances sur la période d’élevage du phoque commun. En ce sens, le chapitre 2 s’intéresse à la saison des naissances et à la croissance pré-sevrage alors que le chapitre 3 s’intéresse au comportement d’allaitement et conséquemment à la consommation alimentaire des chiots allaités.
Objectif spécifique 1
Plusieurs populations de phoque commun ont connu des déplacements récents dans leurs saisons des naissances (Bowen et al. 2003; Reijnders et al. 2010). Cependant les causes demeurent encore aujourd’hui hypothétiques. La caractérisation de la saison des naissances chez le phoque commun du Saint-Laurent par Dubé et al. (2003) de 1998 à 2000 a ouvert la
voie aux suivis à long-terme de la période de reproduction chez cette population. Pour le premier objectif spécifique, il s’agissait donc de : 1) caractériser l’évolution de la phénologie des naissances de 1998-2000 à 2008-2011; et de 2) déterminer les facteurs susceptibles d’entraîner des déplacements dans les périodes de mise-bas du phoque commun du Saint-Laurent. Les facteurs étudiés étaient de deux ordres : environnementaux (e.g. climat, océanographie et disponibilité de la nourriture) et individuels (e.g. sexe de la progéniture).
Objectif spécifique 2
Considérant l’importance du transfert énergétique mère-petit durant la lactation sur les probabilités de survie pré- et post-sevrage de la progéniture, le second objectif visait à caractériser la croissance pré-sevrage des chiots phoques communs du Saint-Laurent en mettant l’emphase sur les différences individuelles, spatiales et temporelles.
Objectif spécifique 3
Finalement, afin d’ajouter une nouvelle dimension à notre compréhension du bilan énergétique des chiots en lactation, le troisième objectif spécifique visait à caractériser le comportement d’allaitement du phoque commun en lactation. Il visait donc plus spécifiquement à : 1) évaluer la fréquence d’allaitement, le transfert volumique de lait par tétée et par jour grâce à l’utilisation de la télémétrie thermique stomacale; et à 2) mettre en évidence de stratégies différentielles dans l’allocation des soins parmi les femelles reproductrices.
CHAPITRE 2
ENVIRONMENTALLY INDUCED CHANGES IN THE
TIMING OF BIRTH AND THE REARING SUCCESS
OF THE ST. LAWRENCE HARBOUR SEAL
Joanie Van de Walle1,2, Mike O. Hammill2,3 & Gwénaël Beauplet1,2
1. Department of Biology, Université Laval, Québec, Canada 2. Québec-Océan, Québec, Canada
Résumé
Chez les mammifères, la quantité d’énergie qu’une femelle peut allouer à la reproduction actuelle dépend des conditions environnementales, telles que le climat et la disponibilité de la nourriture. Considérant l’impact de la croissance pré-sevrage sur la survie de la progéniture, la synchronisation de la saison des naissances avec des conditions environnementales favorables pourrait être bénéfique. Cette étude a examiné le rôle des conditions environnementales sur la phénologie des naissances et sur la croissance pré-sevrage de la progéniture chez le phoque commun du Saint-Laurent (Phoca vitulina). Au cours de 7 saisons de reproduction (1998-2000 et 2008-2011), les dates médianes de parturition s’étendaient du 24 au 30 mai. La saison des naissances était corrélée négativement avec la température de surface de l’eau (SST) durant l’hiver, correspondant à un devancement moyen des dates de naissance de 6 d/oC d’augmentation de la température
de l’eau. Le moment de la parturition pourrait être ajusté afin de minimiser les coûts de thermorégulation chez les nouveau-nés ou être influencé par d’autres facteurs hautement dépendants de la SST, tels que la disponibilité des ressources alimentaires. Globalement, la croissance pré-sevrage (0,51 kg/d, SE = 0.01) était similaire d’une année à l’autre malgré les conditions environnementales fluctuantes, suggérant des coûts fixes pour les femelles reproductrices capables de mener leur chiot jusqu’au sevrage. La réduction récente de l’abondance du hareng de l’Atlantique (Clupea harengus) frayant à proximité des sites de reproduction pendant la période de la lactation était corrélée avec une augmentation de la proportion de chiots qui mouraient ou qui ne parvenaient pas à croître durant la lactation. Nos résultats montrent l’influence du climat pendant la gestation sur les dates de naissance et le fort impact de la disponibilité de la nourriture sur le succès d’élevage des femelles reproductrice phoques commun.
Abstract
In mammals, the amount of energy a female can allocate to current reproduction depends on environmental conditions, such as climate and resource availability. Given the impact of offspring pre-weaning growth on survival, synchronisation of the birth season with favourable environmental conditions may be beneficial. This study investigated the role of environmental conditions on pupping phenology and offspring pre-weaning growth in the St. Lawrence River harbour seal (Phoca vitulina). During 7 breeding seasons (1998-2000 & 2008-2011), median parturition dates ranged from 24-30 May. Pupping season was negatively correlated with winter sea surface temperature (SST), corresponding to an average shift towards earlier dates of pupping of 6 d/oC of SST increase. The timing of pupping may adjust to minimise neonate thermoregulatory costs or may be influenced by other factors highly dependent on SST, such as resource availability. Overall, pre-weaning growth (0.51 kg/d, SE = 0.01) was similar between years despite annual fluctuations in environmental conditions, suggesting fixed costs for reproductive females able to carry their pup until weaning. The recent reduction in the abundance of Atlantic herring (Clupea harengus) spawning close to the breeding sites during the lactation period was correlated with an increase in the proportion of pups that died or failed to grow during lactation. Our results show the importance of climate during gestation for the timing of birth and the great impact of food availability on the rearing success of reproductive harbour seal females.
Introduction
In mammals, lactation is the costliest component of the female reproductive cycle since mothers provide most if not all the energy needed for their young prior to reaching nutritional independence (Gittleman & Thompson 1988, Clutton-Brock 1991). In seasonal environments, females would benefit from synchronising the costly lactation period with the period of maximum resource availability and favourable climatic conditions (Rutberg 1984, Bronson 1985, Temte et al. 1991, Trites & Antonelis 1994). By allowing optimal energy allocation to offspring pre-weaning growth and by ensuring favorable environmental conditions for offspring survival after weaning, synchronicity in parturition dates may represent a strategy to maximise fitness (Ims 1990) as documented in many ungulates (Guinness et al. 1978, Rutberg 1984, Côté & Festa-Bianchet 2001) and pinnipeds (Trites 1992, Dubé et al. 2003, Gibbens & Arnould 2009). Optimal environmental conditions favouring offspring growth and survival are even more crucial in species where females only produce and raise a single offspring per year (e.g. pinniped species; Boness & Bowen 1996), allowing them only one chance, annually, to improve their reproductive success.
Parturition date may have an impact on many offspring traits such as birth mass, growth rate and subsequent survival (Bronson 1985, Clutton-Brock et al. 1987, Boyd 1991, Côté & Festa-Bianchet 2001). Furthermore, the environment in which individuals evolve is subject to important temporal fluctuations that can affect the reproductive cycle (Duck 1990, Gibbens & Arnould 2009) and even cause shifts in birth phenology (Reijnders et al. 2010).
In addition to environmental effects on the reproductive cycle, density dependent factors may also have a significant impact on offspring development and survival. The latter is affected by a reduction in the abundance and the per capita availability of prey as a result of either environmental fluctuations (e.g. El Niño events; Soto et al. 2004) or increased intra- and inter-specific competition (Clutton-Brock et al. 1987, Bowen et al. 2003, Soto et al. 2004).
Among the pinnipeds, the harbour seal (Phoca vitulina) is a small Phocid species (maternal post-partum mass: 84 kg, (Bowen et al. 2003) widely distributed in the northern hemisphere. In Eastern Canada, whelping occurs in May followed by a one month nursing phase in June (lactation stage). Females mate after the weaning of their pup (Boulva & McLaren 1979), then implantation of the embryo is delayed for 2.5 months (embryonic diapause stage from July to September, (Boulva & McLaren 1979, Burns 2009), while active gestation takes place from October to May (gestation stage; (Boulva & McLaren 1979). Most Phocids are capital breeders and use their fat reserves to produce milk during a short lactation (Oftedal et al. 1987, Boness et al. 1994, Boness & Bowen 1996, Schulz & Bowen 2005). However, harbour seal females, because of their small size, cannot store enough energy prior to parturition to support lactation without foraging (Boness & Bowen 1996). Consequently, prevailing environmental conditions prior to parturition as well as during lactation may have a significant impact on harbour seal maternal condition and offspring survival.
In this study, we investigate potential shifts in harbour seal reproductive season and assess the role of climate, resource availability and individual characteristics on the timing of pupping. We hypothesize that the reproductive cycle may be adjusted according to environmental cues, to synchronise births with favorable conditions. We also aim to characterise pup pre-weaning development and to identify the environmental factors influencing its feature. We expect that food availability may strongly impact the rate of energy transfer between mother-pup pairs, especially after parturition given that reproductive females must forage to support lactation costs.
Methods
Study site and species
Harbour seal cohorts were monitored during the 1998-2000 (Dubé et al. 2003) and the 2008-2011 breeding seasons (present study) at two breeding sites in the St. Lawrence Estuary, Canada (Figure 2.1): the Bic Island colony (48o24’N, 68o51’W) is about three
times larger than the Metis colony (48o41’N, 68o01’W). The annual number of harbour seal
births has doubled in these colonies over the last decade (from ≈ 63 births annually in 1998-2000 to >100 births annually in 2008-2011; Dubé et al. 2003 and personal
observations). Seals haul-out mostly on small rocky islets, rocks and reefs exposed at high tide (Lesage et al. 1995, Dubé et al. 2003), but also use permanently-exposed rocky substrate surrounding Bic Island (personal observations). Access to the haul-out sites was only possible by boat.
Growth surveys
From 2008 to 2011, pups were captured, marked and recaptured to monitor their pre-weaning growth at both breeding sites. As soon as possible after parturition, pups were captured from a zodiac boat with a 1 m diameter dip net attached to a 2 m long aluminum pole (Dubé et al. 2003). Once captured, they were sexed and individually marked with a colored and numbered head tag (Seal Hat®, Dalton, England; (Hall et al. 2001) glued to the fur (Loctite #422 cyanoacrylate glue & #7452 Accelerator, Loctite Corp., Mississauga, Canada). The marks remain on the animals until the first moult (late July of the following year, (Boulva & McLaren 1979). A permanent color-coded and numbered tag was also fixed to the hind flipper (Jumbotag®, Dalton, England; (Hall et al. 2001). Upon each capture, pups were weighed to the nearest 0.5 kg (Salter Scale, West Bromwich, England) and axial girth (± 1 cm) and standard body length (from snout to the tip of the tail,
Figure 2.1. Location of the two harbour seal (Phoca vitulina) breeding sites under study in the St.
(McLaren 1993), ± 1 cm) were determined using a flexible measuring tape. Since body mass does not necessarily reflect the quantity of body reserves (Osman et al. 2010), a Body Condition Index (BCI) was also calculated (i.e. axial girth/standard length). All newborn seal manipulations were carried out in less than 5 min to avoid pup abandonment by the mother.
Pups were subsequently recaptured as often as possible until weaning (mean estimated weaning age for harbour seals in the St. Lawrence Estuary = 33 d, SE = 1.8, n = 3, Dubé et al. 2003), but always allowing a minimum of two days between captures. From 2008 to 2011, a total of 388 individuals were captured among which 205 were recaptured between 2 and 7 times. We then classified pups into two groups according to their growth rate. Pups within the first group gained mass throughout lactation and were retained for further analysis on pre-weaning growth. The second group was composed of pups that died or did not gain mass during lactation, hereafter considered as unsuccessfully reared pups. Because they had been abandoned or had not received enough energy to allow for sufficient growth, inclusion of these pups could have biased our pre-weaning growth estimations. Unsuccessfully reared pups from 2008 to 2011 were combined with those from 1998 to 2000 and retained in a separate analysis investigating temporal variations and the impact of environmental conditions on the rearing success.
Age determination
Since pups were rarely caught at birth because of the restricted reef access, two indirect methods were used to determine age: 1) umbilicus degeneration and 2) a back-calculation. After birth, the umbilicus degenerates throughout a sequence of stages reflecting the pup’s age (day 1 = long, red, moist with possible traces of blood; day 2 = long and fresh without blood; day 3 = medium length and white; day 4 = small and dry; day 5 and more = umbilicus loss; (Boulva & McLaren 1979, Cottrell et al. 2002, Dubé et al. 2003). The birthdate of individuals first captured without umbilicus (5 d and older) and weighed at least twice during the breeding season was determined with a back-calculation. This calculation was made according to the following equation modified from (Dubé et al. 2003):
[1] Birthdate = Date of capture – [(Mcpup – BMcohort)/GRpup]
where Mc is the pup’s mass at first capture (kg), BM is the pup cohort’s mean birth mass (kg) and GRpup is the pup’s individual growth rate (kg/d). To validate the use of the
back-calculation, we compared the estimated birthdates from both methods for a total of 91 pups that still had an umbilicus at first capture and that were recaptured at least once throughout the nursing period. No significant difference was found between the two methods (paired t-test, t90 = 0.27, P = 0.79), so the resulting birth dates were considered in an equivalent
manner. By combining the two methods, we were able to estimate the birth date for 64 % of the pups captured from 2008 to 2011.
To investigate temporal variations and environmental impact on pupping phenology, further analyses included data on the 1998-2000 breeding seasons (Dubé et al. 2003). We examined the impact of four climatic and biological indexes through the year prior to parturition: 1) North Atlantic Oscillation (NAO), a fluctuation in the difference of atmospheric pressure between the subtropic high-pressure zone over the Azores and the low-pressure zone over Iceland (Ottersen et al. 2001), 2) Sea Surface Temperature (SST), 3) Ice cover (% of area covered by ice during winter) and 4) Chlorophyll a index. Because of the strong fluctuations of environmental factors due to seasonality and the possible period-specific impact of some environmental factors on the reproductive cycle (Boyd 1991, Renfree & Shaw 2000, Rödel et al. 2005), we separated the NAO index and the SST into three groups according to the three main annual reproductive events of harbour seal females (lactation: L, embryonic diapause: D and true gestation: G).
The mean NAO index was derived from the archives of the National Weather of the National Oceanic and Atmospheric Administration (NOAA; http://www.cpc.ncep. noaa.gov/products/precip/CWlink/daily_ao_index/history/history.shtml). Sea surface temperature was obtained by the satellite imagery system (remote sensing) of the Department of Fisheries and Oceans Canada (DFO) through the St. Lawrence Global Observatory (SLGO; http://ogsl.ca/en/remotesensing/data.html). We determined the annual ice cover by taking the mean percentage of water surface covered by ice in the St. Lawrence Estuary and Gulf from December through May (i.e. harbour seal gestation period). Ice cover data were obtained from the archives of the Canadian Ice Service of