Caractérisation de la farnésyl diphosphate synthase et
de la géranylgéranyl diphosphate synthase chez les
Lépidoptères: cibles potentielles pour la lutte
bio-rationnelle contre les ravageurs
Thèse
Aline Barbar
Doctorat en Biochimie
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Aline Barbar, 2014
iii
Résumé
La présente thèse porte sur la caractérisation de deux prényltransférases chez les Lépidoptères, la farnésyl diphosphate synthase (deux paralogues, FPPS-1 et FPPS-2) et la géranylgéranyl diphosphate synthase (GGPPS). Cette caractérisation s’inscrit dans le cadre de l’identification de leurs caractéristiques spécifiques chez les Lépidoptères en vue de leur utilisation comme cibles dans la lutte bio-rationnelle contre les ravageurs. Dans la présente étude, nous clarifions l'implication de chaque paralogue de FPPS dans la biosynthèse de l’hormone juvénile (JH), se basant sur l'évaluation de leur distribution tissulaire et de leurs propriétés cinétiques. Les quantifications transcriptionnelles et par immunodétection de ces paralogues dans différents tissus ont indiqué que l'expression de la FPPS-1 est ubiquitaire mais principalement détectée dans les tubules de Malpighi, alors que l’expression de la FPPS-2 est confinée aux corps allates (CA). Les analyses cinétiques de la FPPS-2 tronquée en N-terminal révèlent quelques caractéristiques uniques aux Lépidoptères. Toutefois, la forme tronquée de la FPPS-1 s’est avérée inactive. Tous ces résultats suggèrent que la FPPS-2 est la FPPS de Lépidoptères impliquée dans la biosynthèse de JH dans les CA de larves et d'adultes, alors que des analyses transcriptionnelles préliminaires suggèrent que la FPPS-1 pourrait jouer un rôle important dans la prénylation de protéines. D’autre part, la caractérisation biochimique de la GGPPS chez un Lépidoptère, indique son appartenance aux GGPPS de type III, comme les GGPPS humaine et bovine. De façon inattendue, les analyses cinétiques sur la GGPPS et son modèle moléculaire révèlent des modes de liaison alternatifs pour son substrat allylique et son produit, induisant l’inhibition de l'enzyme. L’inhibition par son substrat est particulière à la GGPPS du Lépidoptère, présumément en raison de distinctions structurales décelées par modélisation moléculaire. Les analyses transcriptionnelles de cette GGPPS suggèrent son implication dans la prénylation des protéines. Globalement, nos observations mettent en évidence les caractéristiques uniques de ces enzymes chez les Lépidoptères et suggèrent la possibilité de les utiliser comme cibles pour le développement éventuel de pesticides inhibiteurs qui inactiveraient la biosynthèse de JH et la prénylation des protéines, perturbant ainsi le développement, la métamorphose et la reproduction des Lépidoptères ravageurs.
v
Abstract
The present thesis focuses on the characterization of two lepidopteran prenyltransferases, namely farnesyl diphosphate synthase (FPPS), for which there are two paralogs, FPPS-1 and FPPS2, and geranylgeranyl diphosphate synthase (GGPPS). The main goal of this research was to identify features that are unique to the lepidopteran enzymes so as to assess their suitability as targets for bio-rational pest control. In this study, we clarified the implication of each FPPS paralog in juvenile hormone (JH) biosynthesis, based on the evaluation of their tissue distribution and kinetic properties. Transcriptional quantification and immunodetection analyses confirmed the ubiquitous expression of FPPS-1 and its high titres in Malpighian tubules, while FPPS-2 expression was confined to the corpora allata (CA). Kinetic analysis of an N-terminally truncated form of FPPS-2 revealed certain unique features to the Lepidoptera. However, a similarly truncated form of FPPS-1 was inactive in vitro. Altogether, these results suggest that FPPS-2 is the lepidopteran FPPS paralog involved in JH biosynthesis in the CA at all stages of development, while preliminary transcriptional analysis suggests that FPPS-1 could play a role in protein prenylation. Characterization of a lepidopteran GGPPS indicated that it belongs to the type III group of GGPPSs, as do the human and bovine GGPPSs. Kinetic analysis of this GGPPS and its molecular modeling pointed to alternative binding modes for its allylic substrate and product, both of which can induce enzyme inhibition. Substrate inhibition appears unique to the lepidopteran GGPPS, possibly due to structural differences that were revealed by homology modeling. Globally, the findings reported herein highlight the unique features of these enzymes in the Lepidoptera and suggest the possibility of using them as targets for the development of insecticidal inhibitors that could block JH biosynthesis and protein prenylation, thereby disrupting development, metamorphosis and reproduction in lepidopteran pests.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des figures ... xi
Liste des tableaux ... xiii
Liste des figures supplémentaires ... xv
Liste des tableaux supplémentaires ... xvii
Liste des abréviations ... xix
Remerciements ... xxi
Avant-Propos ... xxiii
Chapitre 1 - Introduction ... 1
1.1 Méthodes de lutte contre les insectes ravageurs ... 1
1.2 Lutte bio-rationnelle : méthodes d’identification des cibles ... 3
1.3 Hormone juvénile (JH) : cible potentielle de la lutte bio-rationnelle ... 4
1.3.1 Nature chimique de l’hormone juvénile ... 4
1.3.2 Voie de biosynthèse de la JH III ... 7
1.3.2.1 Voie du mévalonate : de l’acétyl-CoA au farnésyl diphosphate ... 7
1.3.2.2 Voie spécifique à la biosynthèse de la JH : du FPP à la JH ... 8
1.3.3 Voie de biosynthèse des homologues de la JH chez les Lépidoptères ... 10
1.3.4 Fonctions et fluctuations des niveaux de JH ... 11
1.3.5 JH, cible de la lutte contre les insectes ravageurs ... 13
1.3.6 Les cibles enzymatiques les plus prometteuses chez les Lépidoptères ... 15
1.4 La farnésyl diphosphate synthase (FPPS) : généralités et fonctions ... 18
1.4.1 Généralités sur la FPPS ... 18
1.4.2 Mécanisme catalytique de la FPPS des eucaryotes ... 18
1.4.3 Voies métaboliques dans lesquelles la FPPS est impliquée ... 19
1.4.3.1 Synthèse du cholestérol et des phytostérols ... 20
1.4.3.2 Synthèse de l’hormone juvénile chez les insectes ... 20
1.4.3.3 Synthèse de sesquiterpènes et de sesquiterpénoïdes ... 20
1.4.3.4 Synthèse des ubiquinones ... 22
1.4.3.5 Synthèse du dolichol ... 23
1.4.3.6 Prénylation des protéines ... 23
1.4.4 Un gène de FPPS chez la plupart des organismes ; deux paralogues chez les Lépidoptères ... 23
1.5 Caractérisation des FPPS ... 26
1.5.1 Caractéristiques structurales des FPPS "conventionnelles" ... 26
1.5.1.1 Localisation subcellulaire des FPPS "conventionnelles" ... 26
1.5.1.2 Structure tridimensionnelle ... 27
1.5.1.3 Interactions des substrats avec les résidus de la cavité catalytique ... 28
1.5.1.3 Régulation de l’élongation des chaines de produits... 30
1.5.2 Caractéristiques structurales des FPPS de Lépidoptères ... 32
viii
1.5.2.2 Structure tertiaire et rôle initialement présumé des multiples substitutions observées
chez les FPPS-1 de Lépidoptères ... 35
1.5.3 Implication de la FPPS-1 et de la FPPS-2 dans la biosynthèse de JH III et de ses homologues ... 38
1.5.3.1 Investigations sur l’activité catalytique des FPPS de Lépidoptères ... 38
1.5.3.2 Distribution tissulaire des FPPS de Lépidoptères ... 39
1.5.3.3 Propriétés catalytiques des protéines recombinantes de la FPPS-1 et de la FPPS-2; association hétéromérique in vitro entre FPPS-1 et FPPS-2 ? ... 40
1.6 Des FPPS bifonctionnelles moins "conventionnelles" ... 42
1.7 La prénylation des protéines ... 43
1.7.1 Les protéines prénylées ... 43
1.7.2 Les protéine-prényltransférases ... 44
1.7.3 Mécanisme typique de prénylation des protéines ... 45
1.7.4 Métabolisme des terpènes FPP et GGPP... 46
1.8 La géranylgéranyl diphosphate synthase (GGPPS) ... 47
1.8.1 Généralités sur la GGPPS ... 47
1.8.2 Classification des GGPPSs ... 47
1.8.3 Caractérisation structurale des GGPPS ... 48
1.8.4 Inhibition de la GGPPS par son produit ... 51
1.8.5 La GGPPS chez les insectes ... 51
1.9 Questions abordées dans la présente thèse ... 52
Chapitre 2 - Lepidopteran farnesyl diphosphate synthases: implication in juvenile hormone biosynthesis and other metabolic pathways ... 55
2.1 Résumé ... 56
2.2 Abstract ... 57
2.3 Introduction ... 58
2.4 Material and methods ... 62
2.4.1 Biological material ... 62
2.4.2 Cloning of PuFPPS-1 and PuFPPS-2 cDNAs... 62
2.4.3 Quantitative real-time PCR (qPCR) ... 63
2.4.4 Immunodetection of PuFPPS-1 and PuFPPS-2 in P. unipuncta tissues ... 65
2.4.4.1 Polyclonal antibody production ... 65
2.4.4.2 Tissue dissection and homogenization ... 67
2.4.4.3 Antibody depletion from rabbit serum and Western blot analysis ... 68
2.4.5 Cloning, expression and purification of the truncated forms of PuFPPS-1 and PuFPPS-2 ... 68
2.4.6 Catalytic activity of rPuFPPS-2(Δ46) ... 69
2.4.7 Assessment of inter-FPPS synergistic effects ... 70
2.5 Results ... 71
2.5.1 Tissue-specific expression of FPPS-1 and FPPS-2 ... 71
2.5.2 Cloning, expression and evaluation of the enzymatic activity of wild-type and truncated forms of PuFPPS-1 and PuFPPS-2 ... 73
2.5.3 Kinetic analysis of rPuFPPS-2(Δ46) ... 74
2.5.4 rPuFPPS-1 kinetic characterization ... 75
2.5.5 Assessment of the role played by FPPS-1 in larval Malpighian tubules ... 76
2.5.6 Tissue-specific transcription of protein farnesyl-transferase (PFTase) and protein geranylgeranyl-transferase I and II (PGGTase-1 and PGGTase-2) ... 77
ix
2.5.7 Tissue-specific transcription of CfIPPI ... 77
2.6 Discussion ... 78 2.7 Conclusions ... 85 2.8 Acknowledgements ... 86 2.9 References ... 87 2.10 Tableaux ... 94 2.11 Figures ... 100 2.12 Supplemental material ... 113
Chapitre 3 - Cloning, expression and characterization of an insect geranylgeranyl diphosphate synthase from Choristoneura fumiferana ... 119
3.1 Résumé ... 120
3.2 Abstract ... 121
3.3 Introduction ... 122
3.4 Material and methods ... 125
3.4.1 Cloning and sequencing of a C. fumiferana GGPPS cDNA ... 125
3.4.2 CfGGPPS expression and purification ... 126
3.4.3 CfGGPPS kinetic properties ... 126
3.4.4 Identification of rCfGGPPS product by HPLC/LSC analysis ... 129
3.4.5 Computational modeling of CfGGPPS ... 129
3.4.6 Total RNA extraction and CfGGPPS transcript quantification by qPCR ... 130
3.4.7 Partial sequence determination of β subunits of C. fumiferana protein farnesyl-transferase and protein geranylgeranyl-farnesyl-transferases, and qPCR transcriptional analysis .. 131
3.5 Results and Discussion ... 132
3.5.1 CfGGPPS primary sequence features ... 132
3.5.2 Functional expression, optimal assay conditions and product formation ... 133
3.5.3 Kinetic properties of CfGGPPS ... 134
3.5.4 Analysis of substrate inhibition mechanism ... 136
3.5.5 Inhibition of CfGGPPS by its product ... 137
3.5.6 Structural analysis of ligand binding to the CfGGPPS active site ... 138
3.5.7 CfGGPPS transcriptional profile in whole insects ... 140
3.5.8 Transcriptional profile of the β subunits of the enzymes CfPFTase, CfPGGTase-1 and CfPGGTase-2 in whole insects ... 141
3.6 Conclusions ... 142 3.7 Acknowledgements ... 143 3.8 References ... 144 3.9 Tableaux ... 152 3.10 Figures ... 155 3.11 Supplemental material ... 171
Chapitre 4 - Discussion, conclusion et perspectives ... 181
4.1 La prényltransférase FPPS chez les Lépidoptères ... 181
4.2 La prényltransférase GGPPS chez les Lépidoptères ... 187
4.3 Conclusion et perspectives ... 190
Bibliographie ... 193
xi
Liste des figures
Figure 1. Structure des huit formes de JH connues chez les insectes ... 6 Figure 2. Représentation schématique de la voie de biosynthèse de la JH ... 9 Figure 3. Représentation des étapes de catalyse séquentielle de la FPPS des Lépidoptères 11 Figure 4. Fluctuations des niveaux de la JH et de l’écdysone, sécrétées durant le 5ième et le 6ième (dernier) stade larvaire, et le stade pupal avant l’émergence, chez un Lépidoptère .. 12 Figure 5. Illustration du mécanisme chimique de la réaction de condensation « head-to-tail » entre les substrats IPP et DMAPP ... 19 Figure 6. Représentation schématique de la voie de synthèse du GGPP à partir du FPP ... 21 Figure 7. Schéma représentatif de la condensation d'unités d'IPP avec le FPP pour produire les chaines terpéniques des ubiquinones Q-9 et Q-10 ... 22 Figure 8. Représentation en ruban de la structure tridimensionnelle d’un monomère de la FPPS du poulet (PDB : 1UBX). ... 28 Figure 9. Structure d'une sous-unité du mutant de la FPPS du poulet (F112A/F113S) ... 29 Figure 10. Représentation stéréo de la conformation des interactions entre les résidus de la cavité catalytique de la FPPS d’E. coli avec les substrats IPP et DMAPP ... 30 Figure 11. Représentation en ruban d'une portion du dimère du mutant F112A/F113S-FPPS de poulet. ... 32 Figure 12. Alignement ClustalW des séquences en acides aminés de trois FPPS de Lépidoptères, la FPPS-1 et la FPPS-2 de C. fumiferana, et la FPPS-1 de P. unipuncta, avec celle de la FPPS de drosophile (AAD27853) ... 34 Figure 13. Vue stéréo d’une portion de la cavité catalytique de la FPPS-1 du Lépidoptère P. unipuncta (modèle conçu par homologie, en haut) et de la FPPS du poulet (PDB: 1UBX, en bas). ... 37 Figure 14. Analyse par PCR quantitative en temps réel de l’abondance des transcrits de la FPPS-1 et de la FPPS-2 dans différents tissus de larves et d’adulte de Bombyx mori ... 40 Figure 15. Évaluation de l'activité catalytique de la FPPS-1, de la FPPS-2 et de leur combinaison in vitro ... 41 Figure 16. Illustration de la réaction de prénylation ... 46 Figure 17. Alignement de prényltransférases d'archaea, de bactéries, et d'eucaryotes. Séquences de GGPPS: humaine (GGPS_Homo), de souris (GGPS_Mus), bovine (GGPS_Bos), de la drosphile (GGPS_Dm), de Arabidopsis thaliana (GGPS_AraTh), du Saccharomyce cerevisiae (GGPS_Scer), de bactérie (GGPS_Ttherm), d'archaea (GGPS_Ph). Séquences de FPPS: humaine (FPPS_Homo). La structure secondaire de la GGPPS humaine est représentée en cylindres rouges en-dessous de l'alignement, et une hélice alpha additionnelle correspondant à la structure secondaire de la FPPS humaine est representée par un cylindre gris. Les motifs conservés I-V sont limités par des boites rouges. Les régions A-C impliquées dans l'organisation hexmérique de la GGPPS humaine sont indiquées en boites bleues. Les résidus aromatiques de la FPPS humaine en position -4 et -5 par rapport au FARM sont indiqués par des asterisks au-dessus de l'alignement (D'après Kavanagh et al., 2006). ... 50 Figure 18. PuFPPS-1 transcript abundance, as assessed by qPCR ... 100 Figure 19. qPCR assessment of FPPS-1 and FPPS-2 transcript abundance in corpora allata of P. unipuncta. ... 101 Figure 20. FPPS-1 and FPPS-2 transcript levels, as assessed by qPCR, in whole C. fumiferana individuals during different developmental stages ... 102
xii
Figure 21. Western blot immunodetection of FPPS-1 in various P. unipuncta tissues ... 103
Figure 22. Western blot immunodetection of FPPS-2 in various P. unipuncta tissues ... 104
Figure 23. ClustalW alignment of the N-terminal end of lepidopteran FPPSs ... 105
Figure 24. Assessment of metal requirements (Mg2+ and Mn2+) for rPuFPPS-2(Δ46) activity. ... 107
Figure 25. HPLC-LSC analysis of the percentage of GPP/homo-GPP and FPP/homo-FPP formed by rPuFPPS-2-Δ46 (500ng) ... 108
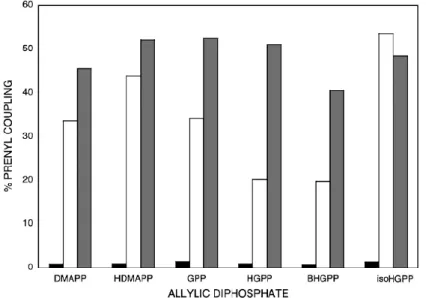
Figure 26. Effect of adding different amounts of 2(∆46) (5-100 ng) to PuFPPS-1(∆76) (500 ng) on prenyl coupling. ... 109
Figure 27. Tissue-specific distribution of transcripts encoding the genes FPPS-1, PFGGTase α, GGPPS, and PPPS ... 110
Figure 28. Tissue-specific distribution of transcripts encoding the genes PFGGTase α, PFTase β, PGGTase-1β and PGGTase-2β. ... 111
Figure 30. Alignment of eukaryotic FPPSs and GGPPSs ... 156
Figure 31. SDS-PAGE protein fractionation during the r-His-CfGGPPS purification ... 157
Figure 32. Effect of divalent metal (MgCl2 and MnCl2) concentration ... 158
Figure 33. Steady-state kinetics obtained for rCfGGPPS ... 159
Figure 34. Steady-state kinetics obtained for rCfGGPPS ... 160
Figure 35. Characterization of the Bi-Bi mechanism for CfGGPPS ... 161
Figure 36. Inhibition of CfGGPPS by its product, GGPP ... 162
Figure 37. GGPP inhibition mechanism with respect to the allylic substrate FPP at a fixed IPP concentration of 4 µM ... 163
Figure 38. GGPP inhibition mechanism with respect to the homo-allylic substrate IPP at a fixed FPP concentration of 10 µM. ... 164
Figure 39. Homology model of CfGGPPS showing potential binding modes of GGPP and FPP ... 165
Figure 40. Active site analysis of HsFPPS (A), ScGGPPS (B), and CfGGPPS (C) obtained using the site finder application of MOE ... 166
Figure 41. FARM analysis of CfGGPPS, with FPP bound in its substrate orientation .... 168
Figure 42. qPCR assessment of the abundance of CfGGPPS and CfFPPS-1 transcripts in whole insects at different developmental stages ... 169
Figure 43. qPCR assessment of the abundance of CfPGGTase-1 β, CfPGGTase-2 β and CfPFTase β transcripts in whole insects at different developmental stages ... 170
xiii
Liste des tableaux
Tableau 1. Primer pairs used for quantitative transcript assessment by qPCR ... 94 Tableau 2. Assay conditions employed for the assessment of kinetic constants for rHis-PuFPPS-2(Δ46) with respect to the substrates IPP, GPP, DMAPP and HDMAPP ... 95 Tableau 3. Prenyl coupling activity of the recombinant wild-type and truncated forms of PuFPPS-1 and PuFPPS-2 ... 96 Tableau 4. Effects of adding Triton X-100, BSA and glycerol to the standard assay buffer ... 97 Tableau 5. Apparent kinetics for rPuFPPS-2-Δ46. ... 98 Tableau 6. HPLC-LSC product quantification for PuFPPS-2-Δ46 (30 ng), either alone or in combination with PuFPPS-1-Δ76 (500 ng) ... 99 Tableau 7. Activity optimization of the purified recombinant CfGGPPS. ... 152 Tableau 8. Product identification of CfGGPPS by HPLC/LSC analysis. ... 153 Tableau 9. Apparent kinetics (Km, Vmax and Ki) for CfGGPPS and different substrates. .... 154
xv
Liste des figures supplémentaires
Figure S1. DNA sequences encoding PPPS and PFGGTase α in C. fumiferana ... 113 Figure S2. Amino acid sequences for the truncated forms of PuFPPS-1 and PuFPPS-2. .. 115 Figure S3. Assessment of qPCR primer specificity for CfGGPPS, CfFPPS-1, CfPFTase β, CfPGGTase-1 β and CfPGGTase-2 β. ... 177 Figure S4. Ligand interaction diagrams for CfGGPPS with ligand bound in FPP-FPP orientation (FPP ligand; A) and FPP-GGPP orientation (GGPP ligand; B). ... 179 Figure S5. Amino acid sequences of CfPFTase β (408 a.a.; 45.36 kDa), CfPGGTase-1 β (349 a.a.; 39.09 kDa) and CfPGGTase-2 β (319 a.a; 35.81 kDa) ... 180
xvii
Liste des tableaux supplémentaires
Tableau S1. Absolute levels of P. unipuncta FPPS-1 and FPPS-2 transcripts ... 116 Tableau S2. Absolute levels of transcripts encoding the enzymes CfFPPS-1, CfFPPS-2 .. 117 Tableau S3. Primers used for the construction of a C. fumiferana Malpighian tubules cDNA library and for cloning of a CfGGPPS cDNA ... 171 Tableau S4. Assay conditions employed for the assessment of Km and Vmax values for CfGGPPS with respect to the substrates IPP, DMAPP, HDMAPP, GPP and FPP ... 172 Tableau S5. Primer pairs used for qPCR transcript quantification of the following C. fumiferana enzymes ... 173 Tableau S6. Hydrophobic contacts for FPP and GGPP tails docked in FPP and FPP-GGPP orientations, respectively. ... 174 Tableau S7. Absolute levels of transcripts encoding the enzymes CfGGPPS, CfFPPS-1, CfPFTase β, CfPGGTase-1β, CfPGGTase-2β ... 175
xix
Liste des abréviations
4-methyl-JHI: méthyl (2E,6E)-10R,11S-(oxiranyl)-7-éthyl-3,4-11-diméthyl-2,6-tridécadienoate, forme homologue de JH à deux branches éthyliques et une méthylique chez les Lépidoptères
A. aegypti: Aedes aegypti ABA: acide abscissique
Acétyl-CoA: Acétyl coenzyme A A. ipsilon: Agrotis ipsilon
A. thaliana: Arabidopsis thaliana
BCAA transaminase: "branched-chain amino acid transaminase" B. mori: Bombyx mori
B. staerothermophilis: Bacillus staerothermophilis C2: deuxième Carbone
C3: troisième Carbone
C3-C4: liaison entre le troisième et le quatrième Carbone
C5, C6, C10,C12, C15, C17, C20… Cn: nombre de carbone dans la chaine aliphatique CA: corps allates
Caax: motif de prénylation, C: cystéine, a: acide aminé alyphatique, x: un acide aminé CC: motif de prénylation, riche en cystéine
C. fumiferana: Choristoneura fumiferana cGMP: guanosine monophosphate cyclique C-O: lien Carbon-Oxygène
CxC: motif de prénylation, C: cystéine, x: un acide aminé D. melanogaster: Drosophila melanogaster
DDxxD: motif conservé dans les prényltransférases riche en aspartate; x: un acide aminé DMSPP: Dimethylallyl S-thiolodiphosphate
EGFP: "Enhanced green gluorescent protein" (protéine fluorescente verte) E. coli: Escherichia coli
FARM: "first aspartate rich motif" (premier motif riche en aspartate) FPP: farnesyl diphosphate
FPPS: farnesyl diphosphate synthase GGPP: géranylgéranyl diphosphate
GGPPS: géranylgéranyl diphosphate synthase GPP: géranyl diphosphate
GPPS: géranyl diphosphate synthase H. cecropia: Hyalophora cecropia
HDMAPP: homo dimethyl allyl diphosphate HIPP: homo isopentenyl diphosphate
HMG-CoA: 3-hydroxy-3-methylglutaryl-coenzyme A I. pini: Ips pini
xx
IPP: isopentenyl diphosphate
IPPI: isopentenyl diphosphate isomerase JH : "juvenile hormone" (hormone juvenile)
JH0 : méthyl (2E,6E)-10R,11S-(oxiranyl)-3,7-diéthyl-11-méthyl-2,6-tridécadienoate, homologue de JH à trois branches éthyliques chez les Lépidoptères
JHI: méthyl (2E,6E)-10R,11S-(oxiranyl)-7-éthyl-3,11-diméthyl-2,6-tridecadiénoate, homologue de JH à deux branches éthyliques chez les Lépidoptères
JHII: méthyl (2E,6E)-10R,11S-(oxiranyl)-3,7,11-triméthyl-2,6-tridécadienoate, forme homologue de JH à une branche éthylique chez les Lépidoptères
JHIII: méthyl (2E,6E)-10R-(oxiranyl)-3,7,11-triméthyl-2,6-dodécadienoate, forme d'hormone juvénile commune à la plupart des insectes
JHB3 : méthyl (2E,6E)-6S,7S,10R-(dioxiranyl)-3,7,11-triméthyl-2-dodécaenoate, forme bisépoxyde de la JH III chez les Diptères
JHSB3 : méthyl (2R,3S)-3-[(E)-6-[(2R)-3,3-diméthyloxiran-2-yl]-4-méthyl-hex-3-enyl]-3-méthyl-oxirane-2-carboxylate, forme bisépoxyde de la JH III chez les Hétéroptères
M. percicae: Myzus percicae
MT: "Malpighian tubules" (tubules de Malpighi) M. sexta: Manduca sexta
NADPH:Nicotinamide adénine dinucléotide phosphate
NDxxE: premier motif riche en aspartate dans les FPPS de type I des Lépidoptères; N: asparagine, E: acide glutamique, x: un acide aminé
PDE: phosphodiestérase
PFTase: protéine farnésyl-transférase
PGGTase: protéine géranylgéranyl-transférase Propionyl-CoA: propionyl coenzyme A
P. unipuncta: Pseudaletia unipuncta (= Mythimna unipuncta)
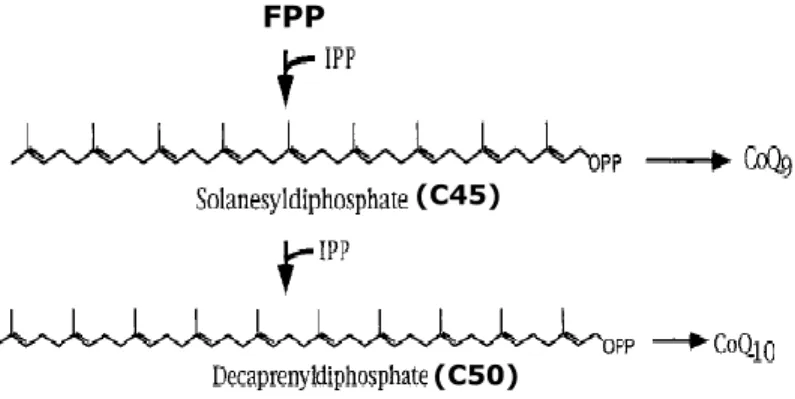
Q-8, Q-9, Q-10… Qn: Q désigne la quinone et n désigne le nombre d'unités IPP dans sa chaine aliphatique
Rab: sous-famille de la superfamille des protéines Ras, spécifiquement une hydrolase de la guanosine triphosphate
Rac: sous-famille des protéines Rho Ras: oncoprotéine ("Rat sarcoma")
Rho: sous-famille de la superfamille des protéines Ras, spécifiquement une hydrolase de la guanosine triphosphate
RxK: motif conservé en C-terminal des farnésyl diphosphate synthase; R: arginine, K: lysine, x: acide aminé
RxxS: motif de clivage à la mitochondrie; R: arginine, S: sérine, x: un acide aminé S. cerevisiae: Saccharomyces cerevisiae
SARM: "second aspartate rich motif" (second motif riche en aspartate) T. cruzi: Trypanosoma cruzi.
xxi
Remerciements
Une thèse est loin d'être le résultat d'un travail solitaire. Je n'aurais jamais pu réaliser ce travail sans le soutien, la générosité et l'intérêt d'un grand nombre de personnes.
À ce titre, je remercie en premier lieu mon directeur de recherche, le Dr. Michel Cusson, pour la confiance qu'il m'a accordée en m'accueillant dans son laboratoire, sa grande disponibilité, ses conseils avisés et son enthousiasme communicatif. J'aimerais également lui dire à quel point j’ai apprécié sa patience à suivre la rédaction de ma thèse, soulevant un nombre de questions dont la pertinence m'a amené à améliorer et approfondir mes compétences en rédaction.
Je tiens à remercier le Dr. Manon Couture, qui a cru en mes capacités. Je la remercie pour l’aide qu’elle m’a fournie dans l’apprentissage de la discipline de l'enzymologie et pour sa contribution à l'accomplissement d'une grande partie de ma thèse.
Un grand merci à madame Catherine Béliveau, biologiste dans le laboratoire de Dr. Michel Cusson, pour son aide et ses conseils précieux.
Je remercie le Dr. Christopher Keeling pour avoir accepté le rôle d'examinateur externe. Je tiens à exprimer ma reconnaissance au Dr. Stephanie Sen pour l'intérêt qu'elle a manifesté dans mes travaux ainsi que pour son invitation et les échanges que j'ai eu avec elle et qui m'ont permis d'approfondir mon sujet de thèse. Je la remercie également pour sa contribution au travail de modélisation de l'enzyme géranylgéranyl diphosphate synthase. Je remercie aussi mon co-directeur, le Dr. Michel Guertin, et le Dr. Patrick Lague, membre de mon comité aviseur, pour leurs qualités scientifiques et humaines, leur suivi attentif et le soutien qu'ils m'ont toujours témoigné. Qu'ils trouvent ici l'expression de ma profonde gratitude. Merci au Dr. Louise Brisson, directrice des cycles supérieurs du Département de biochimie, de microbiologie et de bio-informatique, pour son support moral et son aide à surmonter les difficultés rencontrées au cours de mon cheminement.
xxii
Je remercie aussi les organismes subventionnaires qui m'ont permis de réussir mes études, plus particulièrement le CRSNG et le Service canadien des forêts.
C’est durant ces années d'études que j'ai compris que c'est par l’intermédiaire de nos amis que Dieu prend soin de nous. C'est pour cette raison que je remercie du fond du coeur tous mes amis qui m'ont réconforté dans les périodes difficiles et qui m'ont entouré de leur sympathique compréhension. Plus spécifiquement, je tiens à remercier Patate pour son grand cœur, sa patience et la confiance qu'il a témoignée à l’égard de mes capacités. J'aimerais aussi remercier ma douce sœur et mon adorable frère pour leur soutien constant. Il m’est impossible de trouver les mots pour dire à quel point je suis fière d’eux et à quel point je les aime.
Finalement, j'aimerais dédier cette thèse à mes parents qui ont sacrifié leur vie pour privilégier mon éducation. J'aimerais exprimer ma profonde reconnaissance à l'aide considérable, morale ou matérielle, lointaine ou récente qu'ils m'ont apportée jusqu'à l'achèvement de ce travail. Qu'ils soient remerciés pour leur don inestimable d'amour.
xxiii
Avant-Propos
Chapitre 2 - Lepidopteran farnesyl diphosphate synthases: implication in juvenile hormone biosynthesis and other metabolic pathways
Contributions des auteurs
Aline Barbar: réalisation des expériences d'expression et de purification des protéines recombinantes, essais et analyses par q-PCR, élaboration et exécution du protocole de purifcation de la FPPS-2 insoluble, purification des anticorps et essais d'immunodétection, clonage dans les vecteurs pET28a(+) expression et purification des formes tronquées des protéines, dissection des insectes et collecte des tissus pour analyses, tous les essais enzymatiques, et identifcation des produits par HPLC/LSC. Rédaction de l'article.
Catherine Béliveau et Audrey Nisole: séquençage et clonage les ADNc codant pour toutes les enzymes dans les vecteurs d'expression pET28a(+).
Manon Couture: aide logistique dans le calcul des constantes apparentes.
Stéphanie Sen: évaluation critique de différents éléments du travail; synthèse du HDMAPP. Michel Cusson: supervision des travaux et aide à la rédaction du manuscrit.
Article en préparation pour publication dans: Insect Biochemistry and Molecular Biology
Chapitre 3 - Cloning, expression and characterization of an insect geranylgeranyl diphosphate synthase from Choristoneura fumiferana
xxiv
Aline Barbar: réalisation des expériences d'expression et de purification de la protéine recombinante, dissection des insectes et collecte pour analyses, essais et analyses par q-PCR, essais enzymatiques et tests de compétitions entre substrats et tests de compétition par le produit, et identifcation des produits par HPLC/LSC. Rédaction de l'article sous sa forme publiée sauf la partie concernant la modélisation moléculaire de la GGPPS.
Manon Couture: Supervision des analyses concernant l'inhibition par le substrat et le produit; aide logistique pour générer les graphiques des analyses cinétiques sur Kaleidagraph, et le calcul des constantes apparentes.
Catherine Béliveau, Audrey Nisole, et Marie Bipfubusa: séquençage et clonage des ADNc codant pour la GGPPS dans le vecteur d'expression pET28a(+).
Stéphanie Sen: modélisation de la GGPPS par homologie et estimation de la taille de la cavité catalytique et des essais d'arrimage des substrats et produits.
Michel Cusson: supervision générale des travaux et participation à la rédaction du manuscrit.
xxv
1
Chapitre 1 - Introduction
1.1 Méthodes de lutte contre les insectes ravageurs
Au fil de l’histoire, des dégâts considérables et mémorables ont été causés par des insectes ravageurs de l’agriculture, comme les infestations des cultures de pomme de terre causées par le doryphore, Leptinotarsa decemlineata, qui ont marqué l’esprit en Europe à la fin de la première guerre mondiale. Les ravageurs forestiers peuvent, eux aussi, causer des dégâts considérables. Ainsi au Canada, les pertes annuelles attribuables aux insectes défoliateurs, comme la tordeuse des bourgeons de l’épinette, ont été évaluées à des milliards de dollars (SOPFIM, 2011).
Plusieurs moyens de lutte contre les insectes ravageurs ont été développés et exploités, à commencer par les pratiques culturales et le recours aux barrières physiques. Cependant ces méthodes nécessitent souvent des ressources importantes en termes de main d’œuvre et d’outillage. Pour cette raison, les pesticides de synthèse sont maintenant les outils de lutte les plus répandus. Aujourd’hui, plus de 2 millions de tonnes métriques de pesticides sont pulvérisés annuellement dans le monde, entraînant la contamination de denrées alimentaires et de l’environnement, et dans certains cas, nuisant à la santé humaine (Hill, 1984). Malgré les améliorations apportées aux différents produits chimiques, les problèmes inhérents à leur utilisation n’ont pas diminué pour autant.
Pour ces raisons, on préfère de plus en plus avoir recours à la lutte biologique, laquelle consiste en l’utilisation d’organismes naturels antagonistes aux ravageurs, tels que des parasitoïdes, des prédateurs et des agents pathogènes (bactéries, virus, champignons, etc...). Au Canada, dans le cadre de la lutte biologique contre la tordeuse des bourgeons de l’épinette, Choristoneura fumiferana, l’utilisation de l’insecticide bactérien B.t. (Bacillus thuringensis) est considérée comme assez efficace et présentant peu ou pas de risques pour l’environnement et la santé humaine. Toutefois, cette méthode de lutte compte quelques inconvénients, des coûts élevés de production et une persistance relativement limitée parce que le B.t. est sensible à la dégradation par les rayons UV (Ressources naturelles Québec, 2013).
2
Il peut donc s’avérer nécessaire d’avoir recours à divers approches et produits antiparasitaires dans le cadre d’une lutte dite intégrée (IPM : integrated pest management). La lutte intégrée consiste en l’utilisation des techniques de lutte biologique à spécificité améliorée, combinée à l’utilisation de quantités réduites de produits chimiques pour limiter leur impact négatif sur l’environnement et la santé humaine. Cette approche permet aussi d’utiliser des moyens de lutte plus sophistiqués tels les lâchers de mâles stériles. Par exemple, au Moyen-Orient, en 1997, des mouches mâles stériles ont été introduites en nature dans le cadre d’une lutte intégrée contre la mouche méditerranéenne des fruits. Cette méthode a permis de réduire considérablement les infestations et l’utilisation d’insecticides chimiques. Cependant, elle demeure hautement complexe sur le plan logistique, car elle requiert une intense gestion et son efficacité est de courte durée (FAO, 2005).
Depuis quelques années, un nouveau groupe de produits antiparasitaires offre un compromis intéressant entre efficacité et innocuité environnementale, et entre les insecticides biologiques et les insecticides chimiques conventionnels : il s’agit des insecticides "bio-rationnels". Le principe actif de ces insecticides vise à perturber la fonction d’une molécule, tel une enzyme ou un récepteur d’hormones, spécifique aux insectes ou à un groupe restreint d’insectes. Il s’en suit une perturbation du processus physiologique contrôlé par cette molécule ciblée. Ces produits ont généralement peu ou pas d’effets sur les organismes non ciblés, dont l’humain. Ils sont classifiés en deux groupes distincts : biochimique et microbien. Les produits biochimiques sont des molécules synthétiques et incluent des inhibiteurs d’enzymes et des analogues d’hormones et de phéromones. Quand aux produits microbiens, ce sont des molécules qui dérivent d’organismes biologiques tels que les bactéries, les virus, les champignons et les protozoaires (Rosell et al., 2008).
3
1.2 Lutte bio-rationnelle : méthodes d’identification des cibles
Bien que certains insecticides bio-rationnels aient été découverts par criblage aléatoire de banques de molécules (ex. les insecticides à base de diacylhydrazines, (Wheelock et al., 2006), on privilégie maintenant une conception basée sur la caractérisation poussée des molécules ciblées, comme c’est le cas pour le développement de nouveaux médicaments par l’industrie pharmaceutique. D’où l’augmentation de l’intérêt des chercheurs pour la caractérisation génétique et biochimique des voies métaboliques des insectes afin d’identifier de nouvelles cibles. Dans le cadre du décryptage génétique, on a de plus en plus recours au séquençage de génomes entiers, permettant l’identification de presque tous les gènes d’un organisme donné. Jusqu’à présent, plusieurs séquences de génome entier d’insectes ont été rapportées (ex. Drosophila, Tribolium, Bombyx, ...) (Cusson, 2008). Cependant, une fois la séquence des gènes connue, le plus grand défi réside dans l’évaluation de leur rôle biologique, chez l’insecte. Il faut aussi juger si tel ou tel gène représente une cible intéressante pour le développement d’insecticides bio-rationnels. Dans ce contexte deux approches peuvent être exploitées.
D’une part, l’approche basée sur la technologie du criblage à haut débit par ARN-interférence [high-throughput screening (HTS) by RNAi] connaît un succès grandissant depuis quelques années. Cette approche expérimentale s’avère être efficace dans l’identification de la fonction de nouveaux gènes. Cette méthode consiste en l’introduction d’ARN double brin dans une culture cellulaire ou un organisme entier pour suivre subséquemment l’effet du silençage de l’expression de chaque gène sur divers processus biologiques. Les gènes dont le silençage entraîne des perturbations physiologiques critiques sont prioritairement choisis comme cibles pour le développement d’insecticides bio-rationnels (Armknecht et al., 2005).
4
D’autre part, l’approche basée sur des connaissances préalables est préconisée par plusieurs groupes de recherche. Cette approche consiste à choisir des cibles pour lesquelles des données sont déjà disponibles et pour lesquelles on est en mesure de soupçonner qu’une perturbation entraînera des conséquences physiologiques graves. D’ailleurs, il en est ainsi par exemple, des enzymes de la voie de biosynthèse de l'hormone juvénile et de la prénylation des protéines chez les insectes, lesquelles constituent le sujet de la présente thèse. Des études antérieures ont proposé que l'inhibition des enzymes impliquées dans ces deux voies métaboliques pourrait avoir des conséquences physiologiques nuisant à la survie des insectes (Cusson et Palli, 2000; Day et al., 2006, 2008). Ci-dessous, j'introduis les voies de la biosynthèse de l'hormone juvénile et de la prénylation des protéines chez les insectes, ainsi que deux isoprényl diphosphate synthases impliquées dans ces voies métaboliques et constituant des cibles potentielles pour le développement d’insecticides bio-rationnels.
1.3 Hormone juvénile (JH) : cible potentielle de la lutte bio-rationnelle
1.3.1 Nature chimique de l’hormone juvénile
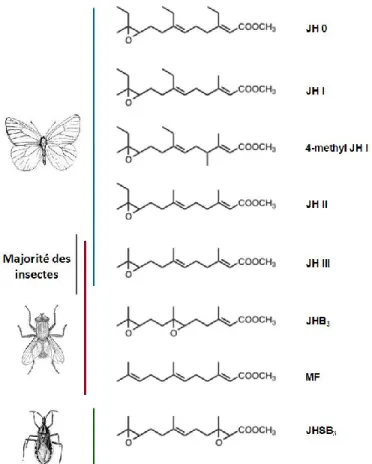
Les JH sont des sesquiterpénoïdes acycliques synthétisés et libérés dans l’hémolymphe par de minuscules glandes endocrines connues sous le nom de corps allates (CA), situées postérieurement au cerveau des insectes. Ce sont des dérivés méthyl esters de l’acide époxy-farnésoïque, lequel dérive du farnésyl diphosphate (FPP). Plusieurs formes de JH ont été identifiées et chimiquement caractérisées à partir de tissus d’insectes et d’hémolymphe (Figure 1).
La caractérisation de la première hormone juvénile, la JH I ou C18-JH [méthyl (2E,6E)-10R,11S-(oxiranyl)-7-éthyl-3,11-diméthyl-2,6-tridecadiénoate], chez le Lépidoptère (i.e. chenilles et papillons) Hyalophora cecropia (Röller et al. 1967), a intrigué les biochimistes puisqu’elle constituait le premier produit naturel possédant un squelette de bishomosesquiterpénoïde, c'est-à-dire avec deux branches éthyliques.
5
L’identification subséquente par Meyer et al. (1968), chez la chenille de H. cecropia, de la JH II ou C17-JH [méthyl (2E,6E)-10R,11S-(oxiranyl)-3,7,11-triméthyl-2,6-tridécadienoate], ayant une structure similaire à celle de la JH I mais à une seule branche éthylique, a continué de susciter l’intérêt des chercheurs vis-à-vis du processus biosynthétique des JH. Depuis, la famille des JH a continué à s’élargir. Judy et al. (1973) ont découvert la forme JH III ou C16-JH [méthyl (2E,6E)-10R-(oxiranyl)-3,7,11-triméthyl-2,6-dodécadienoate] chez le Lépidoptère Manduca sexta. Plus tard, la forme trihomosesquiterpoïde à trois branches éthyliques, JH 0 ou C19-JH [méthyl (2E,6E)-10R,11S-(oxiranyl)-3,7-diéthyl-11-méthyl-2,6-tridécadienoate] a été identifiée dans les œufs de M. sexta (Bergot et al. 1980). C’est aussi dans les œufs que Bergot et al. (1981) ont découvert l’isomère 4-méthyl-JH I ou Me-C19-JH I [méthyl (2E,6E)-10R,11S-(oxiranyl)-7-éthyl-3,4-11-diméthyl-2,6-tridécadienoate] à deux branches éthyliques et une banche méthylique supplémentaire.
En 1989, Richard et al. ont rapporté l’identification d’une forme bisépoxyde de la JH III, dite JHB3 [méthyl (2E,6E)-6S,7S,10R-(dioxiranyl)-3,7,11-triméthyl-2-dodécaenoate] chez le Diptère Drosophila melanogaster. Plus récemment, en 2009, Kotaki et al. ont découvert la présence d’une autre forme bisépoxyde, la JHSB3 [méthyl (2R,3S)-3-
[(E)-6-[(2R)-3,3-diméthyloxiran-2-yl]-4-méthyl-hex-3-enyl]-3-méthyl-oxirane-2-carboxylate], chez l’Hétéroptère (i.e punaises) Plautia stali. Finalement en 2010, Harshman et al. ainsi que Jones et al. (2010) ont présenté des données à l’effet que le méthyl farnésoate, un précurseur de la JH, possède une activité JH chez D. melanogaster et chez les Crustacés. D’autre part, trois formes hydroxylées de la JH III (4’-OH-JH III ; 8’-OH-JH III ; 12’-OH-JH-III) ont été identifiées comme produits de synthèse des CA de criquets in vitro (Darrouzet et al. 1997 ; Mauchamp et al. 1999). Cependant aucune donnée n’a jusqu’à présent été publiée sur l’isolement de ces dernières formes à partir de tissus d’insectes.
6
Dans la foulée de ces découvertes, l’identité des JH a fait l’objet d’études chez plusieurs espèces d’insectes (Schooley, 1977; Trautmann et al., 1974). Il en ressort que la JH III, la forme la plus simple, est la plus commune et qu’elle est présente chez la majorité des insectes. Toutefois chez les Lépidoptères, la JH III coexiste avec les homologues à branches éthyliques (JH 0, JH I, JH II et 4-méthyl-JH I). La JHB3 et la JHSB3 n’ont été observé que chez les Diptères supérieurs et les Hétéroptères, respectivement.
Figure 1. Structure des huit formes de JH connues chez les insectes. La JH III est produite chez la majorité des insectes. Les JH 0, JH I, JH II et 4-méthyl JH I n’ont été détectées que chez les Lépidoptères. La forme bisépoxyde de JH III (JHB3), et le méthyl farnésoate (MF) sont produits chez les Diptères supérieurs. Une différente forme du bisépoxyde de JH III (JHSB3) a été identifiée chez les Hétéroptères (Cusson et al., 2012).
7
1.3.2 Voie de biosynthèse de la JH III
La voie biochimique menant à la synthèse de la JH III emprunte d’abord la voie du mévalonate, une voie métabolique cellulaire présente chez tous les eucaryotes et plusieurs bactéries et dont le produit final est le FPP. Ensuite, le FPP est converti en JH via une voie spécifique à la voie de biosynthèse de JH, unique aux insectes (Figure 2).
1.3.2.1 Voie du mévalonate : de l’acétyl-CoA au farnésyl diphosphate
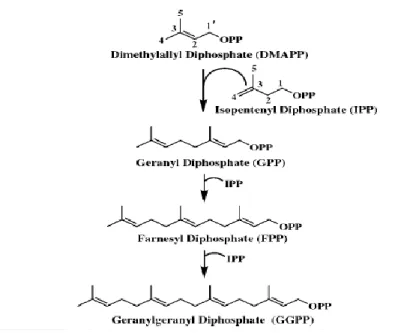
A l'exception des plantes, de certains protozoaires et de plusieurs bactéries, la voie du mévalonate est la seule qui intervient dans la biosynthèse des unités isopréniques. Son produit de départ est l’acétyl coenzyme A (acétyl-CoA). Les enzymes acétyl-CoA acétyltransférase et 3-hydroxy-3-méthyl-glutaryl coenzyme A (HMG-CoA) synthase catalysent la condensation successive de trois molécules d’acétyl-CoA, pour former le HMG-CoA. Ensuite, l’enzyme HMG-CoA réductase catalyse la réduction du HMG-CoA en mévalonate. Ce dernier produit subit deux phosphorylations successives ainsi qu’une décarboxylation conduisant à la formation de l’unité isoprénique, l’isopentényl diphosphate (IPP ; C5). L’IPP isomérase (IPPI) catalyse l’isomérisation de l’IPP en une unité isoprénique allylique, le diméthylallyl diphosphate (DMAPP ; C5) (Bellés et al., 2005).
La liaison covalente de l’IPP à son isomère DMAPP, sous l’action catalytique de l’enzyme géranyl diphosphate synthase (GPPS), conduit à la formation du terpène géranyl diphosphate (GPP ; C10). Ce produit est le précurseur de nombreux monoterpènes identifiés chez les plantes et quelques insectes. La GPPS est commune aux plantes, mais n’a été identifiée que récemment chez certains insectes : chez Ips pini (Coléoptère : la sous-famille Scolytinae de la famille des Curculionidae), la GPPS joue un rôle important dans la biosynthèse de la phéromone d’agrégation (Gilg et al., 2005); chez les larves de deux espèces de Chrysomelidae, la GPPS joue un rôle dans la biosynthèse des monoterpènes iridoïques essentiels à leur système de défense (Burse et al., 2007); chez les pucerons, la GPPS semble être impliquée dans la biosynthèse de la phéromone sexuelle (Vandermoten et al., 2008).
8
La condensation séquentielle de deux molécules d’IPP à une molécule de DMAPP est catalysée par l’enzyme farnésyl diphosphate synthase (FPPS), pour former le GPP comme produit intermédiaire et le FPP (C15) comme produit final. Cette enzyme joue un rôle important du fait qu'elle se trouve à la charnière de la voie du mévalonate et de la voie de synthèse du cholestérol chez les vertébrés, et de la voie de biosynthèse de la JH chez les insectes (Figure 2). Les insectes n'ont pas la capacité de synthétiser le cholestérol, n’ayant pas les enzymes spécifiques à cette voie (Bloch, 1965). Le produit de catalyse de la FPPS, le sesquiterpène FPP, est le précurseur des sesquiterpenoïdes, dont les JH, ainsi que des stérols, de l’ubiquinone, et des dolichols. Le FPP est aussi utilisé dans la farnésylation des protéines (Ericsson et al., 1991; Li et al., 1998; Maurer-Stroh et al., 2003).
1.3.2.2 Voie spécifique à la biosynthèse de la JH : du FPP à la JH
La biosynthèse de la JH III se poursuit par la déphosphorylation du FPP par l’enzyme FPP pyrophosphatase, menant ainsi à la formation du farnésol. Cet alcool est ensuite successivement oxydé et déshydrogéné respectivement par les enzymes farnésol oxydase et farnésal déshydrogénase, pour donner l’acide farnésoïque. L'étape d'oxydation du farnésol peut être aussi effectuée par l'enzyme farnésol déshydrogénase (Mayoral et al., 2009a). L'acide farnésoïque subit une réaction de méthylation suivie d’une réaction d’époxydation respectivement catalysées par les enzymes JH acide méthyl transférase et méthyl farnésoate époxydase, pour aboutir à la production de la forme JH III (Schooley et Baker, 1985). L’ordre de ces deux dernières étapes réactionnelles est inversé chez les Lépidoptères et les Diptères supérieurs (Goodman et Cusson, 2012) (Figure 2).
9
Figure 2. Représentation schématique de la voie de biosynthèse de la JH. Les premières étapes empruntent la voie du mévalonate laquelle est commune à la plupart des organismes. La conversion du FPP en JH est spécifique aux insectes. Le nom des enzymes est représenté en italique (D’après Bellés et al., 2005).
Vo ie du m é v a lo n a te Vo ie s p é cifiq u e à la sy n th è se d e JH
10
1.3.3 Voie de biosynthèse des homologues de la JH chez les Lépidoptères
Tel que mentionné précédemment, les Lépidoptères produisent en plus de la JH III, quatre formes de JH, qui se distinguent de celle-ci par la possession de branches éthyliques. Schooley et al. (1973) ont démontré que l’introduction des branches éthyliques dans ces JH n’est pas le résultat d’une méthylation du FPP. Ces branches sont plutôt introduites dès le début de la biosynthèse de la JH. Ainsi, durant la condensation catalysée par l’enzyme HMG-CoA synthase, le propionyl-CoA se substitue à une unité d’acétyl-CoA pour former l'homologue du HMG-CoA (homo-HMG-CoA), lequel sera convertit en homo-IPP (HIPP ; C6) et son isomère allylique, l'homo-DMAPP (HDMAPP ; C6). Le propionyl-CoA dérive du catabolisme de l’isoleucine et de la valine par l’enzyme BCAA (branched-chain amino acid) transaminase. L’activité de cette enzyme constitue une caractéristique unique aux CA de Lépidoptères, et elle est absente dans les CA d’autres groupes d’insectes (Brindle et al., 1988).
L’HIPP et l’HDMAPP peuvent être utilisés comme co-substrats dans la réaction catalysée par la FPPS chez les Lépidoptères (Figure 3). Ainsi, par exemple, pour la biosynthèse de la JH I à deux branches éthyliques, la FPPS des Lépidoptères catalyse la condensation séquentielle d’une unité de HIPP à une unité de HDMAPP et une unité d’IPP, générant le bishomo-GPP (C12) comme produit intermédiaire et le bishomo-FPP (C17) comme produit final. Ce dernier est alors utilisé pour la production de la JH I en suivant le même parcours métabolique que celui décrit pour le FPP dans la voie de biosynthèse de la JH III.
11
Figure 3. Représentation des étapes de catalyse séquentielle de la FPPS des Lépidoptères. Les substrats homologues alternatifs (HDMAPP, HIPP et les homologues de GPP) et les produits homologues du FPP qui sont les précurseurs des formes homologues de JH III, sont montrés (D'après Cusson et al., 2006).
1.3.4 Fonctions et fluctuations des niveaux de JH
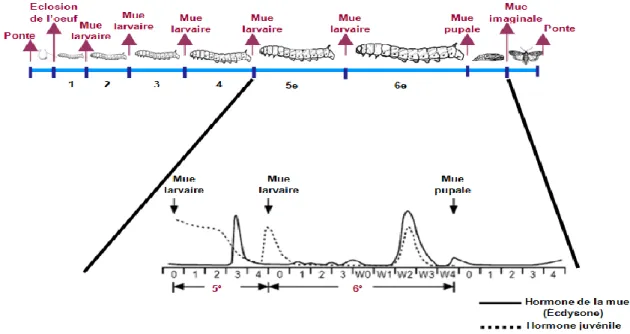
La fonction de la JH la mieux connue est son effet « juvénilisant » pendant le développement larvaire des insectes (Figure 4). Son titre demeure élevé au cours des différentes phases larvaires, ce qui permet de maintenir les caractéristiques juvéniles lors des mues. Peu de temps après la mue au dernier stade larvaire, le titre chute un niveau très bas, ce qui entraîne une première libération des ecdystéroïdes qui a pour effet d’induire l’expression des gènes de la métamorphose et de la transformation larve-pupe ou nymphe-adulte. Durant le stade pupal, les titres de la JH restent faibles, habituellement jusqu’au stade adulte, durant lequel ils redeviennent élevés pour favoriser la maturation du système reproducteur des insectes adultes (Riddiford, 1994).
12
Figure 4. Fluctuations des niveaux de la JH et de l’écdysone, sécrétées durant le 5ième et le 6ième (dernier) stade larvaire, et le stade pupal avant l’émergence, chez un Lépidoptère. Le niveau de JH demeure élevé durant les mues larvaires pour empêcher le déclenchement d’une métamorphose précoce. Il chute abruptement au début du dernier stade larvaire, pour induire la libération de l’écdysone et le déclenchement de la métamorphose (Inspiré de Kinjoh et al., 2007).
Chez les insectes femelles adultes, la JH est connue pour être impliquée dans la maturation ovarienne. En effet, elle induit la synthèse de vitellogénine par le corps gras et sa captation par les ovocytes, assurant ainsi la maturation de ces derniers. D’ailleurs, une association claire entre la variation des titres de JH et la variation des phases du cycle ovarien a été observée chez plusieurs espèces (Tobe et al., 1985).
D’autres études ont permis de mettre en évidence le rôle de la JH dans l’initiation des comportements pré-copulatoires comme le mode de recrutement de partenaire. Ainsi, il a été suggéré que la production et l’émission de phéromones sexuelles par les femelles est régie par des mécanismes physiologiques complexes impliquant l’intervention, entre autre, de la JH (Cusson et McNeil, 1989). Chez les scolytes I. pini et Dendroctonus jeffreyi, les mâles possèdent un système de production d’isoprénoïdes dans l’intestin moyen, propre à la production de phéromone.
13
Chez les insectes mâles adultes, la JH est nécessaire à l’initiation de la production des sécrétions par les glandes accessoires sexuelles et au contrôle de leur comportement (Loher et Huber, 1966). Chez les mâles du Lépidoptère H. cecropia, des études ont mis en évidence la capacité des glandes accessoires, et non des CA, à convertir la forme acide de la JH (JH acide) en son ester méthylique (i.e. la JH). Le rôle de cette conversion n’a pas encore été élucidé, bien qu’il semble possible que le mâle puisse transférer cette JH à la femelle au moment de l’accouplement (Peter et al., 1981).
D’autres processus physiologiques comme la migration, la plasticité phénotypique, la diapause reproductive et la différenciation des castes sont également dépendant des fluctuations des titres de JH (Wyatt et Davey, 1996).
1.3.5 JH, cible de la lutte contre les insectes ravageurs
Vue l’implication importante de la JH dans différents processus physiologiques vitaux chez les insectes, cette hormone a fait l’objet de nombreuses recherches, ce dont témoigne une abondante littérature scientifique. D’ailleurs, la possibilité de développer des outils de lutte axés sur la perturbation des processus contrôlés par la JH n’est pas étrangère à l’intérêt qu’elle a suscité. Deux grandes approches peuvent être envisagées pour perturber les fonctions liées à la JH (Cusson et Palli, 2000). La première consiste à traiter des insectes avec des analogues de la JH en vue d’augmenter artificiellement le niveau de JH à des étapes du développement où ce niveau est naturellement bas (Williams, 1967). Depuis 1967, plusieurs analogues terpéniques (ex., méthoprène) et non terpéniques (ex., fénoxycarbe) ont été mis au point et se sont avérés efficaces pour le contrôle de certains insectes nuisibles au stade adulte (ex. les moustiques) (Dhadallia et al., 1998 ; Retnakaran et al., 1985). Toutefois, étant donné qu’ils ne peuvent agir qu’à la fin de la vie larvaire pour perturber la métamorphose, ils ne peuvent pas efficacement contrôler les insectes qui causent des dégâts durant leur vie larvaire.
14
La seconde approche consiste à mettre au point des agents anti-JH. Ces agents sont destinés à provoquer la suppression de la biosynthèse de JH durant les stades larvaires lorsque ses titres sont naturellement élevés, ce qui entraîne un arrêt des activités de nutrition et une métamorphose précoce des larves. Ils pourraient aussi être utilisés chez les insectes adultes pour induire un arrêt de la reproduction.
Parmi les produits à effets anti-JH connus, on compte des extraits phytochimiques comme le précocène, lequel est capable de détruire sélectivement les CA par nécrose (Bowers et al., 1976). On compte également des substances à base d’imidazole capables d’inhiber l’enzyme méthyl farnésoate époxydase (Unnithan et al., 1995), et des dérégulateurs transcriptionnels des enzymes de la voie de biosynthèse de JH comme l’ETB (Ethyl 4—[2-(butylcarbonyloxy)butyloxy]benzoate) et ses dérivés (Kaneko et al., 2011 ; Kondo et al., 1977 ; Staal et Nassar, 1976). Des effets anti-JH ont aussi été attribués à un extrait fongique, le brévioxim (Cantin et al., 1999), ainsi qu’à un bacculovirus surexprimant l’enzyme JH esterase dégradatrice de la JH (Tan et al., 2005). Toutefois aucun de ces produits anti-JH ne s’est avéré suffisamment efficace pour justifier sa commercialisation.
Pour cette raison, les recherches plus récentes portent sur le clonage des gènes codant pour les enzymes de la voie de biosynthèse de la JH chez les Lépidoptères et autres insectes et la caractérisation de leurs protéines recombinantes. Ces études couplées à des essais QSAR (relation structure-activité quantitative, "quantitative structure-activity relationship"), facilitent la conception d’inhibiteurs. Vue que ces enzymes ont fait l’objet d’études chez quelques groupes d’insectes, les Lépidoptères sont d’un intérêt particulier parce qu’ils sont les seuls organismes capables de produire les JH à branches éthyliques, ce qui suggère qu’une ou plusieurs enzymes de la voie de biosynthèse de la JH chez les Lépidoptères présentent des propriétés structurales et catalytiques distinctes de celles d’autres insectes et des vertébrés. Si ces propriétés sont élucidées par des approches moléculaires et biochimiques, cette stratégie pourrait permettre de concevoir des inhibiteurs enzymatiques hautement spécifiques aux Lépidoptères.
15
1.3.6 Les cibles enzymatiques les plus prometteuses chez les Lépidoptères
Jusqu’à présent, les projets de séquençage génomique de plusieurs vertébrés et insectes ont permis de déduire les séquences codantes et de prédire les séquences en acides aminés de plusieurs enzymes de la voie du mévalonate et de la voie spécifique à la biosynthèse de la JH (voir par exemple, Cusson et al., 2006; Kinjoh et al., 2007; Noriega et al., 2006 ; Zhan et al., 2011). Des suivis de quantification des transcrits de ces enzymes suggèrent l’abondance de certaines dans les CA, le site de biosynthèse de la JH. De plus, les patrons de variation de l’abondance de transcrits de certaines enzymes reflètent dans plusieurs cas les variations dans les titres de JH sécrétés dans l’hémolymphe (Kinjoh et al., 2007). Deux groupes d’enzymes constituent des cibles bio-rationnelles prometteuses : (i) les enzymes de la voie spécifique à la JH, et (ii) les enzymes de la voie du mévalonate, qui, chez les Lépidoptères, présentent des caractéristiques structurales et fonctionnelles uniques qui permettraient de les inhiber de façon spécifique.
Le clonage et la caractérisation des enzymes de la voie spécifique à la synthèse de la JH n'ont pas été élaborés autant que pour les enzymes de la voie du mévalonate, pour lesquelles on a pu profiter de l’existence de séquences orthologues de vertébrés. Chacune des enzymes de la voie spécifique à la JH a maintenant été clonée chez au moins une espèce : (i) farnésyl pyrophosphatase (D. melanogaster; Cao et al., 2009), (ii) farnésol déshydrogénase (Aedes aegypti; Mayoral et al., 2009a), (iii) farnésal déshydrogénase (A. aegypti; Rivera-Perry et al., 2013), (iv) JH acide méthyl transférase (quelques espèces; Mayoral et al., 2009b ; Minakuchi et al., 2008; Niwa et al., 2008; Shinoda et Itoyama, 2003), (v) méthyl farnésoate époxidase (quelques espèces; Daimon et al., 2012; Helvig et al., 2004; Marchal et al., 2011; Noriega et al., 2006).
L'utilisation du RNAi (Minakushi et al., 2008) et de mutants (Daimon et al., 2012) a permis de démontrer que le silençage des gènes codant pour la JH acide méthyl transférase et la méthyl farnésoate époxydase, respectivement, pouvait induire une mue précoce, démontrant que ces deux gènes constituent des cibles bio-rationnelles prometteuses.
16
De plus, il s'avère possible que l'enzyme responsable de la conversion du farnésol en farnésal dans les CA de Lépidoptères ne soit pas une déshydrogénase (comme cela semble être le cas chez les moustiques ; Mayoral et al., 2009a), mais qu'il s'agisse plutôt d'une oxidase (Sperry et Sen, 2001), sauf que le clonage de cette enzyme n'a pas encore été réalisé.
Les enzymes de la voie du mévalonate ont fait l'objet de plusieurs études chez les insectes, dont certaines avaient pour but d'évaluer leurs particularités chez les Lépidoptères. Par exemple, les Lépidoptères sont les seuls insectes à présenter une activité enzymatique de BCAA transaminase dans les CA, cette enzyme étant nécessaire à la production du propionate, lequel est essentiel à la biosynthèse des formes homologues de JH (Brindle et al., 1992; Cusson et al., 1996; Schooley et al., 1973). Dans cette perspective, cette enzyme pourrait donc constituer une cible intéressante pour la conception d’un inhibiteur spécifique aux Lépidoptères. Toutefois, la présence d'une BCAA transaminase active dans les CA de Lépidoptères n'est pas le seul facteur responsable de la production de JH homologues, parce que les CA de non-Lépidoptères ne peuvent être que difficilement forcés à produire des JH à branches éthyliques lorsqu'on leur fournit du propionate (Feyereisen et Farnsworth, 1988). Il est clair alors que d'autres processus enzymatiques interviennent dans la biosynthèse des JH homologues.
L'isomérisation de l'HIPP par une IPPI a le potentiel de générer quatre isomères différents, dont le HDMAPP. Toutefois, il semble que seule l'IPPI des Lépidoptères soit en mesure de générer le HDMAPP, essentiel à la biosynthèse des JH à branches éthyliques, en proportions appréciables (Koyama et al., 1973a; Sen et al., 2012). Une comparaison des séquences primaires d'IPPI de Lépidoptères et d'autres organismes, ainsi qu'un travail de modélisation moléculaire suggèrent que les particularités structurales des IPPI de Lépidoptères sont subtiles (Sen et al., 2012). L'adéquation de cette enzyme comme cible bio-rationnelle demeure donc incertaine.
17
Finalement, vue son emplacement stratégique dans la voie de biosynthèse de la JH, à la charnière entre la voie du mévalonate et la voie spécifique à la JH, la prényltransférase FPPS fait l'objet de quelques études récentes chez différentes espèces d'insectes. Les travaux de Sen et al. (1996) et Sen et Ewing (1997), basés sur l'analyse de l'activité prényltransférase dans des homogénats de CA de Lépidoptères, ont mis en évidence la préférence de la FPPS de Lépidoptère pour l'utilisation de substrats homologues favorisant la production des JH à branches éthyliques. Cette découverte révélait ainsi le caractère particulier de la FPPS des Lépidoptères et son adéquation potentielle comme cible pour la lutte bio-rationnelle. Le clonage d'une FPPS chez le Lépidoptère Agrotis ipsilon, par Castillo-Gracia et Couillaud (1999), ouvrit la voie aux progrès subséquents réalisés dans la caractérisation de cette enzyme. Dans ce contexte, j’aborderai à la prochaine section les caractéristiques de cette enzyme élucidées jusqu’à présent.
18
1.4 La farnésyl diphosphate synthase (FPPS) : généralités et fonctions
1.4.1 Généralités sur la FPPS
La FPPS compte parmi les enzymes de la voie du mévalonate les mieux étudiées. Elle est la première enzyme de la famille des prényltransférases à courte chaine à avoir été purifiée (Eberhardt et Rilling, 1975). Deux types distincts de FPPS ont été identifiés jusqu'à présent, les FPPSs générant des produits trans et les FPPSs générant des produits cis. Les FPPSs de type trans sont caractéristiques des eucaryotes et se distinguent par leur mécanisme catalytique dépendant de la présence de cations divalents (généralement Mg2+ ou Mn2+), et consistant en la condensation de deux unités isopréniques d'IPP avec une unité de DMAPP, pour produire le GPP comme produit intermédiaire, et le E,E-FPP comme produit final. Les FPPS des bactéries et des plantes sont en général du type trans, sauf que la FPPS chez la bactérie Mycobacterium tuberculosis (Ambo et al., 2008; Schulbach et al., 2000) et celle dans la tomate sauvage Solanum habrochaites (Sallaud et al., 2009) semblent faire exception et sont des FPPS de type cis qui produisent respectivement le E,Z-FPP et le Z,Z-FPP.
1.4.2 Mécanisme catalytique de la FPPS des eucaryotes
La FPPS des eucaryotes catalyse une réaction d’élongation de chaines carbonées au cours de laquelle deux unités isopréniques d'IPP se lient à l’isoprène allylique DMAPP. Cette réaction se produit selon un mécanisme séquentiel d’ionisation-condensation-élimination, nommé condensation « head-to-tail ». Le mécanisme chimique de cette élongation est une réaction d’alkylation électrophile qui se réalise en trois étapes distinctes (Figure 5).
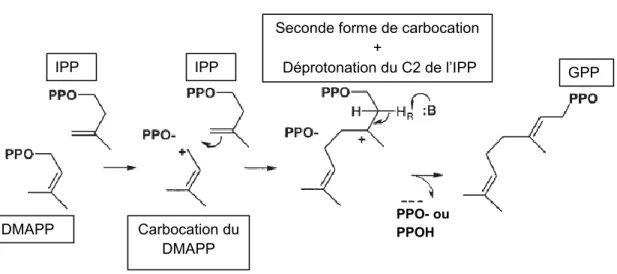
La première consiste en la rupture du lien C-O du DMAPP et en la libération du groupement diphosphate, pour former un carbocation intermédiaire (Figure 5).
La deuxième étape consiste en l’alkylation de la double liaison C3-C4 de l’IPP par le carbocation du DMAPP. Cette réaction génère ainsi une seconde forme intermédiaire de carbocation avec une charge positive au niveau du C3 de l’IPP (Figure 5).
19
En troisième étape, une déprotonation du C2 de l’IPP s’effectue pour générer une nouvelle double liaison C2-C3. Ainsi le produit primaire qui résulte de cette réaction est le GPP (C10) (Figure 5). Le complexe enzyme-GPP formé induit un réarrangement à l’intérieur de la cavité catalytique pour repositionner le GPP dans le site de liaison au substrat allylique et expulser son groupement diphosphate avant la seconde réaction de condensation « head-to-tail ». Durant cette dernière, une autre unité d’IPP est couplée au GPP, par le même mécanisme, pour donner comme produit final, le E,E-FPP (C15) (Cornforth et al., 1966; Kellogg et Poulter, 1997).
Figure 5. Illustration du mécanisme chimique de la réaction de condensation « head-to-tail » entre les substrats IPP et DMAPP. L’élimination du groupement diphosphate du DMAPP génère un carbocation intermédiaire. Ce dernier induit une alkylation de l’IPP pour donner un second carbocation intermédiaire. Subséquemment, une déprotonation du C2 dans l’IPP permet la génération du GPP (D'après Gabelli et al., 2006).
1.4.3 Voies métaboliques dans lesquelles la FPPS est impliquée
La FPPS est impliquée dans diverses voies métaboliques menant à la production de composés naturels essentiels au contrôle et la régulation de plusieurs fonctions biologiques importantes. Ainsi une perturbation de son activité catalytique affectera le taux de production de ces composés et entrainera des modifications physiologiques potentiellement graves. PPO- ou PPOH DMAPP IPP Carbocation du DMAPP IPP
Seconde forme de carbocation +
20
1.4.3.1 Synthèse du cholestérol et des phytostérols
La FPPS est une des enzymes clés responsables de la biosynthèse du cholestérol chez les vertébrés et des phytostérols chez les plantes. Son produit de catalyse, le FPP, constitue le précurseur essentiel à la première étape de la voie spécifique à la synthèse du cholestérol. Cette étape consiste en la condensation "head-to-tail" de deux unités de FPP par l’enzyme squalène synthase, nécessitant la réduction du NADPH, pour donner le squalène. Ce dernier est subséquemment convertit en cholestérol suite à une cascade de réactions de cyclisation catalysées par des enzymes associées aux membranes du réticulum endoplasmique (Brown et Goldstein, 1985). Des modifications additionnelles permettent la production des hormones stéroïdiennes (les œstrogènes, les androgènes...), de la vitamine D (Diwan, 2008) et des phytostérols chez les plantes (Bach, 1986).
1.4.3.2 Synthèse de l’hormone juvénile chez les insectes
Les insectes ne produisent pas de cholestérol ou de stérols (Bellés et al., 2005). La voie spécifique à la biosynthèse de ces composés est remplacée, chez les insectes, par la voie de biosynthèse de la JH. Le FPP, produit de l’activité catalytique de la FPPS, est un précurseur clé de la biosynthèse de la JH. Vue l'importance de la FPPS dans cette voie métabolique, cette enzyme fut le sujet de récentes études de caractérisation moléculaire et biochimique chez les insectes (Koyama et al., 1985 I et II; Sen et Sperry, 2002; Sen et al., 1996).
1.4.3.3 Synthèse de sesquiterpènes et de sesquiterpénoïdes
Chez les plantes, l’acide abscissique (ABA) est un sesquiterpénoïde de formule moléculaire C15H24O4 qui joue un rôle important dans la régulation des échanges d’ions et d’eau à travers la membrane des cellules de garde (Leung et al., 2012). La synthèse d'ABA débute par la condensation d'une unité d'IPP avec le FPP par l’enzyme géranylgéranyl diphosphate synthase (GGPPS), pour produire le géranylgéranyl diphosphate (GGPP) (C20) (Figure 6). Ce dernier est le précurseur du diterpène violaxanthine qui, à son tour, subit une série de réactions de clivage oxidatif pour aboutir à la formation de l’ABA (Hopkins, 2003).