Impact de la lumière sur la production de protéines
recombinantes chez Nicotiana benthamiana
Mémoire
Marielle Gagné
Maîtrise en biologie végétale
Maître ès sciences (M.Sc.)
Québec, Canada
iii
Résumé
La moléculture végétale est une approche prometteuse pour la production de protéines d’intérêt médical ou industriel. Considérant les variations de rendement possibles dans une plante soumise à différentes conditions culturales, nos objectifs étaient : (i) de cartographier l’accumulation d’un antigène viral d’intérêt clinique dans les feuilles du tabac sauvage Nicotiana benthamiana utilisé comme bio-usine, et (ii) d’évaluer l’impact de la lumière en période de croissance sur le rendement total en antigène. Nous avons étudié les relations entre l’âge foliaire, le régime lumineux, l’expression du transgène et le rendement final en antigène dans les feuilles. Nos données confirment l’influence de l’âge sur les variations de rendement d’une feuille à l’autre, et l’impact positif de l’intensité lumineuse sur le rendement par plante. Elles mettent aussi en relief l’importance des tiges secondaires sur le rendement et le rôle clé de la transcription du transgène sur la teneur en antigène à l’échelle cellulaire.
v
Abstract
Plant molecular farming is a promising approach to produce proteins of medical or industrial interest. Considering possible variations of protein yield in plants exposed to different cultural conditions, our goals were : (i) to map the accumulation of a clinically useful viral antigen in leaves of the tobacco relative Nicotiana
benthamiana used as protein biofactory, and (ii) to evaluate the impact of light conditions during plant growth
on total antigen yield. We looked at eventual relations in planta between leaf age, light intensity, light quality, transgene expression and final protein yield in leaves. Our data confirmed the central influence of leaf age on antigen yield variation from one leaf to another, and the positive impact of light intensity on total yield per plant. They also highlight the importance of secondary stem growth on total yield, and the key role of transgene transcription on antigen content at the cell scale.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations et des sigles ... xiii
Remerciements ... xv
Avant-propos ... xvii
Introduction générale ... 1
1.
Revue de littérature : Expression hétérologue des protéines thérapeutiques ... 3
1.1.
Différents systèmes de production pour les protéines recombinantes ... 3
1.2.
La moléculture végétale pour la production de protéines recombinantes ... 4
1.3.
Les espèces utilisées en moléculture végétale ... 5
1.3.1.
Les cultures fruitières et légumières ... 5
1.3.2.
Les céréales et les légumineuses ... 6
1.3.3.
Les plantes à forte biomasse foliaire ... 6
1.4.
Méthodes de transformation et systèmes d’expression ... 6
1.4.1.
Les plantes et cellules transgéniques ... 7
1.4.2.
Les systèmes d’expression transitoire ... 7
1.5.
L’expression transitoire – Vecteurs viraux et bactériens ... 8
1.6.
Problématique de recherche ... 10
1.6.1.
Influence de la température et de l’intensité lumineuse en contexte de moléculture végétale ... 10
1.6.2.
Influence du spectre lumineux sur la croissance des plantes ... 11
1.7.
Hypothèses et objectifs du projet de recherche ... 13
2.
Résultats ... 15
2.1.
Phase 1 : Influence du régime lumineux sur la production de biomasse et d’antigène H1 dans les feuilles ... 15
2.1.1.
Production de biomasse et d’antigène H1 en fonction des unités productrices ... 16
2.1.2.
Effet de l’intensité lumineuse sur la biomasse foliaire et la production d’antigène H1 ... 19
2.1.3.
Influence des traitements lumineux sur la production d’antigène H1 ... 23
2.2.
Phase 2 : Influence de l’intensité lumineuse sur la production de transcrits H1 et la charge protéasique dans les feuilles ... 26
2.2.1.
Influence de l’intensité lumineuse sur la biomasse foliaire et la production d’antigène H1 ... 26
2.2.2.
Production de transcrits H1 dans les différentes unités productrices ... 27
2.2.3.
Charge protéasique dans les différentes unités productrices ... 28
3.
Discussion ... 35
3.1.
Retour sur l’Objectif 1 ... 35
3.2.
Retour sur l’Objectif 2 ... 38
3.3.
Retour sur l’Objectif 3 ... 39
3.4.
Retour sur l’Objectif 4 ... 40
4.
En conclusion ... 41
5.1.
Semis et croissance des plantes ... 43
5.1.1.
Semis ... 43
5.1.2.
Période de croissance... 43
5.1.3.
Période d’incubation ... 43
5.2.
Conditions lumineuses en phase de croissance ... 44
5.3.
Récolte des échantillons foliaires ... 45
5.4.
Construction génétique et agroinfiltration ... 46
5.5.
Extraction des protéines ... 46
5.6.
Activités d’hémagglutination ... 46
5.7.
Activités protéasiques ... 46
5.8.
Extraction de l’ARN foliaire et quantification des transcrits H1 ... 47
5.9.
Analyses statistiques ... 47
Bibliographie ... 49
Annexe 1 ... 53
Données additionnelles, en complément au Chapitre 2 (Résultats) ... 53
A1.1.
Production de biomasse et d’antigène H1 dans les unités productrices foliaires du N. benthamiana ... 53
A1.1.1.
Production de biomasse foliaire ... 53
A1.1.2.
Teneur pondérale en antigène H1 ... 53
A1.1.3.
Teneur globale en antigène H1 ... 54
A1.2.
Effet de l’intensité lumineuse sur la biomasse foliaire et la production d’antigène H1 dans les tiges primaire et secondaires du N. benthamiana ... 54
A1.2.1.
Effet sur la biomasse foliaire ... 54
A1.2.2.
Effet sur la teneur pondérale en antigène H1 ... 55
A1.2.3.
Effet sur la teneur globale en antigène H1 ... 55
Annexe 2 – Résumé d’un brevet provisoire déposé au Bureau américain des brevets et marques de commerce (USPTO) ... 57
ix
Liste des tableaux
Tableau 2.1 Biomasse foliaire des unités productrices P1, P2, P3, S1, S2 et S3. ... 17
Tableau 2.2 Teneur pondérale en antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3. ... 17
Tableau 2.3 Quantité totale d’antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3. ... 18
Tableau 2.4 Influence du traitement lumineux (1 : HPS/MH/ratio bleu:rouge 0,42; 2 : HPS/MH + lampes
intercalaires; 3 : DEL ratio bleu:rouge 0,13 + lampes intercalaires; 4 : DEL ratio bleu:rouge 0,28 + lampes intercalaires) sur le rendement en antigène H1 dans la tige principale (P) et les tiges
secondaires (S). ... 25
Tableau 2.5 Influence du traitement lumineux (1 : HPS/MH/ratio bleu:rouge 0,42; 2 : HPS/MH + lampes
intercalaires; 3 : DEL ratio bleu:rouge 0,13 + lampes intercalaires; 4 : DEL ratio bleu:rouge 0,28 + lampes intercalaires) sur le rendement en antigène H1, exprimé en unités H1 par g de feuille, dans la tige principale (P) et les tiges secondaires (S). ... 24
Tableau 2.6 Transcrits d’ARNm pour l’antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3. ... 27
Tableau 2.7 Activité protéasique de type aspartate dans les unités productrices P1, P2, P3, S1, S2 et S3. ... 29
Tableau 3.1 Contribution relative des six unités productrices, de la tige primaire et des tiges secondaires
à la biomasse et au rendement total en antigène H1 dans la plante. ... 37
Tableau A1.1 Biomasse foliaire des unités productrices P1, P2, P3, S1, S2 et S3 du N. benthamiana. ... 53
Tableau A1.2 Teneur pondérale en antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3 du
N. benthamiana. ... 53
Tableau A1.3 Quantité totale d’antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3 du N.
xi
Liste des figures
Figure 2.1 Représentation schématique des unités de production foliaires du N. benthamiana, tel que
défini dans le cadre du présent projet... 16
Figure 2.2 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s) sur la
production de biomasse en fonction de l’âge des feuilles (1, en bleu : jeunes feuilles; 2, en rouge : feuilles adultes; 3, en vert : feuilles plus âgées). ... 19
Figure 2.3 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s)
sur la teneur pondérale en antigène H1 dans les feuilles de la tige principale (P) et des tiges
secondaires (S). ... 20
Figure 2.4 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s)
sur la teneur pondérale en antigène H1 dans les feuilles, selon leur position sur la tige (1, en bleu : jeunes feuilles; 2, en rouge : feuilles adultes; 3, en vert : feuilles plus âgées). ... 21
Figure 2.5 Effet d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s) sur
l’accumulation totale d’antigène H1 dans les feuilles de la tige principale (P) et les tiges
secondaires (S). ... 22
Figure 2.6 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s)
sur le rendement total en antigène H1 selon la position des feuilles sur la tige (1, en bleu : jeunes feuilles; 2, en rouge : feuilles adultes; 3, en vert : feuilles plus âgées). ... 23
Figure 2.7 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s) sur
la teneur pondérale en transcrits H1 dans les feuilles. ... 28
Figure 2.8 Activité protéasique de type cystéine en fonction de la position des feuilles sur la tige (1 : jeunes
feuilles; 2 : feuilles adultes; 3 : feuilles âgées). ... 30
Figure 2.9 Activité protéasique de type cystéine C1A dans les feuilles de la tige principale (P) et des tiges
secondaires (S). ... 31
Figure 2.10 Activité protéasique de type sérine S1 dans les feuilles de la tige principale (P) et des tiges
secondaires (S). ... 31
Figure 2.11 Activité protéasique de type sérine S1 en fonction de la position des feuilles sur la tige
(1 : jeunes feuilles; 2 : feuilles adultes; 3 : feuilles âgées). ... 32
Figure 2.12 Activité protéasique de type sérine S7 selon la position des feuilles sur la tige (1, en bleu :
jeunes feuilles; 2, en rouge : feuilles adultes; 3, en vert : feuilles âgées), sous des intensités
lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s). ... 33
Figure 3.1 Biomasse relative des unités productrices foliaires du N. benthamiana utilisé comme bio-usine
pour la production de protéines recombinantes. ... 36
Figure 3.2 Production d’antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3. ... 36
Figure 5.1 Dispositif expérimental pour l’ensemble des traitements lumineux en phase de croissance. ... 45
Figure A1.1 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s)
sur la production de biomasse en fonction de l’âge des feuilles (1, en bleu : jeunes feuilles; 2, en
rouge : feuilles adultes; 3, en vert : feuilles plus âgées). ... 54
Figure A1.2 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s)
sur la teneur pondérale en antigène H1 dans les feuilles de la tige principale (P) et des tiges
Figure A1.3 Effet d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s) sur
l’accumulation totale d’antigène H1 dans les feuilles de la tige principale (P) et des tiges
xiii
Liste des abréviations et des sigles
DEL : Diode électroluminescente, LED ou Light-Emitting Diode
DFPP : Densité de flux photonique photosynthétiques (en référence à intensité lumineuse) H1 : Hémagglutinine H1 du virus de l’influenza
HPS : Ampoules à haute pression de vapeur au sodium (High Pressure Sodium) MH : Ampoules aux halogénures métalliques (Metal Halide)
MES : Acide 2-( N-morpholino)éthansulfonique (2-( N-morpholino)ethansulfonic acid)
P1, P2, P3 : Unités productrices rattachées à la tige principale (P) à trois positions (ou hauteurs) différentes PMSF : Fluorure de phénylméthylsulfonyl (Phenylmethylsulfonyl fluoride)
qPCR : Réaction en chaîne par polymérase en temps réel (quantitative polymerase chain reaction) RT : Transcription inverse (Reverse Transcriptase)
S1, S2, S3 : Unités productrices rattachées aux tiges secondaires (S) à trois positions (ou hauteurs)
différentes
xv
Remerciements
Je tiens à remercier tout spécialement mon directeur de recherche, le Dr. Dominique Michaud, pour m’avoir permis l’expérience inoubliable vécue ces deux dernières années. Ton ouverture d’esprit, ton optimisme et ton accessibilité sont pour moi des qualités que j’apprécie grandement et que je tâcherai toujours de reproduire. Un merci spécial à Marie-Claire Goulet et à toute l’équipe du Laboratoire Michaud-Goulet pour l’aide apportée, autant sur le plan technique qu’au moment de la rédaction. Votre soutien m’aura beaucoup aidée tout au long de cette aventure.
Finalement, rien n’aurait été possible sans ma famille et mes amis qui m’ont épaulée, encouragée et écoutée pendant ces deux dernières années. Je vous dédie, à toutes et tous, le travail présenté dans ces pages.
xvii
Avant-propos
Ce projet de maîtrise, supervisé par le Professeur Dominique Michaud, a été réalisé dans le cadre d’un projet de recherche plus vaste financé conjointement par le CRSNG et un partenaire industriel de longue date, la compagnie biotech Medicago inc.1 En 2012, la direction de Medicago demandait à trois chercheurs de
l’Université Laval, les Professeurs André Gosselin, Steeve Pépin et Dominique Michaud, s’ils seraient intéressés d’entreprendre un projet de recherche d’envergure visant à mieux comprendre les divers déterminants physiologiques de Nicotiana benthamiana. Grâce à ces nouvelles connaissances, nous pourrions caractériser l’impact des conditions de culture en serres et en cabinets de croissance sur la production de protéines recombinantes exprimées transitoirement dans les feuilles du Nicotiana benthamiana, plate-forme d’expression adoptée par la compagnie il y a quelques années. Le projet, qui s’échelonne sur quatre ans, comporte différents volets et implique, outre les trois chercheurs principaux, des stagiaires de recherche, des étudiants-chercheurs, des professionnelles de recherche et plusieurs chercheurs et employés de la compagnie partenaire.
Mon directeur de recherche, M. Michaud, a défini avec moi les bases du projet décrit dans le présent mémoire, avec l’aide précieuse de M. Gosselin et de Mmes Linda Gaudreau et Marie-Claire Goulet, professionnelles de recherche impliquées dans toutes les phases du projet. Les travaux en cabinets de croissance présentés au
Chapitre 2 ont été réalisés avec l’incomparable collaboration de madame Gaudreau et son équipe de
stagiaires; j’ai réalisé par ailleurs l’ensemble des travaux de laboratoire, incluant les mesures de rendement en antigène, les dosages enzymatiques et les analyses d’expression génique. En plus de rédiger ce mémoire, j’ai effectué l’ensemble des analyses statistiques, en collaboration étroite avec des experts du Service de consultation statistique de l’Université Laval et avec l’aide précieuse de Mme Goulet. J’ai préparé, enfin, l’ensemble des figures et tableaux présentés dans le mémoire, diffusés également dans le cadre de congrès et colloques scientifiques au Québec et à l’extérieur. Les résultats présentés au Chapitre 2 sont une suite logique des résultats antérieurs de ma collègue de laboratoire, Mme Stéphanie Robert, publiés en 2013 dans le périodique scientifique PLoS One.2 Un manuscrit préparé à partir des données présentées dans le présent
document sera soumis sous peu pour publication dans le même périodique.
Sur un plan plus spécifique, le Chapitre 1 de ce mémoire est une revue de la littérature scientifique sur la définition, les avantages et les limites de la moléculture végétale pour la production de protéines d’intérêt
1 Gosselin A, Pepin S, Michaud D (2013–2017) Physiological determinants of recombinant protein expression
in Nicotiana benthamiana. Projet CRSNG R&D Coopérative, Ref. No. 220877551.
2 Robert S, Khalf M, Goulet M-C, D’Aoust M-A, Sainsbury F, Michaud D (2013) Protection of mammalian
recombiannt antibodies from development-dependent proteolysis in leaves of Nicotiana benthamiana. PLoS One 8, e70203.
médical; sont aussi abordées dans ce chapitre les recherches faites sur l’impact des conditions lumineuses en contexte de moléculture végétale et d’une manière plus générale, leur impact sur la croissance des espèces de la famille des Solanacées. Le Chapitre 2 décrit ensuite nos résultats de recherche; cette partie du document comporte deux volets traitant, d’une part, de la production de biomasse et d’antigène recombinant en fonction du patron de développement de la plante-modèle utilisée et du régime lumineux appliqué au couvert végétal, et, d’autre part, de l’influence du ratio biosynthèse-turnover en regard des rendements mesurés en antigène. Le Chapitre 3 est une discussion générale sur l’ensemble du projet, où sont reconsidérés un à un les hypothèses et objectifs du projet formulés au départ. Complémentaire au Chapitre 3, le Chapitre 4 est une brève conclusion sur les retombées pratiques éventuelles du projet sur le plan pratique. Le Chapitre 5, enfin, décrit l’approche expérimentale adoptée pour le projet, avec des détails sur les protocoles et techniques utilisés. Deux annexes complètent le mémoire présentant, respectivement, des données statistiques complémentaires sur les données générées (Annexe 1) et le résumé d’un brevet provisoire déposé au Bureau américain des brevets en juillet 2014 sur la base des travaux réalisés (Annexe 2)
1
Introduction générale
Depuis deux décennies, le sous-secteur des protéines recombinantes – ou biopharmaceutiques – a pris une ampleur considérable dans l’industrie pharmaceutique, le marché de ces produits passant d’une valeur de 10 % du secteur en 2007 à une valeur de 18 % en 2012. Une estimation récente de l’organisation IMS Health prévoyait une augmentation des parts de marché à 20 % en 2017 et il semble maintenant probable qu’entre 2007 et 2017, soit sur un intervalle de 10 ans, le sous-secteur des biopharmaceutiques ait continué à gagner du terrain pour occuper une part deux fois plus grande de l’industrie pharmaceutique considérée dans son ensemble (Walsh 2014).
Parmi les méthodes développées pour la production de biopharmaceutiques, l’expression transitoire chez les végétaux s’est taillée une place de plus en plus grande chez les différents joueurs de l’industrie. Vézina et coll. définissaient en 2011 l’expression transitoire en systèmes végétaux comme l’utilisation de la capacité d’un vecteur à « infecter les cellules végétales et transférer l’information génétique essentielle sous la forme d’un fragment d’ADN mobile jusqu’au noyau de la cellule infectée. » Le fragment d’ADN n’est pas intégré dans la cellule hôte, distinguant ainsi l’expression transitoire du processus de transgénèse, qui mène à la production de clones transgéniques. En raison de ces caractéristiques, l’expression transitoire s’opère sur quelques jours et les rendements obtenus sont souvent élevés; cette approche de transfection génique est qualifiée par plusieurs comme la plus rapide, la plus flexible et la plus pratique (Obembe et al. 2011; Vézina et al. 2011). Malgré la simplicité du concept d’expression transitoire, beaucoup reste à faire afin d’optimiser les approches et procédures adoptées en pratique. Comparée aux cellules microbiennes souvent utilisées pour la production de protéines recombinantes, une plante est un organisme complexe formé d’organes possédant tous leurs caractéristiques propres, à commencer par leur âge physiologique. Selon l’âge des organes, les flux et ratios métaboliques varient, avec une influence certaine sur le rendement en protéines dans un contexte de moléculture. Il a été rapporté, par exemple, que le rendement final en protéines recombinantes diminue avec l’âge foliaire (Robert et al. 2013; Stevens et al. 2000). Il est bien connu aussi que les activités protéolytiques varient en fonction du même critère, en raison d’une remobilisation des nutriments des tissus âgés en direction des plus jeunes (Robert et al. 2013).
Comme les plantes montrent des rendements en matériel recombinant suivant l’âge métabolique de leurs organes, notre but a été d’établir dans quelle mesure les conditions de culture ambiantes pouvaient influencer l’efficacité de production d’une protéine d’intérêt clinique dans la plante prise dans son ensemble. Stevens et al. (2000) décrivaient il y a plusieurs années une augmentation de la production d’anticorps recombinants dans du tabac transgénique, en réponse à une augmentation de l’intensité lumineuse. Plus récemment,
Colgan et al. (2010) rapportaient une augmentation de la biomasse et du taux en protéines solubles dans les feuilles de la même plante sous une intensité lumineuse élevée, sans toutefois préciser l’impact de ce facteur sur le rendement en protéines recombinantes. Hors du contexte de l’expression protéique, plusieurs articles ont rapporté les bienfaits d’une lumière bleue sur la croissance des plantes. Des « photons bleus » favoriseraient, entre autres, la synthèse de la chlorophylle, l’ouverture des stomates pour l’entrée de CO2, la
photomorphogénèse et la synthèse de plusieurs enzymes (Yorio et al. 2001).
Les expériences du présent projet se sont déroulées en deux temps. Nous avons, d’abord, étudié l’influence des conditions lumineuses appliquées au couvert végétal en période de croissance sur la production de biomasse et l’accumulation subséquente d’une protéine modèle d’intérêt clinique, en fonction du patron de développement de la plante hôte. Nous avons, dans un deuxième temps, tenté d’expliquer en termes métaboliques les variations de rendement éventuellement observées, par un suivi des transcrits d’ARNm pour la protéine recombinante et une analyse comparative des protéases endogènes en fonction de la position des organes foliaires producteurs sur la plante-usine. Les travaux ont été menés avec comme plante modèle le tabac sauvage Nicotiana benthamiana exprimant transitoirement l’hémagglutinine H1 du virus de l’influenza, une protéine utilisée par notre partenaire industriel pour la production de vaccins contre la grippe saisonnière.
3
1. Revue de littérature : Expression hétérologue
des protéines thérapeutiques
Depuis deux décennies, le sous-secteur des protéines recombinantes –ou « biopharmaceutiques »– a pris une importance considérable dans l’industrie pharmaceutique, le marché de ces produits passant de 10 % du secteur en 2007 à 18 % en 2012. Une estimation de l’organisation IMS Health prévoyait une augmentation des parts de marché à 20 % en 2017 et il est plausible qu’entre 2007 et 2017, le sous-secteur des biopharmaceutiques ait continué à gagner du terrain pour occuper une part deux fois plus grande de l’industrie pharmaceutique considérée dans son ensemble (Walsh 2014). Les ventes cumulatives en protéines recombinantes ont atteint un demi billion de dollars américains de 2010 à 2013, dont 140 milliards de dollars pour la seule année 2013. De 2010 à 2013, 54 nouveaux produits biopharmaceutiques ont été approuvés pour commercialisation aux États-Unis et dans l’Union européenne, incluant des anticorps monoclonaux (17), des hormones (9) et des protéines accessoires du sang (8). La part des biopharmaceutiques sur le total des nouveaux médicaments approuvés aux États-Unis entre 2010 et 2013 était estimée à 26 %, comparativement à 24 % pour les années 2005–2009 et à 21 % pour les années 2000–2004 (Walsh 2014).
1.1. Différents systèmes de production pour les protéines
recombinantes
Différents systèmes d’expression sont utilisés pour la production de protéines recombinantes d’intérêt thérapeutique, parmi lesquels les systèmes bactériens sont les plus couramment utilisés. Au fil des années, beaucoup d’informations ont été accumulées et une vaste gamme d’outils ont été développés pour les systèmes bactériens, basés en général sur la bactérie Escherichia coli. La manipulation de cette bactérie est aisée, les conditions de culture sont simples, le temps de génération cellulaire est court et les procédures d’expression courantes permettent d’accumuler de grandes quantités de protéines (Karg & Kallio 2009). Les bactéries présentent en revanche des inconvénients majeurs, incluant leur incapacité à opérer certaines des modifications post-traductionnelles essentielles à l’activité de plusieurs protéines d’intérêt clinique. Un repliement anormal et une instabilité marquée des protéines de mammifères sont par exemple souvent observés dans les cellules bactériennes, en raison de leur capacité déficiente à diriger la formation de ponts disulfures et de l’absence des systèmes enzymatiques pour la glycosylation des protéines sécrétées.
Une alternative aux bactéries pour contourner ces limitations est d’utiliser plutôt des cellules de mammifères en culture, comme les cellules ovariennes du hamster chinois (cellules CHO), les cellules épithéliales de rein du singe vert africain Chlorocebus sp. (cellules Vero) ou les cellules rénales du hamster de Syrie (cellules
BHK) (Mett et al. 2008). Bien qu’exprimant parfois des produits différant légèrement de la protéine originale
nécessaire aux modifications post-traductionnelles requises pour la maturation cellulaire des protéines animales. Contrairement à E. coli, la manipulation de ces cellules et les conditions mises en place pour les cultiver sont toutefois complexes et les quantités de protéines recombinantes accumulées sont beaucoup plus faibles (Karg & Kallio 2009). L’emploi de cellules animales présente un danger sanitaire potentiel sur le plan médical, en raison de leur sensibilité aux agents pathogènes humains (Mett et al. 2008). Les systèmes d’expression utilisant des cellules de mammifères, bien que toujours largement utilisés, montrent des avantages certains mais aussi des inconvénients majeurs sur le plan pratique, comme c’est le cas également pour d’autres systèmes d’expression animaux comme les cellules d’insectes et les animaux transgéniques, ou pour des systèmes microbiens eucaryotes comme les champignons ou les levures. Dans ce contexte, et même si elles montrent aussi des inconvénients éventuels, comme une certaine spécificité des systèmes enzymatiques liés à la biosynthèse et à la maturation des protéines, les plantes s’avèrent aujourd’hui une alternative de choix pour la production de plusieurs protéines recombinantes de structure complexe.
1.2. La moléculture végétale pour la production de protéines
recombinantes
La moléculture végétale (de l’anglais Plant molecular farming, ou PMF) est définie comme « [la] production de protéines recombinantes (incluant des protéines pharmaceutiques et industrielles) et autres métabolites secondaires dans les plantes. » (Obembe et al. 2011). La première protéine d’intérêt pharmaceutique exprimée dans une plante a été l’albumine de sérum humain, produite au début des années 1990 dans des lignées transgéniques de tabac et de pomme de terre (Ma et al. 2005a). Dès 1992, un vaccin expérimental contre l’hépatite B était développé, basé sur l’emploi d’antigènes de surface de ce virus, confirmant alors la faisabilité d’exprimer chez les plantes des protéines recombinantes montrant une certaine « authenticité » sur les plans de la structure et de l’activité (Ma et al. 2003). Un nombre grandissant de biopharmaceutiques recombinants produits en systèmes végétaux se retrouvent aujourd’hui sur le marché ou à différents stades d’études cliniques pour commercialisation éventuelle, incluant des vaccins, des anticorps, des protéines thérapeutiques et des polypeptides à propriétés nutraceutiques (Obembe et al. 2011). À l’échelle cellulaire, plusieurs avantages sont associés aux systèmes végétaux (Ma et al. 2005), incluant en particulier : (1) la grande similarité des systèmes membranaires dans les cellules végétales et les cellules de mammifères, qui permettent l’expression de protéines complexes quasi identiques, sinon identiques, à leur contrepartie originale; (2) la grande homologie de structure entre les chaperones végétales et celles de mammifères, qui
5 La moléculture végétale est souvent qualifiée d’économique, de pratique et de sécuritaire lorsque comparée aux systèmes d’expression utilisant des bioréacteurs à fermentation. Sur le plan économique, le Cost of goods établi en 2002 pour la production en masse de protéines recombinantes dans les végétaux transgéniques était estimé à un dixième, voire un cinquantième, des coûts associés à la fermentation bactérienne (Tiwari et al. 2009). La culture de plantes transgéniques pour la production de protéines recombinantes nécessite peu d’investissements initiaux comparativement aux systèmes d’expression utilisant des bio-réacteurs, les infrastructures agricoles nécessaires pour les cultiver sont souvent déjà en place, et la mise à l’échelle de tels systèmes est facilement envisageable (Pogue et al. 2010; Daniell et al. 2001; Karg & Kallio 2009). Des systèmes d’expression transitoire ne reposant pas sur des végétaux transgéniques et répondant plus facilement aux normes de production réglementaires de type Good Manufacturing Practices (GMP) pourront nécessiter des investissements plus importants, mais le développement rapide d’outils d’expression adaptés à ces nouveaux systèmes depuis quelques années les rend déjà viables – du moins en théorie – sur plan économique (Tiwari et al. 2009; Fischer et al. 2013; Sack et al. 2015). En somme, les nombreux arguments présentés depuis plusieurs années en faveur des systèmes d’expression végétaux suggèrent, selon plusieurs auteurs, que la moléculture végétale jouera un rôle majeur dans les années à venir pour le développement des produits biopharmaceutiques, y compris pour la production à faible coût de médicaments et de vaccins destinés aux pays en voie de développement (Pogue et al. 2010; Ma, et al. 2005b; Karg & Kallio 2009; Stoger et al. 2014).
1.3. Les espèces utilisées en moléculture végétale
En fonction des applications spécifiques envisagées, les plantes utilisées en moléculture sont catégorisées en trois groupes, à savoir (i) les cultures fruitières et légumières; (ii) les céréales et légumineuses; et (iii) les cultures à forte biomasse foliaire :
1.3.1. Les cultures fruitières et légumières
La première catégorie de plantes regroupe les hôtes végétaux destinés à être administrés oralement (Twyman et al. 2003; Ma et al. 2003; Daniell et al. 2001). Le principal avantage d’utiliser ces cultures est de ne pas dépendre des processus onéreux d’extraction et de purification des protéines recombinantes, les organes comestibles de ces plantes pouvant être consommés directement, crus ou après transformation sommaire. Les principaux produits protéiques exprimés dans ces plantes sont des vaccins, des polypeptides nutraceutiques et des anticorps pour application topique. Les espèces envisagées le plus souvent sont la pomme de terre, la tomate et la banane; une sous-catégorie inclut les plantes productrices d’huiles ou de fibres comme le lin, le coton et le colza.
1.3.2. Les céréales et les légumineuses
Les plantes du second groupe incluent des cultures céréalières comme le riz et le maïs et des légumineuses comme le soya et la luzerne, qui accumulent les protéines dans les tissus de réserve des graines. Ces produits sont déshydratés et les protéines qui y sont stockées sont peu sujettes à l’hydrolyse non enzymatique ou protéolytique (Benchabane et al. 2008). Les semences sont considérées en général comme un environnement favorable à l’accumulation des protéines et un lieu d’accumulation utile pour l’entreposage à long terme des protéines recombinantes. Des anticorps recombinants accumulés dans des graines peuvent y rester pendant trois ans à température pièce sans perdre leur activité (Twyman et al. 2003). En plus de leur état déshydraté, les graines contiennent peu de composés phénoliques et présentent des profils protéiques et lipidiques peu complexes comparativement aux feuilles, facilitant d’autant les procédures d’extraction et de purification pour l’obtention d’un produit protéique hautement purifié. L’utilisation de graines présente en revanche l’inconvénient majeur de dépendre du stade de floraison de la plante hôte et du relargage de pollen pour le processus de fertilisation. Des stratégies ont été développées pour minimiser ces contraintes (Twyman et al. 2003; Daniell et al. 2001), mais la dissémination de pollen transgénique dans l’environnement soulève toujours des craintes dans l’opinion publique (Goulet et al. 2013).
1.3.3. Les plantes à forte biomasse foliaire
Les plantes cultivées pour leurs feuilles, comme le tabac, la luzerne et le soya, peuvent subir plusieurs coupes par année sans conséquences néfastes sur leur croissance et leur développement. Il est possible, avec ces plantes, d’obtenir des rendements très élevés en biomasse, atteignant par exemple 25 tonnes/ha annuellement pour la luzerne ou plus de 100 tonnes/ha dans le cas du tabac (Daniell et al. 2001; Twyman et al. 2003; Ma et al. 2003). Ces cultures, si elles donnent des rendements impressionnants en biomasse foliaire comparativement aux plantes des deux catégories précédentes, contiennent souvent, par contre, des composés secondaires comme des phénols ou des alcaloïdes qui peuvent compliquer grandement les processus d’extraction et de purification des protéines (Menkhaus et al. 2004). Comme les protéines recombinantes sont souvent accumulées en milieu aqueux, les tissus foliaires, qui sont riches en protéases, constituent en outre un environnement peu propice à leur stabilité, et il est souvent nécessaire de refroidir ou de sécher la biomasse foliaire au moment de la récolte, avant de procéder aux étapes subséquentes de purification (Benchabane et al. 2008).
7 chloroplastique des cellules de la plante hôte, et (ii) l’expression transitoire post-transfection, qui repose sur l’expression d’un ou plusieurs transgènes intégrés aux cellules de l’hôte par un vecteur viral ou bactérien, sans intégration stable obligatoire dans le génome récepteur (Obembe et al. 2011).
1.4.1. Les plantes et cellules transgéniques
Les plantes transgéniques, dont le mode de production en champ est (par définition) identique à celui des cultures agricoles usuelles, ont été largement considérées pour la moléculture au fil des ans. Toutefois, l’emploi de lignées transgéniques pour la production de protéines présente des désavantages évidents, comme le temps requis pour leur développement et le taux d’expression souvent très faible des protéines exprimées (Schillberg et al. 2005; Rybicki 2009). L’acceptabilité mitigée des cultures transgéniques dans l’opinion publique est également problématique, notamment sur le plan environnemental, alors que le pollen de ces plantes peut – en théorie – féconder les cultures conventionnelles avoisinantes ou des espèces sauvages apparentées (Obembe et al. 2011; Goulet et al. 2013).
Des approches alternatives ont été proposées pour résoudre les limitations liées aux lignées transgéniques classiques, incluant l’emploi de cellules végétales transgéniques cultivées en bio-réacteurs et la génération de lignées transgéniques transplastomiques (Obembe et al. 2011). Le développement de lignées transplastomiques repose non pas sur la transformation du génome nucléaire comme pour les lignées transgéniques usuelles, mais plutôt sur la transformation du génome chloroplastique. Parce que les plastes végétaux sont hérités en général du parent maternel, les transgènes introduits dans l’hôte ne se retrouvent pas dans le pollen et les risques de contamination au champ sont minimes (Obembe et al. 2011). Un inconvénient majeur de cette approche, par contre, est qu’aucun processus de glycosylation ne survient dans le chloroplaste, résultat de l’origine procaryotique de cet organite et de l’absence conséquente de l’appareil enzymatique requis pour l’opérer (Rybicki 2009). Une alternative aux lignées transplastomiques, qui permet aussi un confinement des transgènes, repose sur l’emploi de cellules végétales en culture. Cette approche est utile pour la production de produits pharmaceutiques à haut niveau de pureté, mais les coûts de mise en place et de production de cette approche sont élevés, sans compter les rendements souvent très faibles en protéine recombinante en raison d’une concentration élevée en protéases dans le milieu de culture pendant la phase d’expression (Doran 2006; Mandal et al. 2014).
1.4.2. Les systèmes d’expression transitoire
Comparée aux systèmes transgéniques, l’expression transitoire post-transfection permet souvent des rendements élevés en protéine recombinante. Tel que défini par Vézina et al. (2011), l’expression transitoire tire profit de la capacité d’un vecteur viral ou microbien à « [...] infecter les cellules végétales et [y] transférer l’information génétique essentielle [à la production d’une protéine d’intérêt] sous la forme d’un fragment d’ADN
mobile jusqu’au noyau de la cellule infectée. Comme ce fragment d’ADN mobile n’est viable que quelques jours à l’intérieur du noyau et [n’est] pas intégré au sein du génome de la plante, les cellules ne sont « transformées » que transitoirement, une caractéristique qui distingue conceptuellement l’expression transitoire de la transgénèse » (Vézina et al. 2011). Cette méthode de livraison des transgènes demande peu de temps et les rendements en protéines sont en général importants (Obembe et al. 2011; Vézina et al. 2009; D’Aoust et al. 2009), des attributs qui l’ont rendue attrayante au fil des ans pour la mise au point de constructions génétiques nouvelles, pour l’étude de séquences géniques régulatrices avant la confection de nouvelles lignées transgéniques et, de plus en plus, comme plateforme d’expression pour la production de protéines d’intérêt clinique (Schillberg et al. 2005; Leuzinger et al. 2013). L’expression transitoire des protéines recombinantes, rapide, flexible et pratique, n’est pas affectée par les effets de position reconnus pour altérer de manière importante le niveau d’expression des transgènes dans les lignées transgéniques stables.
1.5. L’expression transitoire – Vecteurs viraux et bactériens
Plusieurs approches ont été développées pour l’expression transitoire de transgènes chez les végétaux. Une première approche, par infection virale, consiste à traiter la plante hôte avec un virus servant de vecteur pour la livraison du ou des gènes étrangers. L’infection virale est rapide, systémique, transmissible par inoculation mécanique et peut se propager d’une plante à l’autre, des caractéristiques qui permettent, à l’échelle industrielle, d’infecter un grand nombre de végétaux en peu de temps. Les plantes infectées par cette approche expriment en général les particules virales et les produits de son génome en grande quantité. Par exemple, un rendement en protéines recombinantes estimé à 17 % des protéines solubles a pu être obtenu avec cette méthode (Varsani et al. 2006), comparable aux rendements souvent obtenus avec les systèmes bactériens ou les levures (Obembe et al. 2011). Une caractéristique intéressante de l’approche de transfection avec des vecteurs viraux est de livrer des gènes étrangers dans la plante sans toutefois les intégrer à son génome (Obembe et al. 2011; Schillberg et al. 2005).
Une autre approche de transfection utilisée couramment pour l’expression transitoire des protéines recombinantes chez les plantes est la magnifection (Obembe et al. 2011; Rybicki 2009), pour laquelle un vecteur viral dont la couche protéique de surface a été supprimée est intégré à la bactérie Agrobacterium
tumefaciens utilisée ensuite comme véhicule bactérien non systémique. La couche de surface du virus lui
permet de voyager dans les tissus de la plante hôte, et son élimination revient alors en à restreindre la mobilité dans la plante et à confiner l’expression des transgènes dans les zones infectées. Un avantage documenté de
9 Une troisième approche de transfection –utilisée dans le cadre du présent projet– est l’infiltration agrobactérienne, ou agroinfiltration. Les gènes d’intérêt sont clonés en laboratoire dans des vecteurs plasmidiques, qui sont pour leur part ensuite transférés dans une souche désarmée du vecteur bactérien A.
tumefaciens (Fischer et al. 1999). En bref, l’agroinfiltration consiste à remplacer, sous vide, les fluides de
l’apoplaste foliaire par une suspension aqueuse contenant les bactéries transformées. Les plantes sont plongées tête première dans la suspension bactérienne, après quoi les espaces intercellulaires du tissu foliaire sont vidés sous pression pour laisser place à l’inoculum bactérien (D’Aoust et al. 2010). Une infiltration aussi invasive des bactéries dans les tissus de la plante favorise un transfert rapide et efficace de leur ADN-T dans les cellules infectées. Des protéines accessoires de la bactérie catalysent le transfert du gène d’intérêt dans la cellule hôte, qui y reste sous forme d’épisome et s’y exprime pendant quelques jours (Rybicki 2009; Obembe et al. 2011). L’approche d’agroinfiltration, développée il y a près de vingt ans par Kapila et al. (1997), est une stratégie d’expression efficace et économique pour les systèmes de production à grande échelle (Vézina et al. 2011; Leuzinger et al. 2013). Avantage non négligeable, cette approche n’est pas sujette aux délais engendrés par la régénération, la propagation et la caractérisation de lignées transgéniques. L’expression simultanée de plusieurs protéines est également permise, aussi bien pour les procédures d’infiltration sous vide que pour les procédures manuelles à plus petite échelle en laboratoire reposant sur l’emploi de seringues (D’Aoust et al. 2009).
D’autres avantages ont été décrits pour l’expression transitoire des protéines recombinantes, incluant la rapidité avec laquelle le développement d’un produit peut être envisagé. Par exemple, l’expression d’antigènes pour la production d’un vaccin antiviral peut être enclenchée dès que l’information génétique est accessible au sujet de la souche virale considérée. Le temps de développement pour une telle opération se compte en semaines, comparativement à plusieurs mois, voire plus d’une année, pour la production et la caractérisation de lignées transgéniques stables (D’Aoust et al. 2009; Tiwari et al. 2009; Ma et al. 2003). Les produits dérivés des systèmes d’expression transitoire sont, par ailleurs, de très bonne qualité, aussi bien en termes de pureté que d’activité des protéines. Pogue et al. (2010) résumaient ainsi les avantages à tirer de l’expression transitoire chez les plantes, en comparaison aux systèmes de fermentation classiques : (i) une vitesse et un coût peu élevé des manipulations génétiques pour le clonage des gènes d’intérêt; (ii) des cycles de production courts; (iii) aucune contamination possible avec des agents pathogènes humains ou de mammifères; (iv) des concentrations négligeables en endotoxines microbiennes; et (v) des coûts de production avantageux pour le processus de production considéré dans son ensemble. Les mêmes auteurs soulignaient aussi le potentiel concurrentiel de l’approche en termes de qualité des produits et de capacité à répondre rapidement à la demande en cas de besoin, notamment pour la production rapide de vaccins en situation de pandémie (Pogue et al. 2010).
1.6. Problématique de recherche
En dépit de développements scientifiques et technologiques importants ces dernières années, de l’approbation récente des premiers produits biopharmaceutiques dérivés de plantes, de la mise en place de plusieurs études cliniques aux États-Unis et en Europe, et de la commercialisation réussie d’une première protéine thérapeutique produite en système végétal (Sack et al. 2015), les connaissances actuelles sur la physiologie des plantes dans un contexte de moléculture demeurent limitées et beaucoup reste à faire pour une utilisation optimale des systèmes d’expression développés. Une plante vasculaire est un organisme complexe formé de plusieurs organes possédant, chacun, leurs caractéristiques propres. Selon leur stade de développement et leurs rôles physiologiques, les organes d’une plante montrent un profil métabolique particulier et une capacité variable à synthétiser et accumuler des protéines. Il est bien documenté, par exemple, que les activités protéolytiques varient avec l’âge des feuilles chez plusieurs plantes –dont le tabac et ses cousines sauvages, associées notamment au recyclage et à la remobilisation des métabolites dans les tissus âgés en direction des tissus plus jeunes (Robert et al. 2013; Stevens et al. 2000).
Dans un contexte de moléculture, il a été rapporté récemment que le rendement final d’un anticorps recombinant exprimé transitoirement dans les feuilles du tabac sauvage Nicotiana benthamiana diminuait avec l’âge foliaire (Robert et al. 2013). La même étude rapportait que les feuilles les plus âgées sur la tige primaire, bien que constituant plus de 30 % de la biomasse totale, n’expliquaient qu’une faible proportion du rendement en anticorps à l’échelle de la plante. Des conclusions similaires étaient formulées auparavant par Stevens et al. (2000), qui rapportaient des rendements en anticorps recombinant diminuant avec l’âge des feuilles dans des lignées de tabac transgénique exprimant cette protéine de manière constitutive. Considérant, d’une part, cette caractéristique bien documentée des plantes à donner des rendements en protéines recombinantes en fonction de l’âge métabolique de leurs organes; et, d’autre part, la littérature scientifique peu étoffée sur l’impact des conditions de culture dans un contexte de moléculture végétale, il apparaissait pertinent, dans le cadre de ce projet, d’établir dans quelle mesure des facteurs culturaux de base comme l’intensité lumineuse ou la qualité spectrale des éclairages d’appoint pendant la phase de croissance pouvaient influencer le rendement en protéines recombinantes dans la plante entière ou dans ses différentes parties.
1.6.1. Influence de la température et de l’intensité lumineuse en contexte de
moléculture végétale
11 température dans leurs lignées transgéniques sur l’expression d’un anticorps ou celle de cyanoviridines-N. Cette dernière étude rapportait au contraire un rendement deux fois plus élevé en anticorps dans des plantes cultivées à une température diurne de 23C, comparativement au rendement observé dans des plantes maintenues à 32C.
L’influence de l’intensité lumineuse en moléculture a été étudiée brièvement dans quelques études. Stevens et al. (2000), dans leur article sur la température, rapportaient en outre que leurs lignées transgéniques de tabac exposées à une intensité lumineuse totale de 275 mol/m2.s produisaient plus de biomasse, plus de protéines
solubles et plus d’anticorps recombinant que des plantes de la même lignée exposées à une intensité totale de 75 mol/m2.s. L’étude de Colgan et al. (2010), qui s’intéressait aussi à la lumière, confirmait les
conclusions de Stevens et al. (2000) sur l’effet positif d’une intensité lumineuse accrue pour les variables
biomasse et protéines solubles, mais n’observaient aucune augmentation significative du rendement en
anticorps recombinant. Il importe de noter toutefois que les auteurs, dans cette dernière étude, utilisaient comme base comparative une luminosité qualifiée d’« ambiante » mais non définie spécifiquement, et qu’il est par conséquent difficile de tirer des conclusions formelles sur les données présentées. De même, Kotakis et al. (2010) rapportaient un effet positif de la luminosité sur la croissance de lignées transgéniques du tabac sauvage N. benthamiana exprimant le polypeptide régulateur hairpin for Nib gene fragment from ppy, mais l’absence de données sur le rendement en protéine recombinante dans les feuilles rend difficile la formulation de conclusions définitives sur cette étude. Une augmentation de la teneur en ARN interférants (RNAi) sous de plus fortes quantités de lumière suggérait néanmoins une forme de « réponse au stress » dans la plante modifiée et un effet significatif possible de la luminosité sur l’expression du transgène (Kotakis et al. 2010).
1.6.2. Influence du spectre lumineux sur la croissance des plantes
Si très peu d’études ont été publiées jusqu’ici sur l’impact de l’intensité lumineuse en moléculture végétale (v. ci-dessus), aucune étude n’a encore été publiée, à notre connaissance, sur l’influence éventuelle de la qualité spectrale des lampes utilisées. Malgré l’absence de données, il apparaît plausible que l’utilisation d’un éclairage à spectre lumineux particulier, fourni par exemple par des électrodes électroluminescentes (LED, de l’anglais : DEL), pourrait avoir une influence sur la croissance des plantes-usines, avec un effet éventuel sur l’expression des protéines. De même, il est plausible qu’un éclairage intercalaire en complément à l’éclairage de base appliqué au-dessus du couvert végétal puisse influencer les rendements en biomasse et en protéine recombinante, en favorisant par exemple un taux de photosynthèse accru dans les feuilles ombragées. Un éclairage de type DEL est mieux adapté à la croissance des plantes que des lampes fluorescentes standards (Darko et al. 2014; Gautam 2012; Ménard et al. 2006), en plus de répondre aux besoins d’économie d’énergie, de flexibilité, de fiabilité et de facilité d’utilisation exprimés par l’industrie serricole (Darko et al.
2014). Des articles ont rapporté, notamment, les bienfaits d’une lumière bleue sur les plantes en croissance, qui favoriserait la biosynthèse de chlorophylle, l’ouverture des stomates, la photomorphogenèse et la synthèse d’enzymes diverses. Une élongation accrue des tiges et une augmentation de la biomasse sèche ont été observées à plus d’une reprise sur des plantes soumises à un éclairage enrichi de photons bleus (Gautam 2012; Ménard et al. 2006; Yorio et al. 2001). La lumière bleue favorise l’ouverture des stomates en stimulant la turgescence des cellules de garde (Kotiranta 2013), et qu’une entrée facilitée du CO2 par les ostioles
augmente le taux de photosynthèse nette dans la plante. En concordance avec ces observations, des études ont rapporté que l’activité photosynthétique est augmentée dans les feuilles par l’utilisation d’un éclairage rouge complémenté de lumière bleue (Darko et al. 2014; Hogewoning et al. 2010). Une quantité minimale de lumière bleue, de l’ordre de 20 à 30 mol/m2.s selon l’espèce, est favorable au maintien d’une morphologie et
d’une croissance optimales des plantes cultivées en serre (Yorio et al. 2001).
L’utilisation de lumière rouge dans l’éclairage des plantes en serre est tout aussi importante, en raison notamment de l’absorption photonique marquée dans cette partie du spectre lumineux par la chlorophylle. Gautam (2012) rapportait en outre que l’utilisation d’un éclairage d’appoint composé uniquement de lumière rouge supprimait l’élongation des tiges du pétunia (Petunia x hybrida cv. Tidal Wave et Mambo Formula Mixture), alors que des éclairages montrant un ratio rouge/rouge lointain élevé compromettaient la dominance apicale, favorisaient l’expression de chlorophylle par un effet régulateur sur le phytochrome, et induisaient la formation de tiges axillaires. La qualité spectrale de la lumière blanche aurait aussi un effet significatif sur la croissance des plantes. Yorio et al. (2001) rapportaient par exemple que 21 jours après la plantation, des plants de laitue, d’épinard et de radis soumis à un éclairage blanc montraient un taux de photosynthèse, une conductance stomatique et une biomasse sèche plus élevés que des plants soumis à un éclairage rouge de type DEL complémenté de lumière bleue.
13
1.7. Hypothèses et objectifs du projet de recherche
Sur la base des données disponibles et manquantes au sujet de l’impact du facteur lumière sur la croissance et le rendement des plantes utilisées en moléculture, deux hypothèses majeures et un ensemble de sous-hypothèses complémentaires ont été testées dans le cadre du présent projet, à l’effet que :
1) Le rendement en protéine recombinante3 exprimée transitoirement dans les feuilles du N. benthamiana4
est influencé par le patron de développement – ou la topologie – de la plante.
a) Les feuilles situées sur les tiges secondaires, plus jeunes d’un point de vue physiologique que les feuilles correspondantes sur la tige principale, ont un impact relatif important sur le rendement en antigène H1.
b) Les feuilles des tiges secondaires, malgré un gradient d’âge moins marqué, montrent un rendement en antigène H1 influencé par leur position respective sur la tige.
2) Le rendement en protéine recombinante exprimée transitoirement chez N. benthamiana est influencé par le régime lumineux appliqué a priori, durant la phase de croissance de la plante.
a) Une intensité lumineuse élevée pendant la croissance augmente le rendement total en antigène H1. b) L’utilisation de luminaires avec DEL bleues et rouges au-dessus de la canopée influence à la hausse
le rendement en antigène H1, comparativement à un traitement de lumière blanche.
3L’hémagglutinine H1 du virus de l’influenza a été utilisée comme protéine modèle dans le cadre de ce projet. Cette
protéine constituante de l’enveloppe externe du virus pathogène est utilisée par notre partenaire Medicago inc. pour la production de vaccins contre la grippe (D’Aoust et al. 2010). L’antigène H1 exprimé chez les végétaux a pour particularité de produire des particules pseudo-virales (de l’anglais Virus-like particles, ou VLP’s) pendant son transit dans les cellules foliaires. Les VLP’s sont des particules non infectieuses, sans matériel génétique, qui ressemblent sur le plan de la structure à l’enveloppe externe du virus d’origine. Les VLP’s produites à partir de plantes induisent une forte réponse immunitaire chez l’individu vacciné et représentent une alternative réaliste aux vaccins conventionnels produits par des approches souvent plus onéreuses en temps.
4 Le tabac sauvage Nicotiana benthamiana, originaire d’Australie, a été utilisé comme hôte d’expression pour le présent
projet. L’uniformité génétique de cette plante et sa grande sensibilité aux infections virales en ont fait un modèle de choix depuis une quinzaine d’années pour l’étude des interactions plante-pathogène (Goodin et al. 2008). Des progrès techniques importants développés pour cette plante, incluant notamment l’approche d’agroinfiltration, en ont fait aussi un véhicule performant pour l’expression hétérologue de protéines recombinantes (Leuzinger et al. 2013).
c) Un traitement lumineux enrichi en lumière bleue, fournie par des lampes HPS et MH, a un impact positif sur le rendement en antigène H1.
d) Un éclairage intercalaire de type DEL bleu:rouge utilisé en complément aux lampes placées au-dessus de la canopée durant la phase de croissance a un effet positif le rendement en antigène H1 dans les feuilles les plus âgées.
Quatre grands objectifs de recherche ont été poursuivis pour tester ces hypothèses :
. Objectif 1 Élaborer une cartographie d’accumulation pour l’antigène H1 exprimé transitoirement chez
N. benthamiana, en fonction de la topographie générale de la plante.
. Objectif 2 Comparer le rendement en antigène H1 dans des plantes exposées pendant leur croissance à différentes intensités lumineuses.
. Objectif 3 Comparer le rendement en antigène H1 dans des plantes exposées pendant leur croissance à des luminaires de type DEL à ratios bleu:rouge de 0,13 ou de 0,28, ou à un éclairage à ratio bleu:rouge total de 0,42 fourni par des lampes HPS et MH.
. Objectif 4 Évaluer le rendement en antigène H1 dans des plantes exposées pendant leur croissance à des lumières intercalaires utilisées en complément à un éclairage standard au-dessus du couvert végétal.
15
2. Résultats
Les travaux du projet se sont déroulés en deux phases. Une première phase abordait l’influence du régime lumineux en période de croissance sur la production de biomasse par la plante hôte et sur sa capacité à accumuler ensuite l’antigène H1, en relation avec son patron de développement (Section 2.1). La deuxième phase visait à expliquer en termes métaboliques les différences de rendement éventuellement observées d’un organe foliaire à l’autre dans la plante, par un suivi des transcrits d’ARNm pour l’antigène H1 et une analyse comparative des « charges protéasiques » dans les feuilles en fonction de leur position sur la plante (Section 2.2).
2.1. Phase 1 : Influence du régime lumineux sur la production
de biomasse et d’antigène H1 dans les feuilles
Les régimes lumineux évalués, au nombre de huit, étaient divisés en deux catégories définies, d’une part, par la nature des traitements lumineux appliqués et, d’autre part, par la quantité de lumière fournie au couvert végétal. Sur le plan qualitatif, les traitements lumineux étaient au nombre de quatre, à savoir (1) un éclairage avec des lampes HPS et MH présentant un ratio lumineux bleu:rouge de 0,42; (2) un éclairage avec des lampes HPS et MH à ratio bleu:rouge de 0,42, complémenté d’un éclairage intercalaire; (3) un éclairage avec des lampes de type DEL à ratio bleu:rouge de 0,13, complémenté d’un éclairage intercalaire; et (4) un éclairage avec des lampes de type DEL à ratio bleu:rouge de 0,28, complémenté d’un éclairage intercalaire (v.
Chapitre 5 pour les détails techniques). Sur le plan quantitatif, deux densités de flux photonique
photosynthétique (ou DFPP) ont été testées pour chaque traitement lumineux, à raison de (1) 175 mol/m2.s
(intensité lumineuse « modérée »); et de (2) 350 mol/m2.s (intensité lumineuse « élevée »).
Pour la récolte et l’interprétation ultérieure des données, les plants ont été divisés en « unités productrices », définies selon l’origine des feuilles en cours de développement (tige principale [unités P] vs tiges secondaires [unités S]) et leur position relative sur la tige (unités 1 : jeunes feuilles, à proximité des apex caulinaires;
unités 2 : feuilles parvenues à la maturité [ou adultes], situées au milieu des tiges; et unités 3 : feuilles plus
âgées, à la base des tiges). La nomenclature adoptée dans le présent document réfère à la fois à l’origine des tiges et à la position des feuilles sur ces tiges. Ainsi, six unités productrices désignées P1, P2, P3, S1, S2 et
S3 ont été étudiées de manière systématique au cours des travaux, référant respectivement aux feuilles
jeunes (P1), adultes (P2) et plus âgées (P3) de la tige principale, et aux feuilles jeunes (S1), adultes (S2) et plus âgées (S3) des tiges secondaires émergées de l’aisselle des feuilles principales P (v. Figure 2.1, page suivante). Pour l’ensemble des plantes, la masse de chaque unité productrice a été mesurée après incubation, c’est-à-dire au moment de la récolte (g), et la biomasse foliaire totale de chaque plante estimée en
additionnant la masse des six unités productrices. Le rendement en antigène H1 fonctionnel dans chaque unité productrice a été évalué par un test d’hémagglutination en laboratoire, tel que décrit au Chapitre 5.
Figure 2.1 Représentation schématique des unités de production foliaires du N. benthamiana, tel que défini dans le cadre du présent projet.5
Afin de respecter les postulats statistiques d’homogénéité de la variance et de normalité des résidus, les tests statistiques réalisés pour comparer les moyennes des traitements ont été faits après transformation des données originales. Les tests statistiques pour la biomasse foliaire ont été faits sur la racine carrée des données originales, les tests statistiques pour les données d’hémagglutination sur le logarithme des données originales. Les rendements en antigène H1 sont rapportés, dans les prochains paragraphes, sur une base pondérale (par g de tissu foliaire) ou sur une base de rendement total à l’échelle des unités productrices ou de la plante entière (en g).
2.1.1. Production de biomasse et d’antigène H1 en fonction des unités
productrices
2.1.1.1. Production de biomasse foliaire
Des analyses ont été faites au départ afin d’établir l’importance relative des six unités productrices en termes de biomasse foliaire sur la plante (Tableau 2.1). En bref, les unités productrices P3 et S3, correspondant aux feuilles plus âgées sur la tige principale et les tiges secondaires, ont montré une biomasse foliaire importante en comparaison aux autres unités productrices, suivies des feuilles adultes de la tige principale (unité P2), des
17
Tableau 2.1 Biomasse foliaire des unités productrices P1, P2, P3, S1, S2 et S3. Les moyennes présentées, en g par unité productrice, étaient significativement différentes, tel qu’établi par une ANOVA effectuée sur la racine carrée des données originales avec une valeur seuil de 0,05. Les moyennes suivies d’une même lettre ne sont pas significativement différentes.
Unité
productrice Moyenne du traitement Erreur type de la moyenne
S3 11,7 0,5 A P3 11,2 0,5 A P2 8,0 0,3 B P1 2,9 0,1 C S2 2,8 0,2 C S1 2,2 0,2 D
2.1.1.2. Teneur pondérale en antigène H1
Les rendements en antigène H1, déterminés au laboratoire par des tests d’hémagglutination, ont été calculés sur une base pondérale (i.e. en unités par g de biomasse foliaire observée après incubation) pour évaluer la capacité unitaire de production des six unités productrices (Tableau 2.2). En bref, les jeunes feuilles de la tige principale et des tiges secondaires (unités P1 et S1) ont produit les taux les plus élevés d’antigène recombinant, suivies des feuilles adultes (unités P2 et S2) puis, à des taux beaucoup plus faibles, des feuilles les plus âgées (unités P3 et S3).
Tableau 2.2 Teneur pondérale en antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3. Les moyennes présentées, en unités par g de feuille, étaient significativement différentes, tel qu’établi par une ANOVA effectuée sur le logarithme des données originales avec une valeur seuil de 0,05. Les moyennes suivies d’une même lettre ne sont pas significativement différentes.
Unité
productrice Moyenne du traitement Erreur type de la moyenne P1 605798 55544 A S1 345958 30234 B P2 231629 20458 C S2 220864 19280 C S3 135117 11802 D P3 27608 4177 E
2.1.1.3. Teneur globale en antigène H1
Considérant les taux de biomasse et de rendement pondéral présentés ci-dessus, le rendement total en antigène H1 dans la plante une semaine après agroinfiltration a pu être déterminé pour les six unités productrices (Tableau 2.3). En bref, les unités P1, P2 et S3 ont été les plus grandes productrices d’antigène
dans la plante, suivies des unités S1 et S2. L’unité P3, importante sur le plan de la biomasse (Tableau 2.1), mais peu efficace à produire l’antigène (Tableau 2.2), s’est avérée peu importante pour le rendement global à l’échelle de la plante.
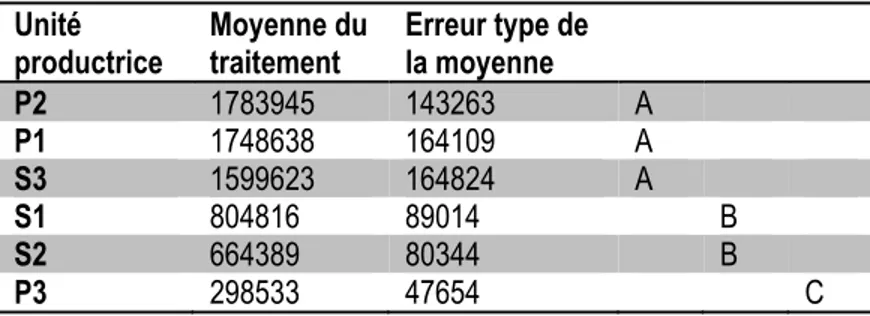
Tableau 2.3 Quantité totale d’antigène H1 dans les unités productrices P1, P2, P3, S1, S2 et S3. Les moyennes présentées, en unités hémagglutinine par unité productrice, étaient significativement différentes, tel qu’établi par une ANOVA effectuée sur le logarithme des données originales avec une valeur seuil de 0,05. Les moyennes suivies d’une même lettre ne sont pas significativement différentes.
Unité
productrice Moyenne du traitement Erreur type de la moyenne P2 1783945 143263 A P1 1748638 164109 A S3 1599623 164824 A S1 804816 89014 B S2 664389 80344 B P3 298533 47654 C
19
2.1.2. Effet de l’intensité lumineuse sur la biomasse foliaire et la production
d’antigène H1
2.1.2.1. Effet sur la biomasse foliaire
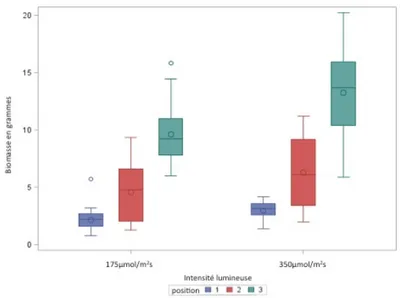
L’impact de l’intensité lumineuse sur la production de biomasse foliaire a été évalué pour les six unités de production considérées (Figure 2.2).6 Peu importe l’origine des feuilles ou leur position sur la tige, nos
données suggèrent l’effet positif d’une DFPP de 350 mol/m2.s sur la production de tissus foliaires, en
comparaison à une DFPP plus faible (ou modérée) de 175 mol/m2.s.7
Figure 2.2 Influence d’intensités lumineuses modérée (1 : 175 mol/m2.s) et élevée (2 : 350 mol/m2.s) sur la
production de biomasse en fonction de l’âge des feuilles (1, en bleu : jeunes feuilles; 2, en rouge : feuilles adultes; 3, en vert : feuilles plus âgées). Les moyennes présentées, en g de masse fraîche, étaient significativement différentes, tel qu’établi par une ANOVA effectuée sur la racine carrée des données originales avec une valeur seuil de 0,05.
6Plusieurs figures de ce mémoire illustrent les données sous la forme d’un « diagramme en boîte » (de l’anglais
box plot), ou « diagramme à moustaches ». Ce mode de représentation décrit visuellement la répartition des données en fonction des différents quartiles. Le rectangle (ou boîte) s’étend du premier au troisième quartile, avec au centre une ligne identifiant la médiane (ou second quartile). La moyenne des données est représentée par un cercle situé le plus souvent au sein du rectangle. Les lignes verticales (ou « moustaches »), à ne pas confondre avec des écarts-types, s’étendent jusqu’à une valeur distante d’au maximum 1,5 fois la distance interquartiles. Les cercles parfois observés en haut ou en bas des moustaches réfèrent aux données aberrantes. La représentation des données sous forme de box plots a été proposée en 1977 par le statisticien américain John Wilder Tukey (1915–2000).