Impact de l’ajout de polysaccharides dans des
matrices laitières gélifiées acides sur la digestion
gastro-intestinale des protéines et des réponses
métaboliques associées
Thèse
Laure Rinaldi
Doctorat en Sciences et technologie des aliments -
Philosophiae Doctor (PhD)
Québec, Canada
Résumé
Les nutriments des matrices alimentaires doivent être bioaccessibles puis biodisponibles pour atteindre les organes vitaux et être métabolisés. Les protéines laitières (caséines et protéines de lactosérum) ont une valeur nutritionnelle importante par leur composition en acides aminés (AA) essentiels et en acides aminés branchés qui ont un impact sur plusieurs réponses métaboliques postprandiales. Ces protéines ont aussi un rôle technologique essentiel dans le processus de fabrication des yogourts. Des polysaccharides (PS) peuvent être ajoutés dans les yogourts pour les stabiliser. Des études précédentes ont montré que des amidons, des pectines (PS communs utilisés par les industriels laitiers) et des β-glucans (stabilisants d‘intérêt comme fibre soluble) pouvaient moduler la digestion des protéines (in vitro et in vivo) et certaines réponses métaboliques postprandiales. Un modèle de digestion gastro-intestinale (GI) in vitro a été mis au point pour analyser la digestion des protéines laitières de yogourts standardisés variant par leur composition en PS (sans PS, 0.75 % d‘amidon, 0.4 % de β-glucan, 0.2 % de pectine). Les formulations ont montré des viscosités différentes dans des conditions de cisaillement contrôlées représentant les conditions GI. La bioaccessibilité des AA a été différente selon le PS ajouté et il n‘y avait pas de corrélation avec la viscosité du yogourt. Une étude in vivo chez l‘animal réalisée avec les mêmes yogourts a aussi montré un impact de l‘ajout de PS de nature différente sur la biodisponibilité de certains AA et sur certaines réponses métaboliques. En particulier, l‘ajout d‘amidon, par rapport au yogourt sans PS, a significativement diminué la vidange gastrique et la concentration plasmatique de Phe, un AA associé à l‘incidence du diabète de type 2. Quinze minutes après l‘ingestion du yogourt avec β-glucan, la glycémie a significativement diminué et la clairance à l‘insuline a augmenté par rapport aux autres yogourts. Ces résultats ont permis de mettre en évidence l‘intérêt d‘étudier l‘impact de la composition de la matrice alimentaire sur son intégrité et sur la cinétique de libération des nutriments azotés dans l‘appareil GI, et sur des réponses métaboliques associées pouvant ici être bénéfiques aux diabétiques.
Abstract
Nutrients of food matrixes have to be bioaccessible and bioavailable to reach vital organs and be metabolized. Dairy proteins (caseins and whey proteins) possess an important nutritional value because of their high content in essential and branched amino acids (AA) affecting postprandial metabolic responses. These proteins have an essential technical function in yogurt process. Polysaccharides (PS) can be added in yogurts as stabilizers. Previous studies showed that starches, pectins (common PS used by the dairy industry), and β-glucans (stabilizers of interest as soluble fiber) modulated protein digestion (in vitro and in vivo) and postprandial metabolic responses. An in vitro gastrointestinal (GI) model was developed to analyze protein digestion in standardized dairy products with different PS composition (without PS, starch 0.75%, β-glucan 0.4%, pectin 0.2%). The formulations showed different viscosities under controlled shear representative to GI conditions. AA bioaccessibility was different depending on the added PS but was not related to the yogurt viscosity. The in vivo study, realised with animal model, using the same yogurts showed different impact of added PS on AA bioavailability and on metabolic responses. In particular, in comparison to the control yogurt the starch supplementation decreased significantly the gastric emptying and the plasmatic Phe concentration, an AA associated with incidence of type 2 diabetes. Fifteen minutes after yogurt with β-glucan consumption, glycemia decreased significantly and insulin clairance increased in comparison to other yogurts. These results show the interest to study the impact of food matrix composition on matrix integrity and on release kinetics of nitrogenous nutrients in GI tractus, and on associated metabolic responses here beneficial for diabetic subjects.
Parce que « La vie ne réside pas dans les molécules mais dans les liens qui les unissent » dixit Linus Pauling, cette thèse est pour tous ceux qui croient en l’importance des liens entre les gens
Remerciements
Tout d‘abord je souhaiterai remercier ma directrice, Sylvie Turgeon, pour m‘avoir acceptée dans son équipe de recherche et m‘avoir fait confiance en m‘accordant de travailler sur mon projet de doctorat. Je la remercie de son support et ses encouragements pendant quatre ans, et surtout je la remercie de son écoute. Elle m‘a appris à devenir une chercheure, et en particulier à toujours remettre les choses dans leur contexte. Je lui dois en particulier l‘aptitude du travail de dernière minute fait de façon efficace en gardant un fort esprit critique. Enfin l‘optimisme de ma directrice m‘a aidée à affronter les moments difficiles de ce doctorat.
Je remercie mon co-directeur, Michel Britten, pour son soutien et ses commentaires toujours très pertinents. Le fait de ne pas se voir souvent et de faire des comptes-rendus de longue date ont permis d‘apporter un regard quasi-extérieur à ce projet avec une expertise de qualité. Je le remercie grandement pour les nombreux échanges de courriels durant le dernier été. D‘autres remerciements vont à Sylvie Gauthier. Je souhaite la remercier pour m‘avoir initiée à la recherche quelques mois avant mon doctorat et de m‘avoir soutenue pour commencer cette belle aventure d‘étudiante au doctorat. Je la remercie aussi pour m‘avoir fortement conseillée avec sa grande expertise de l‘hydrolyse protéique tout au long du projet et d‘avoir fait la pré-lecture de cette thèse. L‗écoute et le temps qu‘elle a pris pour me permettre d‘avancer ce projet en bonne réflexion ont aussi été précieux.
Je voudrai aussi remercier les professionnels de recherche de l‘INAF, et en particulier Diane Gagnon, Ronan Corcuff, et Alain Gaudreau. L‘aide de Diane au laboratoire, ainsi que ses trouvailles mises au point pour résoudre des petits problèmes mécaniques qui font arrêter une expérimentation ont toujours été appréciées. Je la remercie aussi pour les discussions à 7h30 du matin lorsque j‘étais seule au laboratoire, et bien sûr merci pour les échanges culinaires.
Je tiens à remercier l‘équipe d‘André Marette de l‘Hôpital Laval, sans qui l‘étude in vivo de ce projet n‘aurait pas pu avoir lieu. Je remercie en particulier Geneviève Pilon pour avoir
orchestré ce projet animal avec les différents techniciens et professionnels de recherche Patricia Pelletier, Bruno Marcotte, et Philippe St-Pierre.
Je dis un grand merci à mon équipe de recherche. Le retour de Laurie-Ève Rioux dans cette équipe m‘a permis d‘enrichir mes réflexions sur le déroulement des tâches afin de terminer le projet. Je remercie aussi Laurie-Ève pour ses conseils d‘écriture, statistiques, etc. Bien sûr je n‘oublie pas les autres, et en particulier Karen Vallverdu-Spitz pour sa bonne humeur au laboratoire et d‘avoir été mon amie dès mon arrivée à Québec.
Je terminerai par remercier ma famille et mes amis. Mes parents qui ont toujours été là pour m‘écouter et m‘encourager, merci. Je dis un merci spécial à mon (jeune) frère Nicolas pour tous les échanges outre-Atlantique à parler de tout et de rien, et de s‘être intéressé à ma vie Québécoise personnelle et professionnelle pendant ces quatre ans. Béatrice, Bertrand, Camille, Jean-Loup, Jérémie, Maïa, Maxime, Nellie, Samir, Samuel, Sophie et Virginie je vous remercie pour les bons moments passés hors du labo à s‘amuser, rigoler mais aussi pour vos conseils et votre écoute. Je remercie, mes amis connus en France qui ont su m‘écouter et me soutenir même en étant à 5 000 km ou plus de moi.
Avant-Propos
Les travaux de cette thèse ont fait partie d‘un projet de recherche financé par le Fonds Québécois de la Recherche sur la Nature et les Technologies (FQRNT), Novalait Inc., le Ministère de l‘Agriculture, des Pêcheries et de l‘Alimentation du Québec (MAPAQ), et Agriculture et Agroalimentaire Canada (AAC).
Cette thèse a été rédigée sous forme d‘articles scientifiques. Le premier chapitre, intitulé « Revue de littérature », est une revue de la composition et des propriétés nutritionnelles du lait, des caractéristiques structurales et nutritionnelles de certains polysaccharides (PS), de la transformation du lait en produits gélifiés acides, et de l‘importance de l‘étude de la matrice alimentaire lors de la digestion gastro-intestinale (GI) des protéines laitières in vitro et in vivo.
Le deuxième chapitre, intitulé « In vitro gastrointestinal digestion of liquid and semi-liquid dairy matrixes », est un article qui sera soumis au journal Food digestion. Ce chapitre porte sur la mise au point d‘un modèle de digestion GI pour suivre la digestion des protéines de matrices laitières liquides et semi-liquides. J‘ai contribué à ce travail en réalisant toutes les manipulations au laboratoire et en rédigeant entièrement l‘article. Sylvie Turgeon, Michel Britten, et Sylvie Gauthier ont apporté leur soutien scientifique dans les décisions expérimentales et lors de la rédaction de l‘article.
Le troisième chapitre, « In vitro bioaccessibility of peptides and amino acids from yogurt made with starch, pectin, or β-glucan», est un article qui sera soumis à The Journal of Nutrition. Ce chapitre porte sur la digestion GI in vitro des protéines de yogourts contenants différents stabilisants (PS). J‘ai contribué à ce travail en réalisant la majorité des manipulations (production des yogourts, digestions, analyses des produits de digestion) au laboratoire et en rédigeant entièrement l‘article. Une partie de la production des yogourts et les digestions correspondantes ont été réalisées par Émilie Turcotte, stagiaire au baccalauréat que j‘ai encadrée pendant 6 mois. Sylvie Turgeon et Michel Britten ont apporté leur soutien scientifique dans les décisions expérimentales et lors de la rédaction de l‘article.
Le quatrième chapitre, intitulé «Use of polysaccharides in yogurt formulation: impact on glycemia, insulinemia, incretin secretion, and free amino acids in rats», est un article qui sera soumis à The Journal of Nutrition. Ce chapitre porte sur l‘impact de la composition en PS de yogourts sur la biodisponibilité des acides aminés et les réponses métaboliques associées. Le gavage des rats a été fait par l‘équipe d‘André Marette au CRCHUQ, centre de recherche du centre hospitalier universitaire de Québec (Québec, Canada). Sous la supervision et avec l‘aide de Patricia Pelletier, j‘ai effectué les dosages d‘insuline et du C-peptide. Les dosages d‘incrétines ont été effectués par Bruno Marcotte, technicien de l‘équipe d‘André Marette. Avec les conseils de Philippe St-Pierre pour l‘utilisation du logiciel de statistiques Sigma-Plot, j‘ai opéré cette partie analytique du 4ème chapitre. Sylvie Turgeon, Michel Britten, Geneviève Pilon, Philippe St-Pierre et André Marette ont apporté leur soutien scientifique dans les décisions expérimentales et lors de la rédaction de l‘article.
Table des matières
Résumé ... iii
Abstract ... v
Remerciements ... ix
Avant-Propos ... xi
Table des matières ... xiii
Liste des tableaux ... xvii
Liste des figures ... xix
Liste des abréviations ... xxi
Introduction générale ... 1
Chapitre I : Revue de littérature ... 5
1.1 Le lait ... 6
1.1.1 La composition du lait ... 6
1.1.2 Les protéines du lait ... 6
1.1.2.1 Les caséines ... 6
1.1.2.2 Les protéines du lactosérum ... 10
1.1.3 Le lait, ingrédient d‘aliments de structures variées ... 12
1.1.4 L‘impact de la composition et de l‘organisation structurale des nutriments du lait et des produits laitiers sur leurs propriétés nutritionnelles ... 13
1.1.5 Les peptides bioactifs et les acides aminés marqueurs de réponses métaboliques du lait et des produits laitiers ... 14
1.2 Le yogourt ... 15
1.2.1 La préparation des gels acides ... 15
1.2.1.1 La standardisation de la préparation laitière ... 17
1.2.1.2 L‘homogénéisation de la préparation laitière ... 17
1.2.1.3 Le traitement thermique ... 18
1.2.1.4 La fermentation lactique ... 18
1.2.1.5 Le conditionnement et le stockage ... 19
1.2.2 Les propriétés rhéologiques des gels ... 19
1.2.3 Les facteurs influençant les propriétés rhéologiques des yogourts ... 20
1.2.3.1 Les caractéristiques du mélange laitier ... 20
1.2.3.2 L‘influence des procédés de fabrication ... 21
1.2.3.3 Les agents stabilisants utilisés dans les yogourts ... 22
1.3 Les polysaccharides ... 22
1.3.1 Les caractéristiques structurales et physico-chimiques de l‘amidon, de la pectine et du β-glucan ... 23
1.3.1.1 L‘amidon ... 23
1.3.1.2 La pectine ... 26
1.3.1.3 Le β-glucan ... 28
1.3.2 L‘impact nutritionnel de l‘amidon, de la pectine et du β-glucan ... 30
1.3.2.1 L‘amidon ... 30
1.3.2.2 La pectine ... 31
1.3.2.3 Le β-glucan ... 32
1.4.1 Les caractéristiques mécaniques et sécrétrices de la digestion gastro-intestinale 34
1.4.1.1 Les caractéristiques de la digestion buccale ... 34
1.4.1.2 Les caractéristiques de la digestion gastrique ... 35
1.4.1.3 Les caractéristiques de la digestion intestinale ... 37
1.4.2 La digestion enzymatique des nutriments essentiels ... 38
1.4.2.1 La digestion enzymatique des glucides ... 38
1.4.2.2 La digestion enzymatique des lipides ... 39
1.4.2.3 La digestion enzymatique des protéines ... 39
1.4.3 L‘absorption des produits de digestion des nutriments essentiels ... 40
1.4.3.1 L‘absorption des monosaccharides ... 40
1.4.3.2 L‘absorption des acides gras ... 41
1.4.3.3 L‘absorption des tri/di-peptides et des acides aminés ... 41
1.4.4 L‘importance de l‘étude de la digestion protéique ... 41
1.4.5 L‘impact de la microstructure de l‘aliment et de la matrice alimentaire sur la bioaccessibilité et la biodisponibilité des nutriments ... 43
1.4.5.1 L‘impact de la microstructure de l‘aliment ... 43
1.4.5.2 L‘impact de la matrice alimentaire ... 44
1.4.6 L‘impact de la structure physico-chimique des nutriments et des procédés technologiques lors du processus de fabrication des aliments sur la bioaccessibilité et la biodisponibilité des nutriments ... 45
1.4.6.1 L‘impact de la structure physico-chimique des nutriments ... 45
1.4.6.2 L‘impact des procédés technologiques ... 46
1.4.7 La digestion in vitro des protéines ... 47
1.5 Les réponses métaboliques suite à la digestion gastro-intestinale ... 50
1.5.1 La réponse glycémique ... 50
1.5.2 La réponse insulinémique ... 51
1.5.3 La production de C-peptide ... 56
1.5.4 La production de glucagon ... 56
1.5.5 La production des incrétines ... 58
1.5.5.1 Le glucose-dependant insulinotropic polypeptide (GIP) ... 59
1.5.5.2 Le glucagon-like peptide 1 (GLP1) ... 60
1.5.5.3 La ghréline ... 62
1.5.5.4 Le peptide tyrosine-tyrosine (PYY) ... 64
1.5.5.5 Le polypeptide pancréatique (PP) ... 66
Hypothèse et objectifs ... 69
Chapitre II : In vitro gastrointestinal digestion of liquid and semi-liquid dairy matrixes .... 71
2.1 Résumé ... 72
2.2 Abstract ... 73
2.3 Introduction ... 74
2.4 Materials and methods ... 76
2.4.1 Reagents and enzymes ... 76
2.4.2 Commercial milks and yogurt ... 77
2.4.3 In vitro GI digestion ... 77
2.4.4 Chemical analysis ... 81
2.4.5 Statistical analysis ... 82
2.5.1 Soluble proteins during in vitro GI digestion of dairy matrixes ... 83
2.5.2 Protein profiles during in vitro GI digestion of dairy matrixes ... 85
2.5.3 Free amino acids release during in vitro GI digestion of dairy matrixes ... 89
2.6 Conclusion ... 92
2.7 Acknowledgement ... 92
Chapitre III : In vitro bioaccessibility of peptides and amino acids from yogurt made with starch, pectin, or β-glucan ... 93
3.1 Résumé ... 94
3.2 Abstract ... 95
3.3 Introduction ... 96
3.4 Materials and methods ... 98
3.4.1 Reagents, chemicals and enzymes ... 98
3.4.2 Powders for yogurt manufacturing ... 98
3.4.3 Preparation of yogurts ... 99
3.4.4 Yogurt viscosity determination ... 100
3.4.5 In vitro GI digestion model ... 100
3.4.6 Total soluble protein content of digested samples ... 101
3.4.7 Characterization of soluble protein profile of yogurts and digested samples using SDS-PAGE ... 101
3.4.8 Peptide analysis of digested samples using RP-HPLC/MS ... 101
3.4.9 Free amino acids analysis of digested samples using GC/FID ... 103
3.4.10 Statistical analysis ... 103
3.5 Results ... 103
3.5.1 Viscosity of yogurts with different PS ... 103
3.5.2 Soluble protein and peptide content after in vitro GI digestion of yogurts .... 104
3.5.3 Soluble protein and peptide profiles after in vitro GI digestion of yogurts ... 106
3.5.4 Bioaccessible peptides from digested yogurts ... 108
3.5.5 Bioaccessible amino acids from digested yogurts ... 110
3.6 Discussion ... 111
3.7 Conclusion ... 114
Chapitre IV : Use of polysaccharides in yogurt formulation: impact on glycemia, insulinemia, incretin secretion, and free amino acids in rats ... 117
4.1 Résumé ... 118
4.2 Abstract ... 119
4.3 Introduction ... 120
4.4 Animal and methods ... 123
4.4.1 Animal ... 123
4.4.2 Animal diets: yogurt preparation ... 124
4.4.3 Yogurt viscosity determination ... 125
4.4.4 Experimental protocol of gavage ... 125
4.4.5 Insulinemia, C-peptide ... 126
4.4.6 GIP, PYY ... 126
4.4.7 Amino acids analysis using GC/FID ... 126
4.4.8 Calculation and statistical analysis ... 126
4.5 Results ... 127
4.5.1 Viscosity of yogurts with different polysaccharides ... 127
4.5.3 Effect of yogurts consumption with different polysaccharides on glucose
tolerance ... 128
4.5.4 C-peptide and insulin clearance ... 130
4.5.5 GIP, PYY ... 130
4.5.6 Postprandial plasma amino acids ... 132
4.6 Discussion ... 134
4.7 Conclusion ... 137
Conclusion générale ... 139
Bibliographie ... 145
Annexe 1 : FAA (mg) per g of initial protein at the end of in vitro GI digestion of control yogurt, yogurts with starch, with β-glucan, and with pectin. ... 169
Annexe 2 : AUC for the 0 – 180 min and 0 – 60 min recovery periods of glucose, insulin, and C-peptide in plasma. ... 170
Annexe 3 : AUC for the 0 – 120 min recovery period of a) total FAA, b) BCAA, and c) Ala in plasma. ... 171
Liste des tableaux
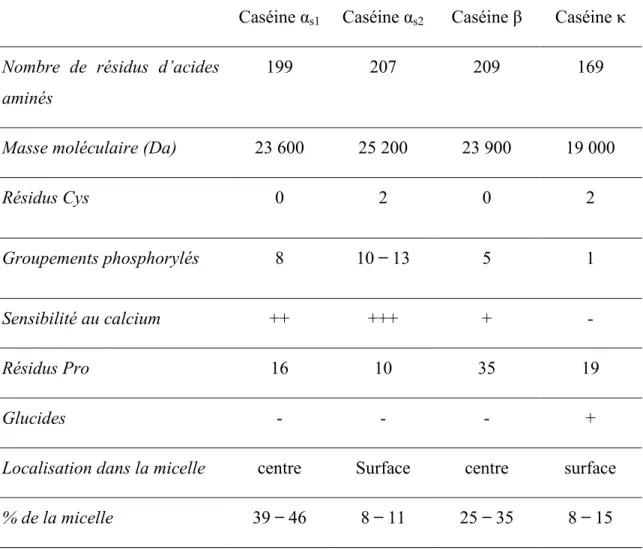
Tableau 1.1. Caractéristiques physico-chimiques des caséines αs1, αs2, β et κ (Debry, 2005).
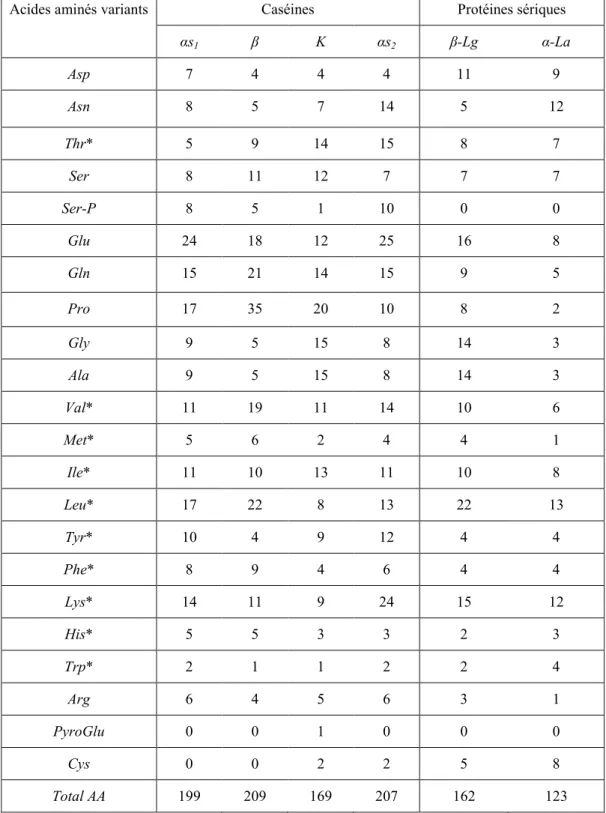
... 7 Tableau 1.2. Nombre d‘acides aminés dans les différentes caséines et les protéines sériques
majoritaires (* = acides aminés essentiels, Debry, 2005). ... 9 Table 2.1. Constituents and their final concentration 1 in the various synthetic juices used
in the in vitro GI digestion model (adapted from Versantvoort et al., 2005). ... 79 Table 2.2. Experimental conditions used in the in vitro GI digestion model for milks and
yogurt. ... 80 Table 2.3. FAA in dairy matrixes at the end of buccal, gastric and duodenal phases of the
in vitro GI digestion. ... 90 Table 4.1. Composition of yogurts without stabilizers (control), with starch 0.75 %, pectin
0.2 %, and β-glucan 0.4 %. ... 125 Table 4.2. FAA (fold over basal time, 0 min) 15 min, 30 min, 60 min, and 120 min after
Liste des figures
Figure 1.1. Représentation schématique a) des sous-micelles et b) des micelles de caséines (Horne, 2006). ... 8 Figure 1.2. Représentation 3D de la structure moléculaire d‘un monomère de
β-lactoglobuline (Brownlow et al., 1997). ... 10 Figure 1.3. Structure secondaire de l‘α-lactalbumine montrant la localisation des ions métal
(Chrysina et al., 2000). ... 11 Figure 1.4. Structures laitières diverses obtenues à partir du lait (Aguilera, 2006). ... 12 Figure 1.5. Schéma des différentes étapes de fabrication de yogourts fermes et de yogourts brassés (Tamine and Robinson, 1985). ... 16 Figure 1.6. Représentation d‘une molécule d‘amylopectine (Royal Society of Chemistry,
2004). ... 24 Figure 1.7. Structure schématique des pectines simples (galacturonane) et complexes
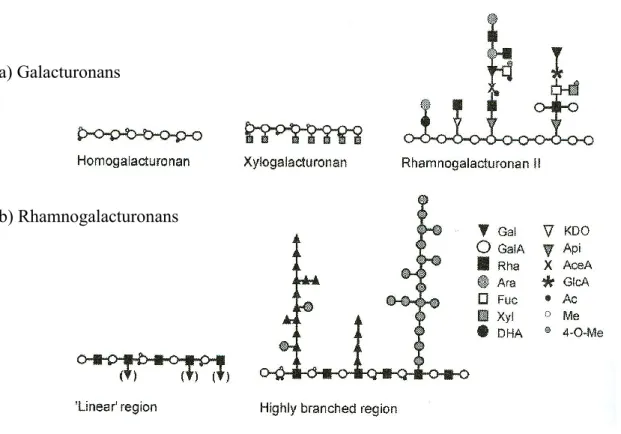
(rhamnogalacturonane)(Seymour and Knox, 2002). ... 27 Figure 1.8. Résidus d‘acide D-galacturoniques formant la chaîne basique des pectines. Des
groupements méthyles peuvent être présents en O-2 et O-3 selon la source de la pectine (Seymour and Knox, 2002). ... 28 Figure 1.9. Représentation d‘une partie de polymère β-D-glucan. (Dais and Perlin, 1982).
... 29 Figure 1.10. Anatomie du système digestif (Widmaier et al., 2011). ... 34 Figure 1.11. Représentation schématique de la conformation tridimensionnelle de la
molécule du peptide insuline (Saltiel and Pessin, 2007). ... 53 Figure 1.12. Schéma des voies de signalisation impliquant mTOR dans la régulation de la
synthèse des protéines (Wang and Proud, 2006). ... 55 Figure 1.13. Principaux peptides hormonaux sécrétés par le tractus GI et impliqués dans la régulation de la prise alimentaire (Cummings and Overduin, 2007). ... 59 Figure 2.1. Soluble proteins (%) in digested matrixes after buccal, gastric and duodenal
phases of in vitro GI digestion ... 83 Figure 2.2. SDS-PAGE analysis of undigested (Ctl) and digested matrixes during buccal,
gastric and duodenal phases of in vitro GI digestion. ... 86 Figure 2.3. FAA (%) pooled in different classes based on their characteristics (acid, basic,
neutral, hydrophobic) in digested matrixes at the end (60 min) of the duodenal phase of in vitro GI digestion.. ... 91 Figure 3.1. Effect of shear rate on the viscosity of control yogurt, yogurt with starch, with
β-glucan, and with pectin. ... 104 Figure 3.2. Soluble proteins (%) in digested matrixes after buccal, gastric and duodenal
phases of in vitro GI digestion of control yogurt, yogurt with starch, with β-glucan, and with pectin.. ... 105 Figure 3.3. SDS-PAGE analysis of undigested matrixes (control yogurt (Ctl), yogurt with
starch, yogurt with β-glucan, and yogurt with pectin). ... 106 Figure 3.4. SDS-PAGE analysis of digested matrixes during buccal (B2), gastric (5 min:
G5, 15 min: G15, 30 min: G30, 60 min: G60) and duodenal (D60) phases of in vitro GI digestion.. ... 107
Figure 3.5. Estimated quantity of peptides (MS chromatogram area - %) pooled in
different classes based on their molecular masses at the end of a) gastric digestion, and b) duodenal digestion, of in vitro GI digestion. ... 109 Figure 3.6. Total FAA content (mg) per g of initial protein content in yogurt after a) gastric
digestion, and b) duodenal digestion. ... 110 Figure 4.1. Viscosity of control yogurt, yogurts with starch, with β-glucan, or with pectin.
... 127 Figure 4.2. Stomach content weight (% ingested yogurt) at the end of the procedure (180
min) with control yogurt (n = 12), yogurts with starch (n = 9), with β-glucan (n = 14), and with pectin (n = 11).. ... 128 Figure 4.3. Plasma a) glucose concentration (mmol/L), b) insulin concentration (pmol/L),
and c) C-peptide concentration (pmol/L) as a function of time after gavage with control yogurt (n = 10), starch (n = 13), β-glucan (n = 10), or pectin (n = 10). ... 129 Figure 4.4. a) GIP and b) PYY in plasma (fold over basal time, 0 min) 15 min, and 30 min after the gavage of the different yogurts. ... 131
Liste des abréviations
α-La α-lactalbumine/ α-lactalbumin β-Lg β-lactoglobuline/ β-lactoglobulin α -Cn α -caséine/ α -casein
ARNm acide ribonucléique messager/ribonucleic acid messenger ATP ade(é)nosine triphosphate
°C degré Celcius/celsius degree AA acides aminés/amino acids
AUC aire sous la courbe/area under the curve BCA bicinchoninic acid
BCAA acides aminés branchés/branched-chain amino acids
Blk blanc/blank
BSA albumine sérique bovine/Bovine serum albumin CVD centre vagale dorsale/center vagal dorsal
Ctl contrôle/control
Da Dalton
GI gastro-intestinal/gastrointestinal
GIP peptide insulinotrope glucodépendant/glucodependent insulinotropic peptide GLP1 glucagon-like peptide 1
HM hautement méthylée/hight methylated
Ig immunoglobuline
LM faiblement méthylée/low methylated
mTOR cible de la rapamycine chez les mammifères/mammalian target of rapamycin MW masse moléculaire/molecular weight
N azote/nitrogen
OGTT test de tolérance au glucose oral/oral glucose tolerance test
PAGE électrophorèse sur gel de polyacrilamide/polyacrylamide gel electrophoresis PL protéines du lactosérum
PP polypeptide pancréatique/pancreatic polypeptide PYY peptide tyrosine-tyrosine
PI3K phosphatidylinositol-3-kinase PKB protéine kinase B/Kinase protein B
PS polysaccharides
RM mesures répétées/repeated measures rpm rotation par minute/rotation per minute
SDS sulfate de sodium dodécyle/sodium dodecyl sulfate
Std standard
T2DM diabète de type 2 mellitus/type 2 diabetes mellitus UHT ultra haute température/ultra-high temperature
Code des acides aminés
Acide aspartique Asp Acide glutamique Glu Alanine Ala Arginine Arg Asparagine Asn Cystéine Cys Glutamine Gln Glycine Gly Histidine His Isoleucine Ile Leucine Leu Lysine Lys Méthionine Met Phénylalanine Phe Proline Pro Sérine Ser Thréonine Thr Tryptophane Trp Tyrosine Tyr Valine Val
Introduction générale
Les aliments sont la source des nutriments essentiels au maintien de la santé chez l‘humain. Depuis plusieurs années, des aliments-santé sont développés par l‘ajout de molécules bioactives à des aliments traditionnels, alors que très peu de travaux s‘intéressent à l‘importance de l‘organisation moléculaire et structurale des nutriments dans les aliments sur leurs propriétés santé. La plupart des aliments subissent des traitements industriels variés pouvant influencer leur valeur nutritive.
Pour qu‘un aliment exerce son effet nutritionnel dans l‘organisme, il doit être libéré de l‘aliment (bioaccessibilité), transporté à travers la membrane épithéliale de l‘intestin (biodisponibilité), puis métabolisé par le foie ou autre organe cible (Versantvoort et al., 2005). La bioaccessibilité, la biodisponibilité et la cinétique de disponibilité d‘un nutriment varient grandement selon le type d‘aliment et ses constituants, de même que selon son mode de préparation et son procédé de fabrication (Argov et al., 2008).
Le lait et les produits laitiers peuvent imager la relation entre la structure d‘un aliment et son impact nutritionnel, car les caractéristiques structurales du lait et des produits laitiers qui en dérivent influencent la digestion et l‘absorption des macronutriments (glucides, protéines et lipides) (Aguilera, 2006). Cependant, la plupart des études nutritionnelles dans la littérature considèrent les produits alimentaires comme des « boîtes noires », négligeant l‘historique des procédés subis par les ingrédients/aliments. Par exemple, le yogourt, le fromage, le lait ou autres produits laitiers sont considérés équivalents dans les guides nutritionnels, alors que des variables de composition, de traitements et de procédés existent pour chacun de ces produits et peuvent influencer la biodisponibilité de leurs nutriments et les réponses métaboliques associées (Argov et al., 2008; Lacroix et al., 2008). Par exemple, il a été démontré que les protéines du lait et les protéines de lactosérum seules diminuent la concentration postprandiale de glucose sanguin par rapport à celle observée après la consommation de certains aliments (sirop glucose, poisson), alors que seules les protéines de lactosérum augmentent significativement l‘insulinémie (Nilsson et al., 2004).
Les procédés technologiques ont été jusqu‘à présent étudiés en vue de contrôler la stabilité et les qualités sensorielles d‘un aliment. Ils doivent maintenant être pris en considération pour les aspects santé des aliments : favoriser ou retarder la biodisponibilité de certains nutriments serait souhaitable dans certaines situations, par exemple pour retarder l‘apparition du glucose sanguin chez des individus atteints de diabètes de type 2. Le traitement thermique du lait est une opération qui influence la digestion des protéines laitières et donc module la vitesse d‘absorption des acides aminés (AA) (Lacroix et al., 2008). Des absorptions différentes d‘AA (ex : les AA branchés) ont été reliées à des concentrations différentes du glucose sanguin (Nilsson et al., 2007). D‘autre part, les produits laitiers fermentés peuvent être stabilisés par l‘ajout de polysaccharides (PS). En solution, il a été démontré que ces biopolymères pouvaient ralentir la digestion de protéines laitières (Ou et al., 2001; Mouecoucou et al., 2003). Cependant, un tel effet n‘a pas encore été clairement démontré dans un aliment. Il est donc important d‘évoluer vers la compréhension du rôle de la matrice alimentaire sur l‘accessibilité des nutriments et sur les réponses métaboliques postprandiales lors de la digestion gastro-intestinale (GI) des aliments. En particulier, les matrices laitières gélifiées acides contenant différents PS représentent un modèle d‘étude intéressant.
Le tractus GI est l‘organe contrôlant la digestion d‘un aliment, l‘adsorption des nutriments et permettant leur disponibilité pour l‘organisme. Le processus de digestion implique une série d‘évènements qui modifient la structure de la matrice alimentaire. La vitesse de digestion de cette matrice dépendra du type et de la concentration des molécules la constituant, de la nature des liens la stabilisant et de son accessibilité aux enzymes digestives. Par exemple, pour la nature des protéines, les protéines de lactosérum sont digérées plus rapidement que les caséines et ont été associées au sentiment de satiété (Anderson et al., 2004; Luhovyy et al., 2007).
L‘objectif de cette thèse est de comprendre le lien entre l‘ajout de PS dans des produits laitiers gélifiés acides, et les bioaccessibilité et biodisponibilité des nutriments azotés et certaines réponses métaboliques associées. Ces travaux permettront d‘évaluer l‘impact
d‘ingrédients et de processus de fabrication sur la valeur nutritive de ces produits laitiers et sur les réponses métaboliques postprandiales.
1.1 Le lait
Le lait, composé d‘une grande diversité de nutriments, est le premier aliment consommé par les nouveau-nés des mammifères. Il joue un rôle très important dans la survie de ces espèces (Debry, 2005).
1.1.1 La composition du lait
Le lait est majoritairement composé d‘eau (87 g/100 mL). Les glucides représentent 4.9 g/100 mL et sont composés à 99.99 % de lactose, diholoside réducteur de glucose et galactose. La matière grasse, 4.2 g/100 mL, est à 98 % représentée par des triglycérides, le reste étant des phospholipides et des composés liposolubles tels que du cholestérol et des vitamines. Les sources d‘azote (N) sont pour 94 % des protéines (3.2 g/100 mL) dont 80 % de celles-ci sont des caséines. Le reste des protéines sont les protéines solubles du lactosérum. L‘ N non protéique se retrouve sous forme d‘urée. Les minéraux ne sont présents qu‘à 0.72 g/100 mL. Le potassium est le macronutriment le plus important en quantité avec 0.15 g/100 mL de lait, puis le calcium (0.12 g/100 mL), le phosphore, le sodium et le magnésium suivent en quantité décroissante. Nous trouvons aussi des micro-éléments tels le zinc, le fer, le cuivre, etc.
1.1.2 Les protéines du lait
Les protéines du lait se composent de deux groupes : les caséines et les protéines du lactosérum.
1.1.2.1 Les caséines
Les caséines sont les protéines majoritaires du lait. On distingue 5 formes de caséines : caséine αs1, caséine αs2, caséine β, caséine κ et caséine γ, représentant 39 - 46 %, 8 - 11 %,
25 - 35 %, 8 - 15 %, 3 - 7 % des protéines du lait, respectivement. La caséine γ résulte de la protéolyse de la caséine β par la plasmine, une enzyme protéolytique naturellement présente dans le lait. Le tableau 1.1 présente les caractéristiques principales des caséines αs1, αs2, β, et κ.
Tableau 1.1. Caractéristiques physico-chimiques des caséines αs1, αs2, β et κ (Debry, 2005).
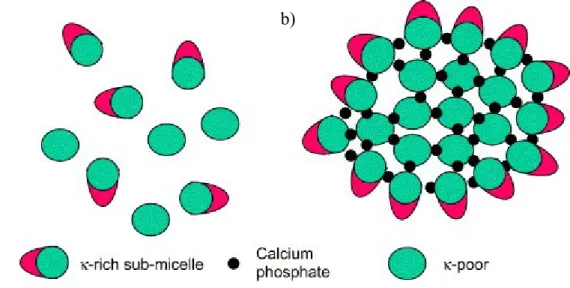
Les caséines se présentent sous forme de micelles (figure 1.1), complexes organiques et minérals très hydratés. L‘organisation structurale de la micelle fait encore l‘objet de discussion, mais plusieurs auteurs s‘entendent sur l‘existence probable de sous-micelles stabilisées par les caséines κ.
Caséine αs1 Caséine αs2 Caséine β Caséine κ
Nombre de résidus d’acides aminés
199 207 209 169
Masse moléculaire (Da) 23 600 25 200 23 900 19 000
Résidus Cys 0 2 0 2
Groupements phosphorylés 8 10 13 5 1
Sensibilité au calcium ++ +++ + -
Résidus Pro 16 10 35 19
Glucides - - - +
Localisation dans la micelle centre Surface centre surface % de la micelle 39 46 8 11 25 35 8 15
Figure 1.1. Représentation schématique a) des sous-micelles et b) des micelles de caséines (Horne, 2006).
Sept pour cent de l‘extrait sec des micelles sont composés de sels, principalement du phosphate de calcium. La composition en acides aminés (AA) des caséines est présentée au tableau 1.2, les AA majoritaires sont Glu, Leu, Pro, Lys, Tyr, Gln, Ile, Val. Les groupements acides libres des résidus Glu et Asp, étant en nombre supérieur aux groupements basiques libres –NH2 des lysines et autres AA diaminés, les caséines ont un
point isoélectrique (pI) de 4.6. Les différentes caséines peuvent s‘associer à pH 7 pour former, par exemple, des agrégats de caséines β et κ entre 20 et 30 unités liées par des interactions hydrophobes. Les caséines κ et αs2 peuvent aussi former des polymères liés par
des liaisons disulfures intermoléculaires.
Tableau 1.2. Nombre d‘acides aminés dans les différentes caséines et les protéines sériques majoritaires (* = acides aminés essentiels, Debry, 2005).
Acides aminés variants Caséines Protéines sériques
αs1 β Κ αs2 β-Lg α-La Asp 7 4 4 4 11 9 Asn 8 5 7 14 5 12 Thr* 5 9 14 15 8 7 Ser 8 11 12 7 7 7 Ser-P 8 5 1 10 0 0 Glu 24 18 12 25 16 8 Gln 15 21 14 15 9 5 Pro 17 35 20 10 8 2 Gly 9 5 15 8 14 3 Ala 9 5 15 8 14 3 Val* 11 19 11 14 10 6 Met* 5 6 2 4 4 1 Ile* 11 10 13 11 10 8 Leu* 17 22 8 13 22 13 Tyr* 10 4 9 12 4 4 Phe* 8 9 4 6 4 4 Lys* 14 11 9 24 15 12 His* 5 5 3 3 2 3 Trp* 2 1 1 2 2 4 Arg 6 4 5 6 3 1 PyroGlu 0 0 1 0 0 0 Cys 0 0 2 2 5 8 Total AA 199 209 169 207 162 123
1.1.2.2 Les protéines du lactosérum
Les protéines du lactosérum représentent 15 à 28 % des protéines du lait de vache et 17 % des matières azotées. Ce groupe de protéines est composé majoritairement des albumines (68.1 %) qui comprennent la β-lactoglobuline (β-Lg), l‘α-lactalbumine (α-La) et la sérum albumine du lait. Les immunoglobulines (Ig) sont un autre groupe des protéines du lactosérum.
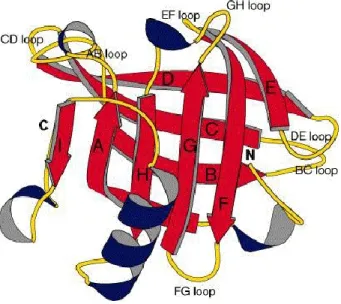
La β-Lg (43.7 % des albumines), dont le monomère est présenté en figure 1.2, est formée de 162 AA, les plus abondants étant Leu, Glu, Lys, Ala et Gly (tableau 1.2). Son pI se situe entre 4.6 et 5.2 (Das and Kinsella, 1989; Bromley et al., 2005; Harnsilawat et al., 2006). Sa chaîne peptidique possède 4 Cys qui permettent la formation de ponts disulfures intramoléculaires lui conférant une structure tertiaire compacte stable. Une autre Cys porte un groupement thiol libre qui donne à la protéine la capacité d‘échanger les liens lors des traitements thermiques (Hoffmann and van Mil, 1997). Elle se présente sous forme de dimères liés par des liens hydrogène à température ambiante et au pH physiologique (Hoffmann and van Mil, 1997).
Figure 1.2. Représentation 3D de la structure moléculaire d‘un monomère de β-lactoglobuline (Brownlow et al., 1997).
L‘α-La (figure 1.3) représente 19.7 % des albumines des protéines sériques et compte 123 AA dont 8 cystéines. La composition en AA de l‘α-La est présentée au tableau 1.2. Possédant un atome de calcium par mole, elle est une métalloprotéine. Son pI se situe entre 4.5 et 4.8 et sa masse moléculaire est de 14.2 kDa (Debry, 2005).
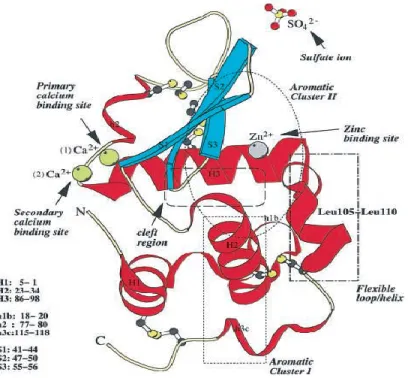
Figure 1.3. Structure secondaire de l‘α-lactalbumine montrant la localisation des ions métal (Chrysina et al., 2000).
La sérum albumine est l‘albumine du lait minoritaire (4.7 %) et possède 582 AA. Elle est identique à l‘albumine du sérum humain : même composition en AA, même masse moléculaire (66 267 Da) et mêmes propriétés électrophorétiques et immunologiques.
L‘ensemble des protéines du lactosérum sont solubles à pH 4.6 à 20 °C (Debry, 2005). Leur structure native globulaire les rend plus compactes et plus résistantes à l‘action des protéases que les caséines et elles fixent peu les ions. Elles sont plus sensibles à la chaleur que les caséines et sont dénaturées par chauffage à 90 °C ; elles forment alors des flocons insolubles sauf les peptones (18.9 % des protéines du lactosérum). Les protéoses-peptones sont des protéoses-peptones issues de la protéolyse de la caséine β par la plasmine et qui ont les mêmes propriétés que les protéines solubles du lactosérum.
Les différents nutriments du lait, ayant des propriétés physico-chimiques différentes, et les différents procédés de fabrication permettent de fabriquer des produits laitiers de structures diverses.
1.1.3 Le lait, ingrédient d’aliments de structures variées
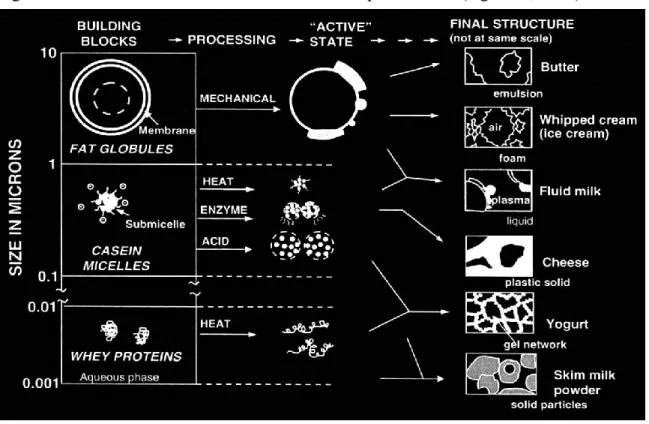
Les produits laitiers sont des exemples d‘aliments faits d‘un nombre limité d‘unités constitutives (Aguilera, 2006). Par différents procédés de fabrication, ces blocs donnent des produits laitiers de structures finales diverses (figure 1.4). Il est rare que des produits alimentaires faits à partir du même ingrédient principal chevauchent diverses structures. Le lait liquide est une émulsion huile dans eau. Par différents procédés de fabrication, l‘émulsion peut être inversée. D‘autres procédés permettent d‘obtenir des mousses, des gels ou des particules solides sèches.
Figure 1.4. Structures laitières diverses obtenues à partir du lait (Aguilera, 2006).
Par exemple, la technologie du lait qui consiste à concentrer sa matière grasse par processus mécanique (écrémage) suivi du barattage de la crème, donne du beurre dont la structure finale est une émulsion eau dans huile. La dispersion de bulles de gaz par agitation
mécanique d‘une phase continue, constituée de lait et crème, donnera une mousse et correspond au processus de fabrication de la crème fouettée et de la crème glacée.
Lors de la fabrication des yogourts (structure gélifiée) et des fromages (structure solide), la coagulation des caséines est essentielle, alors que ces produits laitiers sont de structures différentes. Dans le cas des fromages, la présence de présure permet l‘obtention de caillé et l‘étape d‘égouttage amène la perte des protéines de lactosérum, alors que la fabrication des yogourts par fermentation lactique résulte en un produit laitier constitué de la totalité des protéines laitières.
1.1.4 L’impact de la composition et de l’organisation structurale des nutriments du lait et des produits laitiers sur leurs propriétés nutritionnelles
Plusieurs exemples permettent d‘imager le lien entre la nature et l‘organisation structurale des constituants du lait et des produits laitiers et leurs propriétés nutritionnelles.
Le gras du lait, sous forme de globules, est caractérisé par la longueur et le degré d‘insaturation des acides gras le composant. Ces acides gras ont des propriétés nutritionnelles différentes et peuvent, par exemple, avoir un effet différent sur la cholestérolémie (Ney, 1991). Les phospholipides de la membrane des globules de gras sont importants par leurs propriétés fonctionnelles et physiques, évitant la coalescence des globules. Ces phospholipides peuvent aussi avoir des effets sur la santé. Par exemple, la sphingomyéline a des propriétés anticarcinogéniques (Parodi, 1997). Avec d‘autres composés de la membrane des globules tels que des protéines, des enzymes, du cholestérol, des glycoprotéines et des vitamines, les phospholipides peuvent moduler la liaison des lipases gastriques et pancréatiques à celle-ci et ainsi, la digestion enzymatique des lipides (développée à la section 1.4.2.2) sera affectée (Michalski, 2007; McClements et al., 2008). Suite à l‘homogénéisation d‘un mélange huile/solution émulsifiante (faite de protéines laitières), les protéines du lait stabilisent les globules de gras. Les protéines de lactosérum et les caséinates de sodium permettent un accès plus facile des lipases pancréatiques aux globules de gras que d‘autres émulsifiants tels que la lécithine (Mun et al., 2007). Ces
variations du processus de digestion peuvent entrainer des propriétés nutritionnelles différentes (développé à la section 1.4).
La haute qualité nutritionnelle des protéines du lait repose sur leur grande digestibilité (la digestibilité iléale vraie de l‘N est de 95 %) et une composition équilibrée en AA indispensables (Debry, 2005). Par leur richesse en Pro, les caséines ont peu de structures secondaire et tertiaire, facilitant l‘accès des enzymes protéolytiques tel que démontré in vitro (Baglieri et al., 1995). Cependant, physiologiquement, les caséines sont qualifiées de protéines « lentes » du à leur coagulation au pH acide de l‘estomac, en opposition aux protéines sériques de lactosérum reconnues comme « rapides ». Cette coagulation réduit l‘action de la pepsine dans l‘estomac, retarde la vidange gastrique et prolonge la période de libération des AA dans l‘intestin et leur absorption (Boirie, 2004), donnant aux caséines des propriétés nutritionnelles différentes de celles des protéines de lactosérum.
Les peptides et les AA issus de la digestion des protéines du lait et des produits laitiers ont un impact sur des réponses métaboliques.
1.1.5 Les peptides bioactifs et les acides aminés marqueurs de réponses métaboliques du lait et des produits laitiers
Plusieurs peptides bioactifs issus des protéines du lait ont été identifiés (Haque et al., 2009). En général, ces peptides sont composés de 3 à 15 AA et sont issus de l‘hydrolyse des protéines laitières par les enzymes digestives du tractus GI ou bien par des protéases présentes dans lors de la fabrication du produit laitier. Le caséinomacropeptide (CMP), issu de l‘hydrolyse de la caséine κ par la présure lors de la fabrication fromagère, est un exemple de plus gros peptide qui compte 64 AA. Jusqu‘à présent, les principales activités biologiques associées aux peptides issus des protéines laitières sont les suivantes : antimicrobienne, antihypertensive, immunomodulatrice, opiacés agoniste et antagoniste, bifidogène, antithrombotique, antivirale, antifongique. Certains peptides bioactifs sont multifonctionnels, comme le peptide β-casomorphine de la caséine β auquel sont associées des activités opiacée et immunomodulatrice (Debry, 2005).
Certains AA sont liés à des réponses métaboliques spécifiques, comme les AA branchés (BCAA : Ile, Leu, Val) qui sont marqueurs des sécrétions d‘insuline et d‘incrétines, et de la satiété (van Loon et al., 2000; Nilsson et al., 2004; Luhovyy et al., 2007; Veldhorst et al., 2009). Les protéines de lactosérum et les caséines sont responsables de fortes augmentations en concentration plasmatique de BCAA et autres AA (Lys, Thr, Pro, Phe, Tyr) corrélées à une augmentation de la satiété (Nilsson et al., 2004; Veldhorst et al., 2008; Newgard et al., 2009; Veldhorst et al., 2009). Dans le cas des protéines de lactosérum (en solution avec du glucose), cette augmentation a été accompagnée d‘une plus forte sécrétion d‘insuline postprandiale en comparaison avec une solution de glucose pure (Nilsson et al., 2007). Dans le cas des caséines, une plus forte proportion de ces protéines dans une diète (25 % vs 10 %) a permis de diminuer la sécrétion d‘insuline postprandiale, et d‘augmenter le sentiment de satiété (Veldhorst et al., 2009).
L‘intérêt biologique des peptides et des AA du lait justifie l‘étude de leurs bioaccessibilité et biodisponibilité lors de la digestion des produits laitiers tels que les gels acides (yogourt).
1.2 Le yogourt
Le yogourt est le résultat de la fermentation lente du lactose du lait ou d‘un mélange laitier, en acide lactique par l‘action de deux bactéries lactiques : Streptococcus thermophilus et Lactobacillus bulgaricus (Tamine and Robinson, 1985).
1.2.1 La préparation des gels acides
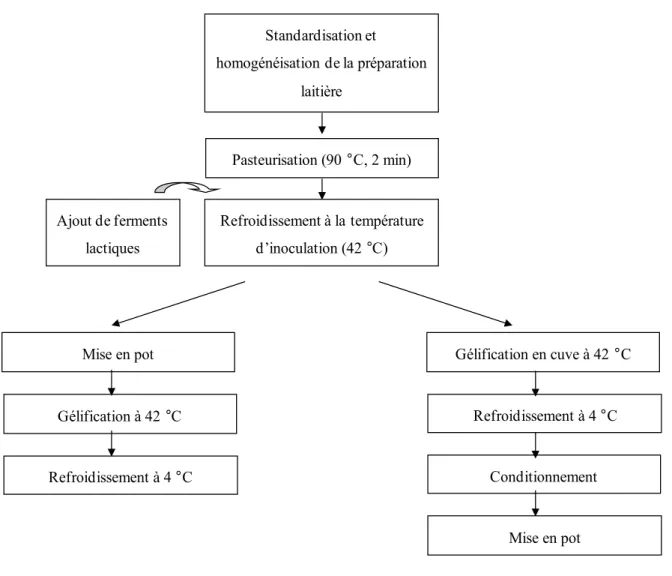
La fabrication des yogourts, fermes et brassés, comporte plusieurs étapes qui sont présentées à la figure 1.5.
Pasteurisation (90 C, 2 min) Standardisation et
homogénéisation de la préparation laitière
Mise en pot Gélification en cuve à 42 C
Ajout de ferments lactiques Gélification à 42 C Conditionnement Mise en pot Refroidissement à 4 C Refroidissement à la température d‘inoculation (42 C) Refroidissement à 4 C
Yogourt ferme Yogourt brassé
Figure 1.5. Schéma des différentes étapes de fabrication de yogourts fermes et de yogourts brassés (Tamine and Robinson, 1985).
La première étape est la préparation du mélange laitier où la composition nutritionnelle du lait est standardisée. Si des stabilisants sont ajoutés, ils sont solubilisés dans le mélange laitier. Le mélange laitier est maintenu au repos 16 h à 4 °C afin d‘assurer une hydratation optimale des protéines laitières qui ont pu être ajoutées sous forme de poudre (isolat, concentré) au lait. Ensuite le mélange subit un traitement thermique de pasteurisation et un refroidissement, puis les ferments lactiques (Streptococcus thermophilus et Lactobacillus bulgaricus) sont ajoutés. Dans le cas des yogourts fermes, l‘étape suivante est la mise en
pot et la fermentation lactique qui débute à 42 °C. L‘arrêt de la fermentation a lieu lors de l‘atteinte du pH à 4.6 (3 h 30 - 4 h 00). Les pots sont refroidis et stockés à 4 °C. Les yogourts brassés suivent un processus de fabrication similaire excepté que la fermentation se fait en cuve, suivie d‘une étape de conditionnement (brassage et lissage) est ajoutée avant l‘étape finale de mise en pot.
1.2.1.1 La standardisation de la préparation laitière
La préparation laitière est standardisée selon le type de yogourt fabriqué. En général, les teneurs en protéines et en lactose sont d‘abord standardisées en utilisant des poudres de lait, des isolats de lactosérum et du lactose alimentaire. La matière grasse est ajustée par l‘ajout de crème (Tamine and Robinson, 1985). Les constituants présents jouent tous un rôle dans la fabrication des yogourts et leur qualité finale. Les protéines laitières sont les éléments clés d‘obtention du gel qui donnent au yogourt sa texture ferme et plastique. Le lactose est aussi important, car il est le substrat essentiel à la croissance des bactéries lactiques. Une croissance bactérienne optimale lors de la fermentation lactique permet la diminution du pH, responsable de la coagulation des caséines. La matière grasse apporte de l‘onctuosité au yogourt. Les minéraux aident à stabiliser le réseau protéique.
Les conditions industrielles de fabrication de yogourts correspondent généralement à une teneur en protéines de 4 %, un ratio caséines/protéines de lactosérum (CN : PL) de 2.8, et une teneur en matière sèche de 14 % (Tamine and Robinson, 1985).
1.2.1.2 L’homogénéisation de la préparation laitière
L‘homogénéisation est une étape qui diminue la taille des globules de gras de 4 - 5 µm à 1 µm par cisaillement (Amiot et al., 2002). Ainsi les globules de gras ne sédimentent pas et sont plus hydrophiles, contribuant à une meilleure rétention de l‘eau. La fermeté du réseau de caséines du yogourt est aussi améliorée (Tamine and Robinson, 1985). L‘efficacité du traitement dépend de la pression et de la température auxquelles il est fait (entre 500 - 2500 psi et 55 - 65 °C) (Lucey et al., 2004).
1.2.1.3 Le traitement thermique
L‘étape du traitement thermique est indispensable pour l‘innocuité du produit laitier. Le traitement thermique se situe entre 80 et 98 °C pendant une durée variable de 20 s à 30 min (Lucey, 2004), permettant la destruction des microorganismes pathogènes et indésirables. De plus, des enzymes responsables de la dégradation du produit laitier, telles que les lipases (du lait) responsables de l‘oxydation subséquente des lipides, sont inhibées (Walstra et al., 2006). Lors de la fabrication de yogourt, le traitement thermique est sévère car il permet de dénaturer irréversiblement les protéines de lactosérum et d‘améliorer la capacité de rétention d‘eau des gels (Lucey et al., 1999). Ces protéines changent alors de conformation et les groupements thiol des β-Lg deviennent des sites réactifs (Hoffmann and van Mil, 1997). La β-Lg se lie alors à la caséine κ par un pont disulfure (Sava et al., 2005). Il peut également y avoir des interactions entre les caséines et l‘α-La (Corredig and Dalgleish, 1996). L‘effet du traitement thermique sur la rhéologie des gels sera développé au paragraphe 1.2.3.2.
1.2.1.4 La fermentation lactique
La fermentation lactique est l‘étape clé dans la formation du réseau caséique gélifié car elle permet d‘atteindre un pH acide égal au pI (4.6) des caséines, et elles coagulent. Le lactose est métabolisé par les bactéries lactiques qui agissent en synergie. Les streptocoques débutent la fermentation et produisent les composantes nécessaires au développement des lactobacilles comme l‘acide formique et le gaz carbonique. Les lactobacilles hydrolysent les caséines et libèrent ainsi des peptides et des AA favorisant la croissance des streptocoques (Walstra et al., 2006). Des métabolites de dégradation des protéines, du lactose, et de la matière grasse sont produits, dont ceux responsables des flaveurs du yogourt (principalement les dérivés carbonés acétaldéhyde, acétoïne et diacétyle, et des acides volatils et non volatils)(Tamine and Robinson, 1985).
Plusieurs facteurs influencent la croissance de ces bactéries comme le pH, la température et la composition du milieu de croissance. Le pouvoir tampon, exprimée par la quantité d‘acide nécessaire pour diminuer d‘une unité le pH du milieu, est important car l‘acide lactique peut devenir toxique pour la croissance bactérienne (Salaün et al., 2005). Les
ferments lactiques ont une température optimale de croissance de 45 °C et cette valeur peut varier suivant leur pourcentage d‘inoculation (Tamine and Robinson, 1985). Le taux d‘inoculation des ferments lactiques peut varier entre 2 et 5 % (Clark and Plotka, 2005). À 2 % d‘inoculation, la température de fermentation recommandée est 42 °C (Tamine and Robinson, 1985). Le lait contient les nutriments carbonés et azotés, les minéraux et les vitamines nécessaires à la croissance bactérienne (Tamine and Robinson, 1985). Les industriels recherchent entre 107 et 108 UFC/mL de bactéries pour former des gels de bonne qualité (Clark and Plotka, 2005).
1.2.1.5 Le conditionnement et le stockage
Le conditionnement des yogourts fermes ne correspond qu‘au refroidissement des pots pour ralentir la croissance des bactéries lactiques à température inférieure à 10 °C (Tamine and Robinson, 1985). Pour les yogourts brassés, le conditionnement comprend le refroidissement, le brassage, le lissage, l‘ajout de fruits suivant la recette et la mise en pot. Lors des étapes de brassage et de lissage, le réseau caséique est brisé et le produit final devient alors lisse et homogène (Tamine and Robinson, 1985). Les yogourts sont conservés à 4 °C entre un et deux mois. Le respect de la chaîne du froid est important pour garder leurs qualités organoleptiques, texturales et microbiologiques.
1.2.2 Les propriétés rhéologiques des gels
La rhéologie est la réponse d‘un matériau (liquide ou solide) à une contrainte appliquée qui permet de caractériser sa structure (à faibles déformations) et de l‘étudier dans les conditions de force et de déformation qui reflètent celles qu‘il subira lors de son utilisation (à grandes déformations). La relation contrainte/vitesse de cisaillement permet de déterminer la viscosité apparente de l‘aliment. Le comportement est newtonien lorsque la contrainte de cisaillement et la vitesse de cisaillement sont proportionnelles et est non-newtonien lorsque la viscosité varie selon la vitesse de cisaillement. Les yogourts ont un comportement non-newtonien, et en particulier un comportement dit pseudoplastique ou rhéofluidifiant. Leur viscosité diminue en fonction de l‘augmentation de la vitesse de cisaillement (Lucey et al., 2004). La viscosité apparente est une caractéristique rhéologique intéressante car elle est fonction de l‘état global du gel acide comme la taille des pores, la
structuration du réseau caséique et l‘état physique du lactosérum dans les pores (Lucey et al., 2004). L‘élasticité est un exemple de caractéristique rhéologique qui ne dépend pas de l‘état global du gel, mais principalement de la force des liens formant le gel.
1.2.3 Les facteurs influençant les propriétés rhéologiques des yogourts
Les propriétés rhéologiques des yogourts permettent de définir des paramètres de fabrication des yogourts qui donneront un produit acceptable par le consommateur. Les défauts à éviter sont une mauvaise texture (un gel trop mou ou trop ferme) ou le phénomène de synérèse. Ce dernier phénomène est majeur et a lieu lorsque le sérum s‘échappe du réseau caséique et se retrouve en surface des yogourts (Lucey et al., 2004). Ces défauts sont contrôlés en modifiant la standardisation des mélanges laitiers, en optimisant le procédé de fabrication ou en ajoutant des agents stabilisants. Les trois solutions peuvent être combinées, tel que décrit ci-après.
1.2.3.1 Les caractéristiques du mélange laitier
La qualité microbiologique du lait est importante puisqu‘une contamination bactérienne du mélange laitier peut apporter des défauts de synérèse au yogourt. Des bactéries psychotropes pourraient hydrolyser les protéines laitières et ainsi diminuer la capacité de rétention d‘eau des protéines du lactosérum (Tamine and Robinson, 1985).
La teneur en solides totaux du mélange laitier influence la texture du yogourt. Lorsque la teneur en solides non gras du lait passe de 9 % (lait non transformé et non enrichi) à 10 - 14 %, la rétention du lactosérum et la viscosité sont significativement améliorées (Amiot et al., 2002). Le changement du ratio CN : PL a aussi un impact sur les propriétés rhéologiques (Lucey et al., 2004). L‘augmentation de la teneur en protéines sériques (ratio CN : PL entre 2.8 et 0.5) améliore la capacité de rétention d‘eau du lactosérum (Puvanenthiran et al., 2002) et augmente les interactions des protéines sériques avec les caséines pour renforcer le réseau caséique (Lucey et al., 2004) ; la fermeté du gel est alors plus élevée. À l‘opposé une teneur trop élevée en protéines de lactosérum entraine une texture granuleuse du yogourt (Puvanenthiran et al., 2002). La forme des protéines de lactosérum peut influencer la rhéologie des yogourts. Bhullar et al. (2002) ont montré qu‘n concentré de protéines
sériques (2 % des solides totaux du yogourt) donne un gel plus stable avec un réseau protéique plus régulier et dense que celui de poudre de lactosérum (2 % des solides totaux du yogourt), lequel montre plus de vides et d‘espaces interstitiels (Bhullar et al., 2002).
La quantité et la nature des minéraux peuvent influencer la rhéologie du yogourt. Au-delà d‘une certaine concentration, les minéraux peuvent déstabiliser le réseau caséique jusqu‘à causer la synérèse (Tamine and Robinson, 1985).
1.2.3.2 L’influence des procédés de fabrication
Le traitement thermique influence fortement la rhéologie du yogourt car il expose le site réactif thiol des β-Lg qui se lient aux caséines κ, aidant à la gélification. Un yogourt fait avec un mélange laitier non traité thermiquement montre un réseau caséique large et peu interconnecté alors que si le même mélange est traité thermiquement le réseau caséique est homogène et interconnecté (Lucey et al., 1999).
Une homogénéisation du lait ou du mélange laitier, faite avec des barèmes non optimaux, rend cette étape de fabrication inefficace. Les protéines qui entourent les globules de gras peuvent être fortement endommagées et le réseau caséique, peut ainsi être déstabilisé (Tamine and Robinson, 1985; Lucey et al., 2004).
La fermentation est une étape critique du procédé de fabrication. La nature, le taux d‘ensemencement des souches lactiques et le ratio streptocoques/lactobacilles modulent la vitesse d‘acidification et ainsi, peuvent influencer la gélification et la rhéologie des yogourts. Une vitesse d‘acidification rapide donne un caillé peu homogène et donc moins ferme (Haque et al., 2001). De même, un pH trop élevé empêchera la formation d‘un réseau caséique stable (Tamine and Robinson, 1985). Les conditions optimales de croissance des ferments lactiques, dont la température, dépendent de la souche et de l‘espèce. Dans des conditions de température d‘incubation non optimale, la production d‘acide est lente et la gélification peut ne pas se faire ou être lente.
La température de refroidissement doit être contrôlée car le refroidissement augmente la fermeté du gel (Lucey et al., 1997) et ce malgré la diminution d‘intensité des interactions hydrophobes. Des liens non-covalents tels que des liaisons hydrogène, dipolaires et électrostatiques sont responsables de l‘augmentation de la fermeté du gel (Haque et al., 2001).
La température et le temps d‘entreposage ont un impact sur la qualité du yogourt. Durant les 48 h suivant la fabrication du yogourt, des réarrangements ont lieu permettant la stabilisation du réseau caséique (Tamine and Robinson, 1985).
1.2.3.3 Les agents stabilisants utilisés dans les yogourts
Les agents stabilisants sont utilisés dans la fabrication des yogourts depuis longtemps en Amérique du Nord afin de contrôler la texture et la synérèse du yogourt (relarguage du lactosérum) (Tamine and Robinson, 1985). Les stabilisants sont des polysaccharides (PS) épaississants et gélifiants contribuant aux propriétés rhéologiques des yogourts et à l‘augmentation de la rétention d‘eau du gel. Les stabilisants sont de plus en plus utilisés dans des yogourts faibles en gras afin d‘apporter l‘onctuosité perdue en enlevant du gras (Sandoval-Castilla et al., 2004).
Les PS les plus utilisés (seuls ou en mélange) sont la pectine, la gomme de caroube, la gomme de xanthane, l‘amidon et la carraghénane (Clark and Plotka, 2005). L‘ajout des PS doit se faire dans des conditions contrôlées (température donnée, avant ou après certains ingrédients du mélange laitier). La concentration utilisée est aussi importante. Une quantité de PS trop ou pas assez importante déstabilise le réseau de caséines (Ramaswamy and Basak, 1992; Seymour and Knox, 2002) et affecte la viscosité du yogourt (Everett and McLeod, 2005).
1.3 Les polysaccharides
Les PS sont des polymères constitués d‘unités de monosaccharides dont la nature et le degré de polymérisation varient selon la source. Les propriétés des PS dépendent de la nature des monosaccharides, de la liaison glucosidique qui relie ces unités et leur poids
moléculaire (Leung et al., 2006a). Les PS sont obtenus de différentes sources telles que les algues (ex : carraghénanes, agar), les plantes (ex : amidon, pectine), ou encore peuvent être synthétisés par les micro-organismes (ex : gomme xanthane). On trouve des β-glucans (polymères de glucose liés en β) issus de plusieurs sources (plantes, micro-organismes). En alimentaire, la plupart des β-glucans proviennent des plantes et en particulier des sons d‘orge et d‘avoine (Brennan, 2005a; Makelainen et al., 2006; Panahi et al., 2007; Rondanelli et al., 2011).
La pectine et l‘amidon étant des PS très utilisés par les industriels (Seymour and Knox, 2002; Eliasson, 2004), leurs propriétés sont bien documentées. Différents amidons sont particulièrement utilisés dans les recettes de yogourts sans gras car ils apportent un aspect crémeux (Alexander, 1992; Alting et al., 2009). Les pectines sont utilisées lors de la fabrication de yogourts pour aider à la stabilisation des gels acides (Tromp et al., 2004). Le β-glucan est un exemple de PS moins étudié. Il a été en premier lieu étudié pour ses propriétés santé (Brennan, 2005a), mais il possède aussi le potentiel de stabiliser des produits laitiers à faible teneur en gras dont les yogourts (Tudorica et al., 2004; Vasiljevic et al., 2007).
Le β-glucan, l‘amidon et la pectine sont les trois PS étudiés dans ce projet et leurs caractéristiques structurales et physico-chimiques seront présentées dans les sections suivantes.
1.3.1 Les caractéristiques structurales et physico-chimiques de l’amidon, de la pectine et du β-glucan
Les caractéristiques structurales et physico-chimiques des PS définissent leur fonctionnalité et leur comportement vis-à-vis d‘autres nutriments présents dans une matrice alimentaire. Les caractéristiques des PS à l‘étude sont présentées dans les sections suivantes.
1.3.1.1 L’amidon
La synthèse de l‘amidon se fait dans les organes de stockage de différentes plantes (fruit ou graine) lors du développement et de la maturation des tissus. Dans les céréales, principale
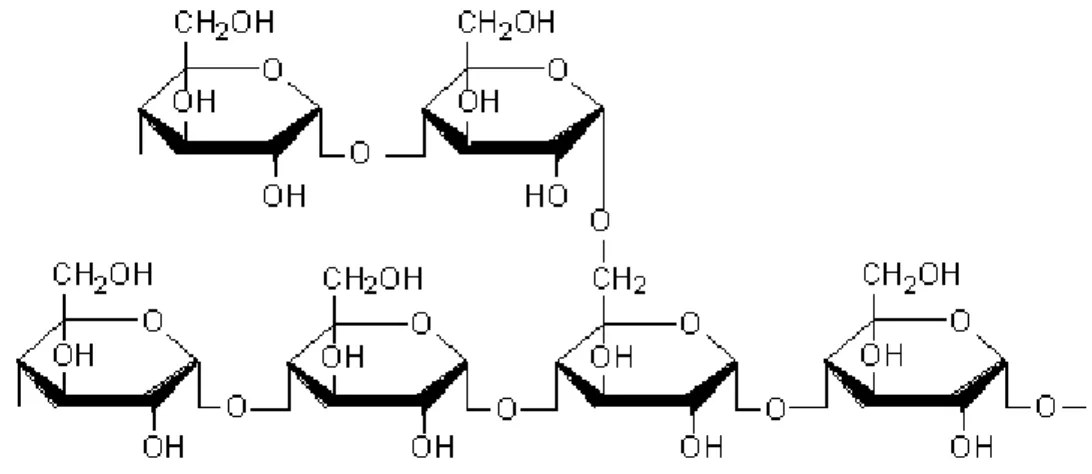
source des amidons alimentaires, le site principal de synthèse et d‘accumulation de l‘amidon (sous forme de granules) sont les amyloplastes localisés dans l‘endosperme. Deux polymères constituent les granules d‘amidon : l‘amylose et l‘amylopectine. L‘amylose est un polymère linéaire contenant entre 840 et 22 000 unités d‘α-D-glucopyranosyl liées par des liens α (1 - 4). L‘amylopectine est un polymère de glucoses liés par des liaisons linéaires α (1 - 4) pour la chaîne principale et par des liaisons α (1 - 6) pour les ramifications. Quatre à cinq % de ces ramifications peuvent elles-mêmes être ramifiées et les amylopectines sont alors dites hautement branchées (figure 1.6).
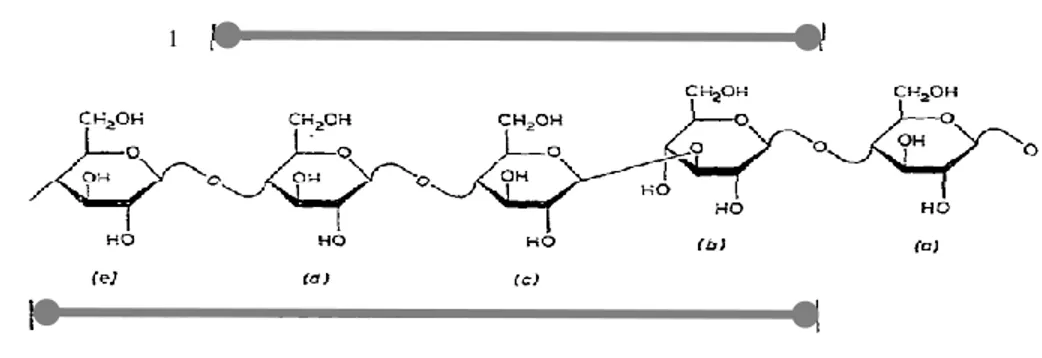
Figure 1.6. Représentation d‘une molécule d‘amylopectine (Royal Society of Chemistry, 2004).
Les granules d‘amidon natif augmentent la viscosité en solution suite au chauffage selon un processus en 5 phases (Eliasson, 2004) :
- Formation d‘une suspension par agitation de l‘amidon dans l‘eau froide.
- Gonflement des grains d‘amidon lors de la montée en température et l‘atteinte de la température de gélatinisation : l‘eau pénètre dans les grains et ceux-ci gonflent, puis la viscosité de la solution augmente. On obtient un empois d‘amidon.
- Perte de la structure granulaire par poursuite du chauffage car l‘amylose sort du grain pour se solubiliser à l‘extérieur du grain, l‘empois d‘amidon disparait.
- Reprise de la viscosité lors du refroidissement de la solution car les molécules (amylose principalement) se réassocient pour former un gel. Il s‘agit du phénomène de rétrogradation.
- Augmentation de la fermeté du gel et expulsion de l‘eau incluse entre les chaînes de macromolécules. Le relargage d‘eau est le phénomène de synérèse.
Les amidons natifs peuvent être utilisés en alimentaire car ils sont fonctionnels et peu coûteux. Cependant, leur utilisation est complexe et des variables telles que le contenu en eau, la température, la concentration en sel et le pH ont un effet sur leur fonctionnalité. Par exemple, il a été démontré que l‘addition de faibles teneurs en sel diminue dramatiquement la viscosité de gels d‘amidon de pomme de terre (Muhrbeck and Eliasson, 1987).
Les amidons sont souvent modifiés pour améliorer leur utilisation. Ces modifications altèrent leur structure et affectent plus ou moins leur capacité à créer des liens hydrogène. La création de liaisons hydrogène est importante pour lier les molécules d‘eau qui hydratent les PS et apportent ainsi la viscosité aux aliments. La réticulation est la modification chimique la plus importante en industrie de l‘amidon. Des liens covalents sont formés entre les groupements OH des unités de glucose par l‘ajout d‘agents chimiques. Le gonflement des granules d‘amidon est inhibé et prévient leur désintégration lors d‘une attaque acide, d‘un cisaillement ou de hautes températures. Plus le nombre de liens covalents augmente, plus l‘amidon est stable à ces attaques. La stabilisation est la seconde modification la plus importante et est souvent couplée avec la réticulation. Lors de cette modification, des groupements OH sont estérifiés, phosphorylés, ou subissent une autre modification chimique. Cette modification permet de freiner la tendance à la dispersion des fragments linéaires qui s‘aligneraient et rétrograderaient. Elle permet ainsi à l‘amidon de tolérer des fluctuations de température telles que des cycles de congélation-décongélation. La pré-gélatinisation est une modification physique qui supprime la nécessité de chauffer les produits contenant l‘amidon. Elle assure une meilleure dissolution de l‘amidon lors de son ajout pour obtenir l‘effet viscofluidifiant (Eliasson, 2004).