THE SE
Présentée àL'Unité de Formation et de Recherche
Sciences des Structures de la Matière et de Technologie (UFR- SSMT)
UNIVERSITE D'ABIDJAN-COCO DY
Par
BOA David
pour obtenir le titre de DOCTEUR de 3me cycle des Sciences Physiques (Spécialité: Chimie Physique)
Président
Examinateurs :
Soutenue le 11 Juin 1998 devant la commission d'examen:
M. Yobou BOKRA Mme Gabrielle KRA
Mme Marie-Chantal KOUASSI
MM. Séka ACHY Pierre KOTClll
Professeur à l'Université de Cocody Professeur à l'Université de Cocody Maître de Conférences à
l'Université de Cocody
Professeur à 1 'Université de Cocody Maître de Conférences à
1 'Université d' Abobo-Adjamé
Thèse préparée conjointement
au Laboratoire de Chimie Physique de l'UFR-SSMT (Université d'Abidjan-Cocody)
et
au Laboratoire de Thermodynamique et de Physico-Chimie Métallurgiques de l'ENSEEG (Institut National Polytechnique de Grenoble)
Ce mémoire est le résultat des travaux de recherche effectués conjointement au Laboratoire de Chimie Physique de l'UFR-SSMT (Université d'Abidjan-Cocody) et au Laboratoire de Thermodynamique et de Physico-Chimie Métallurgiques de l'Institut National Polytechnique de Grenoble (ENSEEG).
Nous sommes heureux de pouvoir exprimer au personnel du Laboratoire de Thermodynamique et de Physico-Chimie Métallurgiques (L.T.P.C.M), notre profonde sympathie pour l'aide considérable qu'ils nous ont apportée tout au long de notre séjour à Grenoble. Nous tenons tout particulièrement à remercier Monsieur le Professeur Claude BERNARD, Directeur du L. T.P. C.M, pour avoir bien voulu nous accepter dans son équipe.
Que Monsieur Ibrahim ANSARA, Directeur de recherche au CNRS, qui nous a encadré durant notre stage de formation doctorale, trouve ici l'expression de notre profonde gratitude. Il a dirigé avec patience les calculs des diagrammes d'équilibre entre phases exposés dans ce mémoire, tout en nous donnant une formation thermodynamique précieuse. Nous avons pu apprécier sa haute valeur scientifique et ses grandes qualités humaines. Nous avons essayé de profiter au mieux de son enseignement et de ses conseils.
La première partie de ce travail a été effectuée au Laboratoire de Chimie Physique, où Monsieur le Professeur Yobou BOKRA, Directeur dudit laboratoire nous a accueilli avec une bienveillance que n'oublierons pas. Nous le prions d'accepter nos remerciements pour avoir présidé le jury de cette thèse.
#adame le Professeur Gabrielle KRA, Directeur du Laboratoire de Chimie Minéra~e de l'UFR-SSMT (Université d'Abidjan-Cocody), nous fait l'honneur dejuger ce travail et de participer au jury. Qu'elle trouve ici, l'expression de notre reconnaissance pour l'intérêt qu'elle a porté à ce travail. Ses nombreux conseils nous
:'::.'~;té très bh1~(iques dans la réalisation de ce mémoire.
Que Madame Marie-Chantal KOUASSI, Maître de Conférences au Laboratoire de Physique de l'UFR-SSMT (Université d'Abidjan-Cocody), soit assurée de notre profonde gratitude pour avoir accepté de faire partie du jury.
Nous adressons nos remerciements à Monsieur le Professeur Séka ACHY, Directeur du Laboratoire de Physique de l'Atmosphère (Université de Cocody) qui a bien voulu participer au jury de soutenance de ce mémoire.
nous ont permis de développer le modèle régulier en paires de bras présenté dans la première partie de ce travail. Nous avons pu bénéficier de sa grande rigueur scientifique. Nous lui sommes particulièrement reconnaissant, pour avoir pu nous obtenir le stage de formation en France sans lequel ce travail n'aurait pas connu son aboutissement. Nous tenons à lui exprimer notre sincère attachement.
Nous ne saurions exprimer toute notre reconnaissance à tous les Enseignants et Chercheurs ainsi qu'au personnel administratif du Laboratoire de Chimie Physique, sans crainte d'omission. Cependant, qu'il nous soit encore permis de remercier nos amis A. P. AHOUSSOU, N. ZIAO et D. DIABATE pour leur soutien constant.
Pages
INTRODUCTION ... . .l
PREMIERE PARTIE
I. PRESENTATION GENERALE DES MODELES EN THERMODYNAMIQUE. .... . .4
1.1 Situation des modèles d'interaction en thermodynamique ... .4
1.2 Représentation analytique des fonctions thermodynamiques ... 6
12.1 Solution idéale ... 6
1.2.2 Solutions non-idéales ... 6
1.2.2.1 Modèles d'interaction ... 7
1.2.2.2 Expressions géométriques empiriques ... 12
1.2.2.3 Expressions analytiques ... 14
II. MODELISATION DES GRANDEURS THERMODYNAMIQUES DE FORMATION DES LIQUIDES METALLIQUES PAR LE MODELE EN PAIRES DE BRAS ... l6 11.1 Hypothèses générales ... 17
II.2 Etude d'une configuration de la solution ... 18
1!.2.1 Calcul de l'énergie totale de configuration de la solution ... 19
II.2.2 Fonction de partition de configuration de la solution ... 20
II.3 Grandeurs thermodynamiques de formation de la solution ... 22
11.3.1 Grandeurs intégrales ... 22
11.3.2 Grandeurs partielles ... 26
II.3.3 Evaluation de l'entropie d'excès de mélange ... 29
II.4 Applicabilité du modèle en paires de bras ... 36
III. ESTIMATION DES GRANDEURS THERMODYNAMIQUES DE MELANGE DE QUELQUES SYSTEMES TERNAIRES ... ... .40
III.1 Rappel. ... 40
III.1.1 Modèle des solutions régulières ... .40
III.1.2 Modèle quasi-chimique de Guggenheim ... .41
11!.1.3 Modèle de Van Laar ... 44
III.1.4 Modèle régulier en paires de bras ... .44
1II.2 Résultats et discussions ... .45
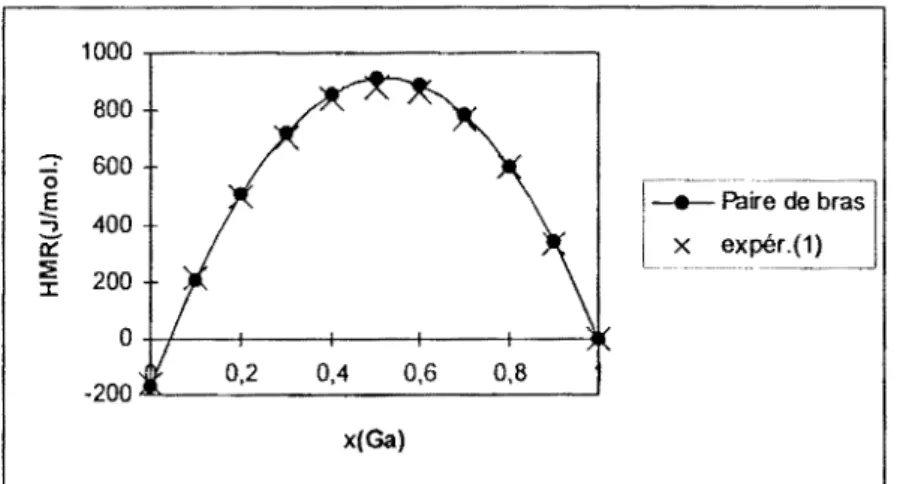
III.2.1 Système ternaire gallium-indium-étain (Ga-In-Sn) ... .48
111.2.1.1 Résultats ... 48
11!.2.1.2 Discussions ... 55
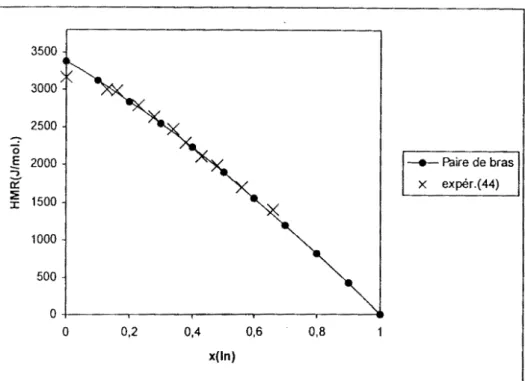
III.2.2 Système ternaire gallium-indium-plomb (Ga-In-Pb) ... 56
11!.2.2.1 Résultats ... 56
111.2.2.2 Discussions ... 66
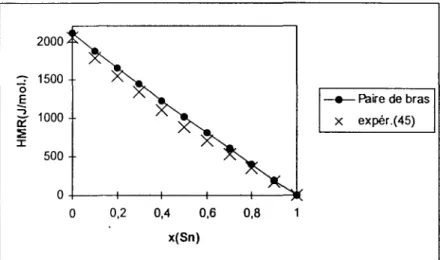
III.2.3 Système ternaire gallium-bismuth-indium (Ga-Bi-ln) ... 67
11!.2.3.1 Résultats ... 67
111.2.3 .2 Discussions ... 77
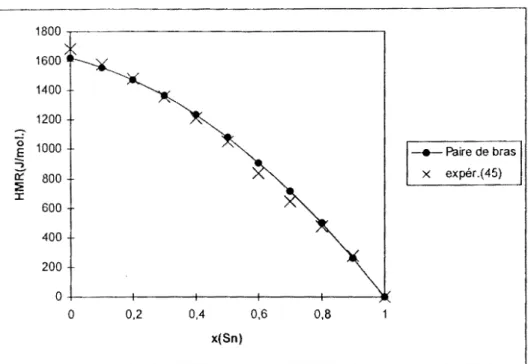
III.2.4 Système ternaire gallium-bismuth-étain (Ga-Bi-Sn) ... 78
111.2.4.1 Résultats ... 78
IV. FONCTIONS THERMODYNAMIQUES ET DIAGRAMMES D'EQUILIBRE
ENTRE PHASES ... 92
IV.1 Rappels ... 92
IV.l.l Notion d'équilibre ... 92
IV .1.2 Conditions de stabilité d'une phase : analogie mécanique et thermodynamique ... 93
IV.2 Principe de calcul des dia,grammes de phases ... 95
IV.2.1 Variance d'un système polyphasé ... 95
IV.2.2 Application de la règle des phases ... 96
IV .2.3 Principe de calcul. ... 98
V. EVALUATION THERMODYNAMIQUE DES ALLIAGES A BASE DE GALLIUM ET D'INDIUM ... 1 02 V.1 Modélisation thermodynamique des phases ... 102
V.l.1 Phases de composition fixe ... 1 02 V.1.1.1 Eléments purs ... 102
V .1.1.2 Composés stœchiométriques ... .1 05 V .1.2 Systèmes binaires ... 1 05 V.1.3 Systèmes ternaires ... 109
V .2 Présentation de la méthode de calcul ... 11 0 V.2.1 Manipulation thermodynamique: TDB et G-E-S ... 111
V.2.2 Calcul: POLY 3 ... 111
V.2.3 Exploitation: POST ... 111
V.2.4 Optimisation: PARROT ... 111
V.3 Applications ... 112
V.3.1 Système ternaire gallium-bismuth-étain (Ga-Bi-Sn) ... 112
V.3.1.1 Systèmes binaires constitutifs ... .112
V.3.1.2 Système ternaire Ga-Bi-Sn ... 118
V.3.2 Système ternaire indium-bismuth-plomb (In-Bi-Pb) ... 126
V.3.2.1 Systèmes binaires constitufs ... .126
V.3.2.2 Système ternaire In-Bi-Pb ... 134
CONCLUSION ... 149
BIBLIOGRAPHIE ... 151
ANNEXE A ... l56 ANNEXE B ... 162
ILl Nature, nombre et énergies des paires de bras ... 19 III.l Nombre de coordination des éléments liquides purs ... .45 III.2 Paramètres binaires calculés dans le cas du modèle en paires de bras ... .46 III.3 Paramètres binaires calculés dans le cas des modèles des solutions régulières,
quasi-chimique et de V anLaar ... 4 7 V.l Structures des phases solides dans le système Ga-Bi-Sn ... 118 V.2 Description des différentes réactions invariantes dans le système Bi-In ... .127 V.3 Système In-Bi-Pb. Données expérimentales du diagramme
d'équilibre entre phases ... 139 V.4 Système In-Bi-Pb. Grandeurs thermodynamiques ... 139 V.5 Structures des phases solides dans le système In-Bi-Pb ... l40 V.6 Différentes réactions invariantes calculées dans le système In-Bi-Pb ... 142
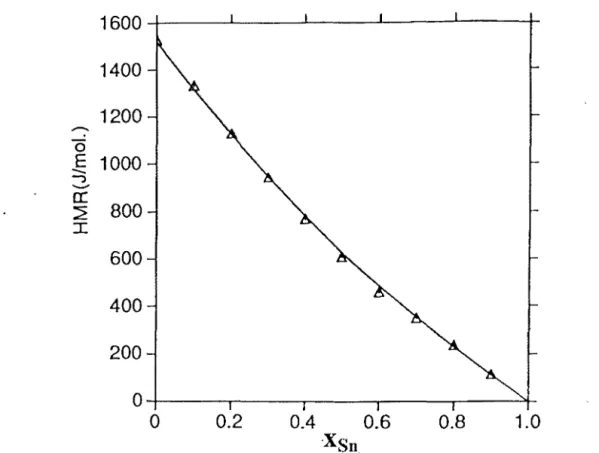
1.1 Représentation des projections de Toop, Bonnier, Kohl er, Colin et et Muggianu .... 14 III.1 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x1,/xsn=2
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=520-750 K ... 48 III.2 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x1,/xsn= 1
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=520-750 K ... .49 III.3 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x3,/x1n=2
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=520-750 K ... 50 III.4 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x1,/xsn=2
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=520-750 K ... 51 III.5 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x1,/xsn=1
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=520-750 K ... 51 III.6 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section xs,/x1n=2
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=520-750 K ... 51 III.? Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x1,/xsn=2
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=520-750 K ... 52 III.8 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section x1,/xsn= 1
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=520-750 K ... 53 III.9 Système Ga-In-Sn. Enthalpies molaires de mélange le long de la section xs,/x1n=2
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=520-750 K ... 54 III.1 0 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section x1,/xGa=3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=892 K ... 56 III.l1 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section xG/Xpb=3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=892 K ... 57 III.l2 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section xGclxPb
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=892 K ... 58 III.13 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section xpt/XGa= 3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=892 K ... 59 III.14 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section x1,/XGa=3
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=892 K ... 60
expérimentales, T=892 K ... 60 III.l6 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section xcJxpb= 1
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=892 K ... 61 III.l7 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section Xpt/Xca=3
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=892 K ... 61 III.l8 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section XJ,/Xca=3
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=892 K ... 62 III.l9 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section xcJxpb=3
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=892 K ... 63 III.20 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section xcJxpb= 1
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=892 K ... 64 III.21 Système Ga-In-Pb. Enthalpies molaires de mélange le long de la section Xpz/Xca=3
calculées à partir des formules géométriques et comparées aux valeurs
expérimentales, T=892 K ... 65 III.22 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xca=2
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 67 III.23 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xca=3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 68 III.24 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xca= 1
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 69 III.25 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section xcJxBi=3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 70 III.26 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xca=2
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 71 111.27 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xca=3
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 71 111.28 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xca= 1
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 72 Ill.29 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section xcJxBi=3
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 72
expérimentales, T=723 K ... 73 111.31 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xaa=3
calculées à partir des formules géométriques comparées aux valeurs
expérimentales, T=723 K ... 7 4 Ill.32 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section x8/xaa= 1
calculées à partir des formules géométriques comparées aux valeurs
expérimentales, T=723 K ... 75 111.33 Système Ga-Bi-In. Enthalpies molaires de mélange le long de la section xalxBi=3
calculées à partir des formules géométriques comparées aux valeurs
expérimentales, T=723 K ... 76 111.34 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xa)xBi=2
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 78 111.35 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section x8/xa0=3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 79 111.36 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section x8/xaa= 1
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 80 III.37 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xaJxBi=3
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 81 111.38 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xa)Xsn= 1
calculées à partir des modèles d'interaction et comparées aux valeurs
expérimentales, T=723 K ... 82 111.39 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xa)xBi=2
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 83 III.40 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xalxBi= 1
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 83 III.41 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section x8/xaa= 1
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 83 III.42 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xalxBi=3
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 84 111.43 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xa)Xsn= 1
calculées à partir du modèle régulier en paires de bras et comparées aux valeurs expérimentales, T=723 K ... 84 111.44 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xalxBi=2
calculées à partir des formules géométriques comparées aux valeurs
III.46 III.47 III.48 III.49 V.l V.2 V.3 V.4 V.5 V.6 V.7 V.8 V.9 V.IO V.ll V.12 V.l3 V.l4 V.15 V.16 V.17 V.l8 expérimentales, T=723 K ... 86 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xs!XGa=1
calculées à partir des formules géométriques comparées aux valeurs
expérimentales, T=723 K ... 87 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xG!xBi=3
calculées à partir des formules géométriques comparées aux valeurs
expérimentales, T=723 K ... 88 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xG!Xsn= 1
calculées à partir des formules géométriques comparées aux valeurs
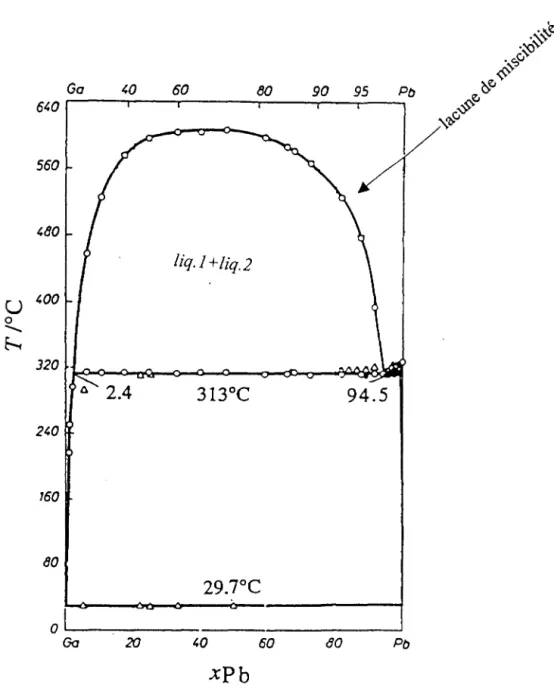
expérimentales, T=723 K ... 89 Système Ga-Pb. Diagramme d'équilibre entre phases expérimental<39> ... 91
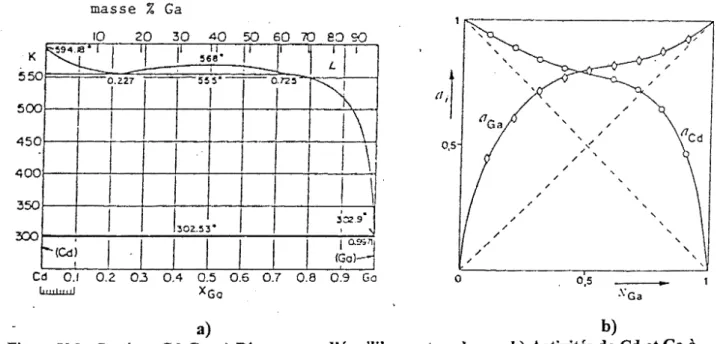
Système In-Sb. a) Diagramme d'équilibre entre phases. b) Activités de In et Sb à 900 K(40) ... 1 07 Système Cd-Ga. a) Diagramme d'équilibre entre phases. b) Activités de In et Sb à
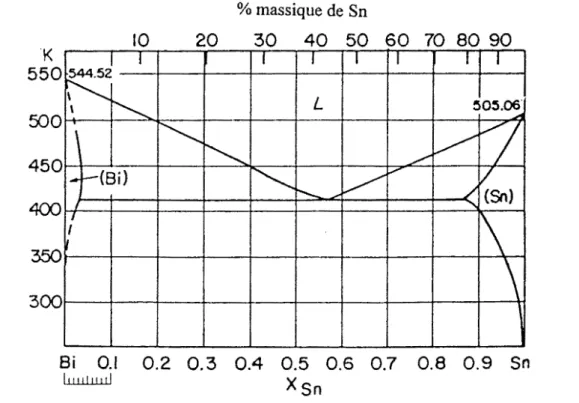
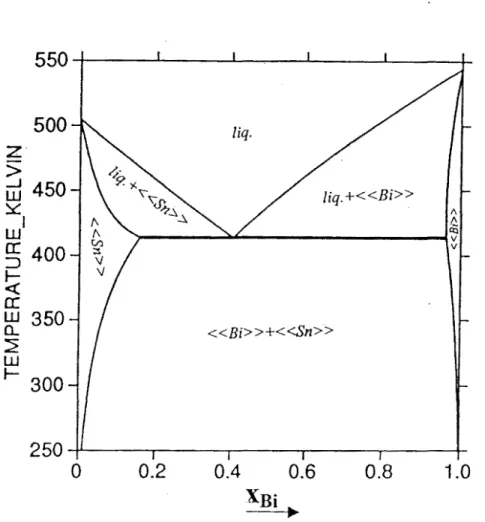
700 K(40) ... 1 07 Système Bi-Ga. Diagramme d'équilibre entre phases expérimental. ... 114 Système Bi-Ga. Diagrammes d'équilibre entre phases calculés ... 114 Système Bi-Sn. Diagramme d'équilibre entre phases expérimental<40> ... 115 Système Bi-Sn. Diagramme d'équilibre entre phases calculé64> •••••••••••••••••••••• 116 Système Ga-Sn. Diagramme d'équilibre entre phases expérimental<65> ... 117 Système Ga-Sn. Diagramme d'équilibre entre phases calculé65) ... 117 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xaafxsi=l/2 obtenues après optimisation (modèle de Redlich-Kister-Muggianu) et comparées aux valeurs expérimentales de Muggianu<45
>,
T=723 K ... 120 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section Xaa1Xsi=2 obtenues après optimisation (modèle de Redlich-Kister-Muggianu) et comparées aux valeurs expérimentales de Muggianu<45>,
T=723 K ... l20 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section Xaalxsi=l/3 obtenues après optimisation (modèle de Redlich-Kister-Muggianu) et comparées aux valeurs expérimentales de Muggianu<45>,
T=723 K ... 121 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section Xaalx8i=1 obtenues après optimisation (modèle de Redlich-Kister-Muggianu) et comparées aux valeurs expérimentales de Muggianu<45>,
T=723 K ... 121 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section Xaa1Xsi=3 obtenues après optimisation (modèle de Redlich-Kister-Muggianu) et comparées aux valeurs expérimentales de Muggianu<45>,
T=723 K ... 122 Système Ga-Bi-Sn. Enthalpies molaires de mélange le long de la section xaafxsn=1 obtenues après optimisation (modèle de Redlich-Kister-Muggianu) et comparées aux1 ' . t 1 d M . <45> T-723 K 1 va eurs expenmen a es e uggtanu , - .. .. .. .. . . .. . . .. . .. . .. . . .. .. .. . . .. . 22 Système Ga-Bi-Sn. Isoplèthe: x8/xsn=1calculée, obtenue par le présent travail. .. l23 Système Ga-Bi-Sn. Isoplèthe : x81xGa= 1 calculée, obtenue par le présent travail...123
Système Ga-Bi-Sn. Projection des lignes monovariantes du liquidus calculées ... 124 Système Ga-Bi-Sn. Sections isothermes calculées ... 125
V 20 S t , . ys erne 1- n. tagramme B' I D' d'' 'l'b eqm t h 1 l ·<8t) 128
1 re en re p ases ca cu e ... ..
V 21 . S ys erne t , B' Pb D' 1- . tagramme eqmt re en re p ases expenmenta d'' 'l'b t h ' . 1<82) ... . 130
V22 S . ysteme ' B'PbD' d'' 'l'b h 1 1'<83) 130
1- • tagramme eqm1 re entre p ases ca cu e ... .
V23 S t , I Pb D' d'' 'l'b h '. 1<84) 132
. ys erne n- . tagramme eqm 1 re entre p ases expenmenta ... ..
V.24a Système In-Pb. Diagramme d'équilibre entre phases calculé ... 133 V.24b Système In-Pb. Diagramme d'équilibre entre phases calculé
du côté riche en indium (In) ... 133 V.25 Système In-Bi-Pb. ProJection des lignes monovariantes du liquidus
selon Stel'makh et at.< 5) rapportée par Prince<98) ..••.•••..•••..•••...•.•••.•••• 137 V.26 V.27 V.28 V.29 V.30 V.31 V.32 V.33 V.34 V.35 V.36 V.37 V.38
Système In-Bi-Pb. Projection des lignes monovariantes du liquidus
1 L. 1(97) ' p· (98) 137
se on tao et a . rapportee par nnce ... .. Système In-Bi-Pb. Pro~ection des lignes monovariantes du liquidus
donnée par Il 'v es et al. 100) •••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••• 13 8
Système In-Bi-Pb. Activités de l'indium calculées et comparées aux données
expérimentales ... 14 3 Système In-Bi-Pb. Isoplèthe Pb-Biln2 calculée et comparée aux points
expérimentaux<100) ... 144
Système In-Bi-Pb. Isoplèthe Pb-Biln calculée et comparée aux points ' • (95),(97)
experimentaux ... 144 Système In-Bi-Pb. Isoplèthe correspondant à 70% (%massique) de Bi dans le sous-système Bi-Pb-Biln calculée et comparée aux valeurs expérimentales<95) ... 145 Système In-Bi-Pb. Isoplèthe correspondant à 50% (%massique) de Bi dans le sous-système Bi-Pb-Biln calculée et comparée aux valeurs expérimentales<95) ... 145 Système In-Bi-Pb. Section isotherme calculée à T=350 K ... 146 Système In-Bi-Pb. Isothermes du liquidus et lignes monovariantes calculées ... 146 Système In-Bi-Pb. Diagramme d'é~uilibre entre phases de la section pseudo-binaire Pb-Biln2 obtenue par Il'ves et a/.0° ) ... 147 Système In-Bi-Pb. Isoplèthe xB/x1n=l/2 déterminée par Stel'mack et a/.<
96
) ... 147 Système In-Bi-Pb. Isoplèthe xBi/x1n=l déterminée par Stel'mack et a/.<95) ... .... 148 Système In-Bi-Pb. Isoplèthe xBi/Xrn=1 déterminée par Liao et at.<97) rapporté par
Les alliages métalliques capables de répondre aux nombreuses exigences des technologies actuelles (fuselage des avions supersoniques, enveloppe des sondes spatiales, trépans pour forage pétroliers, matériels photovoltaïques, etc ... ), sont très généralement formés de plus de deux constituants. Ces alliages polyconstitués offrent en effet, de meilleures performances et des garanties dans des conditions extrêmes de température, de pression, de rayonnement,.... (bonnes propriétés mécaniques, résistance à la corrosion exceptionnelle). Cependant, l'étude expérimentale complète des propriétés thermodynamiques, et en particulier du diagramme d'équilibre entre phases devant permettre 1' élaboration de ces matériaux, est souvent très difficile.
Les méthodes expérimentales utilisées pour la détermination des diagrammes d'équilibre entre phases, nécessitent une gamme très importante d'alliages correspondant à toute 1' étendue du domaine de concentration. Il faut ensuite pour chaque composition, étudier l'état d'équilibre des phases en présence (nature et quantité), à pression constante et en fonction de la température. Cette étude se fait grâce à deux types de méthode:
- les méthodes dynamiques (dilatation, analyse calorimétrique différentielle, enthalpiemétrie, ... ) qui permettent de suivre l'évolution d'une propriété physique en fonction de la température ;
- les méthodes statiques (diffraction X à chaud, effet Mëssbauer, ... ) qm pennettent de suivre l'évolution de la structure jusqu'à son équilibre.
Ces deux méthodes peuvent être complétées par des analyses chimiques.
En général, un diagramme d'équilibre entre phases est obtenu progressivement, par fractions et par différents chercheurs ; dans la plupart des cas, il est la synthèse d'un grand nombre de travaux.
De telles opérations, nécessaires pour
la
détermination pratique des différents équilibres entre phases dans un système polyconstitué, impliquent un grand nombre de mesures et donc un temps assez long.C'est la raison pour laquelle la prévision des diagrammes d'équilibre entre phases, par le calcul apparaît particulièrement importante aujourd'hui.
Le calcul permet non seulement d'obtenir les diagrammes d'équilibre entre phases des systèmes assez complexes le plus rapidement possible, mais aussi à un meilleur coût. Il permet aussi de vérifier la compatibilité entre les données thermochimiques et les diagrammes d'équilibre entre phases.
Le succès de cette approche théorique ces dernières années, est lié au développement de 1' informatique et des nombreux programmes de calcul qui fournissent une rapidité et une facilité d'exécution des problèmes numériques. En effet, différents logiciels de calcul thermodynamique permettent maintenant d'estimer les diagrammes d'équilibre entre phases de systèmes complexes à partir de la modélisation de l'enthalpie libre des différentes phases en_présence.
Notons enfin, que le calcul thermodynamique trouve un intérêt particulier dans 1' estimation des diagrammes d'équilibre entre phases de certains systèmes formés d'éléments ayant un faible point de fusion, comme le gallium (Ga) (les liaisons Ga-Ga liquide sont très fortes et donc sont difficiles
à
casser, cela peut s'expliquer par la température d'ébullition très élevée de ce métal: 2573,15 K). Kubaschewski et Chart (1964-1965i1) ont fait remarquer d'autre part, que les déterminations expérimentales d'équilibre liquide-solide de systèmes comportant des métaux à forte tendance à la surfusion, étaient délicates à réaliser. Selon les conclusions de leur étude, le calcul du diagramme d'équilibre entre phases de tels systèmes, à partir des données thermochimiques de mélange à 1' état liquide, pourrait conduire à des résultats plus satisfaisants que ceux obtenus par analyse thermique différentielle par exemple.Dans ce mémoire nous accordons une attention particulière à ce type d'alliages. L'étude des systèmes ternaires à base de gallium et d'indium constitue notre objectif principal. Pour les six systèmes: Ga-Bi-In, Ga-Bi-Sn, Ga-In-Pb, Ga-In-Sn, In-Bi-Pb et In-Pb-Sn, les enthalpies de mélange ont été calculées à partir de différents modèles thermodynamiques.
Les diagrammes d'équilibre entre phases des ternaires: Ga-Bi-Sn et In-Bi-Pb ont été ensuite estimés grâce à l'ensemble des modules du logiciel THERMO-CALC(2) dans ses versions k et l développées au "Royal Institute of Technology" de Stockholm en Suède.
Ce travail comprend deux parties :
- la première partie comporte trois chapitres relatifs à l'estimation des grandeurs thermodynamiques de mélange des liquides métalliques, grâce aux modèles thermodynamiques. Un accent particulier a été mis sur le modèle en paires de bras ;
- la deuxième partie composée de deux chapitres, présente les principes de l'estimation thermodynamique des diagrammes d'équilibre entre phases et l'application aux deux systèmes ternaires mentionnés ci-dessus.
Nos différentes observations à l'issue de cette étude constituent la conclusion de ce mémoire.
MODELISATION DES GRANDEURS THERMODYNAMIQUES DE
FORMATION DES LIQUIDES METALLIQUES
CHAPITRE!
PRESENTATION GENERALE DES MODELES EN
THERMODYNAMIQUE
I.l SITUATION DES MODELES D'INTERACTION EN THERMODYNAMIQUE
La détermination et l'interprétation des grandeurs thermodynamiques de mélange des solutions non idéales (voir au paragraphe 1.2.2, pour la défmition des solutions non idéales) présentent un intérêt considérable tant sur le plan théorique (lien structure-propriétés, nature des interactions entre particules, existence éventuelle d'espèces en solution, ... ), que sur le plan pratique (estimation des diagrammes d'équilibre entre phases, élaboration des matériaux, ... ).
Ainsi l'enthalpie de formation positive d'une phase liquide ou solide peut être interprétée comme étant une tendance aux homoassociations ou à la démixtion, tandis qu'une valeur négative de la même grandeur laisse présumer une tendance à 1 'hétéroassociation pouvant conduire à la formation d'un composé intermédiaire.
En pratique, si les données thermodynamiques pour les systèmes binaires sont relativement abondantes, elles sont plutôt rares pour les systèmes à plus de deux constituants. Aussi, semble-t-il judicieux de rechercher des expressions permettant d'évaluer les grandeurs thermodynamiques des systèmes polyconstitués, à partir des systèmes binaires limitrophes correspondants.
Cette démarche constitue la base de l'application de la thermodynamique statistique aux solutions métalliques, en vue de l'établissement des modèles.
Dans l'établissement des modèles en thermodynamique, toute phase condensée est décrite comme étant un ensemble de particules porteuses d'énergie. Au sein de cet ensemble, chaque particule peut avoir plusieurs énergies; le problème consiste d'abord à savoir comment les particules se distribuent sur les divers niveaux énergétiques possibles. Cette répartition peut être caractérisée, par la fonction de partition du système que constitue 1' ensemble des particules. La fonction de partition permet d'atteindre les valeurs moyennes des grandeurs correspondant à la configuration la plus probable du système.
Les modèles peuvent différer non seulement dans la manière dont la fonction de partition est calculée ou estimée, mais aussi par le choix, du type de particules ayant une certaine énergie. Ce choix est lié à la nécessité de décrire:
- la structure de la phase étudiée, c'est-à-dire les positions relatives des particules (informations géométriques) pour traduire ainsi la configuration de la phase;
- les interactions entre les atomes (informations énergétiques) qui sont liées à la configuration mais aussi à la nature des espèces atomiques.
Les entités porteuses d'énergie peuvent être très diverses, cependant les modèles d'interaction les plus connus sont issus soit de la description en «paires »(J) soit de la description en« atomes entourés
»<
4>.
Alors que la notion de « paires » est assimilable à une liaison entre deux atomes indépendamment de l'entourage de ceux -ci, l'entité « atomes entourés » est constituée par un atome discernable d'un autre selon la composition et la configuration de son entourage de proches voisins.
Quelque soit le support statistique, l'évaluation de la fonction de partition du système considéré, nécessite toujours certaines hypothèses simplificatrices. Celles-ci, peuvent avoir pour conséquence de diminuer la portée pratique des modèles.
Les hypothèses de base caractérisent le modèle, et leurs différentes combinaisons possibles conduisent à une grande variété d~ modèles. Il n'existe donc pas, une formulation générale adaptée à tous les types d'alliages, et chaque modèle à un domaine d'application (plus ou moins grand) qui lui est propre.
1.2 REPRESENTATION ANALYTIQUE DES FONCTIONS THERMODYNAMIQUES
I.2.1 Solution idéale
Certaines grandeurs molaires de mélange telles que l'enthalpie molaire, l'entropie molaire et l'enthalpie libre molaire sont données par les expressions suivantes :
- enthalpie molaire de mélange : ôH 0
-entropie molaire de mélange: 8S -Rix1Ln(x1)
-enthalpie libre molaire de formation: ôG =RTL x1 Ln(x1)
xi: fraction molaire du constituant i, R : la constante des gaz parfaits, T: la température absolue.
La solution idéale obéit à la loi de RAOULT, l'activité de chaque constituant est égale à sa fraction molaire ; elle ne varie donc pas avec la température. Le coefficient d'activité y1 correspondant est égale à 1 :
y1 =
5..
1, a, : activité de i, y1 : coefficient d'activité dei.xi
L'enthalpie molaire est nulle ce qui traduit l'égalité des forces d'attraction (ou de répulsion) entre les espèces de même nature et les espèces de nature différente de la solution. Aussi, le volume de la solution idéale est-il égal à la somme des volumes des constituants à l'état pur.
1.2.2 Solutions non-idéales
La plus grande partie des solutions métalliques ne suit pas le comportement idéal. Le mélange des constituants s'accompagne de manière générale d'une variation de volume et d'un effet thermique. L'enthalpie de mélange de la solution n'est pas nulle et le coefficient d'activité y1 de i est différent de 1.
L2.2.1 Modèles d'interaction
Il serait impossible de faire un inventaire complet des diverses formulations obtenues par voie statistique, pour analyser les propriétés thermodynamiques des phases condensées. La liste des modèles que nous décrivons ci-après n'est donc pas exhaustive.
1.2.2.1.1. Le modèle des solutions régulières de substitution
Dans le cas le plus simple, celui des solutions régulières de Hildebrand(5),
chaque atome est entouré d'une couche de voisins dont le nombre z, ou nombre de coordination, est le même quel que soit l'atome central. La composition moyenne de la solution est de zx; atomes i (x1 est la fraction molaire de i). D'autre part, le modèle
suppose, que ce soit pour 1 'état solide ou liquide: une répartition complètement aléatoire des atomes sur les sites du réseau (solides) ou du quasi-réseau (liquides), une séparation des degrés de liberté et une absence d'interaction à longue distance. Le nombre de paires ij est donc proportionnel au produit xix
1 ; x; et x 1 sont les fractions
molaires des constituants i et j dans la solution. L'enthalpie de mélange obtenue est égale à:
i=m-l J=m
AH
I I(t-
oij
);tijxixj (1.1)i=l J=m+l
avec X = z~ [ -E l +-E l lj 2 " 2JJ
À ,1 représente l'énergie de formation des paires hétero-atomiques ij selon la réaction
élémentaire : ii+ jj ~ 2ij
m est le nombre de constituants formant la solution· '
~ est Je nombre d'Avogadro, Eu est 1 'énergie de la paire ii.
{
o.
= 1o
ij est le symbole de Kronecker dé fmi comme suit : '1 _o
11 -o
si i = j
L'hypothèse du désordre total dans la solution conduit à une entropie de mélange idéale M'd : 1=m M I:J.S1 d == - R
Lx,
Ln(x
1) (1.2) 1=1L'avantage de ne comporter que des paramètres déductibles de systèmes binaires limitrophes, a fait du modèle des solutions régulières, un outil d'estimation largement utilisé.
Le modèle régulier a été étendu aux sels ioniques, aux phases stœchiométriques et aux solutions interstitielles par Hillert et Staffanson(6).
En outre, Jordan(7) a développé un modèle dit des « solutions régulières associées ». Ce modèle a permis de décrire les propriétés thermodynamiques de liquides métalliques présentant des hétéroclusters, ne pouvant pas être traités comme des solutions régulières, telles que définies ci-dessus.
Jordan introduit une hypothèse supplémentaire: celle de l'association. Ainsi un binaire A-B est traité comme un système ternaire A-B-C, ou C représente les associations
Laugier(&) a étendu ce concept aux systèmes ternaires. D'une manière générale, ce modèle a donné des résultats satisfaisants, dans la description des propriétés thermodynamiques des systèmes binaires fortement associés, notamment les systèmes III-V et Il-VI comportant des semi-conducteurs.
1.2.2. 1.2 Le modèle quasi-chimique
Le modèle quasi-chimique de Guggenheim(3), conserve un nombre de coordination identique pour tous les atomes, mais il tient compte de 1 'action compétitive des différentes espèces d'atomes vis-à-vis d'un atome central. Cette action est traduite par l'équation donnant le nombre P;1 des paires ij:
9
Cette équation rappelle l'expression mathématique de la condition d'équilibre chimique entre les paires ii, jj et ij:
ii+ jj-+ 2ij
N; est le nombre d'atomes i dans la solution.
o
iJ est le symbole de KroneckerL'enthalpie de mélange et l'enthalpie libre d'excès de mélange sont exprimées de la manière suivante:
(1.4)
i=m
oùN IN,
i=l
avec f>;* le nombre de paires quasi-chimique, et f>;~ le nombre de paires dans le désordre complet.
Les formulations obtenues sont peu maniables et nécessitent une résolution numérique. Elles sont cependant indispensables pour établir un lien entre l'ordre à courte distance et les grandeurs thermodynamiques.
Bonnier et a/.(9) et Hagemark(JO)' ont utilisé ce modèle pour décrire les
propriétés thermodynamiques des solutions liquides ternaires.
Ce modèle a été également utilisé avec succès par Stringfellow et Greene<II),(I2l,
pour l'estimation des liquidus des diagrammes d'équilibre entre phases de systèmes ternaires.
Un modèle quasi-chimique «modifié» développé par Sharkey et
at.<'
3l, a étéCe modèle suppose que l'enthalpie de mélange est composée de trois différentes énergies dues à trois types de réaction:
- une énergie de transformation qm fait passer les constituants purs à la structure de mélange;
- une énergie relative à la compression ou à la dilatation des constituants;
- une variation d'énergie due à l'interaction entre les différents constituants du mélange.
L'enthalpie de mélange d'un système ternaire est égale à:
(!.6)
Les termes a1 et a2 sont relatifs aux énergies de liaison, de transformation et de dilatation, tandis que a3 traduit l'ordre à courte distance et q est le terme d'interaction provenant de l'analyse de l'énergie de liaison. Ces coefficients sont obtenus par la méthode des moindres carrés à partir des données expérimentales.
1.2.2.1.3. Le modèle de Van Laar-Hildebrand14J
Dans ce modèle, le nombre de proches voisins ou la coordinence est fonction de la nature de l'atome central; le nombre de chaque type de paires dépend non seulement des fractions molaires (comme c'est le cas dans le modèle des solutions régulières), mais également des fractions volumiques.
L'expression de l'enthalpie de formation qui en découle est la suivante:
t=m
L L
AH1
~nV1
x,x1
AH= _i=_l . . : _ _ . . , .
-i=m (!.7)
Elle dépend des volumes molaires ~ et ~, et des compositions xi et x1 des constituants
i etj.
t:.H,7n représente l'enthalpie partielle de mélange dei à dilution infinie dans j.
L'entropie de mélange associée à cette enthalpie est idéale.
1.2.2. 1.4. Le modèle de //l'atome entouré "
Le modèle en atome entouré développé simultanément par Mathieu et coll.<4l,
Hicter et a/.05
>,
Lupis et Elliot<16),(t?) pour des solutions binaires, a été étendu aux systèmes ternaires par Brion et a/.08>·<19>.C'est dans la nature du support statistique élémentaire permettant de décrire la phase étudiée que réside 1 'originalité de ce modèle. Le concept de base est configurationnel: il s'agit d'un atome dans le champ de force de z proches voisins. En tenant compte des hypothèses classiques(séparation des degrés de liberté, structure quasi-réseau pour le liquide, absence d'interaction à longue distance), Mathieu et Lupis<16) admettent une relation parabolique de l'énergie potentielle par rapport à la
composition de l'entourage, et après traitement statistique, proposent pour les grandeurs thermodynamiques d'excès de mélange, l'expression suivante:
X,~'Jl est la grandeur partielle molaire d'excès dei dans le binaire i-j à dilution infinie.
Une série d'applications aux phases les plus diverses, permet de montrer tant lors des représentations que d'estimations, les performances de ce modèle. Le caractère interprétatif, plus particulièrement sur l'effet d'ordre à courte distance est mis en évidence.
La prise en compte d'une entropie d'excès fait du modèle de l'atome entouré, l'un des modèles les plus complets. En effet, l'un des points faibles communs des modèles d'interaction est qu'ils ne rendent pas compte en général de l'entropie thermique, due entre autres à la modification des vibrations atomiques. Ils laissent ainsi de côté une part importante de l'entropie de mélange. Compte tenu de cette limite, ces modèles d'interaction s'appliquent mal aux systèmes d'ordre supérieur. Cette situation motive l'utilisation de formules empiriques d'estimation pour relier les grandeurs des systèmes temaires et d'ordre beaucoup plus élevé aux grandeurs des binaires.
Ces expressions s'obtiennent soit par une pondération géométrique, soit par des polynômes d'ordre n.
1.2.2.2 Expressions géométriques empiriques
1.2.2.2. 1 Expression de Tool20J
La variation d'enthalpie libre d'excès du ternaire A-B-C est donnée par l'équation:
Cette équation s'applique avec succès, quand les binaires considérés sont réguliers, conduisant ainsi à un ternaire régulier.
/.2.2.2.2 Expression de Bonnier et Caboi21J
Bonnier propose, pour la variation de l'enthalpie libre d'excès de mélange, pour un système temaire l'expression suivante:
Cette formule non symétrique, tout comme celle de Toop, a été appliquée à des systèmes ternaires où deux binaires ont des interactions importantes par rapport au troisième.
1.2.2.2.3 Expression de Kohte/22)
Kohler exprime l'énergie de Gibbs d'excès par la formule symétrique suivante:
llGu
=[(x A
+
X8 )
2llG% }.-_. +
[(xA
+Xc )2 !lG_:c ]x_.+
[(x 8
+Xc )2llG:C
]x. (I.ll)~ ~ ~
Une telle formulation s'applique en particulier dans le cas où il se produit un équilibre entre une solution ternaire et un élément ou un composé intermétallique.
Dans le cas des systèmes d'ordre supérieur, l'expression de Kahler devient:
(1.12)
/. 2. 2.2.4 Expression de Coline/23)
L'enthalpie libre d'excès est donnée par l'équation suivante:
+~-(llG';) +~(AG_:c).
+
(AG';)
l
(1.13)1 -X 'c 1 X x< l X Xo
C A 8
ou par la formule plus générale:
(1.14)
Cette expression s'applique aussi bien aux systèmes polyconstitués à faibles interactions qu'à fortes interactions.
1.2.2.2.5 Expression de Muggianu et collJ24J
Muggianu propose pour 1' enthalpie libre d'excès:
4xAxB { xs)
-:-( ___
-,:-).:.,-(-=----)
t:,.G AB (.<B)2x A +Xc 2x 8 +Xc x, =x,
(1.15)
où
{t:.c;L,,(,,)
représente l'enthalpie libre d'excès de mélange dans le système binaire i-jcalculée pour la composition binaire définie par 1' indice xi(iJ). Cette composition x}il)
est obtenue en projetant la composition de la phase ternaire perpendiculairement à l'axe représentant le binaire i-j, comme l'indique la figure I.l.d.
A A A A
B C B c c
Figure I.l : Représentation des différentes projections(25>.
a): Toop<201 et Bonnier(21
), b): Kohler<221, c): Colinet<23), d): Muggianu!24)
l2.2.3 Expressions analytiques
1.2.2.3.1 Modèle de Redlich-Kister(26J
Redlich-Kister exprime l'enthalpie libre d'excès sous la forme d'un polynôme de degré n:
Y=n
t:.Gxs =xAxs.2:0~.
8
(xA X8Y
(1.16) v=OLes paramètres a~ 8 peuvent être fonction de la température selon:
'
1.2.2.3.2 Equations du type Marguie/27)
Elles sont basées sur la représentation des propriétés thermodynamiques par des polynômes, dont l'expression est :
11Gxs
=
LX;x1aiJ + Ix;x1xkaifk + Ix;x1xkx1+ ... . (1.18)lj ~ ~
i=m j=m k=m
où la somme Ix;x1xt, par exemple correspond à:
Ix;
I x1 Ix*aifkijk i=l j=l h l
aijk sont des paramètres de nature expérimentale
avec aiJk a Jik = a"iJ et aw a .iJJ = aw
=
0.1.2.2.3.3 Expression de KrupkowskP8J
L'enthalpie libre d'excès donnée par Krupkowski est égale à:
(1. 19)
a IJ , k;
1 et m;1 sont déduites à partir des valeurs expérimentales des binaires.
Cette formule est utilisée pour les systèmes montrant une déviation positive par rapport à l'idéalité.
1.2.2.3.4 Expression de Wilson(29J
A partir de l'expression de l'enthalpie libre d'excès de certains composés organiques, Wilson propose:
(1:20)
CHAPITRE II
MODELISATION DES GRANDEURS THERMODYNAMIQUES
DE FORMATION DES LIQUIDES METALLIQUES
PAR LE MODELE EN "PAIRES DE BRAS"
Le modèle en "paires de bras" a été développé par Kotchi(30), pour estimer les grandeurs thermodynamiques de mélange des systèmes binaires et ternaires à fortes interactions, souvent désignés par le terme de : solutions associées.
Ce modèle qui a la particularité de prendre en compte l'effet de volume dans sa formulation, a permis de traduire d'une manière satisfaisante, les propriétés thermodynamiques des liquides à fortes interactions: IV8 V/8 (nomenclature anglaise).
La description des solutions métalliques par la paire de bras, a été utilisée par Niamien(31)' pour rendre compte de l'état d'association dans les liquides Pb-Te et Pb-Se révélé par Glazon et al. <32).
Tout récernment<33), le modèle en paires de bras nous a permis de représenter les grandeurs thermodynamiques de formation, dans le cas particulier des systèmes binaires à faibles interactions interatomiques, avec un important effet de volume. Ces binaires présentent les caractéristiques suivantes :
- diagrammes d'équilibre entre phases simples, sans composés définis, avec un eutectique déporté du coté du constituant à plus petit volume atomique ;
- démixtion en phase liquide ou une inflexion du liquidus indiquant une tendance à la démixtion ;
important écart entre les volumes atomiques des constituants ; -valeurs positives et relativement faibles de l'enthalpie de mélange.
Le but de ce développement était de donner une justification théorique à la relation de Van Laar.
Dans ce chapitre, nous reprenons le formalisme de paires de bras pour analyser les grandeurs thermodynamiques de formation des systèmes ternaires à faibles interactions interatomiques.
II.l HYPOTHESES GENERALES
Considérons un alliage ternaire A-B-C, formé de NA atomes de A, N 8 atomes de B et N c atomes de C. La réaction de mélange qui conduit à la formation de la solution s'écrit :
La description à l'échelle microscopique de la solution suppose la prise en compte de toutes les interactions dans le mélange liquide. Ces interactions dépendent de la nature et de l'origine des atomes en contact. Le support énergétique étant la paire de bras, nous abordons ici le problème des interactions moyennes en raisonnant en termes de bras.
La notion de bras traduit la possibilité que possède un atome, d'interagir avec l'un de ses proches voisins. Dans l'hypothèse où les interactions sont faibles, nous ne distinguons qu'un seul type de bras: les bras libres. Ces bras, capables d'interagir entre eux de façon quelconque vont engendrer dans la solution les interactions suivantes : AA, BB, CC, AB, AC, et BC. Dans ces conditions en admettant:
- la séparation des degrés de liberté (rotation, vibration, etc ... ), - la structure en quasi-réseau,
-le nombre de coordination fonction de l'atome central,
nous arrivons à l'écriture de la fonction de partition canonique, d'où sont déduites les principales propriétés thermodynamiques de l'alliage.
11.2 ETUDE D'UNE CONFIGURATION DE LA SOLUTION
Soient z A, z 8 et zc les nombres de coordination respectifs des atomes A, B et
C.
Avant le mélange, le système est formé de la juxtaposition de NA atomes A,
N 8 atomes B et N c atomes C. Dans cet état, le système possède zAN A bras libres A,
z 8 N 8 bras libres B et zc N c bras libres C. Ce qui donne :
~zAN
A paires de bras AA,±
z 8 N 8 paires de bras BB et~
N c paires de bras CC. Après le mélange, si l'on désigne par :- z Az 8 P, le nombre de bras de A et de B engagés dans la formation des paires AB;
z Aze M, le nombre de bras de A et de C engagés dans la formation des paires AC;
N, le nombre de bras de B et de C engagés dans la formation des paires BC;
les nombres de bras susceptibles de former les paires AA, BB et CC sont :
(zANA ~zAz8P ZAZcM), (z8N8 ~zAz8P~z8zcN) et (zcNc ZAZcM-z8zcN).
Ce raisonnement conduit au dénombrement des différentes paires présentes dans la solution.
Aux paires de bras AA, BB, CC, AB, AC et BC, nous affectons les énergies respectives : E AA, E 88 , Ecc, E AB, E Ac et E ac qui sont indépendantes de la composition du mélange.
Tableau H.l : Nature, nombre et énergies des paires de bras
SYSTEME NATURE NOMBRE DE ENERGIE DES DES PAIRES DE BRAS PAIRES DE BRAS PAIRES
Corps
lA
AA /2zANA 1/2zANAEAAPurs B
BB
l/2z8N8 1/2z8N8E88 Liquidesc
cc
12zcNc ll2zcNcEccAA 12zA NA z8P-zcM) l/2zAI NA -z8P-zcM)EAA
BB
12z8 N8 -z,~,P ZeN) 112z8l
N13 - z Ap- zcN)E8BMélange
cc
12zr Ne -zAM -zRN) l/2zcl N_c_- z _A_M zJLNlE..Œ· (A,B,C) AB zAz8P z AzBPE AB
AC ZJZrM zAzcME~c
BC
z8zcN ZRZrNERrII.2.1 Calcul de l'énergie totale de configuration de la solution
Cette énergie est la somme de toutes les énergies des différentes paires de bras que comporte la solution:
On en déduit :
(11.2) avec:
l
<t> A =
2
zAN A E AA : énergie potentielle de configuration du liquide pur A. l<l) 8
2 z 8 N 8 E 88 : énergie potentielle de configuration du liquide pur B.
l
Et :
AA + BB ~ 2AB
AA+CC~ 2AC
l
ÀBc 2~(2E Be-E BB- Ece)' BB+CC~ 2BC
~est le nombre d'Avogadro.
II.2.2 Fonction de partition configurationelle de la solution
Etant donnés la température : T, le volume : V et les nombres d'atomes : NA,
N 8 , Ne, la fonction de partition configurationelle de 1' alliage s'écrit :
"'
( <f>)
"'
(
<t>(P,M,N)J
Q = L...,exp -kT = L..., exp - kT
conf P.M,N
(II.3)
Pour les corps purs, nous avons :
QA
=
:Lexp(-
<f>A)
conf kT (
zN E )
exp -
A 2;T AA :liquide
pur A.QB
=
:Lexp(-<DB)
conf kT
liquide pur B.
'Ç" L...,exp - - =exp -(
<De)
(
ZeN eEce)conf kT 2kT
liquide pur C.
k est la constante de Boltzmann.
Nous pouvons ainsi définir une configuration moyenne de la solution par :
(liA)
où g( NA, N 8, N c) représente le nombre maximal de termes que comporte la somme
n
(fonction de partition de configuration), et <I>(r,
M., N.) 1' énergie moyenne de configuration.g( NA, N 8, N c) n'est rien d'autre que le nombre total de combinaisons possibles
entre NA ·atomes A, N 8 atomes B et N c atomes· C, sur (NA + N 8 + N c) sites du
quasi-réseau. Il s'écrit:
(ILS)
nombre moyen de paires de bras AB, le nombre moyen de paires de bras AC, et le nombre moyen de paires de bras BC.
En supposant une répartition aléatoire des bras libres du système, la probabilité d'avoir AB:
-à partir d'un atome A est PA8
=
PA P8 ,-à partir d'un atome B est P8A P8PA
=
PA8 •Avec:
____ _:.:___...:..:_ _ _ _ et PB
=
----=----=----zAN A +zaNB +zcNc zAN A +zBNB +zcNc
(II.6)
La probabilité d'avoir AB est donc: 2PA PB. Le nombre total de paires de bras dans
1
l'alliage étant égal à :-(zANA +z8N8 +zcNc), nous en déduisons le nombre moyen de
. 2 .
Il vient :
(II.7)
De même:
(II.8a)
(II.8b)
II.3 GRANDEURS THERMODYNAMIQUES DE FORMATION DE LA SOLUTION
II.3.1 Grandeurs intégrales
//.3. 1.1 Enthalpie libre de formation
L'énergie libre F est reliée à la fonction de partition totale Q de la solution par la relation :
F
=
-kTLn(Q) (II.9)où Q
=
D.qs (séparation des degrés de liberté). Avec:D. : fonction de partition configurationnelle
q s : fonction de partition relative aux vibrations thermiques des atomes autour de leur position d'équilibre, et aux propriétés internes( électroniques, nucléaires, etc .... ):
vib int
qs
=
q .q (11.10)Nous pouvons alors écrire:
F
=
-kT(LnD + Lnq.) (ILl 1)L'énergie libre de mélange est exprimée par:
(II.12)
F étant l'énergie libre de la solution et FA, F8 , Fe respectivement les énergies
libres des corps purs A, B et C, données par les expressions ci-dessous :
FA =-kT( LnDA + Lnq;4 )
F8 =-kT( LnD8 + Lnq:)
Fe =-kT( Lnnc + Lnq;).
(II.13)
Pour les corps condensés, lorsqu'on opère à pression peu élevée, l'énergie libre de mélange est approximativement égale à l'enthalpie libre de mélange, c'est-à-dire:
I:J.F := !:J.G. D'après la relation (II.12), nous avons:
tJ.G:=F F4 F8 -Fc
=
kT( LnD- LnD A - LnD 8 LnDc) kT( Lnq s - Lnq ;4 Lnq 5 8 - Lnq;) (II.l4) Posons: Lnq:- Lnqn (ILlS)D'après (II.4):
N0!1G1 = -k~TLng +~<l>(P•, M• ,N•)-<1> A -<1>8 -
<De}
Il vient: ôG f
~:=Meon/:
est l'entropie molaire intégrale de configuration de la solution.0
L'utilisation de la formule de Stirling simplifiée permet d'écrire:
D.Sconf - R(x A Ln( x A)+ x 8Ln(x8 ) +Xc Ln( xc))
avec:
R k~: la constante des gaz parfaits.
(II.l6)
(II.l7)
x A
=
NNA , x 8=
,
Xc=
NNc : les fractions molaires de A, B et C dans lao No o
solution.
L'enthalpie libre molaire intégrale de formation de l'alliage liquide par référence aux constituants purs liquides A, B et C est:
1
AG,
=
---·---, ZAXA + ZBXB + ZcXc
(II.l8) ou encore sous forme condensée:
(II.I9)
Dans cette expression le terme
l,RN, LJ
TI'q:
J
=!>Su
représente l'entropie d'excès.1
l,
Les relations générales de la thermodynamique classique, permettent d'obtenir à partir de 1 'expression de AG 1, les enthalpies et entropies intégrales de mélange de la
solution.
Il. 3.1. 2. Enthalpies et entropies de formation de la solution par référence aux corps purs liquides
JI.3.1.2.1. Enthalpies de formation
L'enthalpie de formation est reliée à l'enthalpie libre de formation par la relation:
{A~/)
---~~-c{i)
(II.20)On en déduit d'après (Il.l9):
1!.3.1.2.2. Entropies de formation
L'entropie de formation est définie par:
(II.22)
Il vient:
(II.23)
Les grandeurs partielles dérivent directement des différentes grandeurs intégrales obtenues.
II.3.2. Grandeurs partielles
1/.3.2.1. Enthalpies molaires partielles
L'enthalpie partielle molaire de mélange du constituant i est la dérivée partielle de l'enthalpie intégrale (II.20) par rapport à N,:
~H,=[~N:,)]
T.P,N,"-N,
(II.24)
On obtient après calcul:
~H,
=L:,x, [ (
~(l-8,
)œ,.x,)-
z,!ili1 ] (11.25)Pour le constituant A, par exemple on aura:
t..H ;1
(11.26) ou encore:
(11.27)
Les enthalpies partielles des constituants B et C sont données en Annexe A.2.
11.3.2.2. Entropies molaires partielles
L'entropie molaire partielle de mélange du constituant 1 'expression:
On en déduit d'après (11.23 ):
~
-RLn(x,) +R:,
l
Ln[~'q;J
L
N,'NPour le constituant A, on a:
est donnée par
(11.28)
(11.29)
(11.30)
désigne l'entropie
De même, pour les constituants B et C, on obtient:
!!Sn RLn(x8 ) +
I!S;:
!!Sc - RLn(xc) + /!S(:'
//.3.2.3. Potentiels chimiques de mélange
Pour un constituant i du mélange, on a:
(II.31)
(Il.32)
(11.33)
J11 et
JLi
sont respectivement les potentiels chimiques de i dans le mélange et de référence.(Il.33) peut s'exprimer en fonction de l'enthalpie et de l'entropie partielles molaires:
(II.34)
Les équations (II.25) et (11.30) permettent d'écrire:
t-,G,
~
L;:,
x, [ (
~(1-
5 •)ùi,,
x,) -
z,lili 1 ] + RTLn(x,)-&S,u
(II.35)k
!J.G, est relié à l'activité a; dei par l'expression:
d'où:
(11.37)
avec
r,,
le coefficient d'activité dei.Connaissant l'expression de /!..Gi' on peut ainsi calculer les activités et coefficients d'activité des différents constituants du mélange.
11.3.3. Evaluation de l'entropie d'excès de mélange
L'écart à l'idéalité fait apparaître une entropie d'excès /!..Sx.r qui est attribuée à deux efiets:
- l'apparition d'ordre à courte distance, due au facteur de taille ou au facteur chimique, provoquant une entropie d'excès de configuration /!..S;::nf toujours négative;
- la modification des chaleurs spécifiques donnant naissance à une entropie d'excès thermique &)1: de signe quelconque, qui englobe les contributions d'origine
vibratoire, électronique et magnétique : M1~'
=
Mé, + /!..Sv,b + /!..S magnLa part due à 1' entropie d'origine magnétique 8.S magn, est généralement assez
réduite, sauf dans le cas où les propriétés magnétiques d'un des constituants changent au cours de la formation de l'alliage.
La contribution d'origine électronique 8.Sé1, est due aux électrons de
conduction. Cette contribution généralement faible, peut être très importante dans les alliages où interviennent des métaux de transition.
L'entropie d'origine vibratoire /!..Svib, due à l'addition d'atomes étrangers dans une matrice semble être présente de manière permanente quel que soit le type d'alliage<34).
Dans le cas de notre étude, nous négligeons les contributions magnétique et électronique. L'entropie d'excès thermique 8.S1: se réduit donc au seul terme
Il vient:
(Il.38)
Dans ce paragraphe, nous proposons au moyen du modèle en paires de bras, une méthode de calcul de 1' entropie d'excès dans le cas des alliages à faibles interactions.
Pour traduire l'effet d'ordre à courte distance dans la solution dû à l'effet de volume ( f...S;:mf ), nous reprendrons le développement effectué au paragraphe II.2, en nous plaçant dans le cas de l'approximation quasi-chimique de Guggenheim (la solution n'est pas complètement désordonnée et les paires sont orientées) . L'évaluation de l'entropie de vibration ne fera pas l'objet de ce travail.
Traitement quasi-chimique du modèle en paires de bras: détermination de l'entropie d'excès de configuration
*Calcul des nombres de paires de bras à l'équilibre
Toutes les hypothèses énoncées en II.l sont conservées. Par contre, la distribution des atomes dans la solution, n'est plus complètement désordonnée.
Dans l'approximation quasi-chimique, le nombre de configurations g est proportionnel au nombre u des permutations distinctes entre les paires constituant la solution:
g
=
h( NA , N 8 , N c)u
(II.39)D'après la description de la configuration de la solution faite précédemment, on a:
avec:
n(A,B,C)
[~~-(NA
z8P- M)]{z;(N8 -zAP-N)}[~i(Nc-zAM-z
8
N)}
(II.41)
h est le facteur de normalisation calculé, en exprimant que le nombre de toutes les configurations de paires, pour toutes les valeurs possibles de P, M, N, est égal au nombre des configurations obtenues par permutation des atomes:
~ ( ) +Na+Nc
~ g p' M, N' NA , NB , N c
=
-'----'-'---=---'-·P.A1.N NA!NB!Nc!
(II.42) Par application de la méthode de maximisation, la somme (II.42) peut être remplacée par son terme maximal
g(
p•, M., N ·), défini par le système d'équations ci-dessous:ôLn(g} ôP ôLn(g) - - · - - == ôlvf ôLn(g) ôN L (zAzBp)-0 z8 n -2 Ln[!.A(N -z P-z M)]+ zAzc Ln[2c(N -z M -z N)] (11.43) 2 2 A B C 2 2 CA B
2
Lf;(N,-z,P
z,N)]+
2
Ln[
2;(N,-
M-z,N)]
Ln( z8z;.N)=
0Ln(g) dans le système (11.43) se déduit des expressions de g et de u données par les égalités (1!.39) et (II.40). Ln(g) est explicité en Annexe A.3.
Le système est vérifié par les valeurs suivantes:
p•
=
NAN B M* _ _ _ N-'-'.___.:::_ _ _ _zANA +zBNB +zcNc' zANA +zBNB +zcNc
(II.44) qUJ désignent les nombres de paires de bras AB, AC et BC dans le cas d'une distribution complètement désordonnée. Elles déterminent le facteur de normalisation:
(11.45)
*Fonction de partition de configuration:
n
La fonction de partition de configuration est une somme étendue à toutes les valeurs possibles de M, Net P:
n
=
I
g(P,
M,N)exp[-cl>(P,
M,N)lP,M,N kT
(11.46)
Une deuxième application de la méthode de maximisation permet le calcul de cette somme:
(
- __
)
[ cl>(P,
M,N)]Q
=
g P, M, N exp -----"---'-kT (II.47)
Les valeurs moyennes: z Az 8
P,
z Aze Metz 8zc N des nombres de paires à l'équilibresont solutions de l'équation suivante et deux autres analogues: oLn(g) ôP -z z Ln (z z A 8