HAL Id: tel-02998602
https://tel.archives-ouvertes.fr/tel-02998602
Submitted on 21 May 2021HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Mécanismes moléculaires impliqués dans les réponses à
l’exposition in utero des cellules germinales aux
bisphénols
Sonia Abdallah
To cite this version:
Sonia Abdallah. Mécanismes moléculaires impliqués dans les réponses à l’exposition in utero des cel-lules germinales aux bisphénols. Médecine humaine et pathologie. Université de Paris, 2019. Français. �NNT : 2019UNIP7031�. �tel-02998602�
1
Université de Paris
Ecole doctorale BioSPC (n° 562)
Laboratoire de Développement des Gonades (LDG)
Mécanismes moléculaires impliqués dans les
réponses à l’exposition in utero des cellules
germinales aux bisphénols
Par Sonia ABDALLAH
Thèse de doctorat de BiologieSpécialité : Développement, Génétique, Neurosciences, Reproduction, Vieillissement
Dirigée par Virginie ROUILLER-FABRE Et par Marie-Justine GUERQUIN
Présentée et soutenue publiquement le 30 octobre 2019 Devant un jury composé de :
Pr. Armelle BAEZA, Université de Paris, Présidente du jury
Dr. Céline GUIGON, Unité de Biologie Fonctionnelle et Adaptative, Paris, Rapporteur
Dr. Eric PAILHOUX, INRA, Jouy-en-Josas, Rapporteur
Dr. Pascale CHAVATE-PALMER, INRA, Jouy-en-Josas, Examinateur Dr. Nicolas CABATON, INRA, Toulouse, Examinateur
Dr. Brigitte BOIZET, Institut de Génétique Humaine, Montpellier, Examinateur Pr. Virginie ROUILLER-FABRE, Université de Paris, Directrice de thèse
1 A mes parents, ma plus grande force,
Et mon mari, ma plus grande faiblesse.
3 Remerciements du jury
Tout d’abord, je tiens à adresser ma sincère gratitude à tous les membres de mon jury de thèse pour avoir accepté d’évaluer ce travail.
En premier lieu, je remercie le professeur Armelle BAEZA d’avoir accepté de présider mon jury de thèse.
Je remercie ensuite les docteurs Éric PAILHOUX et Céline GUIGON de m’avoir fait l’honneur d’évaluer mon manuscrit de thèse.
J’adresse également un grand merci aux docteurs Brigitte BOIZET, Pascale CHAVATTE-PALMER et Nicolas CABATON pour avoir accepté d’assister à ma soutenance de thèse en tant qu’examinateurs.
C’est avec grande émotion que je remercie mes directrices de thèse, le le docteur Marie-Justine GUERQUIN et le professeur Virginie ROUILLER-FABRE pour tout l’investissement qu’elles ont porté à ce travail.
5 Remerciements
Gabriel. Merci de m’avoir accueillie au sein du laboratoire et ce depuis mon Master 1. Merci pour ta grande disponibilité à chaque fois que j’en avais besoin et pour tes précieux et nombreux conseils. Justine. J’ai l’impression que le mot « merci » n’est pas assez. Tu m’as fait confiance quand moi-même je doutais. J’ai été ta première thésarde, ton n=1, et j’ai adoré ! Merci d’avoir été toujours disponible malgré ton emploi du temps chargé. Merci d’avoir toujours été à l’écoute, pas que scientifiquement parlant. Merci pour tes montages photo et vidéos que je collectionne avidement. Merci pour ces moments qu’on passait dans ton bureau à discuter pendant des heures. Merci d’avoir cru en moi. Merci d’avoir contribué à faire de moi ce que je suis aujourd’hui. Merci d’avoir rendu les choses aussi faciles. Merci de m’avoir fait autant rire… et pleurer ! Tu vois, finalement j’ai abusé de ces cinq lettres… et pourtant, ce n’est toujours pas assez.
Virginie. Ta bienveillance et ta bonté m’ont accompagnée depuis mon arrivée en France. Et jusqu’à aujourd’hui tu fais passer mon bien-être avant tout. Rares sont les profs qui s’impliquent autant. Tu es une personne exceptionnelle, une maman hors pair, d’ailleurs tu m’as rappelé la mienne à plusieurs reprises. Alors merci pour tout ce que tu m’as apportée aussi bien sur le plan scientifique que humain. Merci pour tous tes encouragements qui me reboostaient systématiquement. Merci pour cette simple tape sur le dos que tu me donnais à chaque fois que ça n’allait pas. Tu me redonnais le sourire à chaque fois.
Nour. Ma copine, mon binôme, ma compatriote (sur 2 nationalités ! Si c’est pas la classe ça ?!), ma « petite » sœur (oui, il fallait que je te lance une « petite » pique sur ta taille… je sais, c’est petit ! Le jour où tu es arrivée au labo a marqué un tournant pour moi. J’ai trouvé en toi une grande amie. Un soutien infaillible. Merci de m'avoir fait profiter de ton expérience en thèse. Merci d'avoir été l'oreille qui m'écoute sans juger, l'épaule qui me soutient lorsque j'en ai besoin, le punching-ball qui m'aide à évacuer la pression, et bien plus que ça ❤
Arielle. Comment te qualifier ? Le calme avant la tempête ? Le feu sous la glace ? La psychopathe la plus douce au monde ? Je pense que les trois te vont bien ^^ depuis mon arrivée tu étais là. Disponible et à l’écoute. Merci pour toutes nos discussions allant du très sérieux au complétement surréaliste et déjanté ! Merci d’avoir pensé à ma santé avant que moi-même je n’y pense. Quand je pense que si on s’était croisées au lycée on ne serait JAMAIS devenues copines !
Delphine. Quand je suis arrivée au labo, tout le monde me disait que tu étais une « aide précieuse ». Mais tu es bien plus que ça ! Tu es carrément un cerveau de substitution lorsque le mien est trop fatigué pour réfléchir correctement. Ma sauveuse lorsque rien ne va plus. Merci pour ta répartie et ton humour qui m'ont fait rire plus d'une fois. Et merci pour ta disponibilité à chaque fois que j'avais besoin d'une aide précieuse, justement.
Sébastien. Les études scientifiques préconisent qu’il faut rire pour au moins 15 minutes par jour pour être en bonne santé. Grâce à toi, j’ai largement dépassé mes doses journalières de dopamine ! Seb, le Maître Histo, le patron, chafouin, le petit, tant de surnoms qui te caractérisent. Aujourd’hui, je viens t’en rajouter un nouveau : « Sunshine ». Parce que c'est ce que tu es : un soleil qui illumine nos journées et réchauffe nos cœurs.
Emmanuelle. Un ENORME merci pour m’avoir expliqué toute la partie recombinaison homologue et crossing-over ! Sans toi, je serais encore en train de m’arracher les cheveux à essayer de comprendre ! Merci pour l’anticorps MLH1 et le SYCP3 cochon-dinde, pour ta grande disponibilité, ton énergie communicative et ton âme rebelle et passionnée.
6
Sophie. Merci d'avoir été la première personne que je voyais au labo quand j'arrivais tôt le matin (j'insiste sur l'imparfait du verbe). Nos discussions matinales autour de la bouilloire étaient des plus agréables. Merci pour les conseils en biomol, les pique-niques et le mois sans sucre. Merci d'avoir augmenté ma culture bretonne. J'irai là-bas un jour, et je penserai à toi.
Margaux. Heureusement qu'on n'écrit pas les noms de famille dans les remerciements… merci pour les étalements d'ovocytes, merci de m'avoir appris que pour travailler dans un labo il faut faire des TABLEAUX EXCEL ! Ça m’a sauvé la vie ! Merci pour ta bonne humeur, les soirées, les anecdotes sur les gens du Nord (tu n'as pas arrangé votre réputation franchement !). Ton départ a laissé un grand vide que personne n'a su combler. Heureusement, on aura toujours nos soirées filles !
Mes jeunes Padawan, Juliette et Nolan. Merci pour tout ce que vous avez apporté à ce projet. Merci de m'avoir laissée jouer au prof avec vous et de m'avoir laissée étaler mes connaissances techniques en m'écoutant avec assiduité (j'espère !). Mais à mes yeux, vous êtes bien plus que des apprentis appliqués (je force, hein ?). Merci pour les fous rires, les pauses si agréables qu'on avait envie de les prolonger. Je vous souhaite à tous les deux une bonne continuation dans vos vies personnelles et professionnelles.
Vincent. Tu as égayé mes journées au bureau. Avant toi, j’avais pour seule compagnie les gens qui passaient voir Gabriel et qui me prenaient pour sa secrétaire é_è. Même si tu as hautement contribué à la perversion de mon âme si pure, je te pardonne. Tu as toujours été de bon conseil pour moi, et ce dès le jour de ton arrivée. Nos duos chantants vont me manquer, tes vidéos de médecins bizarres, un peu moins. J’espère que la fin de ta thèse se déroulera comme tu le souhaite.
Laura. On a commencé l'aventure LDG ensemble, et on la termine ensemble ! Merci pour tes conseils d'aînée, nos discussions sur les bébés (souris et humains !), et nos pauses café prolongées. Tu as l'âme d’une chercheuse, je suis sûre que tu réussiras tout ce que tu entreprendras.
Les plateformes imagerie (Lamia), cytométrie (Nathalie) et animalerie (Véronique V). Vous avez chacune énormément contribué à l'établissement de ce travail. On n’en parle pas assez, mais sans vous on n'est rien ! Je remercie également Véronique M pour tout ce qu'elle m'a apportée comme connaissances sur l'irradiation. Merci à toutes les 4, et pas que pour ce que vous m'avez apporté sur le plan professionnel. Vous êtes uniques et génialissimes !
Merci à tous ceux qui sont passés par le LDG ou sont toujours là pour les bons moments et autres. Cynthia, Gaby, Lydia (mon ASMR préférée !), Cécile, Quentin, Gaëlle, Cathy (c'est ma cousiiiiiine !), Leïla (je n’ai pas oublié les deux points sur le i cette fois ^^), Louise (ma première voisine de bureau), Justine G, Brahim, Jonathan, Soria, Émilie, Clotilde ainsi que tous les étudiants de l'iRCM que je ne citerai pas sinon mes remerciements feraient la taille de ma thèse (j'exagère à peine !).
Merci René et Muriel pour votre gentillesse, vos nombreux conseils (surtout au moment de la rédaction de ma thèse) et surtout, merci de m’avoir accueillie dans le bureau. Merci Nelly pour m’avoir transmis une partie de ton savoir sur l’ovaire humain.
Merci aux « gens d'en face et d'à côté » (c'est affectif je vous le jure !), j'ai nommé Clémentine et Anne-Sophie pour nos discussions scientifiques et autres, les pauses, les repas du mercredi (que nous n'avons fait qu'une seule fois finalement). Amandine pour les trajets de bus (très tôt) le matin. Maelle, surtout pour son amitié, mais aussi pour nos pauses de commères du village et ses recommandations de thésarde. Lydia et Isabelle pour tous leurs conseils avisés et nos discussions à la fois scientifiques et autres. Philippe, pour les délicieux gâteaux et les blagues qui me font sourire à chaque fois que je passe dans le couloir « d’en face ». Le LRP pour ses pots à répétition !
7
Le secrétariat. Merci Aurélie et Arielle (oui, oui tu es citée deux fois, c’est normal) pour toute la paperasse administrative que vous avez faite à ma place, je ne vous remercierai jamais assez pour ça. Les « gens de la sécurité ». Luis, JB et Elya. Je ne mentionnerai pas la fois où je me suis coupée au microtome, les « eh oh, ta blouse ! » et les « pas de gants dans les couloirs ! » (Oups). Merci pour tous les moments agréables que j'ai pu passer avec vous.
Je remercie particulièrement Pablo et son équipe, en particulier Anna, Jacqueline et Émilie pour les souris OGG1 et le protocole d'immunomarquage de la 8oxo, ainsi que Katia Wassmann et Damien Cladière de Jussieu pour m'avoir appris la technique de spread d'ovocytes. Finalement, je remercie le personnel hospitalier du service de Gynécologie Obstétrique de l’Hôpital Antoine Béclère et en particulier le professeur Alexandra Benachi et le docteur Stéphanie Pozzi-Gaudi pour le matériel humain. Sans vous, mon travail n'aurait vraiment pas eu la même tête !!
Last but not least : mes piliers (sortez les violons SVP)
Aurore. La meilleure des meilleures amies. Ma belle-famille pour tout leur soutien.
Ma sœur pour les doses quotidiennes de sérotonine.
Mes parents sans qui je ne serai pas là où j'en suis aujourd'hui (et je ne parle pas QUE de la fusion de leurs gamètes !)
Mon mari, l'homme de ma vie, ma moitié. Toute cette période n'a pas été facile pour toi. Merci de m'avoir attendue, de m'avoir comprise, de m'avoir soutenue tout au long de ces trois années de thèse, en particulier les derniers mois. Merci de m’avoir aidée à réintegrer toutes les références bibliographiques en urgence le jour de ton anniversaire, et d’avoir supporté mes crises de nerfs et mon humeur exécrable. Je passerai le reste de ma vie à te dire merci parce que sans toi, je n'y serai pas parvenue ❤ ينويع نم ىلغا اي كبحب
9
Mécanismes moléculaires impliqués dans les réponses à l’exposition in utero
des cellules germinales aux bisphénols
Au cours de ces dernières décennies, les anomalies liées à la fonction de reproduction ont vu leur incidence augmenter. Ces défauts seraient dus à l’exposition des organismes à une large panoplie de contaminants environnementaux tels que le bisphénol A (BPA). Les études expérimentales ont montré que le développement fœtal constitue une fenêtre d’exposition extrêmement sensible à ces substances. En effet, c’est au cours de cette période que s’effectue la mise en place de la lignée germinale ainsi que sa différenciation.
Ainsi, des mécanismes moléculaires complexes et hautement régulés entrent en jeu afin de faire d’une cellule précurseur non fonctionnelle une cellule germinale qui se différencie pour former un gamète haploïde hautement spécialisé. Chez la femelle, une des premières illustrations de cette différenciation germinale est l’initiation de la première division de méiose (méiose I) pendant la vie fœtale conduisant à l’obtention d’un ovocyte haploïde et fécondable à l’âge adulte. La prophase I de méiose (initiation et progression) est une période d’extrême sensibilité aux contaminants environnementaux tels que le bisphénol A (BPA) induisant des défauts irréversibles à l’âge adulte.
Au regard de sa reprotoxicité, l’utilisation du BPA a été récemment interdite dans les contenants alimentaires. Toutefois, nous restons exposés à d’autres analogues structuraux dont on ignore tout de leur toxicité sur les cellules germinales. Ainsi, le but de ce travail est d’explorer les effets d’une exposition fœtale à deux bisphénols, le BADGE et le BPAF sur les cellules germinales de mammifères, en particulier sur les ovocytes et leurs précurseurs, mais également de comprendre les mécanismes mis en jeu.
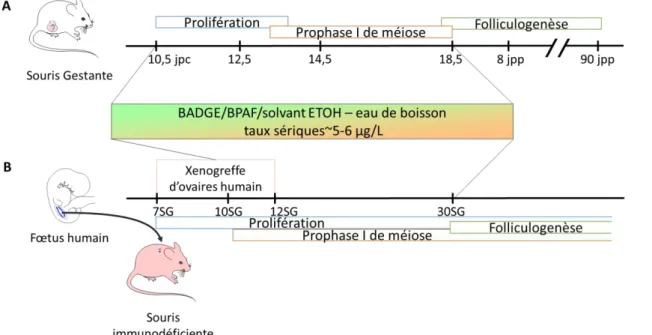
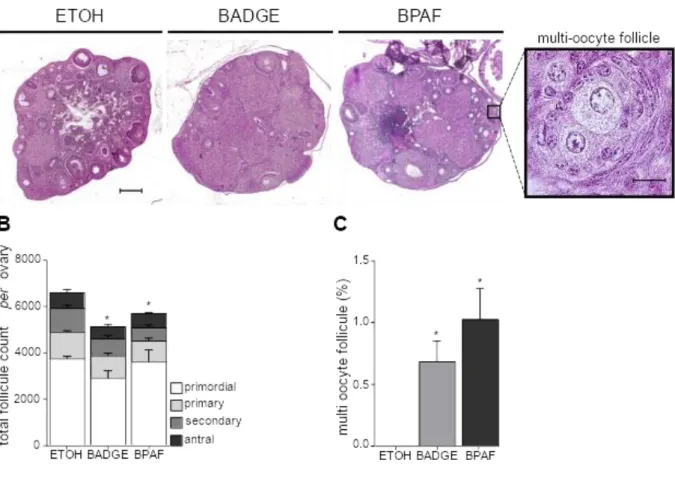
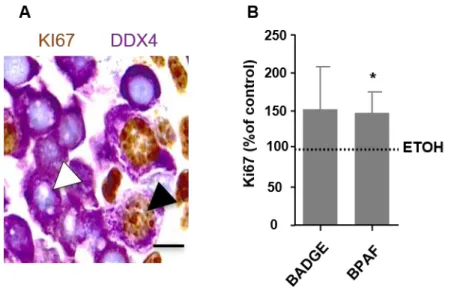
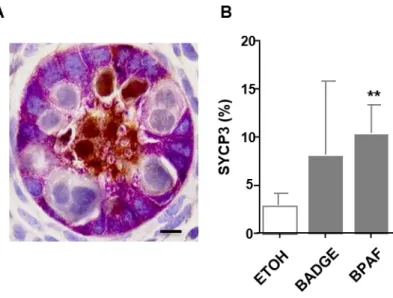
Pour cela, nous avons exposé des souris gestantes aux bisphénols dans l’eau de boisson pendant la seconde moitié de la gestation. L’analyse des ovaires montre que l'exposition aux bisphénols induit une déplétion ovocytaire, une formation de follicules multiovocytaires et augmente les taux d'ovocytes aneuploïdes et de chiasmas. Comme le BPA, le BADGE et le BPAF provoquent des défauts méiotiques tels qu'un retard de l'initiation et la progression en méiose. Ceci est également observé dans l'ovaire fœtal humain, étudié grâce au modèle de xénogreffe de gonades fœtales humaines développé par notre laboratoire et qui permet une exposition à long terme aux bisphénols. Les cellules germinales mâles présentent de même un délai de différenciation caractérisé par un retard d’entrée en phase de quiescence.
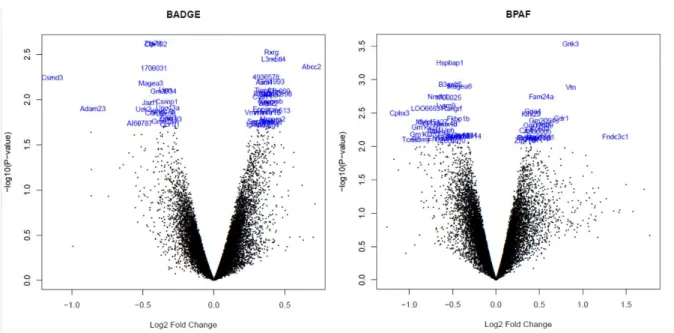
Ces retards semblent être corrélés à l'altération de l'expression et/ou de l'épissage d’ARNm de gènes méiotiques au début du programme méiotique. Ces défauts semblent être dus à des dommages oxydatifs de l'ADN induits par les bisphénols dans les cellules précurseurs. De même, nous avons observé qu'en l'absence d'OGG1, une ADN glycosylase impliquée dans la réparation de la 8-oxoguanine, la phase de différenciation est retardée quel que soit le sexe. Dans l'ensemble, ces résultats montrent que l'exposition fœtale aux bisphénols altère les fonctions reproductrices à l'âge adulte, probablement en raison de la génération de stress oxydant dans les cellules germinales.
10
Molecular mechanisms involved in the response to bisphenols exposure in fetal
germ cells
In recent decades, the incidence of reproductive function abnormalities has increased. These defects are believed to be due to the exposure of organisms to a wide range of environmental contaminants such as bisphenol A (BPA). Experimental studies have shown that fetal development is a highly sensitive window to the exposure to these substances. Indeed, it is during this period that the germ line is set up and differentiated.
Thus, complex and highly regulated molecular mechanisms come into play in order to transform a non-functional precursor cell into a germ cell that differentiates into a highly specialized haploid gamete. In females, one of the first illustrations of this germline differentiation is the initiation of the first division of meiosis (meiosis I) during fetal life leading to the production of a haploid and fertilizable oocyte in adulthood. Prophase I of meiosis (initiation and progression) is a period of extreme sensitivity to environmental contaminants such as bisphenol A (BPA) leading to irreversible defects in adulthood.
Regarding the reprotoxicity of BPA, it has recently been banned from food containers. However, we remain exposed to other structural analogues whose germ cell is unknown. Thus, the purpose of this work is to explore the effects of fetal exposure to two bisphenols, BADGE and BPAF, on mammalian germ cells, particularly on oocytes and their precursors, but also to understand the mechanisms involved in the response to exposure.
To do this, we exposed pregnant mice to bisphenols in drinking water during the second half of gestation. Ovarian analysis shows that exposure to bisphenols induces oocyte depletion, formation of multiovocyte follicles and increases aneuploid oocyte and chiasmas levels. Like BPA, BADGE and BPAF cause meiotic defects such as delayed initiation and progression to meiosis. This is also observed in the human fetal ovary studied using the human fetal gonad xenograft model developed by our laboratory, which allows long-term exposure to bisphenols. Male germ cells also have a differentiation time delay characterized by a delay in entering the quiescence phase.
These delays appear to be correlated with the alteration of expression and/or mRNA splicing of meiotic genes at the beginning of the meiotic program. These defects seem to be the consequence of oxidative DNA damage induced by bisphenols in precursor germ cells. Similarly, we have observed that in the absence of OGG1, a DNA glycosylase involved in the repair of 8-oxoguanine, the differentiation phase is delayed regardless of gender.
All in all, these results provide further proof that fetal exposure to bisphenols impairs reproductive functions at adulthood, probably as a consequence of oxidative stress generation in germ cells.
11
LISTE DES ABBREVIATIONS
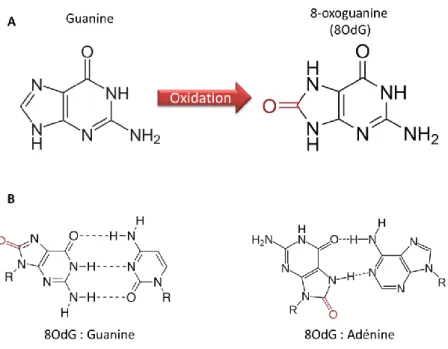
5caC A : 5-carboxylcytosine 5fC : 5-formylcytosine 5hmC : 5-hydroxyméthylcytosine 5mC : 5méthylcytosine 8OdG: 8-oxoguanine 8-OHGua: C8-hydroxyguanine A
ADN : Acide DésoxyriboNucléique ADNmt : ADN mitochondrial AMH : Anti-Mullerian Hormone
AMPc : Adénosine MonoPhosphate cyclique AP2γ : Activating enhancer-binding Protein 2γ APE1 : Apurinique/aPyrimidique Endonuclease 1 AR : Acide Rétinoïque
ARN: Acide RiboNucléique ARNm: ARN messagers
ATM: Ataxia Telangiectasia Mutated ATP: Adénosine TriPhosphate B
BADGE: Bisphénol A Diglycidyl Ether BER: Base Excision Repair
BHPF: Fluorene-9-bisphenol
BLIMP1: B-lymphocyte-induced maturation protein 1 BMP4: bone morphogenetic protein
BPA: Bisphénol A BPAF: Bisphénol AF BPF: Bisphénol F BPS: Bisphénol S
BrdU : BromodésoxyUridine BrKO3 : Bromate de potassium
12 C CAT : CATalase CDK : Cycline-Dependant Kinases CG : Cellule Germinale
CGP : Cellules Germinales Primordiales CH3 : groupement méthyl
COC : Complexes cumulo-ovocytaires COX2 : CycloOXygénase 2
CRM : Chaine Respiratoire Mitochondriale
CYP26B1: CYtochrome P450, family 26, subfamily B, polypeptide 1 D
DAZL: Deleted in AZoospermia-Like DDX4: DEAD box polypeptide 4 DEHP: DiEthylHexyl Phthalate DES: DiEthylStilbestrol
DMC1: Disrupted Meiotic cDNA 1 homologue DMF: DiDethylFumarate
DMRT1: Doublesex- and Mab-Related Transcription factor 1 DNA pol: ADN polymérase
DNMT: DNA Methyl Transferase
DOHaD : Developmental Origins of Health and Disease (Origine Développementale de la Santé et des Maladies)
DDT : DichloroDiphenylTrichloroethane E
e- : électron
EFSA : European Food Safety Agency (autorité européenne de sécurité des aliments) ER : Estrogen Receptor (récepteurs aux œstrogènes)
ERV : Endogenous Retrovirus (ADN de rétrovirus endogènes) ETOH: Ethanol
F
FGF9: Fibroblast Growth Factor 9
FGRR1/2: Fibroblast Growth Factor Receptor 1/2 FIGLα: Factor In the GermLine alpha
13 FSH: Follicle Stimulating Hormone
G
GCAP: Germ Cell Alkaline Phosphatase GFRα1: GDNF Family Receptor alpha-1 GMPc : Guanosine MonoPhosphate cyclique GnRH : Gonadotropin-Releasing Hormone GPx : Glutathione Peroxidase
GR: Glutathione Reductase GSH: Glutathion
GSR: Glutathion Reductase
GV: Germinal Vesicle (vésicule germinative) GVBD: Germinal Vesicle Breakdown H
H2O: eau
H2O2: peroxyde d’hydrogène
H3K27me2/3 : Lysine 27 De L’histone H3 Di Ou Trimethyle H3K4me2/3 : Lysine 4 De L’histone H3 Di Ou Triméthylé H3K9ac : Lysine 9 De L’histone H3 Acétylée
H3K9me2 : Lysine 9 De L’histone H3 Diméthylé H3K9me3 : Lysine 9 De L’histone H3 Triméthylé HIF-1α: Hypoxia Inducible Factor 1 alpha
HO• : Radical Hydroxyl I
IOP : Insuffisance Ovarienne Prématurée J
Jpc : jours post-conception Jpp : jours post partum L
LH: Luteinizing Hormone LHX8: LIM Homeobox 8
LINE: Long Interspersed Elements M
14 MEF: Mouse Embryonic Fibroblasts
MEIOC: MEIOsis-specific with Coiled-coil domain MLH1/3: MutL Homolog 1/3
MMR: DNA MisMatch Repair
MOF : MultiOocyte Follicle (follicules multi-ovocytaires)
MPF : Meiosis Promoting Factor (facteur de promotion de la méiose) MSX1/2: MSh homeoboX 1 and 2
MUTYH: MUTY Homologue, adenine DNA glycosylase MVH: Mouse Vasa Homolog
N
NAC: N-acetylcysteine
NADPH: Nicotinamide Adénine Dinucléotide PHosphate NANOG: NANOG homeobox
NANOS2: NANOS homolog 2
NOBOX: Newborn Ovary homeoBOX protein NOX: NADPH OXydase
NRF2: Nuclear Factor-E2-Related Factor O
O2•−: anion superoxyde
OCT3/4: OCTamer-binding transcription factor 3 or 4 OGG1: 8-Oxoguanine DNA glycosylase
OH•−: Radical hydroxyle
P
PBB: PolyBromated Biphenyls (biphényles polubromés) PCB : PolyChloroBiphényls (biphényles polychlorés) PE : Perturbateur Endocrinien
PI3K: PhosphoInositide 3-Kinase
PLZF: Promyelocytic Leukemia Zinc Finger POU5F1: POU class 5 homeobox 1
PPAR: Peroxisome Proliferator Activated Receptors PRDM1 : PR DoMain containing protein 1
PRDM9 : PR DoMain zinc finger protein 9 PTEN: Phosphatase and TENsin homolog
15 Q Q : Ubiquinone QH2 : Ubiquinol R RAD51 : RAD51-recombinase
RAR : Retinoic Acid Receptor (récepteurs à l’acide rétinoïque) ROO•− : Radical peroxyle
ROS : Reactive Oxygen Species (espèces réactives de l’oxygène) RPA : Replication Protein A
S
SG : Semaines de Grossesse SINE: Short Interspersed Repeats
SMC: Structural Maintenance of Chromosomes SO: Stress Oxydant
SOD: superoxide dismutase
SOHLH1: Spermatogenesis and Oogenesis specific basic Helix-Loop-Helix 1 SOX17: Sry-bOX 17
SOX2: Sry-bOX 2
SPO11: meiosis-specific SPO11 homolog Sry: Sex-determining Region of Y chromosome SSEA-1: Stage Specific Embryo Antigen 1 STRA8: STimulated by Retinoic Acid 8 SYCP3: SYnaptonemal Complex Protein 3 T
TAF4B: Transcription initiation Factor TFIID subunit 4B TDG: Thymine DNA Glycosylase
TET: Ten-Eleven Translocation methylcytosine dioxygenase TFAP2C: Transcription Factor AP-2 Gamma
TGFβ: Transforming Growth Factor beta
TNAP: Tissue Non-Specific Alkaline Phosphatase TSC1/2: Tuberous Sclerosis Complex 1 And 2 X
17
TABLE DES MATIERES
LISTE DES ABBREVIATIONS ... 11
AVANT-PROPOS... 21
IL ETAIT UNE FOIS… LA MEIOSE ... 23
INTRODUCTION ... 25
CHAPITRE UN : LA CELLULE GERMINALE ... 27
I- Cellules germinales : La naissance d’une lignée ... 27
II- Différenciation germinale ... 30
III- Reprogrammation épigénétique des cellules germinales ... 37
CHAPITRE DEUX : LA MEIOSE ... 49
I- Généralités ... 49
II- Initiation de la méiose femelle ... 51
III- Prophase I de méiose ... 58
IV- Maturation ovocytaire et reprise de méiose ... 65
CHAPITRE TROIS : LE STRESS OXYDANT ... 67
I- Généralités ... 67
II- Biologie des ROS ... 69
III- Dommages oxydatifs de l’ADN et réparation ... 81
IV- Stress oxydant et reproduction ... 84
CHAPITRE QUATRE : TOXICOLOGIE ET REPRODUCTION ... 91
I- Perturbation endocrine et environnement ... 91
II- Perturbateurs endocriniens et reproduction ... 95
III- Bisphénol A analogues structuraux ... 101
OBJECTIFS ... 115 RÉSULTATS ... 117 Partie 1 ... 119 Partie 2 ... 171 DISCUSSION ET CONCLUSIONS ... 187 REFERENCES ... 201
19
Liste des Figures
Figure 1 : les pères de la méiose ... 24 Figure 2 : Cycle de développement de la lignée germinale, de la fécondation à la vie adulte ... 26 Figure 3 : Migration des CGP ... 28 Figure 4 : Représentation schématique du développement des cellules germinales femelles de mammifère et des stades de la folliculogenèse ... 34 Figure 5 : Méthylation de l’ADN et mode d’activité des DNA méthyltransférases ... 38 Figure 6 : Dynamique de régulation de la méthylation de l’ADN au cours du cycle de vie des mammifères ... 40 Figure 7 : Dynamique de méthylation de l’ADN au cours du développement embryonnaire et post-natal de souris ... 42 Figure 8 : Expression du gène Stra8 dans les ovaires fœtaux de souris ... 52 Figure 9 : Organisation et disposition des cohésines méiotiques de mammifères ... 54 Figure 10: Stades de prophase I de méiose ... 56 Figure 11 : Processus de la recombinaison homologue méiotique tout au long de la prophase I de méiose ... 60 Figure 12: Maturation méiotique des ovocytes de souris et d’humain ... 64 Figure 13: Structure de la mitochondrie de mammifères ... 70 Figure 14: Représentation schématique de la chaine respiratoire mitochondriale ... 72 Figure 15: Représentation schématique de la génération d’espèces réactives de l’oxygène (ROS) et d’importantes voies d’antioxydants enzymatiques cellulaires ... 78 Figure 16: Formation de la 8-oxoguanine (8OdG) et mésappariements de bases ... 82 Figure 17: Réparation de la 8OdGuanine par excision de base ... 82 Figure 18: Représentation schématique de la régulation des enzymes antioxydantes au cours du développement folliculaire ... 86 Figure 19: Structure chimique de divers xéno-œstrogènes ... 98
20 Figure 20: Biotransformation du Bisphenol A libre en BPA-glucuronide conjugé et BPA-sulfoconjugué chez l’humain et les rongeurs ... 102 Figure 21: Apports quotidiens de BPA dans différentes populations mondiales ... 104 Figure 22: Mécanismes épigénétiques potentiels du BPA dans les ovaires de mammifères ... 110 Figure 23 : Modèle d’exposition in utero des ovaires fœtaux murins et humains au BADGE et au BPAF ... 116 Figure 24: Modèle hypothétique sur les mécanismes moléculaires impliqués dans les défauts observés lors d’expositions fœtales aux bisphénols chez la souris ... 200
Liste des Tableaux
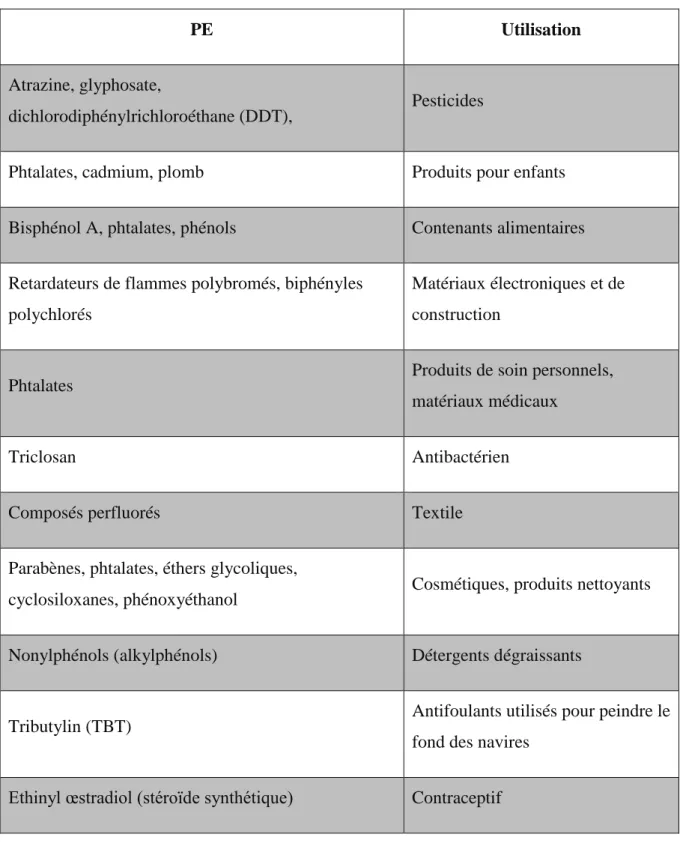
Tableau 1 : Cibles cellulaires des espèces réactives de l’oxygène et dommages engendrés. ... 76 Tableau 2: Tableau récapitulatif des principales enzymes antioxydantes, de leur localisation et leur action dans les cellules de mammifères ... 78 Tableau 3: Tableau récapitulatif des principales enzymes antioxydantes et leurs actions dans les ovaires et les ovocytes de mammifères ... 88 Tableau 4 : Principaux perturbateurs endocriniens et leurs utilisations pendant la vie quotidienne ... 92
21
AVANT-PROPOS
Au cours des dernières décennies, les troubles reproductifs et pathologies liés à la fonction de reproduction se font de plus en plus fréquents. Difficulté à concevoir, syndromes de dysgénésie testiculaire et ovarienne, diminution du nombre global de spermatozoïdes et d’ovocytes, et puberté précoce, tant de facteurs dont l'incidence a considérablement augmenté en peu de temps.
En parallèle, les études épidémiologiques ont corrélé ces défauts au taux de divers perturbateurs endocriniens (PE) contenus dans les fluides biologiques de nombreuses cohortes de populations humaines sur le plan mondial. De plus, les études chez l’animal ont confirmé la toxicité de ces molécules et ont permis une compréhension plus large des défauts qu’ils peuvent induire sur les plans cellulaire et moléculaire à plus ou moins long-terme. Chez les mammifères, une fenêtre d’exposition particulièrement sensible aux PE se situe pendant la vie fœtale puisque c’est au cours de cette période que s’effectuent la mise en place et la différenciation de la lignée germinale ainsi que la différenciation sexuelle somatique.
Le bisphénol A (BPA) figure parmi les PE les plus nocifs vis-à-vis des gonades en cours de développement, particulièrement pour les ovaires fœtaux. En effet, l’exposition au BPA pendant la vie fœtale est connue pour induire des défauts à l’âge adulte (diminution de la réserve ovocytaire, formation de follicules anormaux, augmentation des défauts de ploïdie ovocytaire). Bien que de nombreuses études associent ces effets à des mécanismes œstrogéniques et/ou épigénétiques, aucun mécanisme clair n’a été décrit concernant le mode d’action du BPA dans les cellules germinales (CG) de mammifères.
Étant largement utilisé dans les produits de la vie courante, l’exposition humaine est réelle, importante et continue. Classifié comme produit toxique pour la reproduction dans les années 2010, ce n’est qu’en 2015 qu’il sera définitivement interdit d’usage dans les contenants alimentaires en France et en 2018 dans l'Union Européenne. Néanmoins, d’autres bisphénols sont toujours utilisés sur le marché industriel. Leur innocuité reste cependant encore à prouver. Or, vu leur analogie structurale, nous pouvons penser que les effets des analogues structuraux du BPA pourraient être semblables à ceux du produit d’origine.
Ainsi, mon projet de thèse présente deux axes d'études associées à deux objectifs distincts mais complémentaires :
22 Un axe de biologie appliquée dans lequel la toxicité potentielle d'une exposition fœtale à deux analogues structuraux est évaluée dans les gonades murines. Il vise entre autres à répondre à la question suivante : quelles sont les effets observés à l'âge adulte suite à une exposition fœtale à deux bisphénols, le BADGE et le BPAF ? De plus, en utilisant le modèle de xénogreffe nous avons réalisé des études préliminaires sur les effets de ces deux analogues sur des ovaires fœtaux humains.
Un axe de biologie fondamentale visant à mettre en évidence un mécanisme d'action de ces bisphénols. Il vise à répondre aux interrogations suivantes : comment les bisphénols exercent-ils leurs effets délétères ? Quels sont les mécanismes moléculaires impliqués dans la réponse biologique aux bisphénols ?
Afin de réaliser ces objectifs, nous avons exposé des souris gestantes au BADGE, au BPAF ou au solvant éthanol (ETOH) dans l’eau de boisson au cours de la seconde moitié de gestation et ce jusqu’à la fin de la vie fœtale (18,5 jours post-conception). Les gonades ont par la suite été récoltées à différents moments de la vie fœtale ou à l’âge adulte. En parallèle, nous avons développé un modèle de xénogreffe d'ovaires fœtaux humains permettant une exposition chronique à de faibles doses de bisphénols, mimant ainsi une exposition réelle. L'impact de ce produit sur la survie et la différenciation des CG fœtales murines et humaines a été évalué.
Les résultats de mes travaux seront présentés en deux parties. Dans la première partie, les résultats des expériences conduites chez la souris et chez l’humain et faisant l’objet d’un article en cours de soumission dans le journal Stem Cell Reports seront présentés. La seconde partie de mon travail porte sur des résultats non publiés montrant l’impact d’une exposition de testicules fœtaux murins aux bisphénols sur la différenciation des CG mâles.
23
IL ETAIT UNE FOIS… LA MEIOSE
Le dix-neuvième siècle figure parmi l’une des plus grandes périodes de découvertes scientifiques. Ces dernières ont été le fruit d’importantes avancées en microscopie optique, entre autres, ce qui a considérablement contribué à l’essor de certains domaines comme l’histologie et la cytologie.
En 1876, le biologiste allemand Oskar Hertwig (1846-1922) a décrit pour la première fois le phénomène de fécondation chez les oursins de la côte méditerranéenne. La transparence des œufs de cette espèce d’échinidés a permis au scientifique d’observer les étapes de leur fécondation. C’est ainsi qu’il a défini pour la première fois que la fécondation consiste en l’union d’une cellule mâle et d’un « œuf » femelle, suivie par la fusion des deux noyaux. Ce n’est que huit ans plus tard que l’embryologiste belge Edouard Van Baneden (1846-1910) a décrit les mêmes observations chez le nématode Ascaris megalocephala. De plus, il a remarqué que l’œuf résultant de l’union des deux cellules mâle et femelle aboutissait au même nombre de chromosomes que l’ensemble des cellules composant le corps du ver. Il en conclu alors que l’œuf est le résultat de l’union de deux cellules possédant chacune la moitié du bagage chromosomique initial (Hamoir, 1992 ; Fig. 1).
En 1890, le biologiste allemand August Weismann (1834-1914) a exposé pour la première fois sa « théorie sur la continuité du plasma germinatif ». Ce concept suggère que l’information héréditaire est transmise exclusivement par les cellules germinales contenues dans les gonades et non par les cellules somatiques, comme cela était perçu à l’époque. Cette théorie contrastait fortement avec celle du très réputé Charles Darwin (1809-1882), la «ppangenèse » exprimée en 1868, et selon laquelle l’ensemble des cellules de l’organisme participerait à l’hérédité. Ultérieurs (1896) les travaux d’August Weismann (1834-1914) sur les gamètes d’oursin ont montré différents modes de division dans les futurs gamètes : une division dite « équationnelle» et une division « réductionnelle » (Conklin, 1915).
Ce n’est qu’en 1905 que le botaniste anglais Sir John Bretland Farmer (1865-1944) et son collègue John Edmund Sharrock Moore (1870-1947) ont posé un nom à cette division cellulaire particulière : « maiosis » issue du mot grec « μείωση » dont la traduction littérale correspond à « réduction ». Aujourd’hui, il est plus commun d’utiliser le terme « meiosis » en anglais, mais sa prononciation orale a conservé ses caractéristiques d’antan. Moore est de plus
24 à l’origine du terme « synapsis » (mot grec pour « connexion »), qui décrit l’appariement des chromosomes homologues pendant la méiose.
Il a fallu attendre six ans pour que le généticien américain Thomas Hunt Morgan (1866-1945) observe pour la première fois des mécanismes de crossing-over dans ces cellules méiotiques de
Drosophila melanogaster et qu'il fournisse la première preuve génétique indiquant que les
gènes sont transmis à la descendance par le biais des chromosomes (Morgan, 1910).
Figure 1 : les pères de la méiose.
25
26 Figure 2 : Cycle de développement de la lignée germinale, de la fécondation à la vie adulte. La chronologie est indiquée pour l’homme (h) et la souris (m). Adapté de Tang, Kobayashi, Irie, Dietmann, and Surani, 2016 et Irie, Tang and Azim Surani, 2014.
27
CHAPITRE UN : LA CELLULE GERMINALE
La cellule germinale (CG) est l’entité biologique à l’origine des gamètes d’un organisme. D’un point de vue évolutif, les CG sont les cellules chargées de transmettre l’information génétique à la descendance, maintenant ainsi la continuité d’une espèce donnée (Guo et al., 2015). Elle peut être considérée comme la seule cellule « immortelle » d’un organisme puisqu’elle se transmet de génération en génération.
I- Cellules germinales : La naissance d’une lignée
Chez les mammifères, les CG sont formées très tôt au cours du développement embryonnaire. Elles suivent différentes étapes de différenciation et maturation effectuées sur des périodes plus ou moins longues (en fonction des espèces et du sexe) afin de former des cellules hautement spécialisées : les gamètes (spermatozoïdes chez les mâles et les ovocytes chez les femelles). La caractéristique principale des gamètes est l’haploïdie. En effet, à un stade précis de leur développement, les CG initient la division méiotique qui permet la réduction de moitié de leur matériel génétique. La fusion d’un spermatozoïde et d’un ovocyte produit un zygote diploïde génétiquement différent de ses parents.
Suite à la fécondation, les zygotes de mammifères initient une série de clivages au bout desquels se forme un blastocyste composé d’un ensemble de cellules pluripotentes appelées « cellules de la masse interne » (Fig. 2). Ces dernières se différencient par la suite pour former l’épiblaste préimplantatoire et l’endoderme primitif. L’épiblaste sera à l’origine du futur embryon tandis que l’endoderme primitif donnera naissance aux tissus extra-embryonnaires (Tang et al., 2016).
1) Spécification de la lignée germinale
Les cellules germinales primordiales (CGP) sont les précurseurs des CG. L’induction de la lignée germinale débute au moment de la gastrulation, aux alentours de 6,25 jpc (jours post-conception) chez la souris (Irie, Tang and Surani, 2014) et de 3 semaine de grossesse (SG) chez l’humain (Tang et al., 2016) (Fig. 2).
Aux alentours de 6,75 jpc chez la souris (Yamaji et al., 2008) et 4 SG chez l’humain embryonnaires (Tang et al., 2016), une quarantaine de cellules de l’épiblaste du mésoderme extra-embryonnaire se mettent à exprimer le facteur BMP4 (bone morphogenetic protein). Ce dernier induit l’expression de Blimp1 (B-lymphocyte-induced maturation protein 1) aussi
28 Figure 3 : Migration des CGP. (A) Localisation des CGP dans le sac vitellin près de la jonction entre l’intestin postérieur et l’allantoïde. (B) Migration des CGP le long de l’intestin postérieur et du mésentère dorsal jusqu’aux crêtes génitales. Adapté de Langman, 1981.
29 connu sous le nom de Prdm1 (Pr domain containing protein 1) qui active à son tour l’expression du gène Tfap2c (Transcription factor AP-2 gamma). Tfap2c code pour la protéine AP2γ (activating enhancer-binding protein 2γ) spécifique de la lignée germinale (Ohinata et al., 2005). Ces cellules représentent donc les précurseurs de la lignée germinale. Blimp1 induit également l’expression de Prdm14 (PR domain zinc-finger protein 14; Strome and Updike, 2015). Ce dernier joue un rôle clé dans la réacquisition du potentiel de pluripotence ainsi que dans la reprogrammation épigénétique globale des CGP. Ensemble, ces facteurs forment les régulateurs transcriptionnels majeurs orchestrant la spécification de la lignée germinale en réprimant d’une part le programme somatique et en induisant le programme germinal d’autre part (Tang et al., 2016). Chez l’Homme, l’expression de Blimp1 est également sous contrôle du gène Sox17 (SRY-Box 17; Irie et al., 2015).
2) Migration des cellules germinales primordiales vers les crêtes génitales
Une fois spécifiées, les CGP rassemblées à la base de l’allantoïde migrent en direction de l’endoderme intestinal à partir de 7,75 jpc chez la souris et 4 SG chez l’Homme. Cette première vague de migration est due aux mouvements morphogénétiques de l’embryon (Irie, Tang and Surani, 2014). Vers 9,5 jpc dans l’embryon murin, les CGP en migration émettent des protrusions cytoplasmiques de type filipodes. Elles se déplacent à travers l’intestin postérieur nouvellement formé, remontent le mésentère dorsal puis colonisent les crêtes génitales (Starz-Gaiano and Lehmann, 2001). Aux alentours de 10,5 jpc/6 SG, toutes les CGP auront atteint les futures ébauches gonadiques (Fig. 3)
3) Prolifération des cellules germinales
Tout au long de leur migration, les CGP prolifèrent activement par divisions mitotiques. Une fois arrivées dans les crêtes génitales, la phase proliférative se poursuit. Le nombre de CGP augmente alors de manière exponentielle et passe d’environ 900 à 10,5 jpc à près 6000 cellules à 13,5 jpc dans les gonades murines (Pepling and Spradling, 2001). Cette phase de prolifération est plus longue chez l’Homme mais présente également une augmentation exponentielle du nombre de cellules germinales (Tang et al., 2016). De manière intéressante, les cellules-filles obtenues après chaque cycle de division mitotique restent rattachées l’une à l’autre par des ponts cytoplasmiques ce qui forme des structures en « cystes » appelées les « nids ovigères » (Wang et al. 2017).Au cours de cette phase proliférative, différents remodelages génétiques et épigénétiques sont mis en place afin d’assurer une bonne différenciation des CG.
30 II- Différenciation germinale
1) Différenciation gonadique
Peu après la colonisation des ébauches gonadiques par les CGP (11,5 jpc chez la souris et 6 SG chez l’Homme), la différenciation gonadique est entamée. Jusqu’alors identiques dans les fœtus mâles et femelles, les gonades « bipotentielles » débutent une phase de différenciation dans l’optique de former deux testicules chez les individus XY, notamment par le biais du gène Sry (Sex-determining Region of Y chromosome), ou deux ovaires chez les individus XX qui en sont dépourvus (Spiller, Koopman and Bowles, 2017). Ce n’est qu’à partir de 12,5 jpc chez la souris et 6,5 SG chez l’Homme, que les cordons séminifères formés par les cellules de Sertoli deviennent bien visibles autour des cellules germinales (appelées gonocytes à ce stade) dans les testicules. Les ovaires quant à eux sont dépourvus de cordons et contiennent des cystes d’ovogonies éparpillés entre les cellules somatiques ovariennes.
2) Génétique de la cellule germinale
a) Gènes de pluripotence
Nanog (Nanog homeobox) est exprimé dans les CGP depuis le moment de leur spécification et ce tout au long de la phase migratoire. Cette expression est maintenue après la colonisation des crêtes génitales jusqu’à l’initiation méiotique dans les embryons femelles et jusqu’à l’arrêt mitotique dans les embryons mâles (Yamaguchi et al., 2005). Ainsi, la protéine NANOG n’est exprimée que dans les cellules germinales en prolifération. Par ailleurs, NANOG est essentiel à l’induction de l’expression de Blimp1 et Prdm14. Il joue ainsi un rôle primordial dans la spécification de la lignée germinale (Murakami et al., 2016).
Dès le moment de leur spécification, jusqu’à la phase de différenciation, les CGP expriment des marqueurs de pluripotence leur permettant d’être maintenues à l’état souche. Parmi ces marqueurs figure le facteur de transcription AP2γ (TFAP2C) qui induit l’expression du gène Pou5f1 (POU class 5 homeobox 1) (Chen et al., 2018). Ce dernier code pour la protéine OCT3/4 (octamer-binding transcription factor 4), un facteur de transcription exprimé par les cellules souches (Lengner et al., 2007). On la retrouve dans les CGP au moment de la spécification et ce jusqu’au moment de la différenciation sexuelle dans les gonades. Ce facteur est nécessaire à la spécification des CGP mais aussi au maintien de leur état de pluripotence (Pastor et al., 2018).
31 De plus, les CGP expriment des marqueurs membranaires de cellules pluripotentes tels que SSEA-1 (Stage Specific Embryo Antigen 1) et c-KIT dont l’expression favorise la reconnaissance des cellules de lignée germinale et l’établissement de « niches » (Hoyer et al., 2005; Hamidabadi et al., 2015). Les CGP expriment également SOX2 chez la souris (Irie et al., 2014) et SOX17 chez l’homme (Irie et al., 2015).
Comme toutes les cellules souches pluripotentes, les CGP possèdent une activité « phosphatase alcaline » importante. La phosphatase alcaline est une enzyme membranaire existant sous différentes isoformes dans les divers tissus, dont par exemple la TNAP (Tissue non-specific alkaline phosphatase) exprimée dans les CGP de souris (MacGregor et al, 1995) et GCAP (Germ cell alkaline phosphatase) exprimée dans les CGP humaines (Stefkova et al, 2015). Le rôle principal de la signalisation phosphatase alcaline est d’assurer une signalisation correcte au sein des cellules souches. Cependant, celle-ci n’est pas indispensable à l’établissement ni à la migration de la lignée germinale (Stefkova et al, 2015). Son expression débute dès le stade blastocyste et persiste jusqu’au moment de la différenciation des CG (MacGregor et al, 1995; Stefkova et al, 2015).
b) Différenciation germinale
Au moment de la colonisation de la gonade, les CG expriment de nouveaux facteurs nécessaires à la différenciation germinale (Sarraj and Drummond, 2012). Au même moment, une déméthylation globale de l’ADN effectuée au sein des CG (voir partie III) active la transcription de gènes spécifiquement germinaux tels que Ddx4 (DEAD box polypeptide 4, aussi connu sous le nom de mouse vasa homolog Mvh) ainsi que Dazl (deleted in azoospermia-like) (Spiller, Koopman and Bowles, 2017). Alors que les protéines SSEA1, OCT4 et TNAP ne sont pas des facteurs spécifiquement germinaux, mais plutôt des marqueurs de cellules souches, l’expression de DDX4 et DAZL est strictement limitée aux cellules germinales après leur arrivée au sein des ébauches gonadiques (Toyooka et al., 2000).
DDX4 est une hélicase de l’ARN appartenant à la famille DEAD-box et dont l’activité est dépendante de l’ATP (Yajima and Wessel, 2011). Conservée des invertébrés à l’espèce humaine, elle est localisée dans le cytoplasme des cellules germinales fœtales et adultes. Son rôle principal est d’assurer le « contrôle qualité » des ARN messagers (ARNm) avant leur traduction en protéines (Yajima and Wessel, 2011). Il a été montré que DDX4 n’était pas essentiel à la fertilité féminine puisque les souris femelles déficientes pour Ddx4sont complètement fertiles. Au contraire,
32 les souris mâles Ddx4-/- sont stériles ce qui suggère un dimorphisme sexuel concernant l’activité et la fonction de cette protéine (Tanaka et al., 2000; Kuramochi-Miyagawa et al., 2010). Plus récemment, une équipe américaine a montré que DDX4 est impliqué dans la répression des rétrotransposons dans les CG mâles spécifiquement, ce qui pourrait expliquer ce dimorphisme (Kuramochi-Miyagawa et al., 2010).
DAZL est une protéine de liaison aux ARN exprimée à la fois dans les cellules germinales mâles et femelles (Saunders et al., 2003 ; Gill et al., 2011). Elle est essentielle à l’acquisition de la « compétence méiotique » , c’est-à-dire la capacité d’une cellule à initier la prophase I de méiose (Gill et al., 2011). En effet, les souris invalidées pour le gène Dazl sont totalement stériles. De plus, les cellules germinales issues de fœtus murins Dazl-/- restent dans un état souche indifférencié et sont donc incapables d’initier et de progresser en prophase I de méiose (Soh et al., 2015). Le rôle principal de DAZL est de se fixer aux ARNm de gènes méiotiques et de stabiliser leur expression afin de pouvoir permettre aux cellules d’avancer en méiose (Rosario
et al., 2017).
c) Détermination sexuelle
La différenciation sexuelle proprement dite est mise en place vers 13,5 jpc chez la souris et à partir de 10 SG chez l’humain. Dans les CG femelles, elle est principalement caractérisée par la sortie du programme mitotique et l’initiation de la première division de méiose (Sarraj and Drummond, 2012). Les CG mâles quant à elles n’entrent pas en méiose mais poursuivent leur prolifération jusqu’à initier une phase de quiescence mitotique qui se poursuit jusqu’à la naissance (phase caractérisée chez les rongeurs, son existence est encore mise en doute dans le testicule humain (van den Driesche et al., 2015).
Cette dichotomie sexuelle est la conséquence de signaux extrinsèques et intrinsèques à la cellule germinale, différents entre les deux sexes. Diverses études ont montré que l’entrée en méiose des CG s’effectue suivant un axe antéro-postérieur et est opérée sous contrôle du gène Stra8 (Stimulated By Retinoic Acid 8) dont l’expression est augmentée dans les CG aux alentours de 12,5 jpc chez la souris (Spiller, Koopman and Bowles, 2017).
Des expériences de co-cultures de gonades fœtales à différents âges ont montré que le testicule fœtal sécrète une substance qui inhibe l’initiation méiotique tandis que les ovaires fœtaux en sécrètent une qui promeut la méiose (Byskov et al., 1976; Guerquin et al., 2010).
33
i- Différenciation mâle
Les années 2000 ont été le siège de nombreuses études scientifiques sur la régulation de l’entrée en méiose. Grâce à des expériences de séquençage sur génome entier, le gène Cyp26b1 (cytochrome P450, family 26, subfamily b, polypeptide 1) a été détecté. Exprimé dans les gonades indifférenciées, son expression est réprimée dans les ovaires en développement et augmentée dans les testicules (Guerquin et al., 2010; Spiller, Koopman, and Bowles, 2017). Le gène Cyp26b1 code pour une enzyme qui dégrade l’acide rétinoïque (AR), un métabolite actif de la vitamine A suspecté d’être à l’origine de l’initiation de la méiose via induction de l’expression du gène Stra8 (Oulad-Abdelghani et al., 1996; Anderson et al., 2008; Guerquin et al., 2010).
En contrepartie, NANOS2, une protéine de liaison à l’ARN, joue également un rôle déterminant dans la prévention de l’entrée en méiose des CG mâles dans les testicules fœtaux via la séquestration et la dégradation des transcrits du gène Dazl (Kato et al., 2016). Une fois dégradé, les ARNm méiotiques ne seront pas stabilisés ce qui empêche l’entrée et la progression en méiose. Cependant, même en l’absence d’expression de NANOS2 chez la souris, certains marqueurs méiotiques tels que Sycp3 (Synaptonemal complex protein 3) et Stra8 sont détectés dans les CG mâles aux alentours de 14,5 jpc (Spiller, Koopman and Bowles, 2017). Ainsi, il semble que l’expression de Nanos2 n’inhibe pas l’entrée en méiose proprement dite mais empêche plutôt une entrée ectopique des CG mâles en méiose au cours de la maturation testiculaire.
Un troisième facteur est également impliqué dans cette inhibition de l’entrée en méiose dans le testicule fœtal. Il s’agit du fibroblast growth factor 9 (FGF9) produit par les cellules de Sertoli (Bowles et al., 2010). FGF9 est capable d’une part d’agir directement sur les CG mâles via ses récepteurs membranaires FGFR1 et 2 qui sont exprimés sur leur membrane. Afin de prévenir leur entrée en prophase I de méiose, FGF9 est capable de diminuer la sensibilité des CG à l’AR et empêche la surexpression de Stra8 (Bowles et al., 2010; Feng, Bowles, and Koopman, 2014). D’autre part, FGF9 maintient l’expression de facteurs de pluripotence tels que Nanog et Oct4 dans les gonocytes, maintenant ainsi leur état de cellule germinale souche (Gustin et al., 2016).
34 Figure 4 : Représentation schématique du développement des cellules germinales femelles de mammifère et des stades de la folliculogenèse. (A) Les cellules germinales primordiales (PGC) prolifèrent activement et forment des cystes ou nids ovigères avant d’entrer en prophase I de méiose. Celle-ci se déroule en quatre stades distincts allant du leptotène au diplotène (pour plus d’informations, voir chapitre II). Après rupture des nids ovigères, les ovocytes sont contenus dans des structures appelées follicules primordiaux. (B) Ces follicules entrent par la suite en phase de maturation sous l’effet de signaux spécifiques. La maturation folliculaire est accompagnée d’une augmentation de la taille des ovocytes et de la quantité de cellules de la granulosa qui les entourent. Figure adaptée d’après Anderson and Telfer, 2018.
35
ii- Différenciation femelle
La différenciation sexuelle femelle caractérisée par l’entrée et la progression en méiose sera détaillée dans le Chapitre deux.
A partir de ce point, nous nous focaliserons sur l’étude de la cellule germinale femelle 3) Maturation sexuelle femelle
a) Assemblage des follicules primordiaux : rupture des nids ovigères Lors de leur prolifération, la cytokinèse des CG est incomplète. Les ovogonies issues d’une même cellule-mère restent alors reliées entre elles par des connexions inter-cytoplasmiques et forment des « cystes » germinaux ou « nids ovigères » (Pepling and Spradling, 2001; Wang et al., 2017). Au sein d’un même cyste, certaines cellules sont dites « nourricières ». Peu après l’initiation méiotique, celles-ci transfèrent leurs organelles vers les ovocytes en cours de maturation à travers les ponts cytoplasmiques (Wang et al. 2017). Lorsque les ovocytes atteignent la fin de prophase I de méiose, ils développent une structure cytoplasmique péri-nucléaire formée d’un ensemble de mitochondries, de réticulum endoplasmique et de compartiments golgiens appelée « corps de Balbiani » (Lei and Spradling, 2016).
Aux alentours de 17,5 jpc chez la souris et à partir de 18 SG dans l’espèce humaine un processus d’auto-dégradation des nids ovigères est initié afin de former des follicules primordiaux (Sun and Chen, 2017; Li et al., 2017). Des cellules somatiques de la pré-granulosa envahissent les cystes germinaux et se positionnent autours des ovocytes et les connexions inter-cytoplasmiques qui relient les ovocytes l’un à l’autre sont rompues. Ceci correspond à la « rupture des nids ovigères » dans l’optique de construire un follicule (Fig. 4). Ce phénomène est accompagné d’une apoptose germinale massive si bien qu’au sein d’un même cyste, seul un ovocyte survivra et formera un follicule primordial (Pepling and Spradling, 2001). Seuls 33% des ovocytes de mammifères survivent à la rupture des nids ovigères et établissent un stock définitif et non renouvelable d’ovocytes appelé la « réserve ovarienne » (Pepling and Spradling, 2001). Les mécanismes qui régissent l’assemblage des follicules primordiaux ne sont pas encore bien élucidés mais certains facteurs entrent en jeu tels que le facteur spécifique aux cellules germinales FIGLα (factor in the germline alpha ; Bayne et al., 2004), la protéine
36 TAF4B (Transcription initiation factor TFIID subunit 4B ; Grive et al., 2016) ou encore les récepteurs aux œstrogènes (ER; Mu et al., 2015).
b) Maturation somatique : la folliculogenèse
Aux alentours de 8 jours post partum (jpp) chez la souris (Pepling et Spradling, 2001) et en moyenne 7 ans chez les filles (Baker, 1963) l’ensemble des ovocytes est entouré de cellules somatiques pour former des follicules primordiaux. Ces ovocytes sont engagés dans une période de dormance pouvant durer pendant toute la durée de la période reproductive (Reddy et al., 2010). Plus spécifiquement, ils sont bloqués en fin de prophase I de méiose et forment ce que l’on appelle une « vésicule germinative » (GV, de l’anglais germinal vesicle).
Différents facteurs germinaux et somatiques sont à l’origine de la maintenance de cet état quiescent des follicules tels les protéines PTEN (phosphatase and tensin homolog), TSC1/2 (tuberous sclerosis complex 1 and 2), FOXO3a, p27 ainsi que la voie de signalisation PI3K (phosphoinositide 3-kinase) (Reddy et al., 2010; Kim et al., 2018; R. A. Anderson and Telfer, 2018). Les cellules de la granulosa communiquent avec l’ovocyte via des jonctions communicantes et des protrusions cytoplasmiques qui permettent de coordonner les croissances ovocytaires et folliculaires (Mora et al., 2012).
A intervalles périodiques pendant la vie adulte, une cohorte de follicules primordiaux sera sélectionnée et leur maturation déclenchée. Les mécanismes à l’origine de la sélection des follicules qui vont débuter leur maturation à un instant « t » sont toujours mal compris. Cependant, le passage du stade follicule primordial à follicule primaire s’effectue sous contrôle du facteur de transcription SOHLH1 (spermatogenesis and oogenesis specific basic helix-loop-helix 1) qui active l’expression d’une série de protéines jouant des rôles spécifiques dans la maturation folliculaire (Pangas et al., 2006 ; Y.-F. Wang et al., 2018) :
LHX8 (LIM homeobox 8) qui joue également le rôle d’activateur transcriptionnel (Y.-F. Wang et al., 2018)
NOBOX (newborn ovary homeobox protein) spécifie l’expression génique spécifique des gènes permettant à l’ovocyte au stade GV d’augmenter considérablement de taille (Rajkovic et al., 2004).
FIGLα qui constitue également l’un des éléments majeurs à l’origine de la formation de la zone pellucide au moment de la croissance ovocytaire (Joshi et al., 2007).
37 Au même moment que la croissance ovocytaire, les cellules de la granulosa adoptent une forme cuboïdale et se multiplient pour former différentes assises cellulaires autour de l’ovocyte. Un deuxième type de cellules somatiques, les cellules de la thèque, viennent alors entourer les cellules de la granulosa. Les follicules en croissance sont classifiés en fonction de leur morphologie, de la taille de leurs ovocytes et du nombre d’assises de cellules de la granulosa les constituant (Zeleznik and Pohl, 2006 ; Fig. 4). Les follicules poursuivent alors leur maturation jusqu’au moment ou une cavité remplie de liquide folliculaire appelée « antrum » se forme. A ce moment-là, les cellules de la granulosa externes se mettent à exprimer des récepteurs aux gonadotropines et deviennent sensibles à la FSH (Follicle Stimulating Hormone) puis à la LH (Luteinizing Hormone) (Dewailly et al., 2016). Sous l’effet de la FSH et des œstrogènes sécrétés par les cellules de la thèque interne, les follicules entament une phase de maturation dans laquelle ils augmentent de cent à cent-cinquante fois leur volume (Coticchio et al., 2015). Lors du pic de LH précédant l’ovulation, la membrane basale du follicule mature (follicule de De Graaf) se rompt sous l’effet de fortes concentrations d’acide hyaluronique, ce qui permet la libération du complexe cumulo-ovocytaire (COC) vers les trompes de Fallope (Miha las et al., 2017). Les cellules de la granulosa restantes et de la thèques se différencient alors pour former le corps jaune (corpus luteum) chargé de la synthèse de progestérone nécessaire à l’accomplissement de la seconde moitié du cycle ovarien (Varani et al., 2002).
III- Reprogrammation épigénétique des cellules germinales
Le terme « épigénétique » a été décrit pour la première fois en 1942 par Conrad Waddington comme étant « l’interaction des gènes avec leur environnement ce qui donne naissance au phénotype» (Waddington, 1942).
Les modifications épigénétiques sont de nos jours décrites comme des modifications chimiques héréditaires et réversibles de la chromatine, ce qui entraîne un ajustement de son activité sans modification de la séquence d'ADN sous-jacente. L'épigénétique joue un rôle important dans la différenciation cellulaire, la croissance, le métabolisme et la régulation de l'expression génique en inhibant et en activant des gènes spécifiques (Barrett, 2017). De plus, il a été montré que les mécanismes épigénétiques facilitent l’interaction entre la transcription des gènes et l’environnement (Barrett, 2017).
L’information génétique qui code le génome d’un individu est établie au moment même de la fusion des deux noyaux au moment de la fécondation (Reik et Surani, 2015). Cette
38 Figure 5 : Méthylation de l’ADN et mode d’activité des DNA méthyltransférases. (A) Méthylation d’une cytosine au niveau d’un îlot CpG. (B) Méthylation de novo de l’ADN suite à l’action de la DNMT3. (C) Suite à la réplication de l’ADN, deux nouvelles molécules sont obtenues. Le brin matrice conserve les marques de méthylation d’origine alors que le brin néosynthétisé en est dépourvu. Les deux nouvelles molécules d’ADN sont donc hémiméthylées. Les DNMT1 sont chargées de redéposer des groupements méthyl au niveau des îlots CpG du brin néosynthétisé. Dans le cas contraire, le pourcentage global de méthylation de l’ADN sera dilué (déméthylation passive). Figure adaptée d’après Li and Zhang, 2014.
39 information est constante et n’est pas modifiée tout au long du développement (à l’exception des mutations qui pourraient être produites au cours de cycles de reproduction, voir chapitre 3). Au cours du développement embryonnaire, des modifications majeures de la condensation de la chromatine et du patron de méthylation de l’ADN se produisent. Ces modifications régissent l’expression ou la non expression des gènes à la fois au cours du développement (Leitch, Tang and Surani, 2013) et pendant la vie adulte d’un individu (Barrett, 2017). De plus, elles participent à la régulation des évènements de réparation de l’ADN et notamment lors de la recombinaison homologue en méiose (Baudat, Imai and de Massy, 2013). Lorsqu’ils touchent les cellules germinales, certains de ces changements sont héritables d’une génération à une autre (Barrett, 2017) d’où leur importance critique au sein de l’évolution (héritabilité transgénérationnelle). Ces marques épigénétiques sont présentes dans le génome des futurs gamètes très précocement au cours du développement fœtal.
Les modifications épigénétiques sont très diverses : méthylation de l’ADN, modifications post-traductionnelles des protéines histones, variants d’histones, protéines chromatiniennes non histones, ARN non codants, etc (Tammen, Friso and Choi, 2013 ; Reik and Surani, 2015). Dans le cadre de cette étude bibliographique, nous nous focaliserons sur les principales modifications rencontrées dans les cellules germinales de mammifères, à savoir la méthylation de l’ADN et des histones associées.
1) Méthylation de l’ADN
a) Généralités
La méthylation est un processus chimique impliquant l’addition d’un groupement méthyl (CH3) au sein d’une protéine, d’un lipide ou d’une molécule d’ADN. Au niveau de l’ADN, la méthylation s’effectue spécifiquement sur les cytosines pour former la 5mC et est souvent associée à une répression de l’expression des gènes (Li et Zhang, 2014). Les cytosines méthylées existent dans une entité que l’on appelle les îlots CpG. La 5mC est le produit de l’activité des DNMT (DNA methyl transferase) (Fig. 5A).
Chez les mammifères, il existe deux types de DNMT :
Les DNMT3 chargées de la méthylation dite de novo, agissant principalement au début du développement embryonnaire (Fig 5B). En effet, suite à la fécondation, l’ensemble du génome du zygote est déméthylé. Les DNMT3 se chargent d’apposer de nouveaux profils de méthylation sur les îlots CpG dans le noyau des cellules
40 Figure 6 : Dynamique de régulation de la méthylation de l’ADN au cours du cycle de vie des mammifères. (A) Une cascade de modifications enzymatiques de la cytosine est impliquée dans le contrôle et l’effacement des marques de méthylation au sein des ilots CpG. Les DNMT rajoutent un groupement méthyle au carbone 5 des cytosines (encadré gris), induisant la formation de la 5mC. Les enzymes TET catalysent l’oxydation de la 5mC en 5hmC, 5fC et 5caC (encadrés jaune et orange). Celles-ci peuvent être diluées de manière passive par les cycles de réplication de l’ADN ou prises en charge par la TDG puis par le BER pour reformer une cytosine non méthylée (encadré rouge). (B) Vue d’ensemble de la contribution de la déméthylation passive de l’ADN dans la dynamique de régulation des patterns de méthylation. Un effacement global de la méthylation pendant la période préimplantatoire et dans les CGP repose principalement sur des processus de déméthylation passive. Adaptée d’après Schuermann, Weber and Schar, 2016.