HAL Id: tel-02016365
https://tel.archives-ouvertes.fr/tel-02016365
Submitted on 12 Feb 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Étude des mécanismes de chimiorésistance médiés par le
microenvironnement de la moelle osseuse dans la
Leucémie Aiguë Myéloïde. Mise en évidence d’un
transfert de mitochondries actives des cellules stromales
vers les blastes leucémiques
Ruxanda Moschoi-Bodisteanu
To cite this version:
Ruxanda Moschoi-Bodisteanu. Étude des mécanismes de chimiorésistance médiés par le microenvi-ronnement de la moelle osseuse dans la Leucémie Aiguë Myéloïde. Mise en évidence d’un transfert de mitochondries actives des cellules stromales vers les blastes leucémiques. Hématologie. Université Côte d’Azur, 2018. Français. �NNT : 2018AZUR4084�. �tel-02016365�
E
tude des mécanismes de
chimiorésistance médiés par le
microenvironnement de la moelle osseuse
dans la Leucémie Aiguë Myéloïde.
Mise en évidence d’un transfert de
mitochondries actives des cellules stromales
vers les blastes leucémiques.
Ruxanda MOSCHOI-BODISTEANU
Centre Méditerranéen de Médecine Moléculaire C3M U1065
Présentée en vue de l’obtention du
grade de docteur en recherche clinique et
thérapeutique
d’Université Côte d’Azur
Dirigée par : Dr. Jean-François PEYRON Co-encadrée par : Dr. Emmanuel
GRIESSINGER
Soutenue le : 23 octobre, 2018
Devant le jury, composé de :
Pr. Olivier HERAULT, PU-PH, CHU de Tours
Dr. Marie-Luce VIGNAIS, CR1, U1183,
Montpellier
Pr. Véronique PAQUIS, PU-PH, CHU de Nice Dr. Jean-François PEYRON, DR2, C3M, U1065, Nice
Dr. Emmanuel GRIESSINGER, PhD, UCA, Nice
Etude des mécanismes de chimiorésistance
médiés par le microenvironnement de la moelle
osseuse dans la Leucémie Aiguë Myéloïde.
Mise en évidence d’un transfert de
mitochondries actives des cellules stromales
vers les blastes leucémiques.
Jury :
Président du jury et Rapporteur :
Pr Olivier HERAULT, PU-PH, CHU de Tours (France)
Rapporteur :
Dr. Marie-Luce VIGNAIS, CR1, Inserm U1183, Montpelier (France)
Examinateur :
Pr. Véronique PAQUIS, PU-PH, CHU de Nice (France)
Invité :
Dr. Emmanuel GRIESSINGER, PhD, UCA, Nice (France)
REMERCIEMENTS
La thèse de doctorat représente un travail s’inscrivant dans la durée,
constituant ainsi le fil conducteur d’une tranche de vie, souvent entre le
crépuscule de la naïveté d'une vie d'étudiant, et l’aube d’une maturité
scientifique. Il y a eu un avant qui ne sera plus et un après qui reste à
construire. De nombreuses personnes se retrouvent ainsi impliquées de leur gré
ou non, pour le pire ou le meilleur entre le doctorant et son travail de doctorat.
Ce sont les noms de toutes ces personnes que j’aimerais graver sur ces quelques
pages et leur adresser mes profonds remerciements.
Je tiens tout d’abord à remercier les membres du jury d’avoir accepté de juger
mon travail de thèse ; je remercie Mme Marie-Luce Vignais, Mme Véronique
Paquis et Mr Olivier Hérault.
Je remercie chaleureusement toutes les personnes qui m’ont aidé durant ma
thèse et notamment mon directeur de thèse, le Dr Jean-François Peyron. On le
sait, ce parcours de thèse a été complexe et un peu chaotique mais je n’ai
développé aucune phobie grâce à vous car vous m’avez toujours guidée et
soutenue tout au long de ce projet.
Merci pour votre aide, pour votre curiosité scientifique et votre soutien, merci
pour votre grande disponibilité et les nombreux conseils durant toute ma thèse.
Vous êtes un Chef proche de ses étudiants et toujours à leur écoute. Merci pour
la compréhension de mon langage roumeno-russo-allemando-français, je suis
consciente du travail demandé surtout pour les corrections de ma thèse. Je vous
remercie infiniment.
Merci au Dr Emmanuel Griessinger qui m’a proposé le plus captivant et
attrayant projet parmi tous les sujets de masters. Merci pour toutes tes
remarques critiques et constructives, cela m’a permis de nombreuses fois de
savoir où se trouvent mes lacunes et d'identifier les points à améliorer. Merci
pour ton encadrement et ta patience, pour le partage de tes savoirs, merci pour
ton enthousiasme et ta persévérance.
Après ces 3 ans passés aux C3M, je suis convaincue que la thèse est loin d'être
un travail solitaire. Je n'aurais jamais pu réaliser ce travail doctoral sans le
soutien d'un grand nombre de personnes dont la générosité, la bonne humeur
et l'intérêt manifestés à mon égard m'ont permis de progresser dans ce projet.
Je remercie chaleureusement tous les membres de l’équipe 4.
Merci Didier, cette thèse aurait été incomplète et totalement différente sans
toi. Avec toi on a ce sentiment qu’on a rarement dans la vie : l’impression
qu’on se connaît depuis longtemps et non que depuis 3 ans, on se sent en
confiance et compris. Merci pour ton soutien, tes encouragements et d’avoir cru
en moi.
Merci, Fabien pour ta curiosité et ta collaboration scientifique, les discutions
enrichissante sur le Krav-Maga, j’ai appris beaucoup de choses et aussi merci
pour les muffins.
Grazie Giulia, perché ho avuto la possibilità di dividere con te le mie
preoccupazioni riguardo al nostro futuro insicuro, grazie per la tua amicizia
ed originalità italiana, che hai portato alla nostra squadra, ma ancora di più
da noi nel ufficio. È stato estremamente piacevole collaborare con te, sei
fantastica! GRAZIE MILLE!
Marielle, nos discussions sur les romans «de science-fiction J » vont beaucoup
me manquer. Merci pour la joie que tu apportes chaque jour dans l’équipe, tu
es notre rayon de soleil à travers les gouttes de pluie.
Véro, merci de veiller à la bonne organisation dans l’équipe, pour les remarques
pertinentes, pour ton partage scientifique mais aussi humain, et merci aussi
d’avoir été mon groupe de supporters pour mon tout premier congrès !
Raphaël et Pauline, merci pour votre joie et bonne humeur, pour les gâteaux et
sucreries pendant les datas, ça ne nous a pas aidé dans notre philosophie de vie
« Mens sana in corpore sano » mais comme c’était bon !
Merci Virginie, pour ton aide administrative mais également pour ta bonne
humeur et ta disponibilité.
Je pense aussi aux stagiaires avec qui j’ai eu la chance de travailler.
L’ambiance de travail a été excellente et nous avons pu ainsi allier bons
moments et séances de travail : Rita qui a su mettre l’expression « moi
encore » à la mode ; Anne-Sophie-vive la madeleine fluorescente !
Je remercie également tous les autres thésards du centre Gwenaëlle, Ilona,
Robin, Sébastien,
post-doc Claudine et notre responsable d’imagerie Maeva,
pour la bonne ambiance, leur optimisme mais également pour les nombreux
bons moments passés ensemble, très souvent autour du repas de midi.
Un grand merci à Lisa Kaminski, je t’avais embêtée de nombreuses fois
surtout pendant les derniers mois avant notre soutenance. Merci pour ton
aide.
Merci à toute l’équipe 3, en particulier à Johanna, Annabelle, Rana, Élodie
merci pour votre aide scientifique, vous m’avez beaucoup encouragée et
soutenue.
Merci à toute l’équipe 1, et plus spécialement à Karine et Céline de m’avoir
permis de m’incruster dans votre cercle durant les repas de midi, merci pour le
partage scientifique, votre optimisme, bonne humeur et votre soutien.
Je remercie beaucoup Justine, Lila, Morgane qui m’ont permis d’oublier
momentanément le travail, même s’il nous hantait beaucoup durant nos
soirées apéro. Merci les filles pour les fous rires, l’amitié, votre soutien, les
encouragements, merci simplement pour tous ces moments inoubliables passés
ensemble.
Au terme de ce parcours, je remercie enfin celles et ceux qui me sont chers et
que j’ai parfois quelque peu délaissés. Leurs attentions et encouragements
m’ont accompagné tout au long de ces années.
Merci à ma merveilleuse fille, Ionela, tu as transformé et donné un sens à ma
vie, je t’aime infiniment et je suis la plus fière maman au monde de t’avoir toi
pour fille.
Merci à mon mari, Ivan je te dois tout et si je suis là aujourd’hui c’est en
grande partie grâce à toi car tu me fais confiance et tu crois en moi, te iubesc.
Je suis redevable à ma belle-famille, ma belle-mère Zinovia, Petru, Igor vous
m’avez énormément aidée, encouragée et entourée d’attention et d’amour.
Merci, je suis tellement chanceuse de vous avoir.
Merci à mes parents « mămica, iți mulțumesc pentru toate sacrificiile făcute
pentru noi si pentru mine, pentru curajul tău, pentru sprijinul constant,
prietenia ta si dragostea cu care m-ai învelit din primele clipe de viată, e greu
sa exprim in cuvinte imensa recunoștința ce ti-o port, mulțumesc si te iubesc”.
Mulțumesc tăticu, pentru educația ce mi-ai dat-o, pentru grija ce mi-o porți,
pentru încredere si dragoste incondiționată.
Merci à ma meilleure amie, Victoria, même de loin, tu as toujours été là pour
moi, avec cette question récurrente, « quand est-ce que tu la soutiens cette thèse
? », bien qu’angoissante en période fréquente de doutes, tu m’as encouragé pour
ne jamais dévier de mon objectif final.
RESUME
Etude des mécanismes de chimiorésistance médiés par le
microenvironnement de la moelle osseuse dans la Leucémie Aiguë
Myéloïde.
Mise en évidence d’un transfert de mitochondries actives des
cellules stromales vers les blastes leucémiques.
Résumé
La leucémie aiguë myéloïde (LAM) est une hémopathie maligne à progression rapide, qui se caractérise par une expansion clonale de précurseurs myéloïdes présentant un contrôle défectueux de leur prolifération et de leur différenciation.
Une rémission complète peut être obtenue chez environ 80% à 85% des patients en associant cytarabine et anthracycline qui sont respectivement un inhibiteur de la synthèse d’ADN et un agent intercalant. Néanmoins, les résultats globaux pour les patients atteints de LAM restent médiocres et le taux de survie à 5 ans des patients âgés de plus de 60 ans, est inférieur à 10%. Le paradigme bien accepté de la leucémogenèse est que la leucémie résulte de la transformation d'une cellule unique appelée cellule souche leucémique (SCL) ou cellule initiatrice de leucémie (LIC) qui se développe par autorenouvellement et engendre par division asymétrique les blastes leucémiques bloqués dans leur différentiation. Les LIC vont être responsables du maintien et de la rechute de la maladie après le traitement chimiothérapeutique car si les traitements actuels sont relativement efficaces contre les blastes leucémiques, ils échouent au niveau des LIC. Un autre facteur important impliqué dans la résistance aux traitements est le microenvironnement de la moelle osseuse qui forme la niche hématopoïétique.
Des études ont montré que différents composants cellulaires de la niche peuvent transférer des mitochondries à des cellules normales soumises à un stress métabolique ou dans un contexte pathologique, vers des cellules cancéreuses.
Durant ma thèse, j'ai pu montrer que les cellules murines de la lignée MS-5 et/ou des cellules stromales primaires humaines dérivées de la moelle osseuse, utilisées comme cellules nourricières dans des expériences de co-culture, sont capables de transférer des mitochondries fonctionnelles aux cellules leucémiques.
En utilisant différentes approches moléculaires et d'imagerie, nous avons pu montrer que les cellules de LAM peuvent, par ce transfert, augmenter leur masse mitochondriale jusqu'à 14%. Dans la co-culture, les cellules LAM receveuses ont montré une augmentation de 1,5 fois de la production d'adénosine triphosphate (ATP) mitochondriale et se sont révélées moins sujettes à une dépolarisation mitochondriale après chimiothérapie, affichant une survie plus élevée. Ce transfert unidirectionnel, renforcé par certains agents chimiothérapeutiques, nécessite des contacts cellule-cellule et semble se dérouler par une voie endocytaire qui reste à déterminer. Enfin, nous démontrons que le transfert mitochondrial est observé in vivo dans un modèle de xénogreffe de souris immunodéficientes NSG et se produit également dans les cellules et les
progéniteurs initiateurs de la leucémie humaine et leur conférant une capacité plus élevée à initier des cultures leucémiques à long terme.
Nous avons ainsi apporté la preuve qu'un transfert horizontal de mitochondries provenant des cellules stromales de la niche hématopoïétique participe aux phénomènes de chimiorésistance des cellules leucémiques receveuses.
De ce fait, cibler ce transfert mitochondrial pourrait représenter une future cible thérapeutique originale pour un traitement adjuvant des LAM visant à interférer avec le soutien de leur microenvironnement.
Investigation of a new chemoresistance mechanism mediated by
the bone marrow microenvironment in Acute Myeloid Leukemia
(AML).
Evidence for an active mitochondrial transfer from stromal cells
to leukemic blasts.
Abstract :
Acute myelogenous leukemia (AML) is a heterogeneous group of hematopoietic malignancies arising from hematopoietic stem and/or progenitor cells that display defective control of their proliferation, differentiation, and maturation.
Complete remission is achieved using anthracycline and cytarabine combination therapy in 80% to 85% of older patients. Nevertheless, the overall outcomes for AML patients remain poor, and the 5-year survival rate for patients over 60 is less than 10%.
The well-accepted paradigm of leukemogenesis is that leukemia arises from the transformation of a single cell and is maintained by a small population of leukemic stem cells (LSC) or leukemia initiating cells (LICs). It is theorized that current treatments, although highly effective against the leukemic bulk, fail to eradicate the LICs that are therefore responsible for leukemia relapse.
Another important factor involved in resistance to treatments is the microenvironment of the bone marrow, which is called the hematopoietic niche.
Studies have shown that different niche cell components can transfer mitochondria to normal cells that undergo a metabolic stress and in a pathological context, to cancer cells.
During my PhD we demonstrate that in an ex vivo niche-like coculture system, cells both primary and cultured AML cells take up functional mitochondria from murine or human bone marrow stromal cells. Using different molecular and imaging approaches, we show that AML cells can increase their mitochondrial mass by up to 14%. After coculture, recipient AML cells showed a 1.5-fold increase in mitochondrial ATP production and were less prone to mitochondrial depolarization after chemotherapy, displaying a higher survival. This unidirectional transfer enhanced by some chemotherapeutic agents required cell–cell contacts and proceed through an ill-defined endocytic pathway. Transfer was greater in AML blasts compared with normal cord blood CD34+ cells. Finally, we demonstrate that mitochondrial transfer was observed in vivo in an NSG immunodeficient mouse xenograft model and also occurred in human leukemia initiating cells and progenitors.
As mitochondrial transfer provides a clear survival advantage following chemotherapy and a higher leukemic long-term culture initiating cell potential, targeting mitochondrial transfer could represent a future therapeutic target for AML treatment.
2
Sommaire ... 1
Liste des abréviations ... 6
Liste des figures ... 14
Liste des tableaux ... 20
Avant-propos ... 24
Présentation de la problématique d’une niche dérégulée dans la
LAM. Objectifs de l’étude ... 26
Partie 1 : Introduction sur le rôle du microenvironnement (ou
niche) dans la Leucémie Aiguë Myéloïde ... 28
I.
Le microenvironnement médullaire ... 28
I.1Généralités physiopathologiques des leucémies ... 29
I.1.1 Curiosités ... 29
I.1.2 Généralités ... 29
I.1.3. Les syndromes myélodysplasiques, des états pré-leucémiques
... 31
I.1.4 Les leucémies aiguës myéloïdes : physiopathologie, aspects
cliniques et pronostiques ... 32
I.1.5 Le traitement standard des patients LAM ... 36
I.1.6 Le concept de cellules souches leucémiques dans la LAM : une
aiguille dans une botte de foin. ... 38
I.2 Le microenvironnement, un sanctuaire pour les cellules
leucémiques ... 43
I.2.1 Niche hématopoïétique : composition ... 43
3
I.2.3 Régulation de l'hématopoïèse dans la niche : facteurs
intrinsèques et modes de communications intercellulaires ... 49
I.2.4 Niche hématopoïétique : une communauté pacifique détournée
au bénéfice de la leucémie : complice dans le crime ... 54
I.3 La chimiorésistance dans la LAM ... 64
I.3.1 Mécanismes intrinsèques de chimiorésistance dans la LAM .. 66
I.3.2 La corrélation entre la réponse au traitement et les CSLs ... 68
I.4 Les cibles thérapeutiques potentielles ... 79
I.4.1 Cibler les racines de la leucémie-les CSLs/CILs ... 79
I.4.2 Cibler le sol de la leucémie : la niche leucémique ... 91
II.
Transfert de mitochondries : nouveau mécanisme de
communication intercellulaire et de chimiorésistance entre la
niche et les LAM. Nouvelle évidence d’une niche dérégulée ? .... 100
II.1 Mitochondrie : généralités ... 100
II.1.1 Notion d'hétéroplasmie ... 104
II.1.2 Mitochondrie : centrale énergétique de la cellule ... 107
II.2 Transfert d’organelles ... 109
II.2.1 Transfert de mitochondries dans un contexte non-tumoral .. 111
II.2.2 Transfert de mitochondries et différenciation cellulaire ... 114
II.2.3 Transfert de mitochondries dans un contexte tumoral ... 115
II.2.4 Les cellules peuvent aussi se débarrasser de leurs mitochondries
... 117
II.2.5 Transfert de mitochondries et implication dans le processus
inflammatoire ... 119
4
II.2.7 Signaux stimulateurs du transfert de mitochondries ... 126
II.2.8 Régulation négative du transfert de mitochondries ... 129
II.2.9 Nouvelle cible thérapeutique-le transfert de mitochondries 129
Partie 2 : Contexte scientifique et objectifs de l’étude ... 132
I.
Résumé de l’article ... 133
II.
ARTICLE ... 135
III.
Hypothèses abordées concernant les signaux moléculaires
impliqués dans le transfert de mitochondries. ... 136
III.1 Résultats préliminaires ... 138
Partie 3 : DISCUSSION et PERSPECTIVES ... 142
Annexes ... 148
Références ... 154
6
8
LISTE DES ABREAVIATIONS
3MA 3-Methyl-Adenine
4EBP1 Eukaryotic Translation Initiation Factor 4E Binding Protein 1
ABCC1 ATP Binding Cassette Subfamily C Member 1
ADN Acide Ddésoxyribonucleique
ADNmt ADN mitochondrial
ADNn ADN nucléaire
AG Acides Gras
AGM Aorte-Gonade-Mésonéphros
ANG Angiopoïétine
ANGPTL3 Angioprotein-like Protein 3
AraC Cytarabine
ARN Acide RiboNucléique
ARNm ARN messagers
ARNT Aryl Hydrocarbon Receptor Nuclear Translocator
ATP L'adénosine triphosphate
AVC Accidents Vasculaire Cérébral
BAD BCL2 Associated Agonist of Cell Death
BAK BCL2 Antagonist/Killer
BAX BCL2 Associated X Protein
BCL2 B-Cell Lymphoma 2
BMI-1 Polycomb complex protein BMI-1
BMP Bone Morphogenic Protein
CAR CXCL12-abundant Reticular Cells
CAT Catalase
CBFa1 Core Binding Factor alpha 1
CBP CREB Binding Protein
CCL3 C-C Motif Chemokine Ligand 3
CDH24 Cadherin 24
9
CFU-F Colony Forming Units-Fibroblast
CIC Cellule Initiatrice de Cancer
CIL Cellule Initiatrice de Leucémie
CLL-1 Collectin Liver 1
CPT1 Carnitine Palmitoyl Transferase 1
CRmt Chaîne Respiratoire mitochondriale
CSC Cellule Souche Cancéreuse
CSH Cellules Souches Hématopoïétiques
CSL Cellule Souche Leucémique
CSM Cellules Souches/Stromales Mésenchymateuses
CXCR4 C-X-C chimiokine receptor type 4
DAMPs Damage-Associated Molecular Patterns
DCFDA 2′,7′-Dichlorodihydrofluorescein Diacetate
DC-STAMP Dendritic Cell–specific Transmembrane Protein
Dkk1 Dickkopf-related Protein 1
DPI Diphényléneiodonium
Drp1 Dynamin-related Protein 1
EBF2 Early B Cell Factor 2
ELF4 E74 Like Factor 4
FABP4 Fatty Acid Binding Protein 4
FAM French- American-British
FBXW7 F-Box and WD Repeat Domain Containing 7
FGF-R Fibroblast Growth Factor Receptor
FIS1 Fission, Mitochondrial 1
FLT3 Fms-like tyrosine kinase 3
FLT3-ITD Duplication interne en tandem de FLT3
GFP Green Fluorescent Protein
GJA1 GAP Junction Alpha-1
GLUT1/4 Glucose Transporter Type 1/4
GM-CSF Granulocyte Macrophage Colony Stimulating Factor
GPR56 G Protein-coupled Receptor 56
GPX3 Glutathione Peroxydase 3
10
HIF-1a Hypoxia-inducible factor 1 alpha
HO-1 Hème Oxygénase-1
ICAM Intercellular Cell Adhesion Molecule
IDH Isocitrate Dehydrogenase
IGFBP2 Insulin Like Growth Factor Binding Protein 2
IL Interleukin
IPSS International Pronostic Scoring System
JAK2 Janus kinase 2
JAM Junctional Adhesion Molecules
KIF5 Kinesin Family Member 5
LAL Leucémie Aiguë Lymphoblastique
LAM Leucémies Aiguës Myéloïdes
LDH Lactate Déshydrogénase
Lep-R Récepteur de la leptine
LFA1 Lymphocyte Function-associated Antigen 1
LIF Leukemia Inhibitory Factor
LLC Leucémie Lymphoïde Chronique
LlpP ATP-dependent Clp protease proteolytic subunit
LMC Leucémie Myéloïde Chronique
LPS Lipopolyssacharide
LRP LDL Receptor Related Protein
MAM Mitochondria-Associated ER-membrane
MCAM Melanoma Cell Adhesion Molecule
MDA Malondialdehyde
MDR1 Multidrug Resistance Protein 1
MEC Matrice Extracellulaire
Mfn 1/2 Mitofusine 1 et 2
mTOR Mammalian Target of Rapamycin
MTX Méthotrexate
NAC N-Acétyl Cystéine
NADPH Dihydronicotinamide-Adenine Dinucleotide Phosphate
NCAD Neural Cadherin
11
NF-kB Nuclear Factor-kappa B
NG2 Antigène Neuronal / Glial 2
NLR Nod-like Receptor
NMP1 Nucleophosmin 1
NO Monoxyde d'azote
NOD/SCID Nonobese diabetic/severe combined immunodeficiency
NOX NADPH Oxydase
OC- STAMP Osteoclast Stimulatory Transmembrane Protein
OPA1 Optic Atrophy 1
OPN Ostéopontine
OXPHOS Phosphorylation Oxydative
p53/TP53 Tumor Protein 53
PBX1 Pre-B Cell Leukemia Transcription Factor 1
PCSM Progéniteurs des CSMs
PDGFRA Platelet Derived Growth Fcator Receptor alpha
PDH Pyruvate Déshydrogénase
PDX Patient-derived Xenograft model
PGC-1α Peroxisome Proliferator-activated Receptor-gamma Coactivator 1
alpha
PGF Placentar Growth Factor
PGP Phosphoglycolate Phosphatase
PH Progéniteurs Hématopoïétiques
PI3K Phosphoinositide 3-Kinase
PML Promyelocytic Leukaemia Protein
PRR Pattern Recognition Receptor
PTEN Phosphatase and Tensin Homolog
PTH Parathormone
PTH Parathyroïd Hormone
PTPRT Receptor-Type Tyrosine-Protein Phosphatase T
qPCR Quantitative Polymerase Chain Reaction
RAR Récepteur de l’Acide Rétinoïque
RARγ Retinoic Acid Receptor gamma
12
RISP Rieske Iron-Sulfur Protein
ROS Reactive Oxygen Species
RUNX2 Run Related Transcription Fcactor 2
S6K Ribosomal Protein S6 Kinase
Sca-1 Stem Cells Antigen-1
SCF Stem Cell Factor
SDF-1α Stromal Cell-Derived Factor-1 alpha
SMD Syndromes Myélodysplasiques
SNS Système Nerveux Sympathique
SOD2 Superoxide Dismutase 2
STAT Signal Transducers and Activators of Transcription
TFAM Mitochondrial Transcription Factor 1
TGFß Transforming Growth Factor beta
TIE2 Tyrosine-Protein Kinase Receptor Tie-2
TIM-3 T-Cell Immunoglobulin Mucin Receptor 3
TKD Tyrosine Kinase Domain
TLR Toll-like Récepteurs
TNTs Tunneling Nano Tubes
TNTs1/2 TNTs de type 1/2
TPO Thrombopoïétine
UCP Uncoupling Protein
VCAM-1 Vascular Cell Adhesion Molecule-1
VE Vésicule Extracellulaire
VEGFA Vascular Endothelial Growth Factor A
VEGFR2 Vascular Endothelial Growth Factor 2
VLA 4/5 Very Late Antigen 4/5
14
16
LISTE DES FIGURES
Figure 1 : Classification des leucémies : les quatre grands types de leucémies. 30
Figure 2 : Composition cellulaire du tissu sanguin chez un sujet sain versus un
patient. ... 31
Figure 3 : Modèle de leucémogenèse à 2 évènements. ... 33
Figure 4 : Evolution clonale des cellules initiatrices leucémiques (par Raphaël
Bonnet). ... 39
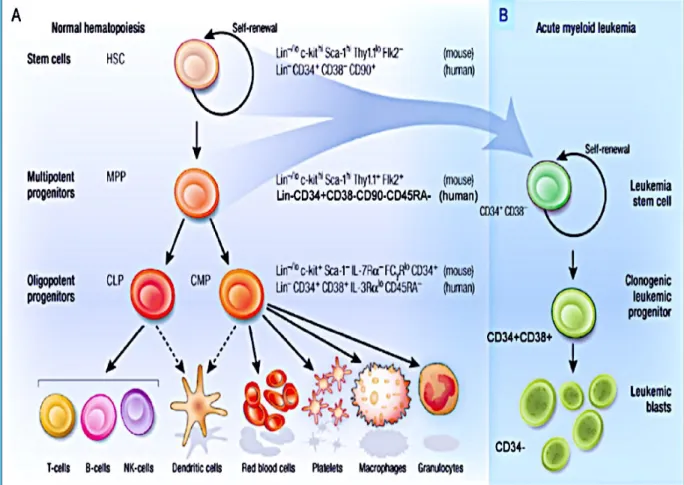
Figure 5 : Modèle d'organisation hiérarchique de l'hématopoïèse et de la LAM
chez l’Homme (selon Standford medicine). ... 40
Figure 6 : Organisation hiérarchique des cellules hématopoïétiques et des cellules
leucémiques. ... 42
Figure 7 : Représentations schématiques des niches hématopoïétiques. ... 44
Figure 8 : Les voies cellulaires impliquées dans la maintenance des CSHs (Li and
Bhatia, 2011). ... 50
Figure 9 : Interaction des composantes cellulaire de la niche hématopoïétique
avec les cellules souche hématopoïétique. ... 52
Figure 10 : Représention schématique des composantes de la niche
hématopoïétique et leurs interactions avec les CSHs (Jean-Claude Chomel).
... 53
Figure 11 : Microenvironnement altéré dans la LMC (Zhang et al., 2012). ... 58
Figure 12 : Remodelage de la niche endostéale par les cellules leucémiques
(Schepers et al., 2013). ... 59
Figure 13 : Comparaison des composantes de la niche hématopoïétique dans un
contexte physiologique et pathologique (Sánchez-Aguilera and
17
Figure 14 : Augmentation de la perméabilité vasculaire au niveau de la moelle
osseuse chez les patients LAM (Passaro et al., 2017)……….63
Figure 15 : Implication de la voie de signalisation TIM-3/NF-kB dans
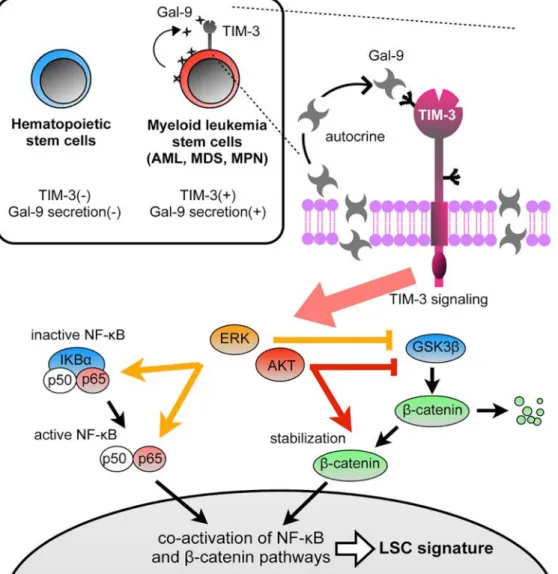
l'auto-renouvellement des CSLs (Kikushige et al., 2015). ... 71
Figure 16 : Implication de la voie JAK-STAT au niveau de la résistance
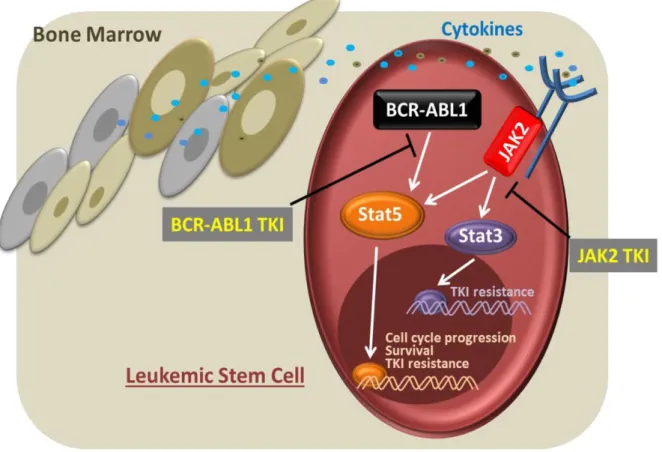
chimiothérapeutique des CSLs dans la LMC (Warsch et al., 2013). ... 74
Figure 17 : La voie de signalisation Hh. ... 75
Figure 18 : Schéma simplifié de la biosynthèse des miARN. ... 77
Figure 19 : Schéma simplifié d'une partie des transformations subies par les
nutriments dans l'organisme. ... 82
Figure 20 : Les CS favorisent la glycolyse pour produire de l’énergie (Takubo et
al., 2013). ... 83
Figure 21 : Modèle proposé par Lagadinou et al. pour le ciblage thérapeutique
des CSLs par l'inhibition de BCL-2. ... 85
Figure 22 : Représentation schématique du mécanisme de résistance de l'AraC
basé sur l’oxydation des acides gras comme source d’énergie qui se traduit
par un métabolisme OXPHOS élevé (Farge et al., 2017). ... 86
Figure 23 : Voies métaboliques contribuant à la maintenance des cellules souches
/ progénitrices hématopoïétiques et leucémiques. ... 87
Figure 24 : La voie de biosynthèse de novo de la pyrimidine. ... 88
Figure 25 : Régulation et mécanisme d'action des facteurs Hif-a (Huang et al.,
2014). ... 90
Figure 26 : La voie de signalisation PI3K / AKT / mTOR (Brenner et al., 2016).
... 97
Figure 27 : Cibles thérapeutiques dans la niche de la moelle osseuse (Zhou et al.,
2016). ... 98
Figure 28 : Représentation 3D d'une mitochondrie. ... 100
Figure 29 : Représentation schématique d'une mitochondrie (Frey and Mannella,
18
Figure 30 : Régulation de la morphologie mitochondriale et de l'efficacité
bioénergétique en réponse à la disponibilité en nutriments (Schrepfer and
Scorrano, 2016). ... 105
Figure 31 : Les effets de la fission et de la fusion mitochondriales suite aux
modifications du métabolisme et recyclage des mitochondries endommagés.
... 106
Figure 32 : Représentation schématique de la CR au niveau de la membrane
interne mitochondriale. ... 108
Figure 33 : Transfert de mitochondries des CSMs vers les cellules épithéliales
alvéolaires impliquant les connexines (Islam et al., 2012). ... 113
Figure 34 : MitoCeption. ... 116
Figure 35 : Production des ROS au niveau de la mitochondrie (Bigarella et al.,
2014). ... 118
Figure 36 : Les protéines motrices du transport de mitochondries (Schwarz TL
2013). ... 122
Figure 37 : Transport mitochondrial le long des TNTs par le complexe protéique
moteur Miro1/Rhot1 des CSMs vers les cellules épithéliales (Ahmad et al.,
2014). ... 122
Figure 38 : Image de Microscopie électronique à transmission (MET) des VEs
contenant des mitochondries détectées dans le milieu conditionné des
astrocytes. ... 124
Figure 39 : Les différents modes de transfert mitochondrial des CSMs vers les
cellules endommagées (Paliwal et al., 2018). ... 126
Figure 40 : Modèle du transfert mitochondrial proposé par Marlein et al. des
CSMs vers les cellules de LAM. ... 128
Figure 41 : Schéma récapitulatif du transfert mitochondrial dans la LAM. .... 135
Figure 42 : Le transfert mitochondrial est augmenté par un stress métabolique.
19
Figure 43 : Implication des ROS dans la stimulation du transfert mitochondrial.
... 140
20
22
LISTE DES TABLEAUX
Tableau 1
: Classification des LAM d'après l'OMS en 2018 (Vardiman et al.,
2009). ... 34
Tableau 2
: Index pronostique cytogénétique et moléculaire des LAM (Dohner
et al., 2010). ... 35
Tableau 3
: Tableau de synthèse concernant les hypothèses abordées au sujet des
signaux moléculaires du transfert mitochondrial. ... 138
24
Avant-propos
« Le cancer, une maladie aussi vieille que l’humanité… »
Les traces les plus anciennes de cancer se trouvent dans des fragments de squelette humain datant de la préhistoire, il y a 1,7 millions d’années. Plusieurs textes à caractère médical, en provenance de l’Égypte ancienne et datant de la période 1600 av. J.-C évoquent l’existence du cancer du sein qui peut être guéri par ablation chirurgicale (Sudhakar, 2009).
Le mot cancer tire son origine du mot latin homonyme qui signifie crabe. C’est Hippocrate (460-377 av J.-C.) qui est le premier à comparer le cancer du sein à un crabe, par analogie de l’aspect de la tumeur avec cet animal. La tumeur est en effet centrée sur une formation arrondie entourée de prolongements en rayons, semblables aux pattes d’un crabe.
Le cancer représente toujours un problème majeur de santé publique. Il est la seconde cause de décès dans le monde, après les maladies cardio-vasculaires. Chaque année plusieurs millions de patients sont diagnostiqués avec un cancer dans le monde entier, et la moitié d’entre eux va mourir suite aux complications causées par cette maladie.
Les dernières statistiques mondiales sur le cancer publiées en 2013 par l’Organisation
Mondiale de la Santé (OMS) montrent qu’en 2012, le fardeau mondial du cancer s'élève à 14,1
millions de nouveaux cas et à 8,2 millions de décès.
Les projections fondées sur les estimations de GLOBOCAN 2012 anticipent une augmentation substantielle de 19,3 millions de nouveaux cas de cancer par an d'ici à 2025, en raison de la croissance démographique et du vieillissement de la population mondiale. Plus de la moitié de tous les cancers (56,8%) et des décès par cancer (64,9%) en 2012 ont été enregistrés dans les régions les moins développées du monde et ces proportions augmenteront encore d’ici à 2025 (Ferlay et al., 2015).
Bien qu’on soit plus de 3000 ans après les premières preuves de l’existence du cancer et malgré des progrès considérables réalisés au fil des siècles, dans le dépistage, le traitement et la prévention du cancer, on est encore loin d’une éradication totale de cette maladie. Ceci souligne
25 la complexité des cellules cancéreuses et les multiples mécanismes qu’elles ont mis en place, pour résister aux traitements.
Que ce soit dans la littérature ou la science, le cancer est sujet à discussion et préoccupe la société. Pour paraphraser Tolstoï en 1877 dans les premières lignes d'Anna Karénine, il conclut que les cellules normales réagissent toutes de la même manière aux médicaments, mais les cellules cancéreuses répondent chacune à leur manière.
Aujourd’hui, l’objectif majeur de tous les cliniciens et chercheurs, et aussi en grande partie celui de cette thèse vise à comprendre comment les cellules cancéreuses vont résister aux traitements pour pouvoir ensuite anticiper et combattre leurs propriétés de chimiorésistance.
26
Présentation de la problématique d’une niche
dérégulée dans la LAM. Objectifs de l’étude
Chez un individu en bonne santé, la production quotidienne des cellules sanguines représente 1011 à 1012 cellules néoformées. Ce processus appelé hématopoïèse se déroule dans la moelle
osseuse et est caractérisé par une organisation pyramidale avec les cellules souches hématopoïétiques (CSHs) multipotentes au sommet de cette hiérarchie. Les CSHs sont
capables à la fois d’auto-renouvellement et de donner naissance à des cellules plus différenciées, permettant de façon régulière et constante, la production de toutes les composantes du tissu sanguin.
Ce processus est rendu possible par les contacts étroits que les cellules hématopoïétiques établissent avec le microenvironnement médullaire au sein de niches spécialisées (Schofield, 1978). Ce microenvironnement peut être divisé d’un point de vue anatomique et fonctionnelle en deux sous niche, une niche endostéale hypoxique au contact de l'os, impliquée dans la régulation de la quiescence et le guidage ou dans domiciliation (« homing ») des CSHs dans la moelle et une autre niche mésenchymateuse, péri-sinusoïdale favoriserait la prolifération et la différenciation des CSHs.
Une autre composante essentielle de la niche hématopoïétique est représentée par les Cellules
Souches/Stromales Mésenchymateuses (CSMs). Ces cellules possèdent un caractère souche
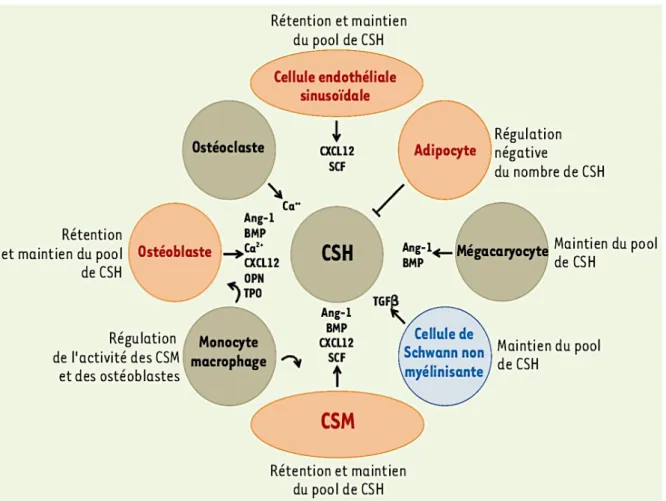
grâce à leur capacité à se différencier vers les lignées ostéoblastique, chondrocytaire et adipocytaire et à s'auto-renouveler (Sacchetti et al., 2007). Elles vont également établir un dialogue étroit avec les CSHs, manifesté par des interactions directes et indirectes. Les CSMs de la niche produisent certains facteurs-clés comme le « Stem Cell Factor » (SCF), le « Stromal Cell-Derived Factor-1-alpha » (SDF-1α/CXCL12), la Thrombopoïétine (TPO) ou l’Angiopoïétine (ANG) qui agissent sur l’auto-renouvellement, la quiescence et la survie des CSHs mais aussi expriment certaines molécules d’adhérence fondamentales comme le « Vascular Cell Adhesion Molecule-1 » (VCAM- 1/CD106) et le « Melanoma Cell Adhesion Molecule » (MCAM/CD146).
Dans certaines conditions pathologiques, l'hématopoïèse peut être perturbée et conduire à une prolifération maligne de cellules hématopoïétiques comme dans les Leucémies Aiguës
27
Myéloïdes (LAM), où la cellule maligne présente un blocage dans sa différenciation vers la
lignée myéloïde, conduisant à la formation des myéloblastes. Les blastes leucémiques partagent donc la même niche médullaire avec les cellules hématopoïétiques et des évidences scientifiques montrent que les cellules leucémiques sont capables de détourner les fonctions protectrices de la niche en favorisant leur propre survie et leur expansion clonale, au détriment de l’hématopoïèse normale.
Dans un modèle de lésion pulmonaire, les CSMs sont capables de transférer leurs propres mitochondries pour favoriser la survie et améliorer le métabolisme énergétique des cellules de l’épithélium pulmonaire qui ont été endommagées (Islam et al., 2012). Ce même phénomène a été montré également dans un contexte tumoral (Tan et al., 2015). Ces évidences scientifiques concernant l’existence d’un nouveau type de dialogue intercellulaire nous ont évoqué l’hypothèse que les cellules leucémiques pourraient être également capables de recevoir des mitochondries à partir des CSMs au niveau de la niche hématopoïétique. Nous nous sommes donc posé la question pour cette thèse si un tel transfert de cette organelle pouvait être observé entre les CSMs et les myéloblastes.
Le présent manuscrit rassemble dans un premier temps des données scientifiques concernant la physiopathologie et la chimiorésistance des LAM, la niche hématopoïétique mais également la niche leucémique avec la mise en évidence d’un nouvel échange intercellulaire entre le stroma et cellules cancéreuse : le transfert mitochondrial.
Dans la deuxième partie, les questions et les résultats de ces études seront exposés ainsi que les perspectives du projet.
28
Partie 1 : Introduction sur le rôle du
microenvironnement (ou niche) dans la
Leucémie Aiguë Myéloïde
I. Le microenvironnement médullaire
L’hématopoïèse est le processus qui permet la fabrication continue et régulée des cellules matures du sang tout au long de la vie de l’individu. Ce processus chez l'homme adulte se déroule dans la moelle osseuse et permet à partir d’une CSH de donner naissance à des
Progéniteurs Hématopoïétiques (PH), puis à des précurseurs qui donneront enfin les cellules
différenciées du sang circulant : les érythrocytes matures (globules rouges), les cellules myéloïdes (neutrophiles, éosinophiles, basophiles et monocytes), les mégacaryocytes (plaquettes), les mastocytes et les cellules lymphoïdes (B, T et NK). Ainsi, un très faible nombre de CSH, qui représentent 1/100 000 cellules de la moelle osseuse, permettra d’obtenir un très grand nombre de cellules sanguines différenciées (1011 à 1012 cellules par jour). La production des composantes du tissus sanguin se fait donc par une succession de phénomènes d’auto-renouvellement, de prolifération et de différenciation, tous très finement contrôlés au sein de structures spécialisées de la moelle osseuse, appelées « niches hématopoïétiques » (Schofield, 1978).
Les composantes cellulaires de ces niches, régulent l'hématopoïèse par l’établissement de contacts très étroits avec les cellules hématopoïétiques.
Dans des conditions pathologiques, l’hématopoïèse ou la régulation par le microenvironnement médullaire peut être perturbée et conduire à une prolifération maligne comme dans le cas de la LAM. Dans ce cas, la niche hématopoïétique est détournée au profit des cellules leucémiques et peut être responsable indirectement des nombreuses rechutes de LAM en protégeant les cellules leucémiques des thérapies anti-tumorales.
De données expérimentales mettent en évidence que le microenvironnement peut être un acteur-clef dans le développement d’hémopathies malignes (Ramakrishnan and Deeg, 2009).
Pour comprendre l’implication du microenvironnement dans la chimiorésistance de la LAM je vais présenter dans un premier temps les aspects physiopathologiques des LAM puis dans un
29 deuxième temps, apporter des données de la littérature sur le concept de niche leucémique et sa dérégulation dans la LAM.
I.1Généralités physiopathologiques des leucémies
I.1.1 Curiosités
Le terme « leucémie » a été inventé par Rudolf Virchow, un pathologiste allemand, en 1856, premier médecin à décrire l'excès anormal de globules blancs chez des patients, grâce à l'utilisation du photomicroscope.
Comme Virchow n’était pas encore capable d’expliquer les causes de l'excès de globules blancs, il a utilisé le terme purement descriptif « leucémie » qui vient du grec « sang blanc ». Grâce à l’avancée rapide de la technologie, c’est par la suite le médecin et scientifique allemand Wilhelm Ebstein, qui introduisit le terme « leucémie aiguë » en 1889 pour différencier les leucémies violentes et mortelles des leucémies myéloïdes chroniques plus « nonchalantes ».
Le terme « myéloïde » a été inventé par Neumann en 1869, car il a été le premier à identifier que les globules blancs tirent leur origine de la moelle osseuse (grec :« myelos » = moelle (d'os)).
Ce n’est qu’en 1900 que le myéloblaste, qui est la cellule maligne dans la LAM, a été caractérisé par l’hématologue Otto Naegeli, qui a séparé les leucémies en « myéloïde » et « lymphocytique ».
En 2008, le premier génome de cancer à être séquencé intégralement a été celui de la LAM. La comparaison avec l’ADN(Acide désoxyribonucléique) de cellules saines de peau a permis la mise en évidence de mutations de plusieurs gènes, impliqués dans la maladie comme
FLT3 (Fms-like tyrosine kinase 3 ) ou NMP1 (Nucleophosmin 1) déjà connu et associé au
mauvais pronostic, mais également d’autres fortement associés avec la physiopathologie du cancer : PTPRT (Receptor-type tyrosine-protein phosphatase T ou CDH24 (Cadherin 24)).
I.1.2 Généralités
Les leucémies sont caractérisées par une expansion clonale dans la moelle osseuse de
30 On va distinguer 4 types de leucémies classées en fonction de leur vitesse d'évolution
chronique ou aiguë, et en fonction de la lignée hématologique qui est affectée : lymphoïde ou
myéloïde(Fig.1).
Les leucémies surviennent aussi bien chez les enfants que chez les adultes, mais leur type est fortement dépendant de l’âge. Ainsi, les 2800 cas de LAM diagnostiqués en France en 2012 concernaient principalement des adultes, alors que les leucémies aiguës lymphoblastiques (LAL) se développent surtout chez les enfants. Avec près de 4500 personnes touchées en 2012, la leucémie lymphoïde chronique (LLC) qui touche principalement des adultes est la plus fréquente des leucémies. La leucémie myéloïde chronique (LMC) est la plus rare et concerne essentiellement les adultes avec une incidence égale à 1-2 nouveaux cas par 100 000 individus par an (Globocan, 2012).
Les symptômes cliniques sont provoqués par un abaissement de la quantité de certaines cellules dans le sang en raison de la prolifération excessive des cellules leucémiques. Dans ce contexte, une diminution du nombre de globules rouges peut entraîner une anémie, ce qui se traduit par une pâleur excessive et un essoufflement. Si le déficit concerne les plaquettes cela entraînera des saignements sévères et lorsqu’il s’agit d’une réduction du nombre des globules blancs, il y
31 aura augmentation du risque d’infection. Quel que soit le cas, une consultation médicale va conduire à réaliser une analyse sanguine, appelé l’hémogramme qui permettra de suspecter l’existence d’une leucémie si le patient présente une quantité anormalement élevée de globules blancs, (on parle d’une hyperleucocytose), un manque de globules rouges (anémie) et une diminution des plaquettes (thrombopénie). Si le nombre et/ou l’aspect des cellules sanguines est anormal, une analyse de la composition de la moelle osseuse – un myélogramme - permettra d’établir le diagnostic en déterminant le type de leucémie (myéloïde ou lymphoïde).
I.1.3. Les syndromes myélodysplasiques, des états
pré-leucémiques
Les syndromes myélodysplasiques (SMD) forment un groupe de maladies hétérogènes
caractérisées par la production insuffisante de cellules sanguines dans la moelle osseuse.
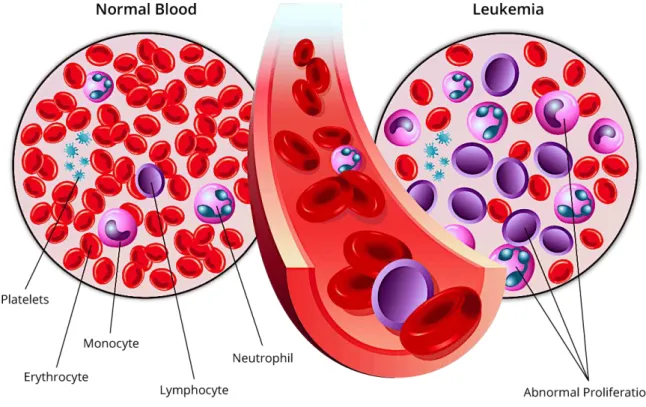
Figure 2 : Composition cellulaire du tissu sanguin chez un sujet sain versus un patient.
Composition cellulaire du tissu sanguin dans un cas non pathologique : plaquettes, érythrocytes, monocytes, lymphocytes et neutrophiles sont présents dans des proportions bien définies. Dans un contexte leucémique il y a réduction des composantes cellulaires du sang et prolifération excessive des blastes leucémiques.
32 L’accumulation des progéniteurs hématopoïétiques immatures conduit à une hématopoïèse inefficace ainsi qu’à une ou plusieurs cytopénies périphériques. Ces cytopénies concernent différents types cellulaires : l’anémie pour une diminution des hématies, la leucopénie pour une diminution des leucocytes et la trombocytopénie pour une diminution des plaquettes.
Ces affections clonales de la cellule souche hématopoïétique sont majoritairement des maladies du sujets âgé avec une médiane d’apparition de 67 ans au diagnostic. Elles touchent 20/100 000 personnes de 70 ans et cette incidence augmente avec l’âge. L’accumulation de mutations génétiques conduit 30% des SMDs à évoluer vers une LAM de mauvais pronostic.
L’évaluation du risque évolutif des SMD et du risque de transformation maligne ainsi que la définition des facteurs prédictifs de la survie globale sont essentiels pour permettre d’adapter aux mieux les stratégies thérapeutiques. Pour cela, on utilise le score pronostique international (« International Pronostic Scoring System », IPSS) qui permet la distinction de quatre sous-groupes pronostique. Les SMDs sont classés en fonction de leur gravité : très faible, faible, intermédiaire, élevée et très élevée.
Ce classement est établi selon 3 critères d’après le score pronostic international révisé (IPSS-R) : le pourcentage de blastes médullaires, le nombre de cytopénies (diminution progressive d’une ou plusieurs lignées cellulaires sanguines) et le caryotype médullaire (anomalies cytogéniques). Ce score permet d’évaluer le risque d’évolution vers une LAM et de donner une approximation de la médiane de survie des patients atteints de SMD (Della Porta et al., 2014). Il existe un continuum d’états pathologiques entre les SMD et les LAM, ce qui fait considérer les SMD comme des états pré-leucémiques.
I.1.4 Les leucémies aiguës myéloïdes : physiopathologie, aspects
cliniques et pronostiques
La leucémie aiguë myéloïde correspond à l’expansion clonale des précurseurs myéloïdes
présentant un contrôle défectueux de leur prolifération, de leur différenciation et de leur maturation. Cette prolifération incontrôlée des myéloblastes provoque un envahissement de la moelle osseuse qui est la cause d’une insuffisance médullaire se traduisant par des cytopénies (anémies, neutropénies et thrombopénies). Les cellules leucémiques peuvent disséminer par voie sanguine et s’infiltrer dans des organes comme la rate, le foie ou encore la peau et le système nerveux central.
33 La LAM représente près de 80% des leucémies aiguës chez l'adulte et 20% de celles de l’enfant. Ce sont des pathologies rares, représentant environ 0,6% des cancers dans les pays occidentaux. Elles sont responsables de 1,5% des décès d’origine tumorale. C’est une maladie qui peut survenir à tout âge, mais seulement 25 % des cas sont diagnostiqués avant 25 ans. L’âge médian de découverte de la maladie se situe autour de 65 ans. La fréquence de la maladie augmente avec l’âge, son incidence chez les patients de moins de 65 ans de 1,7/100 000 alors qu’après 65 ans la fréquence de la LAM est de 16,2/100 000. L’incidence annuel en France est estimée à 3 à 4 cas pour 100 000 (infoCancer 2015). Aux Etats-Unis en 2016, 19.950 nouveaux cas de LAM ont été diagnostiqués, au moins 40.300 patients vivaient avec cette maladie et environ 10.430 sont morts des suites d’une LAM ; le taux de survie à 5 ans est de 26% (LLS Cancer Facts & Figures, 2016).
De nombreuses études ont permis de mettre en avant le caractère multifactoriel du processus leucémique des LAM. L’analyse du caryotype des patients a révélé la présence de nombreuses anomalies chromosomiques qui impliquaient des oncogènes et des gènes suppresseurs de tumeur (Warner et al., 2005).
Le développement leucémique peut se mettre en place à la suite d’une succession de mutations. Dans un premier temps on peut avoir de mutations dites de classe I qui correspondent à des mutations activatrices des gènes FLT3, KIT et de RAS (Fig.3). Elles permettent la transduction de signaux de prolifération cellulaire. La deuxième catégorie de mutations peut englober des
34 translocations comme t(15; 17), t(8;21) et t(9;11) qui sont à l'origine de protéines de fusion (PML-RARα, AML1-ETO, MLL-AF9) qui bloquent la différenciation des cellules leucémiques (Gilliland and Griffin, 2002; Sambani et al., 2004; Tonks et al., 2004; Voetsch et al., 2007).
Tableau 1 : Classification des LAM d'après l'OMS en 2018 (Vardiman et al., 2009).
Ainsi les LAM, qui représentent un ensemble d’hémopathies très hétérogènes, peuvent être classées selon différents critères. Une première classification, la classification French- American-British (FAB) a été proposée en 1976, en s’appuyant sur des caractères morphologiques dépendants de la maturation du clone leucémique. A chaque groupe FAB correspond un degré de différenciation : LAM0 : immature, LAM1 : myéloblastique sans
Acute myeloid leukemia and related neoplasms
Acute myeloid leukemia with recurrent genetic abnormalities
AML with t(8;21)(q22;q22); RUNX1-RUNX1T1
AML with inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11 APL with t(15;17)(q22;q12); PML-RARA
AML with t(9;11)(p22;q23); MLLT3-MLL AML with t(6;9)(p23;q34); DEK-NUP214
AML with inv(3)(q21q26.2) or t(3;3)(q21;q26.2); RPN1-EVI1 AML (megakaryoblastic) with t(1;22)(p13;q13); RBM15-MKL1 Provisional entity: AML with mutated NPM1
Provisional entity: AML with mutated CEBPA
Acute myeloid leukemia with myelodysplasia-related changes Therapy-related myeloid neoplasms
Acute myeloid leukemia, not otherwise specified
AML with minimal differentiation AML without maturation AML with maturation
Acute myelomonocytic leukemia
Acute monoblastic/monocytic leukemia Acute erythroid leukemia Pure erythroid leukemia
Erythroleukemia, erythroid/myeloid Acute megakaryoblastic leukemia
Acute basophilic leukemia
Acute panmyelosis with myelofibrosis
Myeloid sarcoma
Myeloid proliferations related to Down syndrome
Transient abnormal myelopoiesis
Myeloid leukemia associated with Down syndrome
35 différenciation, LAM2 : myéloblastique avec différenciation, LAM3 : promyélocytaire, LAM4 : myélomonocytaire, LAM5 : monocytaire, LAM6 : érythroblastique et LAM7 : mégacaryoblastique (Bennett et al., 1976; Vardiman et al., 2009).
Plus récemment une nouvelle classification, reconnue par l’OMS, a intégré en plus du critère morphologique des blastes, leurs caractéristiques immunophénotypiques, cytogénétiques et moléculaires. Le diagnostic de la LAM est soumis à la présence d’une blastose médullaire ou sanguine supérieure à 20%. Cette classification comprend également le degré de dysplasie dans les différentes lignées. Elle a ainsi permis de distinguer sept groupes dont quatre groupes principaux : les LAMs avec anomalies cytogénétiques récurrentes, les LAM avec anomalies associées aux myélodysplasies, les LAM thérapies induites et les LAM sans spécifications particulières.
Tableau 2 : Index pronostique cytogénétique et moléculaire des LAM (Dohner et al., 2010).
Groupe
pronostique Anomalie cytogénétique ou moléculaire
Favorable
t(8;21)(q22;q22); RUNX1-RUNX1T1
inv(16)(p13;1q22) ou t(16;16)(p13.1;q22) ; CBFB-MYH11
Intermédiaire I
NMP1 muté et FLT3-ITD(caryotype normal) NMP1 non muté et FLT3-ITD(caryotype normal) NMP1 non muté et sans FLT3-ITD(caryotype normal)
Intermédiaire II
t(9 ;11)(p222 ;q23) ;MLLT3-MLL
Anomalies cytogénétiques non considérées comme favorable ou défavorable
Défavorable
inv(3)(q21 ;26.2) ou t(3 ;3)(q21 ;q26.2) ; RPN1-EVI1 t(6 ;9)(p23 ;q34) ;MLL réarrangé
monosomie 5 ou del(5q) ;monosomie 7 ; anomalie(17p) ; caryotype complexe*
*Caryotype complexe défini par la présence de 3 anomalies chromosomiques ou plus en l’absence d’une anomalies récurrentes suivantes : t(15 ;17), t( 8,21), inv(16) ou t(16 ;16), t(9 ;11), t(v ;11)(v ;q23), t(6 ;9), inv(3) ou t(3 ; 3).
FLT-ITD : duplication interne en tandem de FLT3
Différents facteurs pronostiques liés à la maladie peuvent influer sur le devenir du patient : la détection d’une hyperleucocytose au diagnostic, des antécédents de myélodysplasies ou d’anomalies cytogénétiques et moléculaires. Les anomalies du caryotype représentent la plus
36 forte valeur pronostique des LAMs concernant la réponse au traitement et la survie du patient. Ainsi elles permettent une autre classification des LAM en fonction de leur impact positif ou négatif sur l’évolution de la maladie (Tableau 2).
Les causes exactes de la perturbation hématopoïétique ne sont pas encore clairement établies. Les facteurs extrinsèques connus comme déclencheurs de la maladie sont l’exposition à des radiations ionisantes ou à une chimiothérapie par inhibiteurs de topoisomérase II ou d’agent alkylants.
La chimiothérapie est la modalité de traitement la plus courante et dans certains cas, qui cible les cellules en cycle dont les cellules leucémiques. Malgré les traitements existants, la LAM est la leucémie pour laquelle le taux de survie à 5 ans est le plus faible : 26% aux Etats-Unis et 19% en Europe.
I.1.5 Le traitement standard des patients LAM
Le traitement vise à obtenir la disparition des blastes leucémiques, permettant ainsi à la moelle osseuse normale de reconstituer les populations de cellules du sang (globules blancs et rouges, plaquettes). Il est adapté en fonction de l’âge ou de la présence d’anomalies cytogénétiques défavorables chez le patient. Il est généralement administré en deux phases, une première phase
d’induction suivie par une phase de consolidation.
En 2018, la thérapie d'induction pour les patients LAM qui ont moins de 60 ans, a peu évolué
par rapport à celle des années 70 (Yates et al., 1973). Le traitement le plus couramment utilisé dans la LAM est communément appelé régime thérapeutique « 7 + 3 ». Il comporte une combinaison de cytarabine (AraC, un analogue nucléosidique) associée à des anthracyclines : daunorubicine ou idarubicine (Guzman et al., 2001).
Les patients éligibles à la chimiothérapie intensive subissent généralement ce traitement qui comprend une perfusion continue de AraC (100-200 mg / m2) pendant 7 jours consécutifs et de daunorubicine (60 mg / m2) ou d'idarubicine (12 mg / m2) les trois premiers jours.
Après l'induction, une rémission complète est obtenue chez 60 à 80% des patients LAM de moins de 60 ans, contre environ 45 à 65% chez les patients plus âgés (Dohner et al., 2010; Döhner et al., 2015).
37 Cette induction est ensuite suivie d'une thérapie de consolidation qui se fait au cours de la phase post-rémission. Cette thérapie comprend deux à quatre cycles d’AraC à haute dose (2000-3000 mg / m2/jour) administrée aux jours 1, 3 et 5 et qui peut être suivie d'une greffe de cellules souches hématopoïétiques en fonction de l'âge, du sous-type de LAM et de la disponibilité des donneurs (Briot et al., 2018).
Alors que de nombreux patients atteignent une rémission complète avec un traitement d'induction standard, environ 20-40% des patients ne répondent pas au traitement d'induction (Burnett et al., 2011; Thol et al., 2015). Ces patients sont classés comme ayant une maladie
résiduelle ou en échec thérapeutique.
Malheureusement, leur prise en charge est extrêmement difficile, car même avec une deuxième cure identique et l’utilisation d’AraC à fortes doses, suivie d'une greffe de cellules souches allogéniques, les résultats restent médiocres (Thol et al., 2015).
D’autres patients peuvent être déclarés inaptes à un tel traitement intensif et toxique. Ils sont pris en charge avec des agents hypo-méthylants et / ou avec des soins de soutien / palliatifs.
La résistance à la chimiothérapie d'induction et la rechute après l'obtention de la rémission sont les principaux obstacles à la guérison de la LAM. Après une chimiothérapie d'induction standard, les patients sont assignés à différentes stratégies post-rémission sur la base d'anomalies cytogénétiques et moléculaires qui définissent globalement les catégories de risque défavorable, intermédiaire ou favorable.
En plus des anomalies cytogéniques, cette classification va également prendre en compte des facteurs de risque tels que l’âge, le nombre de globules blanc présents au diagnostic (mauvais pronostic si hyperleucocytose majeure >100 000/mm3) ou les mutations génétiques.
Mais cette classification ne représente pas une règle absolue car certains patients ne répondent pas au traitement d'induction et d’autres finissent par rechuter malgré l'absence de facteurs de risque défavorables. Il y a donc un besoin urgent d’identifier des biomarqueurs qui permettront de prédire la réponse au traitement, pour éviter d’une part un sur-traitement des patients de bas risque et d’autre part intensifier les traitements des patients de haut risque. Il apparaît important également d'aller vers le développement de thérapies plus personnalisées.
38 Dans presque la moitié des cas de LAM, on constate des rechutes post-thérapeutiques. Ces dernières apparaissent généralement dans les trois ans qui suivent le diagnostic. Elles répondent mal aux traitements et sont de mauvais pronostic (Dohner et al., 2010). Je décrirai un peu plus loin les mécanismes connus de résistance à la chimiothérapie. Le taux élevé de rechute dans la LAM a été aussi attribué à la persistance de cellules souches leucémiques (CSLs), également appelées cellules initiatrices de leucémies (CIL), résistantes à la chimiothérapie et qui pourraient être réactivées ultérieurement pour reconstituer la masse tumorale (Ishikawa et al., 2007; Kreso and Dick, 2014; Saito et al., 2010).
Dans le chapitre suivant je développerai l’importance des CSLs dans la LAM et leur implication dans les mécanismes de chimiorésistance.
I.1.6 Le concept de cellules souches leucémiques dans la LAM :
une aiguille dans une botte de foin.
Longtemps, les chercheurs se sont accordés sur le modèle unique de l’évolution clonale pour expliquer le développement tumoral. Selon cette théorie, différents clones d'une tumeur donnent naissance à des cellules filles qui acquièrent des mutations au fur et à mesure de leur multiplication.
Il s’ensuit une sélection progressive du clone le plus agressif et le plus apte à survivre dans l’environnement tumoral. Les tumeurs évolueraient donc selon le même modèle que celui proposé par Charles Darwin pour expliquer l’évolution des espèces. Dans ce modèle « classique », il n’existe pas de hiérarchie entre les différents clones et toutes les cellules peuvent contribuer de manière équivalente à la croissance de la tumeur (Fig. 4).
Le concept de cellules souches cancéreuses dit tout autre chose : il postule l’existence d’une hiérarchie au sein de la tumeur. Trouvées au sommet de la pyramide, les cellules
souches cancéreuses (CSC) également appelé cellules initiatrices de cancers (CIC)
seraient les seuls moteurs de la prolifération tumorale. Esquissé depuis plusieurs décennies, le modèle a longtemps manqué d’éléments de preuve.
C’est pour la première fois en 1994 que l’existence de CSLs a été faite dans la LAM par John Dick et ses collègues qui ont démontré que, comme l'hématopoïèse normale, la LAM est organisée de façon hiérarchique, soutenue à long terme par les CSLs (Lapidot et al., 1994)
39 Ces travaux ont montré que seule une sous-population de cellules leucémiques isolées d'un patient, était susceptible de reproduire la leucémie originelle chez une souris hôte NOD/SCID (Nonobese diabetic/severe combined immunodeficiency) immunodéficiente. Plusieurs sous-types de LAM ont été analysés et indépendamment de leur hétérogénéité, des caractéristiques de maturation des blastes leucémiques, cette sous-population se caractérise par un marquage immuno-phenotypique CD34+/CD38-, similaire au phénotype de surface des CSHs, suggérant que ces dernières, plutôt que des cellules progénitrices engagées, sont la cible de la transformation leucémique (Bonnet and Dick, 1997).
Suite à leur découverte, des CSCs ont été identifiées puis isolées dans de nombreuses tumeurs « solides » telles que le cancer du sein (Al-Hajj et al., 2003), le glioblastome (Singh et al., 2004), l’adénocarcinome du côlon (Hubbard et al., 2009), le cancer du pancréas (Li et al., 2009), le cancer du poumon, le cancer de la prostate…
L’analyse épistémologique du concept de CSC révèle que certains chercheurs ont, d’emblée, fait preuve de leur scepticisme dans le caractère définitif de cette démonstration en mettant en avant, entre autres, le rôle de l’environnement : la transplantation dans des souris immunodéficientes ne récapitule pas l’environnement des cellules dans leur tumeur d’origine Ces cellules capable de reconstituer la masse tumorale in vivo, peuvent simplement être des cellules capables de produire leurs propres facteurs de croissance ou des cellules capables