DEPARTEMENT DES SCIENCES AGRONOMIQUES
Réf : ……./UAMOB/F.SNV.ST/DEP.AGR/2018
MEMOIRE DE FIN D’ETUDES
EN VUE DE L’OBTENTION DU DIPLOME MASTER
Domaine : SNV Filière : Sciences Agronomiques
Spécialité : Protection des végétaux
Présenté par :
LATEF Amina
Thème
Contribution à l’étude de deux maladies de l’olivier
rencontrées dans la région de M’chaddellah-Bouira : cas
de dépérissement et de la tuberculose de l’olivier
Soutenu le : 30 / 06 /2018
Devant le jury composé de :
Nom et Prénom Grade
Melle RAHMOUNI Amina MAA Univ. de Bouira Président
Melle MEBDOUA Samira MCB Univ. de Bouira Promoteur
Melle TAFIFET Lamia MAA Univ. de Bouira Examinateur
Le grand Merci je le réserve à DIEU le tout puissant pour le
courage et la volonté qu'il m’a accordé pour mener à bien mon
travail.
Ce mémoire n'aurait pu être réalisé sans l'appui et l'impulsion,
donnés par :
M
elleMEBDOUA Samira Maître de conférences à
l’Université de Bouira, qui a bien voulu assurer mon
encadrement, qu’elle puisse ici trouver toute l’amabilité et la
reconnaissance qu’elle mérite.
Sa bienveillance et son soutien
permanents afin d'aboutir à ce travail a été d’un apport
considérable. Je lui dois une immense reconnaissance et un très
grand respect.
Ainsi je remercie M
elleRAHMOUNI Amina, qu'a bien voulu
présider ce jury.
M
elleTAFIFET Lamia qui a accepté d'examiner ce travail.
Mes profonds remerciements sont adressé Mme HEDIOUCHE
Houria responsable de laboratoire pour son soutient et ses
services.
Enfin, je remercie tous ceux qui ont contribué de prés ou de
loin à la réalisation de ce mémoire.
Dédicace
A mes chers parents MOULOUD et NOURA vous qui avez fait
de moi ce que je suis. Eternelles
adorables parents.
A mes chers beaux parents FADILA et MAKHLOUF
n’avez jamais cessé de m’encourager et de m’aider
accomplir ce travail.
A Mes adorables sœurs et frères.
A mes chers nièces et neveux
A ma jolie petite sœur R
A mes amies avec lesquelles
inoubliables, un profond merci pour leur soutient.
A mon amie Lynda et toute sa famille.
A la flamme de mon av
temps.
Je dédie ce travail a mon mari qui a accompagné ma carrière et
qui a su faire de l’amour de mes études une passion et de cette
passion un art. Un grand me
Dédicace
mes chers parents MOULOUD et NOURA vous qui avez fait
de moi ce que je suis. Eternelles reconnaissance à vous mes
mes chers beaux parents FADILA et MAKHLOUF, vous qui
n’avez jamais cessé de m’encourager et de m’aider pour
accomplir ce travail. Un grand merci pour vous.
A Mes adorables sœurs et frères.
nièces et neveux
sœur Razane.
mes amies avec lesquelles J’ai passé des moments
inoubliables, un profond merci pour leur soutient.
ynda et toute sa famille.
A la flamme de mon avenir ma fille qui est avec moi à
Je dédie ce travail a mon mari qui a accompagné ma carrière et
qui a su faire de l’amour de mes études une passion et de cette
grand merci Fouad.
mes chers parents MOULOUD et NOURA vous qui avez fait
reconnaissance à vous mes
, vous qui
pour
J’ai passé des moments
enir ma fille qui est avec moi à tout les
Je dédie ce travail a mon mari qui a accompagné ma carrière et
qui a su faire de l’amour de mes études une passion et de cette
Figure n°01 : Images représentantes l’olivier………..03
Figure n°02 : Différentes parties d’un arbre d’olive………....05
Figure n°03 : Différents stades phénologiques de l’olivier……….10
Figure n°04 : Superficie en oliviers par classes de densité dans l'UE en 2012………...11
Figure n°05 : Répartition de l’olivier dans le monde………...12
Figure n°06 : Des tumeurs formées sur les rameaux………15
Figure n°07 : Tumeurs formées sur le tronc………...17
Figure n°08 : Cycle de développement de la verticilliose de l’olivier……….20
Figure n°09 : Symptômes de la verticilliose sur l’olivier……….22
Figure n°10 : Carte géographique de la wilaya de Bouira………...24
Figure n°11 : Les étapes d isolement des champignons………...27
Figure n°12 : Lavage et macération des fragments végétaux………..27
Figure n°13 : Ensemencement sur le milieu nutritif………28
Figure n°14 : Etapes suivies pour la préparation des lames à observer……...30
Figure n°15 : Les différentes étapes de l’oxydation……….31
Figure n°16 : Test péctinase………...32
Figure n°17 : Préparation de test arginine………....33
Figure n°18 : Symptômes de la verticilliose……….34
Figure n°19 : Symptômes de la tuberculose de l’olivier………...40
Figure n°20 : Résultat de purification des colonies bactériennes sur les trois milieux (King B , Levane, LPGA)………...43
Figure n°21 : résultats de test oxydase………...45
Figure n°22 : Résultat de test péctinase(Test négatif)…...45
Figure n°23 : Résultat de test péctinase(Test positif)………...45
Figure n°24 : Résultat de test catalase………..46
Figure n°25 : Résultat de test Gram……….46
Tableau 01
Tableau représentatif aux différentes images de parties aériennes de l’olivier03
Tableau02
Principales variétés d’olivier cultivées dans les pays méditerranéens (C.O.I,2006).
06
Tableau 03
Caractérisation macroscopiques des isolats fongiques35
Tableau 04
Caractérisation microscopique des isolats fongiques37
Tableau 05
Description des colonies bactériennes obtenues sur différents milieux41
Tableau 06
Résultats des tests biochimiques44
DSA : Direction des Services Agricoles. g : gramme. ml : millilitre. ha : hectare. n°: numéro. % : pourcentage. μm: Micromètre.
q/ha : Quintaux par Hectare. C°: degré Celsius. mn : minute. cm : centimètre. t: tonne. h : heure. m : mètre. UE : union européenne PDA : Potato Dextrose Agar PCR :Polymérase Chain Reaction Qtx : Quintaux
Liste des figures Liste des tableaux Liste des abréviations
Introduction………..01
Synthèse bibliographique
I. Présentation de la plante hôte I.1. Description de la plante………...03I.2. Classification de la plante………...05
I.3. Variétés (à huile et à olive)…..……….06
I.4. Cycle biologique……….………07
I.5. Exigences climatiques………10
I.6. Importance économique à l’échelle mondiale………...11
I.7. Importance économique à l’échelle nationale………..…….12
I.8. Importance économique dans la wilaya de Bouira………....12
II. Présentation des bios agresseurs II.1. Tuberculose de l’olivier : Pseudomonas savastanoi pv. savastanoi………..14
II-1-1 Généralités………....14
II-1-2 Classification de Pseudomonas savastanoi ……….15
II-1-3 Cycle biologique………...15
II-1-4 Symptômes………....16
II-1-5 Méthodes de lutte………..17
II.2Cas de dépérissement II-2.1Verticilliose : Verticillium dahliae kleb …….………..18
II-2-1.1Généralités……….18
II-2-1.2 Classification de Verticillium dahliae kleb ………..18
II-2.1-4 Symptômes………21
II-2-1-5 Méthodes de lutte………...…..22
Matériel et méthode
I. Présentation de la région d’étude I.1.Situation géographique de la région d’étude : wilaya de Bouira…...24I.2.Caractéristiques climatiques………...24
I-3 Présentation de site d’étude………...25
II. Prospections sur terrains et prélèvement des échantillons…………...25
III. Traitement des échantillons au laboratoire………..…...25
III-1 Cas des échantillons présentant les symptômes de la verticilliose III-1-1 isolement……….25
III-2 Cas des échantillons présentant des symptômes de la tuberculose… III-2-1 Isolement ………...27
III-2-2 Purification des isolats bactériens………..28
IV- Identification des isolats obtenus IV-1- Identification microscopique et macroscopique des isolats fongiques IV-1-1- Analyse macroscopique………...28
IV-1-2-Analyse microscopique………...29
IV-2 identification macroscopique et biochimique des isolats bactériens IV-2-1 Caractérisation macroscopique……….30
IV-2-2 Tests biochimiques………...30
Résultats et discussions
I. Résultats des échantillons présentant les symptômes de la verticilliose I.1. Observation des symptômes sur le terrain………34I.2. Observations macroscopiques et microscopiques des isolats fongiques………35
I.2.1. Caractérisation macroscopique des isolats fongiques………...35
II. Etude des échantillons présentant les symptômes de la tuberculose
II.1. Observation des symptômes sur le terrain……….40
II.2. Résultats du diagnostic au laboratoire………....40
II.3. Caractérisation biochimiques des isolats bactériens………...…44
II.3.1 .Test oxydase………44
II.3.2. Test péctinase………...………45
II.3.3. Test catalase……….45
II.3.4. Test de Gram………....46
II.3.5. Test arginine……….47
Conclusion et perspectives
………...48Références bibliographique
Annexe
Résumé Abstract
Introduction
Depuis des temps immémoriaux l’olivier constitue, pour les pays méditerranéens, un lien fort entre les individus, par ses vertus nutritionnelles et thérapeutiques et par les importants échanges commerciaux qui ont été générés par l’exploitation de ses fruits. Il demeure encore aujourd’hui porteur d’une telle charge emblématique et d’une telle importance pour certaines économies du bassin méditerranéen que nous devions, nous autres universitaires et économistes, lui consacrer un hommage (Benhayoun et Lazzeri,2007).
Il véhicule de nombreux symboles : paix, fécondité, purification, force, victoire et récompense .Cet arbre parait avoir été un des premiers arbres cultivés par l’homme habitant par ailleurs au milieu de champs d’oliviers.
Au niveau de la santé, il peut être d’une aide précieuse dans de nombreux cas. Il peut agir en synergie de manière très efficace avec d’autres plantes,
Olea europea L, est un arbre ancestral profondément encré dans les civilisations
méditerranéennes et arabo-musulmanes. De nos jours, la place de l’oléiculture sur l’échiquier agricole méditerranéen ne cesse de raffermir et le rayonnement de ses produits sur le marché mondial des denrées alimentaires ne fait que s’élargir (Mataix et Barbanchon, 2006).
L’importance de cette espèce revient à ses caractéristiques précieuses, dont cet arbre peut pousser et donner de bons rendements sur des terrains variés. Des vergers d’olivier peuvent être productifs dans des sols squelettiques, et présentant une dalle, ainsi que dans des sols présentant des teneurs élevés en sels et en bore, et qui ne sont pas productifs s’ils sont plantés à d’autres cultures.
Et comme tous autres champs, le champ d’olivier peut être attaqué par divers bioagresseurs qui sont nocifs pour cette culture en influençant sur la productivité en qualité et en quantité et ainsi que le développement de l’arbre. Ces bioagresseurs peuvent être de diverses origines, ils peuvent être des arthropodes, des champignons, des bactéries…etc.
Parmi les maladies bactériennes et fongiques de l’olivier, la tuberculose causée par
Pseudomonas savastanoi et la verticiclliose causée par Verticillium dahliae sont les
plus rencontrées en Algérie, elles engendrent des pertes économiques considérables. L’objectif de ce travail est de :
- Faire un échantillonnage à partir des oliviers présentant des symptômes de ses deux maladies.
- Faire une identification présomptive de l’agent pathogène et autres bactéries vivant en communautés à l’intérieur des tumeurs dans le cas de la tuberculose de l’olivier, en s’appuyant sur des tests phénotypiques et tests biochimiques.
- Faire une identification des champignons isolés sur l’olivier présentant des symptômes de la verticilliose en s’appuyant sur des caractères macroscopiques et microscopiques.
Ce document comporte de :
Une synthèse bibliographique qui contient une description de la plante hôte (l’olivier) et quelques maladies auxquelles elle est exposée.
Partie matériel et méthodes dont on a réalisé des échantillonnages dans les deux vergers, et isolement au laboratoire.
Partie résultats et discussions dont on a mentionné les résultats obtenus en les comparant aux résultats des autres chercheurs.
I Présentation de la plante hôte
I.1. Description de la plante hôte :
L'olivier est un arbre de 3 à 10 mètres de haut à des branches tortueuses au nombreux rameaux arrondis enchevêtrés les uns dans les autres, les tiges portent des feuilles opposées, entières, ovales allongées, portées par un court pétiole, persistantes, enroulées sur les bords, fleurit entre Mai et Juillet. Donnant des fruits drupes ovoïdes à noyau dur dont le mésocarpe peut renfermer plus de 30 % de lipides. Ils sont utilisés par l’industrie agroalimentaire. (Pangol, 1975).
Cet arbre est cultivé essentiellement pour son fruit, consommé ou confi ou sous forme d’huile, mais cet arbre est aussi médicinal par ses feuilles. S’adapte bien à des conditions d’environnement extrêmes telles que la sécheresse et la chaleur. Bien qu’il exige un sol léger et aéré pour un bon développement, l’olivier tolère un large éventail de types de sols différents et résiste à des faibles températures (Kasraoui, 2016).
L’olivier peut vivre jusqu'à 1000 ans et, si à cet âge canonique on le coupe, il produira immédiatement un rejet qui vivra lui aussi des centaines d'années.
Figure n°01 : images représentantes l’olivier (Artaud, 2008)
Partie aérienne :
Tableau n°01 : tableau représentatif aux différentes images de parties aériennes de
l’olivier
Le tableau ci-dessous représente les différentes parties de l’olivier accompagné par leurs images.
Partie Image Tronc Feuilles Fleurs jeunes Fleurs Fruits naissants Fruits verts Fruits mûrissants. Fruits mûrs.
Système racinaire :
L'olivier présente un système racinaire puissant, il assure sa vitalité, adapte la plante à la profondeur et aux caractéristiques physiques et chimiques du sol.
Selon Civantos (1998), dans les sols à texture franche ; le développement en profondeur peut se situer entre 15 à 150 cm avec une concentration importante située aux environ de 80 cm. A noter que dans les sols sablonneux, les racines se développent jusqu'à 6m de profondeur.
Pendant son développement en profondeur, le système racinaire est pivotant s'il est issu de plants de semis et fasciculé s'il est obtenu par bouturage.
Figure n°02 : Différentes parties d’un arbre d’olive (Heimstra et Harris, 1998)
I.2 /Classification de l’olivier :
Selon la systématique moléculaire de Maillard, 1975, la classification botanique de l’olivier est la suivante :
*Règne : Planta
*Sous règne : Tracheobionate *Division : Magnoliphytes
*Embranchement : Spermaphytes *Sous embranchement : Angiospermes *Classe : Dicotylédones
*Familles : Oleéacées *Genre : Oleéa
*Espèce : Oleéa européea.
La famille des oléacées comporte environ 30 genres et 600 espèces. L’espèce Olea
europaea a longtemps été subdivisée en deux sous-espèces, Olea europaea var. Europeaea pour l’olivier domestique, et Olea europaea var sylvestris pour l’oléastre,
ou olivier sauvage (Guignard et al. , 2004 ; Tourte et al. , 2005).
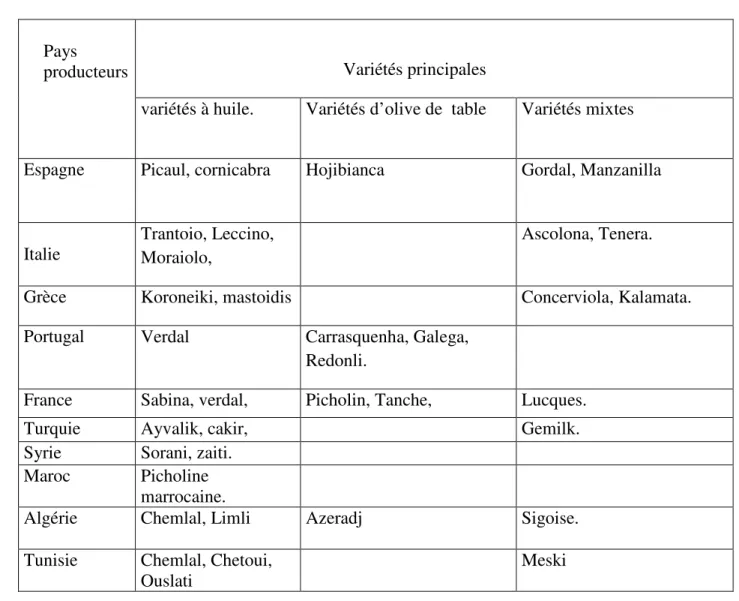
I.3 Variétés (à huile et à olive) :
Il y a actuellement plus de 2000 variétés d’olivier recensées dans le monde et chaque pays privilégie certains cultivars (Breton, 2006).
Tableau n° 02: Principales variétés d’olivier cultivées dans les pays méditerranéens (C.O.I, 2006).
Pays
producteurs Variétés principales
variétés à huile. Variétés d’olive de table Variétés mixtes
Espagne Picaul, cornicabra Hojibianca Gordal, Manzanilla
Italie
Trantoio, Leccino, Moraiolo,
Ascolona, Tenera.
Grèce Koroneiki, mastoidis Concerviola, Kalamata.
Portugal Verdal Carrasquenha, Galega, Redonli.
France Sabina, verdal, Picholin, Tanche, Lucques.
Turquie Ayvalik, cakir, Gemilk.
Syrie Sorani, zaiti. Maroc Picholine
marrocaine.
Algérie Chemlal, Limli Azeradj Sigoise.
Tunisie Chemlal, Chetoui, Ouslati
I.4 / Cycle de développement :
a-cycle de vie de l’arbre :
Tout le monde connaît la grande longévité de l’olivier, et l’on peut observer des arbres millénaires avec une relative fréquence. Néanmoins, du point de vue agricole, on doit nous s’intéresser à la période qui s’étale de la plantation à la diminution notable de sa production. Selon Loussert et Brousse (1978), le cycle de développement de l'olivier comprend à quatre périodes essentielles:
Période juvénile ou période de jeunesse -de 1 à 7 ans (sans production)- : C'est la période d'élevage et de croissance du jeune plant, elle commence en pépinière et se termine au verger. C'est durant cette période de jeune arbre que s'installe son système racinaire, tout en développant sa frondaison. Lorsque l'équilibre feuillage- racine est atteint, il y a apparition des premières fleurs.
-
Période d'entrée en productionC'est une phase intermédiaire chevauchant entre les phases de jeunesse et d'adulte, elle s'étale du moment où l'arbre est apte à produire, jusqu'à ce que ses productions soient importantes et régulières.
Période adulte - de 7 à 150 ans- :
C'est la plus intéressante pour l'oléiculture, sa durée est de 30 à 40 ans en culture intensive. L'olivier fournit l'optimum de sa production car il a atteint sa taille normale de développement et termine son accroissement souterrain et aérien.
-Période de sénescence - les 150 ans (production basse)- :
C'est le vieillissement de l'olivier, elle se caractérise par le ralentissement de renouvellement des jeunes ramifications et le rapport feuille/bois prend une allure descendante. L'alternance s'installe au détriment de la productivité ce qui conduit à une diminution progressive des récoltes.
Selon Boulouha (1986), le cycle biologique de l'olivier est caractérisé par le chevauchement de deux fonctions physiologiques différentes qui sont la floraison et la fructification de l'année en cours -comme la figure n° 03 le montre- qui se manifestent sur les rameaux d'un an ainsi la croissance végétative de nouvelles ramifications qui naissent sur les rameaux d'un an ou sur d'autres, d'âges différents. Le cycle évolutif annuel est caractérisé par les processus et les changements biologiques, biochimiques et morphologiques que subit l'arbre durant l'année. Le déroulement de ce cycle est étroitement en relation avec le climat méditerranéen (Loussert et Brousse, 1978).
Repos hivernal
C'est une période de semi repos (état d'activité végétative ralentie) qui s'étale de décembre jusqu'au début mars (Loussert et Brousse, 1978). Ceci est du à la présence des feuilles persistantes chez l'olivier qui empêchent ce dernier d'entrer en phase de dormance.
Anagnostopoulos (1956) in Loussert et Brousse (1978) estime que certaines variétés ont besoin d'un repos hivernal pour fleurir et se fructifier, afin que l'arbre reconstitue ses réserves et accumule une certaine quantité de froid nécessaire pour l'induction florale.
Mise à fleur
La formation de la fleur est liée à une succession de trois processus fondamentaux qui sont l'induction florale, la différenciation florale et la floraison proprement dite.
Induction florale
Est un changement métabolique qui caractérise la plante lors du passage d'un état végétatif à un état reproductif (Roland, 1982).
Différenciation florale
Des modifications morphologiques que subit un méristème au cours de sa transformation en fleurs ou en inflorescence.
Floraison proprement dite
La floraison chez l'olivier représente une phase physiologique critique dont le processus influe directement le rendement. L’abondance des fleurs, leur fertilité, la qualité du pollen et la fécondation peuvent compromettre le bon déroulement de la production (Nait taheen et al., 1995).
Daoudi (1994), conclu que la pollinisation croisée est nécessaire pour assurer une bonne fructification.
Fécondation
La fécondation est le résultat de fusion des noyaux reproducteurs mâle et femelle en donnant naissance à l’embryon et à l'albumen (Gautier, 1987). Nait taheen et al. (1995), notent que la viabilité des graines de pollen, exprimée par le taux de germination sur un milieu gélosé, est considérée par plusieurs auteurs comme caractère variétal.
Nouaison et Grossissement du fruit
Après une fécondation complète; l'ovaire se développe et grossit, on dit que le fruit est noué. Villemeur et Dosba (1997), estiment que l'olivier se situe en forte floraison autour de 500000 fleurs par arbre adulte et donnant 1 à 2 % de fruits.
Chute physiologique des fruits
La chute physiologique commence juste après la nouaison en diminuant la charge fruitière. Elle maintient un équilibre physiologique satisfaisant entre les fruits et les organes végétatifs. Selon Argenson, (1999), deux semaines après la pleine floraison ; de nombreux fruits peuvent chuter (50% des fruits noués) et une autre chute est notée au cours des deux semaines suivantes. Ce phénomène naturel disparaîtra progressivement et constituera un éclaircissage naturel.
Maturation
La maturation est un processus physiologique et biochimique intervenant vers la fin du cycle végétatif annuel de l'olivier. C'est la phase durant la quelle le fruit s'enrichit en huile et acquiert toutes ses qualités diététiques et organoleptiques. D'après Argenson (1999), la maturation intervenant en mi octobre quand le fruit commence a changé de couleur, et se poursuit jusqu’ à mi novembre ou janvier selon les cultivars et les conditions climatiques.
Figure n°03 : Différents stades phénologiques de l’olivier
I.5/ Exigences climatiques :
Les zones aptes à la culture de l’olivier sont caractérisées par un climat avec des températures minimales non inférieures à -6° ou -7°C, seuil en dessous duquel les feuilles sont gravement affectées. Une température de -3 ou -4°C peut abimer les fruits ayant une teneur élevée en eau qui n’auraient pas encore été récoltés, avec des conséquences négatives sur la qualité de l’huile. C’est pourquoi dans des zones situées au Nord, l’olivier est planté sur les flancs de colline, à des altitudes intermédiaires. Les zones de plus grande diffusion de l’olivier sont caractérisées par des hivers doux, des températures rarement inférieures à zéro degré et des étés secs avec des températures élevées. Dans les régions chaudes, il est nécessaire de satisfaire les exigences en froid de la culture car des températures constamment supérieures à 16°C empêchent le développement des bourgeons à fleur. Les températures doivent en effet être inférieures à 11-12°C pendant au moins un mois. En fin les températures élevées durant la maturation du fruit provoquent une augmentation de l’acide linoléique dans l’huile et une forte réduction de l’acide oléique (C.O.I, 2007).
L’olivier ne supporte pas les grandes gelées. En repos végétatif hivernal l’olivier ne peut résister aux températures -10°C (Mataix et Barbancho, 2006).Concernant les
précipitations, elles doivent être de 400 mm à 600 mm ; acceptables de 800 mm à 1000 mm à condition qu’il n y a pas une durée d’inondation ou de sécheresse très prolongée. (C.O.I, 2007)
I.6./Importance économique de l’olivier à l’échelle mondiale :
Le nombre mondial d’oliviers est évalué à 784 millions, dont 754,2 millions dans le bassin méditerranéen, l’Europe représente 66% du verger oléicole mondial. La superficie de culture d’oliviers représentait environ 4,65 millions d’hectares dans l’UE en 2012, l’Espagne occupe 53% et l’Italie 24% de la surface totale, ils sont suivis par la Grèce et le Portugal avec 15% et 7%, la France, Croatie, Chypre et Slovénie occupent ensemble 1% de la superficie totale de plantation des oliviers comme il est figuré au dessous. (Eurostat, 2016).
Figure 04 : Superficie en oliviers par classes de densité dans l'UE en 2012 (Eurostat, 2016)
L’Afrique du Nord représente (14%) du verger oléicole mondial, L’oléiculture nord africaine est largement dominée par le verger oléicole tunisien avec 55 millions d’arbres et plus de 1.4 millions ha. La Tunisie présente une vaste monoculture sur 800 000h. En 2014 la Tunisie occupe la deuxième place derrière l’Espagne dans la production mondiale d’huile d’olive. (Nicole, 2015).
Le Maroc a une oléiculture en rapide extension et concentrée dans 3 secteurs : les provinces du sud (31%), dans le Rif (28%) et au centre (22%).
En Algérie, coexistent une oléiculture traditionnelle (Kabylie, 55%) et une oléiculture moderne d’origine européenne en Oran (20%). (Agroconsult, 2008).
La figure ci-dessous montre la dispersion de l’olivier dans le monde entier.
Figure n°05 : Répartition de l’olivier dans le monde (WWW.Olives.com,2005)
I.7/
Importance économique de l’olivier à l’échelle nationale :
Dans certaines zones, l'oléiculture assure une activité agricole intense permettant de générer des emplois, de garantir l'approvisionnement d'unités de trituration d'olives et de conserveries d'olives (Achour, 1995). En dépit des potentialités que recèle le secteur, le diagnostic de la situation actuelle montre que les niveaux de production réalisés sont encore très modestes et ne valorisent que partiellement les atouts dont dispose notre pays en la matière. Cette situation résulte des effets négatifs engendrés par des contraintes liées aux incertitudes des conditions climatiques, à la complexité des statuts juridiques des terres agricoles, à la dispersion et à l'irrégularité des plantations, au matériel génétique peu performant et aux pratiques culturales peu évoluées (Benghanem, 1995).
I.8/ Importance économique de l’olivier dans la wilaya de Bouira :
Considérée parmi les régions du pays ayant un fort potentiel oléicole, la wilaya de Bouira table sur une production de 70 000 hectolitres (7 millions de litres) d’huile d’olive au terme de la saison en cours (2016-2017), selon les prévisions rendues publiques par la DSA (Direction des services agricoles).
Avec ce niveau, certes, la récolte s’annonce significativement en hausse par rapport à la campagne précédente (56 700 hectolitres), mais elle demeure en deçà des attentes compte tenu de l’importance de la surface oléicole dont jouit cette wilaya et qui s’élève à près de 40 000 hectares (Allal, 2016).
En quantité d’olives, le même pronostic de l’administration sectorielle locale prévoit une récolte qui dépasserait les 380 000 quintaux (qtx), soit une hausse de 27% par rapport à la saison d’avant où à peine 300 000 qtx seulement ont été cueillis. Le rendement en huile attendu pour cette année, quant à lui, est de 18 litres/quintal, (19l/q l’an dernier).
Globalement, Bouira représente près de 10% de la production nationale d’olives à l’huile, occupant ainsi la 4ème position derrière Béjaïa (20%), Tizi-Ouzou (15 %) et Skikda (10%).(Allal, 2016)
II- Présentation de maladies de l’olivier
II.1. Tuberculose de l’olivier :
Pseudomonas savastanoi pv. savastanoi
II-1-1 GénéralitésC’est une maladie bactérienne omniprésente dans le bassin méditerranéen, en Italie elle est appelée «Rogne» de l’olivier, en Espagne « Verru» ou «Tuberculos» de l’olivier, en France et en Afrique du Nord on lui donne le nom de «Tuberculose» ou chancre de l’olivier. Il est considéré comme l'un des plus graves maladies affectant les oliviers (Olea europaea L) dans la plupart des régions de culture d'olive.
Cette maladie est probablement la première maladie clairement décrite dans l'antiquité par Théophrastus (Iacobellis, 2001), l’agent pathogène est déclaré pour la première fois par Savastanoi en 1870 puis au début du 20éme siècle par Smith et Rorer en 1904 (Guido, 2005).
L’agent causal est le Pseudomonas savastanoi pv. savastanoi (Zohary et al., 1975) est considéré comme le seul pathogène responsable de la formation des nœuds (tumeurs) bactériennes des oliviers (Olea europa L) (Smith, 1908; Janse,
1982 ;Bradbury, 1986; Young et al., 1996).
L’attaque commence timidement sur brindilles des rameaux et n’épargne pas les charpentes et le tronc, à l’ occasion de blessures provoquées sur le végétal par le grêle, le gel et des plaies banales de la taille. Elle se manifeste par des tumeurs parenchymateuses à forme irrégulière, de couleur verte au début et à surface lisse. Le diamètre de ces tumeurs augmente au fur et à mesure de l’évolution de l’attaque et les fissures deviennent irrégulières. Ensuite, on assiste au brunissement de la surface de ces tumeurs.
Le transport de la bactérie se fait par l’homme, la pluie et le vent. Sa gravité provient du fait qu’elle peut être également transmise par les techniques de multiplication en pépinière à partir d’organes provenant d’arbres contaminés apparemment indemnes (greffons-boutures).
La réceptivité et la sensibilité des oliviers sont différentielles selon les variétés : Variétés résistantes : Canino, Grignan, Kalamon ; Variétés sensibles : Chemllal, Frantoio ; Meslala
La maladie peut conduire à de graves dommages dans les oliveraies, affecte également la taille et la qualité des fruits et donnant naissance à des odeurs indésirable, causant de graves perte dans le terme de production (Hall et al., 2004 ; Quesada et al.,2008).
Figure n°06 : des tumeurs formées sur les rameaux (Boulssen et Bourraoui, 2016)
II-1-2 Classification de Pseudomonas savastanoi
Selon (Young, 1996) ; la classification de cette espèce est la suivante : Règne : Bacteria Division : Proteobacteria Classe : Gammaproteobacteria Ordre : Pseudomonadales Famille : pseudomonadaceae Genre : Pseudomonas Espèce : Pseudomonas savastanoi II-1-3 Cycle biologique
Le cycle biologique de Pseudomonas savastanoi comprend deux phases : Phase épiphyte
Pseudomonas savastanoi pv. savastanoi survit à la fois dans les tissus des tumeurs et
comme un épiphyte sur les rameaux, les feuilles et les fruits. Les populations de pathogènes sont plus élevées sur les rameaux que sur les feuilles (Ercolani, 1993). La plage de température dans laquelle Pseudomonas savastanoi peut déclencher l'infection se situe entre 5° et 37 ° C et cet intervalle permettrait aux bactéries de causer des infections tout au long de l'année. Cependant, les conditions optimales pour le développement de la maladie sont d'environ 22°-25 °C et les périodes subséquentes subissent une forte probabilité d'infection en l'automne et au printemps (Protta, 1995). Pseudomonas savastanoi pv. Savastanoi peut infecter des oliviers au tout moment de l'année et la formation des tumeurs se déclenche seulement quand les conditions sont favorables.
Phase endophyte
Les bactéries endophytes sont définies comme des bactéries vivant dans les tissus végétaux sans faire un préjudice matériel ou en retirant les avantages autres que la résidence (Kado, 1992). Certaines rares études ont décrit la phase endophytes de
Pseudomonas savastanoi pv. Savastanoi dans les plantes d'oliviers (Wilson et al.,
1964). Selon d'autres auteurs, Psv pourrait également présenter une phase endophytes, se déplaçant à travers les espaces intercellulaires et même dans les vaisseaux du bois et des zones infectant à proximité de la première zone infectée (Penyalver et al., 2006 ; Schiff Giorgini, 1906 ; Smith, 1920 ; Wilson et al., 1964 ; Wilson et al., 1979). Les plaies de taille peuvent rester sensibles à l'infection pendant au moins 14 jours. Les cicatrices foliaires, cependant, sont les points les plus communs d’entrée des agents pathogènes et peuvent rester sensibles à l'infection jusqu'à 7 jours après la chute des feuilles (abscission).
II-1-4 Symptômes
Le symptôme caractéristique de l'infection est le développement des tumeurs, ou "galles" dans les sites d'infection. Les galles sont le plus souvent formées au niveau des sites de développement des bourgeons, en raison de l'infection des cicatrices foliaires par la bactérie; cependant, ils peuvent également être formés à d'autres points d'entrée des agents pathogènes, tels que les plaies de taille ou de blessures causés par le gel ou la grêle (Boulssen et Bourraoui, 2016).
L’infection par Pseudomonas savastanoi dans les plaies fraiches commence par une petite cavité sur les sites d'infection résultant de la prolifération des tissus végétaux.
Pseudomonas savastanoi pv. Savastanoi entraine la formation d’une croissance
hyperplasique des tissus de l’hôte, l’hyperplasie qui se manifeste par l’apparition de tumeurs d’abord sur le tronc, puis sur les rameaux et parfois sur les feuilles et les fruits (Surico, 1986 ; Lavermicocca et al., 2002 ; Young et al., 2004).
Les bactéries peuvent se propager sur de longues distances en raison de l'introduction et la plantation de matériel infecté, ou sur de courtes distances transportés par les éclaboussures de pluie, aérosols,, insectes et pratiques culturelles (Horne et al., 1912).
Lorsque les bactéries infectent un olivier à l'automne, les tumeurs vont commencer à se développer plusieurs mois plus tard, mais si l'infection se produit au cours du printemps, le temps nécessaire pour la formation des tumeurs peut être seulement deux semaines (Wilson, 1935)
Figure n°07 : Tumeurs formées sur le tronc (Boulssen et Bourraoui, 2016)
II-1-5 Méthodes de lutte
Il n’ya malheureusement, à ce jour, aucun remède connu et efficace contre ce fléau. Il faut cependant prendre quelques précautions afin de limiter la propagation de cette bactérie aux autres arbres (anonyme, 2001) :
- la principale est de désinfecter soigneusement tous les outils de taille en prenant la précaution de graisser par la suite les outils afin de leurs éviter de rouiller.
- éviter les excès d’irrigation de l’arbre. - éviter de blesser l’arbre.
-appliquer des produits cupriques au printemps et à la fin de l’automne tel que la bouillie Bordelaise à 1 % afin de désinfecter et cicatriser les plaies de taille. Des travaux ont montré que les pulvérisations supplémentaires au printemps ainsi que l'application après la récolte habituelle permettront d'améliorer sensiblement le contrôle des maladies (Botelho & Leda, 2006). L’ajout d'un adjuvant peut aider la pénétration et améliorer l'efficacité du cuivre. Bien que la pulvérisation de cuivre de routine réduise les infections. Pour être totalement efficace une couverture continue de cuivre est requise pendant toute l'année. Mais Ceci n'est pas pratique, surtout quand les fruits sont sur les arbres. Des bouillies cupriques sont parfois utilisées sur les arbres à la chute des feuilles, mais au moins certaines souches sont résistantes au cuivre grâce à une protéine qui piège et immobilise le cuivre
II-2
Verticilliose : Verticillium dahliae kleb
II-2-1Généralités
Cette maladie a été décrite pour la première fois par RUVGGINI en 1946. Elle est actuellement largement distribuée dans de nombreux pays méditerranéens. Elle a été rapportée également en Californie, en Argentine.
La verticilliose menace de plus en plus l’olive dans plusieurs pays du bassin méditerranéen. En Algérie, la maladie à été notée dans la région du Kabylie (Benchabane, 1990). Plusieurs oliveraies sont également infestées dans la région de Tlemcen (Boukenadel, 2002).
II-2-2 Classification de Verticillium dahliae kleb
L’agent infectieux, V. dahliae a été décrit pour la première fois comme une espèce distincte par Klebahn (1913). Les donnés bibliographiques (Fradine et Thoma, 2006) lui donnent la classification suivante :
Règne……… Fungi Phylum……….. Ascomycota Sub-phylum………Pezizomycotina Classe……….. Sordariomycètes
Sous classe……….. Incertae sedis Ordre……… Phyllachorales Famille………. Plectosphaerellaceae Genre………... Verticillium
Espèce………. Verticillium dahliae (Kleb)
II-2-3
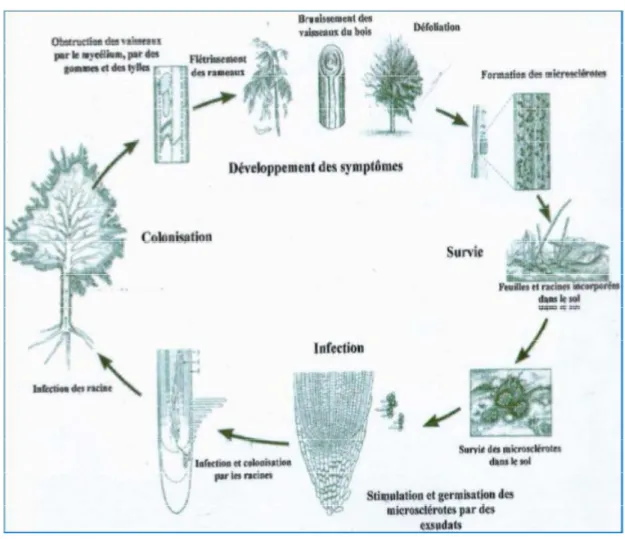
Cycle biologique
Le cycle biologique de V. dahliae se déroule en trois phases (Hiemstra et Harris, 1998), une phase de dormance dont les conditions ne sont plus favorables, une phase parasitaire qui se déroule dans la plante-hôte et une phase saprophytique qui comprend une période d’activité.
La phase de dormance commence lorsque les conditions ne sont plus favorables pour la croissance, le pathogène forme des structures de survie (microsclérotes) qui peuvent pérenniser plus de 14 ans dans le sol aux dépens des débris végétaux et des matériaux organiques (Wilhelm, 1955; Triki et al., 2006) constituant ainsi une source d'inoculum. Dans la nature, l'infection peut avoir lieu même lorsque le pathogène est présent en très faibles quantités dans le sol. Des niveaux aussi bas qu'un microsclérote par gramme de sol suffisent pour causer des symptômes d'infection chez une plante. Les microsclérotes germent dans la rhizosphère (environ 2 mm de la radicelle) en réponse à la présence d'exsudats racinaires de l’olivier (Pegg et Brady, 2002).
La phase parasitaire du champignon débute par la germination des microsclérotes qui atteindra les racines de l’olivier dans le sens d'un gradient de nutriments. Il en résulte une émission des hyphes qui colonisent le cortex des racines, y pénètrent par l’extrémité ou par les cellules épidermiques (Garber, 1966) puis gagne via la sève les vaisseaux du xylème; infection primaire (Fradin et Thomma, 2006; Vallad et Subbarao, 2008). Le parasite se reproduit asexuellement dans les vaisseaux, à l'intérieur desquels il progresse, grâce aux transports des conidies par le flux de la sève ascendante aux pièces aériennes de l’arbre (Vallad et Subbarao, 2008) où elles constituent des foyers secondaires d’infection (Garber, 1966). La poursuite ainsi de l’infection du système vasculaire et les toxines émises par le parasite, font que la plante produise des dépôts gommeux qui obstruent les vaisseaux
symptômes de flétrissement se déclenchent sur les parties aériennes atteintes (Tombesi et al., 2007).
La phase saprophytique du champignon débute par sa sortie du cylindre central pour coloniser tous les tissus de la plante où il forme des microsclérotes dans le parenchyme (Schnathorst, 1981). Les microsclérotes vont se retrouver encastrés dans les débris de la plante morte et constituent une source d'inoculum qui se dissémine par le mouvement des sols infectés, les débris végétaux infectés, l'eau d’irrigation, l’équipement agricole, le vent, les insectes telluriques, prédateurs, pollinisateurs…etc. (Pegg et Brady, 2002; Klosterman et al., 2009; Chawla et al., 2012). Les microsclérotes résiste aussi bien au froid qu’à la chaleur et supporte des écarts thermiques allant de -30°C à 55°C (Schnathorst et Mathre, 1966). Le saprophyte s’active et redevient agressif au rétablissement de bonnes conditions.
Figure n°08 : Cycle de développement de la verticilliose de l’olivier (Heimstra et Harris, 1998)
II-2-4 Symptômes
Les symptômes pathologiques externes de la verticilliose de l’olivier apparaissent traditionnellement sous une forme aigue (dépérissement aigu) chez les jeunes arbres et une forme chronique (dépérissement lent) chez les vieux arbres (Jiménez-Diaz et al., 1998 ; Bubici et Cirulli, 2011).
Les symptômes de dépérissement aigu ou d’apoplexie se produit à la fin de l’hiver ou au début du printemps. Il se caractérise par une fanaison rapide et grave des rameaux, des branches secondaires et principales présentant une écorce de couleur brun-violacé progressant de l’extrémité vers la base. Ces organes foliacés portent des feuilles qui se recroquevillent vers leur face inferieure et perdent leur coloration verdâtre pour virer au brun clair, ce qui induit leur dessèchement et deviennent cassantes ayant tendance à chuter tandis que les fruits se momifient et restent suspendus aux rameaux malades. Cette forme de verticilliose s’accompagne de sortie importante de rejets au pied de l’arbre (Civantos, 1999 ; Bellahcen, 2004 ; Tombsi et al. ; 2007).
Les symptômes pathologiques internes de la verticilliose de l’olivier se manifestent par un brunissement de xylème des branches infectés (Vigouroux, 1975 ; Tombesi et al . ; 2007) et de cylindre central de système radiculaire (Triki et al. ; 2006).
La sévérité des symptômes de cette maladie dépend principalement du type de sol, densité d’inoculum, la virulence du pathogène, la susceptibilité du cultivar de l’olivier et les conditions environnementales (Lopez-Escudero et al. ; 2010 ; Martin-Lapierre,2011).
Figure n°09 : Symptômes de la verticilliose sur l’olivier (Zoubir, 2017)
II-2-5 Méthodes de lutte Lutte biologique
L'enfouissement d'engrais vert améliore l'état sanitaire d'oliveraies atteintes de verticilliose. Cette opération permettrait la prolifération d'une flore antagoniste (Serrihini, 1992).
L'incorporation au sol du champignon Talaromyces flavus a donné des résultats encourageants dans la lutte biologique contre la Verticilliose de l'aubergine. Certains auteurs la considèrent comme étant une voie prometteuse sur l'olivier.
Lutte culturales
* Eviter les précédents culturaux et les cultures intercalaires favorables. * Equilibrer la fertilisation et l'irrigation.
* Eliminer les parties malades pendant la taille.
* Eviter les labours profonds qui risquent de blesser les racines.
La solarisation arbre par arbre a été testée avec un certain succès en Grèce (Tjamos, 1991 et Alahmad, 1993).
Luttes chimiques
La pulvérisation de produits Benzimidazol sur la frondaison des arbres est une technique infructueuse dans le cas de cette maladie. Certains auteurs (Tawil, 1991) ont testé l'injection de fongicide systématique et ont prouvé par des bios tests la
distribution des produits dans l'arbre. Mais jusque là aucune lutte chimique efficace n'a été mise en point.
Interventions agronomiques
Pour contenir le pathogène, il est important d’éviter toute stagnation d’eau, la proximité de Solanacées et essayer d’utiliser des variétés résistantes. (Villa, 2003).
I-
Présentation de la région d’étude
I.1.Situation géographique de la région d’étude
Bouira :
La wilaya est située dans la région de la kabylie
montagneuses de Djurdjura et des Bibans, elle est délimitée au nord par les deux wilayas : Boumerdès et Tizi Ouzou, à l’est par les deux wilayas
Bou Arréridj, au sud par la wilaya de M’Sila et à l’ouest p Blida et Médéa.
Figure n°10 : Carte géographique de la wilaya de Bouira
I.2Caractéristiques climatiques
Selon la Direction des services agricoles (DSA, 2017), les caractéristiques climatiques de cette région
La température
entre 12°C à 18°C au printemps. Durant l’été, elle atteint des degrés plus élevés et varié entre 22°C et 35°C et redevient plus modérée à l’automne : avec 20°C et 25°
L’humidité
elle mesure jusqu’à 60 à 80 %.
Présentation de la région d’étude :
Situation géographique de la région d’étude : wilaya de
La wilaya est située dans la région de la kabylie, elle est bordée par les chaines montagneuses de Djurdjura et des Bibans, elle est délimitée au nord par les deux : Boumerdès et Tizi Ouzou, à l’est par les deux wilayas : Bejaïa et Bordj Bou Arréridj, au sud par la wilaya de M’Sila et à l’ouest par les deux wilayas
: Carte géographique de la wilaya de Bouira (Anonyme,
Caractéristiques climatiques :
Selon la Direction des services agricoles (DSA, 2017), les caractéristiques climatiques de cette région sont comme suite :
La température : elle varie selon la saison : de 06°C à 11°C en hiver, entre 12°C à 18°C au printemps. Durant l’été, elle atteint des degrés plus élevés et varié entre 22°C et 35°C et redevient plus modérée à
: avec 20°C et 25°C.
L’humidité : l’humidité est très élevée surtout au printemps et l’été, elle mesure jusqu’à 60 à 80 %.
: wilaya de
, elle est bordée par les chaines montagneuses de Djurdjura et des Bibans, elle est délimitée au nord par les deux : Bejaïa et Bordj ar les deux wilayas :
(Anonyme, 2011)
Selon la Direction des services agricoles (DSA, 2017), les caractéristiques
: de 06°C à 11°C en hiver, entre 12°C à 18°C au printemps. Durant l’été, elle atteint des degrés plus élevés et varié entre 22°C et 35°C et redevient plus modérée à
L’évaporation : elle est assez importante durant les mois de juillet et aout ou elle peut atteindre 70 à75% de l’évaporation annuelle.
Les vents : les vents de siroco sont les vents dominants.
I-3 Présentation de site d’étude :
Notre station d’étude se trouve au niveau de M’Chedallah : elle comprend deux parcelle :
La première parcelle est située au niveau de la commune d’Ath mensour La parcelle d’étude est un champ d’olivier, sans brise-vent, d’une superficie de 0.4 ha, âgé de plus 80 ans, ce champ possède quatre lignes et neuf colonnes soit 36arbres. Deux variétés d’olive y sont cultivées : Azerraj et Aharoun. Cette parcelle présentait des symptômes de la verticilliose.
La deuxième parcelle est située aussi au niveau de M’Chedallah, cette parcelle présentait des symptômes de la maladie de tuberculose de l’olivier.
II-Prospections sur terrains et prélèvement des échantillons :
Les prospections sur terrains sont effectuées durant la période fin mars – début avril, les premières sorties était faites dans le but de repérer des vergers symptomatiques, puis d’autres sorties sont réalisé afin de prélever les échantillons.
L’échantillonnage est effectué sur les arbres présentant les symptômes de la verticilliose. On a prélevé des rameaux malade mais là ou une grande partie des tissus est verte. Pour le verger atteint de tuberculose, l’’échantillonnage a visé les rameaux vert présentant des tumeurs.
Dans chaque verger, plusieurs prélèvements sont effectués à l’aide d’un sécateur désinfecté à l’eau de javel. Le matériel végétal obtenu est mis dans des sacs en plastique étiquetés (date et lieu de prélèvement).
III-
Traitement des échantillons au laboratoire :
Cette partie comprend des préparations des milieux de cultures favorables à la croissance des champignons et des bactéries
III-1 Cas des échantillons présentant les symptômes de la verticilliose : III-1-1 isolement :
Le matériel végétal symptomatiques est découpé en petit morceau à l’aide de sécateur désinfecté pour les parties durs (rameaux) et à l’aide de scalpel pour les parties tendres, les fragment sont récupérés et mis à désinfecter dans une solution de l’eau de javel à 6% pendant 10 min (figure n 11), puis ces fragments sont rincés deux fois à l’eau distillée stérile pour éliminer toute trace de l’hypochlorite de sodium, les fragment sont ensuite déposés à raison de cinq par boite de Pétri contenant le milieu PDA ; les boites sont incubées dans une étuve à 26°C.
1-Couper les échantillons en petits morceaux
3-Rincer les petits morceaux avec l’eau distillée
Figure n° 11 Les étapes d isolement des champignons
III-2 Cas des échantillons présentant des symptômes de la tuberculose :
III-2-1 Isolement :
Le matériel végétal constitué essentiellement de tumeurs est découpé en très petits morceaux, puis les fragment obtenus sont lavés superficiellement dans une solution d’eau de javel diluée puis lavé avec d’eau distillée stérile, et en fin ils sont mis à macérer dans de l’eau distillée stérile, pour une période de plus de 30 min.
Figure n°12 : Lavage et macération des fragments végétaux
A l’aide d’une pipette, une goutte de la suspension obtenue (macérât) est étalé selon la technique des trios cadrans des boites Pétri contenant un milieu nutritif préalablement préparé
Dans l’étape d’isolement, on a utilisé deux milieux de culture : le milieu Levane, et le milieu LPGA. Le bute d’utilisation de ces deux milieux est pour permettre la croissance d’une grande diversité de bactéries.
Les boites sont ensuite mises à incuber dans un phytotron à 26°C pendant 3 à 4 jours.
Figure n°13 : Ensemencement sur le milieu nutritif
Les isolats obtenus sont nommés selon le milieu d’isolement initiale ainsi pour : Le milieu LPGA : LPi 1, LPi 2, LPi 3…etc
Le milieu levane : LVi 1, LVi 2 ,….etc
III-2-2 Purification des isolats bactériens :
C’est est une étape nécessaire pour avoir des souches bactériennes pures. Pour la purification d’une souche bactérienne, on a prélevé une colonie bactérienne bien individualisé et isolé, puis on l’ensemence dans un milieu de culture neuf selon la technique de trois cadrans. Toutes les colonies bactériennes obtenues sur les milieux d’isolement sont purifiées. Le milieu utilisé pour la purification est le milieu KING. B. Les boites sont mis à incubé dans un phytotron à 26°C.
IV- Identification des isolats obtenus :
IV-1- Identification microscopique et macroscopique des isolats fongiques : IV-1-1- Analyse macroscopique :
Lors de l’analyse macroscopique des colonies fongiques obtenues, plusieurs caractères sont observés :
l’aspect : duveteux, laineux, cotonneux, velouté, poudreux, granuleux ou glabre.
le relief : plat, plissé ou cérébriforme. la taille : petite, étendue ou envahissante.
la couleur : blanche, crème ou colorée (verte, brune, orangée, violette, grises…).
La présence d’un pigment diffusant dans la gélose ainsi que certains paramètres telle -La vitesse de la croissance des colonies peuvent être de bons indicateurs pour l’identification d’une moisissure.
IV-1-2-Analyse microscopique :
Lors de l’analyse microscopique des isolats fongiques, plusieurs structures sont observées comme l’appareil végétatif, les organes de fructification et les spores :
le thalle végétatif : septé ou siphonné, paroi pigmentée (mélanisée) ou non (hyaline).
les organes de fructifications : présence ou non d’organes protecteurs des conidies, modes de formation des conidies (issues directement du thalle, solitaires (aleuriospores) ou en chaines (arthrospores), ou produites par bourgeonnement et regroupées soit en grappes, en masse, en têtes ou en chaînes basipètes ou acropètes), modes d’implantation des cellules conidiogènes.
les spores : endogènes (endospores) ou exogènes (conidiospores ou conidies), l’aspect des spores [amérospores (unicellulaires et de petite taille), didymospores (bicellulaires), phragmospsores (pluricellulaires à cloisons transversales), dictyospores (pluricellulaires à cloisons transversales et longitudinales), scolécospores (étroites et effilées)], présence ou non de chlamydospores.
Et pour réaliser une observation, on a préparé la solution de bleu de méthyle ou bleu de coton (voir annexe), et on a utilisé la technique de scotch, cette technique consiste à adhérer à l’aide d’un bout de scotch une fraction mycélienne à partir d’une culture jeune et de la coller sur une lame contenant une goutte de bleu de coton (Chabasse,
2002). Les observations microscopiques sont effectuées aux grossissements *10 et * 40 à l’aide d’un microscope type Motic digital microscope.
Figure n°14 : Etapes suivies pour la préparation des lames à observer (Originale, 2018)
IV-2 identification macroscopique et biochimique des isolats bactériens : IV-2-1 Caractérisation macroscopique :
Cette opération consiste à observer les caractéristiques à l’œil nu des colonies en se basant sur quelques critères :
La couleur
La bordure : régulière ou irrégulière Elévation : convexe, bombée, plate… etc Surface : lisse, rugueuse.
Opacité : brillant … etc
IV-2-2 Tests biochimiques :
Ces tests sont très importants et utiles dans l’identification des bactéries phytopathogènes, par la connaissance de certaines caractéristiques. Le test catalase :
L’enzyme catalase est produite en abondance par les bactéries ayant un métabolisme respiratoire qui détruit les peroxydes et libère de l’oxygène.
A l’aide d’une pipette pasteure stérile on a déposé une goutte de peroxyde d’hydrogène (H2O2 à 3%) sur une lame en verre stérile, puis on a prélevé une
suspension bactérienne d’une colonie incubée plus de 24 heure et on l’a mis sur la solution déposée sur la lame. La lecture se fait après deux minutes on observe :
-présence du bulle : réaction positive. -absence du bulle : réaction négative. Le test oxydase :
Le test oxydase est basé sur la production bactérienne d’une enzyme oxydase intracellulaire en présence d’oxygène atmosphérique et de cytochrome C. A l’aide d’une pipette pasteur stérile on a prélevé une goutte de la solution du réactif (tetraméthyle paraphénylène diamine) préparée et on l’a mis sur un papier Wattman. Par la suite une émulsion d’une colonie bactérienne est déposée sur la partie du papier Wattman imbibé du réactif. La réaction est lue dans les 30 secondes suivantes.
-Une réaction positive indique qu’il y a eu oxydation du réactif phénylènediamine pour former un composé coloré en violet, l’indophénol. -Une réaction tardive ou une absence de coloration indiquent une réaction négative (Klement et al., 1990).
Figure n°15 : Les différentes étapes de l’oxydation Le test pectinase :
Ce test a pour but de déterminer la présence ou l’absence de l’enzyme péctinase. Pour ce test ; on a utilisé des tranches de la pomme de terre comme un substrat qui est riche en pectine, les rondelles de pomme de terre sont stérilisé avec de l’éthanol à 70°, puis elles sont lavées par de l’eau distillée stérile, et enfin séchée. L’inoculation est faite par une suspension bactérienne prise par une pipette stérile et déposée au milieu des rondelles de la pomme de terre. L’incubation est faite à 26°C pendant 7
jours. Une réaction positive (l’hydrolyse de péctine) se traduit par la formation de nécrose humide.
Figure n°16 : Test péctinase
Le test indicateur de Gram du KOH :
Le test KOH sert à déterminer si la bactérie est Gram positif ou négatif en suivant le protocole suivant : Sur une lame en verre ; on a déposé une goutte de la solution de KOH 3%, puis on a ajouté une suspension prélevée d’une colonie bactérienne, et à l’aide d’une pipette pasteur, on a mélangé bien.
La bactérie est considérée Gram négatif s’il ya formation du filament (filet visqueux) en soulevant la pipette, dans le cas contraire la bactérie est considérée Gram positif (Suslow et al, 1982).
Le test arginine déhdrolase :
Ce test permet de détecter la capacité d’un organisme à produire de l’arginine déhydrolyse (ADH), enzyme qui décarboxyle l’acide aminé arginine
Pour ce faire, un tube contenant le milieu Arginine (Annexe) est inoculé par la bactérie, on ajoute en suite environ 1 cm d’huile minérale stérile. La réaction se fait en condition anaérobique. Les tubes sont incubés dans l’étuve à 26°C. La lecture des résultats se fait après 4 jours.
Si le milieu deviendra jaune ou reste rose violé le test est considéré négatif, et si le milieu vire vers la couleur violette le test considéré positif.
Figure n°17 : Préparation de test arginine.
Test levane sucrase :
Le test levane sucrase sert à déterminer si la bactérie polymérise le fructose en polyfructose. A l’aide d’une pipette pasteur, on a inoculé le milieu de culture levane par stries avec une culture bactérienne jeune. Après 3 jours d’incubation à 26°C, l’apparition d’une culture abondante, bombée, muqueuse et brillante indique que la bactérie possède une levane sucrase (Goszczynska et al., 2000).
Durant les sorties que nous avons fait dés le début de mois d’Avril, nous avons ramassé les échantillons qui portent les symptômes des deux maladies recherchées, les prélèvements ont concerné les différentes parties de l’arbre. .
I. Résultats des échantillons présentant les symptômes de la verticilliose
I.1. Observation des symptômes sur le terrain :
Durant la sortie que nous avons fait sur le premier verger nous avons pu ramasser quelques échantillons paraient semblables aux symptômes de la Verticilliose de l’olivier. Les symptômes observés sont :
- Jaunissement et dessèchement des feuilles, tout en restant accrochées à la branche. elles s’enroulent longitudinalement en gouttière et deviennent cassantes (figure n°18) - Brunissement de l’écorce des rameaux atteints.
- Dépérissement des rameaux et des branches.
Figure n°18 : Symptômes de la verticilliose.
Ces symptômes sont bien en concordance avec ceux décrit par Bellahcen (2004) et Tombsi et al. (2007).
I.2. Observations macroscopiques et microscopiques des isolats fongiques
Nous avons obtenu sept isolats caractères morphologiques variés
I.2.1. Caractérisation
Les résultats de la caractérisation macroscopique des isolats fongiques âgés de 15 jours sur le milieu PDA est illustrés dans le tableau
Tableau n 03: Caractérisation macroscopiques des isolats fongiques
Code de la boite Face supérieure B1 B2 B3
Observations macroscopiques et microscopiques des isolats fongiques
Nous avons obtenu sept isolats fongiques sur le milieu PDA, ces isolats présentent des caractères morphologiques variés
Caractérisation macroscopique des isolats fongiques
ts de la caractérisation macroscopique des isolats fongiques âgés de 15 jours sur le dans le tableau 03
: Caractérisation macroscopiques des isolats fongiques
Face supérieure Face inférieure Description Couleur marron pour les deux faces. Mycélium cotonneux Colonie de à croissance rapide Forme croissance modérée Couleur noir entouré d’une bande grise face supérieure et une couleur noir entourée du jaune inférieure. Forme Colonie mycélium de texture cotonneuse. le revers est blanc
-Observations macroscopiques et microscopiques des isolats fongiques :
, ces isolats présentent des
des isolats fongiques
ts de la caractérisation macroscopique des isolats fongiques âgés de 15 jours sur le
Description
ouleur marron-miel pour les deux faces. Mycélium cotonneux
olonie de forme ronde, à croissance rapide
orme irrégulière à roissance modérée
ouleur noir entouré d’une bande grise sur la face supérieure et une couleur noir entourée du
sur sa face inférieure.
orme ronde.
olonie blanche avec mycélium de texture cotonneuse. le revers est
B4 B5 B6 B7
Dans notre étude nous avons détecté la présence de plusieurs types de colonies mais de ces colonies ne présente les caractéristique de
de ce dernier a été détaillée par plusieurs auteurs dont on cite Lahlou (1983), Cherrab et al. (2002)
auteurs verticillium est caractérisé compact très mélanisé et noirâtre
Colonie de verdâtre
mince bonde jaune. - Le revers est de
noir foncé entouré d’une mince bonde jaune
Forme colonie Colonie à croissance modérée de marron
supérieure, et noire sur la face inférieure.
-Colonie de régulière.
brun-grise sur la face supérieure et noire avec une mince bordure rouge sur la face inférieure.
-Colonie de régulière lente de
foncé sur la face supérieure, et noire foncée sur la face inférieure.
Dans notre étude nous avons détecté la présence de plusieurs types de colonies mais
de ces colonies ne présente les caractéristique de Verticillium . La description macroscopique de ce dernier a été détaillée par plusieurs auteurs dont on cite Bellahcen (2004), Boisson et Lahlou (1983), Cherrab et al. (2002) Harir (2010), et Pegg et Brady (2002)
caractérisé par mycélium blanc à l’état jeune devenant avec l’âge noirâtre par la production abondante des microsclérotes
olonie de couleur gris verdâtre entourée d’une mince bonde jaune.
e revers est de couleur noir foncé entouré d’une mince bonde jaune
orme irrégulière de colonie.
olonie à croissance modérée de couleur marron foncé sur la face supérieure, et noire sur la face inférieure.
Colonie de forme régulière. de couleur
grise sur la face supérieure et noire avec une mince bordure rouge sur la face inférieure.
olonie de forme régulière à croissance lente de -couleur brun foncé sur la face supérieure, et noire foncée sur la face inférieure.
Dans notre étude nous avons détecté la présence de plusieurs types de colonies mais aucune La description macroscopique Bellahcen (2004), Boisson et et Pegg et Brady (2002). Selon ces jeune devenant avec l’âge par la production abondante des microsclérotes.