Chapitre II Lipides : Aspects nutritionnels et diététiques
Texte intégral
Figure



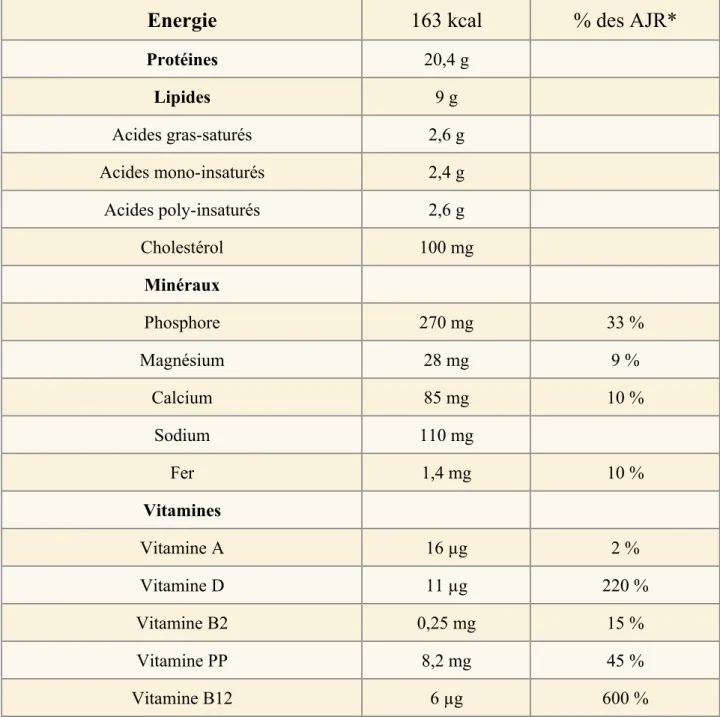
Documents relatifs
La détermination de la teneur en lipides totaux ainsi que de la composition en AG des tissus ont été réalisées sur le tissu adipeux sous cutané dorsal, la panne, le tissu
Organisation structurale et moléculaire des lipides dans les aliments : impacts nutritionnels.. Claude Genot et
- Sont également rangés dans la catégorie des lipides des composés sans acides gras tels les dérivés isoprèniques (stérols, caroténoides, etc…) du fait de leur caractère
un régime carencé en lipides, leur production laitière, leur taux butyreux et leur sécrétion journalière de matières grasses sont significativement inférieurs à
Des études sont en cours, d'autres sont nécessaires, en particulier dans le domaine des fonctions des acides gras saturés, des acides gras conjugués et dans le domaine des
Selon l'IUPAC, par exemple, sont inclus dans la catégorie « lipides » les acides gras et dérivés, ainsi que leurs esters respectifs.... Ils sont monoacides, linéaires, à nombre
Le produit qui est alors dégluti est très différent de celui mis en bouche et les interactions entre la matrice grasse et la salive peuvent entrainer un changement significatif
[r]