traitement électrochimique des sols hétérogènes
Texte intégral
Figure


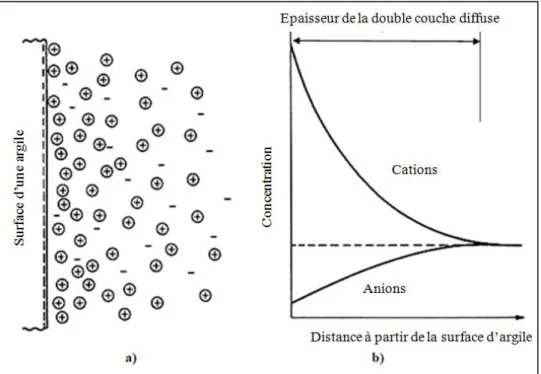
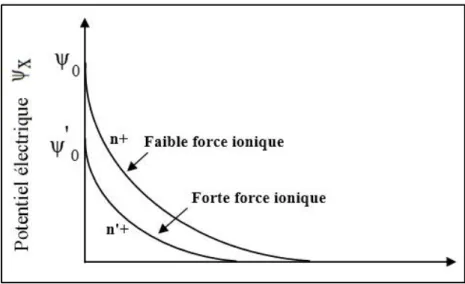
Documents relatifs
Lorsqu’il ne se manifeste plus aucun changementde coloration, laisser refroidir la capsule dans le dessicateur. Recommencer éventuellement l’opération jusqu’à
Campbell et Wood 1 ont trouvé que les sels de potassium possèdent une radioactivité plus grande que les autres substances examinées et que cette radioactivité ne
Pour le chlorure de baryum et de radium chauffé au rouge cerise pendant plusieurs heures, l’activité immédiate- ment après chauffage n’était que 16,2 pour 100
Plusieurs sels permettent d’obtenir un spectre rapide, les chlorures, comme dans les concepts REBUS et WISE, ou les fluorures non modérés, avec un combustible plus concentré
Pour cela, un inventaire des différentes techniques séparatives par changement de phase usuellement employées en milieu de sels fondus a été réalisé afin de sélectionner
caractère nucléophile et basique de l'eau (affinité de l'O pour les entités positives) due aux doublets d'e- libres.. 2- Les molécules d'eau : associées entre elles par
L’influence de la nature du sel (CaCl 2 et CaCl 2 -KCl), de l’anode (graphite et platine), de la densité de courant cathodique, de la concentration en CaO dans le bain (de 1 à
Des outils, plus ou moins complexes d’utilisation, sont disponibles pour, dans un premier temps, extraire les données brutes des bases de données puis assurer leur traitement de