Autres articles
S w i s s - N O S O
I n f e c t i o n s n o s o c o m i a l e s e t h y g i è n e h o s p i t a l i è r e : a s p e c t s a c t u e l s
Volume 7 N° 4 Bulletin de décembre 2000
Editorial
La surveillance est une composante es-sentielle de tout programme de contrôle de linfection. Sans une récolte de don-nées systématique, la fréquence de base des infections nosocomiales (baseline) ne peut pas être établie. Cela permet également de saisir rapidement la surve-nue dune épidémie en relation avec un certain type dinfection ou de pathogène. La surveillance comporte une charge de travail substantielle et cest la raison pour laquelle il existe plusieurs possibi-lités. La méthode la plus simple mais aussi la moins sensible, est la surveillance basée sur la revue régulière des résultats du laboratoire de microbiologie. A lop-posé, une surveillance maximale peut être obtenue par ce quon appelle la «full house» surveillance, cest-à-dire un suivi quotidien par une personne compétente de tous les patients dans toutes les unités de soins ou de policliniques. Cette der-nière forme de surveillance ne peut être recommandée que dans des hôpitaux par-ticuliers, par exemple à but de formation. Entre ces deux extrêmes, il y a de nom-breuses possibilités. Cest au service dhygiène hospitalière de déterminer quelle est la méthode optimale pour cha-cune des situations et cest aussi à lui quincombe la responsabilité de la met-tre en pratique. Les principes de base sont résumés dans le présent numéro de Swiss-NOSO, ainsi que dans le numéro précédent. Dans les hôpitaux de soins aigus, la surveillance continue des hé-mocultures positives ainsi que la saisie des infections du site chirurgical sont considérées comme des standards mini-maux au plan international. Dans la me-sure où la durée de séjour dans les hôpi-taux devient toujours plus courte, la sur-veillance doit faire face à de nouveaux problèmes. Dans le présent article, les bases qui permettent de décider dune surveillance optimale sont présentées.
A. F. Widmer et P. Francioli
Stérilisation au plasma : mise à jour
Andreas F. Widmer, Bâle; Patrick Francioli, Frédy Cavin, Lausanne
La nouvelle technique de stérilisation au plasma (plus exactement: au peroxyde d'hy-drogène) sest améliorée de manière substan-tielle depuis la mise sur le marché du premier appareil Sterrad® 100 (Swiss-NOSO 1994 ; 1 :7). Une description détaillée du procédé se trouve dans larticle mentionné ci-dessus. Du fait que les produits de la réaction ne compor-tent que de leau et de loxygène, il ny a pas de résidus toxiques. Depuis la première installa-tion dun tel appareil à Bâle en 1993, de nombreux hôpitaux les ont introduits dans leur stérilisation centrale. Cependant, durant cette même période, des normes européennes, et par conséquent suisses, sont entrées en vigueur (93/42/CEE,SN EN 285,550,552,554,556) [1]. Le présent article résume les améliorations apportées aux nouveaux appareils (Sterrad® 50, 100S et 200) depuis 1993 (Tableau 1) mais également les exigences qui sont formulées pour garantir une stérilisation de haute qualité.
Exigences de stérilisation
Les normes SN EN 285, SN EN 550, 552, 554, 556 et 868 décrivent les exigences en matière de stérilisation à la vapeur et à loxyde déthylène (Tableau 1), mais on ny retrouve pas encore dexigences en matières de stérili-sation au plasma. Lexigence de base (ISO 14937), qui stipule que 106 spores doivent être détruits au cours dun demi cycle nest remplie quavec les appareils Sterrad® 100S et Sterrad® 200. Le Sterrad® 100 comporte un seul cycle avec une phase de plasma. Le Sterrad® 100S (relativement similaire), et le Sterrad® 200 nouvellement développé ont un programme comportant 2 cycles et qui par conséquent garantit la destruction de 106 spo-res déjà après la moitié du programme. La destruction de 106 spores est notamment exi-gée pour le marquage CE, ce qui est un prérequis pour la mise sur le marché dappareils aussi bien en Suisse que dans les pays de lUnion Européenne. La stérilisation au plasma sest développée de manière notablement plus ra-pide en Europe quaux Etats-Unis, bien que les appareils soient fabriqués là-bas.
Développement de la stérilisation
au plasma depuis 1993
En 1993, seul lappareil Sterrad® 100 était disponible. Il ne comportait quune petite
cham-bre sans double porte, il ny avait pas de cassette comme cela est nécessaire pour cette forme de stérilisation, et le matériel dembal-lage était relativement cher. La marge de sécu-rité, comparée à dautres méthodes de stérili-sation, était relativement faible. En plus, on ne savait pas quels étaient les tests biologiques les plus appropriés. Ceci explique pourquoi les experts allemands se sont opposés à cette technique qui ne garantissait pas la sécurité exigée par les nouvelles normes européennes. Beaucoup de ces manques ont maintenant été comblés. Les tests utilisant B. stearothermophilus (au préalable B.subtilis) se sont imposés et sont disponibles commer-cialement pour le monitoring. Le système de cassette sest enrichi, la taille de la chambre de stérilisation a été augmentée et un système de double porte a été créé. Un produit concurrent, lAbtox Plazlyte Sterilisation System a été également mis sur le marché. Au contraire du Sterrad, lappareil Abtox Plazlyte Sterilisation System utilisait lacide péracétique. Le 13 avril 1998, ces appareils ont été retirés en raison dune épidémie : [Food and Drug Ad-ministration (FDA) Safety Alert, April 13, 1998]. Il sagissait de 16 patients qui ont présenté des lésions cornéennes irréversibles à la suite dune intervention intra-oculaire pratiquées avec des instruments stérilisés avec cet appareil. Cela a été attribué à un dégage-ment de cuivre et de zinc à partir des instru-ments lors du processus de stérilisation [2,3]. Dans le rapport de la FDA, il est fait mention que lappareil utilisé navait pas été approuvé pour stériliser de tels instruments. Cet acci-dent démontre que - comme déjà évoqué dans le premier article de Swiss-NOSO - seul du personnel qualifié doit utiliser de tels appa-reils. Bien que jusquici on ne déplore aucun incident de ce type avec les appareils Sterrad®, des incompatibilités ne peuvent pas être ex-clues et avoir des effets indésirables pour les patients et/ou pour les instruments.
Le processus de stérilisation est contrôlé électroniquement et sinterrompt si lun des paramètres nest pas atteint. De plus, il existe des indicateurs chimiques, comparables à ceux disponibles pour la stérilisation à la vapeur. Ils ne témoignent pas de ladéquation du proces-sus de stérilisation mais simplement du fait quun contact a eu lieu avec le peroxyde dhy-drogène. Le fabricant fournit également des
Surveillance des infections nosocomiales: principes et application (2e partie) .. 27
indicateurs biologiques. Ceux-ci sont néces-saires du fait que cette forme de stérilisation ne fait pas encore lobjet dune norme de stérili-sation de lUnion européenne. Dans cette si-tuation, il nest pas recommandé de se baser uniquement sur la mesure des paramètres de stérilisation sans un monitoring biologique. En Suisse, le fabricant recommande de prati-quer des tests biologiques chaque semaine. Cette fréquence peut cependant être adaptée à chaque hôpital, du fait que la fréquence opti-male nest pas clairement établie. Aux Etats-Unis et en France, un monitoring quotidien est recommandé.
Au printemps 2000, le premier appareil Sterrad® 200 disponible en Europe a été testé en conditions réelles à Bâle. Toutes les exigen-ces, en particulier la destruction de 106 spores lors dun demi cycle ont été remplies. Avec lappareil Sterrad 200, le cycle est plus long quavec lappareil Sterrad 100S ou 50. Du fait de laugmentation du volume de la chambre, la phase de vide initiale ainsi que la phase termi-nale sont plus longues. En laboratoire, les tests nécessaires à lobtention dune certification CE ont déjà été réalisés par le fabricant. En pratique, les conditions ne sont cependant pas toujours optimales : par exemple, les
instru-ments ne sont pas toujours parfaitement net-toyés. De même, une eau déionisée remplis-sant des critères de qualité suffiremplis-sants nest pas disponible dans tous les hôpitaux. Lappareil a cependant satisfait aux tests qualitatifs et quan-titatifs, lesquels ont été réalisés en collabora-tion avec lUniversité Halle (Prof. Borneff, Dr.Okpara). En dehors du Japon et de la Suisse, aucun de ces appareils nest encore en fonc-tion; cest la raison pour laquelle, en Suisse, lannonce de tout incident (postmarketing sur-veillance) sera très importante. Ces annonces peuvent être faites directement au fabricant ou alors à lOffice fédéral de la Santé.
Remarque sur le matériel
Il y a du matériel qui ne se prête pas à une stérilisation au plasma (Tableau 3).
Tableau 2: Résumé des normes importantes pour la stérilisation dans les hôpitaux (Liste plus complète: http://www.adiph.org/afs/NormesSter.html) Tableau 1: Appareils disponibles en Suisse
Tableau 3 : Matériel ne se prêtant pas à une stérilisation au plasma
Liquides et poudres
Coton ou papier, en particulier les étiquettes de papier (des alternati-ves sont disponibles)
Instruments ou appareils qui ne sup-portent pas une mise sous vide (par exemple : cathéters pour les mesu-res urodynamiques)
Instruments avec une lumière lon-gue et étroite
Instruments avec une lumière mais fermé à lune des extrémités.
0 5 d a r r e t S Sterrad100S Sterrad200 Remarques ) m c ( l i e r a p p a 'l e d n o i s n e m i D r u e d n o f o r p x r u e t u a h x r u e g r a l 3 , 1 8 x 3 , 0 4 1 x 4 , 4 6 76,5x166,0x102,0 91,5x175,4x113,0 e r b m a h c a l e d n o i s n e m i D 49iltres(<1STE) 100iltres(~1.5STE) 150 iltres(~2.5STE) s e t r o p e l b u o D Non Non oui t r u o c e l c y C 45minutes 55minutes 75minutes(dépendde ) e g r a h c a l s t n e m u r t s n I g n o l e l c y C aucun 72minutes 105minutes Utiilserdesboosterspourendoscopeflexibleou e r è i m u l e r t u a n o i t a c i d n I petitshôpitaux hôpitauxdepetiteou e ll i a t e n n e y o m t e x u a n o t n a c x u a t i p ô h s e r i a t i s r e v i n u x u a t i p ô h n o i t a m r o f n e n i o s e B élevé élevé élevé Personnelspécialementquailfié. s t i t e p s u l p s e l s e r t è m a i D e n u r u o p s e l b i s s i m d a . a m s a l p u a n o i t a s il i r é t s s e é ll i a t é d s n o i t a m r o f n i s e d e n n o d i o l p m e ' d e d o m e L e n è l y h t é y l o p / n o l f é T lumière1-3mm g n o l m c 0 5 m u m i x a m m m 3 -1 e r è i m u l g n o l m c 0 5 m u m i x a m m m 3 -1 e r è i m u l g n o l m c 0 5 m u m i x a m e r t ê t n e v u e p s e u g n o l u o / t e s e t i o r t é s e r è i m u l s e D . r e t s o o b n u ' d n o i t c u d o r t n i' l r a p s e é s il i r é t s ! é i f il a u q l e n n o s r e P e n è l y h t é y l o p / n o l f é T /3mmmax.100cm /3mmmax.100cm /3mmmax.100cm x o n I /3mmmax.40cm /3mmmax.40cm /3mmmax.40cm s e l b i x e l f s e p o c s o d n E non oui,avecbooster /1mmà200cm r e t s o o b c e v a , i u o /1mmà200cm t s e t n a c i r b a f u d e t i r c é n o i t a m r i f n o c e n U é t il i b i t a p m o c a l r u o p e r i a s s e c é n A S U x u a é s i r o t u A oui Uniquementcyclecourt 0 0 0 2 n i u j s i u p e d n o n LesboostersnesontpasautorisésauxUSA 5 8 2 N E N S Stériilsation–Stériilsateursàlavapeur–Grosstériilsateurs 0 5 5 N E N S Stériilsationdesdispositifsmédicaux . e n è l y h t é ' d e d y x o 'l r a p e n i t u o r e d e l ô r t n o c t e n o i t a d il a v a l r u o p s e d o h t é M 2 5 5 N E N S Stériilsationdesdispositifsmédicaux–Méthodespourlavaildationetcontrôle . n o i t a i d a r r i r a p n o i t a s il i r é t s a l r u o p e n i t u o r e d 4 5 5 N E N S Stériilsationdesdispositifsmédicaux–Méthodespourlavaildationetcontrôle u a e ' d r u e p a v a l à n o i t a s il i r é t s a l r u o p e n i t u o r e d 6 5 5 N E N S Stériilsationdesdispositifsmédicaux–Exigencesdestériiltépourlesdispositifs " s e l i r é t s " s é t e u q i t é x u a c i d é m 1 -6 6 8 N E N S Systèmesbiologiquespour'lessaidesstériilsateurs 8 -6 6 8 – 2 -6 6 8 N E N S Systèmesbiologiquespour'lessaidesstériilsateurs 3 -7 6 8 – 1 -7 6 8 N E N S Systèmesnonbiologiquesdestinésàêtreutiilsésdanslesstériilsateurs 0 1 -8 6 8 – 1 -8 6 8 N E N S Matériauxd'emballagepourlastériilsationd'objetsemballés 7 3 9 4 1 O S I Steriilsationofmedicaldevices-Generalrequirementsforcharacterisationof a f o l o r t n o c e n i t u o r d n a n o i t a d il a v , t n e m p o l e v e d e h t d n a t n e g a g n i s il i r e t s s s e c o r p n o i t a s il i r e t s
Tableau 4 : Causes derreurs possible
Présence de résidus (sel, protéine ou graisse) réduisant la stérilisation de surface [4] Stérilisation de lumière dun diamètre inférieur à 1 mm
Tout le matériel doit être sec avant dêtre introduit (risque dinterruption du cycle, avec augmentation des coûts)
Non respect des recommandations concernant les lumières longues et/ou étroites Utilisation de matériel demballage inadéquat
Mauvais placement de la charge (contact avec la paroi de la chambre) Restérilisation de matériel à usage unique
Manipulation inadéquate des "boosters" Pour les instruments qui ont une lumière
longue ou étroite, on peut utiliser ce quon appelle des «boosters» qui peuvent être intro-duits dans la lumière et garantir localement la présence dune concentration appropriée de peroxyde dhydrogène. Ces "boosters" ne sont pas encore approuvés par la FDA. A lhôpital universitaire de Bâle, ils ne sont tolérés que dans certaines situations. Appliqués correcte-ment, ces «boosters» permettent une stérilisa-tion adéquate, mais une applicastérilisa-tion insuffi-sante ou inadéquate peut ne pas être remarquée par lutilisateur. La stérilisation dinstruments avec une lumière étroite et/ou longue est dailleurs explicitement exclue de ce mode de stérilisation par le fabricant.
Causes derreurs possibles
Un nettoyage mécanique suivi dune désin-fection sont des prérequis pour toute bonne stérilisation. Avec la stérilisation à la vapeur, il est rare que lon ait une stérilisation insuffi-sante même en présence de résidus. Le tableau 4 présente quelques causes de problèmes.
De telles erreurs peuvent cependant être évitées par une bonne formation continue du personnel. De plus, il faut établir un plan de travail qui tienne compte de ces problèmes éventuels.
Réutilisation de matériel à usage
unique
La réutilisation de matériel à usage unique nest pas autorisée en Suisse. Avec la stérilisa-tion au plasma, caractérisée par labsence de résidus toxiques et par une température de stérilisation basse, on pourrait être tenté de restériliser du matériel à usage unique. Les appareils à disposition permettent certaine-ment datteindre les exigences en matière def-ficacité antimicrobienne et des données sont dailleurs publiées. Cependant, lutilisation de ce mode de stérilisation particulier compte encore une série de problèmes non résolus : inocuité sur les matériaux, préservation de la
fonction, et surtout aspects médico-légaux. Dès lors, on ne devrait pas utiliser un appareil Sterrad pour restériliser du matériel à usage unique à lhôpital. Ce problème a été résumé dans un document de la FDA en octobre 2000, ( h t t p : / / w w w . f d a . g o v / c d r h / r e u s e / singleuse.pdf).
Amélioration possible
La compatibilité avec les instruments métal-liques nest pas encore totalement établie. La stérilisation centrale de chaque hôpital doit établir une liste "positive" (le procédé de sté-rilisation au plasma a été testé et est efficace) et une liste "négative" (inapproprié pour une stérilisation au plasma) sur la base des indica-tions des fabricants. Létablissement de telles listes est rendu nécessaire par le fait que des données nexistent pas pour tous les instru-ments. Dès lors, si un instrument ne figure ni dans la liste positive ni dans la liste négative, il convient de prendre contact avec le fabri-cant. Certains fabricants publient des données à ce sujet sur Internet. (http://www.karlstorz.de/ cl-sterr.htm)
Conclusions
En résumé, la stérilisation au plasma sim-pose progressivement et remplacera la stérili-sation par loxyde déthylène. Elle est appro-priée pour la plupart des instruments et
appa-reils thermolabiles. Ce procédé nécessite ce-pendant non seulement une formation du per-sonnel lors de son introduction dans un hôpital mais également une formation continue, pour éviter les erreurs importantes qui peuvent sur-venir plus facilement quavec la stérilisation à la vapeur.
Remarque: Le procédé Sterrad® est ineffi-cace contre les prions
Références
1. Widmer AF, Frei R. Decontamination, Disinfection, Sterilization, In: Murray PR et al. editors. Manual of Clinical Microbiology, 7 ed. ASM Press; 1999 ; p. 138-64.
2. Duffy RE et al. An epidemic of corneal destruction caused by plasma gas sterilization. Arch Ophthalmol 2000;118:1167-76.
3. Smith CA et al. Unexpected corneal endothelial cell decompensation after intraocular surgery with instruments sterilized by plasma gas. Ophthalmology 2000;107:1561-66.
4. Alfa MJ et al. Comparison of ion plasma, vaporized hydrogen peroxide, and 100% ethylene oxide sterilizers to the 12/88 ethylene oxide gas sterilizer Infect Control Hosp Epidemiol 1996;17:92-100.
Surveillance des infections nosocomiales : principes et application
(2ème partie)
Didier Pittet, Hugo Sax, Genève.
La surveillance des infections nosocomiales constitue lun des piliers dun programme de prévention. Cet article fait suite à une première partie (Swiss-NOSO 2000 ;7(3) :17-19) dans laquelle ont été abordés les aspects liés à lhistorique des activités de surveillance, aux définitions des infections nosocomiales, aux différentes méthodologies de surveillance et sources dinformation. Cette partie aborde les indices diagnostiques, les aspects de collecte, dorganisation, danalyse, de synthèse et de
restitution des informations. Le rôle de linfor-matisation des données, et en particulier des possibilités de développement dalertes infor-matisées appliquées à la surveillance est traité. Enfin, une aide à lévaluation des activités de surveillance est proposée.
Indices diagnostiques
Un grand nombre dindices ont été proposés afin de détecter les patients à risque ou
victi-mes dinfections nosocomiales; ces méthodes incluent individuellement ou de façon combi-née: la révision des données de laboratoire, du Kardex infirmier, de la courbe thermique, luti-lisation des antibiotiques, la réadmission de patients récemment hospitalisés, lanalyse des rapports dautopsie, la collaboration dinfir-mières de liaison dans les services (infirdinfir-mières travaillant dans les services désignées comme "répondant" et ayant reçu une formation intro-ductive à lhygiène hospitalière), ainsi que
* Germe sensible à un seul des antibiotiques habituellement testés
Tableau 10: Liste des germes qui peuvent être documentés dans le système dalerte lapproche basée sur la détection
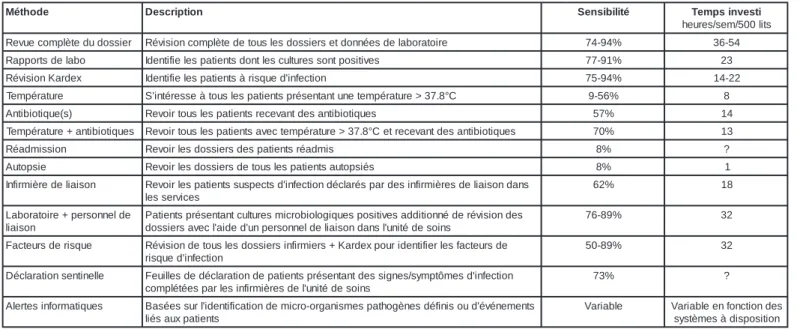
dévéne-ments sentinelles. Chaque paramètre varie de façon importante dans son degré defficience et son(leur) choix dépend des ressources et du temps mis à disposition du personnel à charge de la surveillance, ainsi que des conditions institutionnelles. En règle générale, plus le temps mis à disposition pour la surveillance est important, meilleure est la sensibilité de détection. Une série de méthodes utilisant dif-férentes approches et indices de détection des infections nosocomiales, ainsi que le temps investi dans chaque surveillance et sa sensibi-lité sont indiqués au tableau 9. Les modes de calcul de la sensibilité et de la spécificité des méthodes diagnostiques sont illustrés dans la Figure1; cette étape impose la conduite de deux approches en parallèle.
Collecte de données
La collecte dinformation doit être effectuée par un personnel spécialisé, de préférence ex-terne au service de soin. Une validation des données obtenues par le personnel en question doit être effectuée, en particulier au début. Une phase de pilotage et nécessaire afin de prati-quer les ajustements opportuns.
Les données recueillies varient en fonction des objectifs de la surveillance et du type dinfection surveillée. Enfin, la validation des systèmes ou des méthodes de surveillance mis en place doit être réalisée, en particulier, au moment de leur mise en route. Il apparaît donc fondamental de bien définir les objectifs de la surveillance, afin dévaluer les meilleurs para-mètres à suivre et à collecter et dattribuer les moyens adéquats en personnel, temps de tra-vail et outils logistiques, en fonction des ob-jectifs fixés.
Informatisation
Linformatisation toujours plus avancée des données médicales, infirmières, ou de
labora-e m r e G Précisions,restrictions ) A S R M ( e n il l i c i t e m a l à t n a t s i s é r s u e r u a s u c c o c o l y h p a t S x u a e r i a i d e m r e t n i é t il i b i s n e s e d s u e r u a s u c o c c o l y h p a t S ) A S I G ( s e d i t p e p o c y l g e r t c e p s à s e s a m a t c a l a t e b s e d t n a s i u d o r p s e i r é t c a b o r e t n E ) E S L B ( i g r a l é a l à u o e n i c y m o c n a v a l à t n a t s i s é r p s s u c c o c o r e t n E ) u a e v i n t u a h ( e n i c y m a t n e g s t n a t s i s é r i t l u m s e m r e G Préciserlesprofilsderésistanceàsurveiller* . p s a ll e n o i g e L Antigèneurinaireouculture e l i c i f f i d m u i d i r t s o l C Toxinedanslesselles m u n il u t o b m u i d i r t s o l C s i c a r h t n a s u ll i c a B e a i r e t h p i d m u i r e t c a b e n y r o C e a z n e u l f n i s u l i h p o m e a H Sitesstériles&gorge s i d i t i g n i n e m a i r e s s i e N Sitesstériles e a e o h r r o n o g a i r e s s i e N s i t s e p a i n i s r e Y e a r e l o h c o i r b i V . p s a ll e c u r B . p s r e t c a b o l y p m a C s i t a m o h c a r t a i d y m a l h C Tractusgénital e u q i g a r r o m é h o r é t n e il o c a i h c i r e h c s E verotoxin s e n e g o t y c o n o m a i r e t s i L . A e p u o r G s e n e g o y p . S Sitesstériles,frottisvaginaux B e p u o r G s e n e g o y p . S Unitédenéonatologie,secteurobstétrical . p s a ll e n o m l a S . p s a ll e g i h S e a i n o m u e n p s u c c o c o t p e r t S Sitesstériles s i s o l u c r e b u t m u i r e t c a b o c y M Examendirect,culture e u q i p y t a e i r é t c a b o c y M Examendirect,culture s i s s u t r e p a ll e t e d r o B . p s s u ll i g r e p s A A e t i t a p é H IgM B e t i t a p é H IgM,PCR H I V ?? e l o e g u o R IgM,culture e l o é b u R IgM,culture s n o ll i e r O IgM,culture e ll e c i r a V IgM,culture V S R Sécrétionrespiratoire s u r i v o v r a P IgM,culture s u r i v a t o R Selles
Tableau 9 : Méthodes didentification des patients infectés e d o h t é M Description Sensibilité Tempsinvesti s t il 0 0 5 / m e s / s e r u e h r e i s s o d u d e t è l p m o c e u v e R Révisioncomplètedetouslesdossiersetdonnéesdelaboratoire 74-94% 36-54 o b a l e d s t r o p p a R Identifielespatientsdontlesculturessontpositives 77-91% 23 x e d r a K n o i s i v é R Identifielespatientsàrisquedi'nfection 75-94% 14-22 e r u t a r é p m e T Si'ntéresseàtouslespatientsprésentantunetempérature>37.8°C 9-56% 8 ) s ( e u q i t o i b i t n A Revoirtouslespatientsrecevantdesantibiotiques 57% 14 s e u q i t o i b i t n a + e r u t a r é p m e T Revoirtouslespatientsavectempérature>37.8°Cetrecevantdesantibiotiques 70% 13 n o i s s i m d a é R Revoirlesdossiersdespatientsréadmis 8% ? e i s p o t u A Revoirlesdossiersdetouslespatientsautopsiés 8% 1 n o s i a il e d e r è i m r i f n I Revoirlespatientssuspectsdi'nfectiondéclaréspardesinfirmièresdeilaisondans s e c i v r e s s e l % 2 6 18 e d l e n n o s r e p + e r i o t a r o b a L n o s i a il s e d n o i s i v é r e d é n n o i t i d d a s e v i t i s o p s e u q i g o l o i b o r c i m s e r u t l u c t n a t n e s é r p s t n e i t a P s n i o s e d é t i n u 'l s n a d n o s i a il e d l e n n o s r e p n u ' d e d i a 'l c e v a s r e i s s o d % 9 8 -6 7 32 e u q s i r e d s r u e t c a F Révisiondetouslesdossiersinfirmiers+Kardexpouridentifierlesfacteursde n o i t c e f n i' d e u q s i r % 9 8 -0 5 32 e ll e n i t n e s n o i t a r a l c é D Feuillesdedéclarationdepatientsprésentantdessignes/symptômesdi'nfection s n i o s e d é t i n u 'l e d s e r è i m r i f n i s e l r a p s e é t é l p m o c % 3 7 ? s e u q i t a m r o f n i s e t r e l A Baséessurli'dentificationdemicro-organismespathogènesdéfinisoud'événements s t n e i t a p x u a s é il e l b a i r a V Variableenfonctiondes n o i t i s o p s i d à s e m è t s y s
Tableau 11 : Expression des taux dinfections nosocomiales
(*) Exemple pour une unité de réanimation ayant accueilli 24 patients au cours dune période de 7 jours ; parmi ces patients, 8 ont développé un total de 12 infections nosocomiales. La distribution des infections nosocomiales fut : 5 épisodes de pneumonies chez des patients intubés-ventilés ; 4 infections urinaires chez des patients sondés ; 2 bactériémies primaires chez des patients porteurs de cathéters vasculaires ; et une infection de site chirurgical. Tous les patients admis furent équipés daccès vasculaires (168 jours-cathéters au total), 20 dune sonde urinaire (120 jours-sonde urinaire), et 18 furent intubés pour 5 jours en moyenne (90 jours-tube oro/endo-trachéal).
(**) Lorsque linfection a eu lieu, le patient nest plus considéré comme étant à risque dinfections; ainsi les jour-patients qui suivent le jour de linfection en sont pas considérés au dénominateur. Cette démarche est utilisée également pour exprimer le risque spécifique à chaque type dinfection nosocomiale spécifiquement liée aux procédures invasives; par exemple, le calcul du risque de bactériémie liée au cathéter vasculaire ne considère que les journées dexposition qui ont précédé le jour de linfection. r u e t a r é m u N Dénominateur Taux Exemple(*) e c n e l a v é r P s t n e i t a p e d s é t c e f n i e n u c e v a s t n e i t a p e d e r b m o N e d t n e m o m u a e v i t c a n o i t c e f n i e t ê u q n e 'l e l s n a d s t n e s é r p s t n e i t a p e d e r b m o N e t ê u q n e 'l e d t n e m o m u a e c i v r e s s é t c e f n I s t n e s é r p s t n e i t a P % 0 5 = 6 1 / 8 e c n e l a v é r P s n o i t c e f n i' d u a s e v i t c a s n o i t c e f n i' d e r b m o N e t ê u q n e 'l e d t n e m o m e l s n a d s t n e s é r p s t n e i t a p e d e r b m o N e t ê u q n e 'l e d t n e m o m u a e c i v r e s s n o i t c e f n I s t n e s é r p s t n e i t a P % 5 7 = 6 1 / 2 1 e c n e d i c n I s t n e i t a p e d s é t c e f n i é p p o l e v é d t n a y a s t n e i t a p e d e r b m o N s r u o c u a s n o i t c e f n i s r u e i s u l p u o e n u e i n i f é d e d o i r é p e n u ' d é n r u o j é s t n a y a s t n e i t a p e d e r b m o N e m ê m a l e d s r u o c u a e c i v r e s e l s n a d e d o i r é p s é t c e f n I é n r u o j é s t n a y a s t n e i t a P % 3 3 = 4 2 / 8 e c n e d i c n I s n o i t c e f n i' d u o e n u ( s n o i t c e f n i' d l a t o t e r b m o N u a s e s i u q c a ) t n e i t a p r a p s r u e i s u l p e i n i f é d e d o i r é p e n u ' d s r u o c é n r u o j é s t n a y a s t n e i t a p e d e r b m o N e m ê m a l e d s r u o c u a e c i v r e s e l s n a d e d o i r é p s n o i t c e f n I t n a y a s t n e i t a p e d e r b m o N é n r u o j é s % 0 5 = 4 2 / 2 1 é t i s n e D e c n e d i c n i' d s n o i t c e f n i' d x u e i t c e f n i s e d o s i p é ' d l a t o t e r b m o N s i u q c a ) t n e i t a p r a p s r u e i s u l p u o n u ( e i n i f é d e d o i r é p e n u ' d s r u o c u a e l s n a d s t n e i t a p -r u o j e d l a t o t e r b m o N s p m e t e d e d o i r é p a l t e r u e t c e s s é r é d i s n o c x u e i t c e f n i s e d o s i p E s t n e i t a p -r u o J é t i s n e d e n u t i o s , 0 0 0 1 X 8 6 1 / 2 1 0 0 0 1 / s e d o s i p é 4 . 1 7 e d e c n e d i c n i' d s t n e i t a p -r u o j n o i s s e r p x E e u q s i r u d x u e i t c e f n i x u e i t c e f n i s e d o s i p é ' d l a t o t e r b m o N à t s e t n e i t a p e l e u q s r o l a s i u q c a ) * * ( n o i t c e f n i' d e u q s i r à s t n e i t a p -r u o j e d l a t o t e r b m o N ) * * ( s n o i t c e f n i' d e u q s i r x u e i t c e f n i s e d o s i p E e u q s i r à s t n e i t a p -r u o J x u e i t c e f n i e u q s i r n u t i o s 0 0 0 1 X 2 7 / 8 s t n e i t a p -r u o j 0 0 0 1 / s e d o s i p é 1 1 1 e d t e x u a T é t i s n e d e c n e d i c n i' d s e u q i f i c é p s x u e i t c e f n i s e d o s i p é ' d e r b m o N r u s e i m é i r é t c a b : x e ( s e u q i f i c é p s ) . . . , é b u t n i z e h c e i n o m u e n p ; r e t é h t a c e d o i r é p e n u ' d s r u o c u a s i u q c a e é n i m r e t é d -r u o j e d u o ( s t n e i t a p e d l a t o t e r b m o N x u a s é s o p x e ) s t n e i t a p s e u q i f i c é p s s n o i t a t n e m u r t s n i e b u t , s e r i a l u c s a v s r e t é h t a c ( ) e r i a n i r u e d n o s , l a é h c a r t o d n e / o r o ) * ( x u e i t c e f n i s e d o s i p E s é b u t n i , s é s i r é t é h t a c s t n e i t a P s é d n o s u o u o x u e i t c e f n i s e d o s i p E e c n e s é r p c e v a s t n e i t a p -r u o J , ) s ( e r i a l u c s a v ) s ( r e t é h t a c e d u o , l a é h c a r t -o d n e / o r o e b u t e r i a n i r u e d n o s : s r e t é h t a c u a e é i l e i m é i r é t c a B % 3 . 8 = 4 2 / 2 = e c n e d i c n I , 0 0 0 1 x 8 6 1 / 2 = e c n e d i c n i' d é t i s n e D s r e t é h t a c -r u o j 0 0 0 1 / s e d o s i p é 9 . 1 1 t i o s : n o i t a b u t n i à e é i l e i n o m u e n P % 1 2 = 4 2 / 5 = e c n e d i c n I , 0 0 0 1 x 0 9 / 5 = e c n e d i c n i' d é t i s n e D s r u o j 0 0 0 1 / s e d o s i p é 5 . 5 5 t i o s n o i t a b u t n i' d
Tableau 12 : Interprétation des taux dinfections. Exemple de limpact possible de changements de pratiques sur lestimation des taux dinfections nosocomiales e u q i t a r p e d t n e m e g n a h C Effetapparent - Transfertd'activitéhospitailèresurlesecteurambulatoire - Diminutiondutauxdi'nfectionencasd'absencedesurveillanceaprèsla r e il a t i p s o h r u e t c e s u d e i t r o s ouambulatoire - Diminutiondeladuréedeséjour -s e d e c n a ll i e v r u s e d e u q n a m r a p n o i t c e f n i' d l a b o l g x u a t u d n o i t u n i m i D e i t r o s s è r p a s n o i t a c il p m o c e d e é r u d a l t n o d s t n e i t a p s e l r a c n o i t c e f n i' d x u a t u d e v i t a l e r n o i t a t n e m g u A ) s é t c e f n i u o ( x u e i t c e f n i e u q s i r t u a h s u l p à t n o s e é g n a h c n i e r u e m e d r u o j é s - Diminutiondeladuréedeséjouraprèsinterventionchirurgicale - Diminutionrelativedutauxdi'nfectiondusitechirurgicalencasd'absencede e i t r o s a l s è r p a e c n a ll i e v r u s - Transfertdesactivitésdechirurgieélectiveensecteurambulatoire(one-day ) y r e g r u s - Augmentationdestauxdi'nfectiondusitechirurgical,carlesinterventionsplus x u a t n u à s e é i c o s s a t n o s ) n o i t a s il a t i p s o h e n u t n a u q il p m i c n o d ( s e d r u o l é v e l é s u l p n o i t c e f n i' d - Patientscomptabiilséscommeadmissionsàchaquetransfertinterne(d'une ) e r t u a 'l à e r è il a t i p s o h é t i n u - Diminutiondutauxdi'nfectionapparentparaugmentationartificielledu r u e t a n i m o n é d - Calculdedénominateur(ex:cathéters)basésurdonnéesadministratives e d e d o m e d t n e m e g n a h c t e ) . . . , s t a h c a ' d e l a r t n e c , e i c a m r a h p ( s e é s il a r t n e c ) s é s il i t u s r e t é h t a c s v s é u b i r t s i d s r e t é h t a c : x e r a p ( e t p m o c é d - Diminution(augmentation)dutauxdi'nfectionsassociéesauxcathéterspar r u e t a n i m o n é d u d e ll e i c i f i t r a ) n o i t u n i m i d ( n o i t a t n e m g u a - Tauxdi'nfectionattribuéauchirurgienprévupoureffectuerli'ntervention(etnon ) e é u t c e f f e a 'l i u q i u l e c - Tauxdi'nfectionparchirurgienininterprétable - Traitementempiriquedesinfectionssansexamenmicrobiologiqueà n o i t i s o p s i d - Diminutiondutauxdi'nfections;diminutionencoreplusimportantelorsquela s e u q i g o l o i b o r c i m s e é n n o d s e l r u s t n e m e ll e i t n e s s e e s o p e r s a c s e d n o i t c e t é d - Définitionsutiilséesdefaçoninconsistante - Tauxdi'nfectionsininterprétables - Absencededéfinitionsécrites - Tauxdi'nfectionsininterprétables - Diagnosticdi'nfectionsnosocomialesbasésurlescodagesDRGouICD - Diminutiondutauxdi'nfectionsetdonnéesabsolumentininterprétables - Absencedesurveillanceaprèslasortiedespatients(auminimum48h)des n o i t a m i n a é r e d s r u e t c e s - Diminutiondestauxdi'nfections,cellesenincubationdanslesjoursprécédant s e é s il i b a t p m o c s a p t n a t é ' n n o i t a m i n a é r e d e i t r o s a l - Observateurneconnaissantpasli'nstitutiondanslaquelleiltravaille - Diminutiondestauxdi'nfectionpardifficultéd'accèsàli'nformation - Décomptedi'nfectionsinclutlesbactériuriesasymptomatiques - Augmenteletauxdi'nfectionetmodifieladistributionrelativedesautres s n o i t c e f n i
Figure 1: Mesure de la sensibilité et spécificité des méthodes de surveillance des infections nosocomiales
toire, contribue à optimiser les processus de surveillance des infections nosocomiales, tout en réduisant leffort consenti dans la collec-tion de linformacollec-tion. La mise en place daler-tes informatisées visant par exemple à préve-nir immédiatement les équipes de prévention de lidentification des germes résistants ou du mouvement de patients colonisés ou infectés par de tels microorganismes, augmentent lef-ficience des mesures de contrôle mises en place.
Des exemples dalertes informatiques ba-sées sur les données microbiologiques sont donnés au tableau 10. Il est important déva-luer lapport possible des systèmes informati-sés aux mesures traditionnelles de surveillance et de prévention des infections nosocomiales pour que ceux-ci améliorent leur efficience pour le bien des patients et lintérêt des insti-tutions de soins et de la communauté en géné-ral. La participation précoce à la planification de tels réseaux permet denvisager une utilisa-tion optimale ensuite. Lintroducutilisa-tion des DRG (Diagnostic-Related-Groups), et linformati-sation de données telles que la raison dadmis-sion, les principales comorbidités et compli-cations, paramètres essentiels de mesure du case-mix, sont des priorités absolues afin dajustement des taux dinfections nosocomiales.
Organisation, analyse et synthèse
Lorganisation des données est fondamen-tale à la détection des problèmes. La collecte peut se faire sur papier ou être informatisée. La synthèse doit pouvoir être réalisée par le personnel en charge de la surveillance dans des délais courts, afin quune action, si néces-saire, puisse être entreprise.Les données doivent être analysées faute de quoi le temps (et les moyens) investis dans la surveillance sont gaspillés. Lanalyse et la synthèse doivent être réalisées aussi rapide-ment et fréquemrapide-ment que lexige le but fixé de la surveillance. La fréquence danalyse doit tenir compte de la balance entre les variations de taux liés à lépidémiologie et le seuil de détection des épidémies. Limportance en par-ticulier de lutilisation de dénominateurs ap-propriés afin de répertorier et de restituer les
1. Le système de surveillance a-til permis didentifier des épidémies ?
2. Quelles pratiques de soins ont-elles été modifiées suite aux données de surveillance ? 3. Les données ont-elles été utilisées pour mettre en place des mesures destinées à
réduire lincidence des infections endémiques ?
4. Les données de surveillance ont-elles été utilisées pour objectiver lefficacité de(des) lintervention(s) ?
5. La surveillance a-t-elle été conduite pour vérifier que les taux dinfections ne changent pas avec lintroduction de nouvelles procédures ?
6. Les départements cliniques et les organes administratifs sont-ils informés des résultats de la surveillance ?
7. Les activités de surveillance sont-elles avantageuses au plan coût-efficacité ?
Tableau 13 : Surveillance : évaluation.
Au minimum, une fois par an, répondre aux 7 questions
taux dinfections doit être reconnue et maîtri-sée. Le tableau 11 comprend les modes les plus fréquents de calculs des taux dinfections, associés à des exemples chiffrés.
Les procédures de comparaison statistique des taux dinfections ne peuvent pas être dé-taillées ici. Celles-ci doivent être réalisées par du personnel compétent et entraîné. La com-paraison des taux entre secteurs et des tendan-ces temporelles ne peut être interprétée que par du personnel expérimenté. A titre dexem-ple, le tableau 12 illustre des situations de changement de pratiques affectant les taux dinfections apparemment mesurés. Ces exem-ples sont des exemexem-ples simexem-ples, il est des situations plus perverses.
Restitution
La restitution de linformation est un des composants indispensables de la prévention des infections. Elle doit être faite aux person-nes intéressées et/ou disposant du pouvoir dinitier ou dentreprendre des actions de pré-vention, ainsi quau comité dhygiène/con-trôle de linfection et aux autres comités insti-tutionnels ad hoc. Les personnes clefs de cha-que service doivent bénéficier dun retour dinformation, mais la confidentialité de lin-formation est préférentiellement privilégiée entre les différents services institutionnels. Les rapports doivent être en principe simples, courts, synthétiques et didactiques, compre-nant si possible des graphiques clairs,
facili-tant la diffusion et lintégration de linformation.
Evaluation
Il est très important dévaluer régulièrement un système de surveillance par rapport à la validité de linformation générée, ainsi que son utilité, sa pertinence et son efficience. Une approche simple, permettant une estimation des derniers points, consiste à répondre pério-diquement aux questions figurant au tableau 13.
Conclusion
En conclusion, une grande variété de métho-dologies de surveillance sont disponibles; lef-ficience de chaque approche diffère. Le temps nécessaire à la collection de données varie dune institution à lautre. Plus le temps con-sacré à la collection est prolongé, plus la méthode est sensible. La méthode de référence demande au minimum 20 heures/250 lits/se-maine, mais elle est difficilement applicable. La reproductibilité et la validité de lapproche choisie doivent être testées. Linformatisation doit être envisagée et utilisée lorsque disponi-ble, pour réduire le temps de travail et amélio-rer lefficience. La surveillance dirigée (targeted) est le plus souvent recommandée. Enfin, les taux dinfections calculés doivent être ajustés pour lhétérogénéité de la popula-tion et la structure de soins considérée.
Références
1. Perl T. Surveillance, reporting, and the use of computers. In : Wenzel RP (ed), Prevention and Control of Nosocomial Infections, 3rd edition, 1997, Williams &Wilkins, chapitre 10, pages 127-161. 2. Farr B. What to do about a high endemic
rate of infection. In : Wenzel RP (ed), Prevention and Control of Nosocomial Infections, 3rd edition, 1997, Williams &Wilkins, chapitre 11, pages 163-173.
e c n e r é f é r e d e d o h t é M e d o h t é M Infecté Noninfecté é i f i t n e d I -Infecté a1 b1 é t c e f n i n o N - a2 b2 é i f i t n e d i n o N c d a1 d+b2 a +a +c1 2 b +b +d1 2 Sensibilité = Spécificité =
Moteur de recherche
Grâce à la publication complète de tous les numéros de Swiss-NOSO sur Internet, le lecteur a la possibilité d'accéder rapidement à un ancien article, visualisable en format html et pdf. Les articles sont classés par index chronologique, mais depuis peu un nouveau moteur de recherche est également offert permettant des recherches par mot clé avec combinaison booléenne (AND OR NOT). Les résultats sont affichés par ordre de pertinence. Notons qu'il est également possible de restreindre la recherche dans le titre uniquement pour augmenter la spécificité.
Mailing list Nosomail
Afin d'informer les lecteurs de la parution d'un nouveau numéro de Swiss-NOSO une liste de diffusion Nosomail a été également installée. Chacun peut s'inscrire à cette liste en adressant un e-mail à majordomo@.swiss-noso.ch en plaçant "subscribe nosomail" (sans les guillemets) dans le corps du message (pas de donnée dans l'entête ou l'objet du message). Le lecteur recevra ainsi régulièrement par e-mail des informations sur le domaine des infections hospitalières telles qu'annonces de congrès, nouveautés importantes, etc. Cette liste de diffusion est modérée, c'est-à-dire que seul le comité de Swiss-NOSO peut envoyer des messages évitant ainsi le risque d'être submergé par des messages inopportuns. Il est également possible de se désinscrire à tout moment en envoyant un e-mail à majordomo@www.swiss-noso.ch avec les mots "unsubscribe nosomail".
Alex Gnaegi Webmaster Swiss-NOSO
Nouveautés sur le site Internet de Swiss-NOSO
www.swiss-noso.ch
Articles intéressants
Endemic Pseudomonas aeruginosa
infection in a neonatal intensive
care unit
Foca M. et al. N Engl J Med 2000;
343: 695-700
Pseudomonas aeruginosa est une cause fré-quente dinfection nosocomiale, avec une mor-bidité et une mortalité importante. Des épidé-mies nosocomiales ont surtout été associées à des liquides de perfusion contaminés ou des appareils dassistance ventilatoire. Le person-nel na que rarement été impliqué. Larticle de Foca et al. rapporte une investigation épidémiologique initiée à la suite dune aug-mentation de cas colonisés et infectés par P. aeruginosa dans une unité de soins intensifs néonatale. Des cultures denvironnement, des instruments, des appareils ventilatoires ainsi que de tous les médicaments administrés sous
forme de solutés ont été effectuées. Les mains du personnel ont également été cultivées par immersion dans un liquide stérile. Sur une période de 2 ans, 11 souches différentes de P. aeruginosa ont été isolées chez 40 enfants. Pendant la période où lincidence était maxi-male, une souche A a été responsable de la colonisation/infection de 7/9 des enfants at-teints. Dans 10 cas, la présence de P. aeruginosa a été détectée sur les mains des médecins ou du personnel soignant, et dans 3 cas un 2ème con-trôle était également positif 2 semaines plus tard. La persistance de la colonisation a été mise en rapport avec des ongles artificiels dans un cas, la présence dune onychomycose dans un second cas et dune otite externe chronique dans le 3ème cas. Chez 17 enfants, le portage de la souche A corrélait avec 3 infir-mières dont lune était celle porteuse de lonychomycose et les deux autres avaient des cultures négatives. Au plan clinique, les auteurs indiquent que 47% des bactériémies à bacilles
à Gram négatif observées durant cette période étaient dus à P. aeruginosa. Etant donné que P. aeruginosa nest quun pathogène rare dans les unités de soins intensifs de néonatologie, il est important dentreprendre des investiga-tions épidémiologiques rapides lorsque lon observe un nombre accru de cas colonisés ou infectés. Cette étude suggère que les mains peuvent être la source de certaines souches de P. aeruginosa. La désinfection des mains est une des méthodes les plus simples et les plus importantes pour éviter la transmission de germes nosocomiaux. Léradication de patho-gènes par une désinfection des mains peut être difficile en présence dune dermatose ou dune onychomycose chronique. Le port dongles artificiels par le personnel devrait être évité dans la mesure où des publications toujours plus nombreuses démontrent leur rôle en tant que réservoir de pathogènes.
E. Bernasconi, P. Francioli
NB : le comité de Swiss-NOSO pense que lorigine ultime des P. aeruginosa de cette épidémie pourrait être le système de distribution deau. En effet le nombre de cultures réalisées pour exclure cette possibilité était relativement faible.
Swiss-NOSO est publié trimestriellement avec le soutien de l'Office Fédéral de la Santé Publique (OFSP) et de la Société Suisse d'Hygiène Hospitalière (SSHH).
Rédaction Patrick Francioli (Lausanne), Enos Bernasconi (Lugano), Kathrin Mühlemann (Bern), Didier Pittet (Genève), Pierre-Alain Raeber (OFSP), Christian Ruef (Zürich), Hans Siegrist (SSHH), Nicolas Troillet (Sion), Andreas F. Widmer (Bâle)
Mise en page tribu'architecture (Lausanne)
Correspondance Prof. P. Francioli, CHUV, 1011 Lausanne Internet http://www.hospvd.ch/swiss-noso
Une transmission de lhépatite C par aérosol na pas été décrit dans une telle situation, et est improbable. Les mesures dhygiène standard sont suffisantes et doivent être observées pendant toute lintervention. Comme lors de toute exposition potentielle à du sang ou à des sécrétions, il convient de porter des gants, une blouse, un masque et des lunettes de protection
Kathrin Mühlemann, Berne Un hémangione requiert un traitement au
laser Argon. La patiente souffre également dune hépatite C. Existe-t-il un risque signi-ficatif de transmission du virus par les aéro-sols générés au cours du traitement ? Quel-les sont Quel-les mesures dhygiène recomman-dées ?
P. C. Berne
Courrier des lecteurs
Selon lOFSP/SUVA, il est actuellement recommandé dobtenir une réponse anti-HBs>100 UI/L pour considérer le personnel médical/paramédical comme protégé. En-tre 10-100 UI/L, il faudrait pratiquer des injections annuelles pour maintenir lim-munité.
Toutefois, les recommandations de lACIP*, mentionnent quune réponse anti-HBs supérieure à 10 UI/L définit la réponse au vaccin et quaucune mesure supplémen-taire nest indiquée dans ces cas, même en cas dexposition.
Dès lors, quelle attitude adopter ? F. Zysset, Lausanne * Immunization of Health-Care Workers. Recommendations of the Advisory Committee on Immunization Practices (ACIP) and the Hospital Infection Control Practices Advisory Committee (HICPAC). MMWR 1997 / Vol. 46 / No. RR-18
Les recommandations de lACIP étaient déjà connues lors de la formulation des recomman-dations suisses actuelles. Il est essentiel de préciser les éléments suivants qui sont souvent mal compris.
1. Une concentration danticorps anti-HBs supérieure à 10 UI/L protège contre lhépatite B (limite reconnue internationalement)
2. Après une vaccination complète (0,1,6), une concentration anti-HBs entre 10 et 100 UI/L définit le groupe des «faibles répondeurs». Ces personnes sont également protégées aussi longtemps que les anti-HBs restent supérieurs à 10 UI/L. En revanche leur protection est incertaine lorsque ces anticorps ne sont plus détectables, lefficacité de la protection à long terme reposant essentiellement sur la persistance dune mémoire immunologique capable dinduire très rapidement une réponse humorale en cas dexposition au virus. En revanche, on considère que les personnes qui ont réussi à monter une concentration danticorps au-dessus de 100 UI/L disposent dune mémoire immunologique leur conférant une protection de longue durée (la durée de cette protection reste dailleurs encore à déterminer, les études épidémiologiques ayant actuellement un recul de 15 ans environ). La limite de 100 UI/L est bien sûr arbitraire. Hormis les cas dinfection chez les non-répondeurs, de rares cas dinfection chronique ont également été rapportés chez des personnes avec des anti-HBs inférieurs à 100 UI/L après vaccination, raison du choix suisse (qui est dailleurs également celui de la Grande-Bretagne et des Pays-Bas). On peut discuter sur le bien-fondé dune telle limite, mais il nous semble néanmoins important de la maintenir pour le personnel médical/ paramédical compte tenu du fait quil sagit dun risque professionnel et que nous ne conseillons plus aucun rappel chez les répondeurs. Il faut donc que les personnes de ce groupe professionnel soient vraiment des répondeurs et non des cas limites.
3. La limite de 100 UI/L ne concerne évidemment que les personnes avec un contrôle sérologique pratiqué dans les 6 mois après la dernière injection dune vaccination complète. Elle nest plus valable chez les personnes vaccinées de longue date et dont les anticorps ont forcément décliné. Une attitude pragmatique est de mise dans ces situations (rappel selon la concentration des anticorps et le temps écoulé depuis la dernière vaccination: par exemple si une personne a encore 50 UI/L cinq ans après la vaccination, il est fort probable que la concentration était largement supérieure à 100 UI/L si un contrôle avait été effectué, donc pas de rappel).
R. Kammerlander Office Fédéral de la Santé Publique