ةرازو ميلعتلا يلاعلا و ثحبلا يملعلا
République Algérienne Démocratique et Populaire
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique ةعماج دمحم قيدصلا نب ىيحي - لجيج
-Université Mohamed Seddik Ben Yahia - jijel-
Faculté des Sciences de la
Nature et de la Vie ةايحلا و ةعيبطلا مولع ةيلك
Département Biologie ةيولخلا و ةئيزجلا ايجولويبلا مسق
Moléculaire et Cellulaire
Mémoire de fin d’étude
En vue de l’obtention du diplôme : Master Académique en Biologie
Option : Biologie Moléculaire et Cellulaire
Thème :
Activité antioxydante et
antibactérienne de la plante Allium
cepa
Présenté par : Mme Nabila BRIBER
Devant le jury composé de :
Présidente : Dr ROUIBAH Hassiba
Examinatrice: Dr BOURIDAN Hamida
Encadreur : Dr AMIRA Widad
Année universitaire 2019-2020
En premier lieu, je remercie Allah tout puissant de m’avoir donné le
courage et santé pour réaliser ce travail.
J’exprime ma profonde reconnaissance et mes vifs remerciements à
Mme Widad AMIRA qui m’a honoré en acceptant de diriger ce travail, pour sa
disponibilité et sa simplicité et surtout pour sa patience dans la correction de ce
mémoire. Madame, j’ai été satisfaite de votre qualité de bonne enseignante, je
ne peux que sincèrement vous exprimer mon profond respect et ma gratitude.
Mes vifs remerciements vont à tous ceux qui ont accepté d’associer leurs
compétences et leur savoir afin de juger ce travail :
A Mme BOURIDANE Hamida d’avoir accepté de faire partie de jury.
A Mme ROUIBAH Hassiba qui m’a fait l’honneur de présider le jury de ce
travail.
J’ai sincère gratitude à Pr. RECHRECHE Hocine qui par qui cette étude est
devenue possible
.A mes très chers parents
A ma mère
Je dédie tout particulièrement ce travail à ma mère, symbole de tendresse et de sacrifice pour son
soutien morale et assistance inestimable pendant toutes mes longues années d’études et pour tout
l’amour qu’elle ma donnée pour tout ça Merci maman. Que dieu te garde pour nous.
A mon père
Aucune dédicace ne saurait être assez éloquente pour exprimer ce que vous méritez pour tous les
sacrifices que vous n’avez cessé de consentir, vous avez fait plus qu’aucun père n’a fait pour que
ses enfants suivent le bon chemin, je vous dédie ce travail en témoignage de mon profond respect et
amour. Que dieu te garde pour nous.
A mon cher mari
A l’ombre de mes pas, celui qui m’a tout donné Amour, confiance et sécurité ; il s’agit bien de toi
mon cher mari Naim : Ton soutien indéfectible, ton sourire et ta joie de vivre m’ont été très
précieux, merci chéri.
A ma chère fille Khadidja
A mes frères et toutes mes chères sœurs et tous les petits-enfants A ma belle-mère et mon beau-père et toute la famille Bouzenad et grand-mère
A toute ma famille Briber A mes chers amis
A tous ceux qui me sont chers A tous ceux qui aiment la science Je dédie ce modeste mémoire
A, B1, C, D3, K : Vitamines. A.cepa : allium cepa.
ADN : Adénosine désoxyribonucléique. CAT : catalase.
(CH3CH2OH) : l’éthanol.
(CH3CH (O2•)OH) : radicaux peroxyles. Cl2 : Dichlorine.
DPPH : d'hydrogène au radical. ERO : espèces réactives oxygénées.
FAO : Food and Agriculture Organization of the United Nations.
FRO : Formes Réactives de l’Oxygène.
(GSH-Px) : glutathion peroxydase. (GSH) :glutathion réduit.
H2O2 :pyroxyde d’hydrogène. HO2• :Radical perhydroxyle. HOCL : L'acide hypochloreux. l'HE : huile essentielle.
l'HEs : des huiles essentielles.
LDL : Les lipoprotéines de basse densité. (LPS) : lipo-polysaccharides.
(MPO) : myéloperoxydase.
(3-MP) : 3-mercapto-2-méthylpantan-1-ol.
NADPH-oxydase :(nicotinamide adénine di nucléotide phosphate oxydase). N2 : l’azote.
NO : monoxyde d'azote. O2 : L'oxygène.
(O2°) : l’anion superoxyde . 1O2 : l’oxygène singulet. (°OH) : radical hydroxyle. ONOO : peroxynitrite. (ONOOH) : le nitroperoxyde.
RONS : (reactive oxygen and nitrogen species). RO2° : Radical peroxyle.
(ROO°) : le radical peroxyle. (RO°) : le radical alkoxyle. ROS : reactive oxygen species. SOD : La superoxyde dismutase.
Liste des figures et des tableaux
Liste des figures
N
Titre
page
01 Description morphologique de l’oignon 08 02 Structure des flavonoides identifiés de l’oignon rouge 11 03 Structure des anthocyanes identifiées des oignons rouges 12
04 Schéma d’une bactérie 15
05 Paroi cellulaire à Gram négatif 16
06 Paroi cellulaire des bactéries Gram positif et Gram négatif 17 07 Cellulebactérienne et modes d’action des antibiotiques 18 08 Les différents mécanismes de la résistance aux antibiotiques 20 09 Origine des différents radicaux libres oxygénés et espèces réactives
de l’oxygène impliqué en biologie
26
10 Le stress oxydant, toute une question d’équilibre 28
Liste des tableaux
N
Titre
Page
01
Liste des principales familles de métabolites primaires
04
02
Liste des principales familles de métabolites secondaires
Remerciements Dédicaces
Table des matières Liste des abréviations Liste des figures Liste des tableaux
Introduction……….. Synthèse bibliographique
Chapitre I. Généralités sur les plantes médicinales
I. Introduction……….………... II.Métabolites des plantes médicinales ... II. 1. Les métabolites primaires……… II. 2. Les métabolites secondaires ... II.2.1. Les polyphenoles……… II.2.2. composés soufrés……….…… ….. II.2.3. Les terpènes……… II.2.4. Les Alcaloïdes ………... III. Notion sur la plante « Allium cepa»………. III.1. Description botanique ……….. III.2. Répartition géographique……….. III.3.Classification……… …………... III. 4.Phytochimie et éléments actif de l’ Allium cepa………... III. 5.Utilisation et effet thérapeutique de la plante………...……. III.6. Composision chimique de l’Allium cepa ……….. Chapitre II. L’activité antibactérienne de l’Allium cepa
I. Monde bactérien………...…… I.2. Bactéries Gram positive et Gram négative………..……... II. les antibiotiques………...……… II.1. Modes d’action des antibiotiques………..….. II.2. La résistance aux antibiotiques……….…... II.2.1.Principaux mécanismes de résistance aux antibiotiques……….…. III.Les plantes médicinales comme source antibactérien………....……….. IV.L’activité antibactérienne du plane Allium cepa………....…….……... V. L es mécanismes antibactériennes d’Allium cepa……….
Chapitre III. Activité antioxydante de l'Allium cepa
I. Introduction………..….…….. II. Radicaux libres ………...……….. II.1.Les ERO radicalaires……….……... II. 1 .1. Radical superoxyde O2•-………..…… II.1 .2. Radical perhydroxyle HO2•………... II . 1 .3. Radical hydroxyle OH• ………..
1 3 3 4 4 5 6 7 7 7 7 8 9 9 9 10 14 15 17 17 18 19 20 21 23 25 25 26 26 26 27
II. 2. 1. Peroxyde d’hydrogène (H2O2)………. III. Stress oxydatif………....…
III .1. Causes du stress oxydatif
………
III. 2. Origine du stress oxydant ……….. III .3. Les antioxydants………. III. 4. Stress oxydant et pathologies humaines………. III .5. Activité antioxydante ………....….. III
.6.
les mécanismes antioxydant d’Allium cepa…...
Conclusion Références bibliographique Résumé 27 27 28 29 30 31 32 341
Introduction Depuis des milliers d'années, l'humanité a utilisé diverses ressources trouvées dans son environnement afin de traiter et de soigner toutes sortes de maladies (Abedini, 2014). La connaissance des plantes et l’étude de leurs propriétés, leurs effets thérapeutiques se révèlent une nécessité primordiale, pour découvrir de nouveaux principes actifs pouvant annoncer une révolution de la médecine (Chebaibi et al., 2016). L’étude de la chimie des plantes est toujours d’une brûlante actualité malgré son ancienneté. Cela tient principalement au fait que le règne végétal représente une source importante d’une immense variété de molécules bioactives. Cette matière végétale contient un grand nombre de molécules qui ont des intérêts multiples mis à profit dans l’industrie, en alimentation, en cosmétologie et en dermopharmacie. Parmi ces composés on retrouve, les coumarines, les alcaloïdes, les acides phénoliques, les tanins, les lignanes, les terpènes et les flavonoïdes (Abedini, 2014).
La recherche incessante de nouveaux médicaments à partir de plantes a conduit à la découverte de nombreux métabolites avec un potentiel de développement de médicaments par l'isolement, l'élucidation de la structure, la composition et l'évaluation de la bioactivité basée sur la composition phytochimique et les utilisations en médecine traditionnelle ( Nascimento et al., 2020).
Au cours des dernières années, la résistance aux antibiotiques chez les micro-organismes pathogènes est devenue un problème de santé publique de plus en plus important dans le monde. Les composés antimicrobiens issus des plantes sont capables d’inhiber la croissance bactérienne en agissant sur des cibles cellulaires différentes de celles visées par les 13 antibiotiques actuellement utilisés tels que les pénicillines, macrolides ou tétracyclines (Abedini, 2014).
Les antioxydants naturels sont largement distribués dans les plantes alimentaires et médicinales. Ces antioxydants naturels, en particulier les polyphénols et les caroténoïdes, présentent une large gamme d'effets biologiques, y compris anti-inflammatoires, anti-âge, anti-athérosclérose et anticancéreux. L'extraction efficace et l'évaluation appropriée des antioxydants des plantes alimentaires et médicinales sont essentielles pour explorer les sources potentielles d'antioxydants et promouvoir
2
l'application dans les aliments fonctionnels, les produits pharmaceutiques et les additifs alimentaires (Ping et al., 2017).
Notre intérêt s’est porté sur L'oignon commun (Allium cepa L.). Un légume cultivé dans le monde entier utilisé à la fois comme aliment et également dans le domaine de la santé pour la présence de molécules bioactives dotées principalement d'une activité antioxydante et antibactérienne (Pagano et al ., 2020).
Le but de ce travail s’inscrit dans le cadre général de la valorisation des plantes médicinales, son objectif vise à démontrer les propriétés antimicrobiennes et antioxydantes de l’allium cepa, en raison de leur richesse en composés bioactifs.
La problématique dans ce travail est-ce que l’Allium cepa a une activité antioxydante et antibactérienne?
Notre travail est divisé en trois chapitres :
Le premier concerne des généralités sur les plantes médicinale avec description détaillée de la plante étudiée « Allium cepa ».
Le deuxième démontre des généralités sur le monde bactérien et l’activité antibactérienne de l’Allium cepa.
Alors que le troisième chapitre présente des notions sur le stress oxydatif et l’activité antioxydante de la plante étudiée.
Chapitre I : Généralités sur les plantes
3
I. Introduction
L'homme et les plantes vivent côte à côte depuis des dizaines de milliers d'années. Il est habitué à consommer et à digérer différentes espèces de plantes, qui sont bien souvent appréciées pour leurs qualités aussi bien médicinales que nutritives. La ligne de démarcation entre les propriétés nutritives et les propriétés curatives n'est pas toujours très nette (Iserin et al., 2001).
Les plantes médicinales sont utilisées depuis des siècles pour traiter différentes maladies. Elles peuvent êtresource de nouvelles molécules bio-médicaments. Cependant, l’usage de plantes médicinales peut apporter directement des réponses à certains problèmes de Santé. (Babali, 2012).
Dans le monde, les plantes ont toujours été utilisées comme médicaments. Ces derniers à base de plantes sont considérés comme peu toxiques et doux par rapport aux médicaments pharmaceutiques. Ainsi, Les industries pharmaceutiques sont de plus en plus intéressées par l’étude ethnobotanique des plantes (Dibong et al., 2011).
L'Algérie par son climat (méditerranéen, aride) et la nature de ses sols, possède une flore particulièrement riche en plantes médicinales et aromatiques dont la plupart existe à l'état spontané. La valorisation des plantes médicinales et aromatiques est un domaine particulièrement intéressant à développer car c'est une source de produits à haute valeur ajoutée (Felidj et al., 2010).
II. Métabolites des plantes médicinales
Le règne végétal produit collectivement des centaines de milliers de molécules organiques de faible poids moléculaire traditionnellement appelées métabolites secondaires. Ces métabolites ont été largement utilisés tout au long de l'histoire de l'humanité comme médicaments, épices, parfums, cosmétiques et agents antiparasitaires, ainsi que dans les rituels religieux et culturels (Gaurav et al., 2015).
Au cours des 150 dernières années, l'accent a été mis sur la documentation de la diversité chimique des métabolites secondaires dans le règne végétal, conduisant à la découverte de diverses classes de composés tels que les terpènes, les flavonoïdes, les alcaloïdes, les phénylpropanoïdes, les glucosinolates et les polycétides. Ces composés secondaires étaient historiquement différenciés des produits du métabolisme primaire, tels
4
que les sucres, les acides aminés, les acides nucléiques et les acides gras, comme étant non essentiels à la survie des plantes (Gaurav et al., 2015).
Les constituants du métabolome des végétaux ont été classés en deux catégories de métabolites en fonction de leur rôle au sein de l’organisme : les métabolites primaires et les métabolites secondaires (Fernandez., 2019).
II.1. Les métabolites primaires
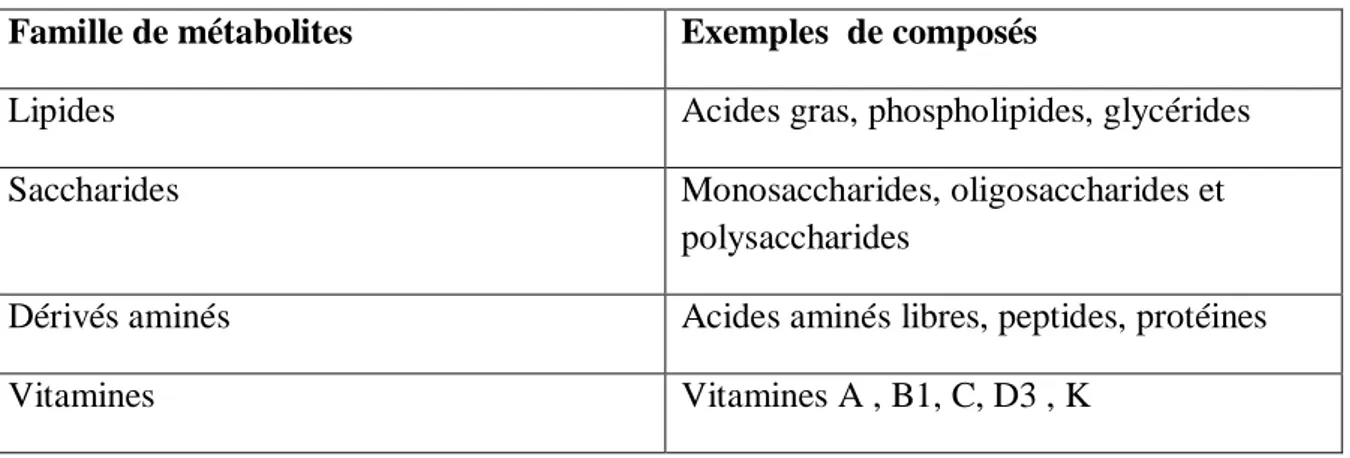
Le métabolisme primaire comprend tous les constituants du végétal qui sont indispensables à sa reproduction, à son développement et à son bon état de fonctionnement (métabolisme général). Parmi ces métabolites primaires (Tableau 1) :
Tableau 1: Liste des principales familles de métabolites primaires (Fernandez., 2019).
Famille de métabolites Exemples de composés
Lipides Acides gras, phospholipides, glycérides
Saccharides Monosaccharides, oligosaccharides et
polysaccharides
Dérivés aminés Acides aminés libres, peptides, protéines
Vitamines Vitamines A , B1, C, D3 , K
II.2. Les métabolites secondaires
La production des métabolites secondaires par les plantes est considérée comme une capacité d'adaptation pour faire face aux contraintes stressantes dans un environnement de croissance difficile et changeant qui peut impliquer la production de types chimiques complexes et d'interactions dans la stabilisation structurelle et fonctionnelle par le biais de processus et de voies de signalisation (Mollavali et al., 2017).
Un grand nombre de molécules secondaires sont biosynthétisées à partir de métabolites primaires et accumulées dans les cellules végétales (Mollavali et al., 2017). Parmi ces métabolites secondaires (Tableau 2) :
5
Tableau 2: Liste des principales familles de métabolites secondaires (Fernandez. 2019).
Famille de métabolites Exemple de composés
Polyphénols Flavonoïdes, Anthraquinones, Acides
cinnamiques, Coumarines, Xanthones …
Terpènes Monoterpènes, Iridoïdes, Diterpènes,
Triterpènes, Saponosides, …
Composés soufrés Thiosulfinates, Glucosinolates, Sulfoxides, …
Alcaloïdes Isoquinoléines, Pyrrolizidines, Indoliques,
Bases puriques, ...
II.2.1. Les polyphénols
Les composés phénoliques ou polyphénols sont des métabolites secondaires caractérisés par la présence d’un cycle aromatique portant des groupements hydroxyles libres ou engagés avec un glucide. Ils sont présents dans toutes les parties des végétaux supérieurs (racines, tiges, feuilles, fleurs, pollens, fruits, graines et bois) et sont impliqués dans de nombreux processus physiologiques comme la croissance cellulaire, la rhizogenèse, la germination des graines ou la maturation des fruits. Les plus représentés sont les anthocyanes, les flavonoïdes et les tannins (Boizot et Charpentier., 2006).
Les polyphénols possèdent un large éventail d’activités biologiques in vitro (antibactériennes, anti-cancérigène, anti-inflammatoire, antioxydante etc…) liées à leur caractère réducteur et à leur affinité pour les protéines et les ions métalliques. Les polyphénols présentant ainsi des propriétés antioxydantes bien établies et en lien avec l’inhibition de l’oxydation aussi bien dans le domaine alimentaire (oxydation des lipides) que physiologique (stress oxydant) (Achat, 2013).
Les flavonoïdes sont des substances phénoliques hydroxylées et sont connus pour être synthétisés par les plantes en réponse à une infection. L'intérêt récent pour ces substances a été stimulé par les bienfaits potentiels pour la santé découlant des activités antioxydantes de ces composés polyphénoliques. Les groupes hydroxyle fonctionnels des flavonoïdes médient leurs effets antioxydants en piégeant les radicaux libres et / ou en chélatant les ions métalliques. La chélation des métaux pourrait être cruciale dans la
6
prévention de la génération de radicaux qui endommagent les biomolécules cibles. En tant que composant diététique Les flavonoïdes sont situés dans le noyau des cellules mésophylles et dans les centres de génération de reactive oxygen species (ROS). Ils régulent également les facteurs de croissance des plantes comme l'auxine. Des gènes biosynthétiques ont été assemblés dans plusieurs bactéries et champignons pour améliorer la production de flavonoïdes. Les fonctions des flavonoïdes dans les plantes et leur production microbienne ont également été décrites (Kumar et Abhay., 2013).
II.2.2. Composés soufrés
Les composés contenant du soufre constituent un groupe important en raison de leur abondance et de leur impact aromatique. Le soufre est un élément essentiel présent en particulier dans deux acides aminés : la cystéine et la méthionine. Les produits de décomposition de ces molécules organiques sont des constituants volatils d'hydrure et d'alkyl-soufre tels que les thiols, les sulfures (disulfures, trisulfures, etc.) (Kremr et al., 2015).
Le soufre contient des particules de faible poids moléculaire qui sont communes dans la nature, des bactéries aux plantes, aux champignons et aux animaux, jouant un rôle essentiel dans la biologie des cellules. En effet, les atomes de soufre peuvent être impliqués dans une grande variété de réactions en raison de leurs propriétés chimiques uniques, comme le nombre élevé d'états d'oxydation qui peuvent former différents chémotypes avec différentes fonctions, y compris l'activité redox, la liaison aux métaux et la catalyse. Les activités redox du soufre sont attribuées à sa grande réactivité contre les ROS et NO, par la formation de radicaux, empêchant les dommages oxydatifs, et les nitrosothiols, médiateurs clés de la signalisation du NO, ayant un impact physiologique et thérapeutique dans de nombreux tissus, dont le foie. Ensuite, les propriétés des groupes sulfydryle confèrent des activités biologiques majeures aux produits naturels soufrés(Milito et al., 2019).
II.2.3. Les terpènes
Les terpènes, également connus sous le nom d'isoprénoïdes, constituent le groupe le plus grand et le plus diversifié de composés naturels que l'on trouve principalement dans les plantes, mais des classes plus importantes de terpènes tels que les stérols et le squalène peuvent être trouvées chez les animaux. Ils sont responsables du parfum, du goût et du pigment des plantes. En général, les terpènes présentent des activités cytotoxiques contre
7
un large éventail d'organismes, allant des bactéries et champignons aux insectes et vertébrés et ont été largement utilisés en phytothérapie contre les infections. De nombreux terpènes sont même efficaces contre les virus à membrane. les terpénoïdes sont largement présents dans les extraits de plantes médicinales (Joshee et al., 2019).
II.2.4. Les Alcaloïdes
Les alcaloïdes font partis des métabolites secondaires les plus actifs et largement distribués dans le règne végétal (en particulier chez les angiospermes). Leurs structures contiennent un ou plusieurs atomes d'azote soit dans une structure cyclique (vrais alcaloïdes) soit dans une chaîne latérale (pseudoalcaloïdes). Les alcaloïdes sont tristement célèbres en tant que toxines animales et servent certainement principalement de produits chimiques de défense contre les prédateurs (herbivores, carnivores) et dans une moindre mesure contre les bactéries, les champignons et les virus. Les cibles moléculaires des alcaloïdes et des amines sont souvent des neurorécepteurs, ou elles modulent d'autres étapes de la transduction du signal neuronal, y compris les canaux ioniques ou les enzymes, qui absorbent ou métabolisent les neurotransmetteurs ou les seconds messagers. D'autres alcaloïdes sont mutagènes en ce qu'ils intercalent ou alkylent l'ADN. Plusieurs alcaloïdes qui interfèrent avec l'ADN, les télomères, la télomérase, la topoisomérase, le cytosquelette ou la biosynthèse des protéines induisent l'apoptose (Wink., 2015).
III. Notions sur la plante « Allium cepa» III.1. Description botanique
L'espèce Allium cepa, communément appelée oignon, fait partie de la famille des Liliacées (Iserin et al., 2001). C’est une plante, vivace, bisannuelle à racines adventives et fibreuses et 3–8 feuilles distiques et glauques. Le bulbe est constitué de bases de feuilles charnues concentriques et élargies. La base externe des feuilles sèche et devient mince et de différentes couleurs, formant la couche protectrice, tandis que les bases internes des feuilles s'épaississent lorsque le bulbe se développe. Le bulbe mature peut être globuleux, ovoïde ou allongé et sa taille varie selon le cultivar (Marrelli et al., 2019). La figure 1 : montre les composants morphologique des parties de la plante d'oignon.
8
Figure 01: Description morphologique de l’oignon.
III.2. Répartition géographique
Allium cepa est une plante bulbeuse largement cultivée dans presque tous les pays du monde. Selon les dernières statistiques disponibles de la FAO, en 2016, les principaux producteurs d'oignons étaient la Chine (23 849 053 tonnes) et l'Inde (19 415 425 t), suivies par l'Égypte et les États-Unis (environ 3 000 000 t), l'Iran, la Turquie, la Fédération de Russie et le Pakistan. , Bangladesh et Brésil (de 2 345 768 à 1 657 441 t). Les oignons produits dans les pays européens représentaient 10,9% de la production mondiale, l'Asie (65,5%) étant le producteur le plus important (Marrelli et al., 2019).
III.3. Classification
La place de l’espèce Allium cepa dans la classification systématique botanique est la suivante (Boukeria, 2017) :
Règne: Plante
Sous règne : Trachéophyte = plantes vasculaires
Embranchement : Spermatophytes ou Phanérogames = plantes à graines Sous embranchement : Angiospermes = plantes à fleurs
9
Sous classe : Liliidae Ordre : Liliales
Famille : Liliaceae ou Liliacées Genre : Allium
Espèce : Allium cepa L. Nom commun : Oignon
Nom en anglais : Onion
III.4. Phytochimie et éléments actif de l’Allium cepa
Cette espèce est connu pour contenir de nombreux compositions phytochimiques, tels que les caroténoïdes, copaènes, flavonoïdes, minéraux, phénoliques, composés organosulfurés, phytoestrogènes, terpénoïdes, vitamines, anthocyanes et acides aminés (Ouyang et al., 2018).
L'oignon ( Allium cepa ) est l'une des sources végétales les plus importantes de polyphénols en raison de sa forte teneur en flavonoïdes. Parmi les flavonoïdes de l'oignon, la quercétine et ses glucosides représentent 70% des flavonoïdes totaux des oignons. Les autres flavonoïdes présents en faible quantité sont le kaempférol, la rutine et leurs dérivés (Hossain et al., 2018).
III.5. Utilisation et effet thérapeutique de la plante
L'oignon est riche en plusieurs phytonutriments reconnus comme des éléments importants du régime méditerranéen, mais il a également fait l'objet d'une attention particulière pour ses propriétés biologiques et son application potentielle dans le traitement et la prévention d'un certain nombre de maladies (Marrelli et al., 2019).
Le bulbe d'oignon est utilisé à la fois comme légume et comme arôme. Le bulbe se consomme cru ou cuit. Les feuilles et les fleurs de la plante sont également comestibles et sont souvent utilisées dans les salades. L'oignon est utilisé comme aliment et épice dans les régimes alimentaires de presque toutes les zones culturelles (Marrelli et al., 2019). Malgré l'utilisation prédominante de cette plante comme aliment, un large éventail d'effets bénéfiques a également été prouvé. Différentes propriétés biologiques, telles que antioxydantes, antimicrobienne et antidiabétique, ont été rapportées (Marrelli et al.,
10
2019). L’Allium cepa L (oignon rouge) est connu pour être un puissant piégeur de radicaux libres (Jeje et al., 2020) .
La recherche scientifique a montré que l’oignon a aussi diverses vertus médicinales : diurétique, antibiotique en usage externe, anti-inflammatoire, expectorante et antirhumatismale. Il soulage la douleur et stimule la circulation. On le prescrit contre le rhume, la toux et la grippe. L’oignon diminuerait la fréquence des angines et préviendrait l'artériosclérose. Chaud, le jus d'oignon atténuerait les maux d'oreilles. En cataplasme, il drainerait les plaies, On lui prête également des vertus aphrodisiaques. L'industrie cosmétique l'utilise pour favoriser la pousse des cheveux (Iserin et al., 2001).
III.6. Composision chimique de l’Allium cepa
Les oignons ( Allium cepa L.) contiennent à la fois des composés phénoliques et des composés soufrés tels que les thiosulfinates et les thiosulfonates. Ces composés sont responsables de la saveur et de l'arôme caractéristiques des oignons. (Koh et Surh., 2016). La matière sèche de l'oignon indique que l'oignon contient 91,60% de composés volatils, qui comprend en grande partie de l'eau (Sharma et Lee, 2015). Les bulbes d'oignon contiennent des glucosyltransférases, Ils contiennent également des glucosidases, et les glucides non structuraux sont constitués de glucose, fructose, saccharose et fructooligosaccharides (Sharma et Lee, 2015).
Les oignons sont une source très riche de flavonoïdes, principalement les mono- et diglucosides de quercétine, le kaempférol, l'isorhamnetine et la myricétine. Les flavonoïdes sont responsables de la couleur de la peau d'oignon. Ils possèdent une forte activité antioxydante qui en fait l'un des meilleurs antioxydants et piégeurs de radicaux libres. (Fredotović et al ., 2020).
Selon une étude réalisée par Ouedraogo et al, 2015, les données recueillies par le dosage des polyphénols et la mesure du potentiel antioxydant des extraits de bulbes d’oignon ont montré une très bonne corrélation entre la teneur en polyphénols totaux et l’activité antioxydante. Cette étude a permet de conclure que l’oignon, en particulier les bulbes colorés, constituent une bonne source d’antioxydants naturels.
De même Benmalek et al., 2013 ont montré que les extraits flavoniques de l’oignon ont présenté des propriétés antioxydantes très élevées. Les flavonoïdes semblent être des
11
donneurs efficaces d'hydrogène au radical DPPH, en raison de leur structure chimique idéale. Les flavonols (par exemple, la quercétine) sont considérés comme un modèle antioxydant en raison de leur capacité à éliminer les radicaux libres.
La figure 02 présente la structure des flavonoides identifiés de l’oignon rouge (Fredotović et al ., 2020).
Figure 02 : Structure des flavonoides identifiés de l’oignon rouge (Metrani et al ., 2020). L’effet antibactérien de l’Allium cepa a été évalué, par Benmedour et al 2015, à partir des jus frais et d’huiles essentielles de cette espèce. Différentes concentrations sont utilisées sur trois souches bactériennes: Staphylococcus aureus ATCC43300, Streptococcus pneumoniae ATCC49619 et Escherichia coliATCC25922. L’activité antibactérienne la
12
plus élevée est obtenue par les jus frais. Ces auteurs suggèrent que les composés soufrés, sont telles qui, sont responsables du pouvoir inhibiteur.
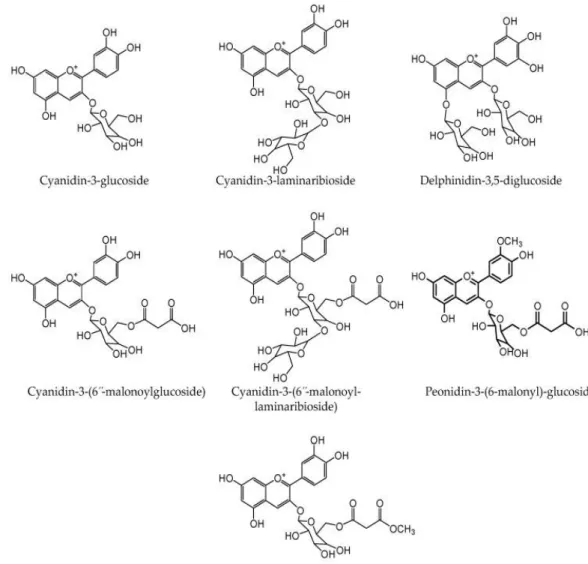
La variété rouge des oignons est principalement due à la présence d'anthocyanines pigmentaires. Ce sont des glycosides d'anthocyanidine et responsables de la coloration rouge ou bleue des fruits, des fleurs et d'autres parties de la plante. L'oignon est un bon complément en magnésium, calcium, fer, sodium, phosphore, bore et potassium. Les anthocyanes sont de puissants piégeurs de radicaux libres et ont démontré une protection contre le clivage oxydatif. La figure 03 présente la structure des anthocyanes identifiées des oignons rouges (Metrani et al ., 2020).
Figure 03 : Structure des anthocyanes identifiées des oignons rouges
13
Les oignons contiennent principalement des glycosides de glucose de quercétine, et est le principal représentant de la sous-classe des flavonoïdes des flavonols. La quercétine est un antioxydant puissant car elle peut chélater les métaux, piéger les radicaux libres d'oxygène et empêcher l'oxydation des lipoprotéines de basse densité (LDL) in vitro. La quercétine pourrait donc contribuer à la prévention du cancer (Hollman et al., 1997).
Chapitre II : L’activité antibactérienne de
14
I. Monde bactérien
Les bactéries sont des micro-organismes unicellulaires classés parmi les procaryotes, car ils ne possèdent pas de membrane nucléaire. Ce caractère les distingue des autres organismes unicellulaires classés parmi les eucaryotes (champignons, algues, protozoaires). Elles sont capables de se reproduire de manière autonome à la différence des virus qui ont besoin de détourner la machinerie d’une cellule pour se reproduire (Boudjouref., 2011).
La taille des bactéries varie de 1 à 10 μm, et elles pèsent de l’ordre de 10-12 grammes.
Elles sont présentes partout, on connait quelques 8 000 espèces mais on estime qu’il en existerait 100 à 1000 fois plus. Ce sont des petits sacs de molécules séparés de l’environnement extérieur. Cet ensemble a la capacité remarquable de se copier à l’identique en puisant énergie et réactifs primaires dans le monde extérieur (Cottinet., 2013).
En tant que procaryote, la structure de la cellule est simple. Le volume intérieur, appelé cytoplasme, est délimité par la membrane plasmique. La membrane contrôle les flux entrant et sortant de la bactérie et sert de support à certaines enzymes. Ce volume est continu et ne contient en général pas de structure secondaire complexe. Toutes les réactions chimiques sources d’énergie, ou permettant l’entretien et la multiplication de la bactérie, ont lieu dans le cytoplasme. Elles peuvent néanmoins être localisées, sur la membrane par exemple (Lesseur., 2014).
Les bactéries pathogènes pour l'homme sont à l'origine de multiples maladies infectieuses qui, en particulier dans les pays en voie de développement, font encore des ravages. En 1995, ces maladies ont été responsables d'un tiers (17 millions de personnes) des décès dans le monde, Figure02 présente une bactérie (Lesseur., 2014).
15
Figure 04: Schéma d’une bactérie. (Xie., 2018).
I.2. Bactéries Gram positive et Gram négative
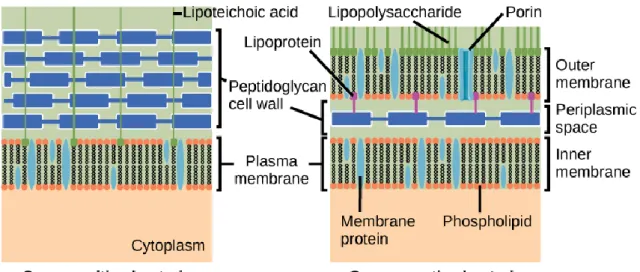
Les bactéries sont classées comme Gram positif et Gram négatif (à quelques exceptions près, comme les mycobactéries) en fonction de leur structure de membrane cellulaire procaryote. Les bactéries Gram-négatives ont une fine couche de peptidoglycane qui est entourée d'une membrane interne et d'une membrane externe formant ainsi l'espace périplasmique (Fig. 5). La double couche de protection dans les bactéries Gram-négatives, en plus d'une abondance de pompes à efflux et de porines hautement sélectives, rend plus difficile pour un agent de ciblage intracellulaire de déclencher sa fonction antibactérienne. Il est évident que la perméabilité des médicaments dans les bactéries Gram-négatives est plus difficile pour les antibiotiques avec des cibles cytosoliques, car ils doivent transiter par deux bicouches lipidiques protectrices (Domalaon et al ., 2018).
16
Figure 05: Paroi cellulaire à Gram négatif (Samanthi., 2018).
Les bactéries à Gram positif possèdent une paroi cellulaire épaisse constituée de couches de peptidoglycane et d'acide teichoïque ancrées sur la membrane cytoplasmique (Domalaon et al ., 2018). D'autre part, le peptidoglycane, qui vient au contact de la membrane cytoplasmique. Celui-ci peut être recouvert d 'une couche polysaccharidique Le peptidoglycane est formé de longs polymères dont la structure disaccharidique de base (N-acétylglucosamine-acide muramique) va être répétée d'une trentaine à plusieurs centaines de fois selon l'organisme. Ces chaînes polysaccharidiques sont reliées entre elles par des ponts interpeptidiques unissant les chaînes peptidiques appendues sur 1' acide muramique. La paroi est ainsi composée de 50 à 100 feuilles de peptidoglycane se recouvrant les unes les autres. Au sein de ce peptidoglycane, on retrouve deux autres composants essentiels : 1) les acides teichoïques qui, liés à l'acide muramique, représentent 20 à 30 % du poids du mur bactérien et auraient pour rôle de capter les cations comme le magnésium.
2) les acides lipoteichoïques qui sont insérés par leur fraction lipidique dans la membrane cytoplasmique sous-jacente et joueraient un rôle important dans la régulation du système autolytique impliqué dans la mort bactérienne (Gutmann et Williamson., 1987).
17
Figure 06: Paroi cellulaire des bactéries Gram positif et Gram négatif (Samanthi., 2018).
II. Les antibiotiques
Les antibiotiques se définissent comme des molécules capables d'inhiber la croissance ou même de tuer des bactéries, sans affecter l'hôte (cellules eucaryotes) (Bambeke et al., 2008). Le premier d’entre eux (la pénicilline) a été découvert en 1928 par Alexander Fleming, par hasard, chez le champignon Penicillium glaucum, et utilisé à partir des années 1940. Depuis cette date, de nombreux antibiotiques ont été découverts. Ils sont classés en familles selon leurs modes d’action ou leur structure moléculaire. Les antibiotiques utilisés en médecine sont fabriqués à partir de cultures de micro-organismes ou sont des produits de synthèse. Ils réduisent ou bloquent la multiplication des bactéries (Lesseur., 2014).
II.1. Modes d’action des antibiotiques
Les antibiotiques sont utilisés en médecine pour lutter contre des infections bactériennes et doivent être choisis en fonction de leur efficacité sur la bactérie responsable de l’infection. Il en existe de très nombreux, répartis en différentes familles. Ils sont très efficaces contre les infections bactériennes, mais n’ont aucun effet sur les infections virales. Ces molécules ont la propriété de tuer les bactéries (antibiotiques bactéricides) ou d’en limiter la multiplication (antibiotiques bactériostatiques) (Lesseur., 2014).
18
Les mécanismes d’action d’un antibiotique comprennent l'interférence avec la synthèse de la paroi cellulaire (par exemple, les bêta-lactamines et les agents glycopeptidiques), l'inhibition de la synthèse des protéines (macrolides et tétracyclines), l'interférence avec la synthèse des acides nucléiques (fluoroquinolones et rifampicine), l'inhibition d'une voie métabolique (triméthoprime-sulfaméthoxazole), et perturbation de la structure de la membrane bactérienne (polymyxines et daptomycine), Figure 05 présente une Cellule bactérienne et modes d’action des antibiotiques (Tenover., 2006).
Figure 07 : Cellule bactérienne et modes d’action des antibiotiques (Lesseur., 2014). II.2. La résistance aux antibiotiques
La résistance aux antibiotiques est un phénomène général observé pour toutes les espèces bactériennes rencontrées chez l’homme. De plus, on assiste à des multi-résistances ; une bactérie est résistante à plusieurs familles d’antibiotiques. Les bactéries ont un grand pouvoir d’adaptation qui leur permet d’acquérir de nouvelles propriétés (modification de leur génome ou information génétique nouvelle) leur permettant de résister aux antibiotiques (Lesseur., 2014).
On distingue la résistance naturelle et la résistance acquise :
La résistance naturelle : concerne toutes les souches d’une espèce bactérienne et pré-existe à l’usage des antibiotiques. Cette résistance est chromosomique et a un caractère permanent transmissible aux cellules filles lors de la réplication bactérienne.
19
La résistance acquise : ne concerne qu’une partie des souches d’une espèce bactérienne normalement sensible et apparait à la suite de l’utilisation des antibiotiques. L’acquisition d’un nouveau mécanisme de résistance résulte :
o soit d’une mutation survenant sur le chromosome bactérien,
o soit de l’acquisition d’une information génétique provenant d’une bactérie déjà résistante (Lesseur., 2014).
II.2.1 Principaux mécanismes de résistance aux antibiotiques Trois principaux mécanismes de résistance sont actuellement connus :
Inactivation de l’antibiotique par une enzyme bactérienne : c’est la situation la plus fréquente.
Diminution de la quantité d’antibiotique atteignant la cible : L’antibiotique n’est pas modifié, mais il ne peut pas accéder à sa cible au sein de la bactérie :
o Soit parce qu’il ne peut plus y pénétrer en raison de la baisse de la perméabilité membranaire.
o Soit parce qu’il est expulsé activement vers l’extérieur de la bactérie par des protéines jouant le rôle de pompe (systèmes d’efflux).
Modification de la cible :
o Modifications quantitatives : par exemple, l’absence de paroi chez les bactéries du genre Mycoplasma est responsable de leur résistance naturelle aux β-lactamines.
o Modifications qualitatives : la modification de la structure de la cible peut diminuer son affinité pour l’antibiotique. C’est un mécanisme fréquent de résistance acquise. (Lesseur., 2014).
o Protection de la cible : c’est une protection réversible de la cible (par des protéines empêchant la fixation des quinolones, par exemple). Dans la figure 06 : Les différents mécanismes de résistance aux antibiotiques (Lesseur., 2014).
20
Figure 08: Les différents mécanismes de résistance aux antibiotiques (Lesseur., 2014). III. Les plantes médicinales comme source antibactérien
Les maladies infectieuses constituent un sérieux problème de santé publique aussi bien dans les pays en développement où elles sont la principale cause de taux de mortalité élevés, que dans les pays industrialisés où les résistances aux antibiotiques existants se développent de façon alarmante .Cette situation engendre un besoin sans cesse croissant de trouver de nouveaux composés antimicrobiens et/ou inhibiteurs de mécanismes de résistances aux antibiotiques. Les plantes médicinales, notamment celles utilisées de façon traditionnelle, constituent une source potentielle de ce type de composés (Bouharb et al., 2014). Elles étaient utilisées comme agents antimicrobiens pour éviter le développement des bactéries multi-résistantes (Al-Sanafi., 2016).
21
La résistance des bactéries aux antibiotiques soulève de sérieuses inquiétudes à l'échelle mondiale. Les plantes médicinales pourraient améliorer les stratégies de traitement actuelles des infections bactériennes (Md Shahadat., 2018).
IV. L’activité antibactérienne de la plante allium cepa
L'utilisation d'antibiotiques conventionnels pour la prévention des maladies infectieuses et comme stimulateurs de croissance dans la production animale a favorisé l'apparition de bactéries résistantes et la transmission de ces agents pathogènes à l'homme. De plus, l'utilisation et parfois la mauvaise utilisation des antibiotiques chez l'homme a augmenté la survenue d'infections (infections des voies urinaires, infections des voies respiratoires, infections de la peau et des tissus mous, etc.) causées par des bactéries multirésistantes, ce qui a réduit les options thérapeutiques et a rendu nécessaire la sélection de nouvelles molécules aux propriétés antibactériennes. Les composés naturels obtenus à partir de légumes aux propriétés antibactériennes pourraient être considérés comme une alternative aux antibiotiques conventionnels (Sorlozano-Puerto et al., 2018).
Diverses propriétés biologiques ont été signalées pour A. cepa . Un grand nombre d'études se concentrent sur son potentiel antimicrobien, qui a déjà été examiné en profondeur par plusieurs auteurs (Marrelli et al., 2019).
Selon (Benmalek et al., 2013) l'étude de l'activité antibactérienne a montré que les extraits de A. cepa L était les plus efficace. Cependant, les flavonols de la couche interne de l'oignon rouge avaient une plus grande activité inhibitrice sur la croissance d' Escherichia coli .
Il a été rapporté aussi que les extraits d'oignon exercent des effets bactéricides envers Streptococcus mutans , Strep-tococcus sobrinus , Porphyromonas gingivalis et Prevo-tella intermedia (bactéries Gram-positives), considérées comme les principales bactéries responsables des caries dentaires et adulteparodontite, respectivement . En plus de l'organosulfure composés, il a été rapporté que certaines quercétine, les produits d'oxydation trouvés dans l'oignon, présentent également des activité teriale contre H.pylori et MRSA (multidrug-résistante à S.aureus ) (Pareek et al., 2017).
22
D’après (Talhi et al., 2018), l’huile essentielle d’Allium cepa a montré des effets considérable aussi bien sur Pseudomonas aeruginosa et Staphylococcus aureus avec des diamètres d’inhibition de l’ordre de 15et 13,7 mm sur respectivement.
Plusieurs études rapportent que l'huile essentielle agit plus sur les bactéries Gram positives que sur les bactéries Gram-négatives ; cela est dû à la différence de composition de la paroi cellulaire. Cependant, il n'y a pas de règle générale concernant la sensibilité Gram car de nombreuses controverses existent dans les différents ouvrages publiés. En raison de la complexité de la composition chimique des huiles essentielles, leurs mécanismes d'action n'ont pas encore été clarifiés. Cependant, des hypothèses sur leur activité pour cibler différentes structures bactériennes pourraient être proposées. Leur hydrophobicité leur permet d'attaquer la membrane phospholipidique de la cellule et d'augmenter sa perméabilité. Par conséquent, le contenu des cellules est perdu, entraînant la mort bactérienne (Mnayer et al., 2014) .
(Benmedour et al., 2015) ont montrés que les extraits des alliums ont une composition chimique complexe ce qui leur confère des propriétés antimicrobiennes très intéressantes. Ils ont rapporté aussi que l’effet antibactérien de Allium cepa est plus remarquable sur les bactéries Gram positive.
D’autres part, les propriétés antibactériennes de certains composés obtenus à partir de l'oignon ont été décrites par (Sorlozano-Puerto et al., 2018). Ces composés peuvent inhiber la croissance d'une gamme de bactéries Gram-positives et Gram-négatives, y compris les bactéries pathogènes et commensales chez l'homme et l'animal (Sorlozano-Puerto et al., 2018).
Les résultats d’une étude réalisée par (Benkeblia, 2004), sur l’activité antimicrobienne de différentes concentrations (50, 100, 200, 300 et 500 ml / l) d'extraits d'huiles essentielles de trois types d'oignons (vert, jaune et rouge), montrent que les extraits d'huile essentielle de ces plantes Allium (oignons) ont une activité antibactérienne marquée.
De plus selon Al-Sanafi, 2015, l'extrait d'éther de pétrole de Bulbus Allium cepa inhibe la croissance de Clostridium paraputrificum et Staphylococcus aureus. Le jus de Allium cepa inhibe la croissance de Escherichiacoli, Serratia marcescens,
23
Pseudomonas aeruginosa, Salmonella typhi, Streptococcus espèces et Lactobacillus odontolyticus.
les extraits de feuilles séchée de Allium cepa exercent des activités antibactériennes contre les bactéries Gram positives comme Staphylococcus aureus et Bacillus subtilius, et les bactéries Gram négatives comme Escherichia coli et Pneumonie de Klebseilia.
D’après (Mnayer et al., 2014) , L' activité antibactérienne in vitro des six huiles essentielles ont été testées sur cinq types de bactéries pathogènes d'origine alimentaire: deux Staphylococcus aureus Gram positif (ATCC 25923), Listeria monocytogenes ( ATCC 19115) et trois Salmonella Typhimurium Gram négatif (ATCC 14028), Escherichia coli (ATCC 8739) et Bactérie Campylobacter jejuni (ATCC 33291). Parmi les huiles essentielles, la plus efficace à cet égard était l'huile d'oignon, inhibant les quatre bactéries. Staphylococcus aureus et Listeria monocytogenes étaient très sensibles à l'huile d'oignon avec des diamètres de 15,5 et 15,0 mm, respectivement. SalmonellaTyphimurium et Campylobacter jejuni étaient également sensibles avec des zones d'inhibition de 12,0 et 9,0 mm, respectivement. Escherichia coli était la seule bactérie résistante à cette huile essentielle. L'activité antibactérienne de cette huile essentielle d'oignon peut être liée aux dérivés propyliques.
V. L es mécanismes antibactériennes d’Allium cepa
Les mécanismes par lesquels des huiles essentielles exercent leur activité antibactérienne sont mal connus. Du fait de la complexité de leur composition chimique, il est difficile de donner une idée précise sur le mode d’action des HEs. Il est probable que leur activité antibactérienne ne soit pas attribuable à un mécanisme unique, mais à plusieurs sites d’action au niveau cellulaire (Hellal, 2011).
La majorité des huiles essentielles ont un spectre d'action très large dont leurs terpènes ou terpènoïdes ont des effets contre les bactéries, les mycètes, les virus et les protozoaires. Les huiles essentielles exercent leur pouvoir antimicrobien par :
Leur interférence avec la bicouche lipidique de la membrane cellulaire grâce à leur
propriété hydrophobe ce qui entraîne une perturbation de la cellule (Burt, 2004). En outre, cette réaction varie en fonction de la nature de la bicouche lipidique ce qui explique la résistance des bactéries à Gram négatif (Barakat et al., 2004).
24
production d'énergie cellulaire et la production des composés structuraux (Liolios et
al., 2009).
Inactivation et destruction du matériel génétique du micro-organisme (Kim et al.,
2004).
Les huiles essentielles ont un spectre d’action très large due principalement à leur grande affinité aux lipides membranaires grâce à l’hydrophobicité de certains de ces composants qui leur permet de traverser facilement la bicouche phospholipidique de la membrane cellulaire en altérant sa perméabilité et entraînant des pertes anormales d’ions, voire même des macromolécules(Burt .,2004).
Le mode d’action des HEs dépend du type de microorganismes. En général, les bactéries Gram négatives sont plus résistantes que les bactéries Gram positives grâce à la structure de leur membrane externe. Ainsi, la membrane extérieure des Gram négatifs est plus riche en lipo-polysaccharides (LPS) la rendant plus hydrophile, ce qui empêchent les terpènes hydrophobes d’y adhérer (Hellal, 2011).
Chalchat et al.,(1997), constatent que l’activité antimicrobienne des huiles essentielles est hautement dépendante de leur composition chimique notamment de leurs constituants majeurs. Les huiles essentielles caractérisées par une faible activité contiennent une grande quantité de composés hydrocarbonés alors que les 3 huiles essentielles des familles alliacées comme l’onigon qui se sont montrées actives sont riches en composés oxygénés.
Chapitre III. Activité antioxydante de
l'Allium cepa
25
I. Introduction
Depuis quelques années, le monde des sciences biologiques et médicales est envahi par un nouveau concept, celui du « stress oxydant », c'est-à-dire d'une situation où la cellule ne contrôle plus la présence excessive de radicaux oxygénés toxiques (Favier., 2003).
La découverte d'espèces chimiques radicalaires présentes normalement dans l'organisme a bouleversé notre compréhension des mécanismes biologiques. Ces radicaux libres sont produits par divers mécanismes physiologiques car ils sont utiles pour l'organisme à dose raisonnable ; mais la production peut devenir excessive ou résulter de phénomènes toxiques exogènes et l'organisme va devoir se protéger de ces excès par différents systèmes antioxydants (Favier., 2003).
Un grand nombre de fruits, légumes, plantes aromatiques, épicées, médicinales et autres peuvent contenir des composés bioactifs présentant une activité de piégeage des radicaux libres. De nombreuses plantes médicinales contiennent de grandes quantités d'antioxydants tels que des composés phénoliques, des composés azotés, des vitamines, des terpénoïdes et d'autres métabolites endogènes (Ozkan et al., 2016).
II. Radicaux libres
Un radical libre est une espèce caractérisée par une instabilité et /ou un pouvoir oxydant fort, il se différencie par la présence d’un électron non apparié sur la couche électronique la plus externe. Parmi toutes les espèces réactives oxygénées (ERO), on distingue un ensemble restreint de ces composés qui jouent un rôle particulier en physiologie et que nous appelons les radicaux primaires à savoir : l’anion superoxyde (O2°-), le radical hydroxyle (°OH), le monoxyde d'azote (NO°), le radical peroxyle (ROO°) et le radical alkoxyle (RO°). (Favier., 2003).
Les autres radicaux libres, dits radicaux secondaires telles que l’oxygène singulet 1O2, le peroxyde d’hydrogène (H2O2) et le nitroperoxyde (ONOOH), se forment par réaction de ces radicaux primaires sur les composés biochimiques de la cellule, Figure 07 présent l’origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène impliqué en biologie (Favier., 2003).
26
Figure 09 : Origine des différents radicaux libres oxygénés et espèces réactives de l’oxygène impliqué en biologie (Favier., 2003).
II.1. Les espèces réactives de l'oxygène radicalaires II.1.1. Radical superoxyde O2•-
Le radical superoxyde résulte de la réduction monovalente de l’oxygène, soit l’apport d’un électron à la molécule O2. Cette réaction se fait dans les mitochondries lors
de la respiration cellulaire. Un autre site de production est le polynucléaire neutrophile. Celui-ci utilise les ERO pour son activité phagocytaire. De plus, lors d’un stress (sepsis, ischémie…) des enzymescomme la NADPH-oxydase et la xanthine-oxydase peuvent produire des radicaux superoxydes(Guilloty., 2016).
II.1.2. Radical perhydroxyle HO2•
Celui-ci est obtenu après protonation du radical superoxyde en milieu pH < 4,8. Le radical perhydroxyle est plus réactif que le superoxyde car le potentiel standard d’oxydoréduction est plus élevé ainsi que ses constantes de vitesse, notamment vis-à-vis des acides gras polyinsaturés (acides linoléique, linolénique, arachidonique) (Guilloty., 2016).
27
II.1.3. Radical hydroxyle OH•
Il s’agit du radical le plus toxique, il n’a pas de rôle physiologique connu. Dans la chaîne respiratoire mitochondriale, le peroxyde d’hydrogène peut réagir directement avec des ions métalliques (fer ou cuivre) par la réaction de Fenton. Il s’agit d’une réaction d'oxydation avancée aboutissant à la formation du radical hydroxyle OH• qui est le deuxième oxydant le plus puissant présent dans la nature après le Fluor (Guilloty, 2016).
II
.1.4.
Radical peroxyle RO2• La radiolyse ou l’irradiation de solvants comme l’éthanol (CH3CH2OH) permet degénérer des radicaux peroxyles (CH3CH(O2•)OH) (Guilloty, 2016). II
.2.
Les espèces réactives de l'oxygène non radicalairesII.2.1. Peroxyde d’hydrogène (H2O2)
Le peroxyde d’hydrogène est obtenu à partir de l’anion superoxyde par dismutation spontanée ou par l’enzyme superoxyde dismutase.
Le H2O2 est métabolisé par la glutathion peroxydase et la catalase. S’il existe une modification de ces enzymes antioxydantes, on peut observer l’arrivée d’un stress oxydatif. H2O2 n’est pas un radical au sens propre mais permet la formation du radical hydroxyle en présence de métaux de transition (réactions de Fenton et d’Haber-Weiss). Le radical hydroxyle est très toxique car très réactif et présente une grande probabilité de réagir à proximité immédiate de son lieu de production (Guilloty., 2016).
III. Stress oxydatif
Les réactions d’oxydation sont des réactions habituelles et indispensables au sein de nos cellules, car elles contribuent au bon fonctionnement du métabolisme cellulaire. En effet, les réactions d’oxydation ont lieu lors de nombreux processus biologiques qui visent à maintenir un équilibre ou à synthétiser des molécules indispensables. Le métabolisme cellulaire produit et utilise en permanence des espèces oxydantes, c’est le cas au cours de la respiration, où chaque cellule réduit notamment l’oxygène en eau. Cependant comme dans tout phénomène important, un dérèglement dans ces réactions d’oxydations peut créer un dysfonctionnement au niveau des cellules, c’est ce qu’on appelle un stress oxydant, Figure 8 présente Le stress oxydant, toute une question d’équilibre (Baraka-Vidot., 2014).
28
Figure 10: Le stress oxydant, toute une question d’équilibre (Ros et al., 2013). Le stress oxydant peut être défini comme la résultante d’un déséquilibre en faveur des espèces pro-oxydantes et au détriment des espèces antioxydantes. Ce déséquilibre provient, soit d’une production exagérée d’agents oxydants (radicaux libres et ROS), soit d’une altération des mécanismes de défense. Les premiers travaux dans le domaine ont montré le rôle important joué par les intermédiaires oxygénés, appelés également radicaux libres, dans les phénomènes physiologiques et leurs effets délétères dans les processus cellulaires (Baraka-Vidot., 2014).
III.1.
Causes du stress oxydatif
Plusieurs études indiquent que les changements du stress oxydatif sont en grande partie attribuables à des facteurs alimentaires et aux niveaux d'activité physique. Divers facteurs liés au mode de vie moderne augmentent considérablement la production mitochondriale de ROS, un apport élevé en acides gras saturés et en sucre, l'inactivité physique. le tabagisme, l'alcool et le manque de fruits et légumes frais (antioxydants) intensifient également le stress oxydatif. Apparemment contradictoire, à court terme, l'activité physique augmente le stress oxydatif. Cependant, à long terme, le stress oxydatif induit par l'exercice favorise la biogenèse, le maintien et l'élimination des mitochondries
29
dysfonctionnelles, diminuant ainsi la production de ROS. De plus, ce stress oxydatif induit par l'exercice améliore la capacité de défense antioxydante endogène. Ainsi, une activité physique régulière entraîne une nette diminution du stress oxydatif. Surtout, comme les mitochondries sont la principale source de production de ROS, un dysfonctionnement mitochondrial hérité et / ou acquis augmentera fortement le stress oxydatif. Étant la source, les membranes mitochondriales sont elles-mêmes soumises à une exposition aux ROS; les dommages oxydatifs de ces membranes peuvent encore intensifier la production de ROS, créant potentiellement un cercle vicieux. Il convient de noter que les cellules cérébrales produisent également des ROS au cours du métabolisme d'importants neurotransmetteurs de l'humeur et de la psychose (par exemple la sérotonine, la noradrénaline et la dopamine) par les monoaminooxydases A et B, situées sur la membrane mitochondrialedx.
Dernier point mais non le moindre, le stress psychologique - un stress vital sévère en particulier - induit une variété de modifications morphologiques et neurochimiques; parmi eux, le stress oxydatif est invariablement observé (Assies et al 2014).
III. 2. Origine du stress oxydant
Le stress oxydatif est induit par des états redox déséquilibrés, impliquant soit une génération excessive d'espèces réactives de l'oxygène (ROS), soit un dysfonctionnement du système antioxydant (Kim et al., 2015).
Les origines du stress oxydant sont multiples et mènent à la formation d’espèces réactives de l’oxygène au sein de l’organisme. Les espèces réactives de l'oxygène comprennent des radicaux libres, c’est-à-dire des espèces chimiques possédant un électron célibataire, ainsi que des molécules non-radicalaires mais chimiquement instables. Ainsi, les espèces réactives de l'oxygène possèdent un pouvoir pro-oxydant vis-à-vis des éléments qui les entourent. Trois voies de génération endogène des espèces réactives de l'oxygène sont généralement décrite, à savoir : la chaîne de transfert des électrons située au niveau des mitochondries ; la flambée respiratoire des cellules phagocytaires, ces dernières étant indispensables à la défense immunitaire. Ainsi que l’activité des enzymes de type oxydase. Lors de réactions inflammatoires, l’activation des enzymes telles que la NADPH-oxydase (nicotinamide adénine di nucléotide phosphate oxydase) et la myéloperoxydase (MPO) est à souligner. Effectivement, elles permettent une forte production d’espèces réactives de l'oxygène. Les oxydants jouent donc un rôle important dans l’inactivation et la destruction
30
des micro-organismes par la peroxydation et la déstabilisation des membranes lipidiques, par l’oxydation et l’inactivation de leurs protéines de structure. par l’oxydation de leur matériel génétique ( De Moffarts et al., 2005).
D’autres sources ou modes de génération exogène des espèces réactives de l'oxygène existent de part les interactions avec leur milieu environnant. Par exemple, l’ingestion ou l’inhalation de toxiques, de produits oxydés ou oxydants, ou encore les radiations sont autant de situations pouvant produire un stress oxydant. Les espèces réactives de l'oxygène peuvent potentiellement réagir avec chaque composant cellulaire et provoquer son oxydation. Cependant, les cibles préférentielles des espèces réactives de l'oxygène sont les lipides, suivis par les protéines et les bases constitutives du matériel génétique. L’oxydation de ces composants cellulaires peut induire des dysfonctions du métabolisme cellulaire telles qu’une modification de la fluidité membranaire causée par la peroxydation lipidique ou encore une diminution de l’activité d’une enzyme suite à son oxydation ( De Moffarts et al., 2005).
III. 3. Les antioxydants
La défense antioxydante protège les systèmes biologiques de la toxicité des radicaux libres et comprend à la fois des molécules endogènes et exogènes.
Les antioxydants endogènes comprennent les voies enzymatiques et non enzymatiques.
Les principales enzymes antioxydantes sont la SOD, la catalase (CAT) et la glutathion peroxydase (GSH-Px). Comme mentionné ci-dessus, O 2 est converti par
SOD en H 2 O 2 , qui est décomposé en eau et oxygène par CAT, empêchant la
production de radicaux hydroxyles. De plus, le GSH-Px convertit les peroxydes et les radicaux hydroxyles en formes non toxiques par l'oxydation du glutathion réduit (GSH) en disulfure de glutathion, puis réduit en GSH par la glutathion réductase. D'autres enzymes antioxydantes sont la glutathion-S-transférase et la glucose-6-phosphate déshydrogénase.
Les antioxydants non enzymatiques sont des molécules qui interagissent avec les RONS et terminent les réactions en chaîne des radicaux libres: la bilirubine, l'α-tocophérol (vitamine E) et le β-carotène sont présents dans le sang tandis que