HAL Id: tel-00003719
https://tel.archives-ouvertes.fr/tel-00003719
Submitted on 6 Nov 2003HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
neutrons avec la matiere vivante. Applications aux
faibles doses de neutrons rapides sur des cellules
tumorales humaines
Marie-Laure Nenot
To cite this version:
Marie-Laure Nenot. DIANE, un code de simulation de l’interaction des neutrons avec la matiere vivante. Applications aux faibles doses de neutrons rapides sur des cellules tumorales humaines. Biophysique [physics.bio-ph]. Université Blaise Pascal - Clermont-Ferrand II, 2003. Français. �tel-00003719�
Sommaire_________________________________________________________________ 1 Introduction_______________________________________________________________ 4 Chapitre 1 : Généralités et rationnel de nos travaux de recherche ___________________ 7
1.1 Généralités _______________________________________________________ 7
1.1.1 Les interactions physiques rayonnement-matière ______________________ 7 1.1.2 Les étapes physico-chimique et chimique de la radiolyse de l’eau _________ 8
1.1.3 Les lésions moléculaires ________________________________________ 12
1.1.4 Quelques définitions de grandeurs utilisées couramment en radiobiologie__ 13 1.1.5 Les courbes de survie cellulaire : définition générale __________________ 15
1.2 Le rationnel de nos travaux de recherche _____________________________ 20
Chapitre 2 : Expériences réalisées dans le cadre du laboratoire ____________________ 26
2.1 Description des dispositifs expérimentaux_____________________________ 26
2.1.1 Le dispositif expérimental du LPC ________________________________ 26 2.1.2 Le dispositif expérimental de l’ETCA ______________________________ 30
2.2 Résultats obtenus en neutrons à faibles doses en fonction du débit de dose _ 31
Chapitre 3 : Mesures de dose et de débit de fluence ______________________________ 37
3.1 Mesures préliminaires de dose dans la casemate d’irradiation____________ 37
3.1.1 Utilisation des chambres d’ionisation équivalent tissu _________________ 38 3.1.2 Test avec un compteur Geiger Muller ______________________________ 38 3.1.3 Tests de spectrométrie gamma avec un détecteur à scintillations BGO
(Bi4Ge3O12) __________________________________________________________ 38
3.1.4 Spectrométrie neutron __________________________________________ 38
3.1.5 Résultats des mesures __________________________________________ 39
3.1.6 Mesure de dose à l’aide des diodes au silicium _______________________ 39
3.2 Mesure du débit de fluence par activation neutronique__________________ 41
3.2.1 Choix de l’197Au_______________________________________________ 42
3.2.2 Le dispositif expérimental _______________________________________ 45 3.2.3 Activation____________________________________________________ 45 3.2.4 Mesure du débit de fluence de neutrons rapides avec l’isotope 197Au______ 48 3.2.5 Mesure du débit de fluence de neutrons rapides avec le cuivre___________ 53 3.2.6 Comparaison avec le flux théorique donné par le constructeur :__________ 55
4.1 Historique et principe _____________________________________________ 60
4.2 La conception de MCNP4C_________________________________________ 63
4.2.1 Les sections efficaces___________________________________________ 63
4.2.2 Le traitement de la physique par MCNP ____________________________ 64
4.3 Utilisation de MCNP 4C ___________________________________________ 66
4.4 Simulation de notre dispositif expérimental à l’aide du code MCNP4C ____ 67
4.4.1 La géométrie modélisée _________________________________________ 67
4.4.2 Choix des matériaux ___________________________________________ 68
4.4.3 Définition de la source __________________________________________ 69 4.4.4 Choix des observables « tallies » __________________________________ 70
4.5 Résultats ________________________________________________________ 70
4.5.1 Influence de la casemate d’irradiation ______________________________ 70 4.5.2 Influence des flacons de cultures cellulaires _________________________ 74
Chapitre 5 : Simulation de l’interaction des neutrons avec le milieu biologique _______ 77
5.1 Généralités ______________________________________________________ 77
5.2 Simulations ______________________________________________________ 78
5.2.1 Les diverses interactions traitées __________________________________ 78
5.3 Le code de simulation DIANE_______________________________________ 86
5.3.1 La géométrie _________________________________________________ 86
5.3.2 Description du programme ______________________________________ 87
Chapitre 6 : Résultats de la simulation _______________________________________ 101
6.1 Le programme TRACE ___________________________________________ 101
6.1.1 Le programme TRACE avec des neutrons incidents de 14 MeV ________ 101 6.1.2 Le programme TRACE avec des neutrons incidents d’énergie uniformément répartie entre 0 et 14 MeV ______________________________________________ 110 6.1.3 Rôle des contraintes géométriques imposées par la présence de la cellule _ 119 6.1.4 Rôle de la position de la cellule dans le flacon de culture ______________ 123 6.1.5 Spectres d’énergie des particules chargées de recul au niveau de la cellule 125 6.1.6 Les dépôts d’énergie dans le volume cellulaire ______________________ 127
6.1.7 Calcul du débit de dose ________________________________________ 133
6.2 Le programme ELEC ____________________________________________ 138
6.2.1 Distribution en énergie des électrons d’ionisation produits au voisinage des traces de particules chargées pénétrant dans la cellule ________________________ 139 6.2.2 Distribution du parcours des électrons d’ionisation à partir des traces de
particules chargées pénétrant dans la cellule ________________________________ 143
7.1 Mesures de débit de fluence et de doses ______________________________ 151
7.2 Spectrométrie avec MCNP4C ______________________________________ 151
7.3 Le code de simulation DIANE réalisé au laboratoire ___________________ 152
7.3.1 Le code TRACE______________________________________________ 152
7.3.2 Le code ELEC _______________________________________________ 156
7.4 Modélisation de la courbe de survie à « faible débit de dose » entre 0 et 5 cGy 156
7.5 Modélisation de la courbe de survie à « débit de dose modéré »___________ 159
7.6 Autres travaux expérimentaux réalisés ______________________________ 160
7.6.1 Recherche d’apoptose _________________________________________ 160
7.6.2 Etude des cassures double brin de l’ADN __________________________ 160 7.6.3 Irradiation de souris ___________________________________________ 160
Conclusion______________________________________________________________ 161 Perspectives _____________________________________________________________ 163 Références bibliographiques________________________________________________ 164 Liste des figures__________________________________________________________ 172 Liste des tableaux ________________________________________________________ 178 Annexes ________________________________________________________________ 180
Introduction
L’étude des effets des rayonnements ionisants à très faible dose sur les tissus vivants ou les cellules isolées a fait l’objet d’un effort intensif depuis ces dernières années. Par faible dose, nous entendons des doses de l’ordre de quelques cGy, très inférieures à celles utilisées lors d’une séance de radiothérapie conventionnelle (≈ 2 Gy/séance). D’autre part, l’influence du débit de dose a été clairement mise en évidence en particulier lors d’irradiation de cultures cellulaires par des rayons X ou des neutrons [DIO.00], [MIT.02]. L’observation d’une hypersensibilité dans ces conditions particulières se traduit en outre par une décroissance rapide de la courbe de survie cellulaire dès les premiers cGy.
Dans le cas particulier de l’irradiation de cellules de mélanome humain par des neutrons de 14 MeV [DIO.00], l’observation d’une forte décroissance de la survie entre 0 et 5 cGy, suivie par un plateau de la courbe de survie entre 5 et 30 cGy, peut suggérer un mécanisme de radiorésistance induite ou de réparation cellulaire. Ceci est d’autant plus surprenant que cette structure particulière de la courbe de survie n’apparaît que dans le cas de très faibles débits de dose (ordre de 5 cGy.h-1). La courbe de survie est obtenue expérimentalement par la méthode de formation de colonies qui est fiable et couramment pratiquée.
Il est clair que de tels résultats expérimentaux présentent un grand intérêt sur le plan de la radiobiologie et peuvent aider à mieux comprendre l’effet des rayonnements ionisants sur des objets sub-cellulaires tels que l’ADN.
Ces résultats présentent également un grand intérêt dans le domaine de la radioprotection : d’une part sur tous les sites où le personnel peut être amené à subir une exposition à très faible dose. Par exemple lors d’utilisation d’accélérateurs destinés à la radiothérapie, dont on sait qu’ils sont la source de production de faibles flux de neutrons, ou bien auprès des centrales nucléaires. D’autre part, l’aéronautique et l’astronautique sont également concernées par de tels problèmes : lors de vols spatiaux de longue durée, les astronautes sont soumis à des rayonnements cosmiques qui en interagissant avec le vaisseau spatial, peuvent produire des flux de neutrons dont l’énergie peut varier depuis les énergies thermiques jusqu’à plusieurs dizaines de MeV.
Enfin, des applications peuvent être envisageables dans le domaine de la radiothérapie. Nous ne ferons que citer ce dernier point, la radiothérapie par neutrons [FOW.81] n’étant pour l’instant utilisée que pour des cas très particuliers ou bien en association avec des méthodes très spécifiques (boroneutrothérapie).
Notre travail s’inscrit dans le cadre de l’irradiation de cellules et de tissus vivants par des neutrons de 14 MeV. De telles expériences nécessitent la maîtrise de divers paramètres, en particulier en ce qui concerne la mesure de la dose de neutrons et de la fluence au niveau des cultures cellulaires.
Nous avons réalisé des mesures de débit de fluence à partir de méthodes d’activation : activation de feuilles d’or 197Au et de cuivre par des neutrons. La mesure de ce débit de fluence est réalisée à partir des raies gamma produites par les échantillons irradiés. Nous décrivons les mesures effectuées et donnons les résultats obtenus.
La dose ou le débit de dose sont obtenus par diverses méthodes : diodes PIN, chambres d’ionisation équivalent tissu, compteurs Geiger Muller et simulations. On observe un bon accord entre les simulations et les mesures expérimentales.
Cet aspect technique de notre travail a été développé sur deux sites expérimentaux : le générateur de neutrons du type SODERN Génie 26 implanté au Laboratoire de Physique Corpusculaire qui fournit un faible débit de dose (environ 5 cGy.h-1) de neutrons de 14 MeV, et l’accélérateur 400 kV de l’ETCA (Etablissement Technique Central de l’Armement) qui fournit un flux de neutrons de 14 MeV avec un débit de dose 50 fois plus élevé que le générateur de neutrons du LPC (dans ce dernier cas nous parlons de débit de dose modéré).
Les irradiations cellulaires ont été réalisées sur ces deux sites afin de comparer les effets à « faible débit de dose » et « débit de dose modéré ».
En parallèle avec les irradiations de cellules, les mesures de dosimétrie et de débit de fluence, nous avons réalisé un code de simulation utilisant la méthode de Monte Carlo, le code DIANE (Dose Induite par l’Action de Neutrons Energétiques), afin de décrire l’interaction des neutrons rapides avec les cellules et le milieu environnant.
Des premiers codes de simulation avaient déjà été réalisés, l’un assimilant la cellule à une sphère d’eau [NEN.98], l’autre décrivant une cellule hémisphérique isolée collée à la paroi des flacons de culture [ALA.02]. Le code DIANE réalisé au cours de notre travail comprend deux codes de simulations : les codes TRACE et ELEC. Il présente un caractère plus général et peut s’appliquer soit à l’irradiation de cellules isolées, soit à l’irradiation de tissus macroscopiques (cas d’expérimentations avec des souris, par exemple). De plus, nous avons utilisé une méthode permettant d’estimer la distribution en énergie et le nombre d’électrons d’ionisation produits par les reculs chargés pénétrant dans le milieu cellulaire ; ce dernier point présente un intérêt fondamental dans la mesure où des travaux récents ont mis en évidence le rôle que peuvent jouer des électrons de très basse énergie, en dessous du seuil d’ionisation de l’ADN.
La dose calculée au moyen de notre code est en accord avec les valeurs obtenues expérimentalement. Cependant, nous avons cherché à obtenir des qualifications supplémentaires en utilisant en parallèle un code connu utilisé en technique nucléaire et auprès des accélérateurs de particules : le code MCNP4C ; nous montrons la cohérence entre les résultats obtenus et ceux fournis par le code TRACE. Cependant MCNP4C ne permet pas de suivre complètement le devenir des ions chargés et la production d’électrons d’ionisation ce qui justifie la réalisation d’un code tel que TRACE. Même si ce dernier ne décrit pas toutes les réactions nucléaires possibles, nous montrons qu’il fournit des résultats suffisamment précis et fiables.
Nous analysons ensuite les résultats de TRACE pour obtenir des informations concernant les dépôts d’énergie des différents reculs chargés ainsi que le rôle du milieu environnant la cellule irradiée. L’effet balistique dû au pic de Bragg sera également évoqué. Des distributions angulaires et énergétiques, ainsi que des statistiques concernant l’histoire des différentes particules chargées produites sont présentées de manière à contrôler le bon déroulement de la simulation. Nous présentons un modèle utilisant TRACE pour décrire les formes des courbes de survie, « à faible débit de dose » dans la région de l’hypersensibilité et « à débit de dose modéré ».
Avec le code ELEC, qui utilise les résultats du code TRACE, nous nous intéressons plus particulièrement aux électrons d’ionisation produits au voisinage des traces ainsi qu’aux distributions des largeurs de trace. Les informations obtenues pourront être reliées aux travaux récents publiés dans le domaine de la radiobiologie, par exemple les mécanismes d’attachement dissociatif de l’électron. Nous montrons que notre travail ouvre des perspectives intéressantes pour l’avenir et suggérons la possibilité d’autres expériences (irradiations d’autres lignées cellulaires), et d’autres simulations (effet des électrons secondaires sur l’ADN). Enfin, nos simulations sont directement utilisables pour fournir les informations nécessaires permettant de calculer le rendement des espèces « primaires » formées lors de la radiolyse de l’eau. Nous présentons les premiers résultats de cette étude qui offre la perspective d’une intéressante collaboration avec l’équipe de l’Université de Sherbrooke à Montréal.
Chapitre 1 :Généralités et rationnel de nos
travaux de recherche
Le premier paragraphe de ce chapitre rassemble quelques définitions générales de radiobiologie qui permettront aux lecteurs de mieux comprendre nos résultats expérimentaux. Dans le deuxième paragraphe, nous expliquons pourquoi nous avons entrepris les expériences d’irradiation de cellules de mélanomes, cellules humaines malignes radiorésistantes aux rayons X, par des neutrons de 14 MeV à faibles doses.
1.1 Généralités
Les expériences réalisées consistent à irradier des cellules de mélanome humain par des neutrons de 14 MeV et à étudier les effets biologiques produits par ces particules sur les cellules. Ces effets biologiques proviennent d’une longue série de phénomènes déclenchés par le passage des particules dans les cellules. Aux événements précoces de types ionisation et excitation qui se produisent le long de la trajectoire de la particule succèdent des réactions physico-chimiques, puis chimiques et enfin un effet biologique. Le principe des processus intervenant lors de l’interaction de rayonnements ionisants avec une cellule vivante sera brièvement décrit dans ce paragraphe. Bien que toutes les molécules présentes dans une cellule vivante puissent interagir, ces rappels concerneront essentiellement les interactions avec l’eau (par son abondance) et l’ADN (par les conséquences de son altération). Les aspects concernant l’étape chimique ne seront abordés que brièvement, cette étape très complexe sortant du cadre de ce travail.
1.1.1 Les interactions physiques rayonnement-matière
Les interactions physiques entre la matière et les particules directement ionisantes ou celles mises en mouvement par les rayonnements indirectement ionisants sont de trois types :
- L’ionisation des atomes : l’énergie du rayonnement est supérieure à l’énergie de
liaison des électrons. Un électron est alors arraché au cortège électronique. A TEL élevé, la probabilité d’observer la “multi-ionisation” des molécules d'eau semblerait non négligeable ; celle-ci pourrait être à l'origine de la formation primaire des radicaux HO2./O2.− [FER.98].
- L’excitation des atomes : si l’énergie n’est pas suffisante pour arracher un électron, elle peut l’être cependant suffisamment pour faire passer un électron du niveau énergétique fondamental à un niveau énergétique supérieur (couche moins liée) ; l’atome est dit excité.
- Les transferts thermiques : si l’énergie n’est pas suffisante pour exciter l’atome, elle peut cependant augmenter son énergie cinétique de translation, de rotation et de vibration ; nous classerons ces phénomènes comme des processus de transferts thermiques.
Durant cette période très courte (< 10−15 s), le rayonnement incident crée des particules chargées et des électrons secondaires qui interagissent à leur tour avec les molécules environnantes. Par suite de la nature même des phénomènes qui leur donnent naissance, les espèces réactives ainsi créées sont distribuées de façon hétérogène le long des trajectoires individuelles des particules ionisantes. Ensuite, ces espèces se réorganisent au cours de l’étape dite physico-chimique (ou « pré-diffusionnelle ») complétée vers 10−12 s. L’évolution
ultérieure de toutes les espèces formées s’effectue au cours de l’étape chimique (ou « diffusionnelle ») où s’élaborent les produits radicalaires et moléculaires de la radiolyse.
1.1.2 Les étapes physico-chimique et chimique de la radiolyse de l’eau
On sait actuellement que l’effet principal de la radiolyse de l’eau liquide est sa décomposition en produits radicalaires (.OH, e−aq, H., HO2
. /O2
.−
) et moléculaires (H2, H2O2) [FER.83], [FER.99]. Mais cette décomposition comporte plusieurs étapes que nous décrivons brièvement ici.
1.1.2.1 Réactions physico-chimiques et formation de radicaux libres
Au cours de l’étape physico-chimique se produisent des réorganisations des espèces créées initialement qui ont lieu pendant un intervalle de temps de l'ordre de 10−15 à 10−12 s. Durant cette très brève période, les électrons secondaires peuvent se recombiner sur leur cation parent ou se thermaliser et par la suite former l’électron hydraté (e−aq), pendant que les molécules d’eau ionisées (H2O.+) ou excitées (H2O*) se dissocient pour conduire à la formation de radicaux libres et de produits moléculaires (tels que .OH, H+, H., H2,
. O.).
Les radicaux libres proviennent essentiellement de l’interaction des rayonnements ionisants avec les électrons des molécules d'eau, et ce en raison de la teneur extrêmement élevée en eau des organismes vivants. Un radical libre porte sur sa couche électronique externe un ou plusieurs électrons célibataires (non apparié à un électron de spin opposé). Cette configuration confère à l’entité radicalaire une très haute réactivité chimique : les radicaux libres tendent à capturer un électron pour compléter leur couche électronique.
Le phénomène physique initial est l’ionisation de la molécule d’eau sous l’action du rayonnement incident (symbolisé par ) :
H2O e + H− 2O.+ (1)
Le radical cation H2O.+, instable, se dissocie (~10−14 s) par une réaction de transfert de proton :
H2O.+ → H+ +
.
Le radical hydroxyle .OH ainsi formé est un agent oxydant puissant doté d’une grande réactivité chimique.
Les électrons arrachés aux molécules d’eau dans la réaction (1) perdent progressivement leur énergie cinétique : ils peuvent parcourir 10 à 15 nm avant de se thermaliser. Lorsqu’ils sont suffisamment ralentis, ils peuvent être piégés par les molécules d’eau et ainsi s’hydrater (~2-6 × 10−13 s) :
−
e → e-th → e−aq (3)
Les électrons hydratés (e−aq) sont des réducteurs puissants. Au cours de leur thermalisation, les électrons secondaires peuvent aussi se recombiner sur l’ion positif parent qu’ils neutralisent en donnant une molécule d’eau excitée (H2O*).
Par ailleurs, la molécule d’eau peut être excitée directement par le rayonnement incident (symbolisé par ) :
H2O H2O* (4)
La molécule excitée peut se désexciter selon plusieurs voies. Le processus de dissociation homolytique :
H2O* → H
.
+ .OH (5)
est le plus couramment admis, mais les voies :
H2O* → 2 H
.
+ .O.(3P) et H2O* → H2 +
.
O.(1D) (6)
impliquant l'atome d'oxygène dans ses états fondamental (3P) et excité (1D) sont également possibles.
1.1.2.2 Etape chimique et formation des produits radicalaires et moléculaires
Au cours de l’étape chimique (~10−12-10−6 s), la concentration des espèces radiolytiques décroît dans les zones d’hétérogénéité (ou “grappes”, ou encore “spurs” dans la littérature anglo-saxonne) où elles ont été produites, le long des trajectoires des particules ionisantes et ce par trois processus simultanés [FER.83] :
- par des réactions de recombinaison favorisées au début par la forte concentration locale des espèces radiolytiques. Ces réactions conduisent à une reformation d’eau (H2O ou OH−) et à l’apparition des produits moléculaires :
. OH + .OH → H2O2 (7) . OH + H2O2 → HO2 . + H2O (8) − aq e + e−aq (+ 2 H2O) → H2 + 2 OH− (9) − aq e + .OH → OH− (10) − aq e + H+ → H. (11) H. + H. → H2 (12) H. + .OH → H2O (13) H. + eaq− (+ H2O) → H2 + OH− (14)
- par diffusion jusqu’à homogénéisation dans l’ensemble du milieu irradié. On admet que les grappes ont disparu 10−7 à 10−6 s après le passage du rayonnement.
- par des réactions avec des solutés éventuels, réactions qui interfèrent d’autant plus tôt avec les deux premiers processus que ces solutés sont concentrés.
Le résultat global des étapes précédentes est l’apparition, à l’échelle de la microseconde, de produits radicalaires et moléculaires (e−aq, H., H2,
. OH, H2O2, HO2 . /O2 .− , H+, OH−, etc…) distribués de façon homogène dans le milieu irradié. Ce sont donc ces produits qui réagissent avec d’éventuels solutés et sont par conséquent seuls responsables de l’effet radiolytique final, pour autant que la concentration des solutés reste suffisamment faible (typiquement, inférieure à 10−3 M) pour empêcher toute intervention dans les grappes au cours de leur expansion.
On définit, à ce stade, les rendements « primaires » (“escape yield” dans la littérature anglo-saxonne) de chacune de ces espèces : −
aq
e
G , GH., G
H2, G .
OH, GH2O2,... Rappelons ici que l'on
appelle rendement radiolytique (G) (“yield” ou “G-value” dans la littérature anglo-saxonne) le nombre de molécules transformées (disparues ou formées) pour une absorption d’énergie égale, par convention, à 100 eV. Le rendement « primaire » d’une espèce S, écrite en indice, est le rendement radiolytique qui est normalement mesuré après réactions complètes dans les grappes et avant que cette espèce n’ait eu une opportunité de réagir en dehors de ces zones (typiquement, 10−6 s). Pour référence, les valeurs (exprimées en molécules/100 eV) adoptées pour les rendements « primaires » de la radiolyse de l’eau par les rayons γ de 60Co ou les rayons X de même énergie sont les suivantes:
− aq e G = 2,65 GH. = 0,60 G H2 = 0,45 G . OH = 2,80 GH2O2 = 0,68.
Ces rendements « primaires » sont évidemment fonction de la nature et de l’énergie du rayonnement, c'est-à-dire du “transfert d’énergie linéique” (ou TEL) (voir définition paragraphe 1.1.4.) de celui-ci.
a. Le rôle du transfert linéique d'énergie
Pour les rayonnements à TEL élevé, la densité d’ionisations et d’excitations, le long de chaque trajectoire, est grande, ce qui conduit à une hétérogénéité particulière intervenant au niveau des phénomènes primaires, due au recoupement des zones hétérogènes décrites ci-dessus. Dans les zones communes à ces recoupements, les concentrations radicalaires sont ainsi plus élevées, ce qui entraîne une augmentation de la production des produits moléculaires H2O2 et H2, accompagnée d’une diminution des rendements radicalaires.
Contrairement à la radiolyse par les rayons γ de 60Co (“rayonnement à faible densité d’ionisations”), où les grappes évoluent indépendamment les unes des autres, la répartition spatiale initiale de l’énergie qui intervient dans la radiolyse à grand TEL conduit à envisager au sein d’une même trajectoire deux zones coaxiales : l’une, le « cœur », de forte densité en événements, où s’élaborent les produits moléculaires ; l’autre est une zone annulaire, dite « pénombre » où s’absorbent les électrons secondaires, éjectés du cœur, qui y forment majoritairement des produits radicalaires. Une telle distribution des zones hétérogènes le long des trajectoires des particules ionisantes montre que le TEL ne suffit pas à appréhender l’ensemble des phénomènes et que c'est un spectre de TEL qui, dans ces conditions, définira mieux la radiolyse [FER.99].
Si, pour les faibles TEL, on observe un très petit rendement « primaire » en HO2
. /O2
.−
(~0,02 molécule/100 eV) en l’absence d’oxygène, ce rendement augmente avec le TEL, atteignant une valeur de 0,43 molécule/100 eV pour des ions 58Ni de TEL égal à 5200 keV/µm [LAV.87]. Une telle valeur est relativement élevée pour une zone de TEL où les rendements des autres radicaux libres sont nuls à cette échelle de temps. L’origine du rendement des radicaux hydroperoxyle, lorsque le TEL augmente, demeure inexpliquée, même si l’intervention d’ions de l’eau multichargés a été invoquée récemment à ce sujet [FER.98]. Le problème de la radiolyse à haut TEL n’est pas encore pleinement résolu, mais l’intérêt de ses applications radiobiologiques incitent à en développer une meilleure compréhension.
b. L'influence de la présence d'oxygène.
L’oxygène (O2) est un gaz soluble dans de nombreux milieux et en particulier dans l’eau, c’est donc un vecteur d’oxydo-réduction quasi universel. Son rôle est d’importance primordiale lors de la plupart des actions biologiques des rayonnements ionisants.
En radiolyse, si l’on ne prend pas de précautions particulières, la cible irradiée contient de l’oxygène : dans l’eau équilibrée avec l’air à pression atmosphérique et température ambiante, la concentration de celui-ci est ~2,5 × 10−4 M. Ceci indique par exemple que O2, bon capteur d’électrons hydratés selon
− aq
e + O2 → O2
.−
(15) réagira avec ces derniers avec un temps de réaction de quelques microsecondes (c’est-à-dire, après l’expansion des grappes), permettant de développer certaines compétitions dans cette échelle de temps. L’oxygène peut aussi réagir sur les atomes H. en les transformant en radicaux HO2 . : H. + O2 → HO2 . (16)
ces derniers jouant alors le rôle oxydant.
Par ailleurs, étant lui-même un biradical, O2 peut réagir sur des radicaux (R
.
) provenant d’éventuels solutés en donnant en particulier un peroxyradical RO2
.
. Enfin, il peut aussi réagir sur un site radicalaire créé au sein d’une macromolécule. Pour l’ADN, il peut ainsi inhiber la réparation de certains défauts radioinduits.
À l’échelle cellulaire, les effets de l’oxygène sur la radiolyse sont souvent complexes. Ils se traduisent toujours par une radiosensibilisation que l’on caractérise par la mesure de l’influence de l’oxygène sur la survie cellulaire [TUB.90], [LAR.94].
1.1.3 Les lésions moléculaires
1.1.3.1 Lésions induites par transfert direct d'énergie
L'action directe est due au transfert direct de l'énergie du rayonnement. La molécule ionisée ou excitée perd son excédent d'énergie par émission de photons de fluorescence ou par rupture de liaisons de covalence R–R’ → R. + R.’ conduisant à la formation de deux radicaux très réactifs. La rupture ne nécessite pas que l’événement physique initial ait lieu au voisinage de la liaison rompue. L’énergie peut migrer au sein de la molécule elle-même pour rompre la liaison la plus faible ou bien être transférée à une autre molécule. Dans une cellule vivante, toutes les molécules peuvent être touchées, mais deux d'entre elles sont plus importantes : l'eau (par son abondance) et l'ADN (par les conséquences de son altération).
1.1.3.2 Lésions induites par transfert indirect d'énergie.
L’effet indirect résulte de l’action des radicaux libres (produits de la radiolyse de l’eau) sur les molécules contenues dans la solution aqueuse. Les radicaux diffusent dans la solution et ils réagissent sur les molécules de soluté, entraînant leur modification chimique. Ceci peut provoquer de façon indirecte des lésions, par exemple à la molécule d’ADN.
1.1.4 Quelques définitions de grandeurs utilisées couramment en
radiobiologie
Rappelons tout d’abord la définition de deux paramètres que nous devrons citer à plusieurs reprises dans la suite de ce travail.
* Le premier paramètre est le Transfert d’Energie Linéique (TEL) ou pouvoir d’arrêt restreint L∆. Il est donné pour un matériau spécifique et des particules chargées d’énergie déterminée. Il est défini par [GAM.97] :
∆ ∆ = ) dx dE ( L (17)
où dE est l’énergie perdue sur une distance dx par une particule chargée lors de collisions avec des électrons, diminuée de la somme des énergies cinétiques de tous les électrons produits avec une énergie supérieure à ∆. En pratique, on exprime le TEL en keV.µm-1. Cette définition permet d’éliminer les électrons qui se différencient de la trace principale par exemple les électrons δ d’énergie supérieure à 100 eV, le TEL sera alors noté L100. Notons que L∞ est égal à la partie électronique du pouvoir d’arrêt
dx dE
.
* Le deuxième est l’Efficacité Biologique Relative (EBR). L’efficacité biologique relative, EBRi, d’un rayonnement donné, i, par rapport à un rayonnement de référence, j, est égale au rapport des doses absorbées du rayonnement de référence, Dj, et du rayonnement considéré, Di, nécessaires à l’obtention d’un même effet biologique. Nous pouvons donc écrire : j j i i D EBR D EBR × = × (18)
Le rayonnement de référence pour lequel l’EBRj est pris arbitrairement égal à 1 est un rayonnement X ou ϒ ayant un TEL inférieur ou égal à 3,5 keV.µm-1 (X de 250 keV et ϒ de 1 MeV environ) et un débit de dose de 0,1 Gy.min-1. Ce qui conduit à la relation suivante :
i j i D D EBR = (19)
Pour un effet donné, l’EBR varie en fonction de la nature du tissu et du rayonnement. On peut également définir une EBR d’un rayonnement à étudier par rapport à n’importe quel autre
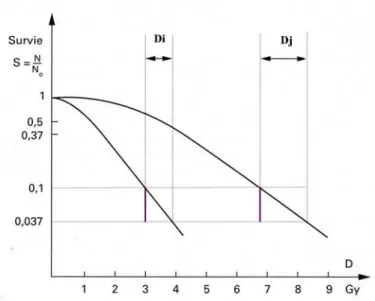
Il existe actuellement deux façons de définir l’EBR, les figures 1 et 2 illustrent ces deux définitions.
- La figure 1 illustre le premier cas, L’EBRi est donnée par la relation (19), l’effet biologique observé correspond à une certaine survie cellulaire, par exemple dans ce cas de figure à 50 %.
Figure 1 : Définition de l’EBR pour une survie de 50%
- La figure 2 illustre le deuxième cas, L’EBRi est toujours donnée par la relation (19) l’effet biologique observé et différent et correspond à une chute de la survie de S à S/e.
Figure 2 : Définition de l’EBR pour une chute de la survie de S à S/e
Les courbes précédentes sont des courbes de survie cellulaire en fonction de la dose ; leur définition détaillée est donnée dans le paragraphe suivant.
1.1.5 Les courbes de survie cellulaire : définition générale
La courbe de survie cellulaire est la représentation graphique du taux de survie en fonction de la dose pour une espèce cellulaire donnée et des conditions expérimentales déterminées. Une des méthodes de détermination du taux de survie cellulaire repose sur une technique de clonage in vitro. Une série de dilutions permet par exemple d’obtenir 100 cellules par flacon de culture. Chaque cellule clonogène peut ainsi se multiplier et donner naissance à une colonie après incubation dans des conditions bien définies. On admet qu’une cellule est « viable » ou survivante lorsqu’elle a donné naissance à une colonie (ou clone) contenant plus de 50 cellules après un laps de temps suffisant, généralement de deux semaines.
On définit le coefficient de clonage ou CFA (Colony Forming Ability) par le rapport du nombre de colonies formées sans irradiation au nombre de cellules initiales incubées. Ce coefficient permet de normaliser les courbes à 100 % de survie à la dose 0 Gy.
Le taux de survie est défini par le rapport entre le nombre de colonies dénombrées après irradiation au nombre de colonies dénombrées sans irradiation.
1.1.5.1 Aspect et modélisation des courbes de survie pour des irradiations X ou γ
Les différents modèles de courbes de survie développés dans ce paragraphe proviennent de l’ouvrage « Radiobiologie » de M. Tubiana, J. Dutreix et A. Wambersie [TUB.86].
Il existe deux modèles mathématiques pouvant modéliser les courbes de survie cellulaire dans une gamme de dose, ne comprenant pas les faibles doses ni les fortes doses :
- La courbe de survie exponentielle - La courbe de survie avec épaulement
a. Courbe de survie exponentielle
La relation entre le taux de survie S et la dose D est donnée par l'équation :
D
e
S= −α (20)
plus communément représentée par :
0 D / D e S= − (21) Avec : D0=1/α
D0 est appelée la dose létale moyenne, c'est la valeur de la dose qui réduit le taux de survie de S à S/e.
Pour D=D0, S=e-1≈ 37%, c'est pourquoi on note souvent ce paramètre D37. L'équation (20) peut aussi s’écrire :
0
D D D
En coordonnées semi-logarithmiques, la courbe de survie est donc représentée par une droite de pente -α. La valeur de D0 présente une large variation selon l'espèce cellulaire considérée, elle dépend aussi du TEL du rayonnement.
La courbe de survie exponentielle répond à un modèle balistique simple. Lors du passage d'une particule à travers la cellule, il peut se produire un événement létal. La production d'un événement létal est aléatoire et le nombre total de ces événements croît proportionnellement avec la dose ; le taux de survie cellulaire est fonction exponentielle de la dose.
En effet, les événements létaux produits après une dose D sont distribués au hasard entre les cellules qui, en proportions diverses, ont subi individuellement aucun, un, deux... événements létaux. On peut définir un nombre moyen d'événements létaux par cellule (p), égal au nombre total des événements létaux produits dans la population cellulaire, divisé par l'effectif de la population.
La loi statistique de Poisson indique que la proportion de cellules dans lesquelles il n'y a aucun événement létal est égale à e-p ; cette proportion représente le taux de survie des cellules.
En rapprochant les expressions :
p e S= − (23) et 0 D / D e S= − (21)
on voit que 1/D0 est le coefficient de proportionnalité entre p et la dose D ; pour une dose D égale à D0, le nombre moyen d'événements létaux par cellule est égal à 1.
Biologiquement, ce modèle signifie que la mort cellulaire est un phénomène de tout ou rien, la cellule non-tuée est intacte et sa radiosensibilité n'est pas modifiée. Il suffit d'un coup au but (une atteinte de la cible) pour tuer la cellule.
La figure 3 ci-dessous représente un exemple de courbe de survie exponentielle en coordonnées semi-logarithmiques.
b. Courbe de survie avec épaulement
Pour des cellules de mammifères, la courbe de survie présente en général une incurvation : sa partie initiale convexe est appelée "épaulement".
Le taux de mortalité, produit par un même incrément de dose, augmente avec la dose. Il y a deux types d'interprétations possibles de ce fait :
- la mort cellulaire résulte de l'accumulation d'événements qui, individuellement, sont incapables de tuer la cellule mais dont l'addition est létale (modèles balistiques).
- des lésions qui, isolées, sont réparables, deviennent irréparables et tuent la cellule si les mécanismes enzymatiques de réparation étant saturés sont devenus incapables de faire face à la multiplicité des lésions (modèles basés sur la réparation).
Modèle quadratique
L'événement létal pour la cellule résulte de l'addition dans une même cible de deux événements sublétaux indépendants, produits par le passage de deux particules distinctes. Le taux de survie est donné par :
2
D
e
S= −β (24)
où β représente la probabilité de production d'un événement sublétal.
La courbe de survie présente une tangente initiale de pente nulle (ce qui traduit une mortalité cellulaire nulle aux faibles doses) et s'incurve progressivement avec la dose.
La figure 4 ci-dessous représente un exemple de courbe de survie modélisée par le modèle quadratique en coordonnées semi-logarithmiques.
Figure 4 : Courbe de survie donnée par le modèle quadratique
Ce modèle représente de façon insatisfaisante la courbe de survie cellulaire aux faibles doses, un meilleur accord avec les résultats expérimentaux est obtenu avec un modèle à deux composantes (linéaire-quadratique).
Modèle linéaire-quadratique
Ce modèle suppose que la létalité cellulaire peut résulter :
- soit d'un seul événement létal, représenté par la composante linéaire
- soit de l'addition de deux événements sublétaux indépendants, représentée par la composante quadratique.
La figure 5 ci-dessous représente un exemple de courbe de survie modélisée par le modèle linéaire-quadratique en coordonnées semi-logarithmiques.
Figure 5 : Courbe de survie donnée par le modèle quadratique-linéaire Le taux de survie est donné par :
) D D ( 2 e S= −α +β (25)
L'expression (25) est appelée relation linéaire quadratique.
La courbe présente une tangente à l'origine, dont la pente négative est -α, puis elle s'incurve progressivement avec la dose. Ce modèle tient compte de la réparation cellulaire.
Les coefficients α et β se rapportent respectivement aux lésions létales et sublétales. Leur rapport est un indice de leur importance relative dans la mortalité cellulaire.
Ce rapport α/β est la valeur de la dose pour laquelle les effets des termes linéaires et quadratiques sont égaux, dans ce cas :
αD = βD2
(26) d'où
D = α/β (27)
Les cellules radiorésistantes ont un rapport α/β petit, leur courbe de survie présente un large épaulement.
Les cellules radiosensibles ont un rapport α/β grand, leur courbe de survie présente un faible épaulement.
Les diverses figures présentées sont extraites de la référence [TUB.86]
1.1.5.2 Courbe de survie pour un rayonnement neutronique
Les neutrons sont des particules qui ont un TEL (Transfert d'Energie Linéique) élevé. Ce type de rayonnement possède donc des caractéristiques radiobiologiques différentes des rayonnements classiquement utilisés (X,γ, électrons).
Après une irradiation par un rayonnement à TEL élevé, on observe généralement des courbes de survie cellulaire de forme exponentielle. Celles-ci peuvent être représentées par l’ expression (20) de la forme [TUB.86] :
D
e
S= −α (20)
La létalité cellulaire est essentiellement due à des lésions létales d'emblée produites par exemple par l’action de particules et d’ions de recul provenant de l’interaction des neutrons.
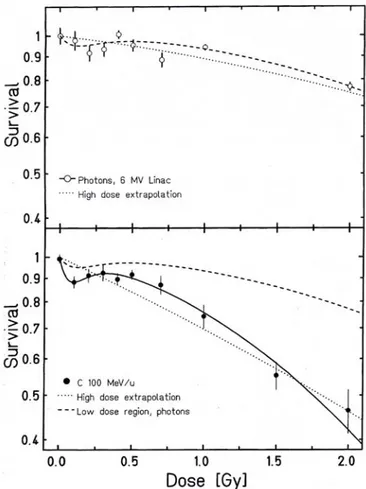
Figure 6 : Influence du TEL sur les courbes de survie cellulaire
La figure 6 ci-dessus compare des courbes de survie cellulaire obtenues après une irradiation par des rayonnements de TEL croissants. Les courbes 1 et 2 concernent des particules α d’énergie croissante, les courbes 3 et 4 correspondent à des deutons et la courbe 5 à des X. Lorsque le TEL augmente, on remarque une augmentation de la pente initiale, une réduction de l'épaulement et une augmentation de la pente finale. Ceci correspond à une augmentation de l'importance relative de la létalité par lésions létales d'emblée par rapport à la létalité par accumulation de lésions sublétales, c'est à dire, en terme de modèle linéaire-quadratique, à une augmentation progressive de la composante linéaire (αD) par rapport à la composante quadratique (βD2). Donc, après une irradiation par un rayonnement neutronique (rayonnement de TEL élevé), la courbe de survie observée peut être représentée en première approximation par une exponentielle.
1.2 Le rationnel de nos travaux de recherche
Le traitement du cancer par radiothérapie se fait classiquement par des photons. La dose totale administrée à la tumeur est délivrée quotidiennement par fraction de dose de 2 Gy. Cette technique repose sur une longue expérience clinique sans rationnel réel. La répétition des doses a permis de trouver un compromis entre la disparition de la tumeur sans trop d’effets délétères sur les tissus sains.
Les radiobiologistes ont alors adopté le système α /β défini précédemment (linéaire quadratique) parce qu’il répondait le mieux à l’irradiation en photons. Ils se sont aperçus qu’il y avait une bonne adéquation entre tumeurs radiorésistantes et α /β petit, tumeurs radiosensibles et α /β grand en supposant que ce rapport est essentiellement dû aux variations de la composante linéaire αD, c'est-à-dire aux lésions létales d’emblée (cible à un coup). Jusqu’alors, il était admis dans la littérature que les courbes de survie observées après une irradiation neutronique présentaient une forme exponentielle pouvant être représentée par l’expression suivante [HAL.00] :
D
e
S= −α (20)
Cela signifie que la létalité cellulaire est essentiellement due à des lésions létales d'emblée et qu’il n’existe pas de lésions sublétales, c'est-à-dire réparables.
Nous pouvons donc représenter la courbe de survie cellulaire en coordonnées semi-logarithmiques après une irradiation neutronique de la façon suivante :
Dose S u rv ie ce ll u la ire D/2 D Dose S u rv ie ce ll u la ire D/2 D
Figure 7 : Effet du fractionnement des doses sur une courbe de survie exponentielle Les raisonnements radiobiologiques sur les neutrons étaient tous fondés sur la linéarité de la courbe de survie, il est admis ainsi que le montre la figure 7 que :
L’effet d’une fraction D est le même que l’effet de deux fractions D/2, il en résulte que le fractionnement n’aurait pas d’influence. Il était aussi admis que le débit de dose n’avait pas d’importance.
Cependant, il est apparu trois paradoxes qui nous ont conduit à étudier l’effet des faibles doses de neutrons sur la survie cellulaire.
Premier paradoxe : De nombreuses publications [HIL.82], [WOR.96], [ELK.91] font état
d’une augmentation majeure de l’ EBR des neutrons avec la diminution de la dose (facteur variant de 3 à plus de 20). Ceci est une des premières anomalies qui a attiré l’attention de notre équipe.
Deuxième paradoxe : Les neutrons sont des particules de TEL élevé, elles sont donc
beaucoup plus agressives que les photons sur les tumeurs mais provoquent en même temps des séquelles importantes sur les tissus sains. Ceci s’explique par le fait que les radiothérapeutes n’ont pas osé diminuer de façon excessive la dose par fraction en rapport avec les données radiobiologiques concernant les photons. Par prudence, ils sont restés du côté minimal de l’EBR et ont donc diminué les doses par fraction de 2 Gy photons à 1 Gy neutron, ce qui ne correspond qu’à une EBR de 2. Dans ces circonstances, il ne faut pas s’étonner que les effets délétères sur les tissus sains soient importants, ce qui a conduit malheureusement à la perte d’intérêt de la communauté radiothérapeutique pour l’irradiation neutronique. Par contre, les neutrons sont encore utilisés mais simplement comme surdosage à certaines tumeurs, dont on évoque, pour justifier cet usage, la radiorésistance aux photons. C’est ainsi que les neutrons sont employés dans le surdosage des tumeurs de la parotide, des sarcomes des membres et éventuellement des cancers de la prostate. Or, considérés sous un tout autre point de vue, les tumeurs précitées ont un autre point commun : il s’agit de leur accessibilité aisée à une radiothérapie qui épargne les tissus sains. Ceci est évident en ce qui concerne les sarcomes des membres et les tumeurs de la parotide. En ce qui concerne la prostate, elle est certes environnée d’organes sensibles, mais étant centrale par rapport au bassin, elle est accessible en multipliant les faisceaux d’irradiation dont elle est le centre de rotation. Cette accessibilité anatomique peut expliquer pourquoi les neutrons sont utilisés sur de telles tumeurs : elle permet en fait d’épargner les tissus sains.
Troisième paradoxe : Nous nous sommes posés la question de l’efficacité biologique des neutrons à beaucoup plus faibles doses. Notre hypothèse de travail était la suivante :
Existerait-il une grande efficacité des neutrons à très faibles doses ?
Un argument nous a laissé pensé qu’il pourrait y avoir une hypersensibilité à faibles doses après une irradiation neutronique. En effet, de tels phénomènes avaient été mis en évidence pour des photons. Ces phénomènes particuliers ont été observés aux faibles doses pour des rayonnements X par P. Lambin, E.P. Malaise et M.C. Joiner [LAMB.94], [JOI.01].
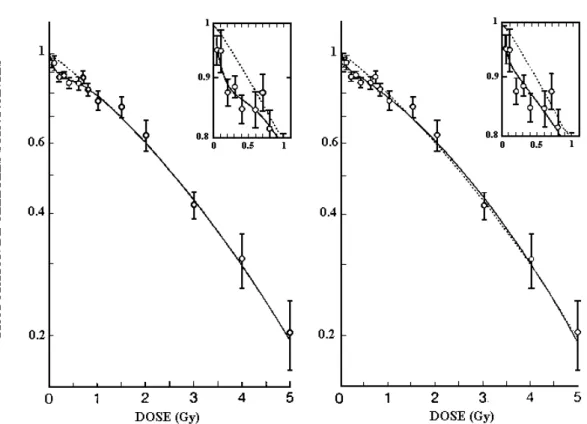
Des cellules humaines de la lignée RT112 provenant d’un carcinome vésical ont été irradiées par des rayons X produits par une tension d’accélération de 240 kV avec un débit de dose de 0,18 Gy.min-1 à des doses allant de 5 cGy à 5 Gy. La survie cellulaire a été déterminée à l’aide de la méthode DMIPS (Dynamic Microscopy Processing Scanner) comprenant un microscope capable d’identifier les cellules et d’enregistrer leur position dans les flacons de culture.
Pour les faibles doses, les auteurs ont mis en évidence une courbe de survie multiphasique avec une phase initiale de grande radiosensibilité suivie d’une rupture de pente entre 0,2 Gy et 0,6 Gy. Ce phénomène n’avait jamais été décrit auparavant.
Sur la courbe de survie cellulaire, on observe une cupule dans la zone comprise entre 0 et 1 Gy. Au-delà de 1 Gy, les courbes de survie sont très bien décrites par le modèle linéaire quadratique, par contre pour des doses inférieures à 1 Gy, on constate une augmentation de la sensibilité des cellules aux rayons X.
Les figures 8 et 9 ci-dessous montrent les courbes de survie obtenues.
Figure 8 : Modèle basé sur la réparation Figure 9 : Modèle à deux populations
Sur la figure 8, la courbe en trait plein est obtenue après lissage d’un modèle tenant compte de phénomènes de réparation. Sur la figure 9, la courbe en trait plein est obtenue après lissage d’un modèle à deux populations qui suppose que 9% des cellules sont hypersensibles à faibles doses. Dans les deux cas, une comparaison est réalisée avec le modèle linéaire-quadratique (ligne tiretée).
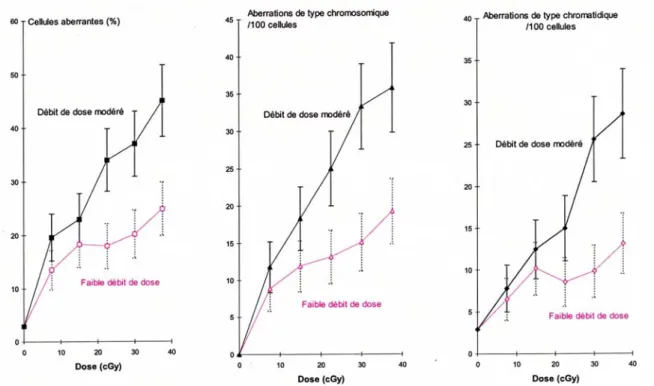
Lambin [LAM.98] a réalisé le même type d’expériences avec les neutrons et les rayons X sur la lignée cellulaire HT29 (cellules tumorales d’origine humaine radio-résistantes), ainsi que le montre la figure 10 ci-dessous.
Figure 10 : Courbe de survie de la lignée HT29 aux neutrons (symboles pleins) et aux rayons X (symboles vides). Chaque point représente la moyenne de 4 expériences.
La courbe de survie après irradiation par des neutrons ne semble pas strictement exponentielle. Pour des doses comprises entre 0 et 0,5 Gy, aucune différence entre la survie en photon et la survie en neutron n’est observée. La divergence entre les deux courbes n’apparaît qu’à partir de 0,5 Gy. Ainsi, aucune hypersensibilité aux faibles doses de neutrons n’a été mise en évidence. La courbe de survie cellulaire en rayons X est du même type que celle observée par les auteurs précédents [LAM.94] ; par contre la courbe de survie pour les neutrons ne présente pas de cupule.
De plus, il a étudié six lignées cellulaires tumorales humaines, en vue d’analyser la corrélation entre le phénomène d’hypersensibilité et la radiosensibilité intrinsèque des cellules. Parmi les lignées cellulaires étudiées se trouvaient deux lignées cellulaires radiorésistantes (HT29 et RT112), deux lignées très radiosensibles (SW48 et HX142) et deux lignées intermédiaires (Be11 et MeWo), (cf.annexe1).
Le phénomène d’hypersensibilité est très visible sur les lignées radiorésistantes (pour des doses comprises entre 0 et 0,5 Gy), ce phénomène est moins visible sur les lignées moyennement résistantes et absent sur les lignées radiosensibles.
Dans l’hypothèse d’une hypersensibilité aux faibles doses de neutrons, l’augmentation de l’EBR lorsqu’on diminue la dose se justifie parfaitement. Les figures 11 et 12 suivantes illustrent cette hypothèse :
La figure 11 ci-dessous représente deux courbes de survie en coordonnées semi-logarithmiques :
- la courbe bleue est une courbe de survie « classique » aux neutrons c’est à dire une courbe de survie exponentielle telle qu’elle était décrite dans la littérature jusqu’à présent.
- la courbe rose est une courbe de survie « classique » aux photons c’est à dire une courbe de survie modélisée par le modèle linéaire-quadratique.
Dose S u r v ie c el lu la ir e DX1 Dn Dn DX2 Dose S u r v ie c el lu la ir e DX1 Dn Dn DX2
Figure 11 : Augmentation de l’EBR des neutrons aux faibles doses pour deux courbes de survie « classique » aux neutrons et aux photons
n x D D EBR = (28) n x n x D D D D 2 1 > (29)
Cette dernière relation, montre bien que l’EBR des neutrons augmente quand les doses d’irradiation diminuent.
En s’appuyant sur les travaux récents publiés pour des irradiations en photons, nous pouvons alors faire l’hypothèse de l’existence d’une hypersensibilité aux faibles doses après irradiation neutronique. La figure 12 ci-dessous représente trois courbes de survie en coordonnées semi-logarithmiques qui illustrent cette hypothèse :
- la courbe bleue est une courbe de survie « classique » aux neutrons c’est à dire une courbe de survie exponentielle telle qu’elle était décrite dans la littérature jusqu’à présent.
- la courbe rose est une courbe de survie « classique » aux photons c’est à dire une courbe de survie modélisée par le modèle linéaire-quadratique.
- la courbe verte est une courbe de survie aux neutrons dans l’hypothèse où il existe une hypersensibilité aux faibles doses.
Dose S u rv ie c el lu la ir e DX Dn1 Dn2 Dose S u rv ie c el lu la ir e DX Dn1 Dn2
Figure 12 : Augmentation de l’EBR des neutrons dans l’hypothèse d’une hypersensibilité des neutrons à faibles doses
Dans ce cas, la dose Dn1 est supérieure à la dose Dn2 pour obtenir un même effet biologique. Ceci pourrait expliquer les grandes variations d’EBR aux faibles doses.
Compte tenu des divers résultats obtenus en photons, nous avons entrepris une étude d’irradiation neutronique de cellules connues pour leur radiorésistance à l’irradiation photonique classique. Ce sont des cellules d’un mélanome humain entretenues en lignée continue sous le nom de BEU à l’unité INSERM U484. Ce travail a nécessité de nombreuses expériences (plus de 50), pour mettre au point la gamme de doses intéressante et comparer les résultats obtenus avec ceux d’une irradiation classique en photons. Les doses d’irradiations (0 à 1 Gy) sont bien inférieures à celles utilisées par Lambin avec de multiples points entre 0 et 30 cGy. Nous décrivons dans le chapitre suivant les conditions expérimentales dans lesquelles ont été effectuées ces irradiations ainsi que les résultats obtenus.
Chapitre 2 :Expériences réalisées dans le cadre
du laboratoire
2.1 Description des dispositifs expérimentaux
Des irradiations de cultures cellulaires par des neutrons rapides ont été réalisées au Laboratoire de Physique Corpusculaire (LPC) qui dispose d’un générateur délivrant des neutrons de 14 MeV à faible flux (3.108n.s-1) dans angle solide de 4π stéradians. Ce flux correspond à un débit de dose de l’ordre de 5 cGy.h-1 au niveau des cultures cellulaires ; dans la suite nous parlerons de « faible débit de dose ».
D’autres irradiations ont été effectuées à l’Etablissement Technique Central de l’Armement (ETCA) à Arcueil qui délivre un flux de neutrons de 14 MeV plus élevé, correspondant à un débit de dose environ 50 fois plus grand que le précédent ; nous parlerons alors de « débit de dose modéré ».
2.1.1 Le dispositif expérimental du LPC
Dans ce paragraphe nous décrivons le principe de fonctionnement du générateur de neutrons du LPC ainsi que le dispositif d’irradiation des cultures cellulaires.
2.1.1.1 Le générateur de neutrons de 14 MeV du LPC
Le générateur de neutrons est situé dans une casemate de béton qui satisfait aux règles de radioprotection. Un compteur à Hélium 3 utilisé comme moniteur fournit un taux de comptage proportionnel au flux de neutrons et permet ainsi de contrôler le flux neutronique pendant l’irradiation.
L'émission neutronique est produite dans un tube scellé (Module d'Emission Neutronique ou MEN) par une réaction de fusion entre les deux isotopes de l'hydrogène : le deutérium et le tritium. On obtient ainsi un noyau d'hélium et un neutron d'énergie cinétique de 14,1 MeV, d'après la réaction : 586 , 17 n He H H1 31 2 42 2 01 1 2 1 + → + + (30)
Le générateur du LPC est un générateur à faible flux de neutrons (3.108 n.s-1) et émet dans un angle solide de 4π stéradians. Il comprend un tube scellé, une alimentation haute tension et un pupitre de commande. Celui-ci regroupe tous les modules permettant le pilotage du générateur ainsi que les organes de sécurité spécifiques à une telle installation.
Le MEN comprend un système assurant la création d'atomes de deutérium et de tritium sous forme de gaz et permettant leur diffusion à travers le tube. Ceux-ci sont ensuite ionisés dans une source d'ions Penning et accélérés jusqu'à la cible.
La production de neutrons est possible en mode continu ou en mode pulsé, avec une fréquence réglable.
La figure 13 représente la coupe transversale du générateur.
Filament
Dépôt d’hydrure de titane Réservoir de nickel
Anode
Cathode en forme de cage
Cible (-125kV) Point d’émission neutronique Système de production des atomes La source d’ions Etage d’accélération Aimant permanent
L’ensemble des caractéristiques du générateur ainsi que les coupes verticales et horizontales de la casemate d’irradiation sont présentées en annexe2.
Nous allons maintenant étudier plus en détail les différentes parties du MEN et les étapes de la production des neutrons.
a. Le système de production des atomes
Les atomes de deutérium et de tritium sont produits dans un réservoir cylindrique en nickel, recouvert d'un dépôt d'hydrure de titane (dépôt contenant du deutérure et du tritiure). Le titane a pour propriété d'absorber à froid l'hydrogène et ses isotopes et de les libérer à chaud. Un filament, placé suivant l'axe du cylindre, est parcouru par un courant de 3 ampères sous une tension de 1,5V (réglable de 0 à 5A ou de 0 à 3V). Essentiellement par rayonnement, le filament fait monter en température le titane qui libère ainsi des atomes de deutérium et de tritium. Ce gaz remplit ensuite tout le volume disponible du tube et en particulier la source d'ions. Lorsque le courant dans le filament est coupé, la température du réservoir de nickel redescend et le gaz de deutérium et de tritium est réabsorbé par le titane. Il est ainsi possible de régler la pression dans le tube en agissant sur le courant circulant dans le filament.
b. La source d'ions Penning
Elle est constituée par une cathode formant une sorte de cage autour de l'anode d'extraction des ions qui est portée au potentiel de 2 kV. La cathode, connectée à la masse, est percée d'un trou permettant la sortie des ions vers l'étage d'accélération.
A la mise sous tension de l'anode, les électrons émis par le métal de la cathode sont attirés par l'anode. Celle-ci est entourée de deux petits aimants permanents créant un champ parallèle à l'axe du tube et donnant ainsi aux électrons une trajectoire hélicoïdale autour de cet axe. Les atomes de deutérium et de tritium présents dans le voisinage de l'anode sont ionisés par interaction coulombienne au passage du courant d'électrons ainsi créé. Les ions sont expulsés par les +2kV de l'anode vers l'étage d'accélération.
Les électrons arrachés aux atomes de gaz lors de l'ionisation contribuent à augmenter le courant d'électrons oscillants, une partie étant absorbée par l'anode.
L'existence du champ magnétique, de l'ordre de 500 Gauss, permet un bon fonctionnement du générateur jusqu'à une pression faible du gaz (≈10-6 torr) c'est à dire lorsque la densité d'ions est faible. En effet, le parcours en hélice des électrons, plus long qu'un parcours en ligne droite améliore le rendement d'ionisation des atomes.
Avant d'entrer dans l'étage d'accélération (≈-125 kV), le courant de décharge arrive sous la forme d'un faisceau étroit et divergent.
Pour fonctionner en mode pulsé et générer des paquets de neutrons, seule la tension d'extraction de la source d'ions est pulsée. Pour l'irradiation des cultures cellulaires, nous fonctionnons exclusivement en mode continu.
c. La cible
La cible est formée d'une couche de titane d'un micromètre d'épaisseur environ, évaporée sur une base d'argent. Lors de la première mise en route du générateur, les premiers ions sont absorbés par la cible de titane qui va être très rapidement saturée en atomes de deutérium et de tritium. On obtient alors dans la cible un nombre d’atomes qui reste pratiquement constant, même après un arrêt prolongé du tube. Ainsi, la cible utilisée est une cible auto-régénérée ("self loading target"), elle a donc une durée de vie plus longue (≥ 1000 heures). Toutefois cette durée de vie est limitée à cause de l’épuisement de la réserve de tritium.
Pour cette raison, nous avons du remplacer le générateur installé en 1992, par un générateur du même type (même énergie de neutrons). Nous serons donc amenées à réaliser des mesures permettant de préciser la nouvelle valeur du flux ainsi que la dosimétrie. Ce nouveau générateur est associé à une électronique de pilotage plus performante, permettant une plus grande stabilité de fonctionnement.
La cible forme la cathode de l'étage d'accélération. Elle est portée à un potentiel négatif réglable de 0 à -125 kV. L'optique d'entrée est une anode trouée connectée à la masse.
Lors du fonctionnement, les ions deutérium et tritium qui arrivent sur la cible induisent les réactions D(D, n)T et T(D, n)α productrices de neutrons.
La réaction principale est la suivante :
586 , 17 n He H H1 31 2 42 2 01 1 2 1 + → + + MeV (30)
Ainsi, les neutrons produits emportent une énergie de 14,1 MeV et les particules α associées ont une énergie de 3,7 MeV.
L'émission neutronique peut être considérée comme mono-énergétique car la quasi-totalité des neutrons sont produits par la réaction T(D, n)α et emportent une énergie de 14,1 MeV plus une partie de l'énergie d'accélération des deutons (0,125 MeV). Moins de 0,5% des neutrons sont produits par la réaction D(D, n)T ; ces neutrons sont émis avec une énergie de 2,4 MeV.
2.1.1.2 Le détecteur à 3He
Le détecteur à 3He est utilisé pour le monitorage du générateur. C'est une chambre d'ionisation, sensible aux neutrons thermiques (section efficace importante de l'ordre de 4000 barns pour les neutrons thermiques). C'est pourquoi les neutrons de 14 MeV sont thermalisés par une sphère modératrice de polyéthylène de 25 cm de diamètre qui enveloppe la chambre d’ionisation. Ce détecteur fournit un nombre d’impulsions par unité de temps, ce nombre d’impulsions est proportionnel au flux de neutrons. Il permet simplement le monitorage et le contrôle du générateur durant les expériences mais ne fournit pas une valeur absolue du flux.
2.1.1.3 Les cultures cellulaires
2.1.2 Le dispositif expérimental de l’ETCA
Dans ce cas, les irradiations ont été effectuées sur un accélérateur de deutons de 400 kV. Les deutons interagissent avec une cible tritiée, les neutrons sont produits par la même réaction que celle décrite précédemment pour le générateur du LPC :
586 , 17 n He H H1 31 2 42 2 01 1 2 1 + → + + MeV (30)
Le tube étant vertical, les flacons où sont cultivées les cellules sont disposés au-dessus du plan horizontal contenant la source de neutrons car c’est dans cette région que l’on a une bonne isotropie du rayonnement. D'autre part, les flacons sont inclinés de telle sorte que leurs parois soient perpendiculaires au flux de neutrons, ainsi toute la surface du
flacon sera irradiée approximativement avec la même
dose.
L'expérience biologique consiste à irradier des cellules de mélanome à faible dose et faible débit de dose
(≈ 5 cGy.h-1). Celles-ci sont
adhérentes à une des parois en PMMA (Polyméthacrylate de méthyle) de chaque flacon.
La mesure de la dose reçue est faite à l’aide de diodes P.I.N. Les défauts créés par les neutrons à l’intérieur de la diode modifient sa conductivité
donc le courant inverse ; cette
variation peut être mesurée à l’aide d’un appareil préalablement calibré. Pour toutes les irradiations, le tube générateur de neutrons est entouré au voisinage de la cible d’une feuille de plomb d ‘épaisseur 1 mm afin d’éliminer les X et γ de faible énergie (< 100 keV).
Figure 14 :Dispositif expérimental ; flacons de culture cellulaire sur leur support placé sur le générateur de
Le flux de neutrons incidents maximal est de l’ordre de 5.1011 neutrons dans un angle solide de 4π stéradians. Lors des irradiations effectuées, les cultures cellulaires sont exposées à une dose 50 fois plus élevée qu’au LPC (débit de dose dit modéré). Les flacons de culture sont placés en arc de cercle à 20 cm de la source comme le montre la figure 15, permettant ainsi d’obtenir un flux homogène de neutrons au niveau des flacons. Le contrôle de la dose est effectué à l’aide d’une chambre à fission préalablement étalonnée et de diodes au silicium. Les flacons de cultures sont entourés d’une feuille de plomb d’épaisseur 1 mm, permettant d’éliminer les X et γ de faible énergie (< 100 keV).
Figure 15 : Dispositif expérimental de l’ETCA
2.2 Résultats obtenus en neutrons à faibles doses en fonction du
débit de dose
La figure 16 représente les courbes de survie pour des cellules de mélanome après irradiation par des rayons X (3 Gy.min-1) et par des neutrons de 14 MeV à faible débit de dose (LPC, 5cGy.h-1).
La figure 17 représente les courbes de survie pour des cellules de mélanome après irradiation par des neutrons à faible débit de dose (LPC, 5 cGy.h-1) et à débit de dose modéré (ETCA, 240 cGy.h-1).
10 100 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 Dose (Gy)
Survie cellulaire (%)
RXNeutrons à faible débit de dose
Figure 16 : Courbes de survie obtenues après irradiation par rayons X et neutrons à faible débit de dose 40 50 60 70 80 90 100 0 10 20 30 40 50 60
Dose (cGy)
Survie cellulaire (%)
Faible débit de dose
Débit de dose modéré
Figure 17 : Courbes de survie obtenues après irradiation des neutrons à faible débit de dose et débit de dose modéré