N° Réf :………
Institut des Sciences et de la Technologie
Département des Sciences de la Nature et de la Vie (SNV)
Mémoire préparé en vue de l’obtention du diplôme de
Master
Domaine : Sciences de la Nature et de la Vie Filière : Ecologie et Environnement Spécialité : Protection des Ecosystèmes
Présenté par :
LARABA Younes BENAMEUR Dallel
Devant le jury :
EL AICHAR Mehdi M.C.B. Président KADECHE Lilia M.C.B. Examinatrice BOUNAMOUS Azzedine M.C.A. Promoteur
Année universitaire :
2018/2019 MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE ةرازو يلعتلا ــ لاعلا م ــ ي ملعلا ثحبلاو ــ ي عماجلا زكرملا دبع يـ حلا ف يـ ظ بـ فوصلاو -يم ـ ةل Centre Universitaire AbdelhafidBOUSSOUF-Mila
Thème
Evaluation de la prévalence de la
Leishmaniose cutanée dans la Wilaya
Remerciement
Nous tenons à remercier sincèrement et profondément en premier lieu le bon Dieu
« ALLAH » qui nous donne la vie, la santé et la volonté d’entamer et de terminer
ce mémoire.
Nous souhaitons adresser nos sincères remerciements à toutes les personnes qui
ont contribué à sa réalisation et ont permis, par leur soutien et leurs conseils, de
le mener à bien, nos remerciements les plus respectueux vont à :
Notre encadreur
BOUNAMOUS Azzedine
pour
avoir diriger ce mémoire
Dr.
KADECHE Lilia
pour
sa gentillesse d’avoir accepter d’examiner ce travail
Dr.
EL AICHAR Mehdi
pour
l’honneur qu’il nous fait de présider les jurys
Nous n’oublions pas de présenter nos remerciements à tout ce qui a
contribué de près ou de loin à la réalisation et l’accomplissement de ce travail.
Finalement un grand merci aux étudiants de la promo 2019.
Dédicace
Je dédie ce modeste travail :
A la lumière de mes jours, la flamme de mon cœur, ma vie et mon bonheur ;
Ma très chère et douce mère Farah, Tu représentes pour moi le symbole de la
bonté par excellence, la source de mes efforts et l’exemple du dévouement qui n’a
pas cessé de m’encourager et de prier pour moi. Que dieu te bénisse et te garde.
A l’homme de ma vie Med Lamine, mon exemple éternel, mon soutien
moral et ma source de joie et de bonheur, Mon père Rien au monde ne vaut les
efforts fournis jour et nuit pour mon éducation et mon bien être. Que dieu te
garde pour moi.
A ma sœur Meryem et mon frère Nouar Mehdi, Je vous remercie pour votre
affection si sincère.
A la mémoire de mes grands-parents paternels Kadour et Mouni qui ont
été toujours dans mon esprit et dans mon cœur, je vous dédie aujourd’hui ma
réussite. Que Dieu, le miséricordieux, vous accueille dans son éternel paradis.
A mes tantes Wided, Soulef et Mounira, votre soutien moral, votre
gentillesse sans égal, votre profond attachement m'ont aidé à réussir.
A tous les membres de ma famille, petits et grands.
A mon ami intime Bilel, un profond respect et un remerciement particulier
pour les moments les plus beaux et les plus dures que tu as partagé avec moi.
A tous mes amis : Seyf Eddine, Ayoub, Moumen, Amina et Dallel pour
l’amitié et les souvenirs de tous les moments que nous avons passé ensemble.
A tous mes collègues de la promotion 2019.
Dédicace
Je dédie ce modeste travail :
A ma très chère mère Dahbia autant de phrases aussi expressives
soient-elle ne sauraient montrer le degré d’amour et d’affection que j’éprouve pour toi.
Tu m’as comblé avec ta tendresse tout au long de mon parcours, reçoit ce travail
en signe de ma profonde estime.
A mon très cher père Djamel autant de phrases et d’expressions aussi
éloquentes sont-elles ne sauraient exprimer ma gratitude. Tu as su m’inculquer le
sens de la responsabilité, de l’optimisme et de la confiance en soi face aux
difficultés de la vie.
A mes sœur Manel, Nihad et mes frères Salah, Hocine, Je vous remercie
pour votre affection si sincère.
A ma chère grand-mère paternelle Zahrouna que dieu te préserve santé, et
à la mémoire de mon grand-père paternel Salah.
A mon cher grand-père maternel Amar, ma chère grand-mère maternelle Akila,
soit l’expression des vœux que vous n’avez cessé de formuler dans vos prières.
A mes petites Alic et Acil, pour toute l’ambiance dont vous m’as entouré.
A tous les membres de ma famille, petits et grands.
A mon cher Mahrous le trèfle à quatre feuilles, tu es difficile à trouver
mais je suis chanceuse de t’avoir, merci d’être là dans ma vie.
A tous mes amis : Younes, Amina, Karima et Fulla pour l’amitié et les
souvenirs de tous les moments que nous avons passé ensemble.
A tous mes collègues de la promotion 2019.
Remerciements Dédicaces
Liste des abréviations Liste des figures Liste des tableaux Glossaire
Introduction
CHAPITRE I : Synthèse Bibliographique
Généralités sur les Leishmanioses………...…………. -03-
1. Définition……….…………. -03-
2. Historique………... -04-
3. Leishmanioses dans le monde………... -05-
3-1. Leishmanioses viscérales dans le monde……….... -06-
3-2. Leishmanioses cutané dans le monde………. -07-
3-3. Leishmanioses cutaneo-muqueuse dans le monde………. -09-
4. Répartition géographique de la LC………... -10-
4-1. Dans le monde………. -10-
4-2. En Algérie………... -11-
4-2-1. La leishmaniose cutanée zoonotique (LCZ).………. -12-
4-2-2. La Leishmaniose cutanée sporadique (LCS)………... -12-
4-2-3. Autres cas……….……….. -13-
5. Importance des leishmanioses………... -14-
5-1. Importance médicale………... -14-
5-2. Importance économique.………... -14-
6. Epidémiologie Générale……….... -14-
6-1. Le parasite Leishmania………... -14-
6-2. Le vecteur………... -18-
6-3. Le réservoir des parasites……….... -24-
6-3-2. Rôle du réservoir………... -27- 6-4. Le cycle de parasite……….….... -27- 7. Co-infection VIH/Leishmania……….…... -28- 8. Clinique……….…... -29- 8-1. Incubation ……….. -29- 8-2. Invasion………...…... -29- 8-3. Phase d’état………...….….. -30- 8-4. Evolution………...………. -30-
9. Facteurs environnementaux qui affectent la transmission de la leishmaniose cutanée…… -30-
9-1. Facteurs anthropiques……….… -30-
9-2. Facteurs environnementaux naturels………..… -31-
10. Principaux facteurs de risque……….. -31-
11. Traitement et Vaccination………... -32-
12. Prévention et Lutte……….. -33-
13. Climat……….. -34-
13-1. Définition……….. -34-
13-1-1. Les changements climatiques……….. -34-
13-1-2. Influence du climat sur la leishmaniose cutanée………. -35-
CHAPITRE II : Matériel et Méthodes 1. Présentation de la zone d’étude………. -37-
1-1. Situation géographique………... -37- 1-2. Aspect Administratif………... -37- 1-3. Climat……….. -38- 1-3-1. Précipitations………... -38- 1-3-2. Température………... -38- 1-3-3. Vent……….... -39- 1-4. Relief………... -39- 1-5. Hydrologie ……….... -39- 1-6. Végétation……….. -40- 1-7. Infrastructures sanitaires... -40-
2. Objectifs………..……….. -40-
2-1. Objectif principal……….... -40-
2-2. Objectif secondaire…….……… -41-
3. Techniques utilisées pour le diagnostic de la leishmaniose……….………. -41-
3-1. Examen microscopique………..………. -41-
3-2. Culture………..………... -41-
3-3. Sérologie………. -41-
3-4. Mise en évidence de l’ADN parasitaire……….………. -42-
4. Etapes de diagnostic………..……… -42-
4-1. Matériels et réactifs du laboratoire………..………... -42-
4-1-1. Matériels utilisé……….……… -42-
4-1.2. Réactifs………...………... -42-
4-2. Prélèvements………..………. -44-
4-3. Examen direct……….……… -44-
5. Enquête épidémiologique de la leishmaniose………..………. -46-
CHAPITRE III : Résultats et discussion 1. La fréquence de la LC………..……… -47-
2. Evolution temporelle de la leishmaniose cutanée (2009-2018).….……….. -48-
2-1. Evolution annuelle……….………. -48-
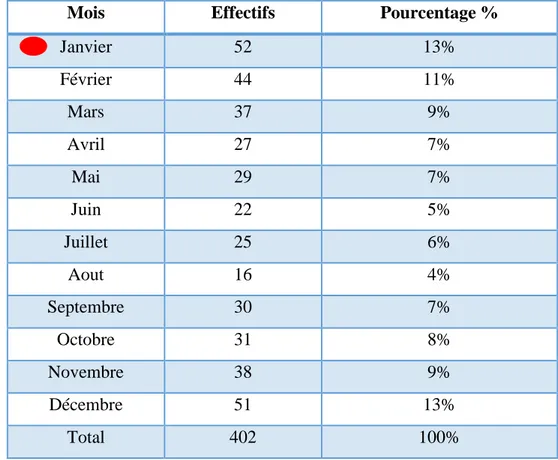
2-2. Evolution mensuelle………..…………...………….. -49-
2-3. Evolution saisonnière………..……… -51-
2-4. Evolution selon le sexe……….……….. -52-
2-5. Evolution selon les tranches d'âge……….………. -54-
2-6. Evolution selon l'origine géographique………..………...………. -55-
2-7. Evolution selon les communes de la wilaya de Constantine….………. -56-
2-8. Evolution selon la durée d'évolution de la lésion………..………...……….. -58-
2-9. Evolution selon le nombre de lésion……….………...……….. -59-
2-10. Evolution selon l'aspect de la lésion……….………...……… -60-
3-1. Répartition des cas da la LC en fonction de la température………..………... -63- 3-2. Répartition des cas LC en fonction des précipitations………... -65- 4. Impact des facteurs climatiques sur la Leishmaniose cutanée………...……….. -66- Conclusion
Références Bibliographiques Annexes
Liste des abréviations
Abréviations Signification L Leishmaniose LC Leishmaniose cutanée LV Leishmaniose viscérale LCM Leishmaniose cutanéomuqueuse LCD Leishmaniose Cutanée Diffuse LCL Leishmaniose Cutanée Localisée LCS Leishmaniose Cutanée Sporadique LCZ Leishmaniose Cutanée-ZoonotiqueP Phlebotomus S Sergentomyia
LCA Leishmaniose cutanée anthroponotique LDPKA Leishmaniose Dermique Post Kala-Azar
CHU Centre Hospitalier Universitaire MI Membre inférieur
MS Membre supérieur PCR Protein Chain Reaction
IFI Immuno Fluorescence Indirecte EIA Enzymoimmunoassay
MGG May Grünwald-Giemsa
OMS Organisation Mondiale de la Santé VIH Virus de l'Immunodéficience Humaine WHO World Health Organisation
ANOFEL Association Française des Enseignants de Parasitologie et Mycologie
AC Anticorps
CAC Centre Anti Cancer
G.I.E.C Groupe d’experts intergouvernemental sur l’évolution du climat
Tab Tableau
Fig Figure
Liste des figures
N° Figure Titre N° Page
01 Les « pères » des leishmanies. A gauche, William Leishman et à droite, Charles Donovan
05
02 Distribution de la leishmaniose dans le monde 06
03 Leishmanioses cutanéo-muqueuse (L. braziliensis): Ulcérations et destruction des muqueuses faciales
09
04 Répartition géographique de la leishmaniose cutanée dans le monde 11 05 Répartition géographique de la leishmaniose cutanée en Algérie en 2009 11 06 Différents aspects cliniques de la leishmaniose cutanée zoonotique chez
les enfants prélevés au niveau de l’annexe Pasteur de M’sila
12
07 Lésion de LCS due à Leishmania infantum 13
08 Les différents foyers de leishmaniose cutanée en Algérie 13
09 Forme promastigote 16
10 Forme amastigote 16
11 Ultrastructure de Leishmania 17
12 Phlébotome mâle et femelle 18
13 Morphologie générale d’un phlébotome adulte 19
14 Tête d’un phlébotome adulte (vue ventrale) 20
15 Thorax de phlébotome 21
16 Génitalia mâle 21
17 Génitalia femelle 21
18 Cycle de vie du phlébotome 22
19 Différents types de cycles épidémiologiques 24 20 Psammomys obesus 25
21 Meriones shawi 25
22 Chien atteint de la L 26
23 Diagramme schématique du cycle de vie de Leishmania 28 24 Carte mondiale des cas rapportés de co-infection VIH/Leishmania 29
25 Localisation de la wilaya de Constantine 37
26 Les communes de la wilaya de Constantine 38
28 Centre Hospitalo Universitaire Ben Badis de Constantine 41
29 Matériels et réactifs du prélèvement 43
30 Matériels et réactifs de coloration 43
31 Matériels et réactifs de lecture 44
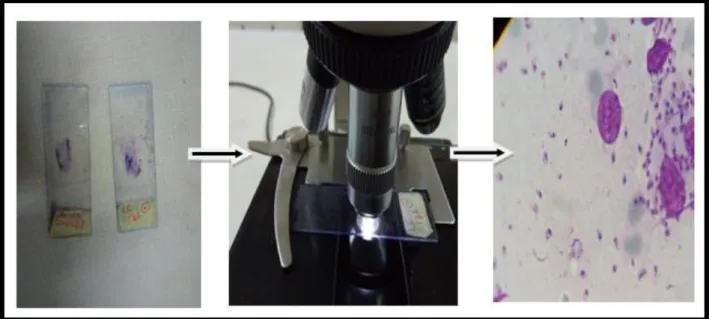
32 Les étapes de l’examen direct : A- Séchage du frottis sanguin. B- la coloration par le colorant Giemsa. C- Rinçage des lames. D- séchage les lames sur du papier absorbant
45
33 Formes amastigotes des leishmanies, sur un prélèvement coloré par Giemsa (Observation au microscope à l'objectif 100)
45
34 Observation les lames préparées par le microscope 46
35 Forme amastigote de Leishmania 46
36 La fréquence de la LC (2009-2018) 47
37 Evolution annuelle des cas de LC (2009-2018) 48
38 Répartition des effectifs de la LC en fonction des mois (2009-2018) 50
39 Répartition saisonnière de la LC (2009-2018). 51
40 Répartition des cas de LC selon le sexe (2009-2018) 53 41 Répartition des cas de LC selon les tranches d'âge 54 42 Répartition des cas de la LC selon leur origine géographique 56 43 Répartition des cas de la LC selon la commune de résidence 57 44 Répartition des cas de la LC selon la durée d'évolution 58 45 Répartition des cas de la LC selon le nombre des lésions 60 46 Répartition des cas de la LC selon l’aspect de la lésion 61 47 Répartition des cas de la LC selon la localisation des lésions. 62 48 Répartition des effectifs de la LC en fonction de température moyenne
(2009-2018).
63 49 Dispersion entre la température moyenne et le nombre de cas de la
leishmaniose cutanée (2009-2018)
64
50 Répartition des cas de la LC en fonction de précipitation totale (2009-2018)
65
51 Dispersion entre Précipitations et le nombre de cas de la leishmaniose cutanée (2009-2018)
66
52 Dispersion entre Précipitations, température et nombre de cas de la leishmaniose cutanée (2009-2018)
Liste des tableaux
N° Tableau Titre N° Page
01 Principales espèces de Leishmanies classées selon le contexte clinique et la répartition géographique
06 02 Les différentes espèces de leishmanie de l'ancien monde et de leurs
principales caractéristiques
08 03 Les différentes espèces de la leishmaniose cutanée du nouveau monde 09 04 Distribution géographique des espèces du nouveau monde 10
05 La classification de Phlébotome 19
06 Liste des espèces de phlébotomes représentées en Algérie 23
07 Fréquence de la LC (2009-2018). 47
08 Evolution annuelle de la leishmaniose cutanée (2009-2018) 48 09 Répartition des effectifs de la LC en fonction des mois pour toute la
période d’étude (2009- 2018)
49 10 Répartition saisonnière de la leishmaniose cutanée (2009-2018) 51 11 Répartition des cas de la leishmaniose cutanée selon le sexe. 52 12 Répartition des cas de leishmaniose cutanée selon les tranches d'âge 54 13 Répartition des cas de la leishmaniose cutanée selon l'origine
géographique
55 14 Répartition des cas de la leishmaniose cutanée selon les communes de
la Wilaya de Constantine
57 15 Répartition des cas de la leishmaniose cutanée selon la durée
d'évolution de la lésion
58 16 Répartition des cas de la leishmaniose cutanée selon le nombre de
lésion
59 17 Répartition des cas de la leishmaniose cutanée par l’aspect de la lésion 61 18 Répartition des cas de la leishmaniose cutanée selon la localisation des
lésions
62 19 Corrélation entre la température moyenne et le nombre de cas de la
leishmaniose cutanée (2009-2018).
64 20 Corrélation entre les précipitations et le nombre de cas de la
leishmaniose cutanée (2009-2018)65
66 21 Nombre de cas de la leishmaniose cu65tanée en relation avec les
paramètres Climatiques (2009-2018)
67 22 Corrélation entre les précipitations, température et nombre de cas de la
leishmaniose cutanée (2009-2018)
Glossaire
L’incidence :
L'incidence d'une maladie est une évaluation statistique du risque, pour une personne ou une catégorie de personnes, de développer cette maladie. L'incidence est une des branches de l'épidémiologie. Elle se base sur des études statistiques.
Taux d'incidence :
On définit le taux d'incidence en donnant le nombre d'individus susceptibles de développer telle ou telle maladie sur un nombre de personnes (généralement sur 100000) en un laps de temps donné (généralement un an).
Prévalence :
La prévalence est un outil de mesure statistique médicale. Elle renseigne sur le nombre de personnes atteintes par une maladie ou tout autre évènement comme un accident, les suicides, au sein d'une population à un moment donné.
Epidémie :
Une épidémie désigne l'augmentation rapide de l'incidence d'une pathologie en un lieu donné sur un moment donné, sans forcément comporter une notion de contagiosité.
Endémie :
Une endémie désigne la présence habituelle d'une maladie dans une région déterminée. Endémo-épidémie :
Le terme d'endémo-épidémie est utilisé en cas d'épidémie survenant dans une zone d'endémicité pour une maladie donnée. Tous ces termes sont liés, en pratique, à des agents infectieux : bactéries, virus, parasites, prions.
La zoonose
Maladie qui frappe surtout les animaux, mais qui est éventuellement transmissible à l’homme.
Sporadique :
Se dit d’une maladie atteignant des individus isolément, contrairement aux maladies épidémiques ou endémiques.
Anthroposonose :
Les maladies parasitaires ou parasitiques sont provoquées par le développement des parasites dans l’organisme hôte. Également appelées parasitoses, elles peuvent être classées selon leurs agents (types de parasites) ou les organes attaqués (la parasitose digestive, intestinale, cutanée). Il existe de nombreuses parasitoses au tant qu’il y a de parasites, mais certaines maladies ainsi que leurs agents sont beaucoup plus courants que d’autres comme les leishmanioses (Site Web 08 consulté le 25/05/2019).
A cet effet, les modifications et la variabilité du climat, s’ajoutent aux facteurs favorables aux maladies à transmission vectorielle (les variations météorologiques saisonnières, la situation socioéconomique, les programmes de lutte antivectorielle, les modifications de l’environnement et la résistance aux médicaments) sont susceptibles d’influencer l´épidémiologie de ces maladies. Les effets de cette situation s’exprimeront probablement de diverses façons, allant de brèves épidémies à des modifications progressives à long terme des tendances de la morbidité (Andrew et al ., 2001).
Les leishmanioses sont des maladies parasitaires largement répandues et possèdent une aire de répartition globalement circumterrestre (Dedet, 2001; Pilly, 2015). Elles représentent un sérieux problème de santé dans les pays tropicaux en raison de leur diversité clinique (cutanée, viscérale et cutanée-muqueuse) et épidémiologique, de la complexité de leurs cycle parasitaires et de la multiplicité de leurs réservoirs (homme, rongeur et chien). Ces maladies sont endémiques dans la majorité des pays ayant un climat tempéré comme le Soudan, le Maroc, l’Algérie, la Tunisie, le Bengladesh, l’Inde et le Brésil (Traoré et al., 2001, Aoun., et al., 2009, Fendri, et al., 2012, Singh et al., 2012, Houti et al., 2016, Gutiérrez et al., 2017).
Elles sont transmises à l’homme par la piqure d’une petite mouche de sable infestée appelée phlébotome femelle. Ce moucheron s’adapte bien aux climats tropicaux et subtropicaux comme il est répandu dans la région méditerranéenne (Gutiérrez et al., 2017 ; Tiwari, et al., 2018) ; Duvallet, 2006 ; Haouas et al., 2015). Les leishmanioses se manifestent sous différentes formes à savoir viscérale, cutanées ou cutanéo-muqueuses. Il faut signaler, cependant, que selon Houti et al., (2016) qu’elles ont des territoires qui dépendent des facteurs intrinsèques liés (espèces de parasite, de phlébotomes vecteurs et de mammifères réservoirs), mais également de facteurs extrinsèques (environnementaux, notamment l’insalubrité des espaces).
La prévalence mondiale dépasse 10 millions de cas, avec 1,5 à 2 millions nouveaux cas par an, dont une forte proportion d’enfants. Alors que la mortalité mondiale annuelle est estimée à 70000 cas considérée comme la deuxième cause de mortalité d’origine parasitaire après le
sont réalisées dans divers domaines tels que le diagnostic, le traitement et la prévention de la leishmaniose. Ces progrès facilitent la mise en place de programmes nationaux et régionaux de lutte susceptible de s’inscrire dans la durée mais ceux qui fonctionnent sont encore rares et l’on observe une inquiétante tendance à l’accroissement dans la morbidité et la mortalité dues à la leishmaniose (OMS, 2017).
Les espèces de Leishmania présentent statistiquement des potentialités pathogèniques différentes, comme par exemple, le complexe Leishmania braziliensis, responsable des formes cutanées, ainsi que des formes cutano-muqueuses ou le complexe L. donovani, agent de la leishmaniose viscérale humaine et de la leishmaniose canine. Les leishmanies révèlent aussi des différences de comportement vis-à-vis de la cellule hote, par exemple, entre L. major et L. donovani, la réponse inflammatoire provoquée est très différente.
L'Algérie, compte parmi les pays les plus touchés du bassin méditerranéen. Il est concerné aussi bien par la leishmaniose cutanée (LC) que viscérale. Les leishmanioses sont des maladies à déclaration obligatoire, ainsi leur extension à différentes régions du pays entraine une forte demande de diagnostics au niveau des laboratoires de parasitologie (H. Zait, 2009 ; Tomás-Péreza et al., 2014).
La wilaya de Constantine est l’une des régions concernées par cette maladie, vu l'augmentation globale de son incidence qui s’explique par la présence de certains facteurs (socioéconomique, mouvements de population, changements environnementaux et climatique).
En se basant sur l’importance de la maladie rapportée, dans la littérature et la recrudescence du nombre de cas ainsi que son extension, il s’est avéré nécessaire de réaliser une étude sur la fréquence de la leishmaniose cutanée (LC) dans la wilaya de Constantine, afin d'éclairer la situation épidémiologique.
Notre objectif est double :
- Déterminer la fréquence de la leishmaniose cutanée à travers les cas diagnostiqués au service de Parasitologie-Mycologie au sein du laboratoire central du CHU de Constantine sur une période de dix ans (de 2009 au 2018).
- D’établir un profil épidémiologique des cas présentant l’affection avec une répartition géographique.
Ce mémoire est organisé en 03 chapitres :
Le chapitre I est une synthèse bibliographique consacrée aux leishmanioses. Le chapitre II présente la partie matériel et méthodes
CHAPITRE I :
Synthèse
Généralités sur les Leishmanioses
Les leishmanioses comptent parmi les nombreuses maladies vectorielles affectant l’homme et/ ou l’animal qui ont émergé ou ré émergé ces dernières années, elles sont en passe de devenir un problème de santé majeur (WHO, 2007). De part sa fréquence, sa gravité, avec un grand problème d’ordre esthétique (pour la leishmaniose cutanée), imposant à développer les modalités de la lutte et de la prévention (Acebey et al., 2008). Les évaluations antérieures sur l’incidence de la leishmaniose cutanée dans le monde sont de 12 millions de personnes infectés et 350 millions de personnes dans le risque d’en attraper. Ces nombres, sont probablement sous-estimés. Le fardeau de la leishmaniose est plus grand dans les pays en voie de développement où la sous déclaration est flagrante. Seulement 32 pays déclarent régulièrement de cas de leishmaniose (WHO, 2010). La maladie est classée en tant qu’importante maladie tropicale négligée et vient après la malaria en termes de mortalité par maladie parasitaire (Alvar et al., 2006).
Les leishmanioses constituent un ensemble hétérogène d'affections toutes dues à l'infection de l'hôte par un parasite, protozoaire du genre Leishmania, et transmises par un insecte vecteur, le phlébotome. Chez l'homme, les leishmanioses représentent un spectre clinique large, allant d'une simple lésion cutanée auto résolutive aux formes cutanéomuqueuse et viscérale, cette dernière peut être mortelle en absence du traitement et elle est considérée comme une parasitose opportuniste à part entière vu sa fréquence et sa gravité au cours de l'infection par le VIH (Bachi, 2006).
1. Définition
Les leishmanioses sont un groupe de maladies parasitaires d’expression clinique variée dues à des protozoaires flagellés appartenant au genre Leishmania. Ce sont des maladies émergentes et étroitement liées à l’état de l’environnement. Ces parasites affectent de nombreuses espèces de mammifères, dont l’homme, auxquelles ils sont transmis par la piqûre infestante d’un diptère, vecteur hématophage appartenant au genre Phlebotomus dans l’ancien monde et Lutzomyia dans le nouveau monde. Ce sont des maladies infectieuses dues au parasitisme des cellules mononuclées par des protozoaires flagellés (Ashford, 2000).
2. Historique
Les leishmanioses sont connues depuis longtemps, la première description clinique moderne est celle de Mc Naught en 1882 et c'est Cunningham en 1885 qui découvrit les parasites dans un prélèvement de bouton d'Orient (Golvan, 1984).
En 1898, en Ouzbékistan, le médecin militaire Borovsky mentionna un protozoaire dans des prélèvements d'ulcère, sans déterminer le statut taxonomique (Akhoundi et al., 2016).
Le parasite Leishmania fut découverte par Sir William Leishman en 1900 dans des frottis de la rate d'un soldat mort de fièvre à Dum-Dum (l'un des anciens noms de la leishmaniose viscérale) en Inde. Alors qu'il publiait ses résultats en 1903, Charles Donovin, la même année, identifia le même parasite dans une biopsie de rate. Le parasite fut nommé
Leishmania donovani et la forme promastigote est appelée corps de Leishman – donovin
(Boussaa, 2008).
En 1904, Mesnil rapproche les agents des deux formes. La même année, Rogers décrit dans une culture in vitro de sang citraté des formes flagellées (Akhoundi et al., 2016).
En 1908, Nicolle et Comte découvrent les mêmes protozoaires chez le chien, puis chez le cheval et le chat. Ils font ainsi de cette affection une maladie commune à l'homme et aux autres mammifères et ouvrent la voie aux recherches épidémiologiques (Golvan, 1984).
L'étude du mode de transmission de leishmaniose connaitra une avancée significative en 1921 grâce aux travaux expérimentale sur l'homme (avec des phlébotomes infectés.) réalisés à l'Institut Pasteur d'Alger (IPA) par les frères Sergent et leurs collaborateurs par application des broyats de ces insectes sur des scarifications cutanées. Mais la transmission par piqure ne fut prouvée qu'en 1941 par Adler et Ber (Tall, 2008).
Dès 1921, Beaurepaire-Arago démontre le rôle d'autres phlébotomes dans la transmission de la leishmaniose forestière américaine. Knowles en 1924 l'établit pour le Kala-azar. Parrot et Donatien en 1930 pour la leishmaniose canine ; ainsi que l'école soviétique, avec Latyshev et Krujukova, en 1941 (Tomás-Péreza, 2014).
En 1937, Cunha et Chagas: isolement de Leishmania chagasi, agent de la leishmaniose viscérale en Amérique (Dedet, 1994).
En 1949, Eglisse donna une classification de la leishmaniose d'après la morphologie, les caractéristiques de la culture, la clinique et les aspects épidémiologiques d'infection chez l'être humain et autres hôtes naturels (Akhoundi et al., 2016).
A partir de 1970, la caractérisation iso- enzymatique des souches de leishmanies est devenue courante après la publication de l'OMS (1982) sur le sujet. Les premiers cas de Co- infection VIH-leishmanies sont signalés à partir de 1985 (Boussaa, 2008).
Figure 01 : Les « pères » des leishmanies. A gauche, William Leishman et à droite, Charles Donovan (Jebbouri, 2013).
3. Leishmanioses dans le monde
Les leishmanioses humaines sont endémiques dans 98 pays et 3 territoires, à l'exception de l'Australie et l'antarctique, la maladie touche surtout les pays pauvres, le nombre des cas de LV atteint 0,2 à 0,4 million, ceux-ci se produit en Bangladesh, Soudan, Ethiopie, Brésil; Avec près de 9٪ des cas mondiaux se localise dans la région de Bihar (l’Inde), d’autre part, depuis le début de la pandémie de l’HIV dans les années 1990, il y a eu une augmentation dans les cas rapportés des co-infection leishmaniose-VIH. Alors que pour la leishmaniose cutanée, on estime environ 0,7 à 1,2 million de cas dans le foyer Méditerranéen.
Principalement vu en Amérique et l’ouest de l’Asie, bien que jusqu'à 75٪ d’entre eux sont signalés au Brésil, Série, l’Afghanistan. En ce qui concerne la leishmaniose cutanéomuqueuse (LCM), on estime annuellement environ 35000 cas au Brésil, Pérou et la Bolivie (Pace, 2014). La leishmaniose diffère par son contexte clinique et par l’espèce en cause d’un pays à un autre et d’une région à une autre.
Figure 02 : Distribution de la leishmaniose dans le monde (ANOFEL, 2014). Tableau 01 : Principales espèces de Leishmanies classées selon le contexte clinique et la
répartition géographique (ANOFEL, 2014). Leishmaniose viscérale Leishmaniose Cutanée Leishmaniose cutanéomuqueuse Nouveau monde (Amérique)
L.infantum L.mexicana, L.amazonensis L.venezuelensis, L.guyanensis L.panamensis, L.peruviana L.braziliensis Ancien monde (Europe, Afrique, Asie) L.donovani L.infantum L.tropica, L.major L.aethropica, L.infantum
3-1. Leishmanioses viscérales dans le monde
Dans l'ancien monde : La LV est évoquée par deux entités :
*La forme zoonotique dont le réservoir principal est le chien pour L. infantum dans les foyers méditerranéens et centre asiatique ; L. chagasi est l’espèce responsable en Amérique du Sud (Carre et al., 2010 et Amrani et al., 2011).
La forme méditerranéenne classique du jeune enfant est caractérisée par la triade classique comme la splénomégalie homogène fébrile, une pâleur « vieille cire » (témoin clinique de l'anémie) et la présence d'une hépatomégalie. Alors que chez l'adulte cette triade est moins constante, dans la moitié de ces cas, on retrouve une immunodépression permanente (Co - infection avec VIH ou thérapie immunosuppressive) (Marty, 2010).
*La LV anthroponotique est due à L. donovani, dans les foyers indiens et l’Est-africain dont l'homme est le principal réservoir (Carre et al., 2010 et Amrani Hassania et al., 2011).
Cette forme atteint les patients de toutes les tranches d'âge. La triade clinique (fièvre, pâleur, splénomégalie) est fréquente. Une hépatomégalie et des adénopathies peuvent être présentes. Des manifestations cutanées sous forme de taches noirâtres ou bistres sont souvent associées, d’où le nom de "kala azar " (signifiant "maladie noire en sanscrit) donné en Inde à cette maladie (Marty, 2010).
Dans le nouveau monde : L’agent étiologique de la LV est L. infantum.
Elle peut être sporadique ou endémique présentant le même tableau clinique que la leishmaniose à L. infantum de l'ancien monde. La plupart des cas s'observent chez les enfants moins de10 ans, mais les adultes sont également fréquemment atteints dans les foyers où la maladie a été récemment réintroduite (Cherif, 2014).
3-2. Leishmanioses cutanées dans le monde Dans l’ancien monde
Elle est causée par quatre espèces différentes de leishmania, avec des répartitions géographiques et des manifestations cliniques propres. Il s'agit de L. major, L. tropica, L.
aethiopica et L. infantum (Tomás-Péreza, 2014).
La LC causée par L. tropica (précédemment connue sous le nom d'anthroponotique ou de leishmaniose cutanée anthroponotique urbaine) prend fréquemment l'aspect d'ulcérations sèches de la peau, qui guérissent d'habitude spontanément en environ un an ou plus, ce qui conduit souvent à des cicatrices disgracieuses. La période d'incubation est habituellement de 2-8 mois.
La LC causée par L. major (précédemment connue sous le nom de zoonotique ou leishmaniose cutanée zoonotique rurale) apparaît souvent comme une peau sévèrement enflammée et ulcérée, qui généralement guérit spontanément en une période de 2-8 mois. Il peut y avoir des lésions multiples, en particulier chez les patients non immuns. La période d'incubation est souvent de moins de quatre mois.
La leishmaniose cutanée causée par L. infantum provoque généralement une seule lésion nodulaire de la face (c'est à dire qu'il n'y a ni croûte ni ulcération et qu'à l'exception de l'induration et de la couleur, la peau sur laquelle la lésion semble presque normale). Bien que
L. infantum provoque également la leishmaniose viscérale, les lésions cutanées se développent
le plus souvent sans aucune atteinte viscérale.
La LC due à L. aethropica prend trois formes principales différentes par l'aspect des lésions : le bouton d'orient, la leishmaniose cutanéomuqueuse et la LC diffuse, la plupart des lésions évoluent lentement, l'ulcération est tardive ou absente et la guérison intervient dans un délai de 1à 3 ans ou plus (WHO, 2010).
Tableau 02 : Les différentes espèces de leishmanie de l'ancien monde et de leurs principales caractéristiques (Weibel Galluzzo et al., 2013).
Espèce Clinique Réservoir Transmission Répartition géographique
L.infantum L. viscérale L. cutanée
Chien, Canidés
Péridomestique Bassin méditerranéen, Moyen-Orient, Asie
centrale.
L.major
L. cutanée Rongeurs Rurale
Bassin méditerranéen, Proche-Orient, Moyen-Orient, Afrique du nord et occidentale, Asie centrale, Pakistan. L.tropica L. cutanée, récidivante Homme Chien Urbaine Bassin méditerranéen, Proche-Orient, Moyen-Orient, Afrique du nord. L.aethiopica L. cutanée L. cutanée diffuse Damans
Rurale Ethiopie, Kenya.
Dans le nouveau monde
Elle est provoquée par de nombreuses espèces et sous espèces de Leishmania, d'abondance variable dans la région d'Amérique. Le tableau clinique est analogue à celui de la LC de l'ancien monde, mais les lésions sont en générale plus grave et durable. Le tableau suivant résume les différentes espèces de cette variété.
Tableau 03 : Les différentes espèces de la leishmaniose cutanée du nouveau monde (Acebey et al., 2008).
Genre Sous genre Complexe Espèce
Leishmania
Leishmania L.mexicana L.mexicana, L.amazonensis L.pifanoi, L.venuelensis
Viannia
L.lainsoni L.lainsoni
L.braziliensis L.braziliensis, L.peruviana L.guyanensis L.guyanensis, L.panamensis
3-3. Leishmanioses cutaneo-muqueuse dans le monde
Elle est surtout due à L. braziliensis, largement répandue du Sud de Mexique au Nord de l'Argentine, c'est une zoonose où les manifestations cliniques, évoluent en deux temps : d'une part, l’apparition des ulcères cutanés initiaux, qui finissent par se résorber spontanément entre six mois et un an et d’autre part, une deuxième infection peut s’installer avant la guérison de la première ou apparaître plusieurs années plus tard. Elle provoque des lésions pouvant conduire à une destruction étendue et mutilante des muqueuses du nez, de la bouche et de la gorge (Acebey et al., 2008 et ANOFEL, 2014).
Figure 03 : Leishmaniose cutanéo-muqueuse (L. braziliensis) : Ulcérations et destruction des muqueuses faciales (ANOFEL, 2014).
4. Répartition géographique de la LC 4-1. Dans le monde
Largement répandues à la surface du globe, les leishmanioses connaissent une aire géographique circumterrestre, globalement intertropicale, mais débordant fortement sur des zones tempérées d’Afrique du Nord, du Sud de l‘Europe et de l’Asie (Dedet, 2001).
Les foyers de leishmaniose sont nombreux et dispersés. D’après leur distribution géographique on distingue deux grandes situations géographiques, l’Ancien monde (Sud de l’Europe, Afrique, Proche-Orient et Asie) et le Nouveau monde (Amériques du Nord, du Sud et Centrale).
Les foyers de l’ancien Monde sont le foyer indien qui comprend l’Inde, le Pakistan, le Bengladesh, le Sri Lanka, la Birmanie accessoirement l’Indochine et l’Indonésie,
Le foyer méditerranéen qui concerne les pays du pourtour du bassin méditerranéen. Le foyer chinois s’étend au Nord-Est de ce pays. Il s’agit surtout de Kala-azar.
Le foyer d’Asie centrale recouvre l’Anatolie, les plateaux iraniens, l’Afghanistan, l’Asie centrale et méridionale russe. Les formes cutanées y prédominent.
Le foyer d’Afrique tropicale est plus important qu’on ne le pensait : des leishmanioses viscérales ou cutanées ont été rapportées en Afrique centrale, sur les rives du lac.
Tchad, au Congo, en Afrique orientale (Soudan, Ethiopie, Kenya, République de Djibouti) et en Afrique occidentale (Sénégal, Mali).
Dans le nouveau monde, coexistent des espèces à aire de distribution restreinte comme
L. peruviana (Pérou), L. mexicana (Sud du Mexique et Amérique centrale). Des espèces à
aire plus étendue telles L. guyannensis (Nord du bassin amazonien), L. panamensis (Colombie et Amérique centrale) et des espèces à répartition très vaste comme L. braziliensis qui s’étend du Nord de l’Argentine au Sud du Mexique (OMS, 1990 ; Gentilini, 1972).
Tableau 04 : Distribution géographique des espèces du nouveau monde (Dedet, 2001).
Espèce Répartition géographique
L. peruviana Pérou
L. mexicana Sud du Mexique, Amérique centrale
L. guyanensis Nord du bassin amazonien
L. panamensis Colombie, Amérique centrale
Figure 04 : Répartition géographique de la leishmaniose cutanée dans le monde (Weibel Galluzzo, 2013).
4-2. En Algérie
La LC en Algérie endémique depuis le commencement du siècle est causé par L.
infantum, L. major et L. killicki (limité pour le moment à Ghardaïa dans le sud algérien,
longtemps confinée au Sahara) (Tomás-Péreza et al., 2014).
Figure 05 : Répartition géographique de la leishmaniose cutanée en Algérie en 2009 (Epelboin, 2012).
4-2-1. La leishmaniose cutanée zoonotique (LCZ) à L .major (zymodème MON-25) C'est la forme la plus rencontrée en Algérie. Elle correspond au clou de Biskra ou bouton d'Orient sous sa forme humide ou rurale. Elle s'observe dans les régions steppiques, arides à semi-arides, principalement au niveau de la frange nord du Sahara. Dans ces régions, cohabitent le vecteur Phlébotomus papatasi et les rongeurs sauvages réservoirs naturels de la maladie
Psammonys obesus et Meriones shawi. Le foyer historique de Biskra reste encore le plus actif,
mais la maladie s'étend rapidement et crée de nouveaux et importants foyers tels ceux de Msila, Bou-Saada, Tiaret et Béchar. Elle est endémo-épidémique dans ces régions, cette forme touche principalement les enfants autochtones et les personnes venant y séjourner (Izri et Belazzoug, 2007).
L'agent pathogène : correspond à L. major Zymodème MON-25. Le Vecteur : P. papatasi est le principal vecteur de cette forme.
Le réservoir : Il est représenté essentiellement par deux espèces sauvages de rongeur gerbillidés : P. obesus et M. shawi.
Figure 06 : Différents aspects cliniques de la leishmaniose cutanée zoonotique chez les enfants prélevés au niveau de l’annexe Pasteur de M’sila (Cherif, 2014).
4-2-2. La Leishmaniose cutanée sporadique (LCS)
Elle se produit sur le littoral du nord du pays, causée par L. infantum MON 24, avec
Phlebotomus perfliewi comme vecteur et les chiens impliqués comme réservoir
Figure 07 : Lésion de LCS due à Leishmania infantum (Ben Abda et al, 2009). 4-2-3. Autres cas
L'étude d'une première manifestation épidémique dans un centre émergent dans Ghardaïa (vers le sud d'Algérie) a indiqué la présence d'une nouvelle espèce de L. killicki, qui coexiste avec L major MON25, avec Phlebotomus sergenti comme vecteurs et les rongeurs
Ctenodactylus gundi comme réservoirs (Tomás-Péreza et al., 2014 et Izri et al., 2014).
La LC zoonotique à L. major connaît une extension géographique en dehors des foyers naturels de la maladie. Cependant, on a constaté au cours de ces dernières années que la barrière géographique formée par l'Atlas tellien, qui séparait la forme cutanée du nord (sporadique) à L.
infantum et la LCZ du sud à L. major, a été franchie avec une avancée rapide de cette dernière
vers le nord du pays. Cette propagation méridienne coïncide avec la survenue d'importantes épidémies affectant des milliers de cas dans le pays (Boudrissa et al., 2012).
5. Importance des leishmanioses
Actuellement les leishmanioses sont considérées par l’OMS comme des maladies zoonotiques négligées, au sein de la liste des maladies tropicales. Chez l’homme, toutes formes cliniques et étiologiques de leishmanioses confondues, les estimations font état de 1,3 million de nouveaux cas chaque année, avec 20000 à 30000 décès (Bourdoiseau et Chermette, 2015). 5-1. Importance médicale
L’importance sanitaire est due au caractère zoonotique de la maladie, qui bien que rarement exprimée, reste non négligeable (Bussiéras et Chermette, 1992). La leishmaniose viscérale méditerranéenne n’est plus comme autre fois une maladie de l’enfant mais s’exprime la plupart du temps chez des sujets immunodéprimés (co-infection par le virus de l’immunodéficience acquise VIH (Cruz et al., 2006). En Algérie, les leishmanioses humaines constituent un véritable problème de santé public et sont classées au premier rang des maladies parasitaires à déclaration obligatoire (Harrat et al., 2009).
5-2. Importance économique
L’importance économique est liée au coût des consultations, des traitements et de la prévention. Concernant la leishmaniose humaine, les coûts relatifs aux consultations, aux examens de laboratoire, aux soins, aux journées d’hospitalisation et au traitement sont tels que dans certains pays le budget qui leur est consacré dépasse celui des soins de santé publique (Desjeux, 2001).
6. Epidémiologie Générale 6-1. Le parasite Leishmania
Les parasites Leishmania dont il existe environ 17 espèces pathogènes chez l'homme sont des protozoaires flagellés appartenant à l’ordre des kinétoplastidés et à la famille des trypanosomatidés (Dedet, 2009).
A- Taxonomie
L’identification des leishmanies a longtemps constitué un problème car leur morphologie et leur pouvoir pathogène ne permettaient pas de les classer. Initialement basée sur des critères éco-épidémiologiques puis immunologiques, la classification des leishmanies utilise aujourd’hui les caractères biochimiques (isoenzymes) et des marqueurs d’ADN (Banuls et al, 2007). Depuis les années soixante-dix, les leishmanies ont pu être identifiées avec assez
de précision au moyen de l’analyse électro-phorétique des isoenzymes, formant ainsi une population homogène ou zymodème (Rioux et al., 1990).
Malgré la percée des techniques moléculaires, l’électrophorèse des isoenzymes représente encore la technique d’identification de référence permettant l’élaboration des classifications phénétiques et phylogénétiques.
La classification du genre Leishmania d’après Levine et al, (1980) est la suivante : Règne : Protista (Haeckel, 1866)
Sous-règne : Protozoa (Gold FUSS 1817 ET Enend Siebold 1848) Embranchement : Sarcomastigophora (Honigberg Et Balanuth, 1963) Sous- Embranchement : Mastigophora (Diesting, 1866)
Classe : Zoomastigophora (Calkins, 1999)
Ordre : Kinetoplastida (Honigberg 1963 et Enend Vickerman 1976) Sous-Ordre : Trypanosomastina (Kent, 1880)
Famille : Trypanosomatidea (Doflein Enend, Grobben 1905) Genre : Leishmania (Ross, 1903)
Le genre Leishmania est subdivisé en deux sous-genres, selon que le parasite se développe dans la partie centrale ou postérieure de l’intestin du vecteur, respectivement. *Sous-genre : Leishmania (Ross, 1903). *Sous-genre : Vianna (Lainson et Shaw, 1987). B- Morphologie
Les Leishmania sont des parasites dimorphes se présentant à leur hôte successif sous une forme particulière :
Chez le vecteur : la forme promastigote extracellulaire mobile vivant dans le tube digestif de phlébotome vecteur. Son corps plus ou moins fuselé de 5 à 2 μm de long et 1 à 4 μm de large est prolongé au pôle antérieur par un flagelle pouvant atteindre jusqu’à 20 μm de long. Le kinétoplaste se situe entre le noyau et le flagelle(Mellano, 2016).
Figure 09 : Forme promastigote (Site Web 01 consulté le 03/01/2019). Chez le sujet parasité : la forme amastigote intracellulaire dans les macrophages des mammifères au sein de vacuoles parasitophores. Son corps beaucoup plus ramassé mesure 4μm de long et 2μm de large et est munis d’un flagelle intracytoplasmique très réduit (le rhyzoplaste). Le kinétoplaste est juxtanucléaire (Mellano, 2016).
Figure 10 : Forme amastigote (Site Web 01 consulté le 03/01/2019). C- Ultrastructure
Les Leishmania sont des protozoaires relativement évolués chez lesquels on peut observer la plupart des organites caractéristiques des cellules eucaryotes supérieures. Comme chez toutes les trypanosomatidés, la membrane plasmique est bordée sur sa face interne parun corset des microtubules stables, arrangées en spirales et qui assurent le maintien de la forme cellulaires. Le flagelle qui émane de la partie antérieure des parasites est également riche en microtubules stables. On note également la présence d’un organite caractéristique des
kinétoplastidés, le kinétoplaste, une portion particulière de l’unique mitochondrie. Comme dans toutes les cellules eucaryotes complexes, on a pu identifier dans les Leishmania, de nombreux organites bordés par une membrane et participant soit à la biosynthèse des constituants parasitaires comme le réticulum endoplasmique rugueux, soit à la dégradation des composants parasitaires ou exogènes (organites de type lysosomal). A noter enfin la présence d’un autre organite caractéristique des kinétoplastidés: le glycosome (Boudrissa, 2014).
Ces compartiments sont de petites tailles, sphériques ou allongés au nombre de 10 à 15/cellules sont apparentées aux peroxysomes et aux glyoxysomes des cellules eucaryotes supérieures. Ils jouent un rôle important dans le métabolisme parasitaire (Boudrissa, 2014).
Figure 11 : Ultrastructure de Leishmania (Niang et al., 2000). D- Biologie et reproduction
Les leishmanies vivent au sein des macrophages, en particulier dans la lymphe dermique, les nœuds lymphatiques, la rate, le foie et la moelle osseuse. Pour leur métabolisme, les leishmanies utilisent les protéines des cellules-hôtes et leur ADN est synthétisé à partir des précurseurs de l'ARN de ces cellules. Elles survivent à la phagocytose et à l’agression oxydative du macrophage et se multiplient par division binaire longitudinale.
Cette multiplication peut engendrer la lyse du macrophage ; les parasites sont alors libérés puis phagocytés par d’autres macrophages. Ceci conduit à la diffusion des leishmanies dans l’organisme (Bussieras et Chermette, 1992).
La reproduction est principalement par reproduction asexuée que se multiplient les
Leishmania. Les leishmanies se multiplient aux deux stades (promastigote et amastigote) par
division binaire simple. Toutefois, des échanges génétiques rares ont pu être observés et semblent participer de façon significative à la structuration des populations par l’apparition de nouveaux hybrides (Akopyants, 2009).
6-2. Le vecteur
La mouche des sables ou Phlébotome est le vecteur du parasite Leishmania infectant les humains et autres vertébrés (Feliciangeli, 2004). Les Phlébotomes sont des insectes velus avec de gros yeux et des pattes longues et grêles. Ils se déplacent par vols courts, en se posant très souvent. Contrairement à tous les autres diptères piqueurs, ils maintiennent leurs ailes relevées lorsqu’ils sont au repos. Les phlébotomes piquent habituellement après la tombée de la nuit (Randrianambnintsoa, 2013).
Figure 12 : Phlébotome mâle et femelle (Niang et al., 2000). A- Taxonomie et classification
Les Phlébotomes, vecteurs de leishmaniose, sont des diptères Nématocères de la famille Psychodidae où ils constituent la sous - famille Phlebotominae qui comprend environ 900 espèces largement réparties sur les régions tropical et tempérées, dont pas plus que 70 ont été impliqués dans la transmission de leishmaniose (Pret, 2013).
Tableau 05 : La classification de Phlébotome (Belgidoum et Sabrou, 2007).
Règne Animal
Sous Règne Métazoaires
Embranchement Arthropodes Sous/ Embrochement Mandibulates
Classe Insectes (hexapode)
Sous/Classe Ptérygotes
Ordre Diptères
Sous/Ordre Nématocères
Famille Psychodidae
Sous/ Famille Phlebotominae
Genre Phlebotomus
Espèce Phlebotomus sp
La famille des Psychodidae est divisée en 6 genres dont trois comportent des espèces hématophages : Phlebotomus ; Lutzomyia et Sergentomyia (Killick-Kendrick, 1999).
B- Structure et Morphologie
Ces insectes présentent un corps grêle et allongé de petite taille, de 1 à 3 mm de long (Lewis, 1973), couvert d’une vestiture épaisse qui lui permet un vol silencieux, Ils sont de couleur claire, jaune pâle à brune, à peine visible à l’oeil nu. La tête forme un angle de 45° avec le corps, donnant à l’insecte une allure bossue (Leger et Depaquit 2002).
La tête
Est formée en grande partie par une capsule chitineuse (épicrane), limitée de chaque côté par un grand œil composé. Sur la région frontale s’insère deux antennes formées chacune de seize segments : deux segments basaux, et quatorze segments beaucoup plus longs et minces, constituant le flagellum (Lewis, 1982).
Figure 14 : Tête d’un phlébotome adulte (vue ventrale) (Banuls et al., 2013). Le thorax
Est convexe et bien développé comme chez tous les diptères, Il est constitué de prothorax, mésothorax et métathorax. Il comporte également une paire d’ailes et des balanciers qui assurent l’équilibration de l’insecte pendant le vol. Les ailes sont lancéolées et comprennent neuf nervures longitudinales et des nervures transversales. Sur chacun des trois segments thoraciques fusionnés est insérée une paire de pattes articulées, longues, fines et couvertes de soies (Leger et Depaquit, 2001).
Figure 15 : Thorax de phlébotome (Niang et al., 2000). L’abdomen
Est cylindrique et composé de dix segments. Le premier est rattaché au thorax. Les sept premiers non modifiés, porte chacun une paire de stigmates respiratoires. Quant aux trois derniers, ils sont modifiés pour constituer le génitalia (Abonnenc, 1972).
Chez le mâle, l’armature génitale très développée, se compose de trois paires de prolongements par contre Chez la femelle, l’appareil génital interne se compose de trois organes pairs (Boussaa, 2008).
Figure 16 : Génitalia mâle Figure 17 : Génitalia femelle (Banuls et al., 2013) (Banuls et al., 2013).
C- Cycle de vie d’un phlébotome
Le développement des Phlébotomes comporte une métamorphose complète (Holométabole) comprenant les stades : œuf, larve, nymphe et imago (Ba, 1999).
La femelle pond de 15 à 100 œufs à la fois dans un endroit calme, abrité du vent, humide et sombre qui au bout de quelques jours donnent naissance à des larves muent trois fois avant de se transformer en nymphes fixées au substrat par l’intermédiaire de la dernière exuvie larvaire qui persiste à la partie postérieure de l’abdomen. Sept à dix jours plus tard, l’adulte émerge (Leger et Depaquit, 2001). Depuis l’oeuf jusqu’au stade imaginal, le développement dure 20 à 90 jours selon les conditions climatiques (Dolmatova et Demina, 1971), Et plusieurs repas sanguins sont souvent nécessaires à la maturation des œufs de Phlébotome.
La durée de vie de la femelle adulte est l’ordre d’une trentaine de jours, ce qui correspond à trois ou quatre cycles de pontes. Les œufs sont disposés dans des microhabitats riches en matières organiques tels que des fissures de murs, des grottes ou des terriers de rongeurs. Ils sont ainsi à l’abri des courants d’air et bénéficient d’un bon degré d’hygrométrie et d’une faible luminosité (Male, 2001).
D- Les phlébotomes d’Algérie
Signalés pour la première fois en Algérie en 1912 par Foley et Leduc, les phlébotomes ont fait l’objet de très importants travaux menés à l’Institut Pasteur d’Algérie par les frères Sergent. Aujourd’hui 24 espèces sont connues en Algérie, 14 du genre Phlebotomus et 10 du genre Sergentomyia (Boudrissa, 2014).
Tableau 06 : Liste des espèces de phlébotomes représentées en Algérie (Belazzoug, 1991). Sous-famille Phlebotominae
Genre Phlebotomus Genre Sergentomyia
Phlebotomus (phlebotomus) papatasi
(Scopoli, 1786)
Sergentomyia (Sergentomyia) minuta
parroti (Adler et Theodor, 1927)
Phlebotomus (Phlebotomus) bergeroti
(Parrot, 1934)(*)
Sergentomyia (Sergentomyia) fallax
(Parrot, 1921)
Phlebotomus (Paraphlebotomus) sergenti
(Parrot, 1917)
Sergentomyia (Sergentomyia) antennata
(Newstead, 1912)
Phlebotomus (Paraphlebotomus) alexandri
(Sinton, 1928)
Sergentomyia (Sergentomyia) schwetzi
(Adler, Theodor et Parrot, 1929) (*)
Phlebotomus (Paraphlebotomus) riouxi
Depaquit, Killick-Kendrick & Léger, 1998
Sergetomyia (Parrotomyia) africana
(Newstead, 1912)
Phlebotomus (Paraphlebotomus) chabaudi
(Croset, Abonnenc et Rioux, 1970)
Sergetomyia (Parrotomyia) eremitis
(Parrot et de Jolinière, 1945) (*)
Phlebotomus (Paraphlebotomus) kazeruni
(Theodor et Mesghali, 1964) (**)
Sergentomyia (Grassomyia) dreyfussi
(Parrot, 1933)
Phlebotomus (Larroussius) ariasi
(Tonnoir, 1921)
Sergentomyia (Sintonius) clydei
(Sinton, 1928)
Phlebotomus (Larroussius) chadlii
(Rioux, Juminer et Gibily 1966)
Sergentomyia (Sintonius) christophersi
(Sinton, 1927)
Phlebotomus (Larroussius) perniciosus
(Newstead, 1911)
Sergentomyia (Sintonius) hirta
(Parrot et de Jolinière, 1945) (*)
Phlebotomus (Larroussius) longicuspis
(Nitzulescu, 1911)
Phlebotomus (Larroussius) langeroni
(Nitzulescu, 1930)
Phlebotomus (Larroussius) perfiliewi
(Parrot, 1930)
Phlebotomus (transphlebotomus) mascittii
(*) Espèces exclusivement localisées au Sahara central.
(**) Un spécimen rapporté de Mila (Nord-est Algérien) par Berchi et al, (1986).
Récemment Phlebotomus (transphlebotomus) mascittii a été rapportée en Kabylie (Berdjane-Brouk et al., 2011).
6-3. Le réservoir des parasites
Seuls les mammifères ont été à ce jour trouvés porteurs de protozoaires appartenant au genre Leishmania pathogènes ou non pour l’homme. Ils peuvent être réservoirs ou hôtes accidentels pour le parasite et diffèrent selon les régions. En fonction de l’hôte il est admis de distinguer plusieurs foyers : primaire, secondaire et tertiaire.
Selon les foyers et l'espèce parasitaire en circulation il existe deux entités nosogéographiques la forme zoonotique avec les petits rongeurs et les canidés (sauvages et domestiques).
Dans les foyers dit primaires (F1) la maladie atteint essentiellement des animaux sauvages (rongeurs…) et les cas humains apparaissent sporadiquement avec localement des poussées épidémiques dues à des modifications de milieu ou de comportement. (Africain, Sud-Américain et Asie Centrale).
Dans les foyers secondaires (F2) la maladie est encore animale mais touche cette fois des animaux proches de l’homme (chiens…) la maladie passe chez l’homme sur un mode endémique. (Foyers méditerranéen, Chinois et Sud-Américain).
Dans les foyers tertiaires (F3) il s’agit d’une affection exclusivement humaine. Elle évolue sur un mode endémique avec des poussées épidémiques. (L’Inde et le Soudan) (Boudrissa, 2014).
Figure 19 : Différents types de cycles épidémiologiques (Site Web 02 consulté le 19/01/2019).
6-3-1. Les différents types de réservoirs Rongeurs
La grande gerbille, Rhombomys opimus, constitue l’hôte réservoir primaire de L. major dans les steppes de l’Asie centrale. P. obesus, le principal réservoir de L. major en Asie de l’Ouest et en Afrique du Nord. Dans les zones semi-arides du Maghreb, c’est Meriones shawi qui est responsable de la dissémination de la maladie. (OMS, 1990).
Deux espèces de damans, à savoir Procavia capensis et Heterohyrax brucei sont des hôtes réservoirs de L. aethiopica en Afrique orientale. L’un deux est soupçonné de constituer le réservoir d’une espèce de leishmanie de Namibie qui n’a pas encore reçu de nom et de L.
tropica dans le Nord d’Israël et peut être aussi en Arabie saoudite (OMS, 2010).
Le réservoir de L. killicki a été récemment identifié en Tunisie il s’agit de Ctenodactyllus
gundi (Jouadi et al., 2011). En Algérie, les hôtes réservoirs de L. major, agent étiologique de
la leishmaniose cutanée, sont des rongeurs. P. obesus et M. shawi ont été prouvés comme réservoirs de L. major (Belazzoug, 1983 et 1986). Plusieurs espèces de leishmanies peuvent coexister à l’intérieur d’un même foyer, provoquant des formes cliniques apparemment identiques alors qu’elles relèvent de cycles épidémiologiques différents (OMS, 2010). En Algérie à Ghardaïa L. killicki et L. major coexistent dans le même foyer (Harrat, 2009).
(Site Web 03 consulté le 20/01/2019). (Site Web 03 consulté le 20/01/2019). Figure 20 : Psammomys obesus Figure 21 : Meriones shawi
(Site Web 04 consulté le 20/01/2019). Réservoirs anthropiques
L'homme malade joue le rôle de réservoir du parasite dans le cas de Kala-Azar indien et dans certains foyers de leishmaniose anthroponotique viscérale à L. donovani et également un réservoir pour L.tropica pour la forme cutanée (Wery, 1995).
Réservoirs zoonotiques
Les hôtes réservoirs des leishmanioses zoonotiques sont des animaux sauvages et des animaux domestiques tels que :
*Le chien : Un fort pourcentage de chiens sont atteints de la leishmaniose et présentent donc une source de contamination possible pour les habitants et en particulier les enfants.
*Les canidés : tels que les chacals, renards, lycalopax.
*Les rongeurs : ceux qui sont naturellement infestés appartiennent à des familles différentes : Gerbillidés (Meriones, Gerbillus, Rhombomys), Cricetidés (Arvicanthis), Gliridés (Loirs et lérots).
*Autres mammifères tels que Tapirs, Hérissons (Wery, 1995).
Seuls les mammifères ont été à ce jour trouvés porteurs de protozoaires appartenant au genre Leishmania pathogènes pour l'homme. Dans l'ancien monde 37 espèces ont été trouvées infestées par des leishmanies appartenant à 8 complexes leishmaniens. Dans le nouveau monde, 25 espèces sont porteurs de leishmanies appartenant à 7 complexes du sous genre Leishmania ; quant au sous genre Viannia, 7 complexes ont été identifiés chez 26 espèces (Wery, 1995).
6-3-2. Rôle du réservoir
De nombreuses espèces de mammifères appartenant à sept ordres différents sont réservoirs de leishmanies. Dans certains cas, c'est le territoire du réservoir qui élimine le territoire de l'espèce leishmanienne. Ainsi, les LC dues à L.guyanensis et à L.panamensis ont des aires géographiques disjointes, correspondant à celles de leurs réservoirs distincts : les paresseux à deux doigts Choloepusdidactylus (C.didactylus) pour L. guyanensis et C.hoffmanni pour L. panamensis. Dans le cas où l'hôte réservoir a une répartition mondiale (par exemple le chien), c'est la précellence du vecteur qui s'exprime(Bensaci et Loucif, 2017).
Le comportement humain intervient également dans la dynamique de distribution des leishmanioses. Les mouvements de populations résultant du développement économique ou, à l'inverse, de situations de guerre, ont eu pour résultat d'exposer des milliers d'individus non immuns au risque de leishmanioses et sont à la base de la survenue d'épidémies souvent meurtrières. Ceci s'est produit pour la LC au Moyen-Orient ou en Afrique du Nord.
Les grands chantiers de déforestation, lors de la construction de routes ou de voies ferrées, se sont accompagné d'importantes épidémies de LC et LCM. Des épidémies de LV se sont produites au cours des deux dernières décennies en Inde et au Soudan, accompagnées de taux élevés de mortalité(Bensaci et Loucif, 2017).
6-4. Le cycle de parasite
Il se déroule entre deux hôtes : un vertébré (homme, chien, rongeurs…) et l’insecte vecteur. La leishmaniose est transmise à l'homme par la piqûre des phlébotomes femelles infectées.
A- Chez le vecteur
Le phlébotome, s'infeste en piquant un homme ou un animal malade. Il absorbe ainsi les macrophages infectés. Au niveau du tube digestif de l'insecte, les formes amastigotes se transforment en formes promastigotes dans les heures qui suivent, et s’échappent de la membrane péritrophique. Ils subissent un cycle complexe comportant de nombreuses divisions mitotiques, deux étapes de fixation à l’épithélium de la muqueuse intestinale et une phase de migration vers la partie antérieure du tube digestif, où a lieu la métacyclogenèse (Dedet, 2009). B- Chez l'hôte définitif
Lors d'un prochain contact avec un mammifère sain, l'insecte injecte les formes promastigotes métacycliques suite aux efforts de succion au niveau du site de la piqûre, ces formes infestantes sont phagocytées par les macrophages du derme et se transforment dans
quelques minutes en amastigotes en perdant leur flagelle. Ces amastigotes se multiplient et survivent dans les phagolysosomes des cellules du système réticulo-endothélial infectées.
La cellule hôte finit par éclater, libérant les parasites qui pénètrent aussitôt dans de nouvelles cellules (Carre et al., 2010) (fig 23).
Figure 23 : Le cycle évolutif de la leishmaniose (Site Web 05 consulté le 05/03/2019) 7. Co-infection VIH/Leishmania
La co-infection Leishmania/VIH est une maladie émergente extrêmement grave et de plus en plus fréquente contre laquelle il faut agir de toute urgence, avec toutes les conséquences que cela implique en clinique, au niveau du diagnostic et de la chimiothérapie, et sur le plan épidémiologique et économique. Même avec un traitement correct, les malades atteints des deux infections à la fois font des rechutes à répétition et l’issue est souvent fatale. Ces deux affections conjuguées provoquent une double immunodéficience car les leishmanies et le VIH détruisent les mêmes cellules, de sorte que la gravité de la maladie et ses conséquences augmentent de façon exponentielle. La LV est considérée comme un facteur majeur de décès chez les sujets co-infectés. Toutefois, l’utilisation de la trithérapie, lorsque les malades y ont