I
Le N-terminal proBrain Natriuretic Peptide (NT-proBNP) est un marqueur biochimique de la dysfonction ventriculaire gauche. Ses concentrations circulantes sont élevées chez les patients dialysés. Une stimulation de la production ventriculaire de NT-proBNP, consécutive à la surcharge volémique, associée à une diminution de son élimination rénale pourrait être à l'origine de l'élévation observée dans cette population. A cet effet, garde-t-il un intérêt chez les hémodialysés chroniques (HDC) ?
Ainsi, l'objectif principal de notre travail est d'évaluer la valeur prédictive du NT-proBNP dans le diagnostic de l'hypertrophie ventriculaire gauche (HVG) chez les HDC de l’Hôpital Militaire d’Instructions Mohammed V. L'objectif secondaire que nous sommes fixés est l'étude de l'influence d'une séance de dialyse sur les taux sériques de ce marqueur.
Avant d’aborder notre étude proprement dite, nous traiterons une revue de littérature concernant le NT-proBNP et le BNP. Le deuxième volet de cette partie bibliographique sera axé sur la dialyse.
P
P
a
a
r
r
t
t
i
i
e
e
t
t
h
h
é
é
o
o
r
r
i
i
q
q
u
u
e
e
R
Chapitre -I- : le NT-proBNP
I/-BNP et NT-proBNP, introduction et généralités :
Un peptide natriurétique désigne tout composé naturel ou synthétique formé par l’union d’un nombre restreint d’acides aminés, unis par des liaisons peptidiques, capable d’induire une élimination urinaire de sodium. Médicalement ce terme indique les hormones, on distingue le BNP qui est une hormone peptidique initialement isolée de l’encéphale du porc [1]. L’utilité de ce marqueur en tant qu’outil diagnostique et pronostic est actuellement bien établie en cardiologie.
Il est cependant apparu très vite que le BNP était surtout produit par les ventricules cardiaques [2]. Sa concentration augmente dans l’insuffisance cardiaque, et des études ont montré une corrélation des taux plasmatiques de BNP avec l’hypertrophie ventriculaire, avec la sévérité de l’insuffisance cardiaque (classification NYHA, New York Heart Association) et avec la fraction d’éjection ventriculaire gauche. D’autres travaux ont montré une élévation du BNP au cours de cardiopathies avec dysfonction ventriculaire gauche [3]. Les peptides natriurétiques de type B comme le BNP, ainsi que le métabolite inactif, NT-proBNP, se sont imposés comme des biomarqueurs majeurs des pathologies cardiovasculaires, et notamment de l’insuffisance cardiaque. Chez le patient symptomatique, le dosage du BNP ou du NT-proBNP permet de réduire le taux d’imprécision diagnostique. Ces marqueurs constituent donc une aide complémentaire au jugement clinique.
Ils présentent également un intérêt certain dans le cadre d’une stratification pronostique ainsi que dans le suivi et l’ajustement thérapeutique. A côté de ces
atouts, ils sont aussi caractérisés par des limites qui doivent être considérées et comprises afin de permettre leur utilisation de façon véritablement efficiente.
Les facteurs natriurétiques (FNa) sont représentés par le peptide natriurétique de type A (ANP), le peptide natriurétique de type B (BNP), le peptide natriurétique de type C (CNP) et l’urodilatine.
II/-Aspects physiologiques et physiopathologiques des peptides natriurétiques :
II.1/-Synthèse et sécrétion du BNP :
Le gène codant le BNP humain est situé sur le bras court du chromosome 1 à proximité du gène de l’ANP et est constitué de 3 exons et de 2 introns [4,5]. Ce gène code le pré-proBNP (précurseur de 134 acides aminés) qui est secondairement clivé en proBNP (108 acides aminés) par une peptidase dans le réticulum ; le proBNP migre alors dans l’appareil de Golgi puis est clivé de façon équimolaire en un peptide actif de 32 acides aminés, le BNP et en un fragment N-Terminal de 76 acides aminés, le NT-proBNP ne possédant pas d’activité biologique connue à ce jour [5,6] (figure 1).
Il est maintenant admis que le stockage et la sécrétion du BNP varient selon son origine, auriculaire ou ventriculaire. En effet, au niveau de l’oreillette, la sécrétion du BNP se ferait à partir de vésicules de stockage tandis qu’au niveau du ventricule, elle se ferait à partir de vésicules de transit. Au niveau ventriculaire, la sécrétion de BNP nécessite donc la synthèse de nouvelles molécules via la stimulation de la transcription de son gène. C’est pour cette raison que l’augmentation de la concentration de BNP circulant, majoritairement d’origine ventriculaire, n’est pas immédiate [7].
Figure 1 : Le BNP : du gène au peptide actif.
aa = acides aminés. [8] II.2/-Physiopathologie des peptides natriurétiques :
Le BNP est une hormone possédant des propriétés diurétiques, natriurétiques, vasodilatatrices, antimitogènes sur le tissu cardiovasculaire, sympatholytiques et enfin inhibitrices du système rénine-angiotensine-aldostérone (SRA). Alors qu’il est associé couramment à la famille des peptides natriurétiques, le NT-proBNP n’a à ce jour aucun rôle physiologique démontré. Cependant pour des raisons pratiques de simplification, nous inclurons ici le NT-proBNP dans le terme de peptides natriurétiques. Les hormones natriurétiques cardiaques sont synthétisées principalement par les cardiomyocytes (Figure 2), en majorité auriculaires pour l’ANP et pour le BNP. Cependant en cas de pathologie ventriculaire, l’expression du gène du BNP est fortement augmentée dans les ventricules [9], notamment en réponse à l’étirement des fibres
myocardiques sous l’effet de l’augmentation des pressions de remplissage. Les réserves myocardiques ventriculaires en BNP sont faibles puisque les myocytes ventriculaires ne semblent pas contenir de granules de stockage de proBNP et de ses dérivés [10]. L’augmentation sérique de BNP serait donc surtout liée à une augmentation de sa synthèse par les cardiomyocytes ventriculaires [11,12]. Le gène codant le BNP est en effet très rapidement transcrit lors de l’étirement des fibres ventriculaires [9]. Ainsi l’augmentation du BNP circulant après stimulation est plus lente que celle de l’ANP pour lequel les réserves auriculaires sont importantes [11].
Le préproBNP est le premier précurseur du BNP lors de sa synthèse. Ce peptide, qui en théorie compte 134 acides aminés, n’existe pas in vivo car sa portion N-terminale de 26 acides aminés est clivée dans le réticulum endoplasmique granuleux alors que son élongation C-terminale n’est pas achevée [13]. Le proBNP (108 acides aminés) est ainsi le premier précurseur réel du BNP. Il présente une boucle de 17 acides aminés fermée par un pont disulfure entre deux résidus cystéine situés en positions 86 et 102. La structure en boucle est bien conservée et caractérise la famille des peptides natriurétiques. Elle est essentielle pour permettre la liaison du peptide à son récepteur. Il est intéressant de noter que si la structure du BNP est bien connue suite à sa purification, ce n’est pas le cas du proBNP et du NT-proBNP dont la structure n’est connue qu’à partir de la traduction de leur cDNA. Le proBNP passe ensuite dans l’appareil de Golgi dans lequel il sera clivé en deux molécules : le segment C-terminale ou BNP (32 acides aminés) et le fragment N-Terminal ou NT-proBNP (76 acides aminés). Ces deux peptides sont donc en théorie secrétés en quantités équimolaires. En réalité, les modalités du clivage du proBNP sont mal connues.
Plusieurs enzymes seraient impliquées. La furine, première enzyme de clivage du proBNP mise en évidence [14], est intracytoplasmique et assure le clivage du proBNP dans l’appareil de Golgi.
Récemment, une sérine protéase transmembranaire, la corine, a été identifiée comme capable de cliver le proBNP lors de son excrétion cellulaire [12]. La prohormone convertase de type 1 (PC1) pourrait également être impliquée dans la maturation du proBNP [13]. La différence de contenu enzymatique entre les cellules auriculaires et ventriculaires pourrait ainsi expliquer les proportions variables entre le proBNP et ses produits de clivage. En particulier, lors de pathologies cardiaques, bien que l’expression du gène du BNP soit augmentée dans les ventricules, l’augmentation du BNP circulant n’empêche pas le développement de la maladie (rétention sodée, oedèmes...) [15]. L’augmentation plasmatique du taux de BNP constatée par immunodosage est ainsi à nuancer : les méthodes disponibles pourraient détecter différentes formes du BNP circulant dont des formes moins voire pas du tout actives du BNP (notamment du proBNP circulant). Le proBNP est en effet détectable dans le sang [11,16], sous forme de monomères mais aussi de tétramères [17]. L’existence de formes circulantes multimériques de NT-proBNP [17] complique également l’interprétation de son dosage. L’immunoréactivité de ces trimères n’est pas connue. Le BNP est métabolisé par deux mécanismes distincts : capture par des récepteurs spécifiques et clivage enzymatique par des endopeptidases neutres (NEP) [18]. Trois types de récepteurs des peptides natriurétiques, appelés NPR-A, NPR-B et NPR-C, ont été mis en évidence (figure 3). Ce sont tous des glycoprotéines transmembranaires présentant une grande analogie dans leur zone de fixation des ligands, mais avec des affinités variables pour les différents FNa. Leur dénomination n’est pas
fonction du peptide qu’ils lient préférentiellement. Par exemple, le NPR-A fixe l’ANP mais le NPR-C le fixe également avec une haute affinité [11]. La liaison des peptides natriurétiques aux NPR-A ou NPR-B déclenche une réponse physiologique. Ces récepteurs ont une activité guanylate kinase et l’augmentation du GMPc intracellulaire est à l’origine de leurs effets physiologiques. Le NPR-C, situé principalement dans le rein, assure (en partie) l’élimination des peptides natriurétiques. La liaison du FNa à ce récepteur forme un complexe qui sera internalisé puis dégradé par les lysosomes. Le NPR-C sera ensuite recyclé. En plus de cette élimination rénale, les peptides natriurétiques sont dégradés par des endopeptidases neutres situées en position membranaire, principalement dans le rein, le cerveau, le poumon et les polynucléaires neutrophiles [11]. Ces endopeptidases sont des métalloprotéases utilisant le zinc comme catalyseur. Elles vont agir en coupant dans un premier temps la liaison entre les acides aminés 4 et 5 (Met et Val) puis en ouvrant la boucle des peptides en clivant la liaison entre les acides aminés 17 et 18 (Arg et Ile). Les peptides sont alors incapables de se lier à leurs récepteurs [2]. L’affinité plus forte de l’ANP par rapport au BNP pour le récepteur NPR-C et les endopeptidases neutres explique sa demi-vie plasmatique faible (4 minutes pour l’ANP contre 22 minutes pour le BNP), ce qui permet de limiter les effets d’une libération « explosive » de l’ANP lors d’une stimulation [11]. Le NT-proBNP n’est pas affecté par ces mécanismes de dégradation et présente une demi-vie plasmatique plus importante, supérieure à une heure. Son élimination est strictement rénale par filtration glomérulaire et il serait donc plus sensible que le BNP à l’insuffisance rénale [11,19]. Autre conséquence de ce métabolisme, les variations de NT-proBNP avec l’âge sont plus importantes que celles du BNP, qui seront moins sensibles à la dégradation de la fonction rénale [19].
Figure 2 : Synthèse du BNP et du NT-proBNP. [20]
II.3/-Mécanismes d’action du BNP :
L’ANP et le BNP ne peuvent agir que s’ils sont d’abord fixés sur un récepteur localisé dans l’endothélium vasculaire et les cellules musculaires lisses de différents tissus cibles. La liaison se fait par leur pont disulfure. On connaît trois récepteurs différents, les NPR-A, B, et C [21] (figure 3). Les trois récepteurs fixent les différents peptides natriurétiques mais avec des affinités différentes : le NPR-A, le plus abondant, lie l’ANP et 10 fois moins le BNP. Le BNP, pour exercer son action vasodilatatrice, doit d’abord s’attacher au récepteur sur la paroi artérielle.
L’ANP et le BNP ont une action inhibitrice sur le système rénine-angiotensine-aldostérone. Ils ont une action diurétique, natriurétique, et vasodilatatrice, et permettent ainsi de compenser en partie la surcharge hydrique et l’hypertension artérielle induites par l’insuffisance cardiaque. C’est pourquoi, on peut observer une élévation de leur taux alors que la maladie est encore asymptomatique. (Figure 4).
Figure 3 : Type de récepteurs des peptides natriurétiques. [20]
II.4/-Catabolisme des peptides natriurétiques : [22] On peut distinguer trois mécanismes d’élimination :
• Élimination du BNP par fixation sur des récepteurs membranaires sans activité guanadylcyclase (NPR-C), suivi d’une endocytose et d’une dégradation lysosomiale ;
• Élimination également par dégradation enzymatique par une endopeptidase neutre, la NEP (une métalloprotéase) ;
• Élimination par voie rénale, plus prononcée pour le NT-proBNP. III/-Intérêts du dosage des peptides natriurétiques :
III.1/- Sur le plan du diagnostic :
Les peptides natriurétiques permettent d’aider le clinicien dans deux grands types de situations.
III.1.1/- Dans le cas du dépistage de patients porteurs d’une insuffısance cardiaque au sein de populations à risque :
Le BNP permet de détecter à moindre coût et avec une grande efficacité l’existence d’une dysfonction du coeur gauche. Plusieurs études se sont en particulier intéressées à l’utilisation du dosage du BNP dans la détection de dysfonctions ventriculaires gauches asymptomatiques dans la population générale. Dans une étude menée en Ecosse en 1997, Mc Donagh, a dosé le taux plasmatique de BNP chez 1252 personnes résidant dans la région de Glasgow en plus de la réalisation d’un électrocardiogramme et d’une échocardiographie [23]. 37 participants avaient une dysfonction ventriculaire gauche. Celle-ci était totalement asymptomatique chez 19 d’entre eux. Dans cette population, l’existence d’un taux de BNP > 17,9 pg/ml avait une sensibilité et une spécificité
respectivement de 77 et 87 %. Dans le sous-groupe des patients présentant une cardiopathie ischémique, celles-ci passait respectivement à 92 et 72 %. Il n’en reste pas moins que le rapport coût efficacité de l’utilisation de ce type de dosage dans la population générale reste très faible. Pour Lerman [24], dans le même cas de figure, le BNP aurait une sensibilité et une spécificité de 90 %. Omland, a retrouvé dans une série de 254 patients que le BNP était le meilleur prédicteur parmi un ensemble de neurohormones (ANP, N terminal Pro ANP, BNP) d’une ptdvg > 15 mmHg (p < 0,001), une fraction d’éjection ventriculaire gauche < 45 % (p < 0,001). L’aire sous la courbe pour la détection de la dysfonction ventriculaire gauche était de 0,79 pour le BNP, 0,66 pour l’ANP et 0,61 pour le N terminal Pro ANP dans cette même étude [25]. Dans une population de 75 patients ayant présenté un infarctus récent, le diagnostic clinique et l’appréciation visuelle de la fonction ventriculaire gauche échocardiographique avaient une sensibilité respective de 46 et 82 % pour la détection d’une FEVG < 45 % pour une sensibilité de 84 % pour le BNP et de 64 % dans cette même indication [26]. De même, Sumida dans un travail portant sur 60 patients a retrouvé que le taux de BNP était corrélé à la sévérité de la dysfonction ventriculaire gauche [27]. Le BNP à sept jours de l’infarctus serait également un bon prédicteur de l’apparition d’un remodelage progressif, le taux de BNP étant corrélé à la variation de la pression télédiastolique ventriculaire gauche [28].
Dans les populations susceptibles de développer une insuffisance cardiaque comme les patients exposés aux anthracyclines, il semble que les taux plasmatiques de BNP montent au terme des cures de doxorubicine sans modification significative de la fraction d’éjection ventriculaire gauche. Les
auteurs émettaient alors l’hypothèse d’une diminution de réponse à l’exercice pour expliquer cette ascension du BNP [29]. Certains auteurs ont également mis en avant l’existence d’une liaison entre réserve contractile myocardique et BNP [30]. De même, chez les patients suspects d’amylose cardiaque, les taux plasmatiques d’ANP et de BNP sont plus élevés chez les patients présentant une amylose cardiaque authentifiée par une étude anatomopathologique que chez les sujets témoins en dépit de fractions d’éjection comparables ce qui pourrait en faire un élément diagnostique de l’amylose cardiaque [31]. Cependant, la faible spécificité du BNP rend difficile son utilisation à large échelle dans ce type d’application [32,33].
III.1.2/- Dans le cas où le problème consiste à étayer le diagnostic d’insuffısance cardiaque :
L’utilité du BNP est actuellement prouvée dans l’aide au diagnostic d’insuffisance cardiaque pour le patient suivi en ville comme pour le patient se présentant aux urgences pour un épisode de dyspnée. Le diagnostic d’insuffisance cardiaque en pratique courante est parfois difficile. Dans une des premières grandes études portant sur l’utilisation du BNP dans l’aide au diagnostic d’insuffisance cardiaque [34], seulement 1/3 des patients considérés comme souffrants d’insuffisance cardiaque par leur médecin généraliste voyait le diagnostic confirmé ultérieurement. La valeur diagnostique du BNP dans cette application est extrêmement significative avec une aire sur la courbe ROC de 0,96, une valeur seuil de 76,4 g/ml de BNP ayant une valeur prédictive négative à 98 % avec une valeur prédictive positive à 70 %, soit une sensibilité de 97 % et une spécificité de 84 % pour le diagnostic d’insuffisance cardiaque. Dans le cas des patients se présentant aux urgences pour un épisode dyspnéique faisant
évoquer une éventuelle poussée d’insuffisance cardiaque, il est maintenant largement prouvé que le BNP est d’une aide considérable pour le clinicien.
Dans une étude portant sur plus d’un millier de patients, intitulée Breathing
Not Properly (BNP study) conduite aux États-Unis, plus de 40% des cas de
diagnostic d’insuffisance cardiaque ne pouvaient être affirmé suite aux examens initiaux réalisés aux urgences. Dans cette étude, le taux de BNP était un élément diagnostique majeur indépendant de l’insuffisance cardiaque, avec au seuil de BNP de 100 pg/ml, une sensibilité de 90 % et une spécificité de 76 % pour le diagnostic d’insuffisance cardiaque [35,36].
La proportion chez qui le diagnostic restait incertain, une fois l’examen clinique réalisé et le taux de BNP mesuré, passait de 43 à 11% quand le taux de BNP était connu. De même, Davis, dans une série de 52 patients avait retrouvé une sensibilité de 93 % et une spécificité de 90 % pour l’aide au diagnostic d’insuffisance cardiaque [37]. Dans l’ensemble des études publiées [35–38], il semble que pour le BNP un taux inférieur à 100 pg/ml rende très improbable l’existence d’une insuffisance cardiaque, sous réserve éventuellement dans les cas d’un second dosage à distance de l’épisode aigu ; cependant, dans de nombreux centres, la stratégie d’utilisation du BNP en tant qu’élément diagnostique est rendue un peu plus complexe avec l’utilisation d’un seuil bas (100 pg/ml) au dessous duquel l’insuffisance cardiaque est peu probable et d’un seuil haut (300 à 400 pg/ml) seuil au dessus duquel il existe vraisemblablement une part d’insuffisance cardiaque gauche [40]. Entre ces deux seuils, il existe une zone d’ombre dans laquelle l’ensemble des examens paracliniques et en particulier, échocardiographiques, en particulier réalisés à la phase aiguë, sont une aide précieuse. Plus tardivement, une étude portant sur plus de 300 patients,
a montré que la mise en oeuvre d’un bilan paraclinique usuel pour l’aide au diagnostic d’insuffisance cardiaque augmentait l’acuité diagnostique du médecin de 7 % alors que l’utilisation du dosage du NT-proBNP l’améliorait de 21 % (p = 0,02). Le seuil de NT-proBNP reconnu comme optimal pour diagnostiquer l’insuffisance cardiaque était de 125 pmol/l [40]. Il faut cependant bien garder à l’esprit que le taux de BNP ou du NT-proBNP n’est que le reflet de la volémie intracardiaque à un moment donné [41] et que le dosage de ces marqueurs à distance de l’épisode aigu et à fortiori après l’instauration d’un traitement diurétique ou vasodilatateur en particulier intraveineux, peut induire une forte négativité des marqueurs.
Dans les cas difficiles et quand les moyens lourds d’appréciation de la fonction ventriculaire gauche sont difficiles à obtenir, le BNP et le NT-proBNP permettent d’aider au diagnostic ce qui a bien évidemment une incidence sur la prise en charge et le pronostic. Il faut cependant noter que l’appréciation de l’utilité du dosage, selon les différentes études, diffère considérablement en fonction de la facilité d’obtention d’examens plus lourds comme l’échographie cardiaque. Dans les pays où l’accès à ce type d’examen est facile, ces peptides natriurétiques sont plus utilisés comme examen d’urgence que dans d’autres pays où ils sont utilisés principalement en raison de sa forte valeur prédictive négative, permettant ainsi d’éviter la réalisation d’échographies cardiaques possiblement inutiles.
III.2/- Sur le plan du pronostic :
Il a été démontré que les taux de BNP sont plus hauts chez les patients ayant une capacité fonctionnelle plus basse ou une atteinte cardiaque plus sévère et qu’un taux de BNP pouvait différencier les patients ayant une atteinte
modérée de ceux ayant une atteinte importante de la fonction ventriculaire gauche. Le taux de BNP est, selon certains auteurs, bien corrélé à la capacité fonctionnelle mesurée par la consommation en oxygène du myocarde ou le périmètre de marche au test de six minutes ainsi qu’à d’autres mesures ou scores comme le Heart Failure Survival Score [42,43]. Il faut cependant bien noter que le BNP n’est pas un marqueur de fraction d’éjection. Il est, en revanche, tout à fait corrélé à certains marqueurs pronostiques comme la mesure de la pression télédiastolique intraventriculaire gauche qui est un marqueur invasif majeur de pronostic chez l’insuffisant cardiaque. À ce titre, le BNP ressort comme étant actuellement le meilleur marqueur prédictif d’une ptdvg supérieure à 15 mmHg et d’une fraction d’éjection ventriculaire gauche inférieure à 45 % [41]. Ceci a été corroboré par d’autres études qui ont montré que le BNP est un prédicteur indépendant de décès chez les patients présentant une insuffisance cardiaque chronique, chaque augmentation de l’ordre de 10 pg/ml augmentant le risque de décès de l’ordre de 3 % [44]. Cette utilité pronostique du BNP est également démontrée chez le sujet âgé, le dosage du BNP dans cette population permettant de prédire la survenue d’un événement cardiovasculaire au cours du suivi. À ce titre le BNP pourrait permettre de suivre facilement les patients. Les informations apportées par son dosage, sont comparables à celles apportées par la mesure complexe de plusieurs éléments cliniques et paracliniques comme le
Heart Failure Score, comprenant les données cliniques, la mesure de la fraction
d’éjection, la mesure de consommation en oxygène du myocarde. Pour ce qui est de l’insuffisance cardiaque aiguë, plusieurs études concordantes ont mis en évidence que le BNP était un prédicteur indépendant de mortalité cardiovasculaire [45,46] ainsi qu’un marqueur important dans l’évolution des patients à la sortie de l’hôpital après décompensation cardiaque. Dans ces
études, le BNP permettait de prédire le risque de réhospitalisations et de décès à court terme après traitement d’un oedème pulmonaire aigu.
D’autre part, une étude relativement récente portant sur plus de 400 patients [47], a mis en évidence une éventuelle possibilité de prédire la survenue d’une mort subite dans l’insuffisance cardiaque par le dosage du BNP mais dans ce cadre, le BNP n’est peut être que le reflet d’une atteinte cardiaque plus sévère plutôt qu’un élément permettant réellement de prédire la mort rythmique. Il faut cependant rester vigilant sur le fait que les traitements employés dans l’insuffisance cardiaque (diurétiques, vasodilatateurs, IEC, bêtabloquants ou Aldactone), peuvent modifier le taux de BNP et donc il semble important de préciser que pour ce qui est du suivi des patients, l’élément pronostique majeur à prendre en compte dans le cadre d’un suivi de long terme, est le dosage du BNP sous traitement médical considéré comme optimal à la dose maximale supportée par le patient. De même, dans l’insuffisance cardiaque aiguë, le taux de BNP initial à prendre en compte est celui avant traitement diurétique. Ce traitement diurétique intraveineux et vasodilatateur provoque une diminution rapide du taux de BNP chez les patients bons répondeurs. Le taux plasmatique de BNP et de NT-proBNP augmente proportionnellement à l’augmentation de la symptomatologie fonctionnelle déterminée au moyen de la classification NYHA (figure 5) [48,49]. Les patients chez qui l’amélioration clinique est la plus nette présentent une diminution parfois spectaculaire de leur taux de neurohormones [50]. Dans un travail portant sur 72 patients insuffisants cardiaques, Maeda [41] a démontré une corrélation entre la PTDVG, la fraction d’éjection ventriculaire gauche (FEVG), la pression capillaire pulmonaire et le taux plasmatique de BNP. Dans cette même étude, seul le taux de BNP était prédictif de la ptdvg. En
revanche, pour d’autres auteurs, le BNP est corrélé à l’index cardiaque mais pas à la pression capillaire pulmonaire [28]. Actuellement, de nombreux travaux portent sur l’utilité comparée des différents marqueurs pronostiques utilisés dans l’insuffisance cardiaque. Il faut néanmoins bien garder en mémoire que les études portent la plupart du temps sur des populations sélectionnées de patients ce qui rend leurs conclusions parfois difficiles à transposer en pratique courante.
III.3/- Sur le plan du suivi des thérapeutiques employées dans le traitement de l’insuffısance cardiaque :
Dans une étude portant sur 415 patients porteurs d’une cardiomyopathie ischémique randomisés en deux groupes recevant soit du placebo soit du carvedilol ; l’existence d’un taux de NT-proBNP > 24 pmol/ml à l’introduction du traitement sélectionnait les patients tirant le maximum de bénéfice du traitement b-bloquant en terme de mortalité. Dans ce travail, le carvedilol ne semble pas diminuer de façon significative le nombre d’événements chez les patients présentant un NT-proBNP en dessous de 24 pmol/ml [51]. Pour d’autres auteurs, la mise en place d’un traitement b-bloquant peut augmenter le taux plasmatique de peptides natriurétiques [52,27] possiblement liée à une down
regulation du NPR type C [26]. Il faut cependant remarquer que la plupart de
ces études se fondent sur des populations de patients ne présentant pas d’insuffisance cardiaque. La première étude s’intéressant aux interactions BNP/IEC est parue dans le Lancet en 1993 [53]. Dans cette étude préliminaire de 16 patients, les patients ont été randomisés en deux groupes, captopril vs placebo en postinfarctus. Dans le groupe placebo, on assiste à une dégradation progressive de la fraction d’éjection mesurée par angioscintigraphie parallèle à l’augmentation des taux plasmatiques de BNP. Dans le groupe traité par IEC, la
fraction d’éjection ventriculaire gauche s’améliore et les taux de BNP décroissent proportionnellement. En 1998, Veldhuisen a étudié 244 patients présentant une insuffisance cardiaque moyenne à modérée selon la classification fonctionnelle de la NYHA stabilisés sous diurétiques et digoxine [54]. Les patients ont été randomisés en quatre groupes (placebo 2,5 5 et 10 mg d’un IEC de demi-vie longue : l’imidapril). Ceux-ci ont été suivis trois mois après inclusion. Au terme de l’étude, on note une diminution significative des taux plasmatiques de BNP de près de 16 % sous des doses intermédiaires à près de 22 % sous de fortes doses. Cette baisse ne semble pas liée à une augmentation de l’activité IEC plasmatique. Sur un plan plus global, une étude récente a montré la supériorité d’un traitement fondé sur le suivi des taux plasmatiques de NT-proBNP par rapport à un traitement fondé sur la classification de la NYHA en terme d’événements cardiovasculaires au sens large [55]. Cette étude laisse entrevoir un possible changement complet de la stratégie thérapeutique de l’insuffisance cardiaque. Cependant, les traitements utilisés dans ce travail pour parvenir aux objectifs fixés ne comprenaient que les diurétiques et les IEC. Des études internationales et nationales (étude STARS coordonnée par le groupe de travail « Insuffisance cardiaque » de la Société française de cardiologie) sont actuellement en cours avec le BNP comme avec le NT-proBNP pour essayer de confirmer cette étude chez des patients traités de façon conforme aux guidelines internationales [56].
Figure 5 : Taux de BNP chez des patients présentant une insuffisance cardiaque. [57]
IV/- Aspects pré-analytiques et analytiques du dosage des peptides natriurétiques, BNP et NT-proBNP :
IV.1/- Nature du prélèvement et facteurs natriurétiques :
Le choix du matériau du tube de prélèvement pose la question du rôle de l’activation de la phase contact de la coagulation et de la kallicréine dans la dégradation du BNP [58].
Cette activation est favorisée par l’existence sur les parois du tube en verre d’une surface de charge négative. La dégradation du BNP serait liée à l’activation de la kallicréine : l’emploi de tubes en polyéthylène tétraphtalate (PET) ou en silicone, non activateurs de la phase contact, entraîne une meilleure stabilité du BNP [59, 58, 60].
L’allongement de la conservation in vitro du BNP par l’emploi d’inhibiteurs de kallicréine (PPACK I et PPACK II) confirme le rôle de la kallicréine dans l’activation de la dégradation du BNP [59].
Le BNP peut donc être recueilli sur tube PET ou silicone. De même, lors d’opération de manipulation du plasma (décantation par exemple), le matériel en verre doit être banni au profit du plastique [58]. Ces observations ont été effectuées en dosant le BNP avec les anticorps de Shionogi (Shionoria®BNP ou Centaur®). Chez Abbott, le recueil sur tube en plastique est également préconisé. Pour le BNP dosé avec le système Triage® aucune différence entre le verre et le plastique n’a été observée. Ceci pourrait être expliqué à nouveau par l’emploi d’anticorps reconnaissant des épitopes différents. Ainsi, pour les systèmes Triage® ou Beckman, le recueil du sang peut se faire indifféremment sur tube plastique ou sur tube en verre, sans que les concentrations de BNP soient modifiées (données fournisseurs).
Le matériau du tube n’intervient pas dans la stabilité du NT-proBNP. Le sang peut donc être recueilli indifféremment dans des tubes en plastique ou en verre en vue du dosage de ce peptide. Il est en pratique recueilli le plus souvent sur tubes en verre [61,62].
IV.2/-Anti-coagulants et facteurs natriurétiques :
L’activation des facteurs de la coagulation, principalement la kallicréine, augmente la dégradation du BNP [58]. Ainsi, le sang prélevé en vue d’un dosage de BNP doit être recueilli sur des tubes contenant un anticoagulant. Le choix de cet anticoagulant s’est principalement porté sur l’EDTA, chélateur de cations divalents [63]. Cette propriété lui confère à la fois une activité anticoagulante par chélation du calcium mais également une activité inhibitrice des endopeptidases neutres par chélation du zinc qui empêche la dégradation du BNP. Cependant, il apparaît que les endopeptidases neutres auraient un rôle mineur dans la stabilité in vitro du BNP [63].
Ces enzymes étant en position membranaire, l’EDTA pourrait tout de même être impliqué dans la protection du BNP tant qu’il est au contact des neutrophiles, c’est-à-dire avant la centrifugation. Ainsi le résultat du dosage du BNP dosé par méthode Triage® sur sang total avec l’EDTA comme anticoagulant n’est pas différent du dosage effectué sur plasma recueilli avec le même anticoagulant (données Biosite). L’EDTA serait donc impliqué dans la protection du BNP dans l’étape précentrifugation, période pendant laquelle le BNP est en contact avec les polynucléaires porteurs d’endopeptidases membranaires [59,64].
D’autres mécanismes de dégradation du BNP non inhibés par l’EDTA entrent en jeu, d’où l’intérêt de l’utilisation d’antiprotéolytiques plus ciblés [66].
Pour le NT-proBNP, l’existence d’une différence de stabilité entre plasma et sérum n’est pas démontrée. Les plus grands écarts trouvés sont de l’ordre de 4 % entre le sérum et le plasma hépariné, sans grande répercussion clinique [64,63].
Une stabilité du NT-proBNP dans le sérum à température ambiante a été démontrée jusqu’à une semaine pour certains auteurs. Mais dans le cas où le sérum est non décanté, une baisse de la concentration en NT-proBNP (–10 % en 72 heures) est observée [66]. Selon ces mêmes auteurs, cette diminution n’a pas de répercussion clinique notamment vis-à-vis de la large variabilité interindividuelle observée dans les résultats des dosages de NT-proBNP [66]. Cependant il semble préférable de décanter le sérum après centrifugation si le dosage ne peut être réalisé dans les 24 heures.
Par ailleurs, les valeurs du NT-proBNP sont plus faibles en présence d’EDTA par rapport aux valeurs observées sur plasma hépariné (–10 % selon
Roche) [67]. Enfin pour les tubes avec séparateurs, aucune différence significative n’a été observée avec les tubes secs « classiques » [61].
Le dosage du NT-proBNP semble donc pouvoir être réalisé indifféremment sur les différents types de tubes, sans variation importante de stabilité.
IV.3/-Interférences analytiques et facteurs natriurétiques :
Une hémolyse modérée (jusqu’à 1 g/dl d’hémoglobine) ne semble pas modifier la valeur du dosage du BNP et du NT-proBNP quelle que soit la méthode employée. Cependant, une hémolyse importante interfère avec le résultat de BNP Bayer (en l’abaissant significativement), alors qu’elle ne semble pas jouer sur le Triage® (Hb jusqu’à 10 g/dl) (Tableau I) (données fournisseurs).
Les différentes techniques de dosages des facteurs natriurétiques sont peu modifiées par une lipémie importante, jusqu’à 9 mmol/l de triglycérides pour le BNP et 46 mmol/l pour le NT-proBNP (Tableau 3) (données fournisseurs).
De même ces dosages sont peu influencés par un ictère important, jusqu’à 340 μmol/l de bilirubine pour le BNP et 600 μmol/l pour le NT-proBNP (Tableau I). Il faut remarquer que les critères de variations maximales tolérables ne sont pas forcément précisés sauf pour Roche (= 10 %) et Bayer (= 5 %).
Pour le test Roche (Elecsys®), l’anticorps de capture étant biotinylé, le traitement par la biotine (vitamine B8) à doses importantes (> 5 mg/jour) peut influencer le dosage du NT-proBNP. Il est recommandé d’effectuer le prélèvement à une distance d’au moins huit heures de la dernière prise et de ne
pas avoir une concentration sanguine de biotine supérieure à 30 μg/l (données fournisseurs) [68].
Tableau I : Stabilité après séparation du BNP et NT-proBNP (données notices fournisseurs). [20]
IV.4/-Stabilité thermique des facteurs natriurétiques :
Il existe un « effet température » sur la stabilité du BNP mais l’hétérogénéité des résultats obtenus par les études effectuées ne permet pas de conclusions précises [64].
Une étude a montré que le BNP exogène dosé par méthode «Shionoria® BNP» avait une durée de vie in vitro à température ambiante de 24 heures, résultat retrouvé avec le BNP endogène dosé par la même méthode. Il est à noter que le BNP exogène de synthèse est connu pour être moins stable in vitro que le BNP endogène [70]. Avec les dosages Biosite et Beckman la durée de vie in vitro à température ambiante serait de l’ordre de quatre heures. Cette différence serait imputable au clivage des deux résidus Terminaux modifiant un des épitopes reconnus. A 30 °C par méthode Shionoria®BNP, le BNP n’est stable que 12 heures. A température ambiante, le NT-proBNP a une durée de vie supérieure à 72 heures. Certains auteurs annoncent une durée de vie de sept jours dans ces mêmes conditions et de 21 jours à 4°C. La définition du critère de stabilité (variation maximale tolérable) entre ces études est à l’origine de ces différences [66,62] (figure 6).
Figure 6 : Stabilité thermique des peptides natriurétiques. [67]
IV.5/- Conditions pouvant fausser le dosage des peptides natriurétiques : Le taux de peptides natriurétiques augmente avec l’âge. Cette augmentation est possiblement liée à une augmentation de la prévalence de l’insuffisance cardiaque et des pathologies cardiovasculaires et rénales avec l’âge. De même, le taux de NT-proBNP est plus élevé chez les femmes sans que l’explication en soit vraiment claire. Le taux des peptides natriurétiques peut également être augmenté en cas d’insuffisance rénale. D’une part, celle-ci diminue la clearance des peptides natriurétiques et surtout du NT-proBNP qui est éliminé par voie urinaire alors que le BNP est inactivé avant d’être éliminé. D’autre part,
l’insuffisance rénale est la cause indirecte de coronaropathies sévères et d’épisodes d’insuffisance cardiaque liés à l’existence d’une hypervolémie induite [59]. Les pathologies pulmonaires provoquant une altération du ventricule droit peuvent également augmenter le BNP comme dans le cas en cas d’embolie pulmonaire avec cœur pulmonaire aigu, d’insuffisance cardiaque droite ou de tamponnade. Il faut d’ailleurs noter que les premiers travaux portant sur le BNP en clinique portaient sur la détection de l’insuffisance cardiaque droite chez les patients porteurs d’une bronchopneumopathie chronique. Les pathologies septiques graves pourraient également augmenter le BNP même si la part éventuelle d’une atteinte myocardique sous-jacente n’est pas encore nettement déterminée.
Pour ce qui est des faux-négatifs, il est actuellement bien documenté que dans le cas d’oedème pulmonaire dit flash [69] c’est-à-dire d’arrivée extrêmement brutale (rupture de cordage, infarctus,...) il peut y avoir des taux de BNP initialement normaux du fait du temps nécessité par la synthèse de BNP en réponse à l’augmentation des pressions intracardiaques. Ces cas sont cependant très rares. Ils doivent néanmoins conduire à réitérer les dosages en cas de taux de BNP anormalement bas en regard de la clinique.
V/-Méthodes de dosages des peptides natriurétiques, BNP et NT-proBNP : De nombreux autres laboratoires se sont lancés dans le dosage du BNP ou du NT-proBNP sur automate mais les études permettant de déterminer leurs seuils diagnostiques et pronostiques sont encore en cours. Il convient de rester vigilant sur le fait que les différents dosages ne sont pas interchangeables et que l’utilisation des nouvelles méthodes nécessite une validation non seulement biochimique mais également clinique.
1. BNP :
Les dosages du BNP sont fondés sur des techniques immunométriques de type « sandwich » qui n’emploient pas toutes les mêmes anticorps. Trois associations d’anticorps différents sont utilisées par différents fournisseurs. Il est important de noter que chacun d’entre eux a fait le choix du BNP ou du NT-proBNP : de ce fait, aucun automate ne dispose de trousses pour doser les deux marqueurs simultanément. Développée par Shionogi, la trousse radio-immunologique Shionoria®BNP a été historiquement la première trousse de dosage du BNP. Elle emploie deux anticorps reconnaissant l’un une séquence de la partie C-terminale (résidus 27–32) et l’autre une séquence de la boucle (résidus 14–21) (Figure 7). Cette combinaison d’anticorps est utilisée par Bayer dans l’Advia Centaur® et l’ACS® 180. Les méthodes Biosite (Triage®) et Beckman (Synchron LX 725®, UniCel DxL 800®, Access II®) utilisent un anticorps monoclonal de capture reconnaissant le pont disulfure et un panel d’anticorps murins dits « omniclonaux » (brevet déposé par Biosite) qui peut être assimilé à un mélange d’anticorps monoclonaux reproductible d’un lot à un autre (données Biosite). Ces anticorps reconnaissent plusieurs épitopes du BNP dont la séquence précise n’est pas connue (Figure 8) [70]. L’automate AxSYM® (Abbott) utilise deux anticorps monoclonaux : l’un dirigé contre le pont disulfure et l’autre contre l’extrémité C-terminale du BNP (Figure 9). Les différences entre les épitopes auraient une conséquence dans les différences de stabilité du BNP in vitro trouvées entre ces méthodes. Ainsi, la stabilité in vitro du BNP est d’environ quatre heures si le dosage est effectué par la méthode Triage® contre 24 heures dans les mêmes conditions si le dosage est effectué par la méthode Shionoria®BNP (Shionogi) [2]. L’explication de cette différence
pourrait venir d’un clivage in vivo de deux acides aminés (sérine et proline) situés en position N-terminale. Ce clivage précoce ne serait pas lié à une activité enzymatique et on ne sait pas si cette protéolyse modifie l’action physiologique du BNP. Au niveau analytique, ce clivage pourrait entraîner une modification d’affinité des anticorps reconnaissant la partie N-terminale et donc affecter les résultats des méthodes Biosite et Beckman [71,72].
Figure 7 : Sites du BNP reconnus par les anticorps employés par Bayer et Shionogi. [20]
Figure 8 : Sites du BNP reconnus par les anticorps employés par Biosite et
Figure 9 : Sites du BNP reconnus par les anticorps employés par Abbott. [20]
2. NT-proBNP :[81]
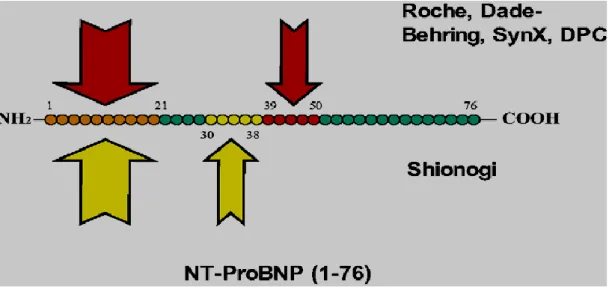
Il existe deux méthodes « sandwich » de dosage du NT-proBNP (Shionogi et Roche) et une méthode fondée sur un dosage par compétition (Biomedica Gruppe). Cependant, la méthode par compétition correspond à la première génération de dosage du NT-proBNP et la méthode non-compétitive présente plus d’intérêt dans ses performances analytiques [73]. Les méthodes développées par Shionogi et Roche ont un anticorps en commun reconnaissant les acides aminés 1 à 21 et deux anticorps différents, l’un reconnaissant la séquence 30–38 (Shionogi) et l’autre la séquence 39–50 (Roche Elecsys®) [74, 73, 75]. Cette même association d’anticorps est utilisée par Dade-Behring (RxL® HM, XpandHM®, Stratus® CS), SynX (Nexus Dx® CHF POC) et DPC (Immulite ® 2000). Les deux méthodes par compétition de Biomedica Gruppe reconnaissent des épitopes différents. La méthode EIA Mid proBNP reconnaît ainsi la séquence 8–29 et la méthode EIA-proBNP reconnaît la séquence 32–57. (Figure 10).
La méthode développée par Shionogi n’a pas été automatisée. Le dosage du proBNP en dehors de la RIA utilise donc un seul panel d’anticorps. Le NT-proBNP circule dans le sang sous différentes formes dont la principale est une forme dont les parties N-terminale et C-terminale sont tronquées [76]. Or la méthode de dosage disponible utilise un anticorps reconnaissant des acides aminés de la partie N-terminale. Si d’autres méthodes de dosage du NT-proBNP sont mises au point en utilisant des anticorps reconnaissant des sites centraux sur les peptides, une hétérogénéité des résultats des dosages de NT-proBNP entre ces méthodes et la méthode disponible est à prévoir.
Figure 10 : Sites du NT-proBNP reconnus par les anticorps des deux méthodes disponibles. [20]
VI/-Influence de la fonction rénale sur les taux sériques de NT-proBNP: Le NT-proBNP mais également le BNP augmentent dans l’insuffisance rénale. Ceci est dû pour partie à la diminution de clairance, mais également à l’impact de la pathologie rénale sur le cœur et vice-versa. Il a été montré que 40% des patients dialysés présentent aussi une maladie cardiovasculaire ou une insuffisance cardiaque (source : société de dialyse américaine). Cependant
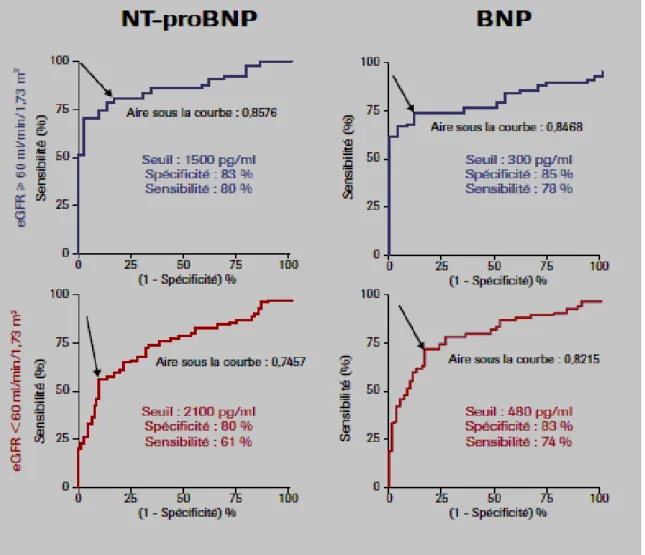
quelques études montrent que le BNP ou le NT-proBNP est significativement plus élevé chez les patients insuffisants rénaux avec IC que chez ceux sans IC [77]. Le problème étant d’établir de nouvelles valeurs seuils en fonction du débit de filtration glomérulaire. (Figure 11 et 12)
Figure 11 : Valeurs de BNP et de NT-proBNP en fonction des valeurs d’eGFR chez les
Figure 12: Influence de la fonction rénale sur les seuils de positivité du BNP et du
Chapitre -II- : l’hémodialyse :
I/-Généralités sur l’hémodialyse :
Le terme « hémodialyse » englobe l’ensemble des modalités d’épuration extrarénale capables de restaurer périodiquement le « milieu intérieur » de patients insuffisants rénaux chroniques résultant de la défaillance de leurs fonctions excrétrices. Il fait appel à différentes modalités techniques (hémodialyse, hémofiltration, hémodiafiltration) qui font intervenir des principes physiques élémentaires (diffusion, convection, adsorption). La capacité d’épuration dépend de la méthode utilisée, de la toxine urémique considérée, des caractéristiques spécifiques du patient et des conditions d’application (durée du traitement, fréquence, débits utilisés).
La clairance instantanée des solutés de référence traduit la performance d’un dialyseur utilisé dans des conditions cliniques optimales mais ne reflète en rien la clairance corporelle du patient. La clairance corporelle effective des toxines urémiques est beaucoup plus difficile à évaluer en pratique dans la mesure où elle fait intervenir la durée du traitement, la complexité du milieu intérieur et l’interaction du système patient/hémodialyse. La notion de « dose de dialyse », volontiers utilisée pour qualifier l’efficacité du programme de dialyse, ne doit pas se résumer à celle d’une mesure périodique de la « clairance fractionnelle » de l’urée, plus connue sous le nom de Kt/V. Elle doit faire appel à un ensemble de marqueurs clinicobiologiques couvrant le spectre des anomalies de l’insuffisance rénale chronique. La bonne connaissance des principes physiques régissant les échanges de solutés en dialyse est indispensable à tout néphrologue soucieux d’améliorer la qualité du traitement et la survie de ses patients.
Le traitement de suppléance rénale par dialyse assure à l’heure actuelle la survie de plus d’un million de sujets à travers le monde. Son utilité et sa place dans le traitement de l’urémie chronique ne sont plus à démontrer [78].
De nombreuses méthodes d’EER ont été développées pour répondre aux besoins spécifiques de chaque patient. De façon schématique, elles peuvent être classées en deux catégories [79]:
Les méthodes extracorporelles, représentées par l’hémodialyse ; Les méthodes intracorporelles, représentées par la dialyse
péritonéale (DP).
Quelle que soit la méthode utilisée, c’est à partir du sang circulant que les phénomènes d’échanges avec le « milieu extérieur » s’établissent, et permettent de rétablir périodiquement l’homéostasie et la composition du « milieu intérieur » du patient urémique.
II/-Hémodialyseurs (hémodiafiltres, hémofiltres) :
L’hémodialyseur (synonymes : dialyseur, hémofiltre, hémodiafiltre) est le module d’échange qui se trouve à l’interface du patient et de l’appareillage d’hémodialyse. C’est lui qui permet les échanges de solutés entre le « milieu intérieur » du patient et le « milieu extérieur » grâce au dialysat, vecteur des solutés.
L’hémodialyseur est un module généralement cylindrique qui comporte une coque rigide (polyuréthane habituellement), deux extrémités coniques (tête artérielle et tête veineuse) sur lesquelles s’attachent les lignes sanguines, et contient un faisceau de fibres creuses permettant la circulation sanguine. Le faisceau de capillaires baigne dans le dialysat qui circule et perfuse à
contre-courant le dialyseur. Sur la coque externe du dialyseur se trouvent deux connecteurs qui permettent son arrimage aux lignes de dialysat du générateur et permettent ainsi la circulation du dialysat. À noter que les dialyseurs à plaque, anciennement utilisés, ont virtuellement disparu du marché des dialyseurs. Les hémodialyseurs capillaires représentent à l’heure actuelle le meilleur compromis alliant compacité (de 25 à 35cm de long sur 8 à 10cm de diamètre), large surface d’échange et résistance circulatoire optimisée. L’application de la nanotechnologie à la production des dialyseurs a permis récemment d’en miniaturiser la taille et d’en réduire les composants [80].
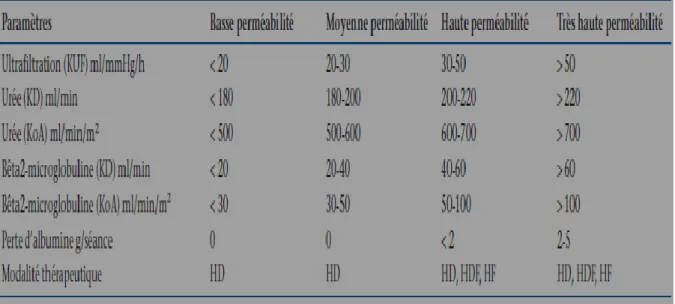
Un hémodialyseur se caractérise par la nature et la perméabilité (basse, moyenne ou haute) de sa membrane (Figure 3), par sa surface d’échange, par sa géométrie interne (résistance circulatoire) et externe (turbulence du compartiment dialysat) et par son hémoréactivité (thrombogénicité, hémocompatibilité) [81]. (Figure 13)
La perméabilité des membranes permet de les classer en quatre catégories principales : les membranes de basse perméabilité (low-flux), les membranes de moyenne perméabilité (midflux), les membranes de haute perméabilité (high-flux) et les membranes de très haute perméabilité (super-(high-flux). La notion de perméabilité est trompeuse et le piège commercial doit être déjoué. En effet, elle fait souvent référence à la perméabilité hydrique (coefficient d’ultrafiltration [KUF]) et non à celle des solutés (coefficient de transfert de masse par unité de surface d’un soluté [KoA] ou coefficient de tamisage). Cela sous-entend que la perméabilité aux solutés serait superposable à celle de la perméabilité hydrique, ce qui est loin d’être vrai. Il apparaît donc nécessaire de rappeler que les caractéristiques exactes de perméabilité d’une membrane doivent être spécifiquement précisées par les fabricants de dialyseurs. Un tableau résumant les principales caractéristiques de perméabilité (hydrique et solutés) des dialyseurs est proposé (Tableau II). Les dialyseurs de radicaux oxygénés, par une libération nettement plus réduite d’enzymes phagocytaires et de cytokines pro-inflammatoires. À noter cependant que les capacités d’adsorption de certaines membranes peuvent masquer en partie leurs capacités activatrices ou inductrices cellulaires. Il faut également souligner que l’activation protéique et cellulaire sanguine membranaire est très nettement amplifiée par la présence de contaminants microbiens dans le dialysat (endotoxines, dipeptides, exotoxines).
L’hémocompatibilité du système de dialyse n’est donc pas qu’un problème de membrane, mais également un problème de pureté microbiologique du dialysat.
Tableau II : Classification des membranes selon leur perméabilité et leurs performances. [83]
. HD : Hémodialyse ; HDF : Hémodiafiltration ; HF : Hémofiltration. KUF : Coefficient d’ultrafiltration ; KD : Clairance diffusive ; KoA :
Coefficient de transfert de masse par unité de surface
III/-Types de membranes selon leur composition biochimique : [83] Membranes cellulosiques non modifiées (cuprophane)
Membranes cellulosiques substituées (cellulose di- et triacétate, hémophane)
Membranes synthétiques ou polymériques (polyacrylonitrile, polyamide, polysulfone, polyméthylméthacrylate, polyaryléthersulfone...)
Membranes bioactives (enrichies en vitamine E, type excebrane avec adsorption orientée, héparine type AN69ST).
IV/-Les paramètres de l’épuration : [83]
La quantification de l’épuration repose sur deux principes fondamentaux: L’urée est prise comme témoin de l’accumulation des toxines urémiques et sert de substance de référence pour quantifier l’épuration.
La cinétique d’épuration de l’urée est du premier ordre, en ce sens que la quantité d’urée J épurée par unité de temps est proportionnelle à la concentration de l’urée Cs dans la solution à épurer, c’est-à-dire le plasma à l’entrée du dialyseur (noter que le sang n’est pas une solution, mais une suspension de cellules dans une solution appelée plasma): J = k Cs. Cette relation indique donc que le rapport J/Cs de la quantité d’urée épurée par unité de temps sur la concentration plasmatique de l’urée à l’entrée du dialyseur est une constante k. Cette constante est appelée « clairance du dialyseur » vis-à-vis de l’urée. Elle s’exprime en ml/minute.
Ces principes de base permettent de définir trois paramètres utiles pour quantifier l’épuration obtenue grâce à une séance d’hémodialyse:
La clairance effective du patient vis-à-vis de l’urée.
La dose de dialyse.
La dose normalisée de dialyse.
IV/.1-La clairance effective du patient vis-à-vis de l’urée : [83]
Alors que la clairance k du dialyseur vis-à-vis de l’urée permet de quantifier l’efficacité d’un dispositif médical, elle ne témoigne pas pour autant que l’épuration du patient est efficace. Un phénomène de recirculation de l’abord vasculaire (figure 14) et/ou de recirculation cardio-pulmonaire (figure
15) peut diminuer l’efficacité de l’épuration du patient parce que la recirculation diminue la concentration plasmatique Cs de l’urée à l’entrée du dialyseur et donc le transfert de masse. En effet, en présence de recirculation, le sang arrivant à l’entrée du dialyseur est un mélange de sang veineux périphérique (concentration plasmatique en urée Cp) et de sang ayant déjà été épuré en urée dans le dialyseur.
Figure 14 : Un exemple de recirculation liée à l’abord vasculaire.
Dans l’exemple schématisé ci-dessus, le patient est porteur d’un cathéter double lumière placé dans la veine fémorale (V) et à l’origine d’une recirculation partielle du sang de l’extrémité veineuse vers l’extrémité artérielle du cathéter.
La concentration en urée Cs du sang arrivant à l’entrée du dialyseur par l’extrémité artérielle du cathéter est inférieure à la concentration en urée cP du sang veineux périphérique du patient parce que le sang à l’entrée du dialyseur
(Cs = 23 mmol/l dans cet exemple) est un mélange de sang veineux périphérique (Cp = 30 mmol/l) et de sang déjà épuré en urée dans le dialyseur et donc de concentration en urée Css très faible (5 mmol/l). [83]
Cependant il est possible de montrer que la quantité d’urée J épurée par unité de temps est aussi proportionnelle à Cp : J = K Cp.
Le coefficient de proportionnalité K est appelé « clairance effective du patient vis-à-vis de l’urée ». Comme Cs est inférieure à Cp, la clairance effective de l’urée J/Cp est inférieure à la clairance du dialyseur J/Cs. C’est cependant la clairance effective qui témoigne réellement de l’efficacité de l’épuration du patient : une séance de dialyse est de bonne qualité technique si la clairance effective K de l’urée est égale à la valeur attendue et si elle le reste pendant toute la durée de la séance.
Figure 15: Un exemple de recirculation cardio-pulmonaire.
Dans l’exemple schématisé ci-dessus, le patient est porteur d’une anastomose artérioveineuse (AV) de bon débit, permettant l’absence de recirculation liée à l’abord vasculaire.
La concentration en urée Cs du sang arrivant à l’entrée du dialyseur est inférieure à la concentration en urée Cp du sang veineux périphérique du patient : du fait de la présence de l’anastomose artérioveineuse, elle est en effet égale à la concentration Cmix (28 mmol/l dans cet exemple) d’un mélange de sang veineux périphérique (cP = 30 mmol/l) et de sang en provenance de l’abord vasculaire (concentration en urée égale à 23 mmol/l dans cet exemple) dont une partie a déjà été épurée en urée dans le dialyseur et est donc de concentration en urée Css très faible (6 mmol/l). [83]
IV/.2-La dose de dialyse : [83]
La clairance effective de l’urée représente en quelque sorte la puissance avec laquelle le patient est épuré. Par analogie avec le travail effectué par une machine, défini en physique comme le produit du temps pendant lequel elle fonctionne et de sa puissance moyenne pendant cette durée, la dose de dialyse est définie comme le produit de la puissance d’épuration K (clairance effective de l’urée) et de la durée t de la séance de dialyse. Cette dose de dialyse s’exprime en litres. La valeur de la clairance effective de l’urée intervenant dans la définition de la dose de dialyse est la moyenne des valeurs de la clairance effective pendant la durée de la séance. La détermination de la dose de dialyse administrée au patient donne une image plus globale de l’efficacité de l’épuration que la simple valeur instantanée de la clairance effective de l’urée, car elle prend en compte les variations éventuelles de cette dernière depuis le début de la séance.
IV/.3-La dose normalisée de dialyse : [83]
Comme dans le cas d’un médicament, la dose de dialyse requise par un patient dépend de sa morphologie: un adulte de 80 kg requiert une dose de dialyse supérieure à celle d’un enfant de 20 kg. De même qu’il importe de rapporter la dose de médicament requise par un patient à son poids corporel ou plus exactement au volume de distribution du médicament, il importe de rapporter la dose de dialyse au poids du patient ou plus exactement au volume de distribution de l’urée qui, à l’équilibre, n’est autre que l’eau totale V du patient. Ainsi définit-on la dose normalisée de dialyse comme le rapport Kt/V. Ce rapport est sans dimension et peut donc être considéré comme un index d’épuration.
V/- Quantification de l’épuration :
La quantification de l’épuration offerte par une séance d’hémodialyse nécessite une estimation précise d’un ou de plusieurs des paramètres précédemment définis. Cette estimation est classiquement basée sur des mesures de concentration de l’urée effectuées dans le sang et/ou dans le dialysat. Elle se heurte en pratique à de nombreuses difficultés.
V/.1-Estimation de l’index Kt/V :
La dose normalisée de dialyse Kt/V est le paramètre de l’épuration le plus facile à quantifier directement (L’indice Kt/V représente le rapport de la clairance corporelle de l’urée sur le volume de distribution du patient (V = 55-60 % poids) (K : produit de la clairance corporelle instantanée, t : la durée de la séance de dialyse) [84]. Contrairement à la quantification directe de la clairance effective (K) de l’urée ou de la dose de dialyse (Kt) qui nécessite de mesurer le transfert d’urée à travers la membrane du dialyseur, l’index Kt/V peut être calculé à partir de la simple observation de l’évolution durant la séance de la concentration plasmatique du patient en urée. La relation mathématique permettant le calcul de l’index Kt/V peut être établie formellement en utilisant un outil mathématique appelé « modélisation cinétique de l’urée » ou empiriquement en dégageant une relation entre l’index Kt/V et les différents paramètres dont il dépend.
La modélisation cinétique de l’urée permet de calculer la valeur de l’index Kt/V à partir de la mesure de la variation relative de la concentration en urée dans le sang ou dans le dialysat efférent pendant la séance d’hémodialyse. Les appareils assurant l’enregistrement en continu de la concentration en urée du
dialysat efférent (Biostat Baxter [85], DQM 200 Gambro [86]) ou de l’ultrafiltrat plasmatique (Bellco [87]) permettent d’automatiser cette procédure.
En ce qui concerne les relations empiriques, la plus communément employée est « l’équation de seconde génération » de Daugirdas: [88]
Kt/V = - ln (R - 0,008.t) + (4 – 3.5.R).ΔP/P où R désigne le rapport Cf/C0 des concentrations de l’urée dans le sang ou dans le dialysat efférent en début (c0) et en fin (Cf) de séance, t la durée de la séance (en heures), ΔP/P le rapport de la perte de poids ΔP durant la séance au poids P du patient en fin de séance. V/.2-Estimation des autres paramètres de l’épuration :
Les méthodes basées sur une mesure du transfert d’urée à travers la membrane du dialyseur permettent de quantifier la clairance de l’urée et la dose de dialyse. Elles ne donnent une estimation fiable de ces paramètres qu’à la condition de suivre une méthodologie très précise [89].
L’estimation de la clairance de l’urée peut être obtenue en mesurant la quantité d’urée qui quitte le compartiment sanguin (mesure « côté sang »), ou celle qui arrive dans le dialysat (mesure «côté dialysat »). Les mesures « côté sang » nécessitent de déterminer le volume de distribution de l’urée dans le sang. Ce volume n’est pas égal au volume de sang total, mais au volume d’eau sanguine qui dépend principalement de l’hématocrite et accessoirement de la protidémie et qui représente environ 85% du volume sanguin total. L’absence habituelle de prise en compte de ce facteur conduit à une surestimation systématique des clairances obtenues par cette méthode [90] La mesure du transfert de masse « côté dialysat » évite cet écueil, mais nécessite une estimation précise du débit QDout de dialysat à la sortie du dialyseur. Par ailleurs
le niveau de concentration de l’urée dans le dialysat, moins élevé que dans le sang, tend à faire perdre de la précision à la mesure.
La méthode de « quantification directe de la dialyse » permet de calculer la dose de dialyse Kt à partir d’une mesure de la quantité totale d’urée recueillie dans le dialysat pendant la séance [91] De plus cette méthode permet une mesure directe du volume de distribution de l’urée. Elle représente en pratique le «gold standard», mais reste de mise en oeuvre difficile.
P
I/-Objectifs de l’étude :
C’est une étude transversale qui s’est déroulée à l’Hôpital Militaire d’Instructions Mohammed V (HMIMV) de Rabat entre le service de Nephrologie-Dialyse et Transplantation Rénale et le laboratoire de Biochimie-Toxicologie sur une période six mois (d’octobre 2008 à fin mars 2009).
Nous nous sommes proposés d’étudier l’intérêt du dosage du NT-proBNP dans le diagnostic de l’hypertrophie ventriculaire gauche chez les patients hémodialysés chroniques de l’HMIMV et de déterminer les paramètres cliniques et biologiques prédictifs de la valeur moyenne de ce marqueur biologique avant la séance de dialyse chez ces même patients.
Dans un deuxième temps nous nous sommes fixés d’évaluer l’influence de la dialyse sur les concentrations sériques du NT-proBNP chez ces patients et d’étudier la relation entre le taux sanguin du NT proBNP et les différents marqueurs de volémie : TA avant et après dialyse, Poids avant et après dialyse, prise de poids interdialytique, et l’index cardiothoracique.
II/-Patients et méthodes : II.1/-Patients :
Nous avons inclus trente patients hémodialysés chroniques, dont 50% femmes et 50% hommes, en hémodialyse depuis au moins 6 mois.
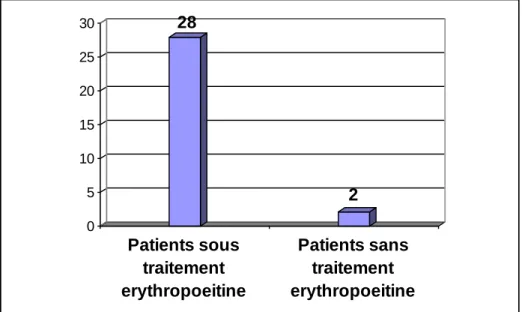
Les patients retenus étaient des HDC stables (sans insuffisance cardiaque). Nous avons exclu les HD dans le cadre d’une insuffisance rénale aigue, une pathologie respiratoire, cardiaque ou hépatique évolutive et les HDC des autres centres hospitalisés dans notre formation.
Un dosage de NT-proBNP plasmatique a été réalisé chez ces patients avant et après la séance de dialyse en même temps que les autres examens de routine (voir fiche d’exploitation en annexe), à savoir :
Un bilan biologique.
Une radiographie pulmonaire
Une échocardiographie associée à un écho-Doppler si nécessaire.
Tous les patients sont dialysés par membrane à basse perméabilité.
II.2/- Méthodes :
II.2.1/-Recueil des prélèvements et conservation :
Les prises de sang veineux destinées au dosage du NT-proBNP ont été recueillies sur tube sec (10 ml avec bouchon rouge).
Le dosage de NT-proBNP a été réalisé immédiatement. Pour certains cas, le dosage a été effectué le lendemain matin, les sérums ayant été conservés au réfrigérateur à +4 degrés. Le NT-proBNP est stable et a une durée de vie de 21 jours [66]. De plus, sa concentration ne varie pas en fonction de l’heure de prélèvement [92,93].
II.2.2/-Dosage du NT-proBNP :
Après centrifugation du prélèvement sanguin à 3000 tours/min pendant 10 minutes, la détermination sérique du NT-proBNP a été réalisée sur l’auto-analyseur Elecsys 2010 de Roche diagnostics (figure 16). Cette technique repose sur une réaction dite en sandwich éléctrochimiluminescence (ECLIA), avec deux anticorps polyclonaux reconnaissant deux régions stables mais
![Figure 3 : Type de récepteurs des peptides natriurétiques. [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059145.698155/11.892.159.736.120.489/figure-type-récepteurs-peptides-natriurétiques.webp)
![Figure 5 : Taux de BNP chez des patients présentant une insuffisance cardiaque. [57]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059145.698155/21.892.226.674.182.410/figure-taux-bnp-patients-présentant-insuffisance-cardiaque.webp)
![Figure 6 : Stabilité thermique des peptides natriurétiques. [67]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059145.698155/27.892.148.749.108.664/figure-stabilité-thermique-peptides-natriurétiques.webp)
![Figure 7 : Sites du BNP reconnus par les anticorps employés par Bayer et Shionogi. [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059145.698155/30.892.267.627.331.609/figure-sites-bnp-reconnus-anticorps-employés-bayer-shionogi.webp)
![Figure 9 : Sites du BNP reconnus par les anticorps employés par Abbott. [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/15059145.698155/31.892.265.629.104.330/figure-sites-bnp-reconnus-anticorps-employés-abbott.webp)