Conflit sexuel et polyandrie de commodité chez une espèce
polygynandre : les effets combinés des processus pré- et
post- copulatoires sur le succès reproducteur de Gerris
buenoi.
Mémoire
Eric Devost
Maîtrise en biologie
Maître ès sciences (M.Sc.)
Québec, Canada
Conflit sexuel et polyandrie de commodité chez une espèce
polygynandre : les effets combinés des processus pré- et
post- copulatoires sur le succès reproducteur de Gerris
buenoi.
Mémoire
Eric Devost
Sous la direction de :
Julie Turgeon
Résumé
Chez les patineurs, des processus postcopulatoires sont documentés et un conflit sexuel sur le taux d'accouplement est démontré. Cependant, leurs effets combinés sur le succès reproducteur ont rarement été investigués. Cette étude joint une analyse de filiation génétique à des observations comportementales pour évaluer l'effet des processus pré- et post- copulatoires sur le succès reproducteur de Gerris buenoi. Nos résultats montrent la nature antagoniste des combats précopulatoires et un niveau de résistance optimal intermédiaire pour les femelles. Cependant, le taux d'accouplement n'a eu aucune influence sur le succès reproducteur des deux sexes. Un taux d'accouplement élevé permettant à des processus postcopulatoires de se mettre en place ainsi que plusieurs copulations superflues ont vraisemblablement masqué les effets attendus du taux d'accouplement. Notre étude confirme l'idée que des précisions peuvent être apportées sur les forces de sélection sexuelle en jeu lorsque l'on considère tous les épisodes d'un cycle d'accouplement chez les animaux polygynandres.
Abstract
In water striders, postcopulatory processes are documented and sexual conflict over mating rate has been shown. However, their combined effect on reproductive success has seldom been investigated. This study combines genetic parentage analyses and behavioral observations to investigate how pre- and postcopulatory processes influence the reproductive success of Gerris buenoi. Our results show the antagonistic nature of precopulatory fights and an optimal resistance level for females. However, mating rate had no effect on the reproductive success of both sexes. A high mating rate allowing postcopulatory processes to take place and many superfluous copulations likely masked the expected effects of mating rate on reproductive success. Our study confirms that insights on sexual selection forces at work are gained from investigating all episodes in the reproduction cycles of polygynandrous animals.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Avant-Propos ... ix
Introduction générale ... 1
Coûts reliés à la reproduction polygynandre ... 2
Coûts associés à la reproduction et à la polyandrie ... 2
Bénéfices à la reproduction et à la polyandrie ... 4
Polyandrie et sélection sexuelle précopulatoire ... 5
Polyandrie et sélection sexuelle postcopulatoire ... 6
Gerris spp. ... 9
Comportement sexuel ... 10
Processus postcopulatoires ... 11
Conflit sexuel ... 12
Objectifs ... 15
Chapitre 1 : Active sexual conflict and convenience polyandry in a polygynandrous species : the combined effects of pre- and post- copulatory processes on lifetime reproductive success of Gerris buenoi. ... 16
Abstract ... 17
Résumé ... 18
Introduction ... 19
Materials and methods... 22
Mating sessions and behavioural observations ... 22
Genetic characterization and parentage analysis ... 23
Variables estimated ... 24
Statistical analyses ... 25
Precopulatory sexual conflict ... 27
Postcopulatory processes ... 27
Discussion ... 28
Sexual conflict over mating rate ... 28
Postcopulatory processes ... 29
Summary and perspectives ... 31
Appendix I : Variables distribution ... 37
Conclusion générale ... 38
Liste des tableaux
Table 1: Information on 10 new microsatellite markers developed for G. buenoi including primer sequences (and fluorescent dye from the standard ABI dye set DS-32) , total number of alleles [AN], PCR product size
Liste des figures
Figure 1: Relationships between relative values of lifetime reproductive success (RS) and precopulatory behavioural traits (A) female cMS (R2 < 0.01 , P-value = 0.65) (B) male cMS (R2 < 0.01, P-value = 0.99) (C)
female preStr (R2 = 0.28, P-value = 0.007) (D) male preStr (R2 = 0.28, P-value = 0.001) (E) female fResS (R2 =
0.22, P-value = 0.005) (F) male mHarS (R2 = 0.26, P-value = 0.002)... 35
Figure 2 : Relationships between relative values of lifetime reproductive success (RS) and indicators of postcopulatory processes (A) female SupCop (R2 = 0.36, P-value < 0.0002) (B) male SupCop (R2 = 0.46,
P-value < 0.0001) (C) female gMS (R2 = 0.85, P-value < 0.0001) (D) male gMS (R2 = 0.69, P-value < 0.0001) (E)
female ratio gMS/pMS (R2 = 0.50, P-value < 0.0001) (F) male ratio gMS/pMS (R2 = 0.42, P-value < 0.0001).
Note that the scale of the x-axis is reversed in (F) because high male harassment success corresponds to a low ratio. ... 36
Avant-Propos
Le présent mémoire comprend une introduction et une conclusion générale rédigées en français, ainsi qu'un projet d'article rédigé en anglais. L'article sera soumis à une revue spécialisée en biologie évolutive dans le but d'être publié. Il a été rédigé par Julie Turgeon, ma directrice de recherche, et moi-même en tant qu'auteur principal. Toutes les étapes qui ont mené à la rédaction de cet article ont été principalement sous ma supervision. Le travail réalisé comprenait, entre autre, la mise en place d'un dispositif expérimental, la réalisation d'observations comportementales, l'élevage d'insectes, l'extraction et l'amplification de matériel génétique, l'analyse de données et la rédaction. Le projet s'est étalé sur un peu plus de deux ans, pendant lesquelles j'ai présenté des résultats préliminaires à trois colloques scientifiques : Colloque de Biologie de l'Université Laval 2013, colloque de la Société Québécoise pour l'Étude Biologique du Comportement (SQEBC, 2013) et le colloque de la Société d'Entomologie du Québec (SEQ, 2013).
Je tiens à remercier ma directrice, Julie Turgeon, pour son support exemplaire, son aide dévouée et sa grande disponibilité. Plusieurs membres du laboratoire Turgeon m'ont aussi beaucoup aidé dans la réalisation de ce projet, dont Genevière Parent, Pierre Duschesne, Xavier Prairie, Naima Jomni et Audrey Bourret. Sans eux, ce projet n'aurait jamais pu être mené à termes.
Introduction générale
La reproduction a longtemps été considérée comme un des meilleurs exemple de coopération dans la nature (Darwin, 1871). Les individus des deux sexes ont clairement intérêt à produire le plus de rejetons possible, et à veiller à ce que ces rejetons atteignent la maturité et se reproduisent à leur tour. Cependant, cette vision coopérative des interactions entre les sexes commença à changer avec les travaux de Geoff Parker au début des années 70. Parker et coll. (1972) proposèrent que l'anisogamie, définie comme étant une différence marquée de taille et/ou de forme entre les gamètes mâles et femelles, reflète un conflit d'intérêt fondamental entre les deux sexes. Avec ses travaux, Parker précisa la notion de conflit sexuel, qu'il définit comme étant un intérêt évolutif différent entre les individus des deux sexes (Parker et coll., 1979). Il suggéra aussi qu'un allèle qui augmente le succès d'accouplement des mâles peut se répandre dans la population même si cet allèle cause des dommages directs aux femelles (voir aussi Rice, 1984). En réponse, les femelles peuvent développer des phénotypes pour contrer ces dommages. Dans ce cas, le conflit sexuel peut mener à une coévolution , au cours de laquelle des adaptations développées dans un sexe sont contrebalancées par des adaptations dans l'autre sexe.
La définition de Parker du conflit sexuel peut être bonifiée en précisant le trait sur lequel le conflit porte (Rowe & Day, 2006). Ce trait doit être présent chez les deux sexes, il doit mener à des optimums de fitness différents pour chaque sexe et les interactions mâles-femelles doivent faire en sorte que ces optimums ne puissent être atteints en même temps dans les deux sexes (Rice & Holland, 1997; Chapman et coll., 2003). Ce trait partagé peut être une simple caractéristique phénotypique présente chez les deux sexes, par exemple une queue, ou une caractéristique phénotypique qui émerge suite à l'interaction entre individus, par exemple un taux d'accouplement (Rowe & Day, 2006). Une fois un trait partagé identifié, le conflit sexuel peut alors être défini comme étant de la sélection sexuellement antagoniste sur ce trait partagé, c'est à dire de la sélection qui favorise le développement du trait dans une direction pour un sexe, et dans une direction opposée pour l'autre. Ce genre de conflit peut se manifester sur des traits comme les soins parentaux (Trivers, 1972; Houston et coll., 2005), le comportement de réaccouplement des femelles (Arnqvist & Rowe, 2005), la sélection de l'habitat (Morris & MacEachern, 2010), la fertilisation (Parker, 2006) ou le taux d'accouplement (Arnqvist & Nilsson, 2000).
Dans un système strictement monogynandre , le succès reproducteur d'un individu est inexorablement lié à celui de son partenaire. Un trait qui diminue le succès reproducteur de son partenaire ne sera
vraisemblablement pas sélectionné. On s'attend alors à retrouver les manifestations les plus intenses du conflit sexuel dans des systèmes polyandres (Parker, 2006).
Coûts reliés à la reproduction polygynandre
Contrairement à une femelle monoandre qui a un seul partenaire sexuel pendant un cycle de reproduction, une femelle polyandre en a plusieurs (Thornhill & Alcock, 1983). Les naturalistes savent depuis bien longtemps que certaines espèces sont polyandres et Darwin en était pleinement conscient. Cependant, on a longtemps considéré que la grande majorité des espèces étaient monoandres, et qu'un seul ou quelques accouplements suffiraient aux femelles pour maximiser leur succès reproducteur (Bateman, 1948; Arnold & Duvall, 1994). Nous savons maintenant que la polyandrie est très répandue (Birkhead & Møller, 1992; Eberhard, 1996), qu'elle comporte des coûts (e.g. Watson et coll., 1998; McNamara et coll., 2008) mais aussi des bénéfices (Jennions & Petrie, 2000; Tregenza & Wedell, 2000; Simmons, 2005; Kempenaers, 2007). Pour bien saisir la nature des coûts et des bénéfices associés à la polyandrie, il est important de différencier accouplements multiples, qui est le fait de s'accoupler à plusieurs reprises avec un ou plusieurs mâles, de la polyandrie. Une femelle polyandre participe nécessairement à plusieurs accouplements, mais une femelle qui s'accouple à plusieurs reprises n'est pas polyandre si elle s'accouple toujours avec le même mâle. Notons que cette distinction n'a pas toujours été faite dans la littérature, comme le déplore entre autre Tregenza & Wedell (2000) et Slatyer et coll. (2012).
Coûts associés à la reproduction et à la polyandrie
Puisque dans la nature, les ressources disponibles pour les animaux sont limitées, la reproduction implique des coûts reliés au fait de s'accoupler et à la production de gamètes. Pour les femelles, l'accouplement amène une myriade de coûts tel que : une dépense énergétique substantielle (Thornhill & Alcock, 1983; Fairbairn, 1993; Watson et coll., 1998), des dommages physiques causés par des épines génitales (Stutt & Siva-Jothy, 2001; Blanckenhorn et al., 2002; Hotzy & Arnqvist, 2009), des substances toxiques transférées avec le sperme (Chapman et coll., 1995; Wigby & Chapman, 2005) , l'exposition aux maladies (Thrall et coll., 2000) et des dangers de prédation (Arnqvist, 1989; Rowe, 1994). Résister et/ou fuir des mâles agressifs comporte aussi des coûts comme une dépense énergétique (Watson et coll., 1998) ou une
diminution de temps alloué à la recherche de nourriture (Magurran & Seghers, 1994; Plath et coll., 2007). Tous ces coûts ont comme effet général de diminuer la longévité des femelles. Puisque la longévité est étroitement liée à la possibilité d'accouplements futurs, une longévité réduite en réponse à un effort de reproduction est donc un indicateur de coûts directs à la reproduction. Aussi, plusieurs de ces coûts ont un effet négatif sur le taux de production d'oeufs, ce qui peut potentiellement mener à une diminution du succès reproducteur à vie des femelles.
On considère naturellement que des gamètes plus grosses et contenant des éléments nutritifs (i.e. gamètes femelles) sont plus coûteuses à produire que des gamètes ne contenant pratiquement que du matériel génétique (i.e. gamètes mâles). D'ailleurs, pour la même quantité de biomasse de gamètes produites, incluant le liquide séminal, les gamètes femelles sont en moyenne 1000 fois plus coûteuses à produire que les gamètes mâles (Hayward & Gillooly, 2011). Aussi, il y a des évidences que la production d'oeufs diminue la longévité des femelles chez plusieurs espèces d'insectes qui ne reçoivent pas de substances nutritives de la part du mâle durant l'accouplement (Arnqvist & Nilsson, 2000).
Cependant, il est difficile de lier la polyandrie à tous ces effets négatifs. Comme vu plus haut, plusieurs facteurs liés au simple fait de s'accoupler influencent négativement la longévité des femelles et leur production d'oeufs, et distinguer ces facteurs de l'effet direct de la polyandrie sur la production d'oeufs est difficile (Arnqvist & Nilsson, 2000), mais réalisable comme l'ont montré Tregenza & Wedell (1998).
Pour les mâles, les composantes de la reproduction pour lesquelles on s'attend à retrouver des coûts sont la production de sperme, la compétition intrasexuelle pour les partenaires, les parades nuptiales et la production de traits sexuels secondaires, le harcèlement, la copulation et plus rarement, les soins parentaux (Parker & Birkhead, 2013). Les évidences empiriques que la spermatogénèse implique des coûts substantiels commencent à s'accumuler (e.g. Nakatsuru & Kramer, 1982; Van Voorhies, 1992; Olsson et coll., 1997; Boivin, 2013). Aussi, la compétition spermatique, discutée plus loin, augmente les coûts de production des éjaculats (Parker & Pizzari, 2010). Des coûts associés à la séduction ont aussi été identifiés chez quelques espèces d'insectes (Cordts & Partridge, 1996; Clutton-Brock & Langley, 1997; Kotiaho et coll., 1998), mais malgré l'importance des traits sexuels secondaires dans la séduction et la théorie de la sélection sexuelle en général, peu d'évidences empiriques directes existent (Kotiaho, 2001; Pelletier et coll., 2006). Des coûts associés au harcèlement ont également été identifiés chez les
Gerridae, via une augmentation des risques de prédation (Rowe, 1994), mais très peu d'études ont investigué les coûts physiologiques du harcèlement chez les mâles (voir Makowicz & Schlupp, 2013 pour un rare exemple). La compétition mâle-mâle pour l'accès aux partenaires peut elle aussi avoir des conséquences négatives sur leur longévité (e.g. Gaskin et al., 2002). On s'attend à ce que les risques de maladies pendant la copulation soient aussi présents chez les mâles et finalement, chez les espèces d'oiseaux avec soins biparentaux, les soins fournis par les mâles peuvent avoir une conséquence négative sur leur longévité (Linden & Møller, 1989).
Avec autant de coûts associés aux accouplements et à la polyandrie, on s'étonne de constater que la polyandrie est si répandue chez les animaux (Jennions & Petrie, 2000). Pourquoi les femelles de la majorité des espèces s'accouplent avec plusieurs partenaires et à de multiples reprises ? Au cours des dernières années, cette question a inspiré de nombreux chercheurs qui ont généré une vaste littérature sur les bénéfices potentiels que peut procurer la polyandrie.
Bénéfices à la reproduction et à la polyandrie
Les bénéfices à la polyandrie sont classés en deux types : les bénéfices directs et indirects. Les bénéfices directs concernent le fait de s'accoupler à plusieurs reprises (accouplements multiples) et ne concernent donc pas strictement la polyandrie. Ils affectent directement le succès reproducteur des femelles via des bénéfices matériels apportés par le mâle avant, pendant ou après la copulation. Ces bénéfices peuvent fournir aux femelles de la nourriture (Sakaluk, 1984; Gwynne, 1988) , un accès à des ressources ou à un territoire (Pleszczynska, 1978; Searcy, 1979) , un apport suffisant en sperme (Matthews et coll., 1997; Drnevich et coll., 2001), des composés défensifs ou nutritifs fournis via le liquide séminal (Dussourd et coll., 1989; Gonzalez et coll., 1999; Iyengar & Eisner, 1999) et des soins parentaux (Pampoulie et coll., 2004). En général, ces évidences de bénéfices directs montrent que la sélection naturelle peut favoriser la promiscuité parce que les accouplements augmentent la fécondité des femelles, soit en augmentant leur longévité ou leur taux de production d'oeufs. Au final, une plus grande promiscuité augmente les probabilités qu'une femelle s'accouple avec plusieurs mâles et favorise par le fait même la polyandrie.
Quant aux bénéfices indirects, ils sont d'ordre génétique et concernent strictement la polyandrie : une femelle s'accouplant à plusieurs reprises avec le même mâle n'augmente pas son échantillonnage génétique de partenaires. Les évidences de bénéfices indirects sont plus contestées, en partie parce que l'effet est souvent confondu avec les bénéfices directs (Slatyer et coll., 2012). On considère qu'ils peuvent survenir principalement de deux façons (Jennions & Petrie, 2000; Slatyer et coll., 2012). Premièrement, en produisant une couvée ayant une plus grande diversité génétique, les femelles polyandres augmenteraient le succès reproducteur moyen de leurs rejetons. Ce type de bénéfices a surtout été démontré chez des insectes eusociaux (abeilles, fourmis, guêpes) chez qui une plus grande diversité génétique a été associée avec un meilleur taux d'acquisition de nourriture, un meilleur taux de croissance populationnel et ultimement, un meilleur succès reproducteur (Baer & Schmid-Hempel, 1999). Ces bénéfices peuvent survenir parce qu'il y a une base génétique aux classes de travailleurs, en ce sens que les colonies fondées par des reines polyandres sont plus efficaces dans l'assignation des tâches (Smith et coll., 2008). Aussi, dans les cas où les signaux des mâles (e.g. ornements, parades, couleurs) ne sont pas honnêtes ou détectables, la diversité génétique accrue des jeunes permettrait aux femelles de minimiser l'effet de s'accoupler avec des mâles de moindre qualité (Jennions & Petrie, 2000). Deuxièmement, les femelles polyandres se donneraient l’opportunité de faire un choix postcopulatoire et de biaiser la paternité vers des mâles qui augmenteraient le succès reproducteur de leurs rejetons (Slatyer et coll., 2012). Les mécanismes qui alimenteraient ce processus sont soit un biais de paternité envers de « bons » gènes (Tomkins et coll., 2010), ou de la compatibilité génétique entre les partenaires associée à l'évitement de consanguinité ou l'augmentation de l'hétérozygotie (Kempenaers, 2007).
Polyandrie et sélection sexuelle précopulatoire
On peut considérer que la sélection sexuelle précopulatoire est une conséquence du choix des femelles et de la compétition pour l'accès aux partenaires. Dans ces deux cas, le succès d'accouplement devient la monnaie d'échange de la sélection sexuelle (Jones, 2009). Il importe donc d'en détailler sa définition.
On peut décomposer le succès d'accouplement en trois différentes composantes (1) le nombre d'accouplements, ce qui inclut les accouplements multiples avec le même partenaire (2) le nombre de partenaires d'accouplement, ce qui exclut les accouplements multiples avec le même partenaire et (3) le nombre de partenaires génétiques, partenaires avec lesquels un jeune a été produit. Ces trois
composantes peuvent être très différentes dans un système d'accouplement hautement polyandre. Par exemple, une femelle peut s'accoupler avec 12 mâles différents, à deux reprises avec chaque et fertiliser la totalité (e.g. 6) de ses oeufs avec un seul de ces partenaires. Les trois composantes de succès d'accouplement mentionnés ci-haut seraient bien différents, soit 24 accouplements, 12 partenaires d'accouplement et 1 partenaire génétique. Le succès reproducteur, le nombre de jeunes produit, serait lui de 6. Donc, tout dépendant de la composante utilisée, les estimés de succès d'accouplement peuvent être très différents. Aussi, une partie de la variation du succès reproducteur d'un individu peut être causée par des facteurs autres que la compétition pour l'accès aux partenaires (Jones, 2009). Il est donc risqué d'utiliser des variables comportementales comme un substitut au succès reproducteur dans un système polyandre (Vermette & Fairbairn, 2002 ; Thompson et al., 2011) puisque des mécanismes postcopulatoire comme le choix cryptique des femelles et la compétition spermatique peuvent être actifs. Ces mécanismes font en sorte que plusieurs copulations peuvent ne pas mener à la production de jeunes et ainsi affaiblir considérablement la force de la relation entre le succès d'accouplement et le succès reproducteur.
De plus, dans un système d'accouplement polyandre, le succès reproducteur d'un mâle n'est plus directement lié au succès reproducteur de ses partenaires puisque plusieurs pères peuvent se partager la progéniture d'une même femelle (Parker & Birkhead, 2013). Cela peut avoir des implications importantes sur les mesures de sélection sexuelle précopulatoires, comme celle du gradient de Bateman, défini comme étant la pente de la régression des moindres carrés du taux d'accouplement (succès d'accouplement) sur le succès reproducteur (Arnold & Duvall, 1994; Jones, 2009). La polyandrie peut avoir comme effet de diminuer la force du gradient de Bateman mâle puisqu'elle diminue la valeur de chaque accouplement, et ce pour trois principales raisons : (1) le coût de production du sperme est non négligeable et augmente avec la compétition spermatique (Parker & Pizzari, 2010), qui elle augmente avec le degré de polyandrie, (2) le risque de perdre une fertilisation en quittant la femelle pour chercher d'autre partenaires augmente avec le degré de promiscuité des femelles (e.g. le mâle ne garde pas) et (3) les gains associés à chaque accouplement peuvent être partagés entre tous les pères d'une couvée, et plus le degré de polyandrie est élevé, plus le risque que ces gains soient moins importants est élevé (Parker & Birkhead, 2013).
La polyandrie fait en sorte que la sélection sexuelle peut se prolonger après la copulation (Parker, 1970; Birkhead & Pizzari, 2002). La sélection sexuelle postcopulatoire se manifeste principalement de manière intrasexuelle via la compétition spermatique et de manière intersexuelle via le choix cryptique des femelles.
Compétition spermatique
La compétition spermatique est le mécanisme postcopulatoire pour lequel nous avons le plus d'évidences (Parker & Pizzari, 2010). Elle peut être définie comme étant de la compétition entre les éjaculats de différents mâles pour la fertilisation d'un groupe d'oeufs donné (Parker, 1970). Son origine résiderait dans l'évolution du sexe même (Parker et coll., 1972). Si à l'origine, les gamètes montraient une distribution normale de taille, la sélection aurait été disruptive, favorisant soit les petites ou les grandes gamètes et la fusion de types différents. Les petites gamètes mobiles, qui pouvaient être produites en grand nombre, ont eu un avantage compétitif à chercher et à fertiliser les plus grosses gamètes immobiles qui elles, contenaient des réserves d'énergie facilitant leur survie (Parker et coll., 1972). On a défini les individus produisant les petites gamètes comme étant des mâles et les individus produisant les plus grosses gamètes comme étant des femelles. La compétition spermatique aurait donc joué un rôle fondamental dans l'évolution de l'anisogamie et des sexes, et elle aurait persisté, tant dans les espèces à fertilisation interne qu'externe, et serait pratiquement omniprésente chez les animaux (Birkhead & Møller, 1998). L'équivalent chez les plantes, la compétition pollinique, serait aussi répandue (Birkhead & Møller, 1998).
La compétition spermatique peut être offensive et viser à combattre les différents éjaculats déjà présents dans la femelle inséminée, ou défensive et viser à empêcher la femelle d'être inséminée par d'autres mâles. Cette dualité est très bien documentée chez des espèces de Drosophila (Chen et coll., 1988; Chapman et coll., 1995; Prout & Clark, 2000). Le liquide séminal des mâles est composé de substances qui comprennent entre autre des prohormones, des peptides et des enzymes. Certaines de ces substances ont pour fonction de désactiver les autres spermatozoïdes présents dans la femelle, et agissent aussi comme un anaphrodisiaque pour décourager la femelle de s'accoupler avec d'autres mâles.
Une des prédiction de la théorie de la compétition spermatique est que, dans un environnement où il y une forte compétition entre les spermatozoïdes, il serait avantageux de produire des éjaculats qui en
contiennent beaucoup (Parker, 1970). En effet, les meilleures évidences que nous avons d'évolution en réponse à de la sélection sexuelle imposée par de la compétition spermatique concernent le nombre brut de spermatozoïdes (Martin et coll., 1974; Pizzari et coll., 2008; Parker & Pizzari, 2010). En plus de sélectionner pour le nombre de spermatozoïdes, la compétition spermatique sélectionne, entre autre, pour : la taille des spermatozoïdes, qui semble être directement corrélée entre elles au sein de certains taxons (Briskie et coll., 1997; LaMunyon & Samuel, 1999) ; la qualité des spermatozoïdes (proportion de spermatozoïdes vivants), qui semble être meilleure chez des espèces polyandres comparativement à des espèces monoandres (Hunter & Birkhead, 2002) ; l'efficacité de fertilisation, via la mobilité des spermatozoïdes (Birkhead et coll., 1999) ; les comportements de garde copulatoire (Parker, 1974; Alcock, 1994; Arnqvist, 1997) ; et la synchronisation de l'insémination avec la ponte (Huck et coll., 1989).
Quatre principaux facteurs affectent les mécanismes par lesquelles la compétition spermatique agit : (1) l'espace disponible pour la compétition des éjaculats, (2) les inégalités entre les éjaculats dans la probabilité de fertilisation, (3) le degré de mélange entre les éjaculats et (4) les manipulations physiques des éjaculats par les mâles et les femelles (Parker & Pizzari, 2010). Ces mécanismes peuvent être définis selon un gradient illustrant les chances de fertilisation, allant de la loterie juste, dans laquelle les billets (spermatozoïdes) ont des chances égales de fertilisation, à un remplacement total, dans lequel les mâles peuvent physiquement enlever des éjaculats emmagasinés dans la femelle et les remplacer par le leur. Voyons deux exemples simples pour illustrer ces deux mécanismes de compétition spermatique (Parker & Pizzari, 2010). Si l'espace d'emmagasinement des éjaculats n'est pas limité (comme chez des espèces à fertilisation externe ou des espèces avec de grands compartiments pour emmagasiner le sperme), alors le mécanisme le plus simple qui peut se mettre en place est la loterie juste, dans laquelle tous les spermatozoïdes ont la même probabilité de fertilisation. Le succès de fertilisation d'un éjaculat est alors proportionnel au nombre de spermatozoïdes présents dans l'éjaculat, divisé par le nombre d'éjaculats présents dans la femelle (Martin et coll., 1974). À l'opposé, si l'espace d'emmagasinement des éjaculats est limité à un éjaculat, alors le mécanisme le plus simple qui peut se mettre en place est le remplacement total, et le dernier mâle à inséminer la femelle fertilisera la totalité des œufs. La réalité de plusieurs systèmes d'accouplement se situe très probablement entre ces deux extrêmes (Parker & Pizzari, 2010).
Le choix cryptique des femelles peut-être défini comme étant la capacité, pour une femelle, de discriminer et d'utiliser de façon différentielle les spermatozoïdes de différents mâles conspécifiques (Birkhead, 1998). Ce mécanisme postcopulatoire est dit cryptique puisqu'il se passe à l'intérieur du corps de la femelle et ne peut être observé directement (Thornhill, 1983). Par exemple, un avortement différentiel des embryons peut être considéré comme étant un choix cryptique postfertilisation (Hull, 1964; Willson, 1983) alors qu'un choix cryptique prefertilisation ne peut être démontré que si la compétition spermatique est contrôlée (Birkhead, 1998). Néanmoins, plus d'une vingtaine de différentes manifestations de choix cryptiques préfertilisation ont été rapportées par Eberhard (1996). Les mécanismes sous-jacents à ces manifestations ne sont en général pas bien compris, le plus intuitif et celui pour lequel les meilleures évidences existent étant le déversement spermatique, mécanisme par lequel la femelle choisit de jeter du sperme de mâles de moindre qualité en faveur de mâles choisis (Pizzari & Birkhead, 2000; Wagner et coll., 2004).
Gerris spp.
La famille des Gerridae (Heteroptera : Gerridae) comporte plus de 1500 espèces dont la plupart sont présentes en eau douce, mais dont plusieurs lignées ont colonisé des habitats marins (Spence & Andersen, 1994). Ce sont des insectes semi-aquatiques, charognards et prédateurs, qui se nourrissent principalement d'insectes trouvés morts ou retenus sur des débris flottants ou à la surface de l'eau. En général, les plus grosses espèces ont la capacité de vivre dans des environnements lontiques comme des ruisseaux et des rivières, alors que les plus petites espèces vont souvent être retrouvées dans des habitats lentiques comme des étangs. On peut les retrouver en densité remarquablement élevée, allant jusqu'à 176 individus /m2 (Spence, 1980).
La phénologie des patineurs est très variable selon les espèces et l'habitat. Certaines espèces sont strictement univoltines, c'est à dire qu'il n'y a qu'une génération par année, alors que d'autres sont bivoltines ou même multivoltines (Vepsäläinen, 1978). Chez les espèces univoltines, les adultes passent l'hiver en diapause, se reproduisent au printemps et meurent pendant l'été. La génération produite au printemps ne se reproduit pas la première année, et doit entrer en diapause avant de pouvoir se reproduire le printemps suivant. Chez les espèces bivoltines, les adultes passent aussi l'hiver en diapause, mais la génération produite au printemps se reproduit directement sans diapauser, et produit une deuxième génération d'été qui elle entrera en diapause et passera l'hiver. Il existe encore de la confusion en ce qui a
trait aux mécanismes qui gèrent la diapause et le nombre de générations par cycle de vie chez les patineurs (Spence, 1989). Cependant, la stabilité de l'habitat, la latitude, la densité d'individus et la température sont des facteurs connus qui jouent un rôle dans la détermination du voltinisme chez plusieurs espèces (Spence & Scudder, 1980; Kaitala, 1987; Spence, 1989; Harada & Spence, 2000; Harada et coll., 2003). Aussi, la croissance de la photopériode juste avant le solstice d'été semble jouer un rôle important dans la détermination du statut reproducteur des adultes (Vepsalainen, 1974; Spence, 1989).
Le développement des adultes de plusieurs espèces passe par 5 stades larvaires et le temps de développement de chaque stade est grandement influencé par la température (Spence et coll., 1980). Le temps de développement total, de l'oeuf à l'adulte, varie de 24 jours à 26oC pour Gerris pingreensis à 87
jours à 15oC pour G. comatus (Spence et coll., 1980). En général, environ 1/3 des œufs produits se
rendront au stade adulte, avec une grande variabilité selon l'espèce et le statut reproducteur (Spence, 1989).
Comportement sexuel
Le système d'accouplement des Gerridae est très bien documenté et plusieurs espèces servent de modèle dans l'étude du conflit sexuel (e.g. Arnqvist, 1989, 1992; Arnqvist & Rowe, 1995). D'ailleurs, ce groupe d'insectes fournit une des seules évidences directes d'une coévolution sexuellement antagoniste dans des populations naturelles (Arnqvist & Rowe, 2002b; Rowe & Arnqvist, 2002; Gagnon & Turgeon, 2011; Perry & Rowe, 2012).
Pendant la période de reproduction, les mâles patineurs sont constamment à la recherche de partenaires. Ils poursuivent les femelles dans des courses frénétiques et tentent de les saisir. La plupart du temps, les femelles réussissent à fuir les mâles et aucun contact n'a lieu (Rowe, 1992; Rowe et coll., 1994). Si un mâle réussit à saisir une femelle, une impressionnante lutte a lieu où la femelle tente de déloger le mâle en effectuant des sauts périlleux (Arnqvist, 1989). La plupart du temps, la femelle réussit à déloger le mâle (80-85%) et la copulation n'a pas lieu (Arnqvist, 1989; Rowe, 1992). Dans les cas où la copulation a lieu, toute activité de lutte cesse et le mâle insère son aedagus pour une période variant, en moyenne, d'une dizaine de minutes chez G. buenoi (Rowe, 1992) à quelques heures chez Aquarius remigis (Rubenstein,
1989; Campbell & Fairbairn, 2001). Une fois la copulation terminée, le mâle reste passivement sur la femelle pour une période plus ou moins longue, dans un comportement associé à de la garde postcopulatoire (Rowe, 1992; Rowe et coll., 1994). C'est la femelle qui initie une lutte postcopulatoire, généralement très courte, pour mettre fin à l'accouplement (Rowe, 1992).
On estime qu'en général, le taux d'accouplement (TA) chez les patineurs est beaucoup plus élevé que ce que les femelles ont besoin pour regarnir leur réserve de sperme. En effet, les femelles peuvent emmagasiner et utiliser efficacement le sperme de plusieurs mâles pendant deux à trois semaines (Arnqvist, 1988, 1989; Danielsson & Askenmo, 1999). En théorie, elles n'auraient besoin que de quelques accouplements par mois pour subvenir à leurs besoins en sperme. Les estimés de taux d'accouplements nous proviennent principalement d'expériences en laboratoire, réalisées à différentes densités. À une densité de 24 ind/m2, Rowe (1992) a obtenu un TA variant de 0.1 à 1 accouplement/ind/h chez G.buenoi. À
une densité de 80 ind/m2, Arnqvist & Rowe (1995) ont obtenus des TA de 0.1 accouplement/ind/h chez G.
incognitus. À une densité de 6 ind/m2, Vermette & fairbairn (2002) ont obtenus des TA de 0.009
accouplement/ind/h chez A. remigis. À une densité de 4.5 ind/m2, Sih et coll. (1990) ont obtenus un TA de
0.05 accouplement/ind/h chez A. remigis. Un des rares estimés en nature nous provient de Rubenstein (1984), qui a documenté des TA variant de 0.1 à 0.4 accouplement/ind/jour chez A. remigis, densité inconnue. En considérant que les patineurs se reproduisent surtout en plein jour (e.g. période de 12h), ces taux varient donc entre 0.1 accouplements/ind/jour à 12 accouplements/ind/jour, ce qui, dans certains cas, semble de beaucoup supérieur à ce que les femelles ont besoin pour regarnir leur réserve en sperme.
Processus postcopulatoires
La morphologie de l'appareil génital des femelles patineurs, le fait qu'elles soient polyandres et qu'elles puissent entreposer le sperme pendant plusieurs semaines (Arnqvist, 1997) créent un contexte favorable à la manifestation de processus postcopulatoires. En effet, la spermathèque des femelles étant longue et étroite, les éjaculats résultant des accouplements seraient entreposés de façon successive (Walker, 1980), rendant possible la mise en place de mécanismes comme la compétition spermatique ou le choix cryptique des femelles.
Comme vu précédemment, le nombre brut de spermatozoïdes peut être une réponse évolutive à la compétition spermatique. Chez les patineurs, la quantité de spermatozoïdes délivrée durant la copulation influence positivement le succès de fertilisation chez G. lateralis (Arnqvist & Danielsson, 1999). Aussi les comportements de garde copulatoire observés chez plusieurs espèces de patineurs sont interprétés comme étant une adaptation mâle à la compétition spermatique (Wilcox, 1984 ; Arnqvist, 1988 ; Rowe et al., 1994). Les mâles resteraient donc sur le dos des femelles après la copulation pour empêcher les autres mâles de venir s'accoupler. Les mâles augmenteraient ainsi les chances que ce soit leur sperme qui fécondera les œufs. D'ailleurs, le dernier mâle à avoir copulé aurait préséance et fertiliserait la majorité des œufs via un mécanisme de délogement spermatique (Arnqvist, 1988 ; Rubenstein, 1989). Cependant, le degré de préséance semble être très variable entre individus et selon les espèces. De plus, l'intervalle entre les copulations (e.g. 10 min vs 24 h) semble avoir de l'importance, allant même jusqu'à favoriser le premier mâle plutôt que le second dans le cas d'un intervalle long (Danielsson & Askenmo, 1999).
Beaucoup moins d'attention a été accordée au choix cryptique des femelles en tant que processus postcopulatoire possible chez les patineurs. Cependant, des observations comportementales font mention de déversement spermatique de la part des femelles juste après la copulation (Arnqvist & Danielsson, 1999 ; Observations personnelles non publiées). Aussi, une distribution bimodale des résultats de préséance spermatique (Arnqvist & Danielsson, 1999) suggère que ce comportement pourrait être responsable d'une part importante du succès de fertilisation des mâles.
Puisque ces processus postcopulatoires peuvent générer des différences entre les différentes composantes du succès d'accouplement, il devient nécessaire de distinguer ces composantes pour préciser où et comment la sélection agit (Pélissié et al., 2012). Ronkainen et al. (2005) ont documenté une des premières études chez les patineurs qui distingue le nombre d'accouplements (accouplements multiples) du nombre de partenaires d'accouplements (polyandrie). Cette distinction leur a permis de montrer que des résultats bien différents peuvent être obtenus selon la composante de succès d'accouplement utilisée. Aussi, comme nous le verrons dans la prochaine section, des coûts à s'accoupler existent pour les femelles, et ces coûts ne peuvent être révélés qu'en discociant les accouplements multiples de la polyandrie.
Les évidences de conflit sexuel sur le taux d'accouplement chez les patineurs sont comportementales et morphologiques. Pour le comportement, comme nous l'avons vu, les femelles et les mâles semblent clairement avoir des préférences différentes en ce qui concerne la décision de s'accoupler. On interprète ces comportements comme étant une évidence de conflit sexuel sur le taux d'accouplement. Le conflit existe chez les patineurs parce que les accouplements sont plus coûteux pour les femelles : coûts énergétiques à porter le mâle (Watson et coll., 1998) et danger de prédation plus élevé pour la femelle pendant la copulation (Arnqvist, 1989; Fairbairn, 1993). Les femelles résistent pour éviter ces coûts.
Cependant, des coûts à résister existent aussi (Watson et coll., 1998) et si le harcèlement des mâles devient trop important, les femelles résistent moins et s'accouplent plus souvent pour éviter les coûts reliés à la résistance (Rowe, 1992; Eldakar et coll., 2009). Les femelles obtiennent alors des bénéfices directs à s'accoupler souvent, sous forme de protection contre le harcèlement (Rowe et coll., 1994; Arnqvist & Rowe, 2005). Ce comportement a pour effet d'augmenter le taux d'accouplement dans les environnements où le harcèlement des mâles est élevé. Notons que le terme employé est polyandrie de commodité, mais que ce comportement concerne plus spécifiquement les accouplements multiples plutôt que la polyandrie en tant que tel.
La morphologie des patineurs a aussi été largement étudiée et des traits mâles et femelles ont été identifiés comme étant sexuellement antagonistes. Chez les mâles, des traits comme un abdomen aplati, un génitalia plus long et les dimensions de leurs pattes avant leur permettent d'assurer une meilleure emprise sur la femelle, les aidant à éviter d'être délogés lors de la lutte précopulatoire (Arnqvist & Rowe, 2002b). Chez les femelles, des épines connexivales (excroissances épineuses de l'exosquelette) orientées vers le haut et les dimensions de leurs pattes avant les aident à déloger le mâle (Arnqvist & Rowe, 2002b). Aussi, la taille des individus pourrait influencer le résultat des luttes. On peut voir ces traits comme étant de l'armement, les individus les mieux armés étant ceux qui réussissent le mieux à résister ou persister (Arnqvist & Rowe, 1995; Sih et coll., 2002). L'étude par Arnqvist & Rowe (2002b) montre une corrélation entre les niveaux d'armement des sexes, parmis plusieurs espèces de Gerridae. Cela indique que ces traits évoluent conjointement entre les mâles et les femelles : une espèce avec des femelles armées aura des mâles armés et vice-versa, et une espèce avec des femelles moins armées aura des mâles moins armés. La même observation a été fait entre populations par Gagnon & Turgeon (2011), les populations avec les femelles les plus armées ayant des mâles plus armés.
Le résultat de cet armement sur les interactions sexuelles, c'est à dire l'efficacité à obtenir des accouplements pour les mâles et l'efficacité à rejeter les accouplements pour les femelles, peut être diffile à détecter car dès qu'un sexe augmente son armement, l'autre l'augmente aussi (Arnqvist & Rowe, 2002a). Cependant, un sexe peut temporairement développer plus d'armement relativement à l'autre sexe, exposant le résultat antagoniste des interactions entre les sexes. D'ailleurs, Arnqvist & Rowe (2002a) ont montré que chez des espèces avec un degré d'armement inégal entre les sexes, les femelles les mieux armées réussissent à déloger les mâles plus rapidement et à éviter des copulations superflues. Aussi, Gagnon & Turgeon (2011) ont montré des liens entre l'armement des mâles et le comportement sexuel, ainsi qu'entre l'armement relatif des sexes et le comportement sexuel. Ces deux études sont des évidences empiriques directes qu'il y a une coévolution antagoniste entre les sexes et que cette coévolution a des conséquences sur les interactions sexuelles chez les Gerridae.
Malgré les efforts de recherche importants consacrés à l'étude du conflit sexuel en général et particulièrement chez les patineurs, notre compréhension globale en demeure incomplète. Tout d'abord, le conflit sexuel sur le taux d'accouplement implique que les deux sexes puissent s'accoupler librement et à plusieurs reprises au cours de leur vie reproductive. Plusieurs études, et ce pour des raisons souvent méthodologiques et/ou pratiques, ne permettaient pas des interactions libres et étaient conduites sur une courte portion de la vie reproductive des individus (e.g. Arnqvist, 1992; Rowe, 1992; Arnqvist & Rowe, 1995; Vermette & Fairbairn, 2002). Aussi, pour que le conflit sexuel sur le taux d'accouplement ait une conséquence évolutive, le taux d'accouplement doit avoir une conséquence positive sur le succès reproducteur à vie des mâles et négative sur celui des femelles (Rowe & Day, 2006). Cependant, beaucoup d'études utilisent le taux d'accouplement comme estimé du succès reproducteur (e.g. Arnqvist & Rowe, 1995; Sih et coll., 2002 ; Eldakar et coll., 2009), éliminant par le fait même la possiblité de mesurer des interactions entre ces deux composantes. De plus, plusieurs études reconnaissent que le taux d'accouplement n'est pas un bon estimé du succès reproducteur chez ces insectes (Danielsson, 2001 ; Vermette & Fairbairn, 2002) puisque certains accouplements peuvent ne pas mener à la fertilisation d'un œuf.
Objectifs
Le but de cette étude était donc d'investiguer le système d'accouplement de G. buenoi en organisant des sessions d'accouplements sur toute la vie reproductive des individus, dans un contexte où les interactions libres entre les sexes étaient possibles. Nous voulions contraster les différentes composantes du succès d'accouplement en utilisant des observations comportementales et des données génétiques. Plus spécifiquement, nous voulions tester l'hypothèse du conflit sexuel sur le taux d'accouplement et sonder la possibilité que des mécanismes postcopulatoire puissent influencer les manifestations du conflit.
Chapitre 1 : Active sexual conflict and
convenience polyandry in a polygynandrous
species : the combined effects of pre- and post-
copulatory processes on lifetime reproductive
success of Gerris buenoi.
Abstract
In polygyandrous animals, postcopulatory processes are likely to interfere with precopulatory sexual selection. In water striders, sexual conflict over mating rate and postcopulatory processes are documented but their combined effect on reproductive success has seldom been investigated. Here, we combine genetic parentage analyses and behavioural observations conducted in a competitive reproductive environment to investigate how pre- and post- copulatory processes influence reproductive success in Gerris buenoi. Our results indicate that precopulatory struggles had the expected antagonistic effects : efficiently gaining copulations was beneficial for males while efficiently avoiding copulations was profitable for females. Also, high mating rates and the intermediate optimal resistance level of females supported the hypothesis of convenience polyandry and sexual conflict. In turn, many matings not resulting in the production of offspring were observed and both sexes benefited from using a large proportion of their mating partners as genetic mates. However, and contrary to formal predictions, copulatory mating rates did not affect neither the reproductive success of males positively nor that of females negatively. Thus, given the high mating rates observed and evidences for postcopulatory processes, sperm competition could easily counter the effect of mating rates, perhaps in interaction with cryptic female choice and/or fecundity selection. Our study presents a complex but realistic overview of sexual selection forces at work in a model organism for the study of sexual conflict, confirming that insights are gained from investigating all episodes in the reproduction cycle of polygynandrous animals.
Résumé
Chez les animaux polygynandres, les processus postcopulatoires interfèrent vraisemblablement avec la sélection sexuelle précopulatoire. Chez les patineurs, des processus postcopulatoires sont documentés et un conflit sexuel sur le taux d'accouplement est démontré. Cependant, leurs effets combinés sur le succès reproducteur ont rarement été investigués. Dans cette étude, nous combinons analyses de filiation génétique et observations comportementales réalisées dans un environnement compétitif pour évaluer l'effet des processus pré- et post- copulatoires sur le succès reproducteur de Gerris buenoi. Nos résultats indiquent que les combats précopulatoires ont eu l'effet antagoniste attendu : obtenir de manière efficace des copulations est favorable pour les mâles alors qu'éviter de manière efficace les copulations est favorable pour les femelles. Aussi, le taux d'accouplement élevé et un niveau de résistance optimal pour les femelles supportent l'hypothèse de la polyandrie de commodité et du conflit sexuel. De plus, les copulations n'ayant pas mené à la production de jeunes ont eu une influence négative sur le succès reproducteur des deux sexes, et tous deux ont eu avantage à produire des jeunes avec une grande proportion de leurs partenaires d'accouplement. Cependant, et contrairement aux prédictions, le taux d'accouplement n'a pas influencé positivement le succès reproducteur des mâles ni négativement celui des femelles. Étant donné le taux d'accouplement élevé observé et l'évidence de processus postcopulatoires, la compétition spermatique peut certainement contrer les effets des copulations sur le succès reproducteur, peut-être en association avec le choix cryptique des femelles et/ou la sélection via la fécondité. Notre étude présente donc un portrait complexe mais réaliste des forces de sélection sexuelle en jeu dans l'étude du conflit sexuel chez un organisme modèle. Elle confirme l'idée que des précisions peuvent être apportées sur les systèmes d'accouplement polygynandres en considérant tous les épisodes d'un cycle d'accouplement.
Introduction
Sexual Conflict (SC) can be broadly defined as the difference in evolutionary interests between individuals of two sexes (Parker et al., 1979; Parker, 2006; Rowe & Day, 2006). It arises when reproductive interactions between males and females affect their fitness in opposite ways. Sexual conflict mainly occurs over shared traits such as parental care (Trivers, 1972; Houston et al., 2005) and mating (Parker et al., 1979; Arnqvist & Nilsson, 2000), although other traits may be concerned (e.g. habitat use, Morris & MacEachern, 2010).
Sexual conflict over mating comprises two dimensions: a precopulatory conflict about the decision to mate or not, and a postcopulatory conflict about fertilization (Parker, 2006). When mating rates and fertilization patterns affect male and female fitness in opposite ways, these conflicts can be viewed as pre- and post- copulatory cases of sexual selection. Since Darwin and until the early 1970s, sexual selection was thought to be strictly precopulatory, as females were considered to be mainly monandrous and polyandry was seen as exceptional (Darwin, 1871; Birkhead & Møller, 1998; Birkhead & Pizzari, 2002). However, multiple matings with several partners seems to be the rule rather than the exception for females (Eberhard, 1996; Jennions & Petrie, 2000; Pizzari & , 2013). Polyandry first implies that mating success can also affect females, and precopulatory sexual selection in females is now well-documented (e.g. Clutton-Brock, 2007). Second, polyandry means that sexual selection can persist after copulation (Parker, 1970; Birkhead & Pizzari, 2002). Postcopulatory sexual selection has been demonstrated in many internally fertilizing species where females are polyandrous (Smith, 1984; Birkhead & Møller, 1992; Eberhard, 1996). It principally happens via male-male sperm competition (Arnqvist et al., 2000; Jennions & Petrie, 2000; Griffith et al., 2002; Kelly & Jennions, 2011) and female cryptic choice (Eberhard, 1996). Pre- and post- copulatory sexual selection can also interact antagonistically or in synergy (Kvarnemo & Simmons, 2013) and there is a growing consensus that all episodes of reproduction must be examined and quantified to understand sexual selection (Pélissié et al., 2012; Fritzsche & Arnqvist, 2013; Kvarnemo & Simmons, 2013).
Water striders (Gerridae) are prime examples of SC over mating rate (Arnqvist, 1992; Rowe et al., 1994; Arnqvist & Rowe, 1995, 2005; Rowe & Arnqvist, 2002). In these insects, sexually antagonistic coevolution has been shaping morphological and behavioural traits to favor a low mating rate in females and a high mating rate in males (Fairbairn & Preziosi, 1996; Arnqvist & Rowe, 2002b; Sih et al., 2002). The armament levels of the sexes are correlated traits across species (Arnqvist & Rowe, 2002b; Rowe & Arnqvist, 2002)
and populations (Gagnon & Turgeon, 2011; Perry & Rowe, 2012), indicating that SC has been and is still active in natural populations.
The different interests of each sex in reproduction are readily apparent in the mating behaviour of these polygyandrous insects. Males actively and repeatedly harass females to gain matings, and females vigorously resist most mating attempts. This leads to frequent precopulatory struggles that seldom result in copulation (Rowe, 1992; Rowe et al., 1994).
This sexual conflict over mating arises from the asymmetric costs and benefits of mating for females and males. One the one hand, females resist to avoid unnecessary costly matings. Multiple matings are not necessary because they can store and utilize sperm for several weeks (Arnqvist, 1988, 1989; Danielsson & Askenmo, 1999), and there are energetic and predation costs associated with mating (Arnqvist, 1989; Fairbairn, 1993; Rowe et al., 1994; Watson et al., 1998). Resisting, however, also incurs costs (Rowe, 1994; Watson et al., 1998). When male harassment is high, the costs of resisting can exceed the cost of mating (Rowe, 1994), forcing females to mate multiply for reason of convenience (Rowe, 1992; Rowe et al., 1994; Arnqvist, 1997; Eldakar et al., 2009). Overall, the so-called ‘convenience polyandry’ promotes multiple mating in female water striders. Note that this well-established term, convenience polyandry, can lead to some confusion because it actually refers to multiple matings rather than to polyandry sensu stricto, i.e. the number of different partners (Slatyer et al., 2012). On the other hand, males persist at harassing females because their fitness is presumably limited by the number of available mates (Bateman, 1948; Arnqvist, 1992), and harassment help them gain matings (Sih et al., 2002). Although males may be exposed to predation risks while mating (Rowe, 1994), mating costs are generally assumed to be low because males only engage in scramble competition polygyny and transfer little if any seminal fluids (Arnqvist, 1997).
In parallel to SC over mating rate, postcopulatory processes have also been documented in water striders. The internal fertilization of polyandrous females equipped with a spermatheca certainly favors sperm competition among males (Parker, 1970; Birkhead & Pizzari, 2002). The postcopulatory mate guard performed by males of several species (Wilcox, 1984; Arnqvist, 1988; Rowe et al., 1994) is interpreted as a response to sperm competition (Parker, 1974; Alcock, 1994; Arnqvist, 1997; Thornhill & Alcock, 2001). Also, numerically-based sperm competition influences male fertilization success in Gerris lateralis (Arnqvist
& Danielsson, 1999). Sperm storage by multiply mated females could also lead to cryptic choice. The complex anatomy of female reproductive organ in gerrids is generally interpreted as favoring last male sperm precedence (Campbell & Fairbairn, 2001), but there are indications that females can adjust their reproductive rates to favor males with higher fertilization success (Arnqvist & Danielsson, 1999).
Despite all the work done, we still have an incomplete portrait of how pre- and post- copulatory processes affect male and female fitness in real water strider populations. First, SC over mating rate implies that males and females can mate freely and repeatedly over the course of their reproductive lifespan. However, many studies have been conducted with few individuals, over short periods of time, and they often focused on only one sex (e.g. Arnqvist, 1992; Rowe, 1992; Arnqvist & Rowe, 1995; Vermette & Fairbairn, 2002). The differences in the interests of each sex, and the potentially cumulative costs of matings in females, may not be fully expressed under these conditions. Second, SC refers to a potential for generating selective processes (Parker, 2006); it will have evolutionary consequences only if it affects fitness (Rowe & Day, 2006; Jones, 2009). However, reproductive success (or other direct estimates such as survival) is seldom estimated for water striders. Instead, mating rate is used as a surrogate for fitness (e.g. Arnqvist & Rowe, 1995; Ronkainen et al., 2005; Eldakar et al., 2009). Yet, several authors recognize that mating success is probably not a fair estimator of fitness in water striders (Danielsson, 2001; Vermette & Fairbairn, 2002) as in other groups (e.g. in damselfly : Thompson et al., 2011).
In this paper, we combined genetic parentage analyses and behavioural observations conducted in a competitive reproductive environment to investigate how pre- and post- copulatory processes influence reproductive success in G. buenoi. We evaluate how different mating success components, along with key behaviours associated with sexual conflict, covary with lifetime RS of males and females. First, we test the hypothesis of SC over mating rate using the formal predictions established by Wade and Shuster (2005): if there are sex differences in the interest in mating, then mating rate, expressed in term of the number of mating events, should covary positively with RS in males, and negatively in females. In addition, we predict that if females mate multiply for reason of convenience (convenience ‘polyandry’), an intermediate level of resistance should be optimal for fitness (Arnqvist & Nilsson, 2000). For males, we can predict that harassment will lead to high mating success, both in terms of number of events and number of partners, and result in high RS. Second, we investigate whether postcopulatory processes affect individual fitness. Postcopulatory processes sensu lato are expected to result in differences between mating and fertilizing
success as some copulation events and/or mating partners fail to lead to offspring production. We predict that high number of such ‘superfluous’ copulations should negatively affect fitness, and especially so in females given the higher cost of mating; likewise, mating partners less often parenting offspring should suffer lower fitness.
Materials and methods
We sampled overwintered G. buenoi adults in a pond near Quebec City (Base de Plein-air de Ste-Foy; 46.790N, 71.330W) on the 14th and 15th of April 2012, just after the pond thawed and before any mating
activity started. We kept sexes separated at 7 °C for 15 days. We confirmed that females were virgin by verifying that eggs laid were not fertilized. Meanwhile, males were kept sexually active with non-experimental females at a sex ratio of 2:1 (males:females). Insects were fed frozen crickets ad libitum during this period.
Mating sessions and behavioural observations
We formed three groups of individuals that were given the opportunity to mate freely over the course of 7 weeks. Each group comprised 12 males and 12 females. Those sample sizes were chosen to ensure a range of mating partners each week while keeping the number of potential parental pairs manageable for parentage analysis. Body length was measured and size distributions were made similar among groups. Insects were individually marked with two dots of enamel paint on the thorax. Each group was placed in a shallow basin (63 x 122 cm: 0.77 m2; water depth: 10cm), resulting in a density (31individuals/m2) that is
conducive to the expression of sexual conflict behaviours (Rowe et al. 1994). Basins were kept in a greenhouse under controlled temperature and a light cycle mimicking natural conditions. Small Styrofoam rafts (2 cm2, 4/basin) were offered as resting and egg laying sites. Insects were fed frozen crickets daily
(4/basin), and food was removed 2h30 prior to the beginning of each session to augment female resistance (Ortigosa & Rowe, 2002).
Mating sessions were designed in order to record all matings (copulation and guarding). Each mating session lasted 5 hours (11h-16h). An observer visited each basin every six minutes, and performed a 2-min
scan to record the mating state of each individual (copulating, guarding, alone) as well as the identity of the mating partner. Matings shorter than 10 minutes are rare in this species (Rowe, 1992), such that a 6-min interval between observations should result in very few matings being missed. Mating sessions occurred four days a week for 7 weeks (May 9th to June 24th, when individuals started to die). To avoid unobserved
sexual activity, basins were split in half by a floating wall at the end of each observation session so that sexes were kept apart.
In addition to the above scans, an additional observer performed continuous 1-hour observations to record the identity of individuals engaging in struggling. Each basin was scanned this way twice a week. Struggles and mating scans were performed on the same time schedule such that upon merging the two sets of observations, it was possible to distinguish pre- from post- copulatory struggles.
Genetic characterization and parentage analysis
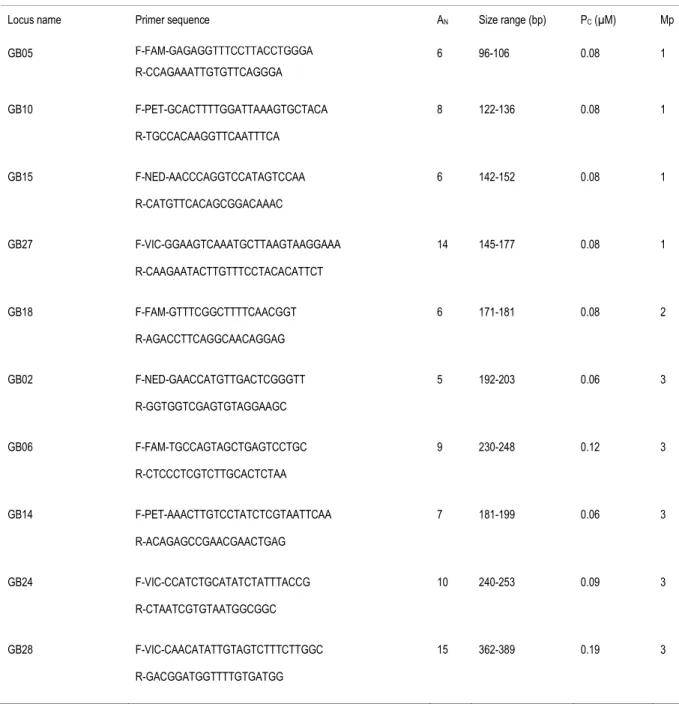
Eggs were collected daily and grouped by basin and week in small plastic containers. Nymphs were reared to the third instar and then preserved in 95% EtOH. All adults were similarly preserved when mating sessions ended. Unfortunately, one female and one male from the same group died early; they were excluded from all analyses. Total genomic DNA was extracted from adults and nymphs with a salt extraction protocol (Aljanabi & Martinez, 1997). Genotyping was based on 10 new microsatellite markers developed for this study by GenoScreen (Lille, France) via high throughput sequencing of an enriched clone library. We selected the 10 loci based on variability, clarity of signal and reproducibility (Table 1). Polymerase chain reactions (PCR) were carried out in three multiplex mixes using Qiagen Multiplex PCR Kit, and 0.06-0.19 M of each primer in a total volume of 6 L (Mix 1 and Mix 2) or 8 L (Mix 3) (Table 1). The thermocycler was programmed as follows: 15 min at 95°C for initial denaturation, 30 cycles at 94°C (30s), 57°C (90s), 72°C (60s), and a final extension step at 60°C (30 min). Equal amounts (1 L) of diluted PCR products (0.2X:0.5X:0.2X) were pooled and co-migrated on a genetic analyzer (3130XL from Applied Biosystem). Alleles were scored with an R script (R Development Core Team, 2008) based on seqinR package (Charif & Lobry, 2007) and double checked visually (R script in supplementary material). We estimated a genotyping error rate of 2.2% by genotyping 14% of the individuals twice (Bonin et al., 2004).
We used genetic parentage analysis to estimate the reproductive success (RS) of each adult. Nymphs were allocated to a parental pair using the maximum likelihood algorithm of the PAPA software (Duchesne et al., 2002), and the number of nymphs allocated to each individual provided an estimate of its RS. We chose to estimate weekly RS for two weeks early (weeks 2 and 3) and two weeks late (weeks 5 and 6) in the reproductive period; the sum over these four weeks provided an estimate of lifetime RS. Each week, 80-100 nymphs/group were genotyped. This followed from our evaluation that a minimum of 65 nymphs/week/group was necessary to correctly estimate Bateman gradients. For unknown reasons, there were not enough nymphs produced on week 4 in two of the groups. Overall we genotyped 73% (1171/1602) of all the collected nymphs (4 weeks sampled).
Variables estimated
We estimated three types of mating success for each individual. The copulatory mating success (cMS) is defined as the number of copulation events each individual participated in, including multiple matings with the same partner. Weekly and lifetime measures (sum over 4 weeks) were considered. The partner mating success (pMS) is the number of different mating partners each individual copulated with at least once. Based on results from parentage analysis, the genetic mating success (gMS) refers to the number of different partners with subsequent offspring production. When summed over the 4 weeks of observations, the variability of pMS and gMS were very low, as every male and female had mated with at least 9 of the 12 available partners. Variability within week was much greater, so that all analyses involving these two variables were conducted based on the average of weekly values.
We quantified the precopulatory struggling activity of each individual in two different ways: the raw number of precopulatory struggles (preStr) and the ratio of the total number of precopulatory struggles over the total number of copulations (preStr/cMS). These ratios are referred to as female resistance success (fResS) and male harassment success (mHarS). For females, a high ratio indicates a high efficiency at avoiding matings by struggling, while for males, a low ratio indicates a high efficiency at gaining matings by struggling. Although preStr and cMS were not registered with the same frequency, the preStr/cMS ratio provides an index of struggles leading to copulation that is comparable across individuals and groups.
Finally, we sought to quantify postcopulatory processes by identifying mating activities that failed to produce offspring. Copulation events with no offspring will be referred to as superfluous copulations (SupCop). For each individual, we compared the number of copulations performed with a mating partner with the number of offspring allocated to that partner. When no offspring was detected for a couple, all copulations were called superfluous. With a single offspring, all but one copulation were deemed
superfluous. Copulations producing two or more offspring were ignored since it was impossible to know how copulations were distributed across offspring. Superfluous copulations were summed over all mating partners. Following Pélissié et al. (2012), we also considered the proportion of behavioural partners that did sire offspring (gMS/pMS). Given that only a subset of nymphs were genotyped, SupCop and gMS/pMS admittedly provided rough estimates of the true number of superfluous copulations and partners. Nevertheless, these estimates are still comparable across individuals and groups.
Statistical analyses
All statistical analyses were performed on relative values (individual values divided by group mean, Jones, 2009) with the computer language R (R Development Core Team, 2008). We used the Bateman gradient (BG), defined as the least squared regression slope of RS on MS (Arnold & Duvall, 1994), as our main sexual selection measure. The three mating success measures (cMS, pMS, gMS) were used in calculations. BG differencesbetween the sexes were evaluated using a non- parametric randomization test (for details of procedure, see Gagnon et al., 2012).
To evaluate our main hypothesis about precopulatory SC, we tested whether the BG for cMS was positive for males and negative for females.The regressions were performed on a weekly basis as well as over lifetime totals (the four weeks). Relationships between other mating behavioural components (e.g. time spent copulating, length of copulations, and length of guards) and RS were also assessed. We only report on cMS, as all other variables yielded non- significant relationships with RS. Finally, to evaluate the impact of struggling activities on fitness, preStr, fResS, and mHarS were regressed on RS. The intermediate optimal resistance rate for females (preStr) hypothesis was tested by fitting and comparing linear and quadratic relationships.