HAL Id: dumas-02267939
https://dumas.ccsd.cnrs.fr/dumas-02267939
Submitted on 20 Aug 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Apport de la technologie du PRGF (ENDORET) dans
les alvéoles post-extractions
Jeanne Chicaud
To cite this version:
Jeanne Chicaud. Apport de la technologie du PRGF (ENDORET) dans les alvéoles post-extractions. Sciences du Vivant [q-bio]. 2019. �dumas-02267939�
HAL Id: dumas-02267939
https://dumas.ccsd.cnrs.fr/dumas-02267939
Submitted on 20 Aug 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Apport de la technologie du PRGF (ENDORET) dans
les alvéoles post-extractions
Jeanne Chicaud
To cite this version:
Jeanne Chicaud. Apport de la technologie du PRGF (ENDORET) dans les alvéoles post-extractions. Sciences du Vivant [q-bio]. 2019. �dumas-02267939�
U.F.R. D’ODONTOLOGIE
Année 2019
Thèse n°59
THESE POUR L’OBTENTION DU
DIPLOME D’ETAT de DOCTEUR EN CHIRURGIE
DENTAIRE
Présentée et soutenue publiquement
Par Mlle CHICAUD Jeanne, Louise
Née le 17/10/1993 à LIMOGES
Le 11/07/2019
Apport de la technologie du PRGF (ENDORET
â
) dans les
alvéoles post-extractions
Sous la direction de : M Johan SAMOT
Membres du Jury
Président M CATROS Sylvain Professeur des Universités Rapporteur M MASSON-RENAUGT Emmanuel Assistant Hospitalo-Universitaire Directeur M SAMOT Johan Maitre de Conférence des Universités Assesseur M D’INCAU Emmanuel Maitre de Conférence des Universités
AVANT-PROPOS
A notre Président de thèse
Monsieur le Docteur Sylvain Catros
Professeur des Universités- Praticien Hospitalier Directrice de l’UFR des Sciences Odontologiques Sous-section Chirurgie-Orale 58-02
Vous m’avez fait l’honneur d’accepter d’être le président de mon jury de thèse. Votre enseignement, ainsi que celui du service de chirurgie orale de Pellegrin m’ont permis d’évoluer dans cette discipline.
Veuillez trouver par ces quelques mots l’expression de mon profond respect.
A notre Directeur de thèse
Monsieur le Docteur Johan Samot
Maitre de conférences des Universités- Praticien Hospitalier Sous-Section Chirurgie Orale
Je vous remercie d’avoir accepté de diriger cette thèse. Votre gentillesse, votre pédagogie et votre savoir-faire suscitent l’admiration de beaucoup d’étudiants dont la mienne. Je vous remercie pour votre aide et votre spontanéité tout au long de la rédaction de ce travail.
Veuillez trouver dans cet ouvrage mes remerciements les plus sincères.
A notre rapporteur de thèse
Monsieur le Docteur Emmanuel Masson-Regnault Assistant Hospitalo-Universitaires
Sous-section Chirurgie Orale
Je vous remercie d’avoir accepté de siéger dans mon jury. Je me souviendrais de votre aide permanente à l’hôpital de Xavier Arnozan, de votre pédagogie, de votre savoir-faire et surtout de votre goût de transmettre vos connaissances.
A mon premier assesseur
Monsieur le Docteur Emmanuel D’Incau
Maitre de conférences des Universités- Praticien Hospitalier Sous-section de Prothèse Dentaire
Je vous remercie d’avoir accepté de siéger dans mon jury. Je vous remercie pour l’enseignement universitaire que vous nous avez donné et votre aide spontanée en clinique.
Veuillez trouver par ces quelques mots l’expression de mon profond respect.
A mes parents, vous avez fait de moi ce que je suis. Vous m’avez transmis votre savoir-faire, votre goût du travail, votre volonté, votre courage et votre détermination à toutes épreuves. Malgré les aléas de la vie, j’ai toujours trouvé en vous un soutien. J’espère vous rendre heureux chaque jour. Ces quelques mots sont le témoignage de la reconnaissance et de tout l’amour que j’ai pour vous.
A mes sœurs, Marie et Lucie, et mon frère Pierre, je vous remercie d’être ici dans un moment si important qu’aujourd’hui. Marie, malgré nos chamailleries, tu représentes tout pour moi ma sœur, ma vie, ma confidente, je ne te remercierais jamais assez pour ton soutien inconditionnel. Lucie, malgré nos huit années d’écart et ta grande taille, tu resteras mon bébé que j’aime de tout mon cœur. Pierre, malgré la distance qui nous sépare depuis plusieurs années, je suis toujours aussi contente de te retrouver et de voir ton joli sourire.
A mon oncle Bernard, la personne la plus généreuse que je connaisse et avec qui j’ai toujours plaisir de partager des moments. C’est vrai que depuis que tu habites à Contis, on n’a pas la chance de te voir aussi souvent et j’espère qu’à l’avenir ça sera différent. A mon oncle Michel, qui m’a fait confiance dès mon premier remplacement en cinquième année et qui a été toujours disponible pour m’aider. J’ai toujours plaisir à te retrouver chez nous sur la terrasse l’été ou au cabinet dentaire.
A ma tante Hélène et mon oncle Pascal, qui ont vécu avec moi pendant mes cinq mois de remplacements à la Souterraine. Quel bonheur de vous avoir à mes côtés. Vous m’avez accueilli comme des parents avec des bons repas le soir ou le week-end et merci beaucoup pour votre soutien.
A mes cousines Claire et Louise, que j’ai le plaisir de voir plus souvent depuis plusieurs années et avec qui j’ai eu la chance de partager des semaines au Moulleau l’été avec leur maman. Impossible de s’ennuyer lorsqu’on est six enfants dans une maison. Je suis heureuse de partager plus de moments avec vous ces derniers temps et le meilleur reste à venir.
A mes autres cousins et cousines que je vois moins mais que j’ai toujours plaisir à retrouver, Méryl, Niels, Lucas, Lois, Alix, Charlotte et Martin.
A ma marraine Sylvaine, qui a toujours été à l’écoute et d’une grande générosité mais que je ne vois que trop peu souvent. A mon parrain Xavier, qui a toujours su me montrer un intérêt à d’autres sports que la course à pied, la danse ou le tennis. Vous avez tous les deux toujours été pour moi un exemple de gentillesse et de dévouement.
A mon David, merci pour ton aide et ton soutien chaque jour.
A mon amie Blandine, avec qui je suis devenue inséparable depuis que l’on se connait. J’ai trouvé en toi une personne avec un cœur énorme et une grande générosité. Je n’oublierais jamais nos voyages toutes les deux et j’espère qu’il y en aura plein d’autres. Merci pour ton soutien inconditionnel.
A mon amie Anne-Sophie, avec qui j’ai sympathisé au milieu de mon cursus mais avec qui j’ai déjà partagé beaucoup de choses (voyages, visites, repas, soirées). Merci de me faire voyager dans tes villes d’internat (Dijon, Nancy). Prochaine destination Reims, n’est-ce pas ?
A mon amie Emilie, connue en dentaire, qui vient des Landes comme moi. Nos passions sportives ont fait de nous deux des acolytes de sport. Même si on s’est moins vu cette année, j’ai toujours la joie de partager des moments avec toi et on reste fixer sur notre prochain défi : le semi-marathon de Bordeaux, en octobre.
A toutes mes autres amies que j’ai connues en dentaire : Nathalie, Mathilde Baleste, Mathilde Mulquin, Lélia, Laetitia (on formait un bon binôme en quatrième année !), Johanna, Marthe, Laure, Alexandre, Alexis, Nicolas, Lucas, Diane.
A Laurent Chauveaux et Elodie, qui m’ont permis d’aller sur le site de la société BTI en Espagne à Vitoria, de rencontrer le Docteur Anitua et de trouver l’inspiration pour ce travail.
TABLE DES MATIERES Introduction 1. Bases fondamentales 1.1. Rappels biologiques 1.1.1. Anatomie et physiologie 1.1.1.1. La muqueuse buccale 1.1.1.2. L’os alvéolaire
1.1.2. Résorption osseuse post-extractionnelle 1.1.2.1. Mécanisme d’action
1.1.2.2. Facteurs influençant la résorption osseuse post-extractionnelle 1.1.2.3. Résorption au maxillaire et à la mandibule
1.2. Définitions
1.2.1. La régénération osseuse guidée
1.2.2. Classification des biomatériaux de régénération osseuse guidée 1.2.3. Historique 1.2.4. Le PRGF : définition 1.3. Protocole de préparation 1.3.1. Prélèvement de sang 1.3.2. Centrifugation 1.3.3. Fractionnement 1.3.4. Résultats 1.4. Applications du PRGF 1.4.1. En médecine 1.4.2. En odontologie 2. Matériels et méthodes 3. Résultats 4. Discussion 5. Conclusion 6. Bibliographie
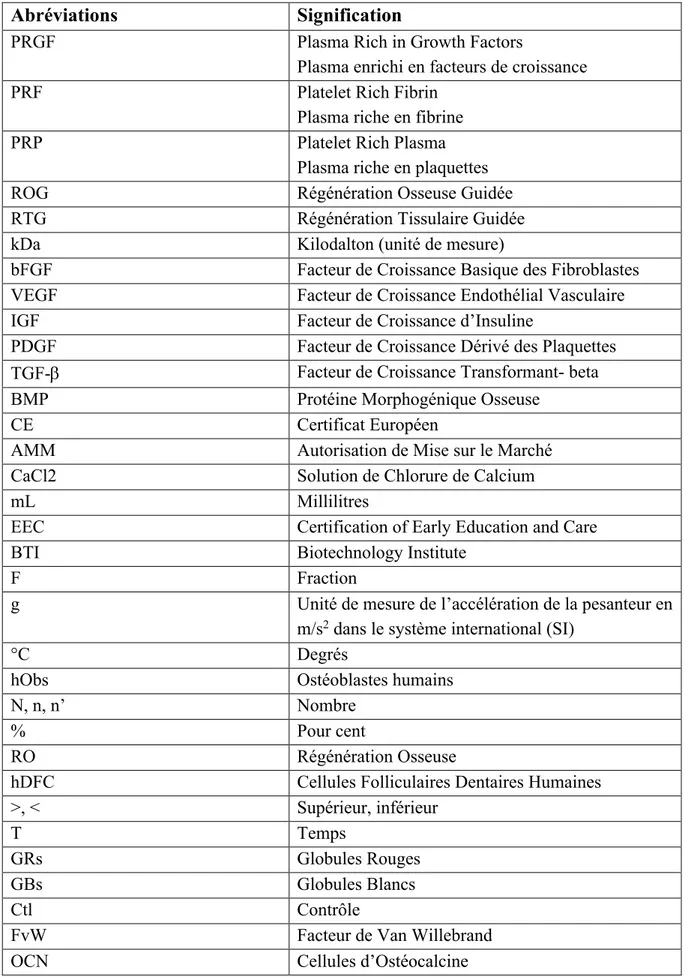
Tableau des abréviations
Abréviations Signification
PRGF Plasma Rich in Growth Factors
Plasma enrichi en facteurs de croissance PRF Platelet Rich Fibrin
Plasma riche en fibrine PRP Platelet Rich Plasma
Plasma riche en plaquettes ROG Régénération Osseuse Guidée RTG Régénération Tissulaire Guidée kDa Kilodalton (unité de mesure)
bFGF Facteur de Croissance Basique des Fibroblastes VEGF Facteur de Croissance Endothélial Vasculaire IGF Facteur de Croissance d’Insuline
PDGF Facteur de Croissance Dérivé des Plaquettes TGF-b Facteur de Croissance Transformant- beta BMP Protéine Morphogénique Osseuse
CE Certificat Européen
AMM Autorisation de Mise sur le Marché CaCl2 Solution de Chlorure de Calcium
mL Millilitres
EEC Certification of Early Education and Care BTI Biotechnology Institute
F Fraction
g Unité de mesure de l’accélération de la pesanteur en m/s2 dans le système international (SI)
°C Degrés
hObs Ostéoblastes humains
N, n, n’ Nombre
% Pour cent
RO Régénération Osseuse
hDFC Cellules Folliculaires Dentaires Humaines >, < Supérieur, inférieur
T Temps
GRs Globules Rouges
GBs Globules Blancs
Ctl Contrôle
FvW Facteur de Van Willebrand OCN Cellules d’Ostéocalcine
CD68 Cellules de « Cluster de Différenciation » FdC Facteurs de Croissance
EVA Echelle Visuelle Analogique
OA Ostéite Alvéolaire
Post-op Post-opératoire
CBCT Scanner Cone Beam
ttt Traitement
amox Amoxicilline
IL Interleukine
PPAR Récepteur Activé par les Proliférateurs de Peroxysomes
Introduction
Lors de sa pratique quotidienne, le chirurgien-dentiste met en place des traitements afin de répondre au mieux à la demande du patient. La réflexion générale peut aboutir à des avulsions dentaires à visée implantaire ou prothétique. Ces avulsions doivent être atraumatiques de sorte que le processus de coagulation et de cicatrisation se mettent en place successivement. Depuis de nombreuses années, des biomatériaux sont utilisés et placés dans les alvéoles après avulsions. Les substituts osseux et les membranes en font partie. Ces biomatériaux sont allogènes ou xénogènes ou synthétiques. Cela entraine un risque de rejet par l’organisme qui compromait les suites post-opératoires de la chirurgie.
Dès les années 1990, des médecins ont eu l’idée d’utiliser l’individu lui-même en lui prélevant du sang. Ils obtiennent ainsi, des concentrés plaquettaires autologues. En 1998, le Docteur Marx et son équipe ont mis au point une technique permettant d’obtenir du plasma riche en plaquettes, le PRP ou Platelet Rich Plasma (1,2). En 2001, le Docteur Choukroun et son équipe ont mis au point une technique permettant d’obtenir un concentré plaquettaire riche en fibrine : le Platelet Rich Fibrin ou PRF (3) . Puis, en 2004, le Dr Anitua et son équipe ont mis au point une technique permettant d’obtenir du plasma enrichi en facteurs de croissance. Il s’agit de la technologie PRGF (Plasma Rich in Growth Factor) commercialisée sous le nom ENDORETâ (4). Ces concentrés plaquettaires sont ensuite réintroduits chez le patient, dans le même but de cicatrisation optimale.
Les études récentes se concentrent sur la nouvelle technologie de PRGF. Tout d'abord, de multiples domaines de la médecine y ont eu recours, en dermatologie, ophtalmologie ou orthopédie. Puis, le PRGF a été utilisée en chirurgie orale. La question de l’intérêt de cette technique dans les alvéoles dentaires, après une ou plusieurs extractions, s’est donc posée. On a émis deux hypothèses : la mise en place du PRGF, après une extraction, dans les alvéoles serait une aide à la cicatrisation et à la régénération osseuse. De plus, elle réduirait les complications post-opératoires (comparativement à celles observées sans mise en place de PRGF).
L’objectif principal de cette thèse est de confirmer ou infirmer l’hypothèse selon laquelle le PRGF améliore la cicatrisation et la régénération osseuse.
L’objectif secondaire est de savoir si des diminutions de complications ont été rapportés, comparativement à une utilisation sans PRGF.
1. Bases fondamentales
1.1. Rappels anatomiques
L’alvéole dentaire est le tissu de soutien qui entoure la dent lorsque celle-ci est en place sur l’arcade dentaire. Elle est composée d’une muqueuse buccale, superficielle et d’os alvéolaire. L’os alvéolaire forme avec l’os basal le support osseux de la dent (5).
1.1.1. Anatomie et physiologie
1.1.1.1. La muqueuse buccale
La muqueuse buccale est composée d’un tissu épithélial stratifié et d’un tissu conjonctif sous-jacent. Entre les deux, se trouve la membrane basale (6).
Le tissu épithélial comporte des cellules qu’on appelle kératinocytes. Il joue le rôle de barrière vis-à-vis des dommages thermiques, chimiques et microbiologiques grâce à son activité de desquamation. Il régule la fonction et l’intégrité du tissu osseux sous-jacent.
Ces cellules épithéliales sont interconnectées par des jonctions gap, intercellulaires et des hémidesmosomes. Entre les cellules, la couche épithéliale comprend des protéoglycanes et des glycoprotéines (6).
Le tissu conjonctif comprend des fibres élastiques ce qui permet une élasticité entre le tissu conjonctif et le tissu osseux ou musculaire sous-jacent.
La membrane basale de la muqueuse buccale sépare l’épithélium du tissu conjonctif et est composée de collagène type IV, laminine, héparine protéoglycanes et cytokératines (7).
1.1.1.2. Les processus alvéolaires
Les processus alvéolaires sont la partie des maxillaires supérieur et inférieur qui contiennent et entourent les alvéoles dentaires. Le développement des processus alvéolaires commence avec la formation des pièces dentaires et prend sa forme définitive avec leur éruption(7).
De manière générale, l’os est un tissu dense à phases multiples. Il est constitué de cellules entourées d’une matrice de composants organiques (fibres de collagène, lipides, peptides, protéines, glycoprotéines, polysaccharides et citrates, glucides) et inorganiques (phosphates de calcium, sodium, magnésium, fluor).
L’os est un tissu conjonctif minéralisé dur et élastique, qui fournit un support et une protection. Il est responsable du maintien de l’homéostasie minérale et source de cellules souches
hématopoïétiques. L’os est remodelé de manière constante par alternance de résorption et formation de l’os et contrôlé par la régulation hormonale et les mécanismes mécaniques (7,8).
L’alvéole dentaire fournit un ancrage aux faisceaux de fibres du ligament parodontal (7).
Image 1 : Structure du processus alvéolaire et sa relation avec le tissu parodontal (9)
On distingue trois couches dans les processus alvéolaires (7,8):
- l’os cortical ou compact - l’os spongieux ou trabéculaire
Il est situé au niveau de la partie centrale de l’os alvéolaire sauf au niveau des dents antérieures où les os corticaux et alvéolaires fusionnent.
- l’os alvéolaire
C’est la partie la plus importante du processus alvéolaire comme support de la dent.
Il suit un remodelage permanent tant que la dent est sur l’arcade. Il disparait lors de la perte de la dent.
Les composants de l’os appartiennent à deux catégories : la matrice extracellulaire et le composant cellulaire.
La matrice extracellulaire comporte deux composants principaux qui forment 95% du poids sec de l’os : les fibres organiques de collagène et les cristaux inorganiques. La matrice est composée d’autres substances organiques connues en tant que protéines non collagéniques (ostéocalcine, la sialoprotéine osseuse, ostéopontine, ostéonectine) et sels inorganiques amorphes ou peu cristallins. Cette architecture de fibres de collagène est renforcée de cristaux inorganiques, rendant le tissu élastique et dur (8).
Les facteurs de croissance sont des peptides compris dans la matrice extracellulaire. Ils régulent la croissance, la fonction, la mobilité cellulaire en formant du nouveau tissu. Ils influent également sur la synthèse d’os nouveau et agissent sur une population de cellules de la moelle osseuse et de la surface de l’os.
Les composants cellulaires de l’os sont les ostéoblastes, les ostéoblastes et les ostéocytes. Ces cellules sont responsables de la production et de la résorption de l’os. Il y a également des cellules souches ostéogéniques qui maintiennent la population cellulaire par le biais de leur prolifération et différenciation (8).
1.1.2. Résorption osseuse post-extractionnelle
Après une ou plusieurs extractions, des mécanismes physiologiques se mettent en place afin de minimiser la perte tissulaire et osseuse. Toute extraction dentaire entraîne une
résorption osseuse, avec un processus de cicatrisation de la plaie alvéolaire de deuxième
intention (10–12).
Image 2: Mécanisme de cicatrisation alvéolaire après extraction en fonction du temps (9)
Ce processus de cicatrisation se divise en trois phases : l’inflammation, la prolifération et la
reconstruction tissulaire (13). Les étapes de la cicatrisation alvéolaire après extraction sont
bien connues chez l’Homme, depuis les travaux de EULER, MEYER, et SIMPSON (14).
L’inflammation a lieu aussitôt après l’extraction de la dent. Le sang envahit l’alvéole et coagule. On parle d’hémostase. L’hémostase se déroule en trois étapes : primaire, secondaire et tertiaire (13)
L’hémostase primaire se caractérise par une diminution du saignement, une redistribution du flux sanguin. Cette étape voit également l’agrégation des plaquettes (polynucléaires) et des fibroblastes qui forment un coagulum mou (13) .
L’hémostase secondaire correspond à l’activation du processus de coagulation. La cascade de coagulation est extrinsèque, sur la surface des cellules ou intrinsèque, sur la surface des plaquettes (15).
Les deux voies aboutissent à la formation du complexe de prothrombinase qui convertit la prothrombine en thrombine en présence de phospholipides de membrane. La thrombine génère une polymérisation du fibrinogène en fibrine et convertit le facteur XIII en XIIIa qui stabilise le réseau de fibrine. Le caillot est alors organisé en réseau.
L’hémostase tertiaire (fibrinolyse) correspond à la dissolution du coagulum. Les fibroblastes et les bourgeons capillaires apparaissent au début, dans la région du 1/3 apical de l’alvéole (15).
Ensuite, la prolifération correspond à l’augmentation considérable du nombre de fibroblastes au sein du caillot qui se rétracte. Le caillot devient un tissu de granulation. Au-dessus, l’épithélium gingival commence à proliférer. Des ostéoclastes commencent à résorber les crêtes alvéolaires, alors qu’au fond de l’alvéole apparaissent des ostéoblastes, et les premières couches de tissu ostéoïde. Le tissu de granulation des bords de l’alvéole se transforme en tissu conjonctif jeune. Les nombreux fibroblastes engendrent les fibres de collagène et les autres éléments de la matrice extracellulaire. La résorption des bords externes de l’alvéole se poursuit, tandis que les zones gingivales marginales s’éversent (16).
La reconstruction tissulaire a lieu, à partir de la troisième semaine de cicatrisation. Le reste du tissu de granulation se transforme en tissu conjonctif jeune. L’apparition de trabécules minéralisés se poursuit à partir du fond de l’alvéole, grâce à la prolifération des ostéoblastes, et aboutit à la formation d’un os immature puis mature. On parle d’os primaire. La fermeture épithéliale est effectuée 4 à 5 semaines après l’extraction, selon le diamètre de l’alvéole. Au bout de 15 semaines, l’alvéole est comblée par du tissu osseux en plein remaniement, mais la nouvelle crête osseuse n’atteint jamais le niveau denté. Radiographiquement, le tissu osseux néoformé n’est visible qu’au bout de plusieurs semaines (6 mois environ) (16).
Ce nouveau tissu osseux qui comble une partie de l’alvéole à la fin de la cicatrisation doit, comme tout tissu osseux, se remodeler. Le remodelage permettra d’obtenir un os cortical et un os trabéculaire identique à l’os entourant la lésion. Les facteurs locaux, essentiellement mécaniques, jouent un rôle prépondérant. Ainsi, la présence de dents naturelles antagonistes et/ou adjacentes, la prothèse fixée, amovible, ou le non appareillage sont autant de facteurs qui vont conditionner le remodelage osseux des sites d’extraction. La perte des dents entraîne, de toute façon, une résorption osseuse tridimensionnelle(16).
La résorption est rapide pendant les 4 premiers mois, puis le processus se ralentit mais se maintient toute la vie ; la physiologie de cette résorption a été décrite par ATWOOD (17), CARLSSON (18) et TALLGREN (19). Cette résorption est décrite comme étant chronique, progressive, irréversible, et cumulative.
Pour CRUM et ROONEY, la résorption au bout de 2 mois correspond à 50% de la résorption totale moyenne (20). Alors que pour CARLSSON et PERSSON, il faut 12 mois pour atteindre 50% de la résorption totale(16).
1.1.2.2. Facteurs influençant la résorption osseuse post-extractionnelle
L’importance de cette résorption osseuse dépend de facteurs locaux et de facteurs généraux :
- Pathologies générales : les troubles métaboliques, les troubles endocriniens (hormones jouant un rôle dans le métabolisme du calcium: hormones thyroïdiennes, parathyroïdiennes, surrénaliennes), l’ostéoporose, la carence vitaminique (A, C, D), les processus traumatiques, une fracture accidentelle d’une table osseuse alvéolaire va ralentir la cicatrisation et augmenter la résorption post-extractionnelle, la réalisation d’une alvéolectomie lors de l’avulsion d’une dent va également augmenter la résorption osseuse (20).
- Processus infectieux : les parodontopathies entraînant une lyse alvéolaire, la présence de granulomes ou de kystes (20,21).
- Intensité et fréquence des forces exercées : une intensité excessive ou faible entraine une ostéolyse. De même, une pression continue ou discontinue avec des intervalles de repos court entrainent une ostéolyse (21).
- Vascularisation une hypo-vascularisation ou une hyper-vascularisation du tissu osseux augmentent la résorption (21).
1.1.2.3. Résorption au maxillaire et à la mandibule
* Au maxillaire
La résorption de l’os maxillaire associe une résorption dans le sens vertical et dans le sens transversal, plus marquée en vestibulaire (résorption centripète). L’une des conséquences de la résorption maxillaire est la diminution du volume osseux disponible sous les cavités sinusiennes (22) .
* A la mandibule
La résorption a une direction opposée à celle observée au maxillaire : elle est plus rapide en lingual (résorption centrifuge). La résorption verticale de la mandibule rapproche le nerf alvéolaire du rebord crestal, ce qui limite la hauteur d’os disponible pour une implantation. La direction opposée de la résorption maxillaire et mandibulaire va dégrader la relation occlusale et compliquer la réhabilitation prothétique (22).
1.1.2.4. Classification du volume osseux disponible
Le volume osseux disponible est à étudier en hauteur, dans le sens mésio-distal et dans le sens vestibulo-lingual ou palatin.
* Dimension verticale
LEKHOLM et ZARB ont proposé en 1985, une classification de la résorption osseuse dans le sens vertical, en distinguant les 5 types suivants : A : persistance en grande partie de la crête alvéolaire, B : résorption modérée de la crête alvéolaire, C : résorption totale de la crête alvéolaire, D : résorption basale, Type E : résorption basale extrême (23).
Figure 1 : Classification de la résorption osseuse verticale (d’après LEKHOLM et ZARB) (23)
* Sens mésio-distal (longueur). Cette dimension correspond à la longueur de l’édentement, qui est lié au nombre de dents manquantes.
* Sens vestibulo-lingual ou palatin. La largeur de la crête osseuse résiduelle est susceptible de limiter les possibilités d’implantation du site. Elle correspond au nombre de parois osseuses résiduelles (1, 2, 3, ou 4).
1.2. Définitions
1.2.1. La régénération osseuse guidée
Le grand défi en chirurgie orale est d’obtenir des résultats stables et satisfaisants tant sur le plan esthétique que fonctionnel. Afin d’atteindre ce but, la création d’un volume osseux suffisant à visée prothétique et/ou implantaire est devenue une règle incontournable. L’objectif principal de l’odontologie moderne est donc la préservation et le maintien des tissus buccaux sains (24).
1.2.1.1. Principe de la ROG
Dans les années 1980, la technique de régénération osseuse guidée (ROG) a été introduite par Dahlin et al. Elle reprend les principes de la régénération tissulaire guidée (RTG) mis au point par Nyman en 1982 : utilisation d’une membrane qui joue un rôle de barrière physique permettant ainsi une colonisation sélective du caillot par les cellules du desmodonte (25). Ces barrières empêchent la colonisation du défaut osseux par les cellules conjonctives et épithéliales et permettent ainsi seulement aux cellules à pouvoir ostéogénique d’envahir l’espace cicatriciel. En effet, le cycle de renouvellement des cellules conjonctives et épithéliales est plus rapide que celui des ostéoblastes (6 à 12 jours contre 4 à 6 mois). Lors de la cicatrisation, la nature du tissu correspond au tissu qui a pu envahir la zone en premier (25).
On peut distinguer la « R.O.G. vraie », inspirée de la régénération tissulaire parodontale, d’abord utilisée par Nyman puis Buser et al. en 1990 (caillot sanguin et membrane rigide) et la
régénération osseuse guidée associée à un comblement du défaut osseux (autogreffe,
allogreffe, xénogreffe... selon la nature du matériau utilisé) (26–28). Le matériau de comblement soutient la membrane (« effet de tente »), si bien qu’il n’est plus nécessaire d’utiliser une membrane non résorbable rigide, avec le risque de complications qu’elle comporte ; les membranes résorbables donnent désormais des résultats équivalents (24).
Le principe général de la greffe osseuse repose sur la notion d’un support capable de rétablir un volume osseux. Ce volume est le siège d’une colonisation par les éléments ostéogéniques de l’hôte receveur (éléments vasculaires et cellules osseuses) aboutissant au remodelage osseux complet du greffon ; c’est-à-dire à sa résorption et son remplacement concomitant par l’os du receveur, correspondant à l’action conjuguée des propriétés inductrices et ostéo-conductrices. Le remodelage osseux au niveau d’une greffe est réalisé en deux temps : formation d’un os primaire puis formation d’un os mature(26) .
La R.O.G. peut toujours être réalisée le jour de l’extraction à condition ne pas se trouver face à une infection aigue ou une infection avec fistule.
Les procédures de ROG pouvant se prêter au placement d’une membrane résorbable comprennent : l’augmentation localisée de la crête/la préparation du futur site implantaire, les défauts osseux péri-implantaires, les alvéoles d’extraction, la régénération osseuse suite à une résection apicale, la fenêtre sinusale, les perforations de la membrane sinusale (28).
C’est la plus documentée dans la littérature et ses résultats en termes d’augmentation du volume osseux tel montrent une fiabilité et un succès à long terme.
1.2.1.2. Influence des facteurs de croissance
L’utilisation de facteurs de croissance est dans le but d’augmenter l’efficacité de la régénération osseuse guidée. En effet, certains de ces facteurs ont la capacité d’augmenter le nombre de cellules synthétisant de l’os et la quantité de matrice osseuse déposée par ces cellules(29).
Les facteurs de croissance sont des protéines naturelles de poids moléculaire peu élevé (6 à 30 kDa). Ils sont produits et libérés par les plaquettes dans la matrice extracellulaire, lors de leur activation par une lésion (30). Lors du phénomène cicatriciel, il se produit une véritable cascade biochimique, chaque cellule se succédant sécrétant de nouveaux facteurs identiques ou différents.
L’influence des facteurs de croissance dans la synthèse osseuse intervient par : - leur effet régulateur de la croissance et la fonction des ostéoblastes
- l’induction d’angiogenèse (vascularisation) comme avec le facteur de croissance
basique de fibroblastes 1 et 2 bFGF-1/2 et le facteur endothélial vasculaire VEGF
- l’induction de l’ostéogenèse, la promotion de la migration et de la différenciation de cellules endothéliales et ostéoprogénitrices (30)
Le contenu de la matrice osseuse en facteurs de croissance est élevé. Les plus importants sont : - les facteurs de croissance fibroblastique FGF. Ils facilitent notamment l’angiogenèse pour revasculariser rapidement la lésion et l’ostéo-induction.
- le facteur de croissance ressemblant d’insuline de type 1 et 2 IGF-I et IGF-II (31). - le facteur de croissance dérivé des plaquettes PDGF. Il facilite notamment l’angiogenèse pour revasculariser rapidement la lésion (30)
- la famille des facteurs de croissance de type TGF-b avec plus de 43 membres comme
TGF-b 1-5 et la protéine morphogénique osseuse BMP 2-16. Ils régulent différents procédés
biologiques comme la croissance et la différenciation cellulaire et la formation de modèles embryogéniques. De plus, les BMP ont un rôle fondamental d’ostéo-induction de la différenciation mésenchymateuse en induisant la séquence complète de l’ossification endochondrale de l’os, où le cartilage est remplacé par de l’os (32).
1.2.2. Classification des biomatériaux de régénération osseuse guidée
La régénération osseuse guidée fait appel à des biomatériaux. On définit comme biomatériaux des matériaux non vivants utilisés dans un dispositif médical à des fins thérapeutiques ou non interagissant avec les systèmes biologiques(24).
Un dispositif médical est un instrument, appareil ou autre article, utilisé seul ou en association, pour être utilisé exclusivement ou principalement chez l’homme à des fins diagnostiques, de prévention ou de contrôle, d’étude ou de modification de l’anatomie, et de
Chaque dispositif médical fait l’objet d’une réglementation et bénéficie d’un marquage européen CE. Ils font l’objet d’une réglementation différente des médicaments et n’ont pas besoin d’une AMM pour être mis sur le marché et donc utilisé.
On distingue :
- les biomatériaux conventionnels, dits de ROG « vraie » c’est-à-dire les membranes résorbables et non résorbables et les substituts osseux d’origine animale, humaine ou synthétique (24).
- les biomatériaux naturels ou organiques dérivés, dits de ROG associé à un
comblement du défaut osseux : le plasma riche en plaquettes (en anglais, platelet rich plasma)
ou PRP (1,2), le plasma enrichi en facteur de croissance (en anglais, plasma rich in growth factor) ou PRGF (3,33), et le plasma riche en fibrine (en anglais, plasma rich in fibrin) ou PRF (4,34). Les plaquettes sanguines présentent la particularité de contenir de nombreux facteurs de croissance, d’où l’idée de produire ces dérivés, à partir d’un prélèvement sanguin du patient.
Le PRP est obtenu après prélèvement sanguin, double centrifugation sous anticoagulant (citrate phosphate dextrose), suivi d’une activation des plaquettes par ajout de thrombine bovine. On obtient alors 3 phases : les globules rouges, le plasma pauvre en plaquettes et le plasma riche en plaquettes (1,2).
Le PRF est obtenu après prélèvement sanguin, une seule centrifugation sans anticoagulant ni activation des plaquettes par trombine bovine ou un agent extérieur. On obtient alors 2 phases : les globules rouges et les globules blancs avec les plaquettes sous forme d’un gel jaunâtre (3).
Le PRGF est obtenu après prélèvement sanguin, une seule centrifugation sous anticoagulant (citrate sodique), suivi d’une activation des plaquettes par ajout de chlorure de calcium (Cal2). On obtient alors 3 phases : les globules rouges, les globules blancs et la fraction PRGF sous forme d’un liquide jaunâtre (4).
1.2.3. Historique
L’utilisation de substances hémostatiques dans le domaine chirurgical remonte aux débuts du XXème siècle. En 1909, Bergel décrit l’usage de la fibrine et ses dérivés en tant qu’agents hémostatiques. Par la suite, le Dr Grey en 1915 est le premier à utiliser la fibrine du sang pour contrôler le saignement dans une chirurgie cérébrale. Mais il faudra attendre 1986 pour que Knighton & Cols citent pour la première fois le premier résultat clinique de l’utilisation de concentrés plaquettaires pour promouvoir la cicatrisation locale sur une suture de nerfs périphériques sur des animaux. A partir de ce moment, lors de la même décennie, plusieurs recherches ont été effectuées afin de trouver des matériaux adhésifs qui puissent accélérer et promouvoir la guérison tissulaire. Le résultat sera la fibrine adhésive, connue depuis 1970 et qui a été pour la première fois utilisée dans des procédures chirurgicales par Matras dans les années 1980 (35).
L’adhésif de fibrine est devenu un produit de synthèse et est commercialisé en Europe sous le nom de Tissucol (Baxter -Immuno, Vienne, Autriche) dans le but d’éliminer la complexité de son processus d’obtention et de réduire le nombre de rendez-vous avec le patient avant la chirurgie (35).
L’utilisation des plaquettes est le principal objectif de tous les travaux de recherche. En effet, les chercheurs tentent d’obtenir, à partir de l’exploitation des plaquettes, un biomatériau d’origine autologue correct et qui puisse promouvoir la régénération des tissus, dans la mesure où elles sont relativement faciles à séparer des autres composants sanguins et où elles libèrent, après leur activation, une cascade de protéines et facteurs de croissance intervenant dans le processus de la régénération tissulaire (36).
Dans les années 1990, de nouvelles idées naissent et se développent. L’équipe de Tayapongsak, de l’Université de Floride, emploie cliniquement une fibrine autologue comme adjuvant dans la reconstruction des discontinuités mandibulaires avec de l’os spongieux, et obtient une consolidation osseuse précoce dans une série de trente-trois cas. Une année plus tard, ce même groupe présente quatorze cas où la fibrine autologue a été utilisée dans une reconstruction mandibulaire avec des bords en titane. Ces premiers concepts de combinaison des propriétés de deux produits, celles de scellement de la fibrine et celles de facteurs de croissance ont entrainé le développement de technologies autologues de plasma riches en plaquettes, de concentrés de plaquettes, de gels de plaquettes(37).
Toutefois, le véritable tournant dans ce domaine arrive avec les recherches du Dr Eduardo Anitua et le développement de la technologie de plasma riche en facteurs de croissance (PRGF). Ces recherches sont publiées au niveau national en 1997 et sont présentées l’année suivante lors du congrès annuel de l’Académie Américaine d’ostéointégration (38).
1.2.4. Le PRGF : définition
Le PRGF ou Plasma Rich in Growth Factor est, comme son nom l’indique, un plasma enrichi en facteurs de croissance, obtenu à partir d’un volume de sang du patient. Le nom commercial donné à cette technique est ENDORETâ (8,38).
Il est breveté en Europe, aux États-Unis et mondialement. De plus, il est agréé dans l’Union Européenne comme produit sanitaire.
Les principales différences entre la technologie ENDORETâ (PRGF) et les autres produits dérivés plaquettaires antérieurs sont les suivantes :
Le PRGF est préparé à partir de petits volumes de sang du patient. Ce volume varie en fonction de la chirurgie réalisée de 20 à 90 mL mais en utilisant toujours le même protocole de préparation. D’autres produits plaquettaires nécessitent jusqu’à 500 mL de sang pour leur
A la différence du concentré de plaquettes, le PRGF est préparé après une seule étape de
centrifugation. Il ne nécessite pas de phases complexes et multiples pour son obtention.
L’activation du PRGF exploite la propre thrombine du patient en utilisant un activateur du PRGF soit une dose standard de chlorure calcique sans aucune thrombine bovine. Cela évite les risques de biosécurité pour le patient, mais aussi une délivrance plus contrôlée des médiateurs biologiques (8,38).
1.3. Protocole de préparation (procédure)
Les produits nécessaires à la technique d’obtention de Plasma Riche en Facteurs de Croissance et son application sont catalogués comme produits sanitaires conformément à la directive européenne 93/42/EEC et sa transposition dans le Décret Royal 1591/2009 pour le marché espagnol.
La technologie ENDORETâ (PRGF) doit être mise en oeuvre avec des matériels adaptés, homologués pour la technique conformément au marquage CE (Classe IIb, dispositif médical, Directive 93/42/EEC), qui garantissent leur efficacité et leur sécurité.
La technologie ENDORETâ (PRGF) suit un protocole rigoureux selon trois grandes étapes : le prélèvement du sang, la centrifugation et le fractionnement (39,40).
1.3.1. Prélèvement du sang
La technologie ENDORETâ(PRGF) s’obtient de manière rapide et simple à partir de petits volumes de sang du patient sur qui nous souhaitons régénérer le tissu. Le prélèvement de sang est effectué en circuit fermé. Cela évite l’emploi de seringues en circuit ouvert (8,38).
Image 3: Kit KMU 15 pour l’usage d’Endoretâ (PRGF) dans le traitement de l’alvéole post-extraction (9)
Les volumes de sang nécessaires varient entre 20 et 90 mL en fonction de la chirurgie qui doit être effectuée, contrairement à d’autres produits plaquettaires qui nécessitent jusqu’à 500 mL de sang pour la réalisation de leur protocole(41).
Image 4: Prélèvement de sang par le système fourni dans le kit Endoretâ (PRGF)(9)
Tout d’abord, le sang du patient est prélevé par le système fourni dans le kit Endoretâ(PRGF). Il est collecté dans quatre tubes de prélèvement BTI de 9mL. Ces tubes sont stérilisés et contiennent 0,4mL d’une solution de citrate sodique à 3,8% comme anticoagulant. Il agit comme chélateur de calcium, n’affectant pas les récepteurs de membrane de plaquettes, autorisant la réversibilité du processus.
Une fois le prélèvement terminé, un pansement autocollant approprié est placé sur la zone de prélèvement et les tubes sont étiquetés avec le code du patient (8,37).
1.3.2. Centrifugation du sang
Les tubes doivent être centrifugés immédiatement après le prélèvement de sang. Dans la centrifugeuse, ils sont placés face à face de manière symétrique dans les paniers afin que le rotor soit équilibré. La composition finale du produit ENDORETâ (PRGF) dépend de leur
Après fermeture du couvercle, le programme de centrifugation est lancé à 580g pendant 8 minutes à température ambiante(8,38,41).
Image 5: Exemple de centrifugeuse (9) 1.3.3. Résultats
Le processus de centrifugation permet la séparation du sang en trois phases distinctes.
Image 6: Phases obtenues après centrifugation du sang : globules rouges, globules blancs, la fraction 2 et 1 d’Endoretâ (PRGF)(9)
La base du tube contient les globules rouges ou érythrocytes plus communément appelée série rouge. Par-dessus, on a les globules blancs ou leucocytes, plus communément appelé la série blanche ou buffy coat. Au-dessus de la série-blanche, le liquide jaunâtre correspond au PRGF(8,37).
La phase PRGF est séparée en deux fractions : la fraction 1 ou F1 et la fraction 2 ou F2. La fraction 2 correspond au 2 millilitres de plasma situés juste au-dessus de la couche de leucocytes. Il s’agit de la fraction la plus riche en plaquettes avec une concentration 2 à 3 fois supérieure à celle du sang périphérique. De plus, elle ne contient pas de leucocytes.
La fraction 1 de PRGF se trouve au-dessus de F2. Elle ne contient pas de leucocytes non plus. Elle comporte un nombre de plaquettes similaire ou légèrement supérieur à celui du sang total. Contrairement à F2, le volume de cette fraction varie en fonction de l’hématocrite du patient (pourcentage du volume total de sang occupé par les globules rouges), et peut osciller entre 2 et 3mL (8,37).
Pour recueillir ces deux fractions, on a recours à une pipette à usage unique et jetable.
Image 7: Exemple de pipette pour prélever les fractions 1 et 2 du PRGF (9)
On collecte la fraction 1 (F1) en premier. Elle est réalisée à l’aide d’une pipette, en plaçant la canule de la pipette dans la zone la plus superficielle de la fraction du plasma à extraire. On cesse l’aspiration dès qu’il reste environ 2mL de plasma par-dessus la série blanche. Le processus est répété pour aspirer la fraction 1 des autres tubes centrifugés.
Pour la collecte de F2, on réalise le même processus, en prélevant les 2 mL de plasma juste au-dessus de la phase de leucocytes(38).
Pour activer les plaquettes contenues dans le PRGF et lancer le processus de coagulation, nous devons utiliser un activateur de chlorure de calcium (CaCl2). Il faut ajouter 0,02 mL de CaCl2 pour chaque millilitre de plasma(38).
Image 8: Exemple de four conçu pour maintenir les fractions de plasma à la température corporelle de 37°C (+-1) (9)
L’activation des plaquettes dans F2 permet d’obtenir au bout d’environ 10 minutes un
coagulum. Plus le nombre de plaquettes présente dans le plasma est important, plus le temps
de formation du coagulum sera court. De plus, la température influence directement le temps de formation de celui-ci. A 37°C, le processus de coagulation et de rétraction de la fibrine est accéléré (8,37).
Image 9: Coagulum de la fraction 2 de PRGF (9)
L’activation des plaquettes dans F1 permet d’obtenir au bout de 15-20 minutes environ une membrane de fibrine. On place le plasma activé sur un récipient en verre et dans un four conçu pour maintenir les récipients à 37°C à 1°C près. On la décolle ensuite de la paroi du contenant en verre avec un instrument stérile afin de l’utiliser. Elle possède d’excellentes propriétés élastiques et hémostatique (8,37).
Image 11: Synthèse du protocole de mise en place du PRGF (ENDORETâ) depuis le prélèvement du sang à sa mise en forme (9)
1.4. Applications du PRGF
1.4.1. En médecine
Les derniers progrès en médecine se dirigent toujours plus vers l'adoption de nouvelles thérapies et procédures qui soient le moins invasives possible. Dans ce cadre, le PRGF a ouvert de nouvelles voies et approches thérapeutiques de par son accessibilité et sa capacité réparatrice (41).
La technologie PRGF est applicable dans de nombreux domaines de la médecine où elle a démontré son efficacité élevée dans la régénération de différents tissus : os, peau, muqueuse orale, tendons, ligaments, muscles, cartilage ou cornée (42).
Cette technologie est notamment utilisée en :
- Dermatologie - Trichologie
Des recherches sont en cours pour le traitement d'affections cutanées graves et de différents types d'alopécie.
De plus, les données cliniques attestent de la sécurité et de l'efficacité du PRGF en tant que traitement pour accélérer le processus de cicatrisation de différents types d'ulcères chroniques (43).
- Médecine Esthétique
L'utilisation locale du PRGF sur les zones abîmées ou présentant des signes de vieillissement
améliore l'état général de la peau et facilite le renouvellement cellulaire (44).
- Orthopédie de l’appareil locomoteur
Le PRGF s'est révélé l'un des traitements les plus efficaces pour l'arthrose, les lésions
tendineuses, ligamenteuses et musculaires, ainsi que la récupération après des fractures ou
des interventions chirurgicales (45).
- Ophtalmologie
Par son contenu en protéines bioactives et facteurs de croissance impliqués dans la régénération tissulaire, le PRGF améliore la régénération de la surface oculaire, en combattant les déficits fonctionnels de l'œil et en améliorant la lubrification de la surface oculaire (46).
1.4.2. En odontologie
La polyvalence de la technologie PRGF a permis son utilisation en chirurgie orale et maxillo-faciale ; dans le traitement de pathologies très diversifiées et lors d'interventions
cliniques. Plus précisément, les dentistes y ont recours en implantologie lors de la mise en place
d’implants et lors de réhabilitations maxillo-faciales en vue d’une régénération osseuse.
Application dans l’alvéole post-extraction
Après l’extraction de l’organe dentaire et le curetage de l’alvéole afin d’éliminer le tissu de granulation, les fractions de PRGF sont mises en place (4).
En effet, le coagulum de la fraction F2 du PRGF est séparée de la paroi interne du tube à l’aide du périotome, instrument utilisé pour décoller le coagulum du tube de centrifugation. On le récupère avec une pince et on le place à l’intérieur de l’alvéole. Puis, on récupère le bouchon de fibrine de la fraction F1 avec une pince. On le place au-dessus du coagulum. On suture l’alvéole afin de retenir dans l’alvéole le coagulum et la membrane(4).
Image 12 (cas clinique du Dr Chicaud A.)
Extraction d’une canine incluse inférieure et mise en place du coagulum de la fraction 2 dans l’alvéole puis mise en place de la membrane de fibrine de la fraction 1.
2. Matériel et méthodes 2.1. Stratégies de recherche
Afin de répondre à notre problématique, les bases de données électroniques suivantes ont été utilisées : Pubmed, Scopus et Cochrane.
Des mots clés ont été sélectionnés et combinés dans ces moteurs de recherche.
Pour la première indication, qui est l’apport du PRGF dans la cicatrisation osseuse
post-extractionnelle, les mots clés PRGF, oral, regeneration ont été appliqués.
Pour la deuxième indication, qui est la diminution des complications post-extractionelles
après mise en place de PRGF, les mots clés PRGF, post extraction socket, pain, infection et
complications ont été appliqués.
Ces termes ont été utilisés de manière croisée afin d’identifier les articles à analyser, après inclusion. La recherche sur les bases de données électroniques a été effectuée le 25 Janvier 2019.
2.2. Critères de sélection des articles
Ensuite, des critères d’inclusion et d’exclusion ont été définis afin de répondre au mieux à nos deux objectifs.
Les articles contenant des informations sur la cicatrisation osseuse post-extractionelle et les complications post-opératoires sur des patients sains, les études in vitro et in vivo chez l’Homme ainsi que les articles en français et en anglais ont été inclus.
Les articles contenant des informations sur la cicatrisation osseuse post-extractionnelle et les complications post-opératoires sur des patients ayant des pathologies générales ou systématiques tels que le diabète ou les cancers de la cavité orale ou sur des patients prenant des traitements comme des anticoagulants ou des biphosphonates, les articles sur d’autres concentrés plaquettaires tels que le PRP ou le PRF, les études où le PRGF était associé à d’autres biomatériaux comme les éponges de collagène ou à la mise en place d’implants dans la même séance, les études in vivo sur des animaux dans une autre zone que la cavité buccale, les études dans une autre langue que le français ou l’anglais ont été exclus.
2.3. Extraction des données et synthèse
Les informations concernant les études retenues ont été extraites à l’aide d’une grille d’extraction des données réalisée à cet effet, puis elles ont été synthétisées sous forme de tableaux. Les critères d’extraction sont les suivants : le titre de l’étude, le ou les objectifs de l’étude, la taille et la nature de l’échantillon, le type d’étude, les groupes d’étude, la durée de l’étude, la méthode, les critères évalués, les résultats, les limites du protocole, la discussion et enfin la conclusion.
3. Résultats
Les recherches électroniques à partir des moteurs de recherche ont permis d’identifier pour la première indication 327 articles (voir schéma 1) et pour la deuxième indication 30 articles (voir schéma 2). Après analyse des titres et résumés de chaque article, 23 publications pour la première indication et 10 publications pour la deuxième indication ont été retenues.
L’analyse des textes complets de chaque article nous a permis d’exclure 13 articles supplémentaires pour la première indication et 5 articles pour la deuxième indication. 1 doublon (retrouvé dans les deux recherches conduites) a été éliminé. Les articles ont été séparés selon qu’ils apportaient des informations sur l’indication seule (gain osseux ou complications post-opératoire) ou des informations supplémentaires sur l’autre indication.
Ainsi, nous avons pu réaliser les schémas suivants et avons abouti à une liste finale d’articles pour la première indication et pour la deuxième indication.
PUBMED SCOPUS COCHRANE
Après lecture titres et résumés Après lecture complète des articles Après exclusion des doublons
Concernant le gain osseux Concernant le gain osseux et les complications post-op 16 articles 5 articles 2 articles
6 articles 3 articles 1 article
8 articles
5 articles 3 articles*
Schéma 2 : Schéma d’extraction des données concernant les complications post-opératoires.
*Ces trois articles sont identiques.
Les informations concernant les études sont résumées dans les tableaux suivants.
PUBMED SCOPUS COCHRANE
Résultats initiaux 12 articles 12 articles
Après lecture titres et résumés
5 articles 3 articles 2 articles
Après lecture complète des
articles
2 articles 2 articles 1 article
Après exclusion des doublons
4 articles
Concernant les complications post-op
Concernant le gain osseux et les complications post-op 6 articles
Nom de l'article
Plasma rich in growth factors (PRGF) for the promotion of bone cell proliferation and tissue regeneration (47) Objectif de
l'étude
Evaluer la migration des ostéoblastes humains (hObs) avec PRGF Echantillon N=27 donneurs humains de sang
Type d'étude
Etude expérimentale, in vitro Groupe
contrôle
n=27 échantillons de cellulose sans PRGF, recueillis et placés dans 1mL de culture favorable à la croissance Goupe
testé
n’=27 échantillons de sang avec PRGF, recueillis et placés dans 1mL de culture, favorable à la croissance. Durée du
test
48h
Méthode Recueil et culture d’ostéoblastes humains (prélevés sur des têtes fémorales lors de chirurgie de la hanche).
Prélèvement de sang sur 27 donneurs humains, centrifugation à 580g (8min) (utilisation de la fraction F2 seulement).
Mise en culture des ostéoblastes avec PRGF ou sans (cellulose oxydée utilisée comme témoin) 48h et mesure en microscopie à fluorescence.
Evaluation Evaluation quantitative, prospective du gain osseux
Résultats Les ostéoblastes humains ont plus pénétré dans le PRGF que dans la cellulose oxydée.
Discussion Probablement dus aux facteurs de croissance et aux chimiokines. Les ostéoblastes qui ont colonisé le PRGF sont plus actifs et ont une meilleure intégrité cellulaire comparés à ceux du contrôle.
Nom de
l'article PRGF promotes bone tissue regeneration by stimuling prolifération, migration and autocrine secretion in primary human osteoblasts (48) Objectif de
l'étude
Evaluer et quantifier l'effet du PRGF sur la prolifération, la migration, la chimiotaxie des ostéoblastes alvéolaires primaires humains. Echantillon N= 1 donneur humain de sang (homme de 35ans) ;
N’=3 donneurs humains d’ostéoblastes alvéolaires (1 homme et 2 femmes de 53 à 86 ans) Type d'étude Etude expérimentale, in vitro
Groupe
contrôle n=1 culture d'ostéoblastes humains sans traitement
Goupe testé n’=3 cultures d'ostéoblastes humains, une avec du plasma pauvre en plaquettes, une avec une fraction très riche en plaquettes (F3 du PRGF), une avec la fraction riche en plaquettes du PRGF F2+F3.
Sur les essais de prolifération cellulaire et ceux de la synthèse des facteurs de croissance angiogénique et des composants de la matrice extra-cellulaire, une quatrième préparation a été faite avec 0,2% de sérum de veau fœtal.
Durée du test 4 jours
Méthode Prélèvement d’ostéoblastes alvéolaires humains sur 3 donneurs humains.
Prélèvement de sang sur un donneur en bonne santé de 35 ans, centrifugation du sang à 580g (8min) pour produire du plasma pauvre en plaquettes, du plasma riche en plaquettes F2+F3 et du plasma très riche en plaquettes F3.
Etude de la prolifération ostéoblastique (concentration variable de préparation de plasma) ; Etude de la synthèse des facteurs angiogéniques et des composants de la matrice extra-cellulaire ; Etude de l’activité de la phosphatase alcaline ; Etude de la migration cellulaire ; Etude de la chimiotaxie
Evaluation Evaluation quantitative, prospective du gain osseux
Résultats Prolifération des ostéoblastes : plus importante avec toutes les fractions plasmatiques comparativement aux contrôles (0,2% de sérum de veau fœtal) La
concentration la plus efficace de PRGF est celle à 20%. (fraction F3 seule comme F2+F3). Toutes les expérimentations suivantes ont été faites avec des fractions de PRGF à 20%.
Migration des ostéoblastes : plus importantes avec les fractions F3 et F2+F3(1,7 fois plus efficace) Chimiotaxie: plus importante avec les fractions F3 et F2+F3.
Synthèse des agents angiogéniques : plus elevée avec les fractions F3 et F2+F3.
Discussion La prolifération osseuse est dépendante de la quantité de plaquettes. Les facteurs de croissance associés au PRGF favorisent la perméabilité des vaisseaux sanguins. L’absence de leucocytes dans le PRGF réduirait considérablement la quantité de molécules pro-inflammatoires.
Conclusion Les fractions PRGF F3 et F2+F3 sont capables d’augmenter la régénération osseuse (RO) en augmentant la prolifération des ostéoblastes, la migration, la chimiotaxie et la synthèse des agents angiogéniques et des composants de la matrice extra-cellulaire.
Nom de
l'article PRGF stimulates proliferation, migration and gene expression associated with bone formation in human dental follicle cells (49) Objectif de
l'étude Evaluer les effets du PRGF sur la minéralisation des cellules folliculaires dentaires humaines (hDFCs)
Echantillon N=4 donneurs de sang (2 hommes et 2 femmes d'âge moyen 29,5ans) et N’= 1 donneur de follicules dentaires de troisième molaire de 14ans Type d'étude Etude expérimentale, in vitro
Groupe
témoin n= 4 cultures cellulaires avec sérum fœtal.
Goupe testé n’= 4 cultures cellulaires avec fraction 1 PRGF, n3= 4 cultures cellulaires avec fraction 2 PRGF. Durée du test 7 jours
Méthode
Préparation du PRGF (fraction F1 et F2) par centrifugation du sang à 460g (8min)+ préparation du sérum à partir du sang des 4 donneurs. Comptage des globules blancs et des plaquettes dans le sang total+ les trois préparations précédentes.
Dosage des FdCs IGF-1, TGF, PDGF, VEGF par méthode Elisa. Mesure de la prolifération cellulaire et de la migration.
Mesure de l’expression ostéogénique des ostéoblastes. (collagène type 1, ostéomoduline,, la phosphatase alcaline, BMP-4 et BMP-2, TGF-b) Evaluation Evaluation prospective du gain osseux, quantitative
Résultats
Concentration des plaquettes: F2>sang total>F1>sérum et pas de GB dans le PRGF F1 et F2 et sérum
Concentrations de facteurs de croissance: TGF-b :plus élevé dans F2 que F1 et sérum et pour IGF-1, PDGF, VEGF :quantités similaires dans F2 et sérum et plus faibles dans F1.
Prolifération cellulaire des cellules folliculaires: plus élevée avec PRGF (concentration 10%) comparé à du sérum de veau fœtal à 10% Migration cellulaire : plus élevée avec PRGF (concentration 10%) comparé à du sérum de veau fœtal à 10% (pas de différence significative) Expression ostéogénique des ostéoblastes : toutes les molécules dosées augmentées avec PRGF comparativement au sérum de veau fœtal. Discussion
La réalisation du PRGF supprime les globules blancs de l’échantillon sanguin.
Le facteur de croissance TGF-b (important dans la cicatrisation osseuse) est augmenté dans les fractions de PRGF plus F2 que F1.
Nouveaux modèles expérimentaux sont nécessaires pour élucider toutes les fonctions biologiques du PRGF, y compris les échafaudages et la libération des facteurs de croissance.
Conclusion Facteurs solubles du PRGF augmente la prolifération, migration et expression des gènes associés à l'induction ostéogénique par des cultures de cellules folliculaires dentaires humaines en raison du taux élevé en facteurs de croissance.
Nom de l'article Plasma rich in growth factors in human extraction sockets: a radiographic and histomorphometric study on early bone deposition (50)
Objectif de l'étude Evaluer le dépôt osseux précoce dans des alvéoles d'extraction avec et sans PRGF.
Echantillon N= 28 patients dont 11 patients avec administration de PRGF et 17 patients sans administration de PRGF N’= 36 alvéoles d’extractions humaines
Type d'étude Etude cas/témoin, in vivo
Groupe témoin n= 18 alvéoles d'extractions humaines sans PRGF
Goupe testé n’= 18 alvéoles d'extractions humaines avec PRGF
Durée du test Temps 1 (T1): 4 à 6 semaines, Temps 2 (T2): 7 à 10 semaines
Méthode
Extraction atraumatique,
Prélèvement du sang, centrifugation du sang à 580g (8min) et prélèvement de la fraction au-dessus des GRs sans distinction des GBs. Détermination de la densité minérale des tissus :
-scan, reconstruction 3D avec logiciel
-Biopsie : échantillon recueilli après T1=4-6 semaines (6 sites PRGF+ 5 sites ctl) ou T2=8-10 semaines (5sites PRGF et 5 sites ctl),+ dosage vWF (marqueur endothélial), OCN (marqueur ostéoblastique de matrice osseuse) CD68 (marqueur macrophage)
Evaluation Evaluation prospective du gain osseux, quantitative, en simple aveugle (analyse des biopsies)
Résultats
Volume osseux, contenu minérale des tissus : tendance à des valeurs plus importantes à T2 mais pas de différences significatives entre le groupe PRGF et le groupe contrôle à T1 et T2
Densité minérale : pas de différence significative entre les deux groupes et identique entre T1 et T2
Cellules CD68+ : plus présentes dans le groupe PRGF à T1 et T2 (peu de changements entre T1 et T2) dans le groupe contrôle augmentation des CD68+entre T1 et T2.
Cellules vWF : plus élevé à T1 dans le groupe PRGF mais équivalent à T2 entre PRGF et contrôle.
Cellules OCN: plus faible à T2 par rapport à T1 dans les groupes PRGF et contrôle, pas de différence entre les deux groupes Limite du protocole Nombre limité de donneurs (inférieur à 100), évaluation quantitative de deux types de cellules seulement.
Discussion
Le contenu similaire en ostéocalcine est concordant avec le volume osseux et le contenu minéral dans le groupe PRGF et contrôle.
La présence plus importante de CD68 peut être expliquer par l’expression de certaines cytokines pro-inflammatoires et l’expression de molécules d’adhésion spécifique contenu dans les concentrés de plaquettes.
L’application locale de PRGF dans les alvéoles d’extractions peut promouvoir l’angiogenèse dans les premiers stades de la cicatrisation. Conclusion Le groupe traité par PRGF n’a montré aucune amélioration significative au début du dépôt osseux (4 à 8 semaines) par rapport au groupe
Nom de l'article Plasma Rich in Growth Factors: Preliminary Results of Use in the Preparation of Future Sites for Implants (40) Objectif de l'étude Evaluer l'amélioration de la régénération osseuse et la guérison des tissus mous.
Echantillon N=23 patients (20 patients avec une extraction simple dont 10 avec PRGF et 10 sans PRGF, 3 patients avec plusieurs sites d’extractions :1 site avec PRGF et tous les autres sites sans PRGF sur même patient) N'= 26 alvéoles d'extractions humaines, hommes et femmes de 35 à 55 ans
Type d'étude Etude cas/témoin, in vivo
Groupe témoin n1=10 alvéoles d'extraction humaines simples sans ajout de PRGF +3 alvéoles d’extractions humaines Goupe testé n2=10 alvéoles d'extraction humaines simples avec ajout de PRGF+ multiples sites sur 3 patients
Durée du test 10 à 16 semaines
Méthode
Prélèvement de sang, centrifugation à 160g (6min) pour produire du PRGF et prélèvement de la fraction au-dessus des GRs sans distinction des GBs, anesthésie, extraction, ajout de PRGF+ os autologue chez 5 patients sur 10, traitement antibiotique (amoxicilline 5jours), cicatrisation 10 à 16 semaines, biopsie réalisée à la semaine 10 ou à la semaine 16.
Evaluation Evaluation prospective du gain osseux, qualitative, en double aveugle (administration PRGF, analyse des biopsies)
Résultats
Groupe PRGF: Observation clinique: épithélialisation meilleure que sur les témoins. Régénération presque complète 8/10 avec PRGF; biopsie et radiographie: os compact avec trabécules organisés et morphologie normale, 2/10 partiellement régénérées (fumeurs, défauts à 3 parois).
Groupe sans PRGF: Observation clinique: situation homogène: tissu conjonctif remplit majeure partie de l'anomalie, épithélialisation normale. Biopsie et radiographie: os compact avec trabécules.
Groupe avec et sans PRGF: Observation clinique: épithélialisation plus rapide avec PRGF, Biopsie: os plus mature, travées mieux organisées avec PRGF
Limite du protocole Evaluation qualitative, subjective Discussion
Une concentration supérieure en facteur de croissance améliorerait la régénération osseuse et la réparation des tissus mous. Etude future pour la concentration idéale en facteurs de croissance (FdC). Définir les autres FdCs physiochimiques ayant un rôle dans la régénération osseuse (RO).
Nom de l'article Effect of PRGF on alveolar osteitis (51)
Objectif de l'étude Evaluer l’effet préventif du PRGF sur l'ostéite alvéolaire
Echantillon
N= 20 patients avec 2 sites au maxillaire et 2 à la mandibule
De 18 à 45 ans avec au moins un facteur de risque d'ostéite alvéolaire (antécédents de péricoronarite, d'absorption contraceptive, de tabagisme, de bruxisme ou d'ostéite alvéolaire)
N'= 80 alvéoles d'extractions
Type d'étude Essai clinique cas/témoin, in vivo
Groupe témoin n=40 alvéoles d'extraction avec un placebo
Groupe testé n’=40 alvéoles d'extraction avec PRGF
Durée du test 7 jours
Méthode
Prélèvement de sang, centrifugation à 460g (8min) pour produire du PRGF Prélèvement de la fraction au-dessus des GRs sans disctinction des GBs
Extractions bilatérales par un seul chirurgien, et mise en place du gel dans la cavité dans deux des quatre alvéoles pour chaque patient à l'aveugle,
Examen 2,3,4 jours après l'opération par autre examinateur pour détecter : ostéite alvéolaire, douleur sur échelle visuelle analogique (VAS) et guérison à 3 et 7 jours selon échelle de guérison.
Evaluation Evaluation des complications post-opératoires, qualitative, prospective
Résultats
Ostéite alvéolaire selon signes cliniques : 14 patients avec OA (dont 4 à la fois sur le site avec PRGF et sans PRGF), tous les autres sites PRGF sans OA.
Douleur : intensité au cours des 2ème, 3èmes et 4èmes jours post-opératoires significativement plus faible dans le groupe PRGF que dans le groupe témoin
Cicatrisation : significativement meilleure dans le groupe PRGF
Limite du protocole Evaluation qualitative, prospective, délai court
Discussion
L'application de PRGF peut prévenir l'OA et ses complications en raison de son effet angiogénique à long terme et d'une régénérabilité accrue. L'effet angiogénique du PRGF peut réduire ces complications chez les bruxomanes.
Conclusion L’application de PRGF dans l’alvéole a été associée à une diminution de l’ostéite alvéolaire, de la douleur, de l’inconfort, et à une guérison améliorée. Elle aiderait à prévenir la formation de l’ostéite alvéolaire, surtout chez les patients sensibles.