IDENTIFICATION DES ANTHOCYANES DE DEUX ESPECES DE BLEUETS SAUVAGES DU QUÉBEC «VACCINIUMANGUSTIFOLIUM» ET «VACCINIUM MYRTILLOIDES » ET ÉVALUATION DE LEUR POTENTIEL ANTIOXYDANT
Thèse présentée
à la Faculté des études supérieures de l'Université Laval
dans le cadre du programme de doctorat en sciences et technologie des aliments pour l'obtention du grade de philosophiae doctor (Ph.D.)
SCIENCES DES ALIMENTS ET NUTRITION
FACULTÉ DESSCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION UNIVERSITÉ LAVAL
QUÉBEC
2010
Les effets bénéfiques du bleuet nain sur la santé sont attribués à sa forte teneur en anthocyanes réputées pour leurs propriétés antioxydantes et anticancérigènes intéressantes. Les anthocyanes sont présentes dans la nature sous forme d'hétéroside dont l'aglycone ou anthocyanidine, est dérivé du cation flavynium ou 2-phénylbenzopyrilium diversement hydroxylé. Dans cette étude, l'extraction des anthocyanes de V. angustifolium et V. myrtilloïdes du Lac-Saint-Jean avec de l'éthanol a été optimisée en utilisant différentes températures, types d'acides et un ratio solvant/solide de 10 ainsi que l'étude de l'effet de ces paramètres du procédé sur la stabilité des anthocyanes. Les teneurs et les indices de dégradation des anthocyanes ont été déterminés par la méthode spectrophotométrique du pH différentiel et par HPLC-DAD après avoir purifié les échantillons sur des cartouches SPE à C-18. Les anthocyanes de ces deux bleuets sauvages ont été identifiées et caractérisées par HPLC-ESI-MS/MS couplée avec une trappe à ions et un détecteur UV-visible. Le pouvoir antioxydant des anthocyanes de ces deux espèces de bleuets sauvages a été aussi évalué par la méthode du DMPD (N, N-dimethyl-p-phenylenediamine) ainsi que leur capacité à inhiber l'oxydation in vitro de la lipoprotéine de faible densité (LDL) qui joue un role crucial dans le développement des maladies cardiovasculaires. Les rendements d'extraction et la qualité des extraits d'anthocyanes varient en fonction de la température et du type d'acide. Tous les échantillons analysés ont révélé cinq des six anthocyanidines les plus répandues et habituellement trouvées dans les fruits et légumes à savoir la delphinidine, la cyanidine, la petunidine, la peonidine et la malvidine à l'exception de la pelargonidine. Hormis les anthocyanes majeures connues, de nouvelles molécules d'anthocyanes récemment découvertes ont été également identifiées. Les anthocyanes extraites des bleuets ont montré un potentiel antioxydant élevé. La capacité de ces anthocyanes à inhiber le radical DMPD + varie de 1614.6 uM d'Équivalent Trolox (ET)/g bleuet frais pour Vaccinium angustifolium et 1454.4 uM d'Équivalent Trolox (ET)/g bleuet frais pour Vaccinium myrtilloïdes. Les données de cette étude ont démontré que le procédé d'extraction dans les conditions optimales n'a aucun effet significatif sur le pouvoir antioxydant des anthocyanes.
Quant à leur capacité à inhiber l'oxydation de la lipoprotéine de faible densité, les résultats ont montré que ces pigments sont potentiellement capables de protéger les molécules organiques contre les modications oxydatives induites par les métaux lourds comme le cuivre.
Short Abstract
The health benefits of wild blueberries are attributed to their high anthocyanes content which is strongly correlated to their highest antioxidant capacity and interesting anticarcinogenic properties. Anthocyanins are heterosides whose aglycone or anthocyanidin is derived from the flavylium or 2-phenylbenzopyrilium cation variously hydroxylated. Anthocyanins were extracted from wild blueberries Vaccinium angustifolium and
Vaccinium myrtilloïdes at different temperatures using ethanol alone or ethanol acidified with different types of acid at a solvent to solid ratio of 10. The effect of these parameters on extracted anthocyanins stability was investigated. The pH-differential and HPLC-DAD methods were used to determine anthocyanin contents and degradation index. Extracted anthocyanins were purified on a C-18 solid-phase extraction cartridge and characterized by HPLC/electrospray-ionization/mass spectrometry (HPLC-ESI-MS/MS). The total antioxydant abilities of anthocyanins extracts of the two lowbush blueberry species were measured in this study using N,N-dimethyl-/?-phenylenediamine (DMPD) method as well as their ability to inhibit in vitro oxidative damage of low density lipoprotein (LDL) which play a pivotal role in heart disease. Anthocyanin extractions gave different yields depending on the type of added acid and the extraction temperature. Of the six common anthocyanindins, five were identified in the extracts, namely delpinidin, cyanidin, peonidin, petunidin and malvidin; pelargonidin was not found. In addition to well-known major anthocyanins, new anthocyanins were identified for the first time in extracts of wild blueberries from Quebec. Extract anthocyanins exhibit potent ability to scavenge DMPD radicals, antoxidant capaties ranged from 1614.6 and 1454.4 p.mol of Trolox equivalent per gram of fresh weight respectively for Vaccinium angustifolium and Vaccinium myrtilloïdes. Data from this survey showed that solvent extraction conditions have no significant effect on anthocyanins antioxidant abilities. Regarding these anthocyanins potential ability to inhibit low density lipoproteins in vitro oxidation induced by copper, this investigation demonstrated these pigments are highly potentially able to protect organic molecules from oxidative damages caused by transition metals such as copper.
Les effets bénéfiques du bleuet nain sur la santé ont été largement acceptés après que Prior (1998) ait rapporté que cette baie possédait la capacité antioxydante la plus élevée parmi 42 fruits et légumes évalués. Cet événement scientifique a incité beaucoup de recherche en ce qui concerne les effets bénéfiques du bleuet sur la santé, dans cette même dynamique, des travaux ont démontré que cette grande capacité antioxydante du bleuet est fortement liée à sa forte teneur en anthocyanes. Les anthocyanes sont des molécules faisant partie de la famille des flavonoïdes dont l'aglycone est appelé anthocyanidine, ont une structure de base commune, le cation flavylium ou 2-phényl-l-benzopyrilium. Compte tenue du fait qu'il existe peu d'informations dans la littérature scientifique sur les bleuets sauvages du Québec, l'objectif global de ce projet était de se focaliser sur les anthocyanes de Vaccinium angustifolium and Vaccinium myrtilloïdes deux espèces de bleuet nains du Lac-St-Jean.
Comme premier objectif, dans cette étude l'extraction des anthocyanes d'un mélange de bleuets composé de 80% de V. angustifolium et de 20% de V. myrtilloïdes du Lac-Saint-Jean avec de l'éthanol a été optimisée en utilisant différentes températures, basse (7.7 °C), moyennement élevée (26.0 °C) à élevée (79.0 °C), différents types d'acides (acide chlorhydrique, citrique, tartrique, lactique et phosphorique) et un ratio solvant/solide de 10 ainsi que l'étude de l'effet de ces paramètres du procédé sur la stabilité des anthocyanes. Les teneurs et les indices de dégradation des anthocyanes ont été déterminés par pH différentiel et par HPLC-DAD purification sur des cartouches SPE à C-18 ainsi que l'élucidation de leurs structures chimiques par HPLC-ESI-MS/MS couplé à une trappe à ions. L'extraction à 79 °C avec l'acide phosphorique a permis de récupérer le maximum de pigments anthocyanes (28.90 mg d'ACY/g sec de bleuet) avec un faible indice de dégradation de 1.10 confirmé par HPLC-DAD. Tous les échantillons analysés ont révélé cinq des six anthocyanidines les plus répandues et habituellement trouvées dans les fruits et légumes à savoir la delphinidine, la cyanidine, la petunidine, la peonidine et la malvidine à l'exception de la pelargonidine.
Hormis les anthocyanes simples majeures connues, à notre connaissance de nouvelles molécules d'anthocyanes acylées récemment découvertes ainsi que de nouvelles molécules ont été également identifiées.
Dans le second objectif, les molécules d'anthocyanes ont été extraites de V. angustifolium et de V. myrtilloïdes séparément avec de l'éthanol acidifié avec de l'acide phosphorique à 79.0 °C et un ratio solvant/solide de 10, qui correspondent aux conditions optimales d'extraction (Nicoué et al. 2007). Après purification sur des cartouches SPE à
C-18, les anthocyanes de ces deux bleuets sauvages ont été iden tifiées et caractérisées par HPLC-ESI-MS/MS couplée avec une trappe à ions et un détecteur UV-visible. Le pouvoir antioxydant des anthocyanes de ces deux espèces de bleuets sauvages a été évalué par la méthode du DMPD (N, N-dimethyl-p-phenylenediamine) (Fogliano et al, 1999). Dans chaque espèce de bleuet, cinq des six anthocyanidines les plus répandues et habituellement trouvées dans les fruits et légumes à savoir la delphinidine, la cyanidine, la petunidine, la peonidine et la malvidine ont été identifiées dans les espèces de bleuet, à l'exception de la pelargonidine, confirmant ainsi ce qui a été rapporté dans la littérature. À notre connaissance c'est la première fois que des anthocyanes liées à des hexoses (épimères du galactose et du glucose) et pentoses inhabituelles (épimères de l'arabinose et du xylulose) inhabituelles ont été identifiées. La capacité de ces anthocyanes à inhiber le radical DMPD'+ varie de 1614.6 uM d'Équivalent Trolox (ET)/g bleuet frais pour Vaccinium angustifolium et 1454.4 uM d'Équivalent Trolox (ET)/g bleuet frais pour Vaccinium myrtilloïdes. Les données de cette étude ont démontré que le procédé d'extraction dans les conditions optimales n'a aucun effet significatif sur le pouvoir antioxydant des anthocyanes.
Le troisième objectif ayant été l'objet de l'extraction des anthocyanes du mélange de V. angustifolium et de V. myrtilloïdes à 0.7 °C, 26 °C and 79 °C en utilisant de l'éthanol acidifié avec de l'acide citrique, tartrique et phosphorique au ratio solvant/solide ratio 10. La capacité antioxydante des anthocyanes extraites ainsi que le potentiel de l'extraction 18 (conditions expérimentales : 79 °C, acide phosphorique) à protéger la molécule organique,
le LDL contre les dommages oxydatifs du métal de transition comme le cuivre, jouant le rôle de pro-oxydant ont été évaluées.
L'inhibition de l'oxydation du LDL a été suivie en déterminant la formation des dienes et trienes conjugués par une méthode spectrophotométrique et celle de l'hexanal par chromatographic en phase gazeuse espace de tête. Les anthocyanes provenant des extractions numéros 18 (79 °C, acide phosphorique) et 7 (29 °C, acide citrique) ont montré un potentiel antioxydant significatif.
Le dernier objectif, a permis d'évaluer le potentiel des anthocynes de V. angustifolium et de V. myrtilloïdes à empêcher l'altération oxydative du LDL provoquée in vitro en présence de sulfate de cuivre. Le suivi du potentiel d'inhibition des anthocyanes a été réalisé en mesurant les produits primaires de l'oxydation du LDL comme les dienes et trienes conjugués et les produits secondaires comme l'hexanal par les méthodes précédemment mentionnées. Après 6 heures d'incubation, la formation des dienes et trienes conjugués a été inhibée à 55 et 47.22% respectivement par Vaccinium angustifolium and Vaccinium myrtilloïdes, tandis que celle de l'hexanal a été de 60.13 et 62% sur la même période de temps. Les résultats ont démontré que les anthocyanes extraites de ces deux espèces de bleuets nains du Québec procurent une protection au LDL contre le stress oxydatif, mise en évidence par la diminution de la formation des dienes, trienes et hexanal comparativement au témoins ne contenant pas d'anthocyanes.
Extended abstract
The health benefits of lowbush blueberries became widely accepted after Prior (1998) reported that blueberries had the highest antioxidant capacity of 42 fruits and vegetables evaluated. This finding sparked numerous investigations into the health benefits of blueberries and it has been showed that wild blueberries highest antioxidant capacity was strongly correlated with their strong anthocyanins content. Anthocyanins are molecules belonging to flavonoids family, present in nature in the form of heterosides whose aglycone or anthocyanidin is a derivative of the flavylium ion or 2-phenylbenzopyrilium, diversely hydroxylated. According to the fact there is few information reported in scientific literature regarding lowbush blueberries of Québec, the main objective of this survey have been focussed on anthocyanins of Vaccinium angustifolium and Vaccinium myrtilloïdes two wild blueberries from Lac-St-Jean.
As first objective of this investigation, Anthocyanins were extracted from a mixture of berries of Vaccinium angustifolium and Vaccinium myrtilloïdes at 7.7 °C, 26 °C and 79 °C using ethanol alone or ethanol acidified with hydrochloric, citric, tartaric, lactic or phosphoric acids at a solvent to solid ratio of 10 as well as the effect of these parameters on extracted anthocyanins stability. After purification, extracted anthocyanins were characterized by HPLC/electrospray-ionization/mass spectrometry (HPLC-ESI-MS/MS). High yields of monomelic and total anthocyanins (26.3 and 28.9 mg/g of dry matter) were obtained at 79 °C using phosphoric acid. Extraction using tartaric acid at 79°C provided the lowest degradation index (1.05). Anthocyanins were stable and browning by polyphenol oxidize was inhibited under these conditions. Of the six common anthocyanindins, five were identified in the extracts, namely delpinidin, cyanidin, peonidin, petunidin and malvidin; pelargonidin was not found. In addition to well-known major anthocyanins, new anthocyanins were identified for the first time in extracts of wild blueberries from Quebec.
In the second objective, anthocyanins were extracted from Vaccinium angustifolium and Vaccinium myrtilloïdes separately using optimal conditions (phosphoric acid, 79 °C) at a solvent to solid ratio of 10 (Nicoué et al. 2007). After purification on C-18 solid-phase extraction cartridge, chemical structures of extracted anthocyanins were elucidated by HPLC/electrospray-ionization/mass spectrometry (HPLC-ESI-MS/MS) as well as their abilities to scavenge free radicals by using N, N-dimethyl-p-phenylenediamine (DMPD) (Fogliano et al., 1999). In each species of blueberry, five of the six common anthocyanindins, were identified, namely delpinidin, cyanidin, peonidin, petunidin and malvidin; pelargonidin was not found, confirming what has been reported. To our knowledge, this the first time that anthocyanins linked to unusual hexoses (epimer of galactose and glucose) and unusual pentoses (epimers of arabinose and xylulose). Anthicyanins abilities to scavenge DMPD radicals ranged 1614.6 and 1454.4 umol of Trolox equivalent per gram of fresh weight respectively for Vaccinium angustifolium and Vaccinium myrtilloïdes. This survey data showed that optimal extraction conditions have no significant effect on anthocyanins antioxidant activity.
The third objective having been the object of anthocyanins extraction from a mixture of berries of Vaccinium angustifolium and Vaccinium myrtilloïdes at 7.7 °C, 26 °C and 79 °C using ethanol alone or ethanol acidified with citric, tartaric and phosphoric acids at a solvent to solid ratio of 10. Antioxidant of extracted anthocyanins as well as that of extraction 18 (79 °C, phosphoric acid) to protect organic molecules such as LDL from oxidative damage has been evaluated. Inhibition of LDL oxidation has been assessed by following dienes and trienes conjugated generation using spectrophotometric method and hexanal by using headspace gas chromatography. Extractions 18 (79 °C, phosphoric acid) and 7 (26 °C, citric acid) showed relatively high antioxidant capacities. Regarding inhibition of LDL oxidation, extraction 18 allowed to decrease dienes and trienes conjugated by 52.49 and 47.64% respectively after 6.5 and 6 h period of in vitro incubation, while hexanal formation was diminished by 47.4% over 6 h period.
angustifolium and V. myrtilloïdes to prevent LDL oxidative alteration induced in vitro with CUSO4. The follow-up of anthocyanins potential inhibition was realized by measuring primary oxidation products coming from LDL oxidation such as conjugated dienes and trienes, and secondary oxidation products such as hexanal by the methods mentioned previously. After 6 h of incubation, conjugated dienes and trienes formation were inhibited by 55 and 47.22% respectively for Vaccinium angustifolium and Vaccinium myrtilloïdes, while allowed to inhibit hexanal formation by 60.13% and 62% over the same period. This survey clearly showed through in vitro model that extracted anthocyanins from Québec wild blueberries are able to decrease oxidation products coming from oxidative damage of LDL and could provide an in vivo protection of organic molecules (LDL, DNA, proteins and lipids) against reactive oxygen species involved in biological systems.
Dédicace
Je dédie l'aboutissement de ce parcours académique à la mémoire de mon père Emile Nicoué et celle de ma mère Mariama Zarou, que je ne remercierai jamais assez pour leur éternel dévouement, de m'avoir soutenu sous toutes les formes tout au long de mes périples à l'étranger et aussi de m'avoir encouragé à pousser le plus loin possible mes études supérieures.
Je terminerai cette dédicace par la personne qui m'aide et me supporte depuis déjà longtemps avec énormément d'amour et de tendresse, pour toute son affection et tout ce que je sais lui devoir, mon épouse Hadiza Boubacar, sans oublier mes enfants : Harouna, Farida, Rahila, Yassina (née le 19/03/2010) et toute la famille NICOUÉ si bien unie.
Avant-propos
Le corps de cette thèse est constitué de cinq chapitres. Le premier chapitre, intitulé « Revue de littérature », donne une vue d'ensemble des connaissances actuelles sur les effets bénéfiques du bleuet sur la santé, les techniques d'extraction des anthocyanes, les techniques d'identification chimique des anthocyanes et les méthodes permettant d'évaluer le potentiel antioxydant des anthocyanes.
Les chapitres suivants sont présentés sous forme d'articles scientifiques qui sont soit publiés, sous presse ou en voie d'être envoyés. J'ai effectué toutes les expériences de laboratoire et j'ai rédigé le premier brouillon de ces articles. Ces derniers ont été revus et corrigés par mon directeur de recherche, Professeur Khaled Belkacemi, et mon co-directeur de recherche, Dr Sylvain Savard du CRIQ. Le travail rapporté dans le chapitre 2, intitulé « Anthocyanins in Wild Bleueteries of Québec : Extraction and Identification » a permis d'élaborer sur l'effet des paramètres d'extraction par solvant organique des anthocyanes et l'élucidation des structures chimiques des anthocyanes extraites a partir d'un mélange de deux espèces de bleuets sauvages du Québec. Les résultats de cette investigation ont été publiés dans le journal «Journal of Agricultural and Food Chemistry » 2007, 55 (14), pp 5626-5635.
Le chapitre 3, intitulé « Quantitative Identification and Antioxidant Activity of Anthocyanins in Wild Blueberries of Quebec: Vaccinium angustifolium and Vaccinium myrtilloïdes », traite de l'identification chimique des anthocyanes et de l'évaluation du potentiel antioxydant des mêmes phytochimiques de deux espèces de bleuets sauvages du Québec séparément. Cet article a été soumis pour publication au « Journal of Agricultural and Food Chemistry ».
L'article qui fait objet du chapitre 4 a permis de réaliser la capacité des antocyanes à inhiber les radicaux libres, à partir des six extractions qui ont permis le meilleur rendement d'extraction des anthocyanes a partir d'un mélange de deux espèces de bleuets sauvages du Québec. Cet article sera prochainement soumis dans le journal « Food Chemistry ».
Le chapitre 5 présente l'état des lieux en ce qui concerne la capacité des pigments anthocyanes des deux espèces de bleuets nains à inhiber l'oxydation des lipoprotéines de faible densité (LDL) de façon in vitro. L'oxydation du LDL est une étape cruciale des maladies cardiovasculaires. Ce qui explique son choix comme substrat modèle durant cette étude. Les résultats correspondants au chapitre 5 seront prochainement soumis pour publication dans le journal « Phytochemistry ».
Les présentations orales faites sur le sujet sont les suivantes :
> E. E. Nicoué : Optimisation du procédé d'extraction et caractérisation des anthocyanes de deux variétés de bleuets nains du Québec «Vaccinium angustifolium» et «Vaccinium myrtilloïdes» pour le Séminaire II STA 64273.
> E. E. Nicoué : Identification et évaluation du pouvoir antioxydant des anthocyanes de «Vaccinium angustifolium» et «Vaccinium myrtilloïdes» du Séminaire III STA 64274 dans le cadre de déroulement du doctorat.
> E. E. Nicoué, S. Savard, et K. Belkacemi, Extraction d'antocyanes à partir de deux variétés de bleuet nains du Québec 'Vaccinium angustifolium et Vaccinium myrtilloides'1 présenté au Congrès de l'INAF, 2005.
Le moment des remerciements a toujours été un moment délicat par crainte d'oubli, mais je tiens à exprimer ma gratitude à toutes les personnes qui ont contribué de près ou de loin à la réalisation de ce projet de recherche.
Je voudrais exprimer toute ma reconnaissance à mon directeur de recherche, Professeur Khaled Belkacemi pour m'avoir permis de réaliser ce projet, sa grande connaissance, ses avis éclairés, sa rigueur scientifique, professionnelle et son respect des initiatives ses qualités humaines exceptionnelles personnelles ont constitué un appui constant.
Que le Dr Sylvain Savard qui m'a fait l'honneur d'assurer la co-direction scientifique de ce projet et la supervision de tous les travaux réalisés au CRIQ, reçoive ici mes sincères remerciements pour ses qualités humaines, ses conseils judicieux, sa grande expertise et son appui constant.
Je veux aussi remercier le Professeur Paul Angers qui a fait la prélecture de ma thèse et avoir accepter d'en être l'examinateur. Je désire aussi adresser mes remercîments aux autres examinateurs, pour leur disponibilité à examiner cette thèse.
Je tiens également à remercier Marie-Josée Hardy, Directrice Adjointe de la Direction Environnement du CRIQ pour son soutien incommensurable.
J'aimerais également remercier Michel Arsenault, André Tremblay, Stéphane Breton du CRIQ et Alain Gaudreau et Ronan Corcuff du Département Sciences des Aliments et Nutrition de l'Université Laval pour leur soutien technique inestimable.
TABLE DES MATIERES
RESUME COURT II SHORT ABSTRACT IV RÉSUMÉ LONG V EXTENDED ABSTRACT VIII
DÉDICACE XI AVANT-PROPOS XII
REMERCIEMENTS XIV LISTE DES TABLEAUX XXII LISTE DES FIGURES XXIV INTRODUCTION GENERALE ET PROBLEMATIQUE DE LA RECHERCHE....27
CHAPITRE I
Revue de littérature
1-1 LE BLEUET 33 1-1-1 Généralités 33 1-1-2 Qualité nutrition nolle du bleuet 33
1-1-3 Fonctionnalités du bleuet dans la santé 34 1-1-3 Utilité dans l'infection de l'appareil urinaire 34
1-1-4 Les substances anticancerigènes 35
1-2 LES ANTHOCYANES 36 1-2-1 Structures chimiques 36
1-2-2 Stabilité 38 1-2-3 Propriétés biologiques des anthocyanes 40
1-2-4 Applications cliniques des anthocyanes 42
1-2-4-1 Activité ophtalmique 42 1-2-4-2 Action vasoprotective 43 1-3 TECHNIQUES D'EXTRACTION DES ANTHOCYANES 43
1-3-1 L'extraction par solvant 43 1-3-2 Technologie de l'extraction des anthocyanes pour les produits
pharmaceutiques 44 1-4 MÉTHODES D'ANALYSE DES ANTHOCYANES 45
1-4-1 Isolation et purification des anthocyanes 45 1-4-2 Détection et identification des anthocyanes 46
1-4-2-1 La spectrofluorométrie 46 1-4-2-2 La spectroscopic UV Visible 47 1-4-2-3 La résonance magnétique nucléaire (RMN) 47
1-4-2-4 La spectroscopic de résonance RAMAN 48
1-4-2-5 La spectroscopic infrarouge (IR) 49 1-4-2-6 La spectrométrie de masse (MS) 49
1-4-3 Les techniques couplées 50
1-4-3-1 HPLC-MS 50 1-4-3-2 HPLC-Diode Array Detection (DAD) 51
1-4-3-3 HPLC-DAD-MS 51 1-4-4 Méthodes d'analyse du potentiel antioxydant des anthocyanes 52
1-4-4-1 Les radicaux libres et les antioxydants 52 1-4-4-2 Capacité d'absorption des radicaux oxygènes (ORAC) 53
1-4-4-3 Capacité du plasma à réduire le fer ferrique (FRAP) 54 1-4-4-4 Capacité antioxydante équivalent trolox (TEAC) 54 1-5 CINÉTIQUE DE L'ACTION INHIBITRICE DES ANTIOXYDANTS 55
1-6 HYPOTHÈSES ET OBJECTIF 56
1-6-1 Hypothèses 56 1-6-2 Objectif 57
1-7 RÉFÉRENCES 58
CHAPITRE II
Anthocyanins in Wild Blueberries of Quebec: Extraction and Identification
2-1 RESUME 66 2-2 ABSTRACT 67 2-3 INTRODUCTION 68 2-4 MATERIALS AND METHODS 70
2-4-1 Plant Material 70 2-4-2 Chemicals 70 2-4-3 Anthocyanin extraction 70
2-4-4 Determination of monomeric and total anthocyanins and degradation index 71
2-4-5 Separation of the anthocyanin fraction 72
2-4-6 Anthocyanin quantification 72 2-4-6 Anthocyanin identification 73
2-4-7 Statistical analysis 73 2-5 RESULTS AND DISCUSSION 74
2-5-1 Extraction experiments 74 2-5-2 Extraction of anthocyanin from whole blueberry filter residue 77
2-5-3 Anthocyanin content and dry matter mass balances 77 2-5-4 Comparison of total anthocyanins determined by pH differential and by
HPLC-DAD 78 2-5-5 Anthocyanin peak identification 79
2-6 CONCLUSION 84 2-7 ACKNOWLEDGMENT 85
CHAPITRE III
Identification and Antioxidant Activity of Anthocyanins in Wild Blueberries of Quebec: Vaccinium angustifolium and Vaccinium myrtilloïdes
3-1 RESUME 101 3-2 ABSTRACT 102 3-3 INTRODUCTION 103 3-4 MATERIALS AND METHODS 105
3-4-1 Plant Material 105 3-4-2 Chemicals 105 3-4-3 Anthocyanin extraction 105
3-4-4 Separation of the anthocyanin fraction 106
3-4-5 Anthocyanin identification 106 3-4-5 Evaluation of antioxidant capacity 107
3-4-6 Statistical analysis 107 3-5 RESULTS AND DISCUSSION 108
3-5-1 Anthocyanin peak identification 108 3-5-2 Antioxidant capacity of anthocyanin extracted from V. angustifolium and V.
myrtilloïdes. 114
3-6 CONCLUSION 116 3-7 ACKNOWLEDGMENT 116
3-8 LITRATURE CITED 117
CHAPITRE IV
Antioxidant Activities of Anthocyanins from a mixture of Vaccinium angustifolium and Vaccinium myrtilloïdes and inhibition effect on //; vitro LDL oxidation
4-2 ABSTRACT 137 4-3 INTRODUCTION 138 4-4 MATERIALS AND METHODS 140
4-4-1 Plant Material 140 4-4-2 Chemicals 140 4-4-3 Anthocyanin extraction 140
4-4-4 Determination of total anthocyanins 141 4-4-5 Evaluation of total antioxidant capacity 141
4-4-6 Preparation of LDL 142 4-4-7 LDL Oxidation in vitro 142 4-4-8 Measurement of conjugated dienes and trienes 142
4-4-9 Measurement of hexanal by headspace Gas Chromatography (GC) 143
4-4-10 Statistical analysis 144 4-5 RESULTS AND DISCUSSION 144
4-5-1 Antioxidant capacity 144 4-5-2 Ability of extraction 18 anthocyanins to inhibit LDL oxidation 146
4-6 CONCLUSION 147 4-7 ACKNOWLEDGMENT 147
4-8 REFERENCES 148
CHAPITRE V
Inhibition of LDL Oxidation by Anthocyanins in Wild Blueberries of Quebec: Vaccinium angustifolium and Vaccinium myrtilloïdes
5-1 RÉSUMÉ 160 5-2 ABSTRACT 161 5-3 INTRODUCTION 162 5-4 MATERIALS AND METHODS 164
5-4-1 Plant Material 164 5-4-2 Chemicals 164 5-4-3 Anthocyanin extraction 164
5-4-4 Separation of the anthocyanin fraction 165
5-4-5 Preparation LDL 165 5-4-7 Measurement of conjugated dienes and trienes 166
5-4-8 Measurement of hexanal by headspace Gas Chromatography (GC) 166
5-4-9 Statistical analysis 167 5-5 RESULTS AND DISCUSSION 167
5-7 CONCLUSION 170 5-7 ACKNOWLEDGMENT 170
5-8 LITRATURE CITED 171
9 w
SYMBOLES
A Absorbance of either conjugated diene at 234 nm or conjugated triene at 268 nm; C Conjugated dienes or triene concentration (umole/L);
CH Hexanal concentration of control test (umole/L); L Path length of the cuvette (cm);
S Hexanal concentration of sample (umole/L); e Molar extinction coefficient (2.95. 104 M" ' cm" ' )
ACRONYMES Cy Cyanidine; Dp Delphinidin; Mv Malvidin; Pn Peonidin; Pt Petunidin
HPLC-DAD High Performance Liquid Chromatography-Diode Array Detection HPLC-ESI-MS/MS High Performance Liquid Chromatography-electrospray
LISTE DES TABLEAUX
CHAPITRE I
Tableau 1-1-Les anthocyanidines naturelles 38
CHAPITRE II
Table 2-1 - Anthocyanins" Recovered by Ethanol Extraction of Blueberries Under
Various Experimental Conditions 90 Table 2-2 - Dry Matter Recovery from Ethanol Extractions of Blueberries Under
Various Experimental Conditions 91 Table 2-3 - Anthocyanins Identified3 in a Mixture of V. angustifolium and V.
myrtilloïdes Berries 92
CHAPITRE III
Table 3-1 - Anthocyanins identifieda in berries of V. angustifolium 121 Table 3-2 - Anthocyanins identified8 in berries of V. myrtilloïdes 123
CHPITRE IV
Table 4-1 - Anthocyanins8 Recovered by Ethanol Extraction and experimental conditions and of the six extractions which yielded the highest amounts of
anthocyanins 152 Table 4-2 - Antioxidant capacity of the six extractions which yielded the highest
amounts of anthocyanins measured 10 minutes after the addition of antioxidant
CHAPITRE V
Table 5-1 - Inhibition of hexanal formation by anthocyanins extracted from V.
LISTE DES FIGURES
CHAPITRE I
Figure 1-1 Structure du cation flavylium ou 2-phénylbenzopyrilium 36 Figure 1-2 Transformations structurales des anthocyanes en milieu aqueux 39
Figure 1-3 Étapes de décoloration du DMPD 55
CHAPITRE II
Figure 2-1 -Comparison of total anthocyanins determined by the pH differential method and by the HPLC-DAD method for extraction extractions runs #7, 8,11,
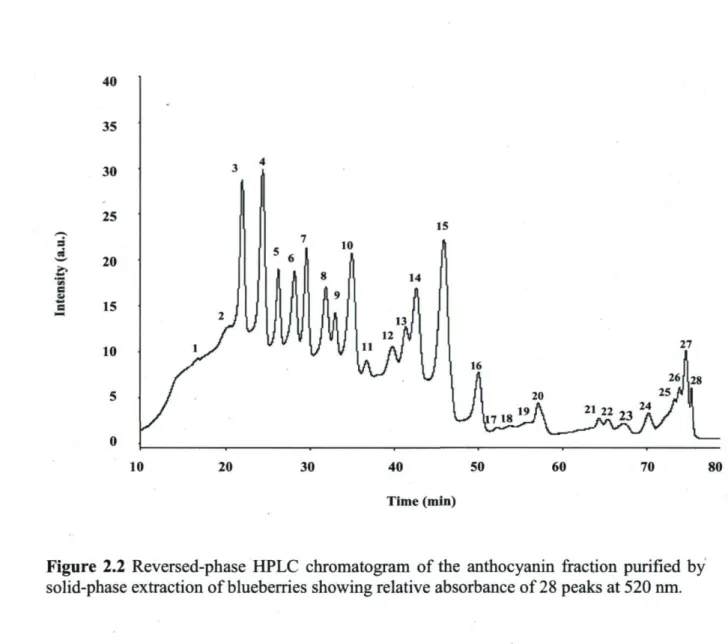
16,17 and 18 94 Figure 2-2-Reversed-phase HPLC chromatogram of the anthocyanin fraction purified
by solid-phase extraction of blueberries showing relative absorbance of 28 peaks
at520nm 95 Figure 2-3 spectra of A) peak 3, B) peak 4 and C) peak 5 (coeluted compounds 5,6,7
and 8) 96 Figure 2-4 MS fragmentation patterns of A) peak 17 and B) peak 18 97
Figure 2-5 Structures and major cleavage of new selected anthocyanins 98
CHAPITRE III
Figure 3-1 Reversed-phase HPLC chromatogram of the anthocyanin fraction of V. angustifolium purified by solid-phase extraction showing the relative absorbance
Figure 3-2 Reversed-phase HPLC chromatogram of the anthocyanin fraction of V. myrtilloïdes purified by solid-phase extraction showing the relative absorbance of
28 peaks at 520 nm 126 Figure 3-3 MS spectra of A) peak 1, B) peak 2 and C) peak 3 in the anthocyanin
fraction of V. angustifolium 127 Figure 3-4 MS fragmentation patterns of A) peak 4 (coeluted compounds 4,5,6 and 7)
and B) peak 21 in the anthocyanin fraction V. angustifolium 128 Figure 3-5 MS spectra of A) peak 1, B) peak 2 and C) peak 3 in the anthocyanin
fraction of V. myrtilloïdes 129 Figure 3-6 MS fragmentation patterns of A) peak 4 (co-eluted compounds 4, 5,6 and
7) and B) peak 18 in the anthocyanin fraction of V. myrtilloïdes 130 Figure 3-7 Structures of selected anthocyanins not previously reported common to
V. angustifolium and V. myrtilloïdes 131 Figure 3-8 Time course of the change in antioxidant activity of anthocyanin extracts of
V. angustifolium and V. myrtilloïdes adjusted to 91.21 mg/L of cyanidin
3-glucoside 133 Figure 3-9 Antioxidant activity of V. angustifolium and V. myrtilloïdes anthocyanin
extracts as a function of concentration * ...134
CHAPITRE IV
Figure 4-1 Time course of the change in antioxidant activity of anthocyanin extracts of
extractions 7 and 18 adjusted to 91.21 mg/L of cyanidin 3-glucoside 154 Figure 4-2 Antioxidant activities of anthocyanin extracts of extractions 7 and 18 as a
function of concentration 155 Figure 4-3 Inhibition of conjugated dienes formation of LDL incubated with 5
micromoles/L of a mixture V. angustifolium and V. myrtilloïdes anthocyanins
Figure 4-4 Inhibition of conjugated trienes formation of LDL incubated with 5 micromoles/L of a mixture V. angustifolium and V. myrtilloïdes anthocyanins
(Extraction 18) during Cu induced LDL in vitro oxidation 157 Figure 4-5 Inhibition effect of V. angustifolium and V. myrtilloïdes anthocyanins
extracts (Extraction 18) on hexanal formation during Cu 2+ induced LDL in vitro
oxidation 158
CHAPITRE V
Figure 5-1: Inhibition of conjugated dienes formation of LDL incubated with 5 micromoles/L of V. angustifolium anthocyanins during Cu 2+ induced LDL /'//
vitro oxidation 176 Figure 5-2: Inhibition of conjugated trienes formation of LDL incubated with 5
micromoles/L of V. angustifolium anthocyanins during Cu induced LDL /'/;
vitro oxidation 177 Figure 5-3 - Inhibition of conjugated dienes formation of LDL incubated with 5
micromoles/L of V. myrtilloïdes anthocyanins during Cu + induced LDL in vitro
oxidation 178 Figure 5-4 - Inhibition of conjugated trienes formation of LDL incubated with 5
micromoles/L of V. myrtilloïdes anthocyanins during Cu induced LDL in vitro
oxidation 179 Figure 5-5 - Inhibition effect of V. angustifolium and V. myrtilloïdes anthocyanins
INTRODUCTION GENERALE ET
Les consommateurs sont de plus en plus conscients de la valeur nutritive et de l'importance sur la santé des fruits et légumes frais qui fournissent plusieurs phytonutriments. Beaucoup d'entre eux possèdent des propriétés antioxydantes qui jouent un rôle critique dans la prévention des pathologies liées au stress oxydatif et aux radicaux libres, telles que les maladies cardiovasculaires, le cancer et les maladies neurodegeneratives. La génération des radicaux libres endogènes cause une accumulation de dommages oxydatifs se traduisant par un processus de vieillissement (Hensley et Floyd, 2002). Dans le but d'avoir un meilleur vieillissement, on observe depuis les années 90 qu'une frange de la population des sociétés modernes s'intéresse de plus en plus aux antioxydants alimentaires qui viendraient renforcer l'effet des antioxydants biologiques (la superoxyde dismutase, la catalase et la glutathion peroxydase) dans l'organisme. Un équilibre est maintenu entre les espèces radicalaires et les molécules ou protéines responsables de leur élimination dans l'organisme humain. Un déséquilibre en faveur des molécules oxydantes défini comme le stress oxydatif, peut alors contribuer au développement des maladies neurodegeneratives (Marksbery, 1997).
Récemment des preuves scientifiques provenant de plusieurs domaines tels que 1'epidemiologic, la recherche biomédicale et la nutrition ont suggéré que les antioxydants des fruits et légumes peuvent jouer un rôle important dans la réduction du risque des maladies neurodegeneratives telles que les maladies d'Alzaheimer et de Parkinson, les pathologies cardiovasculaires et cérebrovasculaires, les cancers variés et d'autres maladies neurologiques (Kalt et al, 1999).
Des travaux de recherche ont démontré qu'en plus des vitamines C, E et des caroténoïdes connus pour leur effet antioxydant, les fruits et légumes contiennent d'autres nutriments antioxydants tels que les polyphenols et les flavonoïdes contribuant significativement à leur capacité antioxydante totale (Cao et al., 1996; Wang et al, 1996). Par exemple, les flavonoïdes alimentaires, composés principalement de flavones, flavonols, catéchines, flavanones et anthocyanes sont des composés des fruits et légumes possédant de fortes capacités antioxydantes (Cao et a l , 1997; Wang et al., 1997).
L'importance des composés phénoliques comme antioxydants alimentaires a été récemment suggérée et recommandée par plusieurs groupes de recherche. Des études ont rapporté comment les composés phénoliques, notamment les flavonoïdes possédant des capacités antioxydantes substantielles (Prior et al., 1998) et apportant une contribution significative à l'alimentation (Hertog et al., 1993), peuvent réduire le risque des maladies cardiovasculaires (Schramm et German, 1998) en plus de posséder une plus grande stabilité comparativement à l'acide ascorbique (Miller et Rice-Evans, 1997). La capacité antioxydante des phytonutriments des fruits et légumes peut être en grande partie attribuée aux composés phénoliques, à d'autres composés flavonoïdes et aux anthocyanes (Cao et al,
1997).
Les travaux de Kalt et al. (1999) sur les fraises, les framboises et deux espèces de bleuet {Vaccinium corymbosum L. et Vaccinium angustifolium Aiton) ont montré que ces quatre fruits présentaient des capacités antioxydantes différentes fortement corrélées à leurs teneurs en composés phénoliques totaux (R2 =0.80) et à celles des anthocyanes (R2 =0.90). La capacité antioxydante des bleuets était trois fois plus importante que celle des deux autres fruits. D'après Kalt et al. (2001) les fortes concentrations d'anthocyanes des bleuets apportent une grande contribution à leur capacité antioxydante, particulièrement chez le bleuet nain {Vaccinium angustifolium Aiton). Selon des données récemment publiées par le Département Agricole des États-unis, le bleuet nain possède la plus grande capacité antioxydante comparativement à 20 autres fruits (Wu et a l , 2004). Les anthocyanes sont des pigments responsables des couleurs rouge, violette, et bleue des plantes et de la plupart des fruits, y compris le bleuet, bien que la couleur rouge de certains fruits tels que les oranges et les tomates est causée par les caroténoïdes. Comparé à d'autres fruits, le bleuet mûr présente une forte teneur en pigments anthocyanes, qui s'apparentent à sa profonde coloration (Kalt et Dufour, 1997).
L'intérêt croissant pour la substitution des antioxydants alimentaires synthétiques par les antioxydants naturels a stimulé la recherche sur les sources végétales et le criblage des matières premières pour identifier de nouveaux antioxydants, en particulier les fruits et légumes potentiellement riches en polyphenols tels que les anthocyanes.
Ces dernières avaient attiré dans un premier temps l'intérêt des scientifiques en tant que colorants alimentaires. Cependant, c'est surtout leur fonctionnalité dans la santé, plus précisément leur capacité antioxydante qui a suscité le plus grand intérêt. Ceci a conduit les chercheurs à développer des méthodes d'analyse dans le but d'avoir le maximum d'information dans l'extraction, l'identification, l'isolement et la quantification des anthocyanes provenant du règne végétal (Delgado-Vargas et al, 2000); mais aussi la mise au point de méthodes permettant d'évaluer la capacité des anthocyanes de neutraliser les radicaux libres ou de réduire les dommages cellulaires causés par ces derniers dans l'organisme et pouvant induire des maladies chroniques telles que celle de l'Alzheimer (Christen, 2000), des défaillances cardiaques (Diaz et a l , 1997) et divers cancers (Ames et a l , 1995).
L'étude de la caractérisation et de l'évaluation de l'action anti-oxydante des anthocyanes extraits des bleuets du Québec ainsi que leur rôle dans la prévention des maladies chroniques telle que les maladies cardiovasculaires et le cancer ne sont que très rarement ou pas du tout rapportées en profondeur dans la littérature. Pour palier à ce manque d'information l'objectif de ce projet se veut d'apporter une contribution originale dans ce domaine tout en s'appuyant sur les connaissances existantes. Pour cela des extraits d'anthocyanes provenant de deux espèces de bleuet sauvage Vaccinium angustifolium et
Vaccinium myrtilloïdes récoltées sans distinction de façon commerciale sur les plantes sauvages au Lac-St-Jean sont analysés.
Cette étude consiste, d'une part en l'extraction par solvant des anthocyanes à partir des deux espèces de bleuet mentionnées ci-dessus, l'élucidation de leurs structures chimiques par des techniques modernes, et d'autre part, des travaux d'investigation in vitro sur l'évaluation de leurs capacités antioxydantes qui est l'une de leurs propriétés biologiques la plus importante. De plus, cette thèse de doctorat concerne l'étude de la cinétique d'inhibition de l'action oxydante des radicaux libres dans des systèmes d'oxydation catalysés in vitro contenant des substrats ou molécules modèles telles que la lipoprotéine de faible densité (LDL) et des triglycérides en présence de molécules réductrices.
Ces molécules-modèles d'oxydation sont choisis car l'oxydation du LDL est un processus faisant partie du mécanisme du développement des maladies cardiovasculaires et celle des triglycérides étant appropriée aux systèmes alimentaires.
CHAPITRE I
1-1 LE BLEUET
1-1-1 Généralités
Le bleuet {Vaccinium sp.) est une baie originaire d'Amérique du Nord et d'Europe, appartenant à la famille des éricacées et au genre vaccinium. La production des bleuets au Canada est pratiquement limitée à l'Est du pays dont le climat tempéré convient parfaitement à cette plante indigène. Les amérindiens du Québec l'utilisaient en abondance pour améliorer les mets et incorporaient ses fruits dans la viande séchée et les galettes de pain banique (Hall et al, 1989).
Cinq espèces de bleuet poussent à l'état sauvage au Canada. Quatre appartiennent au type nain : l'airelle fausse-myrtille (Vaccinium myrtilloïdes Michx), Vaccinium boréale, l'airelle à feuilles étroites (Vaccinium angustifolium Ait.), l'airelle noire à feuilles étroites (Vaccinium angustifolium f. nigrum), et une autre au type géant : l'airelle en corymbe (Vaccinium corymbosum L.). Les fruits de chacune de ces espèces sont récoltés pour la vente commerciale, sauf peut être ceux du Vaccinium boréale (Hall et al,
1989). Le bleuet européen ou myrtille (Vaccinium myrtillus L.) est largement cultivé en Scandinavie, en Europe de l'Est et à des altitudes plus élevées en Europe du Sud (Kalt et Dufour, 1997).
1-1-2 Qualité nutritionnelle du bleuet
Le contenu en minéraux et vitamines du bleuet nain, du bleuet géant et de la myrtille a été rapporté (Bushway et a l , 1983; USDA, 1981). Ces espèces commerciales de bleuet possèdent une teneur d'acide ascorbique qui varie entre 7 et 20 mg, 1.3 mg de niacine et 46 ug de vitamine A pour un poids de 100 g de fruit à l'état frais.
Des teneurs relativement élevées en manganèse (8.15 mg/100 g) dans le bleuet nain ont été également rapportées (Bushway et al, 1983). Le manganèse est requis pour la synthèse de certaines métalloenzymes, comme par exemple la superoxyde dismutase.
1-1-3 Fonctionnalités du bleuet dans la santé
Le bleuet (Vaccinium sp.) a une longue histoire d'utilisation dans la médecine indigène et folklorique en Amérique du Nord et en Europe. Les premières utilisations médicinales de la myrtille datent du moyen âge où des fruits et des feuilles de myrtille ont été employés dans la médecine conventionnelle en Europe depuis le seizième siècle (Marazzoni et Bombardelli, 1996). Les fruits des myrtilles, de par leurs propriétés antiseptiques, ont été utilisés pour traiter les inflammations et les infections, combattre le scorbut et traiter les complications urinaires. Les feuilles de myrtille ont été aussi utilisées pour leurs propriétés anti-inflammatoires et antiseptiques pour réguler la glycémie à travers le traitement du diabète (Marazzoni et Bombardelli, 1996). La myrtille européenne a été décrite dans plusieurs pharmacopées, et son utilisation médicinale est la base de l'extension de l'industrie des produits pharmaceutiques et de santé en Europe et en Asie (Marazzoni et Bombardelli, 1996). En Amérique du Nord l'utilisation du bleuet géant (Vaccinium corymbosum L.) et du bleuet nain (Vaccinium angustifolium Ait.) par les indigènes a été rapportée très tôt par les colons Nord-américains.
1-1-3 Utilité dans l'infection de l'appareil urinaire
Bien qu'il n'existe aucune preuve scientifique apparente, l'acide hippurique contenu dans le jus de bleuet est rapporté comme étant le principe actif dans le traitement des infections de l'appareil urinaire causées par E. coli, qui adhère à la paroi de la vessie et l'appareil urinaire par leurs adhésines (désignées MS et MR) localisées sur les pilis, permettant ainsi une colonisation bactérienne massive (Ofeck et al, 1991). Les jus de fruit de Vaccinium contiennent un inhibiteur stable à la chaleur, résistant à la trypsine et non dialysable, qui agit comme une anti-adhésine bloquant la fixation des bactéries aux parois
de l'appareil urinaire et par conséquent réduisant l'infection bactérienne (Marazzoni et Bombardelli, 1996).
1-1-4 Les substances anticancerigènes
Les fruits de certaines espèces de Vaccinium ont été récemment rapportés pour contenir des polyphenols qui peuvent avoir des propriétés anticancerigènes (Bomser et al, 1996). Dans cette étude, des fruits de l'espèce Vaccinium ont été fractionnés et examinés in vitro dans un essai de criblage du potentiel anticancerigène des substances de ces fruits. Une fraction du fruit de Vaccinium était active en induisant une enzyme qui procure une protection contre les cancers xenobiotiques-induits (Bomser et al, 1996). Ce composé non identifié provenant des myrtilles était plus actif que celui du bleuet nain. Une autre fraction contenant de la proanthocyanidine était active en inhibant une enzyme caractéristique de la prolifération rapide des cellules cancéreuses, ce composé du bleuet nain était plus actif que celui de la myrtille. Ces résultats suggèrent que des composantes spécifiques de certaines espèces de Vaccinium peuvent posséder une activité anticancerigènes.
Aujourd'hui le bluet européen est utilisé dans une variété de produits pharmaceutiques et suppléments alimentaires recommandés pour le traitement du dysfonctionnement des vaisseaux sanguins et pour les traitements ophtalmologiques. Les anthocyanes, pigments qui donnent la coloration bleue aux bleuets, sont considérés comme les ingrédients les plus actifs de ces fruits (Kalt et Dufour, 1997).
1-2 LES ANTHOCYANES
1-2-1 Structures chimiques
Les anthocyanes (du Grec anthos, fleur et kyanos, bleue) ou glycosides d'anthocyanidines sont des polyphenols qu'on trouve aussi bien dans les fleurs que dans les fruits, auxquels elles fournissent un large spectre de couleurs variant de l'orange au bleu. Les anthocyanes font partie d'une famille de molécules ayant un squelette carboné de base à quinze atomes de carbone organisés en trois cycles identifiés par les lettres A, B, C (Figure 1.1). Les anthocyanes sont présentes dans la nature sous forme d'hétéroside dont l'aglycone ou anthocyanidine, est dérivé du cation flavynium ou 2-phénylbenzopyrilium (Figure 1.1) diversement hydroxylé. L'anthocyanidine peut être liée à une ou plusieurs molécules de sucres, lesquelles à leur tour peuvent être ou non acylées par différents acides organiques. La présence de ces groupements hydroxyles sur les cycles, ainsi qu'un ou plusieurs sucres rendent ces composés très solubles dans l'eau, l'éthanol et le methanol (Rivas-Gonzalo, 2003). Selon la littérature, 21 anthocyanidines ont été entièrement décrites, parmi lesquelles six sont largement répandues et couramment retrouvées dans les fruits et légumes. Ce sont : la pélargonidine, la cyanidine, la péonidine, la pétunidine, la delphinidine et la malvidinc (Tableau 1.1). Ces molécules possèdent le même squelette carboné de base du 2-phénylbenzopyrilium hydroxylé aux positions 3, 5, et 7, et diffèrent selon le nombre et la position des groupements hydroxyles et méthoxyles sur le cycle B.
Dérivant de ces anthocyanidines, un large éventail d'anthocyanes existe. Les anthocyanes diffèrent par la nature et le nombre de sucres attachés à l'aglycone et la position de ces liaisons, la nature et le nombre des acides aliphatiques ou aromatiques fixés aux résidus des sucres. Parmi les sucres les plus fréquents on rencontre les pentoses tels que le xylose, Farabinose et le rhamnose, et parmi les hexoses on trouve le glucose et le galactose. Ils sont attachés à l'aglycone par des liaisons a ou P de l'hydroxyle anomérique libre. Des di- et tri-saccharides comme groupements fonctionnels sont aussi courants, parmi lesquels les plus fréquents sont le rutinose (2-O-p-rhanonosyl-D-glucopyranose), le sophorose (2-0-|3-glucopyranosyl-D-glucopyranose), le 2 -xylosylrutinose et le «lueosylrutinose. Dans la nature, les anthocyanes hydroxylées en position 3 sont en règle générale toujours glycosyées. Lorsqu'il existe des groupements additionnels de sucres, ils occupent les positions 5 et/ou 7, et moins fréquemment les positions 3' et 5'. La 3-déoxyanthocyanidine, la carajurine et deux autres carajurines apparentées, récemment identifiées, sont les seules anthocyanidines connues de nos jours naturellement stables et sans substitution à la position 3 (Dévia et a l , 2002). Des anthocyanines inhabituelles portant des sucres seulement à la position 3' ont été également décrites par Fossen et Andersen (1999). Selon la littérature, aucune anthocyanine n'a été décrite avec plus de trois hydroxyles substitués sur la même molécule (Rivas-Gonzalo, 2003).
Les sucres attachés aux anthocyanes peuvent être substitués par des acides aliphatiques, hydroxybenzoïques et hydroxycinnamiques. Les plus fréquents sont l'acide acétique, malonique, p-coumarique et caféique. L'acylation avec l'acide oxalique, succinique, malique, /?-hydroxybenzoïque, gallique, vanillique, syringique, protocatéchuique, ferulique et sinapique est plus restreinte. La substitution des résidus d'acyle a lieu habituellement à la position 6 » des sucres. Bien qu'inhabituel, des groupements fonctionnels substitués à la position 3 » des sucres ont été également rapportés chez Allium victorialis (Andersen et Fossen, 1995).
Tableau 1.1-Les anthocyanidines naturelles.
Anthocyanidines Séquence de substitution Couleur à pH < 1
Anthocyanidines courantes Pelargonidine (Pg) Cyanidine (Cy) Delphinidine (Dp) Peonidine (Pn) Petunidine (Pt) Malvidine (Mv) 3, 5, 7 , 4 ' - O H 3, 5, 7, 3 ' , 4 ' - O H 3, 5, 7, 3', 4', 5 ' - O H 3 , 5 , 7 , 4 ' , 5 ' - O H ; 3 ' - O M e 3, 5, 7 , 4 ' - O H ; 3 ' - O M e 3, 5, 7, 4'-OH; 3', 5' - OMe Orange Orange-rouge Bleu-rouge Rouge Violet Violet
Me: groupement méthyle
(Rivas-Gonzalo, 2003 ; Mazza et Miniati, 1993)
Mazza et Miniati (1993), ont énuméré la plupart des anthocyanes connues. Néanmoins, les listes éditées sont toujours inachevées, car de nouvelles anthocyanes sont continuellement découvertes dans le règne végétal. Selon Andersen (2002), plus de 560 anthocyanes ont été décrites jusqu'ici.
1-2-2 Stabilité
Malgré leur pouvoir colorant, les anthocyanes sont peu utilisées dans l'industrie alimentaire et cosmétique, du fait de leur instabilité (perte ou changement de couleur) vis-à-vis de facteurs physico-chimiques comme la lumière, la température, le pH, ainsi que des réactions avec le dioxyde de soufre utilisé comme agent conservateur des aliments, de leur faible solubilité dans l'eau et d'une possible précipitation d'anthocyanes sous forme de complexes avec les protéines. La stabilité des anthocyanes augmente avec le nombre de groupements methoxyles sur le cycle B et diminue avec l'augmentation du nombre de groupements hydroxyles. Ainsi, parmi les anthocyanes les plus couramment rencontrées les plus stables sont la malvidine, suivie de la peonidine, la petunidine et la cyanidine.
En général les anthocyanes sont plus stables à pH acide. La glycocylation et l'acylation des sucres augmentent aussi la stabilité et, donc les diglycosides d'anthocyane sont plus stables que leurs monoglycosides correspondants (Rivas-Gonzalo, 2003). En solution aqueuse, les anthocyanes sont en équilibre sous forme de quatre structures basiques, le cation flavylium AH+, la base quinonique A, la pseudobase carbinol B et la chalcone C (Figure 2). La proportion de ces formes est principalement déterminée par le pH, avec l'ion flavylium prédominant en milieu très acide (pH < 2). Lorsque le pH augmente la plupart des ions flavylium de forte coloration rouge disparaissent rapidement par déprotonation des groupements hydroxyles en position 5, 7 et 4', pour donner d'autres types d'anthocyanes de couleur bleue, appelées bases quinoniques. A des valeurs de pH entre 3.5 et 4.5 le cation flavilium et la base quinonique coexistent, tandis qu'à pH 4.5-6.0 seules les bases quinoniques neutres sont présentes. Les bases quinoniques neutres et anioniques coexistent à des valeurs de pH approchant la neutralité et quand la température croit. En présence de solutions légèrement acides ou neutres, la pseudobase carbinol est transformée, conduisant ainsi à une chalcone ouverte (Rivas-Gonzalo, 2003).
o u O C
1-2-3 Propriétés biologiques des anthocyanes
En plus de leur rôle de colorants, les anthocyanes possèdent d'autres caractéristiques biologiques intéressantes. Plusieurs travaux font état des propriétés des anthocyanes, en particulier celles de la myrtille concernant leur bioactivité. Les anthocyanes ont été étudiées par rapport à plusieurs activités biologiques incluant la capacité antioxydante, l'effet sur la perméabilité et la fragilité des vaisseaux capillaires, l'agrégation des plaquettes de sang et l'effet sur le collagène (Kalt et Dufour, 1997).
La capacité antioxydante des anthocyanes peut être l'une de leurs propriétés biologiques la plus importante. La recherche épidémiologique et biomédicale suggèrent que les antioxydants diététiques contenues dans les fruits et légumes peuvent jouer un rôle important dans la prévention de certaines maladies (Wang et a l , 1996). Les dommages oxydatifs des lipides, protéines et acides nucléiques sont impliqués dans le développement des cancers, des maladies cardiovasculaires et autres désordres pathologiques. Les anthocyanes et les autres flavonoïdes apportent une contribution substantielle aux antioxydants totaux du régime alimentaire (Ramarathnam et Osawa, 1996). Les antioxydants flavonoïdes sont en soi plus stables que les antioxydants communément trouvés dans les fruits comme la Vitamine C (Miller et al, 1995). Les flavonoïdes agissent en tant qu'antioxydants en contrant l'effet des radicaux en leur donnant des électrons pour terminer la réaction en chaîne des radicaux libres (Ramarathnam et Osawa, 1996). La capacité antioxydante est influencée par le nombre d'hydroxyles sur le cycle B (Raajalakshmi et Narasimhan, 1996), de sorte que la delphinidine et la cyanidine sont les plus efficaces des anthocyanes connues (Marazzoni et Bombardelli, 1996). Tsuda et al, (1998, 1999) ont rapporté que la cyanidine 3-O-glucopyranoside (Cy-g), la principale anthocyane présente dans le jus des oranges pigmentées est l'un des antioxydants naturels les plus efficaces agissant en tant qu'oxydant et non comme un simple composé chelatant de métaux, en raison de son potentiel redox particulier (Amaroni et al, 2001). Cependant il a été aussi démontré que la Cy-g est un antioxydant potentiel dans deux modèles d'altération cellulaire et de tissu en cas de stress oxydatif aigu.
Ses effets sont de nature intracellulaire grâce à sa capacité d'imprégner la membrane plasmique des cellules du myocarde (Amaroni et al, 2003).
Les travaux de Fimognari et al. (2004) ont également indiqué que la Cy-g possède une activité anti-génotoxique in vitro, ce qui suggère son utilisation potentielle comme agent chimio-préventif.
Les anthocyanes des myrtilles possèdent un pouvoir inhibiteur sur l'agrégation des plaquettes du sang (Marazzoni et Magistretti, 1990). L'agrégation des plaquettes du sang dans les vaisseaux sanguins intervenant dans la thrombose (coagulation du sang) est un élément important dans le développement de l'athérosclérose (Beretz et Cazenave, 1988). Le myrtocyan® un complexe d'anthocyanosides de Vaccinium myrtillus (VMA) contenant environ 38 % d'anthocyanes, inhibe in vitro et in vivo l'agrégation des plaquettes de sang, le collagène et l'arachidonate de sodium. Dans ce processus d'anti-agrégation il a été observé que la cyanidine 3-O-glucoside, la delphinidine 3-O-glucoside et la malvidine 3-0-glucoside, trois des principaux anthocyanosides du myrtocyan® sont aussi actives dans l'inhibition de la coagulation in vitro (Marazzoni et Bombardelli, 1996). Les anthocyanes affectent l'adhérence des plaquettes directement et indirectement à travers des effets sur le métabolisme de la prostaglandine (Beretz et Cazenave, 1988). L'effet des anthocyanes sur le métabolisme de la prostaglandine peut être lié à l'activité de détente musculaire qu'elles exercent sur le muscle lisse vasculaire (Marazzoni et Bombardelli, 1996).
On rapporte également que les anthocyanes ont des effets directs et indirects sur le collagène, qui est l'élément protéique principal des tissus connectifs (tendons et cartilage). La structure réticulaire des anthocyanes renforce de ce fait la matrice du collagène. De plus elles sont rapportées comme étant des molécules bioactives inhibant les enzymes qui décomposent le collagène (Marazzoni et Bombardelli, 1996).
1-2-4 Applications cliniques des anthocyanes
Les premières études cliniques et pharmacologiques sur les extraits de V. myrtillus ont mis en évidence des propriétés intéressantes sur le système ophtalmique et vasculaire qui semblent être liées à la fraction anthocyanosidique. La plupart des études des années 60 jusqu'à 1996 ont été réalisées sur l'extrait de fruit de V. myrtillus possédant une basse concentration d'anthocyanosides et l'extrait de Myrtocyan® hautement purifié, contenant 38% d'anthocyanosides (Marazzoni et Bombardelli, 1996).
1-2-4-1 Activité ophtalmique
L'extrait de la myrtille, seul ou en association avec le P-carotène et la vitamine E, est rapporté pour améliorer l'acuité visuelle nocturne, aide à s'adapter le plus rapidement aux conditions de faible luminosité, et diminue le temps de récupération après un éblouissement luminaire. Suite à des essais cliniques réalisés sur des contrôleurs du trafic aérien, des pilotes et des conducteurs de camions, qui ont révélé le potentiel des extraits anthocyanosidiques à améliorer la vision nocturne, l'utilisation des anthocyanes a été recommandée à ce groupe de personnes actives et tous ceux qui souffrent de faible vision nocturne (Marazzoni et Bombardelli, 1996). L'extrait d'anthocyanes de la myrtille est rapporté comme ayant une action préventive contre le glaucome, et a montré une grande efficacité dans le traitement de la rétinopathie, y compris la rétinopathie diabétique (Marazzoni et Bombardelli, 1996; Pizzorno et Murray, 1987).
1-2-4-2 Action vasoprotective
Des essais cliniques ont démontré l'efficacité des extraits de myrtille dans le traitement des maladies vasculaires périphériques, c'est à dire que ces extraits ont permis la réduction de l'approvisionnement en sang des membres inférieurs de femmes enceintes souffrant d'insuffisance veineuse chronique. Et de plus, ces extraits se sont révélés utiles dans le traitement pré- et post-opératoire de la varice des veines et dans les phases aiguës d'hémorroïdes (Marazzoni et Bombardelli, 1996).
1-3 TECHNIQUES D'EXTRACTION DES ANTHOCYANES
1-3-1 L'extraction par solvant
Bien qu'il n'existe aucun protocole d'extraction qui peut être considéré de façon optimale pour tous les types d'échantillons, les méthodes les plus fréquemment utilisées pour extraire les composés phénoliques de leurs sources végétales pour des fins analytiques sont l'extraction par solvant et celle utilisant des fluides supercritiques.
La procédure la plus commune pour extraire les anthocyanes utilise des solvants tels que le methanol ou l'éthanol avec différentes proportions d'acide chlorhydrique (HC1 0.1-1%). L'utilisation d'un solvant organique a l'avantage d'inactiver les enzymes présentes dans les tissus végétaux et de faciliter le traitement subséquent de l'extrait obtenu, car il est facilement évaporé. Néanmoins, dépendant de la nature de l'échantillon, il peut s'avérer nécessaire d'ajouter de l'eau afin de réaliser une extraction complète des anthocyanes (Escribano-Baillon et Santos-Buelga, 2003). Pour une extraction des composés d'origine alimentaire, il est préférable d'utiliser l'éthanol car il est moins toxique, bien qu'il soit moins efficace dans l'extraction et plus difficile à éliminer plus tard. Des réactions d'estérification des groupements carboxyliques libres peuvent avoir lieu en présence d'éthanol, si le processus d'extraction est réalisé à haute température.
C'est le cas par exemple des malonyles conjugués des anthocyanes du maïs (de Pascual-Teresa et al, 2002).
Strack et Wray (1989) ont rapporté que pendant le procédé d'extraction et la concentration subséquente, l'acide chlorhydrique peut hydrolyser les anthocyanes fortement acylés, particulièrement celles liées à des acides aliphatiques. Pour cette raison, et afin de réaliser une meilleure extraction des anthocyanes labiles, des conditions acides plus douces comme celles obtenues avec l'acide acétique, tartrique ou citrique sont recommandées.
1-3-2 Technologie de l'extraction des anthocyanes pour les produits pharmaceutiques
La production d'extraits d'anthocyanes pour la fabrication des produits pharmaceutiques à l'échelle industrielle est conçue pour maximiser la productivité permettant d'obtenir des anthocyanes monomériques. La forte réactivité des molécules d'anthocyanes peut les dégrader ou leur faire subir des réactions pouvant détériorer leur qualité dans les formulations galéniques. Par exemple, une concentration élevée d'anthocyanes peut initier la formation des polymères inefficacement metabolises par l'organisme (Kalt et Dufour, 1997).
La première étape de ce procédé d'extraction consiste en une macération et une extraction aqueuse préliminaires de la peau et de la chaire des fruits et légumes. Ensuite les sucres libres contenus dans l'extrait obtenu sont metabolises par Saccharomyces sp. via une fermentation. L'extrait est alors clarifié et concentré, et une deuxième extraction de celui ci est effectuée avec de l'alcool acidifié. Le nouvel extrait est séché sous vide à basse température, le matériel sec résultant est ensuite écrasé, saupoudré et empaqueté. Alternativement, les anthocyanes sont stabilisées par un traitement au dioxyde de soufre (SO2) et séparées des autres composés par chromatographic non ionique. Le solvant est éliminé par evaporation pour avoir un extrait final contenant 25 % d'anthocyanes (Kalt et Dufour, 1997).
1-4 MÉTHODES D'ANALYSE DES ANTHOCYANES
1-4-1 Isolation et purification des anthocyanes
Il est difficile de séparer les différents anthocyanes d'un extrait puisque leurs squelettes carbonés de base des différentes aglycones diffèrent très peu les uns des autres. Pour cette raison, les techniques chromatographiques sont le choix par excellence, autant pour séparer les diverses fractions d'anthocyanes que pour obtenir des pigments purs qui permettront une identification et une quantification subséquentes (Escribano-Baillon et Santos-Buelga, 2003). La chromatographic en phase gazeuse (CPG) a été peu utilisée à cause de la volatilité limitée des polyphenols impliquant une étape supplémentaire de dérivation pour assurer la volatilité des composés. De plus, cette méthode nécessite une purification préalable de l'échantillon avant la dérivation. La chromatographic sur colonne et la chromatographic à contre courant ont été également utilisées pour séparer les fractions des diverses anthocyanes pour obtenir des pigments purs qui permettront une identification et une quantification subséquente. L'inconvénient de ces techniques chromatographiques énumérées ci-dessus, réside dans la difficulté de l'obtention d'anthocyanes pures en quantités suffisantes et l'exigence de longues périodes d'analyse (Hamerstone et a l , 1999).
La technique chromatographique de choix actuellement utilisée pour la purification et la séparation des anthocyanes est la chromatographic en phase liquide à haute performance (HPLC) (Harborne, 1998; Robard et Antolovich, 1997; Merken et Beecher, 2000). Celle-ci permet une séparation, une identification et une quantification simultanées sans exiger une pureté excessive des extraits. Comparativement à la CPG, elle permet une séparation rapide des échantillons. Cependant, une extraction par phase solide sur des cartouches C-18 ou Sephadex est couramment utilisée pour une purification initiale des extraits bruts d'anthocyanes avant l'analyse par HPLC. Les anthocyanes se lient fortement à ces adsorbants à travers leurs groupements hydroxyles non substitués et sont éluées en utilisant une série de solvants de polarité croissante. Étant donné la polarité des différents anthocyanes, l'analyse par HPLC en phase inverse est généralement effectuée en établissant
un gradient linéaire ou autre, entre une phase aqueuse suffisamment acidifiée et une phase organique (methanol, acétonitrile ou acétone), dont la proportion augmente continuellement au cours de l'analyse. Étant donné que chaque laboratoire de recherche a tendance à développer une méthode analytique pour des besoins spécifiques de séparation, il est impossible de décrire une seule méthode standard. L'HPLC étant une méthode largement utilisée, elle présente une meilleure sensibilité comparativement à la spectroscopic RMN à haute résolution, cependant, elle exige une préparation des échantillons avant les analyses (Kosir et Kidric, 2002).
La plupart des techniques énumérées jusqu'ici ont démontré une capacité à séparer adéquatement les anthocyanes, mais elles ont révélé une insuffisance quant à leur elucidation structurale.
1-4-2 Détection et identification des anthocyanes
Plusieurs techniques de caractérisation ont été utilisées pour obtenir des informations structurales nécessaires afin d'identifier les anthocyanes. Celles-ci incluent la spectrofluorométrie, la spectroscopic UV-visible, la spectroscopic de résonance magnétique nucléaire (RMN), la spectroscopic de résonance Raman, la spectroscopic infra rouge (IR) et la spectrométrie de masse.
1-4-2-1 La spectrofluorométrie
La malvidine 3,5- diglucosides et la peonidine émettent de la fluorescence lorsqu'elles sont illuminées par une lumière UV. Cette propriété peut être utilisée pour identifier les anthocyanes, spécialement quand on veut détecter leur présence en chromatographic sur couche mince (CCM). De plus la malvidine 3,5- diglucosides (malvine) à travers l'oxydation et un ajustement subséquent du pH dans des conditions alcalines, conduit à la formation de dérivés fluorescents. Cette propriété peut être utilisée pour détecter leur présence et de les quantifier. Bien que cette méthode soit qualitativement
efficace, elle ne permet pas d'obtenir résultats quantitativement fiables à cause des interférences dans la matrice de la réaction de fluorescence (Rivas-Gonzalo, 2003).
1-4-2-2 La spectroscopic UV Visible
Les propriétés spectrales UV-Visibles sont souvent très utiles pour la caractérisation des anthocyanes, spécialement pour identifier le type (Rivas-Gonzalo, 2003). Les anthocyanes présentent des maxima d'absorption dans la région du visible (510 - 528 nm, dans le cas de celles du vin) aussi bien dans la région de l'UV (270 - 280 nm). L'absorbance est due à la structure de l'hétérocycle central et la conjugaison des deux cycles aromatiques, et celle-ci est influencée par le pH et le type de solvant. Les groupements fonctionnels du cycle aromatique (cycle B) de l'ion oxonium peuvent aussi exercer une certaine influence sur l'absorbance, si bien que les anthocyanes qui possèdent deux groupements fonctionnels sur ce cycle (la cyanidine et la peonidine) possèdent des maxima d'absorption de 11 nm plus bas que celles avec trois groupements fonctionnels (la delphinidine, la petunidine et la malvidine). Ces différences demeurent identiques pour les aglycones et pour les mono- et di-glucosides. La substitution des groupements hydroxyles par des groupements méthoxyles sur le cycle B provoque un déplacement de l'absorption vers des longueurs d'onde plus courtes (effet hypsochrome), apportant ainsi une grande stabilité à la molécule. L'absorbance des anthocyanidines à l'exception de celle de la malvidine et la peonidine, peut subir aussi un déplacement de l'absorption vers des longueurs d'onde plus grandes (effet bathochrome) en présence de AICI3, une propriété caractéristique qui a souvent été utilisée comme critère de différenciation entre les différentes anthocyanes (Rivas-Gonzalo, 2003).
1-4-2-3 La résonance magnétique nucléaire (RMN)
Cette technique a été utilisée pour l'identification des anthocyanes, et elle a assurément permis une identification correcte. Néanmoins, la complexité des ces composés doit être prise en compte, due, avant tout, à la présence des sucres dans la molécule, ce qui
nécessite l'utilisation d'instruments capables de fournir une résolution suffisante afin d'avoir une bonne distribution des signaux des carbones et des protons dans le spectre RMN. D'un autre coté, il est nécessaire d'utiliser des milieux tels que le chlorure de deuterium (DC1) ou le CF3COOD, dans le but de déplacer les équilibres qui permettent d'avoir seulement des cations flavylium dans la solution, sinon il pourrait s'avérer compliqué d'obtenir un spectre à cause de la coexistence de plusieurs formes chimiques. L'utilisation de la spectroscopic RMN à une dimension (ID), à deux dimensions (2D) du *H et du 13C avec des méthodes de signaux larges permet d'avoir des distributions fiables des signaux de résonance *H et 13C pour les anthocyanes individuels dans le CD3OD qui serviront d'outil pour une identification particulière en analyse HPLC (Kosir et Kidric, 2002). Contrairement à l'HPLC, la préparation des échantillons est plus simple et moins longue en spectroscopic RMN. Un autre grand avantage de la RMN à haute résolution est la possibilité de détecter la résonance magnétique des différents noyaux présents dans une molécule dans différents environnements électroniques et spatiaux (Kosir et Kidric, 2002). A part les inconvénients déjà mentionnés, cette technique exige de grandes quantités de produit qui permettent d'obtenir des spectres suffisamment perceptibles par rapport aux bruits de fond, représantant un sérieux handicap dans l'identification des anthocyanes. De plus, il est nécessaire de travailler avec des composés purs, ce qui implique une isolation initiale très précise.
1-4-2-4 La spectroscopic de résonance RAMAN
C'est une technique qui utilise un rayon laser comme source de lumière. Lorsque celle-ci est absorbée par un échantillon, elle est essentiellement dispersée sans changement de la fréquence. Cependant une petite portion des protons incidents en diffusion, subit un changement de fréquence. La dispersion Raman qui est caractéristique de l'échantillon ne dépend pas de la fréquence d'excitation. Comme cette technique exige des concentrations très élevées d'anthocyanes et que le spectre obtenu doit correspondre à toutes les molécules présentes dans l'échantillon, son utilisation est donc limitée (Rivas-Gonzalo, 2003).