HAL Id: dumas-01842408
https://dumas.ccsd.cnrs.fr/dumas-01842408
Submitted on 18 Jul 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Neurodata : suivi longitudinal à un an d’une cohorte de
traumatisés crâniens admis en réanimation au CHU de
Caen
David Lhermitte
To cite this version:
David Lhermitte. Neurodata : suivi longitudinal à un an d’une cohorte de traumatisés crâniens admis en réanimation au CHU de Caen. Médecine humaine et pathologie. 2018. �dumas-01842408�
UNIVERSITÉ de CAEN NORMANDIE ---
FACULTÉ de MÉDECINE
Année 2017/2018
THÈSE POUR L’OBTENTION
DU GRADE DE DOCTEUR EN MÉDECINE
Présentée et soutenue publiquement le : 23 Février 2018
par
Monsieur David LHERMITTE Né le 28 décembre 1988 à Vannes (56)
:
Neurodata : suivi longitudinal à un an d’une cohorte de traumatisés crâniens admis en réanimation au CHU de Caen
Président : Monsieur le Professeur GERARD Jean-Louis
Membres : Monsieur le Professeur HANOUZ Jean-Luc Monsieur le Docteur GABEREL Thomas Monsieur le Docteur GAKUBA Clément Directeur de thèse : Dr GAKUBA Clément
U N I V E R S I T É D E C A E N · N O R M A N D I E
U F R S A N T É
Année Universitaire 2017 / 2018
Doyen
Professeur Emmanuel TOUZÉ Adjoint pédagogique Professeur Paul MILLIEZ
Assesseur recherche Professeur Guy LAUNOY Directrice administrative Madame Sarah CHEMTOB
PROFESSEURS DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. AOUBA Achille Médecine interne
M. AGOSTINI Denis Biophysique et médecine nucléaire
M. AIDE Nicolas Biophysique et médecine nucléaire
M. ALLOUCHE Stéphane Biochimie et biologie moléculaire
M. ALVES Arnaud Chirurgie digestive
M. BABIN Emmanuel Oto-Rhino-Laryngologie
M. BÉNATEAU Hervé Chirurgie maxillo-faciale et stomatologie
M. BENOIST Guillaume Gynécologie - Obstétrique
M. BERGER Ludovic Chirurgie vasculaire
M. BERGOT Emmanuel Pneumologie
M. BIBEAU Frédéric Anatomie et cytologie pathologique
M. BIENVENU Boris Médecine interne
Mme BRAZO Perrine Psychiatrie d’adultes
M. BROUARD Jacques Pédiatrie
M. BUSTANY Pierre Pharmacologie
Mme CHAPON Françoise Histologie, Embryologie
Mme CLIN-GODARD Bénédicte Médecine et santé au travail
M. COQUEREL Antoine Pharmacologie
M. DAO Manh Thông Hépatologie-Gastro-Entérologie
M. DAMAJ Ghandi Laurent Hématologie
M. DELAMILLIEURE Pascal Psychiatrie d’adultes
M. DENISE Pierre Physiologie
M. DERLON Jean-Michel Éméritat jusqu’au 31/08/2018 Neurochirurgie
Mme DOLLFUS Sonia Psychiatrie d'adultes
M. DREYFUS Michel Gynécologie - Obstétrique
M. DU CHEYRON Damien Réanimation médicale
M. DUHAMEL Jean-François Éméritat jusqu’au 31/08/2018 Pédiatrie
Mme ÉMERY Evelyne Neurochirurgie
M. ESMAIL-BEYGUI Farzin Cardiologie
Mme FAUVET Raffaèle Gynécologie – Obstétrique
M. FISCHER Marc-Olivier Anesthésiologie et réanimation
M. GÉRARD Jean-Louis Anesthésiologie et réanimation
M. GUILLOIS Bernard Pédiatrie
Mme GUITTET-BAUD Lydia Epidémiologie, économie de la santé et
prévention
M. HABRAND Jean-Louis Cancérologie option Radiothérapie
M. HAMON Martial Cardiologie
Mme HAMON Michèle Radiologie et imagerie médicale
M. HANOUZ Jean-Luc Anesthésiologie et réanimation
M. HÉRON Jean-François Éméritat jusqu’au 31/08/2018 Cancérologie
M. HULET Christophe Chirurgie orthopédique et traumatologique
M. HURAULT de LIGNY Bruno Éméritat jusqu’au 31/01/2020 Néphrologie
M. ICARD Philippe Chirurgie thoracique et cardio-vasculaire
M. JOIN-LAMBERT Olivier Bactériologie - Virologie
Mme JOLY-LOBBEDEZ Florence Cancérologie
Mme KOTTLER Marie-Laure Biochimie et biologie moléculaire
M. LAUNOY Guy Epidémiologie, économie de la santé et
prévention
M. LE COUTOUR Xavier Epidémiologie, économie de la santé et
prévention
Mme LE MAUFF Brigitte Immunologie
M. LEPORRIER Michel Éméritat jusqu’au 31/08/2020 Hématologie
M. LEROY François Rééducation fonctionnelle
M. LOBBEDEZ Thierry Néphrologie
M. MANRIQUE Alain Biophysique et médecine nucléaire
M. MARCÉLLI Christian Rhumatologie
M. MAUREL Jean Chirurgie générale
M. MILLIEZ Paul Cardiologie
M. MOREAU Sylvain Anatomie/Oto-Rhino-Laryngologie
M. MOUTEL Grégoire Médecine légale et droit de la santé
M. NORMAND Hervé Physiologie
M. PARIENTI Jean-Jacques Biostatistiques, info. médicale et tech. de
communication
M. PELAGE Jean-Pierre Radiologie et imagerie médicale
Mme PIQUET Marie-Astrid Nutrition
M. RAVASSE Philippe Chirurgie infantile
M. REZNIK Yves Endocrinologie
M. ROUPIE Eric Thérapeutique
Mme THARIAT Juliette Radiothérapie
M. TILLOU Xavier Urologie
M. TOUZÉ Emmanuel Neurologie
M. TROUSSARD Xavier Hématologie
Mme VABRET Astrid Bactériologie - Virologie
M. VERDON Renaud Maladies infectieuses
Mme VERNEUIL Laurence Dermatologie
M. VIADER Fausto Neurologie
M. VIVIEN Denis Biologie cellulaire
Mme ZALCMAN Emmanuèle Anatomie et cytologie pathologique
PROFESSEUR DES UNIVERSITÉS
M. LUET Jacques Éméritat jusqu’au 31/08/2018 Médecine générale
PROFESSEUR ASSOCIÉ DES UNIVERSITÉS A TEMPS PLEIN
M. VABRET François Addictologie
PROFESSEURS ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
M. de la SAYETTE Vincent Neurologie
Mme DOMPMARTIN-BLANCHÈRE Anne Dermatologie
Mme LESCURE Pascale Gériatrie et biologie du vieillissement
M. SABATIER Rémi Cardiologie
PRCE
Année Universitaire 2017 / 2018
Doyen
Professeur Emmanuel TOUZÉ Adjoint pédagogique Professeur Paul MILLIEZ
Assesseur recherche Professeur Guy LAUNOY Directrice administrative Madame Sarah CHEMTOB
MAITRES DE CONFERENCES DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. ALEXANDRE Joachim Pharmacologie clinique
Mme BENHAÏM Annie Biologie cellulaire
M. BESNARD Stéphane Physiologie
Mme BONHOMME Julie Parasitologie et mycologie
M. BOUVIER Nicolas Néphrologie
M. COULBAULT Laurent Biochimie et Biologie moléculaire
M. CREVEUIL Christian Biostatistiques, info. médicale et tech. de communication
Mme DEBRUYNE Danièle Éméritat jusqu’au 31/08/2019 Pharmacologie fondamentale
Mme DERLON-BOREL Annie Éméritat jusqu’au 31/08/2020 Hématologie
Mme DINA Julia Bactériologie - Virologie
Mme DUPONT Claire Pédiatrie
M. ÉTARD Olivier Physiologie
M. GABEREL Thomas Neurochirurgie
M. GRUCHY Nicolas Génétique
M. GUÉNOLÉ Fabian sera en MAD à Nice jusqu’au 31/08/18 Pédopsychiatrie
M. HITIER Martin Anatomie - ORL Chirurgie Cervico-faciale
M. LANDEMORE Gérard sera en retraite à partir du 01/01/18 Histologie, embryologie, cytogénétique
M. LEGALLOIS Damien Cardiologie
Mme LELONG-BOULOUARD Véronique Pharmacologie fondamentale
Mme LEPORRIER Nathalie Éméritat jusqu’au 31/10/2017 Génétique
Mme LEVALLET Guénaëlle Cytologie et Histologie
M. LUBRANO Jean Chirurgie générale
M. MITTRE Hervé Biologie cellulaire
M. REPESSÉ Yohann Hématologie
M. SESBOÜÉ Bruno Physiologie
MAITRES DE CONFERENCES ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
Mme ABBATE-LERAY Pascale Médecine générale
M. COUETTE Pierre-André Médecine générale
M. GRUJARD Philippe Médecine générale
M. LE BAS François Médecine générale
Remerciements
A Monsieur le Professeur Jean-Louis GERARD, Merci de me faire l’honneur de présider ce jury.
Merci pour la facilité avec laquelle vous partagez votre expérience clinique avec vos internes.
Soyez assuré de mon respect.
A Monsieur le Professeur Jean-Luc HANOUZ, Vous me faites l’honneur de juger cette thèse,
Merci pour votre enseignement tout au long de ces années d’internat. Soyez assuré de mon respect.
A Monsieur le Docteur Thomas GABEREL Tu me fais l’honneur de juger cette thèse,
C’est un plaisir de travailler avec toi au quotidien.
A Monsieur le Docteur Clément GAKUBA,
Tu m’as fait l’honneur de prendre la direction de cette thèse.
Merci de m’avoir donné gout à la recherche clinique, pour ta patience infinie avec moi !
A ma famille, mes amis,
Maman, Papa, merci de m’avoir soutenu tout au long de ces années, vous avez su me redonner confiance dans les moments de doutes.
A mes sœurettes, merci pour votre patience quand j’étais petit, d’avoir mis les fondations de ma mauvaise éducation (je me suis très bien chargé de la finir) !
A Marianne, partager ma vie avec toi est la meilleure chose qui me soir arrivée, je t’aime.
A tous les copains rennais, Alban, Céline, Yannou, Benj, Tif et les autres. Merci pour tous ces bons moments passés ensemble, il y en aura d’autres…
A tous les copains caennais, Paul, Marion, deb et François, et tous mes cointernes. Pour ces moments d’entraide au boulot ou ailleurs, et ces folles soirées à Caen ou ailleurs.
Laure, Ronan, et Arthur, votre vision de la vie et de l’avenir est un exemple pour moi, je vous souhaite tout plein de bonheur dans la vie
_-_-_-_-_-_-_-_-_-_-_-_
Je tiens à remercier également :
Tous les anesthésistes-réanimateurs du CHU de Caen, pour la patience dont vous avez fait preuve avec moi, votre professionnalisme et votre engagement auprès des patients resteront un exemple.
Toute l’équipe de réanimation médicale, et l’équipe de choc des internes du 16.30, Charlotte, Pierrot et Claire pour ce semestre riche en émotion et fous rires !
Les équipes paramédicales des blocs et réanimation qui ont guidé mes premiers pas d’interne, puis d’interne seniorisé, avec « tact et mesure » le plus souvent !
Abréviations
ACR : arrêt cardio respiratoire
DVE : dérivation ventriculaire externe GOS-E : Glasgow outcome scale extended HED : hématome extra-dural
HIP : hématome intra-parenchymateux HSD : hématome sous-dural
HTIC : hypertension intracrânienne
IRM : imagerie par résonnance magnétique LAD : lésions axonales diffuses
LCR : liquide céphalorachidien mRs : modified Rankin scale
NACO : nouveaux anticoagulants oraux PIC : pression intracrânienne
SFAR : société Française d’anesthésie réanimation SMUR : service d’aide médicale urgente
TC : traumatisme crânien TDM : tomodensitométrie
Tableaux et figures
Tableau 1 : classification de Marshall………6 Tableau 2 : Glasgow Outcome Scale Extended………..8 Tableau 3 : caractéristiques de la population étudiée………...………13 Tableau 4 : thérapeutiques mises en œuvre à l’admission au bloc des urgences……14 Tableau 5 : gestion de l’HTIC au cours du séjour……….….………...15 Figure 1 : diagramme de flux des patients………..………12 Figure 2 : pronostic des patients à la sortie de réanimation et à un an…….…………16
SOMMAIRE
I. Introduction ... 1
A. Aspects cliniques et physiopathologiques du TC ... 1
1. Épidémiologie et étiologie... 1
2. Différents types de lésions cérébrales... 1
a. Lésions primaires ... 2
b. Lésions secondaires ... 2
c. Les agressions cérébrales secondaires d’origine systémique (ACSOS) ... 3
B. Classification des traumatisés crâniens ... 4
C. Principes de prises en charge ... 4
1. Les 24 premières heures ... 4
2. En réanimation ... 5
3. Imagerie ... 5
4. Chirurgie ... 6
D. Pronostic des TC ... 7
II. Objectifs ... 9
III. Matériel et méthodes ... 9
A. Aspects éthiques ... 9
B. Type d’étude ... 9
C. Critères d’inclusion, de non inclusion, d’exclusion... 9
D. Recueil de données ...10
IV. Résultats ... 12
A. Inclusion des patients ...12
B. Caractéristiques de la population étudiée ...13
C. Traitement à la prise en charge initiale ...14
D. Prise en charge de l’HTIC ...14
E. Evolution en réanimation ...15 V. Discussion ... 17 VI. Conclusion ... 20 Conflits d’intérêts ... 20 Bibliographie ... 21 Annexes ... 24
1
I. Introduction
A. Aspects cliniques et physiopathologiques du TC
1. Épidémiologie et étiologie
Le traumatisme crânien (TC) est une des premières causes d’hospitalisation aux urgences. En Europe, on estime que 1,5 million de personnes sont hospitalisées pour ce motif chaque année (tout âge et gravité de traumatisme confondus), et environ 57000 personnes en meurent chaque année. (1)
L’épidémiologie des TC de l’adulte évolue. Si dans les années 1970-1990 les TC étaient secondaires à des chocs violents (accidents de la voie publique, rixes) chez des patients jeunes et sans comorbidité (2), il existe depuis plusieurs années une augmentation de la prévalence des TC graves chez les personnes de plus de 65 ans. Ces traumatismes sont souvent de plus faible cinétique (chute de la hauteur) mais aggravés par la prise d’anticoagulants ou antiagrégants plaquettaires (3). Chez les personnes âgées aux plus lourds antécédents et avec une capacité de récupération réduite, le pronostic vital et fonctionnel est beaucoup plus réservé.
Les TC graves arrivent fréquemment chez les jeunes actifs, les conséquences sociales et économiques sont donc importantes : en Europe, il est estimé qu’environ 375 années de vie perdues par an sont dues aux traumatismes crâniens (7)
2. Différents types de lésions cérébrales
Le TC est secondaire à un choc au niveau de la boîte crânienne, ce qui entraîne des dommages au cerveau, soit directs au point d’impact (lésions de coup) soit au côté opposé à l’impact, dus à la collision du cerveau contre la paroi osseuse à l’intérieur de la boîte crânienne (lésions de contrecoup).
Les lésions post-traumatiques peuvent être classées en fonction du moment de leur apparition : les lésions primaires résultent directement du choc traumatique et comprennent des lésions focales (fractures du crâne, contusions, hématomes,
2 hémorragies intracrâniennes, ...) ainsi que des lésions axonales diffuses (LAD). Ces lésions primaires vont initier des cascades physiopathologiques, telles que la neuro-inflammation, ce qui va aboutir à la constitution des lésions dites secondaires (dommages dus à l'augmentation de la pression intracrânienne (PIC), l’ischémie cérébrale, l’œdème et l’inflammation). Elles se développent dans les heures et les jours qui suivent l’impact et se constituent à distance du point de l’impact.
a. Lésions primaires
Les lésions primaires apparaissent dans les suites directes du TC et sont maximales dans les 4 heures qui suivent. En fonction de la cinétique du choc elles peuvent être focales ou diffuses.
- Lésions cérébrales focales :
o Hématome sous-dural (HSD)
C’est une collection sanguine constituée entre la dure-mère et le cerveau o Hématome extra-dural (HED)
Il s’agit d’une collection sanguine qui se développe entre la table interne de la boite crânienne et la dure-mère.
o Hématome intra-parenchymateux (HIP)
C’est une collection sanguine, intra-cérébrale provenant d’un foyer de contusion - Lésions cérébrales diffuses :
o Pétéchies hémorragiques
o Hémorragie sous arachnoïdienne o Lésions axonales diffuses
Chaque traumatisme crânien peut entrainer une ou plusieurs de ces lésions formant un tableau clinico-radiologique initial complexe.
b. Lésions secondaires
Les lésions secondaires sont l’ensemble des lésions qui apparaissent dans les suites du traumatisme. Elles débutent juste après le choc et sont maximales 24-48h
3 après. Elles sont secondaires à l’activation de cascades moléculaires pro-inflammatoires :
- Œdème cérébrale
La boite crânienne est une structure à volume limité, non extensible. Il existe trois compartiments intracrâniens distincts : le parenchyme cérébral, le liquide céphalo-rachidien (LCR), et le sang.
45 minutes après le TC, 2 types d’œdèmes cérébraux vont se développer :
Un œdème interstitiel, secondaire à la rupture de la barrière hémato-encéphalique, et un œdème intra-cellulaire, secondaire à des mécanismes inflammatoires.
Ces œdèmes sont les principaux responsables de l’augmentation de la pression intracrânienne (PIC)
- Ischémie reperfusion
L’augmentation de la PIC et les lésions vasculaires (dissections, ruptures, thromboses) vont engendrer des lésions d’ischémie focales ou diffuses sur le parenchyme cérébral. Un mécanisme anaérobie va alors se mettre en place, favorisant la synthèse de radicaux libres et la destruction cellulaire. Des plages plus ou moins importantes de nécroses tissulaires vont alors se former.
c. Les agressions cérébrales secondaires d’origine systémique (ACSOS)
Au cours de la prise en charge des TC graves, un certain nombre de paramètres physiologiques vont être modifiés, soit du fait du TC lui-même, soit du fait d’autres lésions ou comorbidités. Parmi ces désordres physiologiques, certains vont aggraver les lésions cérébrales déjà existantes d’une manière significative (6) :
- Hypoxémie - Hypotension - Hypocapnie / hypercapnie - Anémie - Acidose - Hyperthermie - Hypoglycémie / hyperglycémie
4 L’ensemble de ces facteurs ont un rôle très important sur la survie et le pronostic fonctionnel des TC graves (4,5). Ces facteurs sont un des objectifs principaux des équipes d’anesthésie-réanimation et SMUR qui prennent en charge des TC graves. Parmi cette liste, l’hypotension et l’hypoxie artérielle sont des facteurs indépendants de mortalité (6).
B. Classification des traumatisés crâniens
Classiquement, les TC sont classés en fonction du score de Glasgow. Ainsi le TC grave est défini pour un score de Glasgow ≤ 8, un TC modéré pour les scores de Glasgow compris entre 9 et 13, et TC léger pour les scores ≥ 14.
Ce score permet de définir rapidement la gravité des TC mais il faut, d’une part répéter l’examen le plus souvent possible afin de diagnostiquer rapidement une aggravation neurologique, mais aussi notifier la composante motrice du score de Glasgow ainsi que la taille et la réactivité pupillaire (8). En effet, ces deux éléments sont les éléments les plus prédictifs d’une évolution neurologique péjorative retrouvés dans les analyses multivariées des études IMPACT et CRASH (4)
C. Principes de prises en charge
1. Les 24 premières heures
La prise en charge pré-hospitalière et des 24 premières heures des TC graves est très bien codifiée par des recommandations formalisées d’experts de la Société Française d’Anesthésie-Réanimation (SFAR) (8).
Les thérapeutiques engagées dans le cadre de l’urgence ont deux objectifs : - Limiter l’aggravation des lésions primaires, et si possible les traiter - Prévenir l’apparition des lésions secondaires
Le traitement médical vise à préserver l’homéostasie cérébrale en luttant contre les ACSOS, éviter les pics d’hypertension intracrânienne en optimisant la sédation, et si besoin en administrant une osmothérapie par mannitol ou sérum salé hypertonique.
5 Cette prise en charge s’inclue dans une stratégie plus globale chez les patients polytraumatisés chez lesquels un choc hémorragique se surajoute souvent au TC.
2. En réanimation
En réanimation, après les 24 premières heures et la phase de stabilisation des lésions, une période de surveillance active va débuter avec :
- Maintien d’une sédation minimale efficace pour une PIC satisfaisante - Poursuite du contrôle des ACSOS
- Surveillance des complications et aggravations neurologiques par des examens cliniques répétés, monitorage de la PIC et réalisation de doppler transcrânien. - Soins de nursing intenses en prévention des complications de décubitus et des
attitudes vicieuses.
- Prévention et traitement des complications de réanimation le plus précoce possible.
La problématique principale des patients traumatisés crâniens graves, après les premiers jours et le contrôle de la PIC, réside dans l’évolution neurologique et son caractère imprévisible. Pour chaque patient se posera la question de la qualité du réveil, et les séquelles neurologiques. De ces facteurs découleront des discussions éthiques notamment en cas de coma profond sans espoir de récupération.
3. Imagerie
L’examen d’imagerie réalisée en première intention est le scanner cérébral. Souvent réalisé dans le cadre d’un scanner corps entier injecté dans le contexte d’un patient polytraumatisé, il permet rapidement d’évaluer les lésions primaires, de poser une éventuelle indication chirurgicale et, grâce à l’injection de produit de contraste, de diagnostiquer une éventuelle dissection des vaisseaux du cou.
La classification de Marshall (13) est une aide diagnostique et pronostique pour les équipes médicales
6 Tableau 1 : classification de Marshall
4. Chirurgie
La prise en charge neurochirurgicale a deux fonctions principales :
- Évacuer un hématome intracrânien compressif. Les équipes s’appuient pour cela sur les recommandations de la SFAR qui préconisent un geste chirurgical en cas d’HED symptomatique, d’HSD significatif et en cas d’embarrure ouverte (8)
Catégorie Définition Mortalité
Lésions diffuses type I Pas de signe d’atteinte cérébrale 6%
Lésions diffuses type II
- Citernes de la base présentes - Déviation de la ligne médiane <5mm - Pas de lésion hyperdense ou en
mosaïque >25mm
11%
Lésions diffuses type III
- Citernes comprimées ou absentes - Déviation de la ligne médiane <5mm - Pas de lésion hyperdense ou en
mosaïque >25mm
29%
Lésions diffuses type IV
- Déviation de la ligne médiane >5mm - Pas de lésion hyperdense ou en
mosaïque >25mm
44%
Lésions avec effet de masse opérées type V
- Toutes lésions évacuées
chirurgicalement 30%
Lésions avec effet de masse non opérées type VI
- Lésions hyperdenses ou en mosaïque
7 - Contrôler la pression intracrânienne, en dérivant une partie du LCR par une dérivation ventriculaire externe (DVE). Cette technique n’a jamais été corroborée par des essais cliniques prospectifs (9) mais demeure recommandée en dépit d’un faible niveau de preuve d’efficacité - comme l’ensemble des thérapeutiques luttant contre l’HTIC - dans les référentiels français et nord-américain (8,10). La craniectomie décompressive est un geste envisagé lors des situations d’hypertension intracrânienne (HTIC) réfractaire secondaire à un œdème cérébral majeur. Les différentes études réalisées à ce sujet ont retrouvé une diminution de la mortalité. Cependant, ce gain semble obtenu au coût d’une augmentation du nombre de comas végétatifs (11,12). De ce fait, les recommandations françaises proposent une discussion au cas par cas en fonction de la clinique et du pronostic du patient.
D. Pronostic des TC
Pour l’évaluation et le pronostic des patients à 1 an, l’échelle la plus communément employée est la Glasgow Outcome Scale Extended (GOS-E). Il s’agit d’une échelle fonctionnelle qui classe les patients en 8 catégories de bonne récupération au décès (tableau 1). Elle est établie au moyen d’un questionnaire standardisé proposé au patient, ou à défaut à un proche au cours d’un entretien (annexe 1). Cette échelle est la plus utilisée pour le pronostic à moyen ou long terme dans les études sur les TC (impact, RESCUEicp…).
8
Glasgow Outcome Scale Description
1 Décès
2 Etat végétatif persistant
3.1 Handicap sévère niveau inférieur
3.2 Handicap sévère niveau supérieur
4.1 Handicap modéré niveau inférieur
4.2 Handicap modéré niveau supérieur
5.1 Bonne récupération niveau inférieur 5.2 Bonne récupération niveau supérieur Tableau 2 : Glasgow Outcome Scale Extended
En sortie de réanimation, les patients sont le plus souvent évalués selon l’échelle de Glasgow Outcome Scale, classant la sévérité de handicap de 1- décès - à 5 - Bonne récupération de niveau supérieur -. Cette échelle moins fine que le GOS-E permet une évaluation grossière à la sortie de réanimation
9
II. Objectifs
L’objectif de ce travail est d’étudier une cohorte prospective de patients traumatisés crâniens admis au bloc des urgences puis secondairement en réanimation au CHU de Caen afin d’établir leur pronostic à 1 an.
III. Matériel et méthodes
A. Aspects éthiques
Il s’agit d’une étude observationnelle. Aucune intervention n’a été nécessaire. Le recueil prospectif d’informations liées à la prise en charge et à l’évolution des patients neurolésés admis au sein du pôle réanimations-anesthésie-SAMU-SMUR du CHU de Caen a fait l’objet d’une lettre d’information au Comité de Protection des Personnes nord-ouest III avec avis favorable de ce comité (référence CPP : A12-D35-VOL13 ; référence CHU : NEURODATA).
B. Type d’étude
Nous avons mené une étude de cohorte prospective au sein du service d’anesthésie-réanimation du CHU de Caen.
C. Critères d’inclusion, de non inclusion, d’exclusion
Tous les patients adultes traumatisés crâniens admis au bloc des urgences et/ou admis en réanimation au CHU de Caen entre le 29 novembre 2015 et le 31 décembre 2016 ont été inclus. Les patients mineurs au moment du traumatisme crânien n’étaient pas inclus.
10 D. Recueil de données
Les données étaient recueillies à l’aide d’un cahier de recueil. Le cahier suivait le patient durant toute la durée de son séjour en réanimation médicale et chirurgicale. Le suivi a été réalisé par une consultation du dossier médical et par contact téléphonique à 1 an.
Pour chaque patient, nous avons recueilli les données suivantes :
- Les caractéristiques démographiques (âge, sexe, indice de masse corporelle, catégorie socioprofessionnelle)
- Les antécédents médicaux principaux - Un comportement addictif
- Les traitements antérieurs à l’admission : anti-hypertenseur, statine, insuline, metformine, autre antidiabétique oral, antiagrégants plaquettaires (AAP), antivitamine K (AVK), nouvel anticoagulant oral (NACO)
- Les données de l’examen neurologique initial : score de Glasgow, présence ou non d’une anomalie pupillaire (mydriase bilatérale ou anisocorie).
- Le délai entre l’heure du traumatisme et l’admission au premier hôpital, puis au CHU de Caen.
- Les défaillances présentes à l’admission au CHU de Caen (neurologique, ventilatoire, circulatoire, rénale), et le score de Glasgow à la prise en charge. - Les thérapeutiques engagées au bloc des urgences
Au cours du séjour en réanimation : - L’Indice de Gravité Simplifié (IGSII)
- Le recours à la ventilation mécanique invasive - Le recours à la sédation et la durée de sédation - La durée de séjour en réanimation
- Le recours à une craniectomie décompressive
- La mise en place d’une dérivation ventriculo-externe, d’une trachéotomie, d’une gastrostomie d’alimentation
11 - La survenue d’un sepsis (pneumopathie, méningite ou autre)
- La décision collégiale de limitation des thérapeutiques
- Le décès du patient, la cause du décès (secondaire à une limitation des thérapeutiques ou non)
- La mort encéphalique et le prélèvement multi-organes (PMO) Après le séjour en réanimation :
- Le GOS à la sortie de réanimation. Lors du rappel à un an :
Pour les patients vivants : - Lieu de vie
- Ré-hospitalisation - Reprise du travail - GOS-E
Pour les patients décédés - Date et lieu du décès - Cause du décès
12
IV. Résultats
A. Inclusion des patients
Entre le 30 novembre 2015 et le 31 décembre 2016, la recherche auprès du département d’informatique médicale nous a permis de retrouver 1814 patients admis en réanimation médicale et chirurgicale. Les patients avec un TC admis au bloc des urgences puis transférés en réanimation étaient inclus au bloc des urgences. Cent douze patients ont fait l’objet d’une évaluation pour inclusion dans la cohorte. Au terme de cette évaluation, une décision de non-inclusion a été retenue pour 13 patients : 4 traumatismes rachidiens sans TC, 2 patients avec un polytraumatisme sans TC, et 7 patients dont ni l’anamnèse, ni l’imagerie n’a permis de retrouver de TC. Au total 99 patients ont été inclus dans la cohorte.
Figure1 : diagramme de flux des patients
5 perdus de vue 1814 patients admis en réanimation médicale et
chirurgicale entre le 30/11/2015 et le 31/12/2016 112 patients évalués 13 patients Exclus - 4 traumatismes rachidiens - 2 polytraumatismes - 7 absence de TC à postériori 99 patients inclus 94 patients évalués à un an
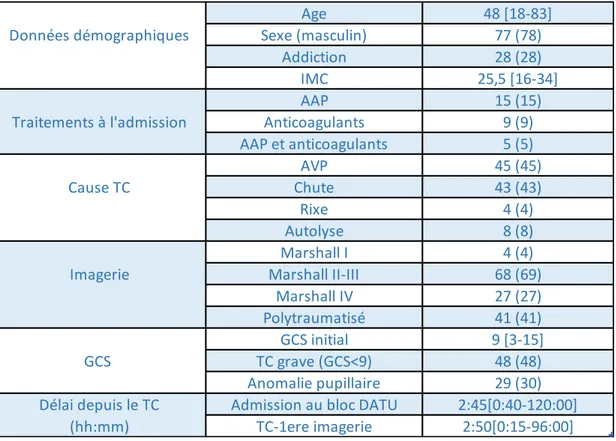
13 B. Caractéristiques de la population étudiée
L’âge médian est de 48 [18 ; 83] ans avec une nette prédominance masculine (sexe ratio 3,3 - Tableau 3). Le score de Glasgow médian en pré-hospitalier est de 9 [3 ; 15]. Le mécanisme du TC est pour 45% (n=45) un accident de la voie publique, 43% (n=43) une chute, 8% (n=8) une autolyse et 4%(n=4) une rixe. Quinze (15%) patients étaient sous antiagrégants plaquettaires, 9 (9%) sous anticoagulants (AVK ou NACO) et 5 (5%) avaient une association anticoagulants et AAP au moment du TC. La durée médiane entre le TC et l’admission au bloc des urgences était de 2h45 minutes [0h40min-120h]. Au premier scanner, 4 (4%) patients étaient de la classe I de MARSHALL, et 68 (69%) étaient de la classe II ou III. Enfin 41 (41%) des patients étaient polytraumatisés (patients avec au moins une autre lésion mettant en jeux le pronostic vital confirmé au scanner).
Tableau 3 : caractéristiques de la population étudiée
Données exprimées en effectif (pourcentage) et médiane [minimum ; maximum] IMC : indice de masse corporelle, AAP : antiagrégants plaquettaires
AVP : accident de la voie publique, GCS : Glasgow coma scale, TC : traumatisme crânien
Age 48 [18-83]
Données démographiques Sexe (masculin) 77 (78)
Addiction 28 (28)
IMC 25,5 [16-34]
AAP 15 (15)
Traitements à l'admission Anticoagulants 9 (9)
AAP et anticoagulants 5 (5) AVP 45 (45) Cause TC Chute 43 (43) Rixe 4 (4) Autolyse 8 (8) Marshall I 4 (4)
Imagerie Marshall II-III 68 (69)
Marshall IV 27 (27)
Polytraumatisé 41 (41)
GCS initial 9 [3-15]
GCS TC grave (GCS<9) 48 (48)
Anomalie pupillaire 29 (30)
Délai depuis le TC Admission au bloc DATU 2:45[0:40-120:00]
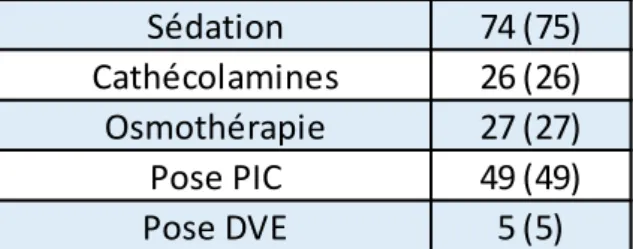
14 C. Traitement à la prise en charge initiale
A leur arrivée au bloc des urgences, 33 (33%) patients avaient transité par un centre hospitalier général. 74 (74%) patients étaient sédatés à l’arrivée au CHU. A la phase initiale de la prise en charge, 49 (49%) patients ont bénéficié de la pose d’un capteur de PIC, et 5 (5%) d’une DVE. Durant la prise en charge pré-hospitalière et au bloc des urgences 27 (27%) patients ont reçu une osmothérapie, principalement pour anomalie pupillaire. En effet, 19 (19%) patients ont eu au moins un épisode d’anisocorie et 10 (10%) un épisode de mydriase bilatérale. Enfin, 4 (4%) patients ont présenté un ACR
Tableau 4 : thérapeutiques mises en œuvre à l’admission au bloc des urgences
Données exprimées en effectif (pourcentage) PIC : Pression intracrânienne,
DVE : Dérivation ventriculaire externe
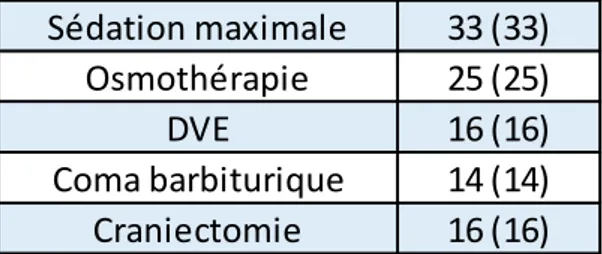
D. Prise en charge de l’HTIC
Cinquante-sept (58%) patients ont bénéficié de la pose d’un capteur de PIC. Quarante-neuf (49%) à la prise en charge initiale et 8 (8%) durant leur séjour en réanimation. La PIC médiane à la pose était de 10mmHg [0-29]. Trente-deux (32%) vont présenter au moins un épisode d’HTIC ainsi traité :
- 33 (33%) ont reçu une sédation maximale - 25 (25%) ont reçu de l’osmothérapie
- 16 (16%) ont bénéficié de la pose d’une DVE (5 (5%) à l’arrivée au bloc des urgences, et 11 (11%) durant leur séjour en réanimation)
- 16 (16%) ont bénéficié d’une craniectomie décompressive.
Sédation 74 (75)
Cathécolamines 26 (26)
Osmothérapie 27 (27)
Pose PIC 49 (49)
15 Par ailleurs, 30 (30%) patients ont bénéficié de l’évacuation d’un hématome intracrânien à l’admission au bloc des urgences ou lors de leur séjour en réanimation.
Tableau 5 : gestion de l’HTIC au cours du séjour.
Données exprimées en effectif (pourcentage) et médiane [minimum ; maximum]
HTIC : hypertension intracrânienne, PIC : pression intracrânienne, DVE : dérivation ventriculaire externe
E. Evolution en réanimation
Lors de leur arrivée en réanimation, 83 (84%) patients étaient sédatés sous ventilation mécanique. L’IGS médian calculé à la 24ème heure était de 44 [11-128]. La complication la plus fréquente était le sepsis pour lequel 39 (39%) patients ont été traités. Soixante-dix (71%) patients ont reçu des amines vasopressives. Onze (11%) patients ont bénéficié d’examens électrophysiologies ou d’imagerie pour retard de réveil (potentiels évoqués somesthésiques et visuels, électroencéphalogramme, imagerie par résonnance magnétique (IRM)). La durée médiane de séjour était de 10 [0-96] jours. Durant le séjour en réanimation, 33 (33%) patients sont décédés. Treize (13%) sont passés en mort cérébrale et 11 (11%) ont fait l’objet d’un PMO (1 patient contre-indiqué, 1 patient étant opposé de son vivant). Dix-sept (17%) ont fait l’objet d‘une discussion éthique amenant à un arrêt ou une limitation des thérapeutiques actives. En sortie de réanimation, 57 (58%) patients avaient un pronostic défavorable (GOS≤3) et 42 (42%) avaient un pronostic favorable (GOS≥4).
Sédation maximale 33 (33)
Osmothérapie 25 (25)
DVE 16 (16)
Coma barbiturique 14 (14)
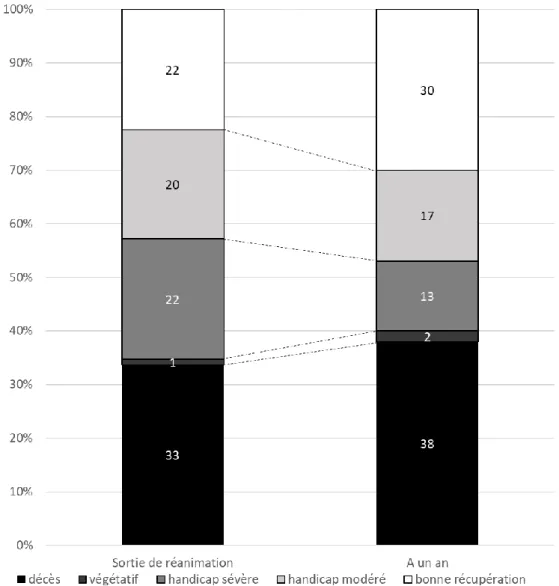
16 F. Pronostic des patients à un an
A un an 5 patients sont perdus de vue. Deux patients étaient décédés depuis la sortie de réanimation, tous les deux après décision d’un arrêt des thérapeutiques actives. Cinquante-trois (53%) patients vivaient à leur domicile et 7 (7%) vivaient en institution.
Deux (2%) patients étaient dans un état végétatif, 12 (13%) présentaient un handicap sévère, 16 (17%) un handicap modéré et 28 (30%) une bonne récupération. L’ensemble de ces résultats est résumé dans la figure 2
Figure 2 : pronostic des patients à la sortie de réanimation et à un an Données exprimées en pourcentage
17
V. Discussion
Notre travail est la première cohorte prospective de traumatisés crâniens au CHU de Caen, centre de référence pour un bassin de population de 1 479 000 habitants. Un tiers de la cohorte développe une HTIC secondairement et un patient sur trois est décédé au terme du séjour en réanimation. A un an, la moitié de la cohorte présente un pronostic jugé favorable.
Les patients polytraumatisés représentent 41% de notre cohorte pour lesquels nous n’avons pas récupéré de score de sévérité tel que l’injury severity score, dont la cotation nous aurait aidés à évaluer la gravité de cette population. En effet, un patient ayant une lésion extra-neurologique sévère (amputation, paraplégie…) aurait un GOS diminué pour une cause autre que neurologique. Cependant, aucun patient n’est décédé d’une cause autre que neurologique, et aucun n’a nécessité d’épuration extra-rénale. Les études internationales sur les TC ne référencent pas systématiquement de score pronostique spécifique aux patients polytraumatisés.
Nous savons que notre travail ne représente pas la totalité des TC graves survenus sur la période en Basse-Normandie. En effet, une partie des patients décèdent avant d’arriver à l’hôpital, et certains patients, au-delà de toutes ressources thérapeutiques ne sont pas transférés au CHU. Pour évaluer réellement la mortalité due aux TC, il faudrait donc réaliser une recherche grâce aux données des certificats médicaux de décès pour obtenir des résultats exhaustifs sur la mortalité des TC en Normandie. Ce type de recueil a été réalisé en 1986 dans la région Aquitaine.
Par ailleurs, nous ne pouvons éliminer l’hypothèse que certains patients n’aient pas été inclus dans le registre notamment les patients décédant rapidement après le début de leur prise en charge du fait d’un oubli des investigateurs, principalement lors de la mise en place du registre. Cependant compte-tenu du recensement annuel réalisé des traumatismes crâniens admis dans le service, ce nombre de patients manquants est faible (100 à 120 traumatisés crâniens admis par an en réanimation).
Pour réaliser l’évaluation neurologique des patients en sortie de réanimation, nous avons utilisé le GOS. Cette échelle n’est pas adaptée pour l’évaluation hospitalière étant conçu pour évaluer les patients dans leur environnement propre. Cependant, la majorité des études sur les TC utilisent ce score et s’en servent comme
18 base pour juger de l’évolution des patients. Cette échelle tout à fait adaptée pour le suivi des patients à un an, nous permet d’objectiver l’évolution des patients durant l’année qui a suivi le TC.
L’âge médian des patients de notre cohorte est de 48 ans. Depuis les premières cohortes sur les TC des années 1960 (17), cet âge ne fait que progresser. Si les premières cohortes des années 1970-1980 montraient un âge moyen de 30 à 36 ans, il était de 46 ans dans l’étude POCON de 2009. La proportion de patients âgés semble très importante dans notre travail. Plus de la moitié (51%) des patients ont plus de 45 ans, comparativement à PariS-TBI, qui n’en retrouve que 25%. Plusieurs raisons peuvent être proposées pour expliquer cela. La première est la diminution du nombre d’accidents de la voie publique, qui touche principalement les jeunes. La deuxième, est le vieillissement de la population, chez qui la cause principale de TC est la chute, dont le pronostic est aggravé par la prise d’anticoagulants ou d’anti-agrégants plaquettaires. En effet, dans notre travail, 45% des TC sont secondaires à un AVP, ils sont 68% dans la cohorte PariS-TBI et étaient environ 60% dans les anciennes cohortes internationales (17).
L’algorithme de prise en charge de l’HTIC chez le TC grave n’est pas encore parfaitement défini, la place de la DVE et de la craniectomie n’étant que des grades 2+ dans les dernières recommandations françaises (8). Il est intéressant de noter que 16% des patients ont bénéficié d’une craniectomie (précoce ou tardive). Cependant, ces craniectomies semblent être des craniectomies précoces, secondaires à l’évacuation d’un hématome intracrânien, et non afin de traiter une HTIC apparue secondairement comme dans la plupart des dernières études à ce sujet. Les études internationales font état de 10% de craniectomie tardive dans les études, ce chiffre est inférieur dans notre cohorte.
La mortalité de réanimation est inférieure à la mortalité retrouvée dans d’autres cohortes françaises telles que PariS-TBI qui est de 52% (16). Les chiffres que l’on retrouve dans la littérature sur les grandes cohortes internationales montrent aussi une mortalité qui se situe autour de 45% (17). Cette différence tient essentiellement au fait que nous n’avons pas inclus nos patients en fonction de la gravité du TC mais de leurs orientations dans un service de réanimation, le TC pouvant n’être qu’un épiphénomène d’un polytraumatisme ou un TC grave isolé. Ainsi, dans notre cohorte, la mortalité en
19 réanimation des patients avec un GCS initial <9 est proche de celle des cohortes internationales (44%).
Nous avons choisi d’inclure dans notre travail tous les patients traumatisés crâniens admis en réanimation au CHU de Caen. Cette inclusion n’est donc pas basée sur les critères cliniques habituels mais nous permet facilement de connaitre le devenir de tous les patients admis en réanimation, de définir quelles thérapeutiques ont été utilisées et de valider les prises en charge réalisées au sein du service.
La faible proportion de patients avec un pronostic neurologique défavorable à un an, nous permet d’évaluer la qualité du travail de prise en charge global des patients neurolésés, du lieu de l’accident jusqu’à la rééducation. Et d’autre part nos choix d’arrêts des thérapeutiques actives semblent être confortés par ces résultats. Cependant, les discussions éthiques sont souvent difficiles à prendre. Le développement de l’IRM fonctionnelle sera, dans les années à venir, une aide précieuse pour éviter les patients en état végétatif mais aussi pour conforter un arrêt des thérapeutiques chez des patients sans espoir de réveil.
Actuellement, il existe peu de recommandations de grade A au sujet de la prise en charge des TC en réanimation. Cette cohorte permet de recueillir des données préliminaires à la réalisation de futurs travaux de recherche. C’est un prérequis indispensable à la réalisation d’essais randomisés contrôlés qui nous permettrait d’évaluer une technique particulière telle que la DVE dans la prise en charge du patient traumatisé crânien.
Enfin, cette cohorte nous permettra d’évaluer l’incidence annuelle des TC dans la région Basse Normandie ainsi que leur degré de handicap. Dans l’hypothèse de la création d’un réseau régional de prise en charge des TC, du lieu de l’accident au centre de rééducation, nous pourrons nous appuyer sur cette étude pour évaluer les besoins régionaux en structures de soins.
20
VI. Conclusion
Notre travail montre que la population des TC admis en réanimation évolue, avec sur les dernières années une tendance au vieillissement de la population. La mortalité reste importante, malgré les progrès thérapeutiques. L’objectif dans les années à venir sera d’évaluer et de valider scientifiquement les thérapeutiques de prise en charge de l’HTIC en cours d’évaluation mais aussi des moyens de monitorage dont peut bénéficier chaque patient.
Conflits d’intérêts
21
Bibliographie
1. Roozenbeek B, Maas AIR, Menon DK. Changing patterns in the epidemiology of traumatic brain injury. Nat Rev Neurol [Internet]. 2013;9(4):231–6.
2. Gaastra B, Longworth A, Matta B, Snelson C, Whitehouse T, Murphy N, et al. The ageing population is neglected in research studies of traumatic brain injury. Br J Neurosurg [Internet]. 2016;30(2):221–6.
3. Majdan M, Plancikova D, Brazinova A, Rusnak M, Nieboer D, Feigin V, et al. Epidemiology of traumatic brain injuries in Europe: a cross-sectional analysis. Lancet Public Heal [Internet]. 2016 Dec [cited 2017 Jan 9];1(2):e76–83.
4. Murray GD, Butcher I, McHugh GS, Lu J, Mushkudiani NA, Maas AIR, et al. Multivariable Prognostic Analysis in Traumatic Brain Injury: Results from The IMPACT Study. J Neurotrauma [Internet]. 2007;24(2):329–37.
5. Utomo WK, Gabbe BJ, Simpson PM, Cameron PA. Predictors of in-hospital mortality and 6-month functional outcomes in older adults after moderate to severe traumatic brain injury. Injury. 2009;40(9):973–7.
6. Manley G. Hypotension, Hypoxia, and Head Injury. Arch Surg [Internet]. 2001;136(10):1118.
7. Majdan M, Plancikova D, Maas A, Polinder S, Feigin V, Theadom A, et al. Years of life lost due to traumatic brain injury in Europe: A cross-sectional analysis of 16 countries. PLoS Med. 2017;14(7):1–19.
8. Geeraerts T, Velly L, Abdennour L, Asehnoune K, Audibert G, Bouzat P, et al. Prise en charge des traumatisés crâniens graves à la phase précoce (24 premières heures). J Eur des Urgences Reanim. 2017;29(2):167–92.
22 9. Stocchetti N, Maas AIR. Traumatic intracranial hypertension. N Engl J Med
[Internet]. 2014;370(22):2121–30.
10. Carney N, Totten AM, OʼReilly C, Ullman JS, Hawryluk GWJ, Bell MJ, et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 2016;
11. Hutchinson PJ, Kolias AG, Timofeev IS, Corteen EA, Czosnyka M, Timothy J, et al. Trial of Decompressive Craniectomy for Traumatic Intracranial Hypertension. N Engl J Med . 2016;375(12):1119–30.
12. Cooper DJ, Rosenfeld J V., Murray L, Arabi YM, Davies AR, D’Urso P, et al. Decompressive Craniectomy in Diffuse Traumatic Brain Injury. N Engl J Med . 21 avr 2011;364(16):1493-502.
13. Wilson Jtl, Pettigrew L, Teasdale, Wilson J, Slieker F, Legrand V, et al. Glasgow Outcome Scale Observer variation in the assessment of outcome in traumatic brain injury: experience from a multicenter, international randomized clinical trial. J Neurotrauma J Neurotrauma Neurosurg . 1998;1561(1581):587–97.
14. Marshall LF, Marshall SB, Klauber MR, et al. A new classification of head injury based on computed tomography. J Neurosurg. 1991;75(1S):14–20.
15. Fayol P, Carrière H, Habonimana D, Preux PM, Dumond JJ. Version française de l’entretien structuré pour l’échelle de devenir de Glasgow (GOS): Recommandations et premières études de validation. Ann Readapt Med Phys. 2004;47(4):142-56.
23 16. Jourdan C, Bosserelle V, Azerad S, Ghout I, Bayen E, Aegerter P, et al. Predictive factors for 1-year outcome of a cohort of patients with severe traumatic brain injury (TBI): results from the PariS-TBI study. Brain Inj 2013;27(9):1000–7
17. Andriessen TMJC, Horn J, Franschman G, van der Naalt J, Haitsma I, Jacobs B, et al. Epidemiology, Severity Classification, and Outcome of Moderate and Severe Traumatic Brain Injury: A Prospective Multicenter Study. J Neurotrauma [Internet]. 2011; 28 (10):2019–31.
18. Grindlinger GA, Skavdahl DH, Ecker RD, Sanborn MR. Decompressive craniectomy for severe traumatic brain injury: clinical study, literature review and meta-analysis. Springerplus. Springer International Publishing; 2016;5(1).
24
Annexes
« Par délibération de son Conseil en date du 10 Novembre 1972, l’Université n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ou mémoires. Ces opinions doivent être considérées comme propres à leurs auteurs ».
VU, le Président de Thèse
VU, le Doyen de la Faculté
VU et permis d’imprimer en référence à la délibération
du Conseil d’Université en date du 14 Décembre 1973
Pour le Président
de l’Université de CAEN et P.O Le Doyen
TITRE DE LA THESE : Neurodata : suivi longitudinal à un an d’une cohorte de
traumatisés crâniens admis en réanimation au CHU de Caen
Introduction :
L’épidémiologie des traumatismes crâniens (TC) se modifie avec le vieillissement de la population et les progrès en accidentologie routière. De plus, les thérapeutiques évoluent avec l’adoption de récents consensus. A l’échelle nationale, peu de données épidémiologiques sont disponibles concernant le pronostic des TC.
Méthodes
Etude observationnelle prospective monocentrique après avis favorable du comité de protection des personnes. Sont inclus les TC adultes admis au bloc des urgences afin d’étudier leur pronostic en sortie de réanimation et à un an. Un pronostic est jugé favorable pour un score sur l’échelle du devenir de Glasgow (GOS) ≥4.
Résultats
Entre le 30/11/2015 et le 31/12/2016, 99 patients ont été inclus. Parmi eux, 48 (48%) présentaient un score de Glasgow initial ≤8 et 41 (41%) un polytraumatisme. Une hypertension intracrânienne a été diagnostiquée chez 32 (32%) patients. En sortie de réanimation, la mortalité était de 33% et 42 (42%) patients ont présenté une évolution favorable. A un an le GOS médian était de 3 [1-5], avec 14 (15%) patients présentant un handicap sévère et 44 (47%) une évolution favorable.
Conclusion
Nous constatons une mortalité moindre par rapport aux données de la littérature avec la persistance d’un handicap lourd à un an. Ces premières données épidémiologiques propres au CHU de Caen nous permettront à l’avenir de mieux informer les patients et les familles quant aux évolutions possibles au terme du séjour en réanimation et de préparer des études destinées à améliorer le pronostic de ces patients.