UNIVERSITÉ
llAVAL
L'absence des kératines 8/18 augmente la
résistance des cellules hépatocytaires au stress
oxydant par une modulation de l'association de
l'hexokinase à la mitochondrie
Mémoire
Nicolas Prud'homme
Maîtrise en biologie cellulaire et moléculaire
Maître es sciences (M.Sc.)
Québec, Canada
Résumé
Le foie, en tant qu'organe exerçant un rôle prédominant dans le métabolisme de plusieurs substances, tels le glucose, les médicaments et les xénobiotiques, constitue une cible de prédilection pour le stress oxydant. Les kératines (K), protéines de la famille des filaments intermédiaires (FI) retrouvées dans le tissu epithelial, englobent une vingtaine de protéines du cytosquelette regroupées en type I (K9-23) et type II (Kl-8). Leur expression implique différentes paires type I/type II, corrélant avec l'état de différenciation des cellules épithéliales. Chez les hépatocytes, principales cellules constituant le parenchyme hépatique, ainsi que chez les cellules d'hépatome, les K8/K18 sont les seuls FI retrouvés. La présente étude vise à définir le mécanisme permettant aux cellules de l'hépatome H4IIE-C3 dépourvues de K8/K18 (shK8b) de résister plus efficacement au stress oxydant produit par un surplus de H2O2 que les mêmes cellules possédant les K8/K18 (H4ev). Les résultats montrent que la résistance des shK8b au H2O2 ne provient pas d'une altération dans l'activation de voies signalétiques en réponse au stress oxydant. Par contre, le taux de glucose présent dans le milieu de culture affecte de manière différentielle la survie des H4ev versus shK8b au H2O2. De plus, une augmentation du niveau d'hexokinases en surface des mitochondries des shK8b corrèle avec la résistance de ces cellules au H2O2. Par ailleurs, une perturbation de cette association donne lieu à une augmentation de la sensibilité chez les shK8b se rapprochant du niveau observé chez les H4ev, tout en déclenchant une sortie du cytochrome c issu des mitochondries. Dans l'ensemble, les résultats obtenus suggèrent fortement que la résistance des shK8b au stress oxydant est principalement due à une altération dans l'utilisation du glucose, en lien avec l'association plus importante d'hexokinases aux mitochondries.
Table des matières
RÉSUMÉ
LISTE DES TABLEAUX IV
LISTE DES FIGURES V
LISTE DES ABRÉVIATIONS VI
REMERCIEMENTS VIII
INTRODUCTION 1
1 STRUCTURE LOBULAIRE, COMPOSITION CELLULAIRE ET FONCTIONS DU FOIE 1
1.1 LES CONSIDÉRATIONS ANATOMIQUES 1 1.2 DES DONNÉES HISTOLOGIQUES 2
1.3 L'HÉPATOCVTE 3 1.4 LES MULTIPLES FONCTIONS HÉPATIQUES 3
2 LE MÉTABOLISME DU GLUCOSE 4 2 . 1 LE TRANSPORT TRANSMEMBRANAIRE DU GLUCOSE 5
2.2 LES HEXOKINASES ET LE GLUCOSE-6-PHOSPHATE 6 2.3 LES SENTIERS MÉTABOLIQUES DÉCOULANT DE LA FORMATION DU G6P 7
2.4 LES HÉPATOCYTES ET L'HOMÉOSTASIE DU GLUCOSE 10 2.5 LA SIGNALISATION INTRACELLULAIRE DE L'INSULINE 12
2.6 LE MÉTABOLISME ET LE CANCER 13 2.7 LES MALADIES MÉTABOLIQUES DU FOIE 14
3 LE STRESS OXYDANT 17
3.1 SYSTÈMES ANTIOXYDANTS CELLULAIRES 17
3.2 LA SIGNALISATION DÉPENDANTE DU H2O2 18
3.3 LA MORT CELLULAIRE DÉPENDANTE DU H202 19
3.4 LE PORE DE LA PERMÉABILITÉ MITOCHONDRIALE TRANSITIONNELLE 20
3.5 LES HK, LA MORT CELLULAIRE ET LE CANCER 23
4 LES FILAMENTS INTERMÉDIAIRES 24
4.1 LES KÉRATINES 26 4.2 LES KERATINES, LES MALADIES HEPATIQUES ET LE CANCER 3 0
5 LE CONTEXTE DU PROJET DE RECHERCHE 32
MATÉRIEL ET MÉTHODES 34
RÉSULTATS 40
DISCUSSION 60
BIBLIOGRAPHIE 66
Liste des tableaux
Liste des figures
Figure 1. Schématisation de la circulation sanguine et biliaire du foie Figure 2. Le lobule hépatique
Figure 3. L'hépatocyte
Figure 4. La voie métabolique de la glycolyse Figure 5. Le cycle de Krebs
Figure 6. Synthèse du GSH
Figure 7. Représentation schématique des FI et de leur assemblage
Figure 8. La perte des K8/K18 mène à l'augmentation de la résistance des cellules au stress oxydant
Figure 9. La perte de K8/K18 affecte les signalisations intracellulaire et mitochondriale lors d'un stress oxydant
Figure 10. Les hépatomes sont plus résistantes au stress oxydant en présence de concentrations physiologiques de glucose
Figure 11. Le CTZ augmente la sensibilité des shK8b au stress oxydant Figure 12. L'association de HKI à la mitochondrie est diminuée par le CTZ
Figure 13. Le CTZ permet la libération du cyt c dans le cytoplasme des shK8b lors d'un stress oxydant
Liste des abréviations
18F-FDG : 18F-fluorodeoxyglucose 3-Br : 3-bromopyruvate ADP : Adenosine diphosphate
ANT : Adenine nucleotide translocator ASH : Stéatose hépatique alcoolique ATP : Adenosine triphosphate
BCIE : Bullous congenital ischtyosiform erythroderma CAT : Catalase
CsA : Cyclosporine A CTZ : Clotrimazole CyP-D : Cyclophiline D cyt c : Cytochrome c Ap : Proton motive force Da : Dalton DAG : Diacylglycérol
DMEM : Dulbecco's modified Eagle high glucose medium DRP1 : Dynamin-related protein 1
EBS : Epidermolysis bullosa simplex ECM : Matrice extracellulaire
ER : Reticulum endoplasmique FI : Filaments intermédiaires g-GSC : g-glutamylcystéine synthetase G6P : Glucose-6-phosphate G6Pase : Glucose-6-phosphatase GK : Glucokinase GLUT : Transporteur de glucose GPx : Peroxydase au glutathion GS : Glycogène synthase GSH : Glutathion
GSK-3 : Glycogène synthase kinase-3 H2O2 : Peroxyde d'hydrogène
H4 : Hépatome de rat de la lignée H4IIE-C3 H4ev : Cellules H4 transfectées avec un vecteur vide HCC : Carcinome hépatocellulaire
HK : Hexokinase HRPO : Horseradish peroxydase
IMM : Membrane mitochondriale interne IR : Récepteur de l'insuline
1RS : Substrat du récepteur de l'insuline JNK : Kinase c-jun-N-terminal
K : Kératine Km : Constante de Michaelis LDH : Lactate déshydrogénase
MAPK : Mitogen-activated protein kinase MCD : Dystrophic cornéenne de Meesmann MDB : Corps de Mallory-Denk
MFN1 : Mitofusin 1
MPT : Perméabilité transitionnelle mitochondriale
MPTP : Pore de perméabilité transitionnelle mitochondriale NADPH : Nicotinamide adenine dinucléotide phosphate NAFLD : Stéatose hépatique non alcoolique
NASH : Stéatohépatite non alcoolique OMM : Membrane mitochondrial externe OPA1 : Optic atrophy 1
P70 S6K : p70 S6-kinase
PI3K : Phosphatidylinositol-3-kinase
PIP3 : Phosphatidylionsitol-(3,4,5)-triphosphate PKA : Protéine kinase A
PKC : Protéine kinase C
ROS : Espèces réactives d'oxygène SDS : Dodécylsulfate de sodium
shK8b : Cellules H4 ayant subit un knockdown de la K8 shRNA : ARN tige-boucle
SOD : Superoxyde dismutase
SREBP-lc : Sterol regulatory element binding protein-le SUMO : Small ubiquitin-like modifier
TEP : Tomographic par émission de positrons TNF : Tumor necrosis factor
TRADD : TNF receptor 1-associated death domain VDAC : Voltage dependant anion channel
UV : Rayonnement ultraviolet
Remerciements
Les présents travaux ont été réalisés dans le cadre du programme MD/M.Sc. de l'Université Laval. J'aimerais remercier en premier lieu le Dr Normand Marceau, mon directeur de recherche, qui a accepté d'entreprendre cette aventure plutôt exigeante avec moi et de me faire cheminer comme aucun autre directeur de recherche n'aurait pu le faire. Son dynamisme, son expérience et son humanité ont rendu mon cheminement des plus agréables. J'aimerais aussi remercier le Dr. Stéphane Gilbert qui, au travers des différentes années passées au sein du laboratoire, a su me prodiguer de très nombreux et judicieux conseils en plus de me soutenir à certaines occasions et de m'inviter à me dépasser afin que je tire le maximum de cette expérience. J'espère qu'il aura la chance d'enseigner encore longtemps à d'autres étudiants, car sa pédagogie et son approche font de lui un excellent mentor. J'aimerais également remercier Dre Anne Loranger qui, tout au cours de mes études au 2e cycle, m'a apporté une aide très précieuse afin de résoudre les problèmes, petits comme importants, auxquels je devais faire face. Mme Loranger est une scientifique comme il ne s'en fait plus et je sais que si je suis parvenu à mes fins, c'est en grande partie grâce à elle. Je remercie tous les membres du laboratoire qui ont été de passage durant mes études de 2e cycle, en particulier François Tremblay-Bordeleau, Jamsin Matthew et Maxime Côté. Tous, à leur façon, ont su rendre l'ambiance de travail plus agréable et m'ont donné un coup de main à un moment ou à un autre. De plus, j'aimerais remercier ma famille et ma conjointe, Isabelle, qui m'ont soutenu tout au long de mes études, qui m'ont écouté, supporté tout au long de ce travail et qui ont aussi partagé mes joies tout au long de ce périple. Finalement, une petite pensée pour Maki, mon petit chien, qui a su me réchauffer couché sur mes cuisses tout au long de l'écriture de ce manuscrit.
Je dédis ce mémoire à tous ceux qui se battent, qui ont trépassé ou qui ont survécu
Introduction
1 Structure lobulaire, composition cellulaire et fonctions du foie
1.1 Les considérations anatomiques
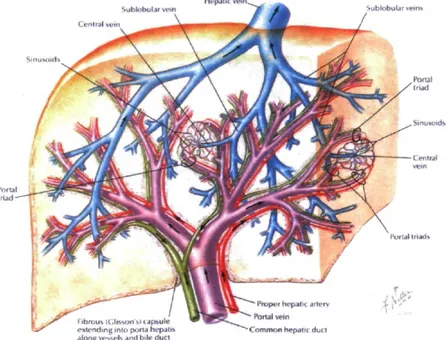
Le foie est l'organe le plus gros du corps humain. Il se situe dans la partie supérieure de l'abdomen, à l'hypochondre droit. Il est séparé en 2 lobes, le lobe droit et le lobe gauche. Chacun d'eux est de nouveau divisé en segments, correspondant aux branches artérielles et veineuses les irriguant [1]. Le foie possède une double circulation sanguine, artérielle et veineuse, lui faisant parvenir 1,5 L de sang chaque minute [2]. L'artère hépatique fournit le sang oxygéné au foie alors que la veine porte, d'où provient envhon 70% de l'apport sanguin, achemine le sang riche en nutriments, mais pauvre en oxygène provenant de l'estomac, de l'intestin et de la rate. Le foie est donc le premier organe vers lequel les nutriments absorbés par l'intestin se dirigent. La circulation sanguine, provenant des deux systèmes, traverse le parenchyme hépatique et est ensuite retournée à la circulation systémique par l'intermédiaire de la veine hépatique, qui se jette ultimement dans la veine cave inférieure. Finalement, le foie donne naissance au système biliaire, formé des canalicules biliaires, des ductules biliaires, des conduits biliaires et de la vésicule
Suhiobular vein Hepalk vein„_ Minlobular veins
i v
\ \ l f t_y
/ '■' Portai InadFibrous ((..lisson'su jpsule ^ ^ extending ink) porta hepatis along vessels and bile duct
Proper hepatic arterv **~ Portal vein '■Common hep.iti( duc i
/
'■'
4t
biliaire. Ce système permet l'excrétion de la bile depuis les hépatocytes et sa modification dans les ductules biliaires par des cellules appelées cholangiocytes [3]. La réunion de tous les vaisseaux, soit les 2 vaisseaux sanguins et du canal biliaire donne lieu à la triade portale (Figure 1).
1.2 Des données histologiques
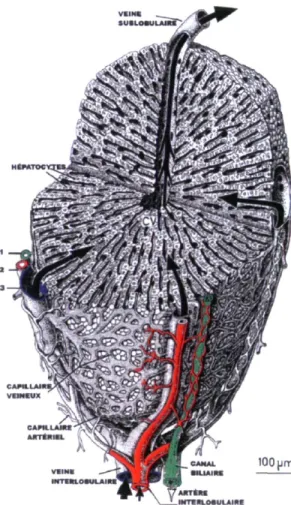
Le parenchyme hépatique est caractérisé par la présence de lobules hépatiques. Chaque lobule est entouré d'une capsule fibreuse, où l'on retrouve de trois à six espaces portaux. La circulation sanguine intralobulaire provient de ces espaces portaux. Durant son passage intralobulaire, le flot sanguin passe par une série de capillaires sinusoïdes avant de rejoindre la veine centrale, au centre du lobule (Figure 2). Les capillaires sont dits sinusoïdes, car ils sont constitués de cellules endothéliales fenestrées qui laissent un passage facile au travers de F endothelium aux différents constituants sanguins. À la surface luminale des capillaires se trouvent des macrophages, appelés cellules de Kupffer. Ils sont
impliqués dans la dégradation des erythrocytes âgés, dans l'élimination de bactéries et de débris et servent de cellules présentatrices d'antigènes. La partie extravasculaire des sinusoïdes est formée de l'espace périsinusoïdal, ou espace de Disse, où l'on retrouve d'autres types cellulaires, entre autres les cellules de Ito, qui sont des cellules hépatiques étoilées servant à emmagasiner des lipides, de la vitamine A et produisant des composantes de la membrane extracellulaire [4] et les cellules pit, qui sont des lymphocytes intrahépatiques [5].
1.3 L'hépatocyte
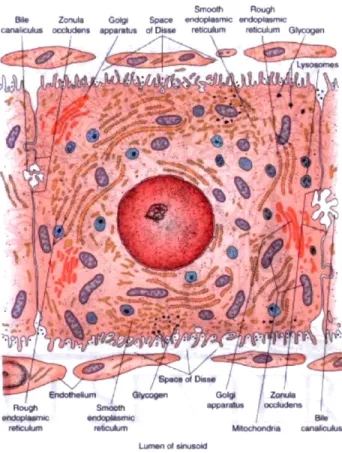
L'hépatocyte est le principal constituant cellulaire du parenchyme hépatique. La cellule hépatocytaire est polyédrale, d'un diamètre de 20-30 Lim, possède un minimum de 6 surfaces et plus de 50% des hépatocytes sont polyploïdes. La cellule étant métaboliquement très active, son cytoplasme présente une très grande concentration de mitochondries. Les hépatocytes s'étendent radialement autour de la veine centrale, de part et d'autre des sinusoïdes. Comme ils doivent être en contact direct avec les composants sanguins acheminés au foie, ils possèdent de nombreux microvillis qui s'étendent dans l'espace de Disse jusqu'aux capillaires sinusoïdes. Pour leur part, les membranes plasmiques de cellules adjacentes délimitent des canalicules biliaires qui, en s'anastomosant, donnent naissance aux ductules biliaires des espaces portes qui permettent à l'hépatocyte d'excréter la bile vers le duodénum (Figure 3) [4]. Il est à noter que les fonctions spécifiques de chaque hépatocyte vont varier selon qu'il soit situé en position périportale ou périveineuse, aspect qui sera discuté plus loin.
1.4 Les multiples fonctions hépatiques
Les multiples fonctions du foie sont réalisées en grande partie par les hépatocytes. Ceux-ci sont importants pour l'homéostasie énergétique, par le métabolisme du glucose et la formation de corps cétoniques, entre autres par le catabolisme des acides aminés, par l'élimination de l'ammoniaque produite durant la dégradation des acides aminés, sous forme d'urée, et par le traitement des triglycérides et des acides gras provenant des adipocytes. De plus, il possède des fonctions importantes de biosynthèse et de biodégradation, telles que dans le métabolisme des phospholipides, du cholestérol et des lipoprotéines, dans la synthèse et la dégradation des protéines plasmatiques, telles que
l'albumine, la transferrine et les facteurs de coagulation, dans la formation de la bile et dans la défense de l'organisme contre les xénobiotiques. Finalement, le foie joue un rôle endocrinien important, par la dégradation d'hormones circulantes et la synthèse et la libération de facteurs humoraux [6].
Smooth Rough Bee Zonula Golgi Span endoplasrmc endoptasmc canaliculus ocdudant apparatus ol Disse reticulum reticulum Glycogen
Mrtochondna canaliculus Lumen of sinusoid
©ELSEVIER. INC. - ELSEVIERIMAGES.COM
Figure 3. L'hépatocyte
2 Le métabolisme du glucose
Le foie joue un rôle essentiel dans le maintien d'une concentration de glucose sanguin adéquate. Ainsi, lors d'excès de glucose sanguin, il en retire de la circulation afin de synthétiser du glycogène et des triglycérides et en ramène dans la circulation lorsque les niveaux de glucose sanguin s'abaissent. L'homéostasie du glucose se fait grâce à trois mécanismes : la glycolyse qui permet de briser le glucose pour produire différents composés, tels le glycogène et les acides gras, la gluconéogenèse qui permet la synthèse de novo du glucose à partir de substrats tri-carbonés et le métabolisme du glycogène qui permet la dégradation du glycogène en glucose et son retour vers la chculation sanguine
[6]. De plus, l'hépatocyte permet la conversion du galactose et du fructose en glucose, qui sera alors utilisé dans la glycolyse [3],
2.1 Le transport transmembranaire du glucose
Le transport du glucose au travers de la membrane de l'hépatocyte se fait par transport facilité à l'aide de transporteurs de glucose, soit les GLUT. Ces transporteurs font partie de la « Major Facilitator Superfamily » de transporteurs membranaires, qui compte près de 5000 membres. Il y a 13 membres connus de GLUT, divisés en 3 classes selon leurs similarités de séquence : la classe I (GLUT 1-4), la classe II (GLUT 5, 7, 9 et 11) et la classe III (GLUT 6, 8, 10 12 et HMIT) [7,8]. Le transport du glucose vers l'intérieur de l'hépatocyte est influencé par la concentration d'insuline retrouvée dans la circulation sanguine. En effet, une augmentation de la concentration d'insuline dans la veine porte augmente la prise de glucose par les hépatocytes. Dans ce contexte, l'insuline peut agir sur la localisation de GLUT, en plus d'influencer le stockage du glucose et la formation du glycogène, phénomènes favorisant l'entrée du glucose dans l'hépatocyte [9,10]. Afin de contrebalancer ces effets de l'insuline, une autre hormone, le glucagon, régule la production hépatique de glucose durant le jeûne, l'exercice ou l'hypoglycémie, en plus de limiter la prise hépatique de glucose [11].
Parmi les différents GLUT, le GLUT1 est le seul à se retrouver dans tous les tissus, avec une expression qui corrèle généralement avec le métabolisme glucidique tissulaire. Cependant, chez l'hépatocyte, le principal transporteur de glucose est GLUT2, qui permet le transport bidirectionnel du glucose [12]. La structure des différents GLUT est semblable. Ils possèdent tous 12 domaines transmembranaires avec une chaîne oligosaccharidique liée à la portion N-terminale de la protéine. Cette structure permet le transport des hexoses au travers de la membrane cellulaire. Ainsi, le transport se fait dans la direction imposée par le gradient électrochimique. Il est intéressant de noter que tous les GLUT n'ont pas la même affinité pour le glucose. En effet, les transporteurs GLUT1, GLUT3 et GLUT4 sont des transporteurs de haute affinité, alors que GLUT2 est un transporteur de faible affinité. Dans ce contexte, le transport du glucose au travers la membrane chez les GLUT possédant une haute affinité est dépendant uniquement de la quantité de transporteur en surface de la cellule puisque la concentration de glucose sanguin se trouve toujours à être supérieure à leur constante de Michaelis (Km). C'est donc dire que les transporteurs fonctionnent
toujours à pleine capacité. Dans ce contexte, GLUT4 se retrouve dans les tissus insuline-dépendants, où la présence d'insuline mène à une translocation du transporteur depuis les membranes intracellulaires vers la membrane plasmique. En comparaison, le Km de GLUT2 étant élevé (Km =17 mM), le transport du glucose vers l'intérieur de la cellule est dépendant de la concentration sanguine en glucose et augmente donc proportionnellement à la concentration en glucose sanguin. Il se retrouve donc dans les tissus où une équilibration rapide du glucose entre l'espace extracellulaire et le cytosol est nécessaire, tels que l'intestin, le foie et le tubule proximal du rein [8,13].
2.2 Les hexokinases et le glucose-6-phosphate
Une fois à l'intérieur de la cellule, le glucose est pris en charge par une des différentes hexokinases (HK) qui s'y trouvent. L'hexokinase est une enzyme qui phosphoryle le glucose générant du glucose-6-phosphate (G6P). Le G6P ainsi produit peut alors servir pour les différentes voies métaboliques qui seront discutées plus en détail ultérieurement. Il existe 4 isoenzymes de l'HK, soit HKI, HKII, HKIII et HKIV (cette dernière étant également connue sous le nom de glucokinase (GK)). Les trois premières HK ont des structures semblables et possèdent toutes un poids moléculaire de 100 kDa, alors que la GK ne possède qu'un poids d'environ 50 kDa. De plus, HKI, HKII et HKIII sont des enzymes ayant des affinités relativement importantes pour le glucose, l'HKIII ayant la plus grande affinité avec un Km de 0,003 et l'HKII ayant l'affinité la moins importante avec un Km de 0,3 et dont l'activité est grandement influencée par la concentration cellulaire en G6P, une augmentation de cette concentration ayant un effet inhibiteur sur l'enzyme [14]. De son côté, la GK est une enzyme particulière qui a une affinité moins importante pour le glucose puisque le Km est approximativement de 5.0 et dont l'activité n'est pas affectée par la concentration cellulaire en G6P [15,16]. Une caractéristique de HKI et HKII est leur capacité à se lier à la membrane externe de la mitochondrie par l'intermédiaire du "voltage dependant anion channel" (VDAC), aspect dont nous discuterons plus en détail plus loin [14].
Dans le foie, HKI est l'isoenzyme retrouvée majoritairement lors de la période foetale alors que chez l'adulte, c'est surtout GK qui est exprimée [17]. HKII, retrouvée chez 1'adipocyte et chez la cellule musculaire, n'est généralement pas retrouvée dans le foie, sauf lorsqu'il y a développement de tumeur, tel que le carcinome hépatocellulaire [18,19].
2.3 Les sentiers métaboliques découlant de la formation du G6P
Comme mentionné plus haut, suite à la conversion du glucose en G6P par l'hexokinase, celui-ci peut être pris en charge par la voie de la glycolyse et éventuellement former 2 molécules de pyruvate. Il peut aussi être utilisé pour former des composés différents. Premièrement, il peut mener à la formation du glycogène comme il sera expliqué plus loin. Le glucose peut également être transformé en glycerol, qui servira à la formation de lipides. La glucose-6-phosphatase peut aussi s'en servir pour fournir la voie des pentoses phosphates, qui génèrent du NADPH, nécessaire à plusieurs voies de synthèse dans la cellule, en plus de jouer un rôle majeur comme antioxydant [20], et le ribose-5-phosphate qui permet la formation de nucleotides [21]. Lorsque le processus de transformation mène à la formation de pyruvate, la molécule peut être utilisée dans deux sentiers distincts. Le premier sentier, le cycle de Krebs, nécessite la présence d'02, alors que le deuxième sentier, le sentier anaérobique, n'utilise pas d'Û2 [22].
2.3.1 La glycolyse
Un des sentiers métaboliques les plus prédominants est la glycolyse. Lors de son entrée dans la cellule, le glucose est tout d'abord transformé en G6P par l'hexokinase comme déjà mentionné. Par la suite, 8 à 9 autres enzymes travaillant de concert permettent ultimement la formation de 2 molécules de pyruvate (Figure 4). Outre l'hexokinase, la phosphofructokinase est l'autre enzyme de la glycolyse qui utilise l'ATP comme substrat pour sa réaction et dont la réaction est irréversible. Ce sentier métabolique produit de l'énergie sous forme de 2 ATP et de 2 NADPH. Voici la réaction complète :
2 Glucose + 2 ADP -» 2 pyruvates + 2 ATP + 2 NADPH
La glycolyse a une importance capitale au sein de la cellule puisqu'elle est à la base de la balance énergétique cellulaire. En effet, elle fournit les précurseurs nécessaires à la formation plus efficace d'énergie en état d'aérobie, en plus de permettre le stockage d'énergie sous diverses formes et de mener à la formation de différents composés essentiels nécessahes au bon fonctionnement de la cellule et à sa croissance, tels les nucleotides, les acides aminés non essentiels, les lipides, les glycolipides et les glycoprotéines [22]. Certains de ces éléments seront revisités plus en détail ultérieurement.
Gtucoo* Itettokinasc ATP ■ADP Glucose 6-phospnaté) i I F» ueto4* e-pho$ph»t« ATP PtaspticfructctoTuisa - A D P 7 Fructo&e 1 ,&-toispho&phate Faictc*» i .6-t*spho8prwte aldolase 3-pho«phate fetydrogeMs* Tnoeephosphate tsomafaso * . Dlhytfc*y»)C*lort* phosphate 2 P , " _ - — 2 NAD* 2 NADH + M* 2x1.3-Biaphosphoglycefate J Phonphoglyo«a*r kinase - — 2 ADP — 2 ATP 2 x 3-Pnospfïoglycôratô r 2 x 2-Phoaphoglycerate i FnoUso a>2HiO 2 Phosphoanopyruvals) - 2AOP Pyruvate IÉMM v - 2 ATP 2 Pyruvate
2.3.2 Le cycle de Krebs
Lorsque le cycle de Krebs et la phosphorylation oxydative font suite à la glycolyse, le glucose est ultimement oxydé à l'aide de l'02 en CO2. Dans ce contexte, une fois formé, le pyruvate passe du cytoplasme vers l'intérieur de la matrice mitochondriale où il est transformé en acetyl-CoA. L'acétyl-CoA est alors utilisé pour former différents intermédiaires (Figure 5). AcatylCoA H s° „CoASH Cltrat* syntrtaM NADH+H-1 N A 0. Oxaloacetate Malat* déhyoVogtxttM Citrate ^ H J O cts-Aconitate Aconitase HjO QH2 ♦ ^ Succmat* dehydrogenase Q -Succmale Isocttratfi Isocitrate dehydrogenase/ COi. NAD-- NADH ♦ H* xSuccmyt CoA synthetase
CoASH .^4 C*°' 24)»>gMMta 2-Ojcoglutarate ATP SuocinylCoA ^vàT^^^ A D P + P . i CoASH
NAD-Figure 5. Le cycle de Krebs [23]
Deux de ces intermédiaires, le citrate et le malate, vont être respectivement impliqués dans la formation de lipides et la formation de pyruvate, celui-ci étant surtout formé suite à la l'utilisation de la glutamine et est utilisé dans le processus de fermentation en découlant [21]. En plus de ces intermédiaires, les différentes réactions mènent à la production d'énergie sous forme d'ATP. Voici la réaction complète du métabolisme aérobique :
2.3.3 La fermentation
Le processus de fermentation permet à la cellule de produire de l'énergie par la glycolyse en absence d'C^. Ce processus est utilisé, entre autres, par les cellules musculaires lors d'un effort important alors que l'apport en O2 est limité. Dans ces conditions, la phosphorylation oxydative n'étant plus fonctionnelle, la cellule ne peut utiliser le cycle de Krebs pour produire une partie importante de son énergie. La glycolyse fournit alors l'énergie à la cellule, mais la cellule doit se débarrasser des molécules de pyruvate qui sont créées. Une enzyme, la lactate déshydrogénase (LDH), transforme donc le pyruvate en un produit pouvant être excrété de la cellule, le lactate. Le rendement énergétique de tout ce processus n'est cependant pas très bon : la cellule n'en retire que 2 molécules d'ATP, produites au cours de la glycolyse [24]. Voici la réaction complète du métabolisme anaérobique chez les mammifères :
Glucose + 2 ADP + 2 P ->2 lactates + 2 H20 + 2 ATP 2.4 Les hépatocytes et l'homéostasie du glucose
2.4.1 L'état postprandial
Suite à un repas, l'augmentation de la concentration de glucose sanguin amène une production d'insuline par les cellules |3 des îlots de Langerhans situés dans le pancréas [25]. L'interaction de l'insuline avec son récepteur (IR) en surface des hépatocytes provoque l'activation de voies signalétiques intracellulaires menant à une augmentation de l'entrée de glucose et à son utilisation par la glycolyse et pour la synthèse de glycogène. Cette augmentation de l'entrée de glucose dans la cellule se fait via le transporteur GLUT-2. Parallèlement, l'activation d'Akt, suite à la stimulation du récepteur de l'insuline, entraîne la production de glycogène. En effet, Akt, en phosphorylant la glycogène synthase kinase-3 (GSK-3), inhibe l'enzyme. Celle-ci ne peut donc plus inhiber la glycogène synthase (GS), qui peut utiliser l'UDP-glucose produit au cours de la glycolyse pour former le glycogène par la création d'un lien ct-1,4 entre cet UDP-glucose et la chaîne de glycogène préexistante [26]. Il est à noter cependant que le glucose n'est pas le seul précurseur utilisé dans la formation du glycogène. En effet, plusieurs autres molécules, tels le fructose, le lactate et la glutamine, sont aussi utilisées par le foie pour produire du glycogène, certains menant à une formation plus efficace du glycogène que le glucose lui-même [27]. Finalement, l'insuline
agit aussi sur le métabolisme des acides gras en promouvant la lipogenèse au foie par l'activation du « sterol regulatory element binding protein-lc » (SREBP-lc) qui à son tour favorise l'utilisation de l'acétyl-CoA dans la synthèse de novo de triglycérides [28].
2.4.2 L'état déjeune
Lorsque l'organisme est en jeûne, la concentration de glucose circulant diminue. Les acides gras libres, qui deviennent alors la principale source d'énergie de l'organisme, ne peuvent fournir tous les tissus, puisque certains ne peuvent utiliser d'autres sources énergétiques que le glucose, l'exemple le mieux connu étant le cerveau [29]. L'organisme vise donc à maintenir en permanence la concentration de glucose circulant entre 3.9 et 5.6 mM. Afin de la maintenh, des réserves de glucose sont mobilisées vers la chculation sanguine. Les réserves mobilisables se retrouvent principalement au foie, qui produit près de 90 % du glucose endogène total, les reins fournissant le reste du glucose. Afin d'amener du glucose dans la circulation sanguine, les hépatocytes peuvent soit cliver le glycogène, phénomène appelé la glycogénolyse, ou encore produire du glucose à partir de précurseurs glucogéniques par le phénomène de gluconéogenèse. Ces processus sont contrôlés par des hormones, principalement le glucagon, par des metabolites tels le glucose, les acides gras libres et par des composés à 3 carbones tels le lactate et le glycerol [30].
2.4.3 La glycogénolyse
Lorsqu'il y a hypoglycémie, c'est-à-dire que la concentration de glucose sanguin baisse sous les 5 mM, les cellules a du pancréas débutent la sécrétion de glucagon et le ratio glucagon:insuline augmente. La liaison du glucagon à son récepteur, qui se trouve principalement en surface des hépatocytes, amène une inhibition de la synthèse du glycogène et active la glycogénolyse [26]. Durant la glycogénolyse, le glycogène est brisé en glucose-1-phosphate sous l'action de la glycogène phosphorylase. Il y a alors conversion du gluco se-1-phosphate en glucose-6-phosphate dans l'hépatocyte. Une enzyme particulière présente seulement au foie et au rein, la glucose-6-phosphorylase (G6Pase), catalyse ultimement la conversion du glucose-6-phosphate en glucose [30]. Une fois la molécule de glucose produite, elle est exportée par le récepteur GLUT2 vers la circulation sanguine.
2.4.4 La gluconéogenèse
En plus d'utiliser ses réserves de glycogène, le foie peut produire du glucose à partir de précurseurs du glucose tels 1'alanine, le lactate, le pyruvate, le glycerol. Plusieurs enzymes sont impliquées dans la gluconéogenèse, telles la phosphoenolpyruvate carboxykinase, la fructose-1,6-biphosphatase, la phosphofructo-1-kinase, la pyruvate kinase et la glucose-6-phosphatase. Ainsi, le pyruvate est converti en fructose-1,6-biphosphate. Celui-ci est ensuite transformé en G6P qui est à son tour converti en glucose avant d'être exporté hors de la cellule par le transporteur GLUT-2. Ce processus est très important dans le maintien de la concentration du glucose sanguin, car il compte pour plus de 50% de l'apport en glucose en période déjeune et augmente lorsque cette période se prolonge [30].
2.5 La signalisation intracellulaire de l'insuline
Comme mentionné à quelques reprises, l'insuline joue un rôle très important dans le maintien de l'homéostasie du glucose. La liaison de l'insuline à son récepteur membranaire permet l'activation de voies de signalisation intracellulaire importantes : la voie des MAPK (mitogen-activated protein kinase) et la voie de la PI3K (phosphatidylinositol 3-kinase). La voie de la PI3K, lorsqu'activée, mène à une diminution de la production de glucose par l'hépatocyte. Elle implique les substrats du récepteur de l'insuline (1RS), dont le plus connu est IRS2, qui permet le recrutement de la PI3K à la membrane et, par conséquent, la phosphorylation de la PI-(4,5)-bisphosphate en PI-(3,4,5)-triphosphate (PIP3). Une fois à la membrane, PIP3 permet le recrutement à la membrane de protéines possédant un domaine PH, soit PDK1, Akt et certaines PKC où elles sont activées. L'activation d'Akt est connue pour diminuer l'activité de la PEPCK et de la G6Pase chez les hépatocytes, entre autres par une diminution de l'expression de ces protéines, en plus d'augmenter la synthèse de glycogène par l'inhibition de la GSK-3P comme il a été décrit précédemment. Finalement, cette voie mène aussi à l'activation de la p70 S6-kinase (p70 S6K), qui subséquement active S6, une protéine ribosomale impliquée dans la traduction. Cependant, malgré qu'elle active S6, il a été démontré que l'inactivation de p70 S6K n'avait pas d'effet sur l'expression de la PEPCK et de la G6Pase [31].
La voie des MAPK est aussi activée par la liaison de l'insuline à son récepteur. Cependant, l'inhibition spécifique de différentes protéines impliquées dans cette voie n'affecte pas l'expression de la PEPCK et de la G6Pase [31].
De plus, l'insuline a un effet sur le transport du glucose par GLUT2. En effet, il a été démontré que IR et GLUT2 s'associent ensemble à la membrane de l'hépatocyte [32] et que cette association, chez les hépatocytes de nouveau-nés, amène une augmentation de l'entrée de glucose dans la cellule. L'expression du gène GLUT4 dans les hépatocytes, par transfection, n'affecte pas l'entrée du glucose [33].
2.6 Le métabolisme et le cancer
Depuis de nombreuses années, un lien étroit a été établi entre métabolisme et cancer. La première théorie les reliant a été décrite par Otto Warburg, l'effet Warburg [34], et découle de l'observation que les cellules en prolifération constante contenues dans une tumeur génèrent une grande quantité d'énergie, possiblement due à un défaut mitochondrial. Cependant, chez ces cellules, aucun défaut mitochondrial n'a été trouvé. Des avancées récentes permettent d'émettre des hypothèses pour mieux comprendre la raison d'être d'un tel phénomène.
Les cellules en prolifération, en plus de leurs besoins énergétiques, ont des besoins en nutriments augmentés. Il a été démontré qu'une cellule en replication utilisait jusqu'à 50% plus de glucose qu'une cellule qui maintient ses besoins primaires, sans que les niveaux d'ATP de la première soient particulièrement plus importants. C'est donc dhe que le glucose ne sert pas seulement de source d'énergie à la cellule en prolifération, mais sert également à en augmenter la biomasse. Tel que déjà mentionné, après son entrée dans la cellule, le glucose peut être transformé en glycerol, lequel servira à la synthèse de lipides, ou il peut être transformé en pyruvate, qui peut être converti en acétyl-CoA, être transaminé en alanine ou encore être transformé en lactate en condition hypoxémique. L'acétyl-CoA peut à son tour être transformé en citrate qui servira à la génération d'énergie, de CO2 et de source de carbone pour la formation de molécules, ou encore servir à la synthèse d'acides gras qui serviront à la synthèse de biomembranes. Finalement, le glucose, peut permettre la production de NADPH et de ribose par la voie des pentoses phosphates, le dernier servant à la synthèse des acides nucléiques [35].
Dans la cellule en prolifération comme les cellules cancéreuses, il y a présence d'hypoxie plus importante que dans la cellule en prolifération normale. Cette hypoxie amène la conversion du pyruvate principalement en lactate. Ainsi, le glucose servira alors de façon moins importante à fournir la cellule en éléments permettant d'augmenter la biomasse. Pour
procurer suffisamment de carbone à la cellule, un autre élément important du métabolisme, la glutamine, est utilisée pour fournir le cycle de Krebs. La glutamine, transformée en glutamate suivant son entrée dans la cellule, permet de compléter l'apport en carbone nécessaire à la biosynthèse de macromolécules. En effet, le glutamate est converti en cc-cétoglutarate qui, suite à la carboxylation reductive, produit une molécule de citrate, qui servira à la synthèse de lipides [35,36]. Un autre élément à considérer est que la cellule cancéreuse, en prolifération, doit contrôler la production d'ATP formé à partir du glucose, car une production hop importante mène à une hausse importante du ratio ATP/ADP intracellulaire, ce qui freine alors l'entrée du glucose, compromettant par le fait même la synthèse des macromolécules nécessaires à la biomasse cellulaire [21]. Des mutations de plusieurs gènes, tels que MYC, RAS, CTNNB1 (le gène codant pour la (3-caténine) et p53 permettent de modifier le métabolisme cellulaire [36]. Ces modifications procurent un avantage aux cellules tumorales qui peuvent alors croître dans un microenvironnement hypoxique, pauvre en nutriments et dont le pH est diminué, microenvironnement découlant principalement d'une néovascularisation imparfaite au sein de la tumeur [35,37].
Les changements métaboliques peuvent s'opérer de 2 façons [38], tout d'abord, par une sélection des cellules ayant un métabolisme altéré, causé par le microenvironnement tumoral hypoxique, ensuite par des mutations chez des suppresseurs de tumeur ou des oncogenes faisant partie de voies signalétiques de survie ou de prolifération, tels que ceux mentionnés précédemment. Les altérations du métabolisme observées peuvent permettre aux cellules cancéreuses d'échapper à la mort cellulaire par apoptose, par exemple par l'association de HKI et HKII à la mitochondrie [39], comme il sera expliqué plus loin. Ceci démontre que les cellules cancéreuses modifient leur métabolisme afin de survivre et de proliférer dans le microenvironnement tumoral et que ces changements métaboliques leur procurent un avantage marqué comparativement aux cellules saines.
2.7 Les maladies métaboliques du foie 2.7.1 Le diabète sucré
Le diabète sucré (communément appelé diabète) regroupe un ensemble de pathologies qui ont en commun une hyperglycémie. Le diabète est classé sous deux grandes catégories, soit le type 1 et le type 2. Le diabète de type 1 est causé par une destruction auto-immune des
cellules (3 des îlots de Langerhans du pancréas par les lymphocytes T, ayant pour conséquence une diminution importante de la synthèse de l'insuline. Le diabète de type 1 est beaucoup moins fréquent que le type 2 et se déclare généralement entre l'âge de 5 et 7 ans et à la puberté. Le diabète de type 2 est pour sa part caractérisé par une résistance à l'insuline qui peut également être combinée à une diminution de sécrétion d'insuline par les cellules P du pancréas, celles-ci ne pouvant ultimement plus répondre à la demande corporelle [40]. Il est généralement observé chez les personnes ayant un surplus de poids et une histoire familiale de diabète de type 2.
L'hyperglycémie qui caractérise le diabète amène une augmentation de la production de stress oxydant. Deux mécanismes semblent être responsables de cette augmentation : la génération dhecte de stress oxydant et/ou l'altération de la balance d'oxydoréduction. Pour sa part, l'augmentation du stress oxydant produit dans la cellule est due en grande partie à une activité plus importante de la chaîne transporteuse d'électrons à la mitochondrie en présence d'un surplus de glucose, menant à une production accrue de superoxyde. La génération directe et indirecte de stress oxydant peut aussi se faire suite à l'activation de la voie diacylglycérol (DAG)-PKC au cours de l'hyperglycémie. En effet, dans ces conditions, une augmentation du contenu en glycérol-3-phosphate peut mener à la synthèse de DAG, qui peut activer les différentes PKC. Certaines PKC, comme PKC-a et PKC-ô, ont été démontrées capables d'activer la NADPH oxydase, alors que d'autres peuvent moduler le niveau de production d'oxyde nitrique [41]. Les individus souffrant d'hyperglycémie possèdent donc un environnement cellulaire interne plus oxydant pouvant mener à des dommages cellulaires importants.
2.7.2 La stéatose hépatique non alcoolique
La stéatose hépatique est une pathologie caractérisée par l'accumulation de triglycérides dans le foie. Lorsque celle-ci se produit en absence de consommation importante et régulière d'alcool, elle est appelée la stéatose hépatique non alcoolique (NAFLD). La NAFLD se développe généralement chez les gens souffrant de résistance à l'insuline en lien avec l'obésité, le diabète ou encore l'hyperlipidémie. Cette résistance à l'insuline mène à une augmentation de triglycérides au foie de 2 manières. Premièrement, par une lipolyse du tissu adipeux viscéral causée par une suppression de la lipase hormono-sensible à l'insuline chez les adipocytes, menant à une libération importante d'acides gras libres dans
le sang qui vont s'accumuler au foie. Deuxièmement, par une augmentation de la synthèse de triglycérides par les hépatocytes.
La NAFLD va ensuite progresser vers la stéatohépatite non alcoolique (NASH) chez environ 40% des patients[42]. En plus des mécanismes déjà décrits plus haut, l'accumulation d'acides gras libres non estérifiés dans ce contexte chez l'hépatocyte mène à une augmentation de production d'espèces réactives d'oxygène (ROS). Ceci provoque de l'inflammation au foie par une peroxydation des lipides et une diminution de la |3-oxydation mitochondriale, en plus de provoquer une dysfonction mitochondriale. Un autre processus, la production de cytokines pro-inflammatoires par les adipocytes, endommage les hépatocytes qui peuvent entrer en apoptose ou encore mourir par nécrose. En présence de destruction chronique du parenchyme hépatique, il y a activation de cellules de Ito, qui se transdifférencient alors en myofibroblastes, et de pericytes hépatiques. Ces cellules vont produire de la matrice extracellulaire (ECM) afin de réparer les dommages subis par le foie. La production excessive d'ECM mène à la fibrose hépatique. Finalement, lorsque l'atteinte est très importante, il y a développement d'une cirrhose, maladie diffuse du parenchyme hépatique qui se caractérise par de la fibrose, des nodules de régénération et la disparition de l'architecture hépatique normale. Il est à noter que 74 % des patients atteints de NASH développeront des atteintes hépatiques plus sévères, telles la fibrose et la cirrhose [42]. 2.7.3 Le cancer hépatique
Le carcinome hépatocellulaire (HCC) est la cinquième forme de cancer la plus répandue et est la troisième cause de décès par cancer [43]. Différents facteurs peuvent mener au développement d'un HCC, telles l'exposition à différents carcinogènes comme l'aflatoxine Bi, les hépatites chroniques (hépatites B et C), les maladies hépatiques alcooliques, les NASH et les maladies génétiques du foie [44]. Ainsi, le HCC se développe en présence de maladies chroniques du foie, la cirrhose hépatique étant le facteur de risque le plus important. Par exemple, le NAFLD et le NASH procurent un environnement propice aux transformations néoplasiques puisque durant les premières étapes de leur développement, des dommages à l'ADN et l'expansion des progéniteurs hépatocytaires se produisent, ceux-ci augmentant avec la progression de l'atteinte hépatique [45].
3 Le stress oxydant
La production d'énergie par la phosphorylation oxydative à la mitochondrie amène la formation de ROS. Une famille d'enzymes dépendantes du NADPH et liées à la membrane cellulaire, soit les Noxl à 5 et Duoxl et 2, peuvent aussi produire des ROS intracellulaires [46]. Il existe différentes formes de ROS. Certaines sont sous forme de radicaux libres, tels que l'anion superoxyde (02* "), l'hydroxyle (HO), le peroxyle (RO/) et l'alkoxyle (RO'), d'autres sont sous forme non radicale comme le peroxyde d'hydrogène (H2O2) [47]. Ces ROS, lorsque produites en excès, sont néfastes pour l'organisme, puisqu'elles sont connues pour provoquer des dommages cellulaires et tissulahes importants, agissant sur les protéines, les lipides et l'ADN. Certaines maladies, tels la sclérose latérale amyotrophique, l'Alzheimer, l'ataxie de Friedreich, divers cancers et le diabète de type 2 peuvent découler d'un surplus de ROS [46,48]. Cependant, ces mêmes ROS, comme le H2O2, produites relativement à faible concentration, peuvent s'avérer très utiles à l'organisme, que ce soit pour leur rôle dans la défense de l'hôte, dans certaines réactions de biosynthèse oxydative ou encore en tant qu'agents de signalisation [49]. Dans ce contexte, plusieurs stratégies ont été développées par les organismes pour contrôler le stress oxydant, afin de garder une balance juste entre la production et l'élimination des ROS et ainsi permettre aux cellules et à l'organisme de fonctionner normalement.
3.1 Systèmes antioxydants cellulaires
Les dommages causés aux cellules par l'exposition aux ROS ont mené celles-ci à développer des mécanismes de protection, les systèmes antioxydants cellulaires. Ils permettent la prévention et la réparation des dommages causés par les ROS, en plus de permettre une défense physique et une défense antioxydante contre celles-ci. Les défenses antioxydantes peuvent être enzymatiques, telles que la superoxyde dismutase (SOD), la peroxidase au glutathion (GPx) et la catalase (CAT), ou encore non-enzymatiques, tels les vitamine C et E, le glutathion (GSH), les caroténoïdes, les flavonoïdes et plusieurs autres antioxydants [50]. Le GSH est l'un des antioxydants majeurs de la cellule. Il est produit dans le cytoplasme par la GSH synthetase qui utilise la y-glutamylcystéine, formée à partir du glutamate et de la cysteine par la y-glutamylcystéine synthetase (y-GSC), et la glycine (Figure 6).
ATP ADP ATP ADP
Glu+Cys ► f-gju-cys * ► irglu-cys-gly (GSH)
^ * G l y
Figure 6. Synthèse du GSH [51]
Une fois synthétisé, en plus de rester dans le cytosol, le GSH est redistribué vers certains organites, soit le reticulum endoplasmique (ER) et la mitochondrie, de même que vers le noyau [51]. Le GSH, de concert avec la SOD, la GPx et la catalase, permet à la cellule de se débarrasser des ROS intracellulaires. Lorsque le GPx fait la conversion du H2O2 en H2O, entre autres dans la mitochondrie où il y a absence de catalase, le GSH lui sert de donneur d'hydrogène [52]. En plus de ses fonctions antioxydantes, le GSH est impliqué dans le métabolisme des xénobiotiques, dans les réactions d'échanges des disulfides de thiol et dans certaines voies de signalisation cellulaires impliquées dans la régulation du cycle cellulaire, de la prolifération et de Tapoptose [51]. Ces mécanismes permettent à la cellule de contrôler le niveau de ROS présent dans la cellule, prévenant les dommages que causerait un excès de celles-ci tout en leur permettant de jouer leurs rôles dans la signalisation intracellulaire.
3.2 La signalisation dépendante du H2O2
Le H2O2 affecte la signalisation intracellulaire par l'oxydation de molécules spécifiques. Différentes voies de signalisation peuvent ainsi être activées. Les voies des MAPK, de la PI3K et certaines voies impliquant des récepteurs de facteurs de croissance tels l'EGFR et le PDGFR peuvent être activées [53] [46]. Certaines phosphatases, comme la PTEN qui joue un rôle important d'inactivation de la voie PI3K, peuvent être inactivées suite à leur oxydation par le H2O2, menant à une activation plus importante des voies de signalisation. Le H2O2 est aussi connu pour activer certains facteurs de transcription ainsi que certaines protéines impliquées dans la mort cellulaire, telles les caspases.
La voie de la PI3K est une voie de signalisation pro-survie. L'activation de cette voie par des doses modérées de ROS mène à l'activation d'Akt [53] et cette activation a été démontrée dans la protection des cellules contre la mort chez différents types cellulaires [54,55,56]. C'est donc dire que le H2O2 peut jouer un rôle important dans la signalisation
pro-survie à l'intérieur d'une cellule et que la production d'une quantité contrôlée de H2O2 est nécessaire au bon fonctionnement de la cellule.
3.3 La mort cellulaire dépendante du H ;()2
Comme mentionné plus haut, le stress oxydant peut mener à des dommages cellulaires causés aux protéines, aux lipides et à l'ADN. Lorsqu'on parle de mort cellulaire, quatre grandes catégories sont aujourd'hui acceptées, soit Tapoptose, Tautophagie, la cornification et la nécrose. Les deux les plus étudiées sont Tapoptose et la nécrose. Dans le premier cas, il y a mort cellulaire propre avec arrondissement de la cellule, fragmentation cellulaire et formation de corps apoptotiques alors que dans le second cas, il y a un gonflement du cytoplasme, un bris de la membrane plasmique et une condensation de la chromatine [57]. L'apoptose et la nécrose peuvent survenir en réponse à différents agents et ce de façon dose-dépendante.
La mort par apoptose peut survenir suite à une stimulation extrinsèque ou encore par une stimulation intrinsèque à la cellule. La voie extrinsèque est activée en surface de la cellule, entre autres par le ligand du récepteur Fas ou par le TNFa (« tumor necrosis factor alpha ») qui, en se liant à leur récepteur respectif, vont mener à une amplification importante du signal via l'activation de caspases et à la mort cellulaire programmée. La voie intrinsèque peut, elle, être activée par différents stress cellulaires, tels les radiations ionisantes, le rayonnement ultraviolet (UV) et le H2O2. Lorsqu'activée, la voie intrinsèque permet l'activation et la translocation vers la mitochondrie de protéines pro-apoptotiques de la famille Bcl-2 pour y former un pore et altérer la perméabilité membranaire mitochondriale, menant entre autres à la libération du cytochrome c (cyt c) et à la formation de Tapoptosome. Une fois formé, Tapoptosome permet l'activation de la procaspase 9 qui mène éventuellement à la mort cellulaire par apoptose [58].
Lorsqu'un stress important au H2O2 survient dans une cellule, la mort se produit soit par apoptose ou par nécrose. Lorsqu'il y a apoptose, le H2O2 mène à l'activation et à la translocation de Bax et Bad, deux protéines proapoptotiques de la famille des Bcl-2, à la mitochondrie, à la libération subséquente du cyt c, à l'activation des caspases et à la fragmentation de TADN, comme il a été démontré chez les cardiomyocytes [59] et les cellules HeLa [60]. Lorsqu'il y a nécrose subséquente à un stress au H2O2, il y a mort par ouverture du pore de perméabilité mitochondriale transitionnelle (MPTP), suite à la perte
de l'homéostasie du Ca2+ et la dysfonction mitochondriale [60], phénomène qui sera expliqué ultérieurement.
Les PKC sont impliquées dans la mort cellulaire liée au H2O2. En présence de H2O2, une activation de PKCÔ peut mener à la mort cellulaire chez différents types cellulaires [61,62], et ce par apoptose ou par nécrose. Cependant, une activation concomitante de la voie PI3K/Akt peut inhiber cette mort cellulaire, comme il a été démontré chez les cellules CHO [62]. De plus, des cellules musculaires lisses PKCÔ-/- ont montré une résistance marquée à la mort cellulaire induite par le H2O2 [63]. D'autres voies de mort cellulaire impliquant entre autres AMPK [64] et c-Abl [65] peuvent être activées en réponse au H2O2.
3.4 Le pore de la perméabilité mitochondriale transitionnelle
Afin de produire de l'ATP lors de la phosphorylation oxydative, la mitochondrie génère un potentiel électrochimique provenant d'un gradient de protons à la membrane mitochondriale interne, aussi appelé « proton motive force » (Ap) [66]. Lors d'une perméabilité mitochondriale transitionnelle (MPT), il y a dissipation du Ap, empêchant la mitochondrie de produire de l'ATP. Ce phénomène fait suite à l'ouverture du MPTP [67]. L'ouverture de ce pore peut se produire lors d'un surplus de Ca2+ à la mitochondrie, lors d'un stress oxydant excessif ou encore lors d'une diminution du Ap [68]. Cette ouverture mène à une plus grande perméabilité de la membrane pour les molécules de faible poids moléculaire, tels les cofacteurs et les ions, et à la libération de ces molécules comme le Ca2+, ce qui entraîne une équilibration des gradients métaboliques entre la mitochondrie et le cytosol, en plus de provoquer le gonflement de la mitochondrie. Finalement, les protéines proapoptotiques contenues dans la membrane, telles que le cyt c et AIF, peuvent être larguées suite à l'ouverture du MPTP [67].
La composition du MPTP a été déterminée à l'aide d'essais de purification partielle. Il est composé de trois protéines, le « adenine nucleotide translocator » (ANT) à la membrane mitochondriale interne (IMM), la cyclophiline D (CyP-D) à l'intérieur de la matrice mitochondriale et finalement VDAC à la membrane mitochondriale externe (OMM). D'autres protéines de régulation sont aussi connues pour influencer le MPTP, telles que certains membres de la famille des Bcl-2 et les HK [69].
3.4.1 MPTP et mort cellulaire
La MPT est présente dans différentes conditions pouvant mener à la mort cellulaire, telle que lors d'un stress oxydant important chez les hépatocytes, lors de l'anoxie, lors d'un traitement à l'ATP et lors de l'ischémie chez les cardiomyocytes. De plus, différents inhibiteurs de l'ouverture du MPTP, comme la bongkrekate et la cysclosporine A (CsA) permettent de protéger la cellule [69]. Ainsi, le MPTP est impliqué dans la mort cellulaire, et ce autant lorsqu'elle se produit par apoptose que par nécrose.
Lorsqu'une stimulation intrinsèque mène à Tapoptose chez la cellule, il y a ouverture du pore à la OMM, permettant la sortie de facteurs proapoptotiques tels le cyt c et la formation de Tapoptosome. Cette perméabilisation de la OMM peut se produire grâce à VDAC dans le MPTP ou encore grâce aux protéines proapoptotiques de la famille Bcl-2, soit Bax et Bak qui vont former le canal mitochondrial induit par Tapoptose (MAC).
L'ouverture du MPTP est aussi observée lors de la nécrose. Chez le cardiomyocytes, la nécrose induite par la reperfusion lors d'une ischémie cellulaire provoque l'ouverture du MPTP suite à la diminution de l'ATP, la surcharge en Ca2+ et la production de ROS intracellulaire [70]. Des résultats similaires ont été obtenus chez des hépatocytes et des fibroblastes déficients en CyP-D qui étaient plus résistants à la nécrose induite par le H2O2 et un ionophore de Ca2+ [69].
3.4.2 Le VDAC
VDAC est une protéine membranaire qui se retrouve à la OMM et à la membrane plasmique [71]. Il existe 3 isoformes différentes de VDAC, soit VDAC1, VDAC2 et VDAC3 [72]. La structure tridimensionnelle de VDAC1 a été déterminée par différentes techniques et montre que celui-ci forme un baril |3 composé de 19 feuillets bêta, donnant la forme d'un cylindre elliptique traversant la membrane. À l'intérieur du pore, se retrouve la région N-terminale en forme d'hélice a [73]. À la mitochondrie, la protéine régule le transport des metabolites, le volume mitochondrial et Tapoptose [74]. Ainsi, VDAC est perméable à de petits ions, à de larges anions, entre autres le glutamate et l'ATP ainsi qu'à de larges cations comme T acetylcholine et la dopamine. Sa sélectivité et sa perméabilité aux ions et anions dépendent du voltage. À de faibles voltages, VDAC se trouve en conformation ouverte, menant à un transport des anions plutôt que des cations, alors qu'à de hauts voltages, il est en conformation fermée et permet surtout le passage des cations
[73].
VDAC joue un rôle dans la survie et la mort cellulaire. Tout d'abord, VDAC est essentiel à la production d'énergie et à la croissance cellulaire. En effet, lorsque l'expression de VDAC1 est abolie, il y a arrêt de la croissance cellulaire dû à une diminution de la production énergétique [75]. De plus, la mort cellulaire peut être régulée par VDAC, et ce de façon différente dépendant de l'isoforme impliquée. Ainsi, des évidences démontrent que VDAC2 diminuerait la susceptibilité des cellules à Tapoptose par une séquestration de Bak à la mitochondrie [74], alors que VDAC1 ferait partie de la machinerie apoptotique et permettrait la libération de protéines pro-apoptotiques comme le cyt c, AIF et Smac/Diablo depuis la mitochondrie. Pour ce faire, VDAC1 peut soit s'oligomériser ou encore s'associer à une protéine pro-apoptotique de la famille des Bcl-2, Bax [73,76]. C'est donc dire que VDAC joue un rôle primordial non seulement dans la fonction de transport transmembranaire du MPTP, mais aussi dans la régulation de la survie, de la croissance et de la mort cellulaire.
Étant donné sa localisation à la OMM, c'est-à-dire à la barrière séparant la mitochondrie du cytosol, VDAC est une protéine de liaison pour plusieurs autres protéines. VDAC interagit avec des protéines mitochondriales pour former le MPTP, peut interagir avec des protéines anti et pro-apoptotiques de la famille des Bcl-2 et peut aussi interagir avec les HKI et HKII. Ces interactions peuvent moduler les fonctions de VDAC, telles ses fonctions dans le métabolisme et la mort cellulaire [77].
Dans un contexte de mort cellulaire, il a été proposé antérieurement que VDAC pouvait s'associer avec Bax pour former un pore à la OMM permettant la sortie, entre autres, du cyt c. Dans le même ordre d'idée, la liaison de protéines régulatrices en surface de la mitochondrie comme Bcl-xL [74] et HKI et II [77] permet de bloquer la mort cellulaire induite par différents mécanismes. Ainsi, il est possible de bloquer la sortie de protéines pro-apoptotiques depuis la mitochondrie en bloquant le pore formé par VDAC.
3.4.3 La dynamique mitochondriale et la mort cellulaire
Bien que la dynamique protéique de la membrane michondriale soit le principal facteur connu pour affecter la mort cellulaire passant par la mitochondrie, d'autres facteurs peuvent être contributoires. Un de ces facteurs est la dynamique morphologique de la membrane mitochondriale. Celle-ci est modulée par des processus de fusion et de fission. Les
protéines OPA1 (optic atrophy 1) MFN1 (mitofusin 1) et MFN2 sont impliquées dans le processus de fusion, alors que la fission est régulée par DRP1 (dynamin-related protein 1) [78]. Lors de périodes de jeûne, les mitochondries se fusionnent entre elles par un processus dépendant de PKA (protein kinase A). Le jeûne provoque une augmentation de TAMP cyclique qui permet l'activation de PKA, qui, une fois activée, phosphoryle DRP1 sur la Ser 637 pour Tinactiver [79]. Ceci mène à un débalancement entre les protéines de fusion et de fission, conduisant à une plus grande activité des protéines de fusion et donc à une elongation des mitochondries. Ces mitochondries allongées possèdent plus de cristae, ont des niveaux de dimérisation et d'ATP synthase plus importants et maintiennent donc une production accrue d'ATP [79]. Dans les cellules endothelials sénescentes, il a été démontré que l'élongation des mitochondries augmente la résistance des cellules au stress oxydant par un mécanisme PINK1 dépendant [80], PINK1 étant impliquée dans le processus de contrôle de qualité mitochondriale et donc dans la mitophagie, qui se produit suivant des dommages mitochondriaux importants provoqués par un stress oxydant [81].
3.5 Les HK, la mort cellulaire et le cancer
La liaison des HKI et HKII à la mitochondrie permet de remplir plusieurs fonctions. Premièrement, cette liaison permet une production accrue de G6P par la cellule. Il a été démontré que HKII, par sa liaison à VDAC, permet un rapprochement des protéines de l'ATP synthase (protéine permettant la synthèse de l'ATP située à la IMM), et de ANT (qui permet le transport de l'ATP) avec le complexe VDAC-HKII [82]. Ainsi, étant à la source même de l'ATP utilisé pour la conversion du glucose au G6P, THKII peut fournir rapidement ce précurseur nécessaire à la production d'énergie chez la cellule en croissance. Tel qu'expliqué plus haut, en plus d'augmenter le métabolisme cellulaire, la liaison des HK à la mitochondrie permet de bloquer la mort cellulaire, et ce en inhibant l'ouverture du MPTP. Différentes hypothèses ont été émises permettant d'expliquer un tel phénomène. La liaison de HK à VDAC peut inhiber la formation du MPTP, tout d'abord en changeant la conformation de VDAC, en altérant la conformation de ANT, rendant donc la formation du MPTP impossible et aussi en empêchant la liaison de protéines proapoptotiques, telles que Bax, à VDAC, prévenant encore une fois un changement de conformation de ANT [82]. Finalement, une étude récente a démontré que non seulement HK doit se lier à VDAC pour avoir un effet protecteur contre la mort cellulaire, mais que la capacité de HK à
phosphoryler le glucose est aussi essentielle [83].
Depuis plusieurs années, l'importance du rôle des HK chez les cellules cancéreuses a été démontrée. En effet, les HKI et HKII aideraient T immortalisation des cellules cancéreuses pour les raisons déjà évoquées [84]. Des évidences montrent qu'il y a augmentation de la transcription de HKII dans les tumeurs malignes et que, dans les tumeurs glycolytiquement très actives, une fraction importante de HKI et/ou de HKII est attachée à VDAC à la OMM [82]. En fait, il est de plus en plus accepté que HKII est une protéine ayant une grande importance dans le processus tumoral, entre autres dans l'effet Warburg, dont il a déjà été discuté [85]. Ces observations ont mené aux thérapies anticancer visant à perturber l'activité de HK de la mitochondrie afin de limiter la capacité des cellules à proliférer et à résister à Tapoptose. Le clotrimazole (CTZ), un antifongique régulièrement utilisé dans le traitement d'infections fongiques cutanées, provoque le détachement de HKII de la mitochondrie lorsque des cellules y sont exposées. En utilisant le CTZ chez certains types cellulaires, seul ou en combinaison avec d'autres traitements, il a été possible de provoquer la mort de ces cellules [86,87,88]. Des peptides spécifiques mimant la partie N-terminale de THKII ont, de la même façon, permis de provoquer la mort cellulaire [88,89]. Finalement, une autre molécule, le 3-bromopyruvate (3-Br), un inhibiteur de THKII qui agit en dissociant HKII de la mitochondrie, a démontré son efficacité in vivo en permettant une nécrose importante du carcinome VX2, un modèle expérimental du carcinome hépatocellulaire chez le lapin [90,91,92]. Des résultats semblables ont été obtenus in vitro en utilisant des lignées cellulaires d'hépatomes [93]. Ces résultats démontrent l'importance des HK, en particulier THKII, dans la prolifération et la survie tumorale et que, en privant les cellules tumorales des fonctions spécifiques protumorales de HK, celles-ci deviennent plus susceptibles à la mort cellulaire.
4 Les filaments intermédiaires
Il existe 3 familles majeures de polymères fibreux dans la cellule formant le cytosquelette, soit les microtubules, les microfilaments et les filaments intermédiaires (FI). Les microtubules sont constitués des tubulines a et p et permettent, entre autres, la séparation des chromosomes et le transport à distance de particules dans la cellule. Les microfilaments sont constitués d'actine et apportent la structure mécanique aux cellules et permettent leur
motilité [94]. Type Nom I Kératines II Kératines III Vimentines IV Orphelines Desmines Protéines acides gliales fi
Périphérines Syncoilin Neurofilaments a-Internexines Synemines .amines A et C Lamines B1 et B2 Phakinines Filensines aires Tableau 1. Types de FI
Les protéines constituant la famille des FI fonctionnent comme protéines d'échafaudage cytosquelettiques au noyau et dans le cytoplasme. Il existe 5 types de FI, soit les type I, II, III, IV et V. Plusieurs protéines différentes se retrouvent au sein de chacune des familles (voir tableau 1) [95].
Les protéines de FI sont constituées de 3 domaines, un domaine central appelé le domaine « rod », constitué d'une hélice-a de 310 résidus (352 pour les lamines), qui est flanquée de chaque côté par un domaine tête et un domaine queue, qui varie en séquence, structure et propriétés, permettant l'hétérogénéité des FI.
a-helical rod 1B 2A
Apolar
Figure 7. Représentation schématique des FI et de leur assemblage [96]
Afin de donner des FI complets, les protéines de FI s'associent en pahes. Certaines protéines s'arrangent seulement en hétéropolymères (par exemple les kératines, les neurofilaments et la nestine) alors que d'autres peuvent s'arranger en homo ou hétéropolymères (vimentine et desmine). Ces associations se produisent au niveau du domaine « rod », où les partenaires monomériques s'associent tout d'abord en parallèle, puis les dimères obtenus s'associent entre eux de façon antiparallèle, donnant un tétramère apolaire. En multipliant ces associations, on obtient un FI apolaire de 10 nm de diamètre. Les domaines tête en N-terminale et queue en C-terminale permettent l'interaction entre les filaments et plusieurs autres protéines cellulaires, en plus de subir des modifications post-traductionnelles qui régulent la structure, l'organisation et la fonction des FI [96].
Dans la cellule, les FI interagissent avec un grand nombre de protéines, entre autres les protéines faisant le pont avec les complexes d'adhésion telles que la desmoplakine et la plectine. De plus, elles interagissent avec les organelles comme les mitochondries, l'appareil de Golgi, les endosomes et les lysosomes, en plus d'être ancrées à la surface du noyau. Les FI sont ainsi impliqués dans le support mécanique cellulaire, l'adhésion cellulaire, la signalisation cellulaire, la mort cellulaire, la croissance et la régénération tissulaire [96].
4.1 Les kératines
Les kératines (K) sont des protéines de FI exprimées préférentiellement dans les cellules épithéliales. Une première nomenclature les divisait en deux types, les kératines de type I, dites acides, et les kératines de type II, dites basiques. Chez les types I, on retrouvait alors les K9-K10, K12-K28 et les K31-K40 alors que chez les types II, ce sont les K1-K8 et les K71-K86 [97]. Depuis, cette nomenclature a été revue et les 54 kératines formant les types I et type II sont de plus divisées selon quatre critères, selon quelles soient des : 1) kératines épithéliales humaines, 2) kératines des cheveux humains, 3) kératines épithéliales ou des cheveux non humains ou 4) pseudogènes de kératines humaines [98]. Afin de former des FI, les kératines s'associent obligatoirement en hétéropolymères constitués d'une kératine acide et d'une kératine basique. Les cellules possèdent des paires spécifiques de kératines qui prédominent selon le type de cellules épithéliales et l'état de différenciation de la cellule. Par exemple, il y a le couple K5/K14 chez les kératinocytes de l'épiderme basai, le couple K1/K10 chez les kératinocytes de l'épiderme suprabasal. Comparativement, les
cellules de Tépithélium simple vont exprimer les K7, K8, K18, K19, K20 et K23 [99]. De toutes les kératines exprimées chez les cellules de Tépithélium simple, le couple K8/K18, qui est commun à toutes les cellules de Tépithélium simple, est le premier exprimé durant l'embryogenèse et chez certaines cellules, tels les hépatocytes, les cellules acinaires et des îlots du pancréas et les cellules du tubule proximal, il constitue le seul couple présent [100,101].
4.1.1 Les modifications post-traductionnelles
L'expression des kératines est modulée en réponse au stress, de même qu'elles peuvent être modifiées post-traductionnellement ou encore être réorganisées structurellement. Plusieurs modifications post-traductionnelles peuvent réguler les fonctions des kératines. La modification majeure est la phosphorylation, qui se produit aux domaines tête et queue. Cette phosphorylation peut se produire sur des résidus Ser, Thr ou Tyr. La phosphorylation des domaines va varier selon le type de kératine et selon le type et le contexte cellulaire. Chez la K8, il y a trois sites majeurs de phosphorylation, soit la Ser23, la Ser 73 et la Ser 431, alors que chez la Kl8 ce sont la Ser 33 et la Ser 52 qui sont les sites majeurs de phosphorylation [102]. Un certain nombre de kinases sont connues pour mener à la phosphorylation de ces résidus, telles que p38, la kinase c-jun-N-terminal (JNK), PKA et PKCÔ. Ces phosphorylations permettent, entre autres, de modifier la solubilité des filaments de kératines, jouent un rôle dans Tubiquitination et le turnover des kératines, en plus de permettre la liaison de protéines telles que 14-3-3 durant la mitose et des protéines de la voie Akt/mTOR lorsqu'en présence de sérum [100].
D'autres modifications post-traductionnelles ont été observées chez les K8 et Kl 8, soit la glycosylation, la sumoylation, la protéolyse et la transglutamination. Chez la Kl 8, il a été démontré que la glycosylation peut se produhe sur les Ser 30, 31 et 49, conférant une protection aux cellules en permettant la phosphorylation et l'activation de kinases dans la cellule [103]. De son côté, la sumoylation est l'ajout d'un polypeptide SUMO (small ubiquitin-like modifier) et affecte la localisation, l'interaction des kératines avec les partenaires de liaison ainsi que sa dégradation. Cette sumoylation se produit au domaine « rod » des kératines et a été démontrée sur les Lys 285 et 364 de la K8, sur les Lys 207 et 372 de la Kl8 et sur la Lys 208 de la Kl9. La sumoylation peut survenir lors d'un stress oxydant, lors de Tapoptose ou lors de l'inhibition des phosphatases. Une hypersumoylation
amène une insolubilité des filaments de kératines [104]. Durant Tapoptose, les FI sont clivés par les caspases. Ainsi, les caspases 3, 6 et 7 sont capables de cliver Taspartate 238 de la Kl8 durant le processus apoptotique et que ceci produisait des agrégats de fragments de Kl8 dans la cellule qui s'associaient alors à la caspase 3, protégeant la cellule contre la digestion induite par la caspase 3 [105]. Finalement, la transglutamination des kératines est observée dans des conditions physiologiques et pathologiques dans le foie et permet de fournir une structure compacte et protectrice à la cellule en conditions physiologiques alors qu'en conditions pathologiques, son rôle n'est pas bien compris [106].
4.1.2 Leurs multiples rôles
Les kératines ont longtemps été considérées comme étant le squelette des cellules épithéliales, leur conférant leur rigidité. Cependant, cette vision des kératines minimise leurs fonctions mécaniques et structurelles. En effet, les kératines peuvent se restructurer rapidement et de façon localisée afin de répondre à leur environnement et sont donc impliquées dans la migration, la différenciation et la prolifération. Les kératines vont être en mesure de se durcir rapidement, sans briser, lors d'une déformation et de retrouver une forme hautement viscoélastique et flexible lorsque la déformation se termine [102]. En plus de ces fonctions purement mécaniques, il a été démontré, chez les kératinocytes, que Téthement de la cellule pouvait stimuler l'entrée en phase S de la cellule en plus de mener à une modification de l'expression des kératines, telles que la suppression de l'expression de la Kl 0 et une induction de celle de la K6. Ces effets sont comparables à ceux observés lorsqu'il y a cicatrisation chez les kératinocytes, alors qu'il y a surexpression de la K6, Kl6 et Kl 7 et activation de la voie Akt/mTOR par la Kl 7, menant du même coup à une prolifération cellulaire [107].
En utilisant des cellules de Tépithélium simple, soit des cellules épithéliales alvéolaires, il a été possible de démontrer une régulation de l'assemblage de la K8/K18 par la PKCÔ lors d'un stress de cisaillement, la phosphorylation de la K8 sur la Ser73 par la PKCÔ menant à un désassemblage du couple K8/K18 [108]. Finalement, il a été observé que le couple K8/K18 était impliqué dans la réponse viscoélastique de la cellule au point focal d'adhérence en réponse à un stress mécanique en agissant par l'intermédiaire des microfilaments d'actine et des microtubules [109].
![Figure 4. La voie métabolique de la glycolyse [23]](https://thumb-eu.123doks.com/thumbv2/123doknet/7502287.225295/20.918.267.615.101.1014/figure-voie-métabolique-glycolyse.webp)
![Figure 5. Le cycle de Krebs [23]](https://thumb-eu.123doks.com/thumbv2/123doknet/7502287.225295/21.918.252.729.337.839/figure-le-cycle-de-krebs.webp)
![Figure 6. Synthèse du GSH [51]](https://thumb-eu.123doks.com/thumbv2/123doknet/7502287.225295/30.918.246.637.95.197/figure-synthèse-du-gsh.webp)
![Figure 7. Représentation schématique des FI et de leur assemblage [96]](https://thumb-eu.123doks.com/thumbv2/123doknet/7502287.225295/37.918.141.828.123.504/figure-représentation-schématique-assemblage.webp)