N° d’ordre : 2850
THÈSE DE DOCTORAT
Présentée par :
Muna Shueai Abdullah yahya
Discipline : Chimie
Spécialité : Électrochimie et Chimie Analytique
Soutenu le : 26 Mars 2016
Devant le jury
:Président :
M. KACIMI Mohammed PES, Faculté de Science de Rabat.
Examinateurs:
Mme CHAKIR Achraf PES, Faculté des Sciences et Techniques de
Mohammedia.
M. EL HOURCH Abderrahime PES, Faculté des Sciences de Rabat.
Mme GUESSOUS Aïcha PES, Faculté des Sciences de Rabat.
M. EL KACEMI Kacem PES, Faculté de Science de Rabat.
Rabat
Traitement de la pollution organique en milieu aqueux par le
Procédé électrochimique d’oxydation avancé ‘‘Électro-Fenton’’.
Application à la minéralisation des antibiotiques fluoroquinolones.
Dédicaces
A ma mère
ةيلاغلا
يمأ
يل
إ
A mon père
زيزعلا
يبأ
يلإ
A mes soeoeurs et frères
Ce travail a été réalisé au sein de l’Équipe d’Électrochimie et Chimie Analytique (EECA) de la Faculté des Sciences relevant de l’Université Mohammed V, Rabat sous la direction du le Professeur Kacem EL KACEMI.
Je tiens tout d’abord à adresser mes plus sincères et respectueux remerciements à mon Directeur de thèse Monsieur le Professeur Kacem EL KACEMI responsable de l’EECA, d’avoir accepté d’encadrer le travail de cette thèse et l’opportunité qu’il m’a donné dans le but de réaliser un travail scientifique à la fois enrichissant et très passionnant. Je le remercie pour sa compréhension de nos longues discussions, ses conseils, sa patience et sa présence inconditionnelle qui ont fortement contribué aux résultats de ce travail.
La présente étude a bénéficié de la contribution de plusieurs institutions à l’échelle nationale et internationale.
Je tiens à remercier Monsieur KACIMI Mohammed Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat, de l’honneur qu’il m’a témoigné en acceptant de présider le jury de cette thèse
J’exprime ma reconnaissance à Madame CHAKIR Achraf, Professeur de l’Enseignement Supérieur à la Faculté des Sciences et Techniques de Mohammedia pour l’intérêt quelle a ont porté à cette étude et pour avoir accepté d’être les rapporteurs de ce travail.
J’exprime ma reconnaissance à Monsieur EL HOURCH Abderrahime, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat, pour l’intérêt qu’il a porté à cette étude et pour avoir accepté d’être rapporteur de ce travail.
Madame GUESSOUS Aïcha, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat me fait l’honneur de participer au jugement de ce travail. Qu’elle trouve ici mes sincères remerciements
Je tiens à remercier vivement Monsieur le Professeur Mehmet Ali OTURAN et Madame OTURAN Nihal, Docteur Ingénieur, pour leur aide précieuse en assurant en partie la réalisation des études analytiques, spectrométriques et chromatographiques au sein de l’équipe de Chimie de l’Environnement du Laboratoire des Géomatériaux et Environnement (LGE) à l’Université Paris-Est, Marne La Vallée dans le cadre de la convention de coopération qui existe entre nos deux Universités. Également, je tiens à exprimer ma reconnaissance à Monsieur
Miloud EL KARBANE pour son soutien infaillible et son aide constante. Je lui adresse mes remerciements pour sa collaboration scientifique fructueuse pour mener à terme ce travail de thèse et notamment les analyses HPLC effectuées sous sa direction au sein du Laboratoire National de Contrôle des Médicaments de Rabat.
Enfin je remercie chaleureusement tous ceux qui ont contribué d’une façon ou d’une autre de loin ou de près à l’accomplissement de cette thèse. Je leur témoigne tout le respect que je leur éprouve et l’admiration que j’ai pour eux. Merci à tous et à toutes.
l'un des produits pharmaceutiques les plus nocifs sont les antibiotiques en raison de leur forte production dans le monde et leurs larges utilisations. Le problème des antibiotiques, est qu'ils possèdent une faible biotransformation, ce qui signifie qu'ils sont excrétés presque inchangée dans l'urine ou les fèces. L'entrée principale des antibiotiques dans l’environnement, est par les eaux usées, car ils ne sont pas éliminés au cours de son traitement dans les stations d'épuration des eaux usées communs. Dans ce travail, nous avons fait appel au procédé électro-Fenton (EF) pour étudier l’élimination par minéralisation en milieu aqueux des trois antibiotiques appartenant à la famille des fluoroquinolones: la ciprofloxacine (CIP), la lévofloxacine (LEV) et la moxifloxacine (MOX). le procédé EF est une technique électrochimique d’oxydation avancée de pointe basée sur la production in situ des radicaux hydroxyles ●OH, réactifs qui ont un pouvoir oxydants très élevés (E° = 2,8 V/ESH). Il a été montré que la réaction de dégradation oxydative des trois antibiotiques par
●OH suit une cinétique de pseudo-premier ordre. Les constantes de vitesse absolue, déterminées par
la méthode de la cinétique de compétition sont de (1.01 ± 1.14) × 109 et (2.84 ± 0.18) × 109 mol-1 L s-1 pour CIP et LEV respectivement, La minéralisation de solutions aqueuses d'antibiotiques atteint un degré quasi-total (supérieur à 91%) au bout de 6 h d’électrolyse à I = 400 mA. Le suivi et l’identification des intermédiaires aromatiques et aliphatiques formés et des ions inorganiques libérés au cours de la minéralisation, ont permis de proposer un schéma plausible de cette minéralisation. L’ensemble de ces résultats confirment clairement l’efficacité du procédé EF à traiter les eaux polluées par ces antibiotiques.
Abstract
The water pollution by pharmaceutics products is an emerging environmental problem. Antibiotics belong to the class of the most harmful drugs because of their high production in the world and their various and diverse uses. A major problem with the antibiotics is that they have low biotransformation, which means they are excreted almost unchanged in the urine or feces. The main entrance of antibiotics in the environment is through wastewater because they are not removed during the treatment in the common wastewater treatment plants.
In this work, we have used the electro-Fenton process (EF) to study the elimination in aqueous environment by mineralization of three antibiotics belonging to the Fluoroquinolone, namely: Ciprofloxacin (CIP), Levofloxacin (LEV), and Moxifloxacin (MOX). EF process is an advanced electrochemical oxidation technique based on the production of hydroxyl radicals in situ ●OH, which have a very high oxidizing power (E° = 2.8 V/ESH). It has been shown that the oxidative degradation reaction of the three antibiotics by ●OH follows pseudo-first order kinetics. The absolute rate constants determined by the method of competition kinetics are (1.01±1.14) ×109 and (2.84±0.18)×109 mol-1 L s-1 for CIP et LEV respectively. Mineralization from aqueous solutions of antibiotics reached an almost total degree (superior than 91%) after 6 hours of electrolysis at I = 400 mA. Monitoring and identification of aliphatic and aromatic intermediates formed and inorganic ions released during mineralization, allowed us proposing a plausible Pathway of this mineralization. All these results clearly confirm the effectiveness of the EF method for the treatment of water polluted by the mentioned antibiotics.
LISTE DES TABLEAUX LISTE DES ABRÉVIATIONS
INTRODUCTION GÉNÉRALE ...1
PARTIE I : ÉTUDE BIBLIOGRAPHIQUE
CHAPITRE I.1 :
Produits pharmaceutiques : Généralités et Impacts
surl’Environnement
I.1. INTRODUCTION ...7I.2. GÉNÉRALITÉS SUR LES PRODUITS PHARMACEUTIQUES...7
I.2.1. Définition...7
I.2.2 Historique...8
I.2.3 Classification des médicaments...9
I.3. CONTAMINATION ENVIRONNEMENTALE...11
I.3.1 Contamination de l’atmosphère...11
I.3.2 Contamination des sols...12
I.3.3 Contamination des milieux aquatiques et des ressources en eau douce...12
I.4. POLLUANTS ORGANIQUES D’INTÉRÊT ÉMERGENT RETROUVÉS DANS LES EAUX USÉES RÉSIDUAIRES...13
I.5 RÉSIDUS MÉDICAMENTEUX DE TYPE ANTIBIOTIQUE...14
I.6 LES ANTIBIOTIQUES DE LA FAMILLE FLUROQUINOLONES...14
I.6.1 Présentation générale...17
I.6.2. Structure chimique des fluoroquinolones...17
I.6.3. Mode d'action des fluoroquinolones ...18
I.6.4. Classification des quinolones...19
I.6.5 Propriétés physicochimiques des antibiotiques fluoroquinolones étudiés...19
CHAPITRE I.2 :
Procédés d’oxydation avancée pour le traitement des eaux
contaminées par de polluants organiques persistants
II.1 Introduction...
22II.2 PROCÉDÉS DE TRAITEMENT DES EAUX USEES ...23
II.2.1 LES PROCÉDÉS CLASSIQUES...23
II.2.2 Procédés biologiques...23
II.2.3 Procédés physiques...23
II.2.3.1 Adsorption sur charbon actif. ...24
II.2.3.2 Filtration membranaire...24
II.2.4 Procédés chimiques...24
II.5 LES PROCÉDÉS D’OXYDATION AVANCÉE(POA) ...25
II.5.1 Définition et principe des POA...25
II.5.2 Les radicaux hydroxyles...28
II.5.3 Constantes cinétiques de réaction entre les radicaux hydroxyles et les composés organiques...29
II.6.2. Photocatalyse homogène : photo-Fenton...33
II.6.3. Photocatalyse hétérogène avec TiO2...33
II.7 Ozonolyse...33
II.8 Sonolyse (irradiation par les ultrasons) ...34
II.9 Procédés électrochimiques...35
II.9.1. Electrochimie directe : Oxydation anodique...35
II.9 .2. Electrochimie indirecte: Procédé électro-Fenton...35
PARTIE II : ÉTUDE EXPERIMENTALE
CHAPITRE II.1 :
Protocoles expérimentaux et Méthodes analytiques
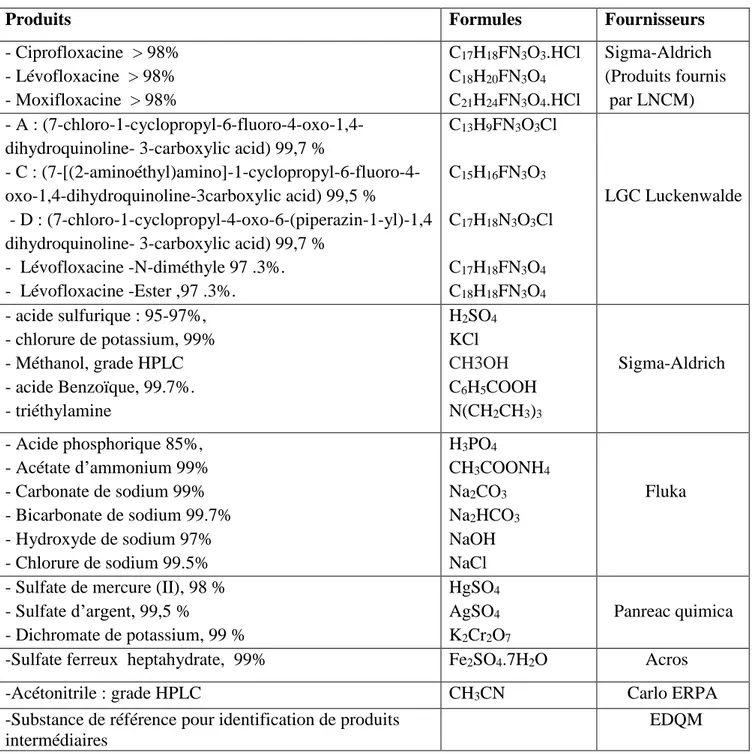
II.1.1 PRODUITS CHIMIQUES...42II.1.2 DISPOSITIF EXPÉRIMENTAL...43
II.1.3 LES TECHNIQUES ANALYTIQUES...44
II.1.3.1 La demande chimique en oxygène (DCO) ...44
II.1.3.2 Le carbone organique total (COT) ...45
II.1.3.3 La Chromatographie en phase liquide...47
II.1.3.4 La chromatographie Liquide à Haute Performance (CLHP) ...47
II.I.3.5 Analyse d’antibiotiques et de produits intermédiaires par la CLHP...47
II.1.3.6 La spectrométrie de masse ...49
II.1.3.7 La chromatographie liquide couplée à la spectrométrie de masse (LC-MS et LCMS/MS) ...49
II.1.3.8 La chromatographie ionique...51
II.1.4 DÉTERMINATION DES CONSTANTES CINÉTIQUES...52
CHAPITRE II.2 :
Cinétique de dégradation des antibiotiques CIP, LEV et MOX
par le procédé EF
II.2.1 INTRODUCTION...55II.2.2 ÉTUDE DES PARAMÈTRES INFLUENTS L’OXYDATION DES ANTIBIOTIQUES ÉTUDIÉS...55
II.2.2.1 Effet du courant appliqué...56
II.2.2.2 Effet de la concentration du catalyseur Fe (II). ...60
II.2.3 DÉTERMINATION DES CONSTANTES DE VITESSE APPARENTES ET ABSOLUES ...65
II.2.3.1 Constantes de vitesse apparentes ...65
II.2.3.2 Constantes de vitesse absolues...70
II.2.4 : ÉTUDE PAR HPLC MISE EN ÉVIDENCE DE PRODUITS INTERMÉDIAIR...73
II.2.5 CONCLUSION...76
CHAPITRE II.3 :
Minéralisation des antibiotiques CIP, LEV et MOX par
le procédé EF Etudes cinétique et mécanistique
II.3.1 INTRODUCTION...78II.3.2 ESSAIS PRÉLIMINAIRES...78
II.3.3ÉTUDE DES PARAMÈTRES INFLUENTS LA MINÉRALISATION DES ANTIBIOTIQUES CIP, LEV ET MOX...79
LA MINÉRALISATION DES ANTIBIOTIQUES ÉTUDIÉS...92
II.3.4.1. Cas de la Ciprofloxacine (CIP) ...93
II.3.4.2 : Cas de la Lévofloxacine (LEV) ...94
II.3.5 IDENTIFICATION DES INTERMÉDIAIRES RÉACTIONNELS ET VOIES DE DÉGRADATION...95
II.3.5.1Cas de la ciprofloxacine (CIP)...96
II.3.5.2Cas de la lévofloxacine (LEV) ...102
II.3.5.3 Cas de la Moxifloxacine (MOX)………...113
II.3.6 CONCLUSIO...121
CONCLUSION GÉNÉRALE ... 123
CHAPITRE I.1 :
Produits pharmaceutiques : Généralités et Impacts
surl’Environnement
Figure I.1.1 : Synthèse de l’acide nalidixique……….………..17
Figure I.1.2 : Formule semi-développée d’une molécule de fluoroquinolones……...………....…..18
CHAPITRE I.2 :
Procédés d’oxydation avancée pour le traitement des eaux
contaminées par de polluants organiques persistants
Figure I.2.1 Principaux procédés de production des radicaux hydroxyles………...………….27Figure I.2.2. Le mouvement des ondes acoustiques relié à la croissance et à l'implosion des
bulles………..……….34
Figure I.2.3 Production électrocatalytique des radicaux hydroxyles dans le procédé électro-Fenton
………..……..37
Figure I.2.4 Cycle catalytique simplifié du procédé Electro-Fenton……….37
PARTIE II : ÉTUDE EXPERIMENTALE
CHAPITRE II.1 :
Protocoles expérimentaux et Méthodes analytiques
Figure II.1.1 : Schéma de la cellule utilisée pour effectuer les expériences "électro- Fenton……..43
Figure II.1.2 : Photographie de l’analyseur de DCO………...………..45
Figure II.1.3 : Analyseur du Carbone Organique Total TOC-VCSH…..………..……….46
CHAPITRE II.2 :
Cinétique de dégradation des antibiotiques CIP, LEV et MOX
par le procédé EF
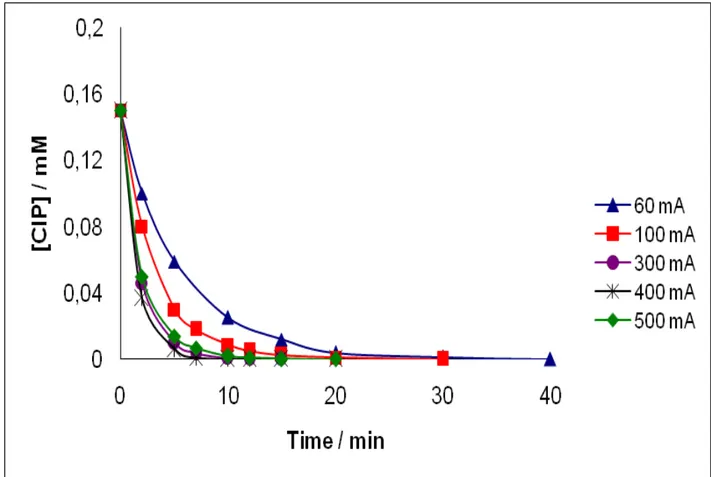
Figure II.2.1 : Cinétique d’oxydation de la ciprofloxacine (CIP) lors de traitement d'une solution
aqueuse par le procédé électro-Fenton. [CIP] = 0,15 mmol L-1; V = 0,23 L; [Fe2+] = 0,1 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L
-1
; I = 60 - 500 mA…..………...……….57
Figure II.2.2 : Cinétique de l'oxydation du LEV lors de traitement d'une solution aqueuse par le
procédé électro-Fenton. [LEV] = 0,15 mmol L-1; V = 0,2 L; [Fe2+] = 0,1 mmol L-1; pH = 3;
[Na2SO4] = 0,05 mol L-1; I = 60 - 500 mA. …..………...………..59
Figure II.2.3 : Cinétique d’oxydation en solution aqueuse de MOX lors de traitement par le
procédé électro-Fenton. [MOX] = 0,15 mmol L-1; V = 0,2 L; [Fe2+] = 0,5 mol L-1; pH = 3; [Na2SO4] = 0,05 mol L
-1
; I variant de 60 à 500 mA. …..………..…….60
Figure II.2.4. Influence de la concentration de Fe2+ en tant que catalyseur lors de la minéralisation du CIP par le procédé électro-Fenton. [CIP] = 0,51 mmol L-1; V = 0,23 L; I = 400 mA; pH = 3; [Na2SO4] = 0,05 mol L
-1
; [Fe2+] = 0,05 - 0,5 mmol L-1. …..……….61
Figure II.2.5 : Influence de la concentration de Fe2+ en tant que catalyseur lors de la minéralisation du LEV par le procédé électro-Fenton. [LEV] = 0,51 mmol L-1; V = 0,2 L; I = 400 mA; pH = 3;
radicaux hydroxyles. [CIP] = 0,15 mmol L-1; V = 0,23 L; [Fe2+] = 0,1 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60 - 500 mA. ..………..……….……….66
Figure II.2.8 : Détermination des constantes de vitesse apparentes pour la réaction de CIP avec les
radicaux hydroxyles. [CIP] = 0,15 mmol L-1; V = 0,23 L; ; I = 400 mA ; pH = 3; [Na2SO4] = 0,05 mol L-1; [Fe2+] = 0,05 - 0,5 mmol L-1. ..………..……….……….66
Figure II.2.9 : Détermination des constantes de vitesse apparentes pour la réaction de LIV avec les
radicaux hydroxyles. [LIV] = 0,15 mmol L-1; V = 0,2 L; [Fe2+] = 0,2 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60 - 500 mA. ..………..……….………….67 Figure II.2.10 : Détermination des constantes de vitesse apparentes pour la réaction de LIV avec
les radicaux hydroxyles. [LIV] = 0,15 mmol L-1; V = 0,2 L; I = 400 mA; [Na2SO4] = 0,05 mol L-1 ; pH = 3; [Fe2+] = 0,05-0,5mmol L-1. ..………..……….………....67
Figure II.2.11 : Détermination des constantes de vitesse apparentes pour la réaction du MOX avec
les radicaux hydroxyles. [MOX] = 0,15 mmol L-1; V = 0,2 L; [Fe2+] = 0,5 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60 - 500 mA..………..………....68
Figure II.2.12: Détermination des constantes de vitesse apparentes pour la réaction de MOX avec
les radicaux hydroxyles. [MOX] = 0,15 mmol L-1; I = 500 mA; pH = 3; [Na2SO4] = 0,05 mol L-1; V = 0,2 L; [Fe2+] = 0,1 – 1,0 mmol L-1. ..………..……….………...68 Figure II.2.13 : Détermination de la constante de vitesse absolue pour la réaction d'oxydation de
CIP avec les radicaux hydroxyles au cours du procédé électro-Fenton. [CIP] = [AB] = 0,1 mmol L
-1
; V = 0,2 L; [Fe2+] = 0,1 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60 mA. ..…………...72 Figure II.2.14 : Détermination de la constante de vitesse absolue pour la réaction d'oxydation de
LEV avec les radicaux hydroxyles au cours du procédé électro-Fenton. [LEV] = [AB] = 0.1 mmol
L-1; V = 0.2 L; [Fe2+] = 0,1 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60 mA..…………...72 Figure II.2.15 : Chromatogrammes représentant l’évolution de l’aire du pic correspondant à La CIP
dans la solution au cours de l’électrolyse : [Na2SO4] = 0,05M; [Fe2+] = 0,1 mM ; pH= 3 ; C0 = 0,15
mM ; V = 0,2 L; I = 80 mA. ..………..………...75
Figure II.2.16 : Chromatogrammes représentant l’évolution de l’aire du pic correspondant à La
LEV dans la solution au cours de l’électrolyse : [Na2SO4] = 0,05 M; [Fe2+] = 0,1 mM ; pH = 3 ;
C0 = 0,15 mM ; V = 0,2 L; I = 100 mA. ..……….………..………...75
CHAPITRE II.3 :
Minéralisation des antibiotiques CIP, LEV et MOX par
le procédé EF Etudes cinétique et mécanistique
Figure II.3.1 Traitement par procédé EF : cas de la ciprofloxacine prise en solution à une
concentration de 0,15 mmol L-1 et pour un courant appliqué égale à 400 mA. Concentration en
catalyseur Fe2+ égale à0.1 mmol L-1..………...…….………..………...79
Figure II.3.2 : Évolution du COT en fonction du temps d’électrolyse et du courant appliqué lors du
traitement électro-Fenton d'une solution aqueuse de CIP. [CIP] = 0,15 mmol L-1; V = 0,23 L; [Fe2+] = 0,1 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60 - 400 mA..……….…...81
Figure II.3.3 : Évolution de l'efficacité du courant de minéralisation en fonction de temps
d’électrolyse d’une solution aqueuse de 0,15 mmol L-1 en ciprofloxacine ; pH = 3 ;
[Na2SO4] = 0,05 mol L-1; I = 60 - 400 mA. ..………..….…...84
Figure II.3.5 : Évolution de l'efficacité du courant instantané en fonction du temps d’électrolyse
d’une solution aqueuse de la lévofloxacine (0,15 mmol L-1), pH = 3, électrolyte support: Na2SO4 (0,05 mol L
-1
)..……..………...………..….…...86
Figure II.3.6 : Évolution de la DCO en fonction du temps d’électrolyse et du courant appliqué lors
du traitement électro-Fenton d'une solution aqueuse de MOX. [MOX] = 0,15 mmol L-1; V = 0,2 L; [Fe2+] = 0,2 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 60-400 mA……..….…………...87 Figure II.3.7 : Évolution de l'efficacité du courant instantané en fonction du temps d’électrolyse
d’une solution aqueuse de 0,15 mmol L-1 de la moxifloxacine. [Na2SO4] = 0,05 mol L -1
, pH=
3………..87
Figure II.3.8 : Effet de la concentration initiale du catalyseur Fe2+ sur la lévofloxacine en fonction du temps durant le traitement électro-Fenton d'une solution aqueuse de LEV. [LEV] = 0,15 mmol
L-1; V = 0,2 L; pH = 3; [Na2SO4] = 0,05 mol L-1; I = 400 mA…………....….………...89 Figure II.3.9 : Effet de la concentration initiale du catalyseur sur moxifloxacine en fonction du
temps durant le traitement électro-Fenton d'une solution aqueuse de MOX. [MOX] = 0,15 mmol
L-1; V = 0,2 L; pH = 3; [Na2SO4] = 0,05 mol L-1; I= 500 mA………...90
Figure II.3.10 : Effet de la concentration initiale d’antibiotique sur l'évolution du DCO en fonction
du temps d'électrolyse lors de traitement électro-Fenton de MOX. [MOX]0 = 0,075- 0,12- 0,15 et
0,2 mmol L-1; V = 0,2 L; [Fe2+] = 0,2 mmol L-1; pH = 3; [Na2SO4] = 0,05 mol L
-1
; I = 400 mA.
……….………...92
Figure II.3.11 Evolution des ions nitrate, ammonium, fluorure et chlorure lors du traitement électro-Fenton de solution aqueuse de CIP. [CIP] = 0,15 mmol L-1; V = 0,23 L; pH = 3; [Fe2+] = 0,1 mmol L-1; [Na2SO4] = 0,05 mol L-1; I = 400 mA. …...94
Figure II.3.12 : Temps cours de ions inorganiques NH4+ et NO3- libéré pendant l'électrolyse de
0,15 mM LEV mM Na2SO4 en pH 3 et à température ambiante avec un courant appliqué de 400
mA en présence de 0,1 mM d'ions Fe2+ en tant que catalyseur…...95
Figure II.3.13 : Chromatogrammes HPLC des échantillons prélevés au cours de la minéralisation
de la ciprofloxacine par le procédé électro Fenton à différentes échelles de temps.
[CIP]0 = 0,15 mM ; I = 80 mA, [Fe 2+] = 0,1 mM ; [Na2SO4] = 0,05 M, V: 0,2 L et pH = 3.
…...97
Figure II.3.14 : (1, 2, 3) Chromatogrammes HPLC au cours de la dégradation de la ciprofloxacine
(CIP) par le procédé EF jusqu’à 6 min d’électrolyse. [CIP]0 = 0,15 mM, pH 3, [Fe2 +] = 0,1 mM,
[Na2SO4] = 0,05 M, I = 80 mA, V = 0,2 L à la température ambiante…...98
Figure II.3.15 : (4, 5) Chromatogrammes HPLC au cours de la dégradation de la ciprofloxacine
(CIP) par le procédé EF jusqu’à 10 min d’électrolyse. [CIP]0 = 0,15 mM, pH 3, [Fe2 +] = 0,1 mM,
[Na2SO4] = 0,05 M, I = 80 mA, V = 0,2 L à la température ambiante. …...99
Figure II.3.16 : Les spectres de masse MS/MS des composés B, C et F dérivés de l'analyse de la
solution de la ciprofloxacine (CIP) traitée par le processus électro-Fenton. [CIP]0 = 0,15 mM (60
mg L-1), [Fe2+] = 0,1 mM, [Na2SO4] = 0,05 M, I = 80 mA, V = 0,2 L, pH 3. …...100
Figure II.3.17 : Principales voies de réaction proposées pour la minéralisation de la CIP par les
radicaux hydroxyles générés pendant le processus électro-Fenton. …...103
Figure II.3.18 : Chromatogrammes HPLC des échantillons prélevés pendant les 10 premières
minutes du processus électro-Fenton de la LEV. [LEV]0 = 0,15 mM, I = 100 mA,
minutes de la minéralisation de LEV par le procédé de l'électro-Fenton. L’identification a été faite par comparaison des temps de rétention respectifs avec ceux des produits purs standards …...107
Figure II.3.21 : Les spectres de masse des composés (2,3,4,7 et 8) dérivée de l'analyse de la
solution de LEV traitée par le processus électro-Fenton MS-MS. [Fe2 +] = 0,1 mM, [LEV] 0 =
0,15mM [Na2SO4]=0,05M , I=100 mA , V = 0,2 L, pH = 3. …...108
Figure II.3.22 : Les spectres de masse des composés B et (1,5,6 et 9) dérivée de l'analyse de la
solution de la LEV traitée par le processus électro-Fenton MS-MS. [Fe2 +] = 0,1 mM, [LEV]0 = 0,15mM [Na2SO4]=0,05M , I=100 mA , V = 0,2 L, pH = 3. …...109
Figure II.3.23 : Principales voies de réaction proposées pour la minéralisation de la LEV par les
radicaux hydroxyles généré pendant le processus électro-Fenton. …...114
Figure II.3.24: Chromatogrammes HPLC des intermédiaires (1, 2, 3 et 4) obtenus lors de la
dégradation électro-Fenton de MOX après huit min électrolyse. Ces intermédiaires ont été identifiés par comparaison de leur temps de rétention en HPLC et les spectres UV avec ceux de produits purs standards. …...115
Figure II.3.25 : Les spectres de masse des composés (1,2 et 4) dérivée de l'analyse de la solution de
la MOX traitée par le processus électro-Fenton. [Fe2 +] = 0,5 mM, [LEV]0 = 0,15 mM,
[Na2SO4] = 0,05M, I = 500 mA , V = 0,2 L, pH = 3. ………...116
Figure II.3.26 : Les spectres de masse des composés ( 5 et 6 ) dérivée de l'analyse de la solution de
la MOX traitée par le processus électro-Fenton. [Fe2 +] = 0,5 mM, [LEV]0 = 0,15 mM, [Na2SO4] = 0,05M, I = 500 mA , V = 0,2 L, pH = 3. ………...117
Figure II.3.27 : Les spectres de masse des composés (7 et 8) dérivée de l'analyse de la solution de
la MOX traitée par le processus électro-Fenton. [Fe2 +] = 0,5 mM, [LEV]0 = 0,15 mM,
PARTIE I : ÉTUDE BIBLIOGRAPHIQUE
CHAPITRE I.1 :
Produits pharmaceutiques : Généralités et Impacts
surl’Environnement
Tableau I.1.1 : Quelques classes thérapeutiques de médicaments………10
Tableau I.1.2 : Concentrations des antibiotiques détectés dans l'environnement………...………16
Tableau I.1.3 : Propriétés physico-chimiques des antibiotiques étudiés………...…20
CHAPITRE I.2 :
Procédés d’oxydation avancée pour le traitement des eaux
contaminées par de polluants organiques persistants
Tableau I.2.1: Potentiel d’oxydation des oxydants utilisable en milieu aqueux……….…..…26
Tableau I.2.2 : Constantes de vitesse de réaction entre les OH et quelques composés organiques en
milieu aqueux………..………...30
Tableau I.2.3 : Orientation de la réaction d’hydroxylation par les substituants lors de la substitution
électrophile sur aromatique…...31
PARTIE II : ÉTUDE EXPERIMENTALE
CHAPITRE II.1
:
Protocoles expérimentaux et Méthodes analytiques
Tableau II.1.1: Produits chimiques utilisés dans ce travail de thèse…...42
Tableau II.1.2 : Courbes d’étalonnage obtenues pour le dosage des antibiotiques par CLHP.……48
Tableau II.1.3: Conditions chromatographiques de détection des différents antibiotiques étudiés49
Tableau II.1.4 : Paramètres d’analyse chromatographique LC-MS………...51
CHAPITRE II.2:
Cinétique de dégradation des antibiotiques CIP, LEV et MOX
par le procédé EF
Tableau II.2.1 : Constantes de vitesses apparentes (kapp) pour la dégradation de CIP………...69
Tableau II.2.2 : Constantes de vitesses apparentes (Kapp) pour la dégradation de la LIV………....69 Tableau II.2.3 : Constantes de vitesses apparentes (Kapp) pour la dégradation de la MOX……...70
Tableau II.2.4 : Constantes de vitesse absolues (kabs) pour la dégradation oxydative des
antibiotiques CIP et LEV par les radicaux hydroxyles en utilisant la méthode de cinétique de
compétition avec l’acide benzoïque (kAB = 4,3× 109 M -1 s-1)………...72
CHAPITRE I.3 :
Minéralisation des antibiotiques CIP, LEV et MOX par le
procédé EF Etudes cinétique et mécanistique
Tableau II.3.1 : Produits aromatiques identifiés par HPLC et LC-MS/MS au début de la
minéralisation de la ciprofloxacine par procédé électro-Fenton. ………..…..101
Tableau II.3.2 : Les produits intermédiaire identifié par HPLC et LC-MS/MS Lors de la
dégradation du traitement de la LEV par procédé électro-Fenton………....110
Tableau II.3.3 : Les produits intermédiaire identifié par HPLC et LC-MS/MS Lors de la
MOX: Moxifloxacine
A, B, C, D ,E ,F : intermédiaires
L’OMS : l’organisation mondiale de la santé DCO : Demande chimique en oxygène ICE : courant instantanée
POA : Procédé d’oxydation avancée DBO5: Demande biologique en oxygène ESH : Electrode standard à hydrogène S : Substrat
Kabs : Constante absolue
Kapp : Constante apparente
Eq : Equation UV : Ultra-violet
OA : Oxydation anodique EF: Electro-Fenton
•
OHads: Radicaux hydroxyles adsorbés ●OH: radicaux hydroxyles
BDD : Boron Doped Diamond « Diamant dopé au bore » Pt : Platine
CLHP : Chromatographe liquide à haute performance
LC-MS-MS: Liquid chromatography-Mass spectroscopy-Mass spectroscopy CI: Chromatographe ionique
COT : Carbone organique totale
MCE : L'efficacité du courant de la minéralisation ( Minéralisation current efficiency ). F: Constante de Faraday (96487 C mol-1)
Vs: Volume de la solution
m : Nombre d’atomes de carbone I: Courant appliqué (A)
t: Temps d’électrolyse (h)
n: Nombre d’électron échangé par la molécule de antibiotique AB : Acide benzoïque
PSPP: Produits de Soins Personnels et Pharmaceutiques PPs: Produits pharmaceutiques
PE :perturbateur endocrinien STEP: Stations d'épurations FQ: Fluoroquinolone AB : acide Benzoïque SCP : sulfachlopyridazine KD: coefficient de sorption OTC : oxytétracycline CTC : chlorotétracycline TC: tétracycline TCs: tétracyclines
LNCM: Laboratoire National de Contrôle de médicaments ESI: Pulvérisation ionique
ECS: électrode au calomel à KCl saturé psi: pound per square inch
Au rythme de croissance actuel, la consommation mondiale d'eau atteindrait 4,7 milliards de m3 par an d'ici 2020, ce qui est supérieur aux capacités de renouvellement des réserves.
A ce problème de pénurie d’eau s’ajoute celui de la pollution par les matières organiques et métaux lourds. En effet, au cours du XXème cycle, les rejets domestiques et industriels ainsi que les pollutions d’origine agricole ont grandement contribué à la dégradation de la qualité des eaux de surface et souterraines. Ces diverses pollutions ne sont pas sans impact sur le milieu naturel et la santé humaine.
Selon l'organisation mondiale de la santé (l’OMS), 3,4 millions de personnes décèdent chaque année de la pollution aquatique, 2,6 milliards de personnes ne disposent pas de sanitaires, 3.1% des décès dans le monde sont expliqués par une mauvaise qualité de l'eau de l'assainissement et de l'hygiène.
Une réglementation de plus en plus stricte s’est progressivement mise en place au fil des ans. Pour répondre à ces contraintes, des efforts importants ont été portés sur la diminution des rejets polluants par la mise en place de technologies propres et la dépollution d’effluents gazeux et d’eaux usées avant leur rejet dans le milieu naturel
Parmi les polluants organiques émergents, on trouve les résidus de produits pharmaceutiques. Ces produits médicamenteux sont des éléments essentiels de la médecine moderne qui apportent d’importants bienfaits à la société. Environ 4000 principes pharmaceutiques actifs sont administrés à l’échelle mondiale dans les médicaments sur ordonnance, les médicaments thérapeutiques en vente libre et dans les médicaments vétérinaires.
Alors que ces produits pharmaceutiques sont strictement réglementés pour en contrôler l’efficacité et assurer la sécurité du patient, les effets secondaires nocifs qu’ils peuvent avoir sur l’environnement naturel n’ont pas encore été suffisamment étudiés et ne sont pas couverts par un accord ou un arrangement international.
Les produits pharmaceutiques sont des substances biologiquement actives qui affectent les mécanismes de contrôle des organismes vivants, par exemple en régulant le métabolisme, en influant sur l’équilibre hormonal ou en atténuant la transmission de signaux entre les cellules. Une fois rejetée dans l’environnement, cette activité biologique peut avoir un impact négatif sur la faune et la flore (les «organismes non-cibles») et altérer la santé des écosystèmes.
l’attention du public sur la contamination de l’eau par des résidus de produits pharmaceutiques et cosmétiques et de leurs dérivés (métabolites).
Cette nouvelle forme de pollution est issue principalement des traces médicamenteuses contenues dans les urines, mais aussi des médicaments jetés par les particuliers dans leurs toilettes pour s’en débarrasser, ainsi que des eaux usées des hôpitaux. Les exploitations d’élevage sont également une source de pollution de l’eau par des antibiotiques. La consommation de médicaments étant à la hausse dans les pays riches depuis quelques décennies, cette pollution s’accentue en proportion et fait craindre que certains seuils critiques soient atteints. Or cette problématique n’a jamais été prise en compte dans la gestion de l’eau. La plupart des stations d’épuration (STEP) ne sont pas équipées pour éliminer ces substances. Même si l’aspirine y est dégradée à plus de 90 %, on en retrouve des traces dans les eaux usées libérées et donc dans les cours d’eau. Certains autres composés comme la carbamazépine (un antiépileptique) ou le diclofénac (un anti-inflammatoire) ne se dégradent quasiment pas.
Les recherches en écotoxicologie se tournent actuellement vers l’étude des effets sur les écosystèmes de composés actifs à de très faibles concentrations (de l’ordre de la dizaine de ng/l). Des études sur les risques pour l’homme et pour l’écosystème liés aux résidus médicamenteux présents dans l’environnement sont recommandées pour comprendre leurs comportements et leurs devenirs dans l’environnement.
La biodégradation des produits pharmaceutiques intervenant aussi bien dans le milieu naturel que dans les STEP s’exerce de manière faible et produit parfois des composés plus toxiques que la molécule mère.
L’élimination complète de résidus pharmaceutiques n’est possible qu’avec des technologies avancées utilisant des processus chimiques et physiques comme la filtration à travers des membranes denses (osmose inverse), l’adsorption sur du charbon actif ou des processus d’oxydation avancée.
Dans ce travail, nous avons fait appel au procédé électrochimique d’oxydation avancée dit ‘‘Electro-Fenton’’ (EF) pour étudier et déterminer les conditions expérimentales optimales de dégradation et de minéralisation en solution aqueuse de trois antibiotiques de la famille des fluoroquinolones : la ciprofloxacine (CIP), la lévofloxacine (LEV) et la moxifloxacine (MOX). Le choix de cette étude se justifie par le fait que ces produits médicamenteux sont non biodégradables
(bio-réfractaires) et largement solubles en milieu aqueux et peuvent donc se trouver dans l’eau en tant que polluants organiques persistants.
Le procédé électrochimique d’oxydation avancée, communément appelé procédé Électro-Fenton, est basé sur la génération électrochimique indirecte des radicaux hydroxyles •OH. Ce sont ces oxydants puissants qui sont responsables de la complète minéralisation de toute matière organique présente en solution. De nombreuses études ont appliqué le procédé EF à la dégradation d’une variété de composés organiques persistants incluant pesticides, polluants industriels, solvants chlorés, [1-12]. L’avantage de ce type de procédé est sa non sélectivité vis-à-vis des substances organiques.
Au cours des différents chapitres de ce travail, et dans une première partie consacrée à l’étude bibliographique, il sera donné et expliqué quelques généralités sur les produits pharmaceutiques (les antibiotiques en particulier) et leur impact sur l’environnement (chapitre I) et comment les procédés électrochimiques d’oxydation avancée peuvent être appliqués sur les produits organiques pour les éliminer complètement de l’eau (chapitre II).
Dans la deuxième partie consacrée à l’étude expérimentale, il sera présenté les protocoles expérimentaux et les méthodes analytiques utilisés (chapitre I), l’étude cinétique de dégradation (chapitre II) et l’étude cinétique de minéralisation (chapitre III) des antibiotiques étudiés. Cette étude expérimentale mettra en évidence l’efficacité du procédé EF quant à la minéralisation de ces antibiotiques, ainsi que les mécanismes de réaction engagés avec les radicaux hydroxyles. Il sera également montré que les performances de ce type de traitement électrochimique peuvent être significativement améliorées en faisant varier les paramètres expérimentaux impliqués dans le système, tels que le pH du milieu réactionnel, la concentration du catalyseur utilisé, le courant d’électrolyse appliqué et la concentration de l’antibiotique étudié.
PARTIE I
CHAPITRE I.1
Les produits pharmaceutiques : Généralités
et Impacts sur l’environnement
I.1. INTRODUCTION
Le terme «produits pharmaceutiques» couvre une classe complexe des composés largement utilisés dans la médecine moderne et traditionnelle. Actuellement des milliers de molécules actives sont utilisées pour traiter ou pour prévenir les maladies [13].
Alors que ces produits pharmaceutiques sont strictement réglementés pour en contrôler l’efficacité et assurer la sécurité du patient, les effets secondaires nocifs qu’ils peuvent avoir sur l’environnement naturel n’ont pas encore été suffisamment étudiés et ne sont pas couverts par un accord ou un arrangement international.
Dans ce chapitre, nous avons effectué une étude bibliographique détaillée sur les produits médicamenteux et leur impact négatif sur l’environnement, en particulier la contamination de nos eaux naturelles (de surface et souterraines) par ces produits organiques persistants (bio-réfractaires). Un intérêt particulier est réservé aux antibiotiques qui font l’objet de notre travail.
I.2. GÉNÉRALITÉS SUR LES PRODUITS PHARMACEUTIQUES
I.2.1. Définition
Un médicament est toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies humaines ou animales. Par extension, un médicament comprend toute substance ou composition pouvant être utilisée chez l'homme ou l'animal ou pouvant leur être administrée, en vue d'établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique. L'ensemble de la chaîne des médicaments (recherche, production, contrôle qualité, distribution en gros, délivrance aux patients, pharmacovigilance) est sous la responsabilité de spécialistes diplômés des médicaments, les pharmaciens.
I.2.2 Historique
Au Moyen-âge et jusqu'au début du XIXème siècle, la guérison des maladies garde un caractère «magico religieux»: on cherche, par exemple, à «extirper le mal» par le biais des saignées (phlébotomie). Cependant, dès le XVIe siècle, Paracelse (alchimiste et médecin suisse né en 1494) a l'intuition de la nécessité d'un médicament spécifique pour chaque maladie.
De l'utilisation des plantes comme remèdes à certaines maladies, jusqu'à l'apparition récente des médicaments issus des biotechnologies, l'histoire du médicament est largement associée à la recherche scientifique, qui tente dès le XVI siècle de trouver un remède spécifique pour chaque maladie.
Le XIXème siècle marque une étape nouvelle grâce aux progrès de la chimie et de la physiologie: les chercheurs réussissent à isoler des principes actifs de substances connues. Ainsi, en 1803, la morphine est isolée à partir de végétaux par Friedrich Adam Satürner (Laboratoire GlaxoSmithKline)[14].
Au début du XXe siècle, n'étaient considérés comme médicaments qu'une douzaine de molécules de synthèse, et une centaine de produits naturels. Le XXe siècle a vu l'essor des médicaments à base de molécules de synthèse produits par des laboratoires pharmaceutiques. Depuis peu, les protéines, sont de plus en plus utilisées comme médicament. Au début du XXIe siècle, nous utilisons des centaines de molécules de synthèse. Il ne reste que très peu de remèdes courants d'origine exclusivement naturelle.
C'est grâce à cette capacité à isoler les principes actifs que les molécules médicamenteuses pourront être par la suite synthétisées: après avoir isolé l'acide acétylsalicylique de l'écorce de saule, Charles Frédéric Gerhardt puis Félix Hoffmann vont synthétiser cette molécule en 1853 : c'est la naissance de l'aspirine, commercialisée pour la première fois en 1893 (Laboratoire GlaxoSmithKline)[14].
L'ère moderne du médicament débute en 1937 (Laboratoire GlaxoSmithKline) [14], avec la découverte de l'action antibactérienne des sulfamides. En 1929, Flemming découvre la pénicilline (Genopole® [15]. Vient ensuite une phase d'accélération des découvertes. Dans les années 60, les chercheurs mettent au point une nouvelle méthode d'évaluation des médicaments existants, qui va permettre d'élaborer de nouveaux médicaments à partir de ces modèles de médicaments existants.
Aujourd'hui, et pour les années à venir, c'est vers les biotechnologies que s'orientent les recherches autour des médicaments. En effet, grâce à de nouveaux outils puissants (génie génétique, biologie moléculaire, cellules souches, clonage, etc.), les chercheurs possèdent maintenant une approche génétique des pathologies humaines. En effet, les biomédicaments que les entreprises développent aujourd'hui permettent d'imaginer des solutions dans des pathologies pour lesquelles il n'existe pas encore de traitement satisfaisant: cancers, maladies auto-immunes, maladies rares, etc. (Genopole®, Biotechnologie et médicaments du futur[15].
I.2.3 Classification des médicaments
Afin de faciliter leur application thérapeutique, les médicaments ont été classés en différentes familles, subdivisées en groupes et sous-groupes. Les critères de classification sont [16]: (i) le mode d’action, (ii) l’origine, (iii) la nature chimique, (iv) la modalité d’action et (v) le spectre d’action. Dans (le tableau I.1.1), on trouve quelques classes de médicaments avec quelques exemples de chaque classe [17,18].
Tableau I.1.1 : Quelques classes thérapeutiques de médicaments.
CLASSE Exemple CLASSE Exemple
Analgésiques et Antalgiques -Aspirine -Paracetamol -Phenazone -Tramadol Anticancéreux -Cyclophosphamide -Ifosfamide Antiarythmiques -Amiodarone Anticoagulants -Warfarine Anti-asthmatiques -Salbutamol Anticonvulsivants -Carbamazépine Anti-diabétiques -Metformine Antibiotiques AMINOGLYCOSIDES -Apramycine -Kanamycine β-LACTAMINES, PENICILLINES -Amoxicilline -Ampicilline CEPHALOSPORINES -Cefaclor -Cefalexine SULFONAMIDES -Sulfaméthoxazole -Sulfachloropyridazine FLUOROQUINOLONES -Ciprofloxacine -Erythromycine MACROLIDES -Erythromycine -Tylosine LINCOSANIDES -Clindamycine -Lincomycine PHENICOLES -Chloramphénicol TETRACYCLINES -Chlorotétracycline -Tétracycline TRIMETHOPRIM POLYPEPTIDES -Bacitracine -Néomycine Antifongiques -Amphotéricine B Antigoutteux -Allopurinol Antihistaminiques -Cimetidine Anti-hypertenseurs -Propranolol Anti-inflammatoires non stéroïdiens -Aspirine -Acide salicylique -Ibuprofène Antiseptiques -Triclosan β-bloquants -Atenolol -Bisoprolol -Carazolol Bronchodilatateurs -Fenoterol
Régulateurs lipidiques -Fénofibrate et acide fénofibrique
-Stéroïdes et hormones -Progestérone -Testostérone Stimulants cardiaques -Digoxine -Stimulants système
nerveux centrale
I.3. CONTAMINATION ENVIRONNEMENTALE
Des résidus médicamenteux contaminent l'environnement (eau et sol en particulier) via les excréta d'humains ou animaux traités (urine, excréments, exudats, poils, desquamations, mucus et autres fluides provenant des organismes vivant ou de leurs cadavres). Certains sont des hormones ou des perturbateurs endocriniens rejetés dans le milieu avec les urines, qui peuvent agir à doses infimes et qui sont retrouvées dans des réservoirs destinés à produire de l'eau potable[19].
Dans les pays riches, globalement, les mêmes molécules sont trouvées dans les eaux traitées d’origine souterraines ou superficielle, ce qui montre une contamination déjà générale de l'environnement terrestre, avec des variations pour certaines molécules : par exemple, la caféine, comme on s’y attendait est plus fréquente en surface, de même en France que l’époxycarbamazépine, l’oxazépam et l’hydroxyibuprofène (jusqu’à 85 ng L-1), alors que la
carbamazépine est plus souvent trouvée dans les eaux traitées d’origine souterraine (ce qui laisse penser qu’elle se dégrade plus vite en surface).
Du point de vue toxicologique et écotoxicologique, il faudrait ajouter à ces listes les pesticides (dont les phytosanitaires, qui sont les « médicaments des plantes », et d’autres molécules indésirables, et évaluer les synergies possibles entre ces polluants ; et étudier la capacité de certains organismes à éventuellement bioconcentrer ces produits.
I.3.1 Contamination de l’atmosphère
Les rejets de médicaments dans l'atmosphère concernent un nombre limité de molécules, et essentiellement des anesthésiques volatils de type fluothane qui sont utilisés en milieu hospitalier mais aussi des médicaments, tel que l’eucalyptol, qui sont éliminés par voie pulmonaire. Les hydrofluoroalcanes sont connus pour s’oxyder dans l’atmosphère pour donner l’acide trifluoroacétique qui est un produit fortement persistant, toxique et susceptible d’intervenir dans les mécanismes de l’effet de serre, même si cette source représente une contribution relativement faible [20]. Dans le cas des antibiotiques, les tensions de vapeur et les constantes de Henry sont faibles, ce qui indique qu’ils sont très peu volatiles et peu propices à se diffuser vers l’air à partir des milieux terrestres et aquatiques. La constante de Henry des sulfonamides varie de 1,3 10-12 à 1.8 10-6 Pa L mol-1 et de 2,5 10-19 a 1,2 10-12 Pa L mol-1 pour les β-lactames [21].
I.3.2 Contamination des sols
Les sols peuvent être contaminés par les aliments, par les déjections des animaux traités par des médicaments vétérinaires directement dans les prairies mais aussi par l’épandage sur les champs des boues des stations d’épuration ou des fumiers produits dans les étables. Comme les urines et les fèces des animaux sont déposées directement sur les terres, des fortes concentrations locales peuvent y être observées. Selon la nature hydrophile ou hydrophobe des substances éliminées, les pluies peuvent en entraîner et en disperser une partie vers les eaux souterraines ou les eaux des surfaces. Enfin, les résidus de médicaments peuvent agir sur les microflore ou le microbiote. Il est ainsi possible d’affecter directement les micro-organismes de ces sols en particulier avec les résidus d’antibiotiques. Dans le cas des molécules lipophiles, elles peuvent être soumises à des phénomènes de bioconcentration. Les animaux qui se nourrissent du fumier comme les oiseaux, les vers et les mouches peuvent subir une exposition immédiate aux substances médicamenteuses ou à leurs métabolites et subir a priori des effets indésirables ou encore accumuler les produits qui peuvent ensuite se concentrer dans la chaîne alimentaire. La mobilité dans les sols est influencée par une combinaison de plusieurs facteurs incluant la structure chimique, la solubilité dans l’eau, le pH des sols, leur capacité d’échange de cations, la nature calcaire ou sableuse des sols et la température. Pour la sulfachlopyridazine (SCP), le transport sur des sols calcaire peut atteindre une concentration allant jusqu’à 590 g L-1 dans les eaux de drainage alors que, dans les sols sableux, la migration ne
se produit pas [22].
Le coefficient de sorption (KD) de la SCP est faible et varie entre 0,9 à 1,8 L kg-1dans le sol, ce qui
indique sa grande mobilité [23].
I.3.3 Contamination des milieux aquatiques et des ressources en eau douce
Le rejet en continu de médicaments et de leurs métabolites dans le milieu aquatique conduit à leur accumulation due à leur persistance [24]. Leur présence dans les milieux aquatique dépend de leurs propriétés physico-chimiques et en particulier de leur hydrosolubilité, de la stabilité des molécules, de leur demi-vie, qui est, par exemple, de plusieurs jours pour le sulfaméthoxazole [25]. En ce qui concerne les antibiotiques, plusieurs entre eux ont été détectés dans les effluents industriels, certains de ces antibiotiques étant faiblement dégradés par les stations d’épuration (STEP), comme par exemple le sulfaméthoxazole [26]. Pour le sulfaméthoxazole, le taux d’élimination dépend du procédé de traitement: il était de 5 à 21% dans une station à boues activées conventionnelle et
montait à 80 % dans un bioréacteur à membrane MBR [27,28] ont évalué la dégradation de 28 antibiotiques dans des STEP conventionnelles au charbon active ainsi que des stations utilisant la microfiltration et l’osmose inverse. Si globalement les teneurs en antibiotiques sont réduites de 92%, ils trouvent systématiquement dans les premières la ciprofloxacine, le sulfaméthoxazole, la lyncomycine et le triméthoprime à des teneurs de 0,05 à 0,6 g L-1, alors que dans les secondes, les teneurs varient entre 0,01 et 0,001 ng L-1, ce qui n’empêche pas qu’ils soient retrouvés. Dans les
eaux de surface, plusieurs antibiotiques ont été aussi détectés comme les sulfonamides [29-31] ont détecté des traces d’antibiotiques dans 50% des eaux des 139 sites étudiés sur le territoire nord-américain.
Dans les eaux souterraines, marines, mais aussi dans les eaux destinées à la consommation humaine, plusieurs antibiotiques et autres médicaments ont été détectés. Récemment, en France, une étude a montré dans les eaux de boisson la présence des plusieurs antibiotiques de quelques à plusieurs ng L-1 [32,33], ce que devient un problème très préoccupant.
I.4. POLLUANTS ORGANIQUES D’INTÉRÊT ÉMERGENT RETROUVÉS DANS LES EAUX USÉES RÉSIDUAIRES
Depuis le 20ème siècle, une industrialisation intense et incontrôlable se développe dans plusieurs pays du monde, et ce dans différents secteurs d'activités: industries pharmaceutiques, agroalimentaires, cosmétiques, pétrolières, chimiques, etc. Au nombre de ces polluants couramment décelés dans les rejets industriels et urbains, se trouvent les produits pharmaceutiques et de soins personnels (PPSPs), les pesticides, les produits chimiques industriels et domestiques, les surfactants, les métaux, etc., [34]. Un perturbateur endocrinien (PE) se définit comme étant une substance exogène qui altère ou inhibe le fonctionnement du système endocrinien et, par conséquent, cause des effets négatifs sur un organisme intact, ou sur sa progéniture ou sa population [35,36]. Ces substances s'accumulent ainsi dans l'environnement engendrant des bouleversements significatifs sur la faune aquatique (féminisation et disparition de la faune aquatique) et sur la santé humaine (occurrence de certains cancers, malformation des organes génitaux, altération des thyroïdes, baisse du quotient intellectuel, etc.) [37-39]. ont signalés que 38.000 substances chimiques ont une action sur le système endocrinien, alors que l'agence de la protection environnementale (USEPA) prévoit que 87,000 composés chimiques doivent être testés pour déterminer leurs effets sur le système endocrinien [37].
Les rejets issus des stations d'épuration sont l'une des causes principales de l'apport de ces contaminants dans l'environnement aquatique et terrestre incluant les eaux de surface, les eaux souterraines, les sédiments et les boues [31]. Des concentrations allant jusqu'à 100 ng L-1 peuvent être détecté dans les eaux usées résiduaires [40,41]), alors que des concentrations très faibles (0.1 ng L-1) peuvent induire des effets ostrogéniques chez les organismes aquatiques [41]. Ces composés sont souvent présents à l'état de trace, c'est-à-dire à des concentrations allant du ng L-1 à quelques dizaines de µg L-1, et ils ne participent globalement qu'à une très faible proportion de la matière organique dissoute [42]. Cependant, leur présence dans les eaux est à prendre en considération en raison de la toxicité potentielle pour l'homme et les espèces aquatiques. Ces composés organiques réfractaires sont nombreux et échappent pour la plupart à l'épuration classique des eaux usées, comprenant un prétraitement physico-chimique suivi d'un traitement biologique par biomasse en suspension (boue activée) ou biomasse fixée (biofiltration, lit bactérien) [43]. La pollution de l'environnement par ces contaminants organiques persistants constitue aujourd'hui une des problématiques émergeantes associées au traitement des eaux usées.
Parmi tous les produits chimiques complexes, une variété de PPSPs administrés aux hommes et aux animaux ont été détectés dans les eaux usées ainsi que les eaux de surface (rivières, lacs, etc.). Même si leurs concentrations étaient dans certains cas détectables à l'état de trace (des concentrations allant du ng L-1 vers le µg L-1, ces polluants organiques sont persistants dans l'environnement et sont par conséquent reconnus comme une menace potentielle pour la santé humaine et les écosystèmes. Les PPSPs sont des micropolluants d'intérêt émergents couramment décelés dans les effluents résiduaires de type industriel et urbain.
I.5 RÉSIDUS MÉDICAMENTEUX DE TYPE ANTIBIOTIQUE
Les médicaments les plus couramment détectés dans l'environnement sont les antibiotiques, les antidépresseurs, la caféine, les antalgiques, les médicaments contre le cholestérol, etc. Les antibiotiques sont souvent cités parmi les composés les plus problématiques [44-47].
Les antibiotiques sont largement utilisés pour traiter et prévenir les maladies dans la médecine humaine et animale, ainsi que pour augmenter l'efficacité alimentaire et améliorer le taux de croissance chez les bétails et les volailles [45] [47-49]. Tel que mentionné par [50,51], le volume de production annuelle de médicaments a été estimé à plusieurs centaines de tonnes, alors que son utilisation a été globalement estimée entre 100.000 et 200.000 tonnes [52]. Par exemple, la capacité
de production annuelle des antibiotiques en Chine est d'environ 210.000 tonnes (85% est utilisé pour l'élevage et la médecine), tandis que le rapport annuel de production d'antibiotiques au Japon est d'environ 2.200 tonnes (30% sont utilisés pour les humains et 60% sont utilisés pour le bétail) [53,54]. Aux Etats-Unis, environ 9200 tonnes d'antibiotiques ont été produites en 2003 pour des applications agricoles [55]. Au cours de leur utilisation, les antibiotiques ne peuvent pas être absorbés ou métabolisés entièrement in vivo et une fraction importante (30 à 90%) est excrétée sous forme de métabolites dans l'environnement via l'urine [56-58]. Après utilisation, ces substances chimiques persistent et peuvent contaminer les eaux de surface, les eaux souterraines et même les eaux potables [59-61].
(Le tableau.1.1.2) présente les différentes concentrations des antibiotiques détectées dans l'environnement. Ces composés peuvent se trouver dans l'environnement aquatique à travers le rejet direct des eaux usées issues de fermes ou le rejet d'effluents des usines de traitement des eaux usées de type municipal ou industriel. L'application de fumier de ferme d'élevage sur les terres agricoles contribue également à introduire les antibiotiques dans l'environnement[62,49]. L'infiltration de ces substances dans l'environnement peut ainsi causer des problèmes environnementaux y compris les risques écologiques et des dommages de la santé humaine.
Le groupe de tétracycline (oxytétracycline (OTC), chlorotétracycline (CTC) et tétracycline (TC)) est l'un des premiers groupes d'antibiotiques utilisés en thérapie dans la médecine humaine et comme additif alimentaire dans le secteur agricole [63,64]. En raison de leur plus faible coût et de leur plus grande activité antimicrobienne, le groupe de tétracycline a été largement utilisé comme médicament dans la médecine vétérinaire pour la prévention et le traitement des animaux de ferme et pour guérir plusieurs maladies infectieuses [46,49]. Ce groupe d'antibiotique a été également utilisé comme additif alimentaire pour favoriser la croissance des annaux [65,66]. Du fait de leur utilisation excessive, les tétracyclines (TCs) sont souvent décelés dans l'environnement: eaux de surface [63], eaux souterraines [67], eaux usées [68,69], les boues municipales, sol et sédiments [70,49]. D'après les études antérieures [71], environ 25% à 75% et même 70% à 90% des TCs administrés aux animaux sont libérés dans l'environnement sous la forme active. Les procédés de traitement conventionnels utilisés dans les stations d'épurations des eaux usées semblent incapables d'assurer une élimination totale de ces micropolluants. Le taux d'élimination des TCs dans les stations de traitement des eaux usées varie de 12% [72] à 80% [73]. La persistance de ces micropolluants organiques dans l'environnement peut causer une toxicité aiguë et même chronique chez les espèces aquatiques et terrestres, et entrainer des perturbations dans le système endocrinien.
Tableau I.1.2 : Concentrations des antibiotiques détectés dans l'environnement
Classe Substance Concentration
(ng L-1) Source Références Sulphonamides Sulphadiazine Sulphamethazine Sulphamethoxazole 4,130 240 52-1900 Jusqu'à 2000 Jusqu'à 470 66 Eaux de surface Eaux souterraines Eaux de surface
Effluents des eaux usées Eaux souterraines Eaux potables [30] [74] [75] [31] [29] [76] [77] Sulfamethazine Sulfamethizol Sulfadiazine Sulfadimidine Jusqu'à 220 Jusqu'à 17 Jusqu'à 23 Eaux de surface Eaux souterraines Eaux souterraines [31] [31] [31] Chinolones Fluorchinolone Fluorchinolone (ciprofloxacine, norfloxacine) Ciprofloxacine Jusqu'à 100 Jusqu'à 5 Jusqu'à 106 Jusqu'à 19 Jusqu'à 30 200-1400
Effluents des eaux usées Eaux de surface
Effluent eaux usées Eaux de surface Eaux de surface
Effluents des eaux usées [78] [78] [79] [79] [31] [80] Tetracyclines Tetracycline Chlortetracycline Oxytetracycline 400 61-1100 Jusqu'à 690 32.000 Eaux souterraines Effluents des eaux usées Eaux de surface Eaux de surface [81] [80] [31] [82] Macrolides Lincomycine Azithromycine Erythromycine-H2O 21.100 Jusqu'à 3 Jusqu'à 6000 Eaux de surface Eaux de surface
Effluents des eaux usées [30] [75] [29] Penicillines Penicilline Flucloxacilline Piperacilline Jusqu'à 200 7 48
Effluents des eaux usées Eaux de surface
Eaux de surface
[78] [75] [75]
I.6 LES ANTIBIOTIQUES DE LA FAMILLE FLUROQUINOLONES
I.6.1 Présentation générale
Les quinolones qui comportent un atome de fluor sont appelées les fluoroquinolones et sont des dérivés de l’acide pyridine-β-carboxylique. Les fluoroquinolones sont des antibiotiques qui forment une large classe d'antibactérien et sont obtenus par synthèse chimique à partir de la chloroquine. Le premier composé de ce groupe est l'acide nalidixique qui a été décrit pour la première fois en 1962. Cependant, les premières quinolones développées ont eu une application clinique limitée et sont utilisées pour traiter les infections urinaires seulement [83].
Figure I.1.1 : Synthèse de l’acide nalidixique.
Dans les années 1980, l’addition d’un atome de fluor et la substitution du groupement pipérazine a augmenté l’activité de ces composés ainsi que leur absorption et leur distribution dans les tissus. Ils permettent donc de traiter de nombreuses infections génitales, urinaires, gastro-intestinales et osto-articulaires. Les fluoroquinolones sont des antibiotiques à large spectre bactérien et devenues très utilisées en médecine humaine et vétérinaire par rapport aux autres antibiotiques [84].
I.6.2. Structure chimique des fluoroquinolones
La structure chimique des fluoroquinolones comporte une fonction cétone (C=O) et une fonction acide (COOH), qui ont une grande tendance à piéger les ions divalents comme les ions Ca2+, Fe2+,
Les fluoroquinolones sont des molécules obtenues par synthèse chimique qui dérivent de l’acide carboxylique hétérocycliques diversement substitués. Touts les composés quinolones actuels présentent une structure bicyclique, avec un atome d’azote en position 1, un carboxylate en position 3, un carbonyle en position 4 et un atome de fluor en position 6. Le groupe R est généralement un groupe pipérazine dérivant de la quinoléine [84].
Figure I.1.2 : Formule semi-développée d’une molécule de fluoroquinolones
I.6.3. Mode d'action des fluoroquinolones
Les quinolones agissent sur l’ADN bactérien. Elles bloquent la synthèse de l'ADN bactérien et inhibent d’une manière sélective l'action de deux enzymes qui sont la gy-rase et la topo-isomérase II et IV [84].
Lorsqu'elles sont diffusées dans le cytoplasme, les fluoroquinolones vont inhiber de manière sélective la réplication de l'ADN bactérien. Les fluoroquinolones ciblent deux enzymes parentes appartenant à la famille des topo-isomérases II et qui sont impliquées dans la synthèse de l’ADN bactérien. L’ADN gy-rase qui est généralement une cible principale chez les bactéries à Gram négatif. La topo-isomérase IV est une cible principale chez les bactéries à Gram positif. Les nouvelles fluoroquinolones sont la Gatifloxacine et la Moxifloxacine.
L'utilisation des fluoroquinolones administrées par voie orale ou administrées par voie intraveineuse peut fournir des avantages significatifs en termes de réduction de l'hospitalisation ou des frais de soins à domicile. L'utilisation de ces antibiotiques est très efficace et très recommandée.
I.6.4. Classification des quinolones
La classification des fluoroquinolones prend en compte le spectre antimicrobien et leurs indications cliniques. Cette classification est un outil pour les médecins à utiliser lors de la prescription de ces médicaments ou l'évaluation de nouveaux principes actifs introduits dans le marché. Un médicament de chaque groupe est similaire à une activité antimicrobienne. Avec chaque génération successive, un nouveau groupe important d'agents pathogènes est ajouté à la couverture. Les quinolones sont habituellement classées en quatre générations basées sur leur activité et leur spectre d’activité [85].
1. La première génération
Les quinolones de la première génération ont un spectre étroit et limité contre les bactéries et aussi contre les germes de type Gram négatif. Les fluoroquinolones de cette classe incluent l’acide nalidixique, l’acide pipémidique, l’acide oxolinique, la fluméquine et la cinoxacine.
2. La deuxième génération
Les fluoroquinolones de la deuxième génération sont les: Ciprofloxacine, Norfloxacine, Enoxacine, Loméfloxacine, Ofloxacine et Péfloxacine.
3. La troisième génération
La troisième génération contient les composés suivants : La Grépafloxacine, la Sparfloxacine, la Témafloxacine et la Lévofloxacine. Les agents de cette génération ont une activité accrue contre les bactéries et contre les pathogènes atypiques.
4. La quatrième génération
Elle a les mêmes propriétés que les agents de la troisième génération mais avec une couverture anaérobique beaucoup large. Les substances de la quatrième génération sont: la Trovafloxacine, la Moxifloxacine, la Gémifloxacne, la Sitafloxacine, la Clinafloxacine et la Gatifloxacine.
I.6.5 Propriétés physicochimiques des antibiotiques fluoroquinolones étudiés
Dans ce travail, nous nous sommes intéressés à l'étude de trois antibiotiques : la ciprofloxacine, la
lévofloxacine et la moxifloxacine appartenant à la famille des fluoroquinolones. Le tableau I.1.3
Tableau I.1.3 : Propriétés physico-chimiques des antibiotiques étudiés[86-89].
Nom Ciprofloxacine hydrochlorate Lévofloxacine Moxifloxacine hydrochlorate
Class antibiotique antibiotique antibiotique
Famille fluoroquinolone fluoroquinolone fluoroquinolone
Formule brute C17H18FN3O3.HCl.H2O C18H17FN3O4 C21H24FN3O4.HCl
Masse molaire 385,8 361,368 437,9 (g/mol)
Apparence poudre poudre poudre Solubilité dans l’eau 30 g L-1 à 20 °C 25,3 g L-l à 25 °C 1,146 g L-l à 25 °C λmax (nm) 274,2 294 292,4 Structure O N F N HN O OH H-Cl O N O N N F O OH O N F N O OH H-Cl O CH3 H H NH
On note que ces trois antibiotiques sont largement solubles dans l’eau. Ils peuvent donc contaminer nos eaux naturelles, ce qui justifie notre choix d’étudier ces produits en tant que polluants organiques persistants en milieu aqueux afin de proposer un procédé économique et écologique pour les éliminer des eaux usées.
![Tableau I.2.2 : Constantes de vitesse de réaction entre les OH et quelques composés organiques en milieu aqueux [120] :](https://thumb-eu.123doks.com/thumbv2/123doknet/2197822.12179/45.892.96.791.197.572/tableau-constantes-vitesse-reaction-composes-organiques-milieu-aqueux.webp)